Preflucel Suspension Inyectable En Jeringa Precargada
Información obsoleta, busque otrojm
Prospecto: información para el usuario PREFLUCEL Suspensión inyectable en jeringa precargada Campaña 2012/2013
Vacuna antigripal (virus fraccionados, inactivados, preparados en cultivos celulares)
Lea todo el prospecto detenidamente antes de ser vacunado, por que contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es PREFLUCEL y para qué se utiliza
2. Qué necesita saber antes de empezar a usar PREFLUCEL
3. Cómo usar PREFLUCEL
4. Posibles efectos adversos
5. Conservación de PREFLUCEL
6. Contenido del envase e información adicional
1. Qué es PREFLUCEL y para qué se utiliza
Preflucel es una vacuna. Esta vacuna ayuda a proteger a los adultos y las personas de edad avanzada frente a la gripe. El uso de Preflucel debe estar basado en las recomendaciones oficiales.
Cuando una persona recibe la vacuna Preflucel, el sistema inmunitario (el sistema de defensa natural del cuerpo) generará su propia protección (anticuerpos) frente a la enfermedad. Ninguno de los componentes de la vacuna puede causar la gripe.
La gripe es una enfermedad que puede propagarse rápidamente y está causada por diferentes tipos de cepas que pueden variar de un año a otro. Por tanto, es necesario vacunarse todos los años. El riesgo máximo de contraer la gripe se presenta en los meses fríos, entre octubre y marzo. Si no se ha vacunado en otoño, todavía es susceptible de vacunarse hasta que llegue la primavera, ya que corre el riesgo de contraer la gripe hasta entonces. Su médico le recomendará la mejor época para vacunarse.
Preflucel le protegerá frente a las tres cepas del virus que contiene la vacuna desde aproximadamente 2 o 3 semanas después de la inyección.
Dado que el periodo de incubación de la gripe es de pocos días, si se expone al virus inmediatamente antes o después de la vacunación, podría desarrollar la enfermedad.
La vacuna no le protegerá frente al resfriado común, aunque algunos de los síntomas sean similares a los de la gripe.
Qué necesita saber antes de empezar a usar PREFLUCEL
2.
No use PREFLUCEL
- si es alérgico (hipersensible) a los principios activos o a cualquiera de los demás componentes o residuos (por ejemplo, formaldehído, benzonasa, sacarosa) de Preflucel; ver sección 6
- si tiene alguna enfermedad acompañada de temperatura elevada (fiebre) o una infección aguda, la vacunación deberá posponerse hasta que se haya recuperado.
Advertencias y precauciones
Antes de la vacunación debe informar a su médico si tiene una respuesta inmunitaria deficiente (inmunodeficiencia o consumo de medicamentos que afectan al sistema inmunitario).
Su médico decidirá si debe recibir la vacuna.
Si, por alguna razón, va a realizarse un análisis de sangre a los pocos días después de la vacunación frente a la gripe, informe a su médico. Esto es porque en algunos pacientes recién vacunados, se han observado falsos positivos en los resultados de los análisis de sangre.
Como todas las vacunas, Preflucel puede no proteger totalmente a las personas vacunadas.
Se ha notificado anafilaxis con Preflucel (ver sección 4 “Posibles efectos adversos”).
Como con otras inyecciones intramusculares, Preflucel debe administrarse con precaución en pacientes con trastornos de la coagulación hemorrágicos como hemofilia o que se encuentren en tratamiento en terapia con anticoagulantes, para evitar el riesgo de hematoma tras la inyección.
Uso de PREFLUCEL con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
- Preflucel se puede administrar al mismo tiempo que otras vacunas si se inyectan en extremidades distintas.
Debe tenerse en cuenta que los efectos adversos pueden ser más intensos.
- La respuesta inmunológica puede disminuir en el caso de tratamientos inmunosupresores, como los corticoesteroides, los medicamentos citotóxicos o la radioterapia.
- No mezclar con otras vacunas en la misma jeringa o vial.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
La seguridad de Preflucel en mujeres embarazadas o en periodo de lactancia no se ha valorado en ensayos clínicos. Los datos limitados de las vacunaciones frente a la gripe en mujeres embarazadas no indican que la vacuna pueda tener efectos perjudiciales sobre el embarazo o el bebé. El uso de esta vacuna se puede considerar a partir del segundo trimestre del embarazo. Para mujeres embarazadas con enfermedades que aumenten el riesgo de complicaciones por la gripe, se recomienda la administración de la vacuna con independencia de su fase de embarazo.
Los efectos de Preflucel en la fertilidad masculina no se han establecido.
Preflucel puede utilizarse durante la lactancia.
|
Su médico podrá decidir si debe recibir Preflucel. Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento. Conducción y uso de máquinas La influencia de Preflucel sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. PREFLUCEL contiene sodio. Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de 0,5 ml, por lo que se considera esencialmente ‘exento de sodio’. 3. Cómo usar PREFLUCEL El médico administrará Preflucel mediante una inyección en la parte superior del brazo (músculo deltoides). La vacuna nunca debe administrarse en una vena. Los adultos de 18 años o mayores recibirán una inyección de 0,5 ml de Preflucel. Uso en niños No hay información sobre el uso de Preflucel en menores de 18 años de edad. 4. POSIBLES EFECTOS ADVERSOS Al igual que todos los medicamentos, Preflucel puede producir efectos adversos, aunque no todas las personas los sufran. Comunicación de efectos adversos Si experimenta cualquier tipo de efecto adverso, consulte con su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento. Durante los ensayos clínicos, se observaron los siguientes efectos adversos. - Muy frecuentes (que afecta a más de 1 de cada 10 personas): dolor de cabeza*, dolor muscular (mialgia), dolor en el lugar de la inyección*, sensación general de malestar (malestar general), cansancio (fatiga). - Frecuentes (que afecta a entre 1 y 10 de cada 100 personas): tos, dolor en la boca y en la garganta (dolor orofaríngeo), moqueo de nariz (rinorrea), ganas de vomitar (náuseas)*, vómitos*, sudoración (hiperhidrosis), tensión arterial alta, dolor de las articulaciones (artralgia)*; en el lugar de la inyección: hinchazón, enrojecimiento (eritema), endurecimiento (induración)*; reacciones sistémicas: escalofríos, fiebre (pirexia). - Poco frecuentes (que afecta a entre 1 y 10 de cada 1.000 personas): sensibilidad anormal o reducida (trastornos sensoriales)*, ojos rojos (hiperemia ocular), drenaje de mucosidad del ojo (secreción ocular)*, irritación de garganta, hinchazón de garganta (edema de faringe), dificultad para respirar (disnea), dolor de vientre (dolor abdominal), picor (prurito), enrojecimiento de la piel (eritema), irritación de ojos, rigidez musculoesquelética; en el lugar de la inyección: picor (prurito), hemorragia menor (hemorragia), sensación de calor*; reacción sistémica: malestar en el pecho. |
.<í&* jm |
- Raros (que afecta a entre 1 y 10 de cada 10.000 personas): reacciones alérgicas que potencialmente pueden producir una disminución de la tensión arterial y, si no se trata, puede producir un shock. Los médicos deben conocer estas posibilidades y deben tener disponible un tratamiento adecuado para estos casos. Alteración del sentido del gusto (disgeusia), dificultad para tragar (disfagia), habones (urticaria), inflamación local (edema periférico).
*Estas reacciones normalmente desaparecen en 1 - 2 días sin necesidad de tratamiento.
Se ha notificado un caso de esclerosis múltiple en un único sujeto varón. Los primeros síntomas aparecieron 6 semanas después de la vacunación.
5. CONSERVACIÓN DE PREFLUCEL
Mantener fuera de la vista y del alcance de los niños.
No utilice Preflucel después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Conservar en el embalaje exterior para protegerla de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de PREFLUCEL
Los principios activos son virus de la gripe (fraccionados, inactivados), de las siguientes cepas*:
|
A/California/07/2009 (H1N1) |
15 microgramos de HA** |
|
A/Victoria/361/2011 (A/H3N2) |
15 microgramos de HA** |
|
B/Hubei-Wuj iagang/158/2009 (B) |
15 microgramos de HA** |
|
por dosis de 0,5 ml |
* cultivados en células Vero (línea celular continua de origen mamífero) ** hemaglutinina
Esta vacuna cumple con las recomendaciones de la OMS (Organización Mundial de la Salud) y con la decisión de la Unión Europea para la campaña 2012/2013.
Los demás componentes son: trometamol, cloruro de sodio, Polisorbato 80 y agua para preparaciones inyectables.
Aspecto de PREFLUCEL y contenido del envase
La vacuna es una suspensión entre transparente y opalescente.
Preflucel se suministra como una suspensión inyectable de 0,5 mililitros en jeringa precargada.
Tamaños de envases:
1 o 10 jeringas precargadas con aguja incorporada 1 o 10 jeringas precargadas sin aguja incorporada
Puede que solamente esté comercializado algún tamaño de envase.
Titular de la autorización de comercialización y responsable de la fabricación:
Titular Baxter, S.L.
Pouet de Camilo, 2
46394 Ribarroja del Turia (Valencia)
Responsable de la fabricación Baxter AG IndustriestraPe, 67 A-1221 Viena, Austria
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Austria: PREFLUCEL Injektionssuspension in einer Fertigspritze
Bélgica: PREFLUCEL suspension injectable en seringue préremplie, PREFLUCEL suspensie voor injectie in een voorgevulde spuit, PREFLUCEL Injektionssuspension in einer Fertigspritze.
República Checa: PREFLUCEL injekcm suspenze v predplnené injekcm stnkacce Dinamarca: PREFLUCEL injektionsv^ske, suspension, i fyldt injektionssprojte Finlandia: PREFLUCEL-injektioneste, suspensio, esitaytetyssa ruiskussa Alemania: PREFLUCEL Injektionssuspension in einer Fertigspritze Irlanda: PREFLUCEL suspension for injection in a pre-filled syringe Italia: PREFLUCEL, sospensione iniettabile in siringa preriempita Noruega: PREFLUCEL injeksjonsv^ske, suspensjon i en ferdigfylt sproyte Polonia: PREFLUCEL zawiesine do wstrzykiwan w ampulko-strzykawce Portugal: PREFLUCEL
España: PREFLUCEL suspensión inyectable en jeringa precargada Suecia: Preflucel injektionsvatska, suspension i forfylld spruta Países Bajos: PREFLUCEL 2012/2013, suspensie voor injectie 0,5 ml Reino Unido: PREFLUCEL suspension for injection in a pre-filled syringe
Este prospecto ha sido aprobado en marzo 2014
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
Debe dejarse que la vacuna alcance la temperatura ambiente antes de su uso.
Agitar bien las jeringas precargadas antes de su administración para que la suspensión de la vacuna se mezcle de forma adecuada. Tras agitarse, Preflucel es una suspensión entre transparente y opalescente. La vacuna
debe inspeccionarse visualmente para ver si hay partículas extrañas y/o alguna variación en el aspecto físico antes de su administración. Si se observa cualquiera de estas condiciones, la vacuna debe desecharse.
Retirar el protector de la aguja de la siguiente forma:
1. Sujetar la jeringa precargada por la parte inferior del protector de la aguja que está fijado al recipiente de vidrio (Fig. 1).
2. Con la otra mano, sujetar la parte superior del protector de la aguja entre los dedos índice y pulgar, y girarlo para romper el sello (de garantía) (Fig. 2).
3. Retirar la parte separada del protector de la aguja con un movimiento vertical (Fig. 3).
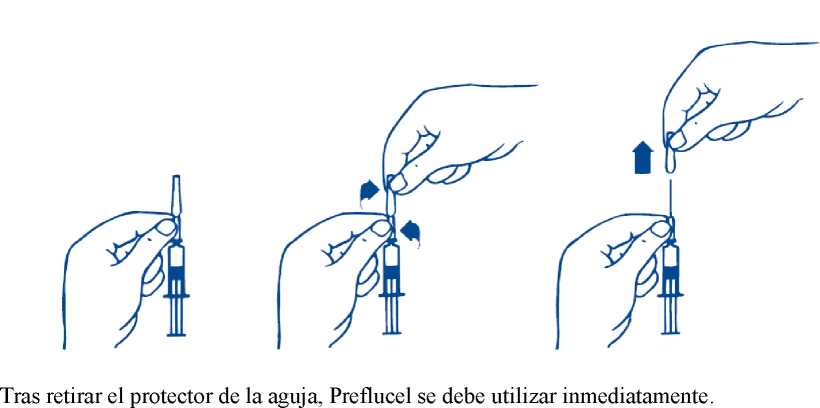
La aguja no se debe dejar sin protección durante un periodo prolongado para evitar que pierda su esterilidad y/o que se obstruya. Por tanto, sólo se debe retirar el protector de la aguja después de agitar e, inmediatamente antes de su uso.
Información adicional para PREFLUCEL jeringa sin aguja incorporada:
Tras retirar la tapa de la jeringa, incorpore la aguja inmediatamente y retire el protector de la aguja antes de administrarlo. Una vez la aguja esté incorporada, la vacuna tiene que administrarse inmediatamente.
Se debe tener cuidado para evitar la presencia de gotas de la vacuna en la punta o en la superficie externa de la aguja antes de la inyección para minimizar el riesgo de aparición de reacciones adversas locales. Si se utiliza alcohol en la zona de inyección, se debe secar por completo antes de la vacunación y no debe entrar en contacto con la vacuna.
Preflucel no debe mezclarse con otros medicamentos. Preflucel se puede administrar al mismo tiempo que otras vacunas. La inmunización debe realizarse en extremidades distintas.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.