Pantoprazol Sun 40 Mg Polvo Para Solucion Inyectable Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Pantoprazol SUN 40 mg polvo para solución inyectable EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 40 mg de pantoprazol (como sodio sesquihidrato)
Para lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución inyectable.
Polvo de color blanco o blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Esofagitis por reflujo moderada y severa
- Úlcera gástrica y duodenal
- Síndrome de Zollinger Ellison y otras enfermedades hipersecretoras patológicas
4.2 Posología y forma de administración
Sólo se recomienda la administración intravenosa de Pantoprazol SUN 40 mg cuando la administración oral no es apropiada. Hay estudios disponibles sobre la administración intravenosa para hasta 7 días. Tan pronto como sea posible la terapia oral, debe interrumpirse el tratamiento con Pantoprazol SUN 40 mg instaurar la administración de 40 mg de pantoprazol 40 mg oral en su lugar.
4.2.1 Posología
Úlcera duodenal, úlcera gástrica, esofagitis por reflujo
La dosis intravenosa recomendada es un vial de Pantoprazol SUN 40 mg (40 mg de pantoprazol) al día.
Síndrome de Zollinger Ellison y otras enfermedades hipersecretoras patológicas Tratamiento a largo plazo de Síndrome de Zollinger Ellison y otras enfermedades hipersecretoras patológicas: el tratamiento debe iniciarse con una dosis diaria de 80 mg de Pantoprazol SUN 40 mg. Esta dosis se puede aumentar o disminuir posteriormente, según sea necesario, tomando como referencia las determinaciones de la secreción ácida gástrica. En el caso de administrar dosis superiores a 80 mg al día, ésta se debe dividir y administrar en dos dosis diarias. De forma transitoria se podría administrar una dosis superior a 160 mg de pantoprazol, si fuera necesario aunque no debe aplicada durante más tiempo del que sea necesario para una adecuada secreción ácida.
En el caso de que sea necesario controlar rápidamente la secreción ácida, suele bastar con una dosis inicial de 2x80 mg de Pantoprazol SUN 40 mg para que la secreción ácida gástrica descienda al rango deseado (<10 mEq/h) antes de una hora en la mayoría de los pacientes.
Poblaciones especiales
Población pediátrica
La experiencia en niños es limitada. Por lo tanto, no se recomienda el uso de Pantoprazol SUN 40 mg en pacientes menores de 18 años hasta que se disponga de más datos.
Insuficiencia hepática
En caso de insuficiencia hepática grave la dosis diaria debe ser de 20 mg de pantoprazol (la mitad de un vial de 40 mg de pantoprazol) (ver sección 4.4).
Insuficiencia renal
En pacientes con insuficiencia en la función renal no es necesario ningún ajuste en la dosis.
Pacientes de edad avanzada
En pacientes de edad avanzada no es necesario ningún ajuste en la dosis.
4.2.2 Forma de administración
La solución a utilizar se prepara inyectando 10 ml de solución fisiológica de cloruro sódico 9 mg/ml (0,9%) solución inyectable. Para consultar las instrucciones de preparación del medicamento antes de la administración ver sección 6.6. Esta solución puede administrarse directamente o mezclándola con 100 ml de solución fisiológica de cloruro sódico 9 mg/ml (0,9%) solución inyectable o de glucosa 55 mg/ml (5%) solución inyectable.
Después de su preparación la solución debe utilizarse en un periodo de 12 horas.
El preparado se administrará por vía intravenosa durante 2 - 15 minutos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, benzimidazoles sustituidos, o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En presencia de síntomas alarmantes
En presencia de cualquier síntoma alarmante (por ejemplo, pérdidas significativas de peso involuntarias, vómitos constantes, disfagia, hematemesis, anemia o melena) y en caso de sospecha o presencia de úlcera gástrica, la maligna debe ser excluida, ya que el tratamiento con pantoprazol puede aliviar los síntomas y retrasar el diagnóstico.
En el caso en que los síntomas persistan a pesar de un adecuado tratamiento, debe considerarse una investigación más a fondo.
Insuficiencia hepática
En pacientes con insuficiencia hepática grave, deben monitorizarse las enzimas hepáticas durante el tratamiento. En caso de un aumento de las enzimas hepáticas, se debe interrumpir el tratamiento (ver sección 4.2).
Co-administración con atazanavir
La co-administración con atazanavir con inhibidores de la bomba de protones no está recomendada (ver sección 4.5). Si la combinación de atazanavir con inhibidores de la bomba de protones se considera inevitable, se recomienda una estrecha monitorización clínica (por ejemplo, carga viral) en combinación con un aumento de la dosis de atazanavir hasta 400 mg con 100 mg de ritonavir. La dosis de pantoprazol diaria no debe exceder los 20 mg.
Infecciones gastrointestinales causadas por bacterias
El pantoprazol, como otros inhibidores de la bomba de protones (IBP), podría aumentar el número de bacterias normalmente presentes en el tracto gastrointestinal superior. El tratamiento con Pantoprazol SUN 40 mg puede dar lugar a un ligero aumento del riesgo de infecciones gastrointestinalescausadas por bacterias como Salmonela y Campylobacter.
Hipomasnesemia
Se han notificado casos graves de hipomagnesemia en pacientes tratados con inhibidores de la bomba de protones (IBP) como pantoprazol durante al menos tres meses y, en la mayoría de los casos tratados durante un año. Se pueden presentar síntomas graves de hipomagnesemia como fatiga, tetania, delirio, convulsiones, mareos y arritmia ventricular que aparecen de forma insidiosa y pasan desapercibidos. En la mayoría de los pacientes afectados, la hipomagnesemia mejora cuando se repone el magnesio y se suspende el tratamiento con el IBP. Para pacientes que pueden tener un tratamiento prolongado o que toman IBP con digoxina o medicamentos que puedan producir hipomagnesemia (por ejemplo los diuréticos), se debe valorar la determinación de los niveles de magnesio antes de comenzar el tratamiento con IBP y periódicamente durante el mismo.
Lupus eritematoso cutáneo subagudo (LECS)
Los inhibidores de la bomba de protones se asocian a casos muy infrecuentes de LECS. Si se producen lesiones, especialmente en zonas de la piel expuestas al sol, acompañadas de artralgia, el paciente debe solicitar asistencia médica rápidamente y el profesional sanitario debe considerar la interrupción del tratamiento con pantoprazol. El LECS después del tratamiento con un inhibidor de la bomba de protones puede aumentar el riesgo de LECS con otros inhibidores de la bomba de protones.
Riesgo de fracturas de cadera, muñeca y columna vertebral
Los inhibidores de la bomba de protones (IBP) en altas dosis y durante tratamientos prolongados (más de un año) pueden aumentar el riesgo de fracturas de cadera, muñeca y columna vertebral, sobre todo en pacientes de edad avanzada o presencia de otros factores de riesgo. Estudios observacionales indican que los inhibidores de la bomba de protones pueden aumentar el riesgo global de fractura entre un 10-40%. Parte de este aumento puede ser debido a otros factores de riesgo. Los pacientes con riesgo de osteoporosis deben recibir tratamiento según las guías clínicas vigentes y deben tener una ingesta adecuada de vitamina D y calcio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos del _pantoprazol en la en la absorción de otros _ fármacos Anticoagulantes de cumarina
Aunque en los estudios de farmacocinética clínica no se han observado interacciones durante la administración concomitante de fenprocumón o warfarina, se han notificado casos aislados de cambios en el INR (International NormalizedRatio) en la etapa postcomercialización. Por esta razón se aconseja monitorizar al paciente en tratamiento con anticoagulantes cumarínicos, realizando determinaciones del tiempo de protombina/INR cuando se inicie el tratamiento con pantoprazol, cuando se interrumpa el mismo o cuando no se administre regularmente.
Otros estudios sobre interacciones
Pantoprazol se metaboliza en el hígado mediante el sistema enzimático del citocromo P450.
La principal ruta metabólica es la dimetilación por CYP2C19 y otras rutas metabólicas incluyen la oxidación por CYP3A4.
Sin embargo, no se han observado interacciones, clínicamente significativas, en pruebas específicas realizadas con varios fármacos y compuestos de este tipo, como: carbamazepina, diazepam, glibenclamida, nifedipino, y anticonceptivos orales que contengan levonorgestrel y etinilestradiol.
Los resultados de una serie de estudios demuestran que la reacción de pantoprazol no afecta al metabolismo de las sustancias activas metabolizadas por el CYP1A2 (como la cafeína, teofilina), CYP2C19 (como el piroxicam, diclofenaco, naproxeno), CYP2D6 (como metropolol), CYP2E1 (como el etanol) o no interfiere con la p-glicoproteína absorción relacionada con la dioxina.
No se han demostrado tampoco interacciones con antiácidos administrados concomitantemente.
3E
También se han realizado estudios de interacción administrando pantoprazol concomitantemente con los antibióticos respectivamente (claritromicina, metronidazol, amoxicilina). No se observaron interacciones clínicamente relevantes.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
La experiencia clínica en mujeres embarazadas es limitada. En estudios de reproducción en animales se observaron ligeros signos de toxicidad reproductiva (ver sección 5.3). El riesgo potencial en humanos es desconocido. Pantoprazol SUN 40 mg no debe ser utilizado durante el embarazo a menos que sea claramente necesario.
4.6.2 Lactancia
Los estudios en animales demuestran la secreción de pantoprazol en la leche materna. Excreción en la leche humana ha sido reportada. Por lo tanto, la decisión de continuar/interrumpir el amamantamiento o de continuar/interrumpir el tratamiento con pantoprazol SUN 40 mg se debe tomar teniendo en cuenta los beneficios del amamantamiento para el bebé y los beneficios del tratamiento con pantoprazol SUN 40 mg para la mujer.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se pueden dar reacciones adversas así como mareos y alteraciones en la visión (ver sección 4.8). Si se ven afectados, los pacientes no deben conducir o utilizar máquinas.
4.8 Reacciones adversas
Aproximadamente se puede esperar de un 5% de los pacientes que experimenten reacciones adversas a medicamentos (RAMs). Las RAMs más frecuentes son diarrea y dolor de cabeza, ambas ocurren en aproximadamente el 1% de los pacientes.
La siguiente tabla muestra las reacciones adversas notificadas con pantoprazol, ordenadas según la siguiente clasificación de frecuencia:
Muy frecuentes (> 1/10); frecuentes (>1/100,<1/10); poco frecuentes (> 1/1.000, <1/100); raras (>1/10.000, <1/1.000); muy raras (<1/10.000); desconocidas (no puede estimarse a partir de los datos disponibles).
Para todas las reacciones adversas de las que se ha informado desde los datos de post-comercialización, no es posible aplicar una frecuencia para las Reacciones Adversas y por lo tanto se mencionan con frecuencia desconocida.
Dentro de cada agrupación de frecuencia, las reacciones adversas están ordenadas en gravedad decreciente. Tabla 1. Reacciones adversas con pantoprazol en estudios clínicos y experiencia post-comercialización:
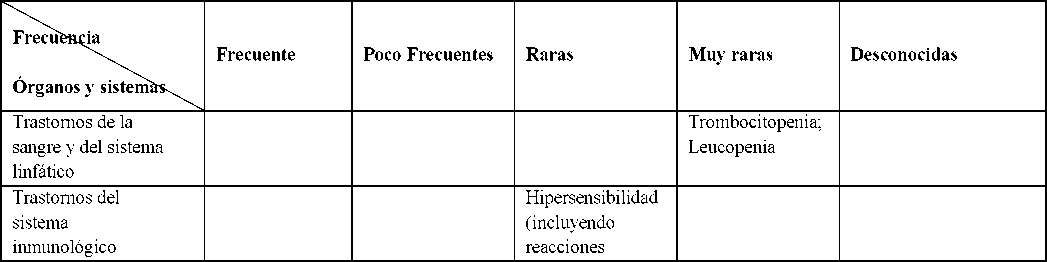
LITTCA
ALDAD
ota efe
|
anafilácticas incluyendo shock anafiláctico) | |||||
|
Metabolismo y trastornos nutricionales |
Hiperlipidemia y aumento de lípidos (triglicéridos, colesterol); cambios de peso |
Hiponatremia Hipomagnesemia. [Ver Advertencias y precauciones especiales de empleo (4.4)] | |||
|
Trastornos psiquiátricos |
Trastornos del sueño |
Depresión (y todos los agravantes) |
Desorientación (y todos los agravantes) |
Alucinaciones; Confusión (especialmente en pacientes con predisposición, así como todos los agravantes de estos síntomas en caso de su pre-existencia) | |
|
Trastornos del sistema nervioso |
Dolor de cabeza, mareos | ||||
|
Trastornos oculares |
Trastornos de la visión / visión borrosa | ||||
|
Trastornos gastrointestinales |
Diarrea; Náuseas/V ómito s; distensión abdominal e hinchazón; estreñimiento; sequedad de boca; dolor abdominal y malestar | ||||
|
Trastornos hepatobiliares |
Incremento de los valores de las enzimas hepáticas(transam inasas y-GT) |
Incremento de la bilirrubina |
Lesión hepatocelular; ictericia; insuficiencia hepatocelular | ||
|
Trastornos de la piel y del tejido subcutáneo |
Sarpullido / exantema / erupción; prurito |
Urticaria; angiodema |
Síndrome de Stevens Johnson; eritema multiforme; Síndrome Lyell fotosensibilidad Lupus eritematoso cutáneo subagudo (ver sección 4.4) | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Fractura de cadera, muñeca y columna vertebral (ver sección 4.4) |
Artralgia; mialgia | |||
|
Trastornos renales y urinarios |
Nefritis intersticial | ||||
|
Trastornos en el sistema reproductivo y de la mama |
Ginecomastia | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Tromboflebitis en el lugar de la administración |
Astenia, fatiga y malestar |
Elevación de la temperatura corporal; edema periférico |
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es.
4.9 Sobredosis
No se conocen síntomas de sobredosis en humanos.
Exposición sistémica de hasta 240 mg administrados por vía intravenosa durante dos minutos fueron bien toleradas. El pantoprazol tiene una alta unión a proteínas, no es fácilmente dializable.
En caso de sobredosis con signos clínicos de intoxicación, aparte de los tratamientos sintomáticos y de apoyo, no se pueden hacer recomendaciones terapéuticas específicas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Inhibidores de la bomba de protones, Código ATC: A02BC02
5.1.1 Mecanismo de acción
Pantoprazol se convierte en su forma activa en el medio ácido de las células parietales donde inhibe a la enzima H+ /K+ ATP asa es decir, en la etapa final de la producción de ácido clorhídrico en el estómago. La inhibición es dosis dependiente y afecta tanto a la secreción ácida basal como la estimulada. Como otros inhibidores de la bomba de protones y los antagonistas de los receptores H2, el tratamiento con pantoprazol produce una reducción de la acidez en el estómago y por tanto, se produce un aumento de gastrina en proporción a la reducción de acidez. El aumento en gastrina es reversible. Como pantoprazol se une en una zona distal a la enzima a nivel del receptor celular, puede afectar a la secreción de ácido clorhídrico independientemente de la estimulación por otras sustancias (acetilcolina, histamina y gastrina). El efecto es el mismo tanto si se administra por vía intravenosa u oral.
Los valores de gastrina aumentan en ayunas con el pantoprazol. El uso a corto plazo, en la mayoría de los casos no superan el límite superior de la normalidad. Durante el tratamiento a largo plazo, los niveles de gastrina se duplican en la mayoría de los casos. Un uso excesivo, sin embargo se produce sólo en casos aislados. Como resultado, se observa un aumento de leve a moderado en el número de las células endocrinas específicas (ECL) en el estómago en una minoría de los casos durante el tratamiento a largo plazo (de hiperplasia simple a adenomatosa). Sin embargo, según los estudios realizados hasta el momento, la formación de precursores carcinoides (hiperplasia atípica) o carcinoides gástricos como se encontraron en experimentos con animales (ver sección 5.3) no se han observado en seres humanos.
La influencia del tratamiento a largo plazo con pantoprazol superior a un año no puede ser totalmente descartada en los parámetros endocrinos del tiroides de acuerdo con los estudios con animales.
5.2 Propiedades farmacocinéticas
Farmacocinética General
Los valores farmacocinéticos no varían después de una administración única o repetida. En el intervalo de dosis de 10 a 80 mg, la cinética de pantoprazol en plasma es prácticamente lineal después de la administración tanto oral como intravenosa.
5.2.2 Distribución
La unión de pantoprazol a proteínas séricas es de alrededor del 98%. El volumen de distribución es de unos 0,15 l/kg.
5.2.4 Eliminación
El compuesto se metaboliza casi exclusivamente en el hígado. La principal ruta metabólica es la dimetilación por CYP2C19 con la consiguiente conjugación de sulfatos, otra ruta metabólica incluyen la oxidación por CYP3A4. La vida media final es de aproximadamente 1 hora. Algunos sujetos presentaron eliminación retrasada. Debido a la activación específica de pantoprazol en la célula parietal, la vida media de eliminación no se correlaciona con su duración de acción más prolongada (inhibición de secreción ácida).
La eliminación renal representa la principal ruta de excreción (alrededor de un 80%) para los metabolitos de pantoprazol, el resto se excreta con las heces. El principal metabolito en suero y orina es desmetilpantoprazol, el cual se conjuga con sulfato. La vida media del metabolito principal (alrededor de 1,5 h) no es mucho más larga que la de pantoprazol.
Características en pacientes/grupos especiales de sujetos
Aproximadamente un 3% de la población europea carece de la encima CYP2C19 funcional y se denominan metabolizadores pobres. En estos individuos el metabolismo del pantoprazol está principalmente catalizado por CYP3A4. Después de una dosis única de pantoprazol de 40 mg, el área promedio bajo la curva plasmática concentración-tiempo era aproximadamente 6 veces más alta en metabolizadores pobres que en sujetos que tienen una encima CYP2C19 funcional (metabolizadores exhaustivos). El promedio de las concentraciones plasmáticas máximas se incrementaron en un 60%. Estos hallazgos no tienen implicaciones en la posología del pantoprazol.
No se requiere una reducción de la dosis cuando se administra pantoprazol a pacientes con función renal disminuida, la eliminación es todavía rápida y no se produce acumulación.
Aunque para pacientes con cirrosis hepática (clases A y B según Child) los valores de vida media aumentaron hasta 7-9 h y los valores AUC aumentaron en un factor de 5-7, la concentración máxima en suero solamente se incrementó ligeramente, en un factor de 1,5 comparado con sujetos sanos.
Tampoco es clínicamente relevante el ligero incremento en AUC y Cmax en voluntarios de edad avanzada en comparación con voluntarios jóvenes.
Niños
Después de la administración de una dosis única de 0,8 a 1,6 mg/kg de pantoprazol en niños de 2-16 años no hay una asociación significativa entre la eliminación del pantoprazol y edad o peso, el AUC y el volumen de distribución están de acuerdo con los datos para adultos.
5.3 Datos preclínicos sobre seguridad
Los datos preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre farmacología de seguridad, toxicidad de dosis repetidas y genotoxicidad
En un estudio de carcinogénesis durante 2 años en ratas, se encontraron neoplasias neuroendocrinas. Además, se hallaron papilomas de células escamosas en los estómagos de las ratas. El mecanismo que conduce a la formación de carcinoides gástricos por benzimidazoles sustituidos ha sido investigado cuidadosamente y se ha llegado a la conclusión de que es una reacción secundaria a los niveles séricos masivamente elevados de gastrina, que se presentan en la rata durante un tratamiento crónico. En los estudios a 2 años, se observó un aumento de tumores hepáticos en ratas y ratones hembras y fue interpretado como debido a la alta tasa de metabolización hepática de pantoprazol.
Se observó un ligero aumento de cambios neoplásicos de la tiroides en el grupo de ratas que recibían la dosis más alta (200 mg/kg). La aparición de estas neoplasias está asociada con los cambios inducidos por pantoprazol en la degradación hepática de tiroxina en el hígado de las ratas. Como la dosis terapéutica en el hombre es baja, no se esperan efectos secundarios en las glándulas tiroides.
En estudios de reproducción animal, se observaron signos de toxicidad para el feto a dosis de 5 mg/kg.
Las investigaciones no han revelado evidencia de alteraciones en la fertilidad o efectos teratogénicos.
Se investigó en rata la penetración a través de placenta, y se encontró un incremento en la gestación avanzada. Como resultado, la concentración de pantoprazol en el feto se eleva poco antes del nacimiento.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes Sin excipientes.
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros excepto con los mencionados en el sección 6.6.
6.3 Periodo de validez
18 meses
Después de la reconstitución, la estabilidad química y física ha sido demostrada durante 12 horas a 25°C. Desde el punto de vista microbiológico, el producto debe ser utilizado inmediatamente.
6.4 Precauciones especiales de conservación
Conservar por debajo de 25°C. Conservar el vial en el envase.
Para las condiciones de conservación tras la reconstitución y dilución del medicamento ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de 10 ml (tipo 1 según. A Ph. Eur.), con una cápsula de aluminio y tapón de goma.
Pantoprazol SUN 40 mg polvo para solución inyectable EFG se suministra en envases que contienen 1 ó 5 viales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La solución a utilizar se prepara inyectando 10 ml de solución fisiológica de cloruro sódico en el vial que contiene la sustancia seca. La solución reconstituida debe ser de incolora a ligeramente amarilla. Esta solución puede administrarse directamente o mezclándola con 100 ml de solución fisiológica de cloruro sódico 9 mg/ml (0,9%) o de glucosa al 55 mg/ml (5%). Para la dilución deben utilizarse envases de vidrio o plástico.
Después de la reconstitución, o reconstitución y dilución, la estabilidad química y física ha sido demostrada durante 12 horas a 25°C.
Desde el punto de vista microbiológico, el producto debe ser utilizado inmediatamente.
Pantoprazol SUN 40 mg no debe prepararse o mezclarse con otros disolventes diferentes a los especificados.
El preparado debe administrarse por vía intravenosa durante 2-15 minutos.
]£

El contenido del vial es para un único uso. Debe descartarse cualquier resto de producto que quede en el vial o cualquier vial en el cual se detecte un cambio en su aspecto visual (por ejemplo: si se observa turbidez o precipitaciones) realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87 2132 JH Hoofddorp Países Bajos.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Reg. AEMPS n°: 72704
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
15 noviembre 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015
MINISTER10DE )E
SAN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
proouctcs san-íanos taws
9 de 9