Octanate Lv 200 Ui/Ml Polvo Y Disolvente Para Solucion Inyectable
Prospecto: información para el usuario
Octanate LV 100 Ul/ml, polvo y disolvente para solución inyectable Factor VIII de coagulación humano Octanate LV 200 UI/ml, polvo y disolvente para solución inyectable Factor VIII de coagulación humano
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Octanate LV y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Octanate LV
3. Cómo usar Octanate LV
4. Posibles efectos adversos
5. Conservación de Octanate LV
6. Contenido del envase e información adicional
1. Qué es Octanate LV y para qué se utiliza
Octanate LV pertenece a un grupo de medicamentos denominados factores de coagulación y contiene factor VIII de coagulación humano. Esto es una proteína especial implicada en la coagulación de la sangre.
Octanate LV se usa para tratar y prevenir las hemorragias en pacientes con hemofilia A. Es una enfermedad en la cual la hemorragia puede durar más de lo esperado. Se debe a una ausencia hereditaria del factor VIII de la coagulación de la sangre.
2. Qué necesita saber antes de empezar a usar Octanate LV
Es altamente recomendado que cada vez que reciba una dosis de Octanate LV anote el nombre y el número de lote del producto con el fin de mantener un registro de los lotes utilizados.
Su médico puede recomendarle que considere la vacunación (contra la hepatitis A y B), si usted recibe regularmente o repetidamente productos de Factor VIII de origen humano.
No use Octanate LV:
si es alérgico al factor VIII de coagulación humano o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Octanate LV.
Octanate LV contiene muy pequeñas cantidades de otras proteínas humanas. Cualquier medicamento que contenga proteínas y sea inyectado a través de una vena (administrado por vía intravenosa) puede producir reacciones alérgicas (ver el apartado 4. “Posibles efectos adversos”).
Las personas con hemofilia A pueden desarrollar inhibidores del factor VIII (anticuerpos neutralizantes) (Ver apartado 4. “Posibles efectos adversos”).
Información sobre la sangre y el plasma usado para Octanate LV
Cuando se administran medicamentos derivados de plasma o sangre humanos, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen una cuidadosa selección de los donantes, para excluir a aquellos que están en riesgo de ser portadores de enfermedades infecciosas, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar / inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus emergentes o de naturaleza desconocida u otros tipos de infecciones.
Estas medidas se consideran efectivas para virus envueltos como el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B (VHB) y virus de la hepatitis C (VHC) y para el virus no envuelto de la hepatitis A (VHA). Las medidas tomadas pueden tener un valor limitado frente a virus no envueltos, como por ejemplo el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección del bebe) y para individuos cuyo sistema inmune está deprimido o para pacientes con algún tipo de anemia (por ejemplo enfermedad de las células en hoz o una destrucción anormal de los glóbulos rojos).
Uso de Octanate LV con otros medicamentos:
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar otros medicamentos, incluso los adquiridos sin receta.
No se conocen interacciones del factor VIII de coagulación humano con otros medicamentos. Sin embargo, no se debe combinar Octanate LV con otros medicamentos durante la perfusión.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento
Conducción y uso de máquinas:
No se han observado efectos sobre la capacidad de conducir o manejar maquinaria.
Octanate LV contiene
hasta 1,75 mmol de sodio (40 mg) por dosis en el vial de 500 y 1000 UI. Esto debe ser tenido en cuenta en pacientes con una dieta baja en sodio.
3. Cómo usar Octanate LV
Octanate LV se debe administrar por vía intravenosa una vez reconstituido con el disolvente proporcionado.
El tratamiento debe ser iniciado bajo supervisión médica.
Dosis para prevenir la hemorragia. Si usted padece hemofilia A grave deben inyectarle de 20 a 40 UI de factor VIII por kilo de peso corporal cada dos o tres días para una prevención a largo plazo. Se le ajustará la dosis en función de su respuesta. En algunos casos pueden ser necesarios intervalos de administración más cortos o dosis más altas.
2 de 10
Siga exactamente las instrucciones de administración de Octanate LV indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
La actividad del factor VIII se refiere a la cantidad de factor VIII presente en el plasma. Se expresa bien como porcentaje (respecto al plasma humano normal) o en Unidades Internacionales (UI). La dosis de factor VIII se expresa en UI.
Una unidad internacional (UI) de actividad del factor VIII es equivalente a la cantidad de factor VIII en un ml de plasma humano normal. Una UI de factor VIII por kg de peso corporal aumenta la actividad del factor VIII plasmático en un 1,5%-2% de la actividad normal. Para calcular la dosis que usted necesita, debe determinarse el nivel de actividad del factor VIII en plasma. Esto indicará la cantidad de esta actividad que es necesario incrementar. Pregunte a su médico si tiene alguna duda de que cantidad de actividad de factor VIII necesita incrementar o como calcular su dosis.
La posología necesaria se determina utilizando la siguiente fórmula:
Unidades necesarias = peso corporal (kg) x aumento del factor VIII deseado (%) (Ul/dl) x 0.5
La cantidad a administrar y la frecuencia de la administración debe estar siempre orientada a la eficacia clínica para cada paciente individual.
En el caso de los siguientes episodios hemorrágicos la actividad del factor VIII no debe descender por debajo del nivel de actividad plasmática dado (en % de normal) dentro del período correspondiente.
La siguiente tabla se puede usar como una guía de dosificación en episodios hemorrágicos y cirugía:
|
Grado de hemorragia / Tipo de procedimiento quirúrgico |
Nivel necesario de factor VIII (%) (UI/dl) |
Frecuencia de la dosis (horas entre dosis) / Duración de la terapia (en días) |
|
Hemorragia: | ||
|
Hemorragia en una articulación (hemartrosis temprana), hemorragia muscular o hemorragia oral. |
20 - 40 |
Repetir cada 12 a 24 horas. Al menos 1 día, hasta que el dolor disminuya o consiga la cicatrización. |
|
Hemorragia más extensa en una articulación (hemartrosis), hemorragia muscular o efusión de sangre (hematoma). |
30 - 60 |
Perfusión repetida cada 12 a 24 horas durante 3-4 días o más hasta que el dolor y la discapacidad se hayan resuelto. |
|
Hemorragias amenazantes para la vida , como cirugía cerebral, sangrado de garganta, sangrado abdominal grave. |
60 - 100 |
Perfusión repetida cada 8 a 24 horas hasta que se supere el peligro. |
|
Cirugía: | ||
|
Menor incluyendo extracción dental. |
30 - 60 |
Cada 24 horas, como mínimo 1 día, hasta que se alcance la cicatrización. |
|
Mayor |
80 - 100 (antes y después de una operación) |
Perfusión repetida cada 8-24 horas hasta una adecuada cicatrización de la herida, seguida de una terapia como mínimo durante 7 días para mantener una actividad del factor VIII del 30% al 60%. |
Su médico le indicará la dosis y la frecuencia con que debe utilizar Octanate LV.
Su respuesta a los productos de factor VIII puede variar. Por lo tanto, los niveles de factor VIII deben determinarse durante el tratamiento para calcular la dosis correcta y la frecuencia de perfusión adecuada.
Uso en niños
Un estudio clínico (que incluía 15 pacientes de edad igual o inferior a 6 años) no identificó ningún requisito de dosificación especial para niños.
Los datos clínicos sobre el uso de Octanate LV en pacientes no tratados previamente (PntP) son limitados. Hay un estudio clínico en curso. Hasta ahora el 10,3 % de los PntP tratados con Octanate LV desarrollaron inhibidores. Al tratar a los PntP hay que analizar el posible desarrollo de anticuerpos (ej. test Bethesda).
.<&P.
Instrucciones para el tratamiento ambulatorio
• Por favor, lea todas las instrucciones y sígalas cuidadosamente
• No utilice Octanate LV después de la fecha de caducidad que aparece en el envase
• Durante el procedimiento descrito a continuación, debe mantenerse la esterilidad
• La solución en la jeringa debe ser límpida o ligeramente nacarada. No inyectar soluciones turbias o que contengan sedimentos.
• Utilizar inmediatamente la solución preparada, para evitar una contaminación microbiana.
• Utilizar únicamente el equipo que se incluye. El uso de otro equipo de inyección/perfusión puede ocasionar un riesgo adicional y el fracaso del tratamiento.
Instrucciones para preparar la solución:
1. No utilizar el producto directamente de la nevera. Dejar el disolvente y el polvo en los viales cerrados hasta alcanzar la temperatura ambiente.
2. Retirar las cápsulas flip off de los viales y limpiar los tapones de goma con uno de los apósitos impregnados en alcohol que se incluyen.
3. El Mix2vial® está representado en la Fig. 1. Colocar el vial de disolvente sobre una superficie plana y sujetarlo con firmeza. Coger el Mix2vial® y darle la vuelta. Colocar la parte azul del Mix2vial® sobre la parte superior del vial del disolvente y presionar con firmeza hasta que se oiga un chasquido (Fig. 2 + 3).
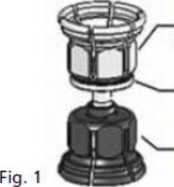
Adaptador del vial de polvo (transparente)
Filtro integrado
Adaptador del vial de disolvente (azul)

.HP.
4. Colocar el vial del polvo sobre una superficie plana y sujetarlo con firmeza. Coger el vial de disolvente con el Mix2Vial® acoplado y darle la vuelta. Colocar la parte transparente sobre la parte superior del vial del polvo y presionar con firmeza hasta que se oiga un chasquido (Fig. 4). El disolvente fluye automáticamente al interior del vial del polvo.

Fig. 4

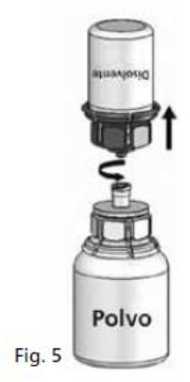
5. Con ambos viales todavía acoplados, agitar suavemente el vial del polvo hasta que el producto se haya disuelto.
La disolución es completa en menos de 10 minutos a temperatura ambiente. Podría aparecer una ligera espuma durante la
preparación. Desenroscar las dos partes del Mix2Vial® (Fig. 5). Desaparecerá la espuma.
®
Desechar el vial de disolvente vacío con la parte azul del Mix2Vial
Instrucciones para la inyección:
Como precaución, se debe medir la velocidad de su pulso antes y durante la inyección. Si la velocidad de su pulso aumenta mucho, reducir la velocidad de la inyección o interrumpir la administración durante un breve periodo de tiempo.
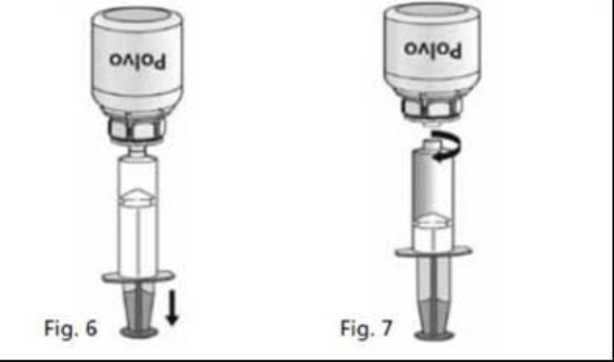
1. Acoplar la jeringa a la parte transparente del Mix2Vial®. Darle la vuelta al vial y extraer la solución al interior de la jeringa (Fig.6). La solución en la jeringa debe ser límpida o ligeramente nacarada.
Una vez que la solución ha sido transferida, sujetar con firmeza el émbolo de la jeringa (manteniéndolo hacia abajo) y extraer la jeringa del Mix2Vial® (Fig. 7). Desechar el Mix2Vial® y el vial vacío.
2. Limpiar la zona donde se va a poner la inyección con uno de los apósitos con alcohol que se incluyen.
3. Acoplar el kit de inyección que se incluye a la jeringa.
4. Insertar la aguja de inyección en la vena escogida. Si ha empleado un torniquete para ver la vena con más facilidad, este torniquete debe ser liberado antes de empezar a inyectar Octanate LV.
No debe fluir sangre al interior de la jeringa debido al riesgo de formación de coágulos de fibrina.
5. Inyectar la solución dentro de la vena a una velocidad lenta, no superior a 2-3 ml por minuto.
Si usa más de un vial de polvo de Octanate LV para un tratamiento, puede emplear el mismo kit de inyección y la misma jeringa. El Mix2Vial® es de un solo uso.
Si usa más Octanate LV del que debe
No se han registrado síntomas de sobredosis con el factor VIII de coagulación humano. Sin embargo se recomienda no exceder la dosis recomendada.
Si olvidó usar Octanate LV
No tome una dosis doble para compensar una dosis olvidada. Proceda a administrar la siguiente dosis inmediatamente y prosiga con las recomendaciones de su médico o farmacéutico.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos Octanate LV puede producir efectos adversos, aunque no todas las personas los sufran.
Aunque raras (afecta de 1 a 10 pacientes de cada 10.000), se han observado reacciones de hipersensibilidad o alérgicas en pacientes tratados con productos que contienen factor VIII.
Contacte con su médico si sufre alguno de los siguientes síntomas:
malestar (vómitos), irritación y escozor en el lugar de inyección, opresión en el pecho, escalofríos, ritmo cardiaco más rápido (taquicardia), náuseas, sensación de pinchazos (hormigueo), sofocos, cefalea, urticaria, disminución de la tensión arterial (hipotensión), erupciones cutáneas, inquietud, hinchazón de la cara, labios, boca, lengua o garganta que puede producir dificultad para tragar o respirar (angioedema), cansancio (letargia), silbidos.
En casos muy raros (afecta a menos de 1 paciente de cada 10.000), esta hipersensibilidad puede desembocar en una reacción alérgica grave amenazante para la vida, denominada anafilaxis, que puede incluir shock, además de algunos o todos los síntomas descritos anteriormente. En este caso, póngase inmediatamente en contacto con su médico o llame a una ambulancia.
Otros efectos adversos raros (afecta de 1 a 10 pacientes de cada 10.000)
Fiebre
Si usted sufre hemofilia A puede desarrollar inhibidores (anticuerpos neutralizantes) del factor VIII. Si se producen anticuerpos, éstos pueden impedir que su medicamento funcione adecuadamente y continúe el sangrado. En estos casos raros se recomienda contactar rápidamente con un centro especializado en hemofilia. Deben monitorizarle cuidadosamente para detectar el desarrollo de inhibidores mediante observaciones clínicas apropiadas y análisis de sangre. Los inhibidores pueden aumentar el riesgo de sufrir reacciones alérgicas graves (shock anafiláctico). Si usted sufre una reacción alérgica, deberán hacerle análisis para detectar la posible presencia de un inhibidor.
Para información respecto a la seguridad viral ver el apartado 2. (Tenga especial cuidado con Octanate LV - información sobre la sangre y el plasma usado para Octanate LV).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.
También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Octanate LV
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento despues de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre +2 - 8°C).
No congelar.
Mantener los viales dentro del envase exterior para protegerlos de la luz.
Utilice Octanate LV inmediatamente después de la reconstitución y en una sola ocasión.
No utilice este medicamento si observa soluciones turbias o que no estén completamente disueltas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico como deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Octanate
El principio activo es el factor VIII de la coagulación humano Volumen y concentraciones:
|
Cantidad vial de polvo de |
Cantidad vial de diluyente |
Concentración nominal de la |
|
Octanate® |
(para ser añadido al vial de polvo de Octanate®) |
solución reconstituida |
|
(UI FVm) |
(ml) |
(UI FVIII/ml) |
|
250 UI |
5 |
50 |
|
500 UI |
10 |
50 |
|
1000 UI |
10 |
100 |
Los demás componentes son:
Para el polvo: citrato de sodio, cloruro de sodio, cloruro de calcio y glicina.
Para el disolvente: agua para inyectables.
Aspecto del producto y contenido del envase
Octanate se presenta como polvo y disolvente para solución inyectable.
El polvo es blanco o amarillo pálido, o también con apariencia de solido friable.
El disolvente es un líquido claro e incoloro.
Los tamaños de envase disponibles difieren en la cantidad de factor VIII de la coagulación humano y disolvente
• 250 UI/vial: al reconstituirlo con 5 ml se obtienen 50 UI/ml
• 500 UI/vial: al reconstituirlo con 10 ml se obtienen 50 UI/ml
• 1000 UI/vial: al reconstituirlo con 10 ml se obtienen 100 UI/ml
Todos los envases incluyen:
Una jeringa desechable, un equipo de transferencia Mix2Vial®, un kit de inyección y dos apósitos con alcohol.
Puede que no todos los tamaños de envases estén disponibles
Titular de la autorización de comercialización
Octapharma S.A.
Avda. Castilla, 2. (P.E. San Fernando)
Ed. Berlín, bajo
28830 San Fernando de Henares Madrid
Responsable de la fabricación:
Octapharma Pharmazeutika Produktionsges.m.b.H. Oberlaaer Str. 235
A-1100 Vienna Austria
o
Octapharma S.A.S 70 - 72 Rue du Maréchal Foch BP 33, F - 67381 Lingolsheim Francia
o
Octapharma AB
Lars Forssells gata 23, 112 75 Stockholm Suecia
Fecha de la última revisión de este prospecto: Enero de 2016
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
10 de 10