Numeta G13%E, Emulsion Para Perfusion
ÍTT1
ÍTT1
1.
Nombre del medicamento
NUMETA G13%E, emulsión para perfusión
2. Composición cualitativa y cuantitativa
Este medicamento se presenta en forma de bolsa tricompartimental. Cada bolsa contiene una combinación estéril y apirógena de una solución de glucosa, una solución pediátrica de aminoácidos con electrolitos y una emulsión de lípidos tal como se describe a continuación:
|
Tamaño del envase |
Solución de glucosa al 50% |
Solución de aminoácidos al 5,9% con electrolitos |
Emulsión de lípidos al 12,5% |
|
300 ml |
80 ml |
160 ml |
60 ml |
Si no es recomendable administrar lípidos, el diseño de la bolsa permite activar el sello no permanente entre las cámaras de aminoácidos/electrolitos y glucosa, dejando el sello que separa las cámaras de aminoácidos y lípidos intactos. El contenido de la bolsa se puede perfundir posteriormente con o sin lípidos. La composición del medicamento tras la mezcla de las dos cámaras (aminoácidos y glucosa, bolsa de 2 cámaras, solución de 240 ml) o tres cámaras (aminoácidos, glucosa y lípidos, bolsa de tres cámaras activada, emulsión de 300 ml) se indica en la siguiente tabla.
74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencsaesparioíaóe medicamentos y oroductos samaros
|
Composición | |||
|
Principio activo |
B2C activada (240 ml) |
B3C activada (300 ml) | |
|
Compartimento de aminoácidos | |||
|
Alanina |
0,75 g |
0,75 |
g |
|
Arginina |
0,78 g |
0,78 |
g |
|
Ácido aspártico |
0,56 g |
0,56 |
g |
|
Cisteína |
0,18 g |
0,18 |
g |
|
Ácido glutámico |
0,93 g |
0,93 |
g |
|
Glicina |
0,37 g |
0,37 |
g |
|
Histidina |
0,35 g |
0,35 |
g |
|
Isoleucina |
0,62 g |
0,62 |
g |
|
Leucina |
0,93 g |
0,93 |
g |
|
Lisina monohidratada |
1,15 g |
1,15 |
g |
|
(equivalente a lisina) |
(1,03 g) |
(1,03 |
g) |
|
Metionina |
0,22 g |
0,22 |
g |
|
Ornitina hidrocloruro |
0,30 g |
0,30 |
g |
|
(equivalente a ornitina) |
(0,23 g) |
(0,23 |
g) |
|
Fenilalanina |
0,39 g |
0,39 |
g |
|
Prolina |
0,28 g |
0,28 |
g |
|
Serina |
0,37 g |
0,37 |
g |
|
Taurina |
0,06 g |
0,06 |
g |
|
Treonina |
0,35 g |
0,35 |
g |
|
Triptófano |
0,19 g |
0,19 |
g |
|
Tirosina |
0,07 g |
0,07 |
g |
|
Valina |
0,71 g |
0,71 |
g |
|
Acetato de potasio |
0,61 g |
0,61 |
g |
|
Cloruro de calcio dihidratado |
0,55 g |
0,55 |
g |
|
Acetato magnésico tetrahidratado |
0,27 g |
0,27 |
g |
|
Glicerofostato de sodio hidratado |
0,98 g |
0,98 |
g |
|
Compartimento de glucosa | |||
|
Glucosa monohidratada (equivalente a anhídrido de glucosa) |
44,00 g (40,00 g) |
44,00 g (40,00 g) | |
|
Compartimento de lípidos | |||
|
Aceite de oliva refinado (aprox. 80%) + aceite de soja refinado (aprox. 20%) |
- |
7,5 g | |
B2C= bolsa de 2 cámaras, B3C= bolsa de 3 cámaras
Para consultar la lista completa de excipientes, ver sección 6.1.
74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencsa española de medicamentos y productos samaros
La solución/emulsión reconstituida proporciona lo siguiente:
|
Composición | ||||
|
B2C activada |
B3C activada | |||
|
Por unidad de volumen (ml) |
240 |
100 |
300 |
100 |
|
Nitrógeno (g) |
1,4 |
0,59 |
1,4 |
0,47 |
|
Aminoácidos (g) |
9,4 |
3,9 |
9,4 |
3,1 |
|
Glucosa (g) |
40,0 |
16,7 |
40,0 |
13,3 |
|
Lípidos (g) |
0 |
0 |
7,5 |
2,5 |
|
Energía | ||||
|
Calorías totales (kcal) |
200 |
83 |
275 |
91 |
|
Calorías no proteicas (kcal) |
160 |
67 |
235 |
78 |
|
Calorías de glucosa (kcal) |
160 |
67 |
160 |
53 |
|
Calorías de lípidos (kcal) (1) |
0 |
0 |
75 |
25 |
|
Calorías no proteicas / nitrógeno (kcal/g N) |
113 |
113 |
165 |
165 |
|
Calorías de lípidos / calorías no proteicas (%) |
NA |
N/A |
32 |
32 |
|
Calorías de lípidos / calorías totales (%) |
NA |
N/A |
27 |
27 |
|
Electrolitos | ||||
|
Sodio (mmol) |
6,4 |
2,7 |
6,6 |
2,2 |
|
Potasio (mmol) |
6,2 |
2,6 |
6,2 |
2,1 |
|
Magnesio (mmol) |
1,3 |
0,52 |
1,3 |
0,42 |
|
Calcio (mmol) |
3,8 |
1,57 |
3,8 |
1,25 |
|
Fosfato (mmol) (2) |
3,2 |
1,34 |
3,8 |
1,26 |
|
Acetato (mmol) |
8,8 |
3,7 |
8,8 |
2,9 |
|
Malato (mmol) |
3,2 |
1,3 |
3,2 |
1,1 |
|
Cloruro (mmol) |
9,4 |
3,9 |
9,4 |
3,1 |
|
pH (aprox.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolaridad aprox. (mOsm/l) |
1410 |
1410 |
1155 |
1155 |
(1) Incluye calorías de fosfatidos de huevo.
(2) Incluye el fosfato proporcionado por los fosfatidos de huevo de los lípidos.
3. Forma farmacéutica Emulsión para perfusión.
Aspecto antes de la reconstitución:
• Las soluciones de las cámaras de aminoácidos y glucosa son trasparentes, incoloras o ligeramente amarillentas.
• La emulsión de lípidos es homogénea y de un blanco lechoso.
4. Datos clínicos
4.1 Indicaciones terapéuticas
NUMETA G13%E está indicado para la alimentación parenteral de recién nacidos prematuros cuando la alimentación oral o enteral es imposible, insuficiente o está contraindicada.
74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencsaesparioíaóe medicamentos y oroductos santeros
4.2 Posología y forma de administración
Posología
La dosis depende del gasto de energía, el estado clínico, la edad, el peso del paciente y la capacidad de metabolizar los componentes de NUMETA, así como de la energía y las proteínas adicionales administradas oral o enteralmente. La composición total de electrolitos y macronutrientes depende del número de cámaras activadas (ver sección 2).
La velocidad de perfusión máxima por hora recomendada y el volumen por día dependen del componente. La primera de estas limitaciones alcanzadas define la dosis máxima diaria. Las directrices para la velocidad máxima por hora recomendada de perfusión y el volumen por día son:
|
B2C activada (240 ml) |
B3C activada (300 ml) | |
|
Velocidad máxima de perfusión en ml/kg/hora |
5,1 |
6,4 |
|
Correspondiente a: | ||
|
Aminoácido en g/kg/hora |
0,20* |
0,20* |
|
Glucosa en g/kg/hora |
0,85 |
0,85 |
|
Lípidos en g/kg/hora |
0 |
0,16 |
|
Cantidad máxima en ml/kg/día |
102,3 |
127,9 |
|
Correspondiente a: | ||
|
Aminoácido en g/kg/día |
4,0* |
4,0* |
|
Glucosa en g/kg/día |
17,1 |
17,1 |
|
Lípidos en g/kg/día |
0 |
3,2 |
* Parámetro limitador según directrices de ESPEN-ESPGHAN
NUMETA puede no ser apropiado para algunos recién nacidos prematuros, si el médico ha considerado que la situación clínica del paciente puede requerir la administración de fórmulas individualizadas para satisfacer sus necesidades específicas.
Forma de administración
Para obtener instrucciones acerca de la preparación y la manipulación de la solución/emulsión para la perfusión, ver sección 6.6.
Debido a su elevada osmolaridad, NUMETA sin diluir sólo puede administrarse a través de una vena central. Sin embargo, una dilución suficiente de NUMETA con agua para preparaciones inyectables reduce la osmolaridad y permite la perfusión periférica. La siguiente tabla indica el impacto de la dilución sobre la osmolaridad de las bolsas.
Ejemplos de osmolaridad para las adiciones de las bolsas de 2 y 3 cámaras activadas tras la adición de oligoelementos (TE), vitaminas (V) y agua para preparaciones inyectables:
4 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agenea española óe medicamentos y productos sanearos
|
Aminoácidos y glucosa (B2C activada) |
Aminoácidos, glucosa y lípidos (B3C activada) | |
|
Volumen inicial en la bolsa (ml) |
240 |
300 |
|
Osmolaridad inicial (mOsm/l aprox) |
1410 |
1155 |
|
Volumen de agua añadida (ml) |
240 |
300 |
|
Oligoelementos añadidos * |
2,5 ml TE1 |
2,5 ml TE1 |
|
Vitaminas añadidas * |
V de vial V1 |
V de vial V1 + V de vial V2 |
|
Volumen final tras adición (ml) |
485 |
605 |
|
Osmolaridad tras adición (mOsm/l aprox) |
700 |
575 |
* La composición de las preparaciones de vitaminas y oligoelementos se describen a continuación.
Composición de oligoelementos utilizados en las preparaciones comerciales
Composición por vial _TE1(10 mi)_
Zinc......................................38,2 pmol ó 2,5 mg
Selenio................................. 0,253 pmol ó 0,02 mg
Cobre...................................3,15 pmol ó 0,2 mg
Yodo.................................... 0,0788 pmol ó 0,01 mg
Flúor....................................30 pmol ó 0,57 mg
Manganeso..........................0,182 pmol ó 0,01 mg
Composición de vitaminas utilizadas en las preparaciones comerciales
|
Composición por vial |
V1 |
V2 |
|
Vitamina B1 |
2,5 mg |
- |
|
Vitamina B2 |
3,6 mg |
- |
|
Nicotinamida |
40 mg |
- |
|
Vitamina B6 |
4,0 mg |
- |
|
Ácido pantoténico |
15,0 mg |
- |
|
Biotina |
60 pg |
- |
|
Ácido fólico |
400 pg |
- |
|
Vitamina B12 |
5,0 pg |
- |
|
Vitamina C |
100 mg |
- |
|
Vitamina A |
- |
2300 UI |
|
Vitamina D |
- |
400 UI |
|
Vitamina E |
- |
7 UI |
|
Vitamina K |
- |
200 pg |
La velocidad de administración debe aumentarse gradualmente durante la primera hora. Hasta la discontinuación de Numeta esta velocidad debe disminuir gradualmente durante la última hora. La velocidad de administración debe ajustarse para tener en cuenta la dosis que se está administrando, la ingesta diaria de volumen y la duración de la perfusión, ver sección 4.9.
En el caso de recién nacidos prematuros, se suele recomendar la administración parenteral continua durante 24 horas. Sin embargo no se debe activar, colgar ni perfundir la misma bolsa durante más de 24 horas. Las perfusiones cíclicas deben tratarse según la tolerancia metabólica del paciente.
5 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es parí oía óe medicamentos y productos santeros
ÍTTI
El tratamiento con la alimentación parenteral puede prolongarse tanto tiempo como requiera el estado clínico del paciente.
Este producto contiene electrolitos y puede complementarse con preparados comerciales de vitaminas según la opinión del médico y las necesidades clínicas del paciente, ver sección 6.6.
Se pueden añadir vitaminas y oligoelementos según la opinión del médico y las necesidades clínicas del paciente, ver sección 6.6.
4.3 Contraindicaciones
Las contraindicaciones generales para la administración de NUMETA como una bolsa de 2 cámaras activada para perfusión intravenosa son las siguientes:
• Hipersensibilidad a las proteínas de huevo, soja y de cacahuete, a alguno de los principios activos, excipientes incluidos en la sección 6.1 o componentes del envase
• Alteración congénita del metabolismo de los aminoácidos
• Elevada concentración en plasma, de forma patológica, de sodio, potasio, magnesio, calcio y/o fósforo
• La administración concomitante con ceftriaxona en recién nacidos (< 28 días de edad), aunque se utilicen líneas de infusión separadas. Ver secciones 4.5 y 6.2
• Hiperglucemia grave
La adición de lípidos (administrando NUMETA como una bolsa de 3 cámaras activada para emulsión intravenosa) está contraindicada en las siguientes situaciones clínicas adicionales:
• Hiperlipidemia grave o alteraciones graves del metabolismo de los lípidos caracterizadas por la hipertrigliceridemia
4.4 Advertencias y precauciones especiales de empleo
La perfusión debe detenerse inmediatamente si se desarrolla cualquier signo anormal o síntoma de una reacción alérgica (como fiebre, sudoración, temblores, cefalea, erupciones cutáneas o disnea).
No debe realizarse ninguna adición a la bolsa sin realizar una comprobación previa de la compatibilidad, ya que la formación de precipitados o la desestabilización de la emulsión de lípidos podrían dar lugar a una oclusión vascular, ver secciones 6.2 y 6.6.
Se puede producir infección y septicemia al usar los catéteres intravenosos para administrar formulaciones parenterales o llevar a cabo un mantenimiento inadecuado de los catéteres. Los efectos inmunodepresores de la enfermedad o los fármacos pueden facilitar la aparición de infección y septicemia. Una meticulosa supervisión sintomática y de laboratorio de la fiebre/escalofríos, la leucocitopenia, las complicaciones técnicas con el dispositivo de acceso y la hiperglucemia puede ayudar a detectar infecciones de forma precoz. Los pacientes que requieren alimentación parenteral suelen presentar predisposición a complicaciones infecciosas debido a la malnutrición y/o el estado de la enfermedad subyacente. La aparición de complicaciones sépticas puede reducirse haciendo especial hincapié en el uso de técnicas asépticas en la colocación y el mantenimiento de los catéteres, así como en utilizar una técnica aséptica para la preparación de la fórmula nutricional.
Se han descrito casos de síndrome de sobrecarga de grasas con productos similares. Una reducción de la capacidad de eliminación de los lípidos que contiene NUMETA puede ocasionar un "síndrome de sobrecarga de grasas"
La realimentación de los pacientes con una desnutrición grave puede dar lugar al síndrome de realimentación, que se caracteriza por variaciones intracelulares en el potasio, el fósforo y el magnesio
6 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos saldaros
ÍTTI
a medida que el paciente aumenta de peso. También se puede desarrollar una deficiencia de tiamina y retención de líquidos. Se recomienda la iniciación cuidadosa y lenta de la alimentación parenteral, con una supervisión rigurosa de los fluidos, los electrolitos, los oligoelementos y las vitaminas.
NUMETA sólo debe ser administrado a través de una vena central, excepto si se realiza una dilución adecuada (ver sección 4.2).Si se realizan adiciones a la formulación, debe medirse la osmolaridad final de la mezcla antes de administrarla a través de una vena periférica con el fin de evitar la irritación venosa.
No conecte bolsas en serie con el fin de evitar posibles embolias gaseosas debidas al aire residual contenido en la bolsa primaria.
Los lípidos, vitaminas, electrolitos adicionales y elementos traza deben ser administrados cuando sean necesario.
Precauciones
No adicione otros medicamentos o sustancias a ningún compartimento de la bolsa o a la solución/emulsión reconstituida sin confirmar primero su compatibilidad y la estabilidad de la preparación resultante (en particular, la estabilidad de la emulsión lipídica). Ver secciones 6.2 y 6.6.
Supervise de forma rutinaria el equilibrio hidroelectrolítico, la osmolaridad y los triglicéridos sanguíneos, el equilibrio ácido/base, la glucosa en sangre, la función renal y hepática, el hemograma incluyendo las plaquetas y los parámetros de coagulación, durante todo el tratamiento.
En caso de que el estado sea inestable (por ejemplo, los siguientes estados postraumáticos graves, diabetes mellitus no compensada, fase aguda de shock circulatorio, infarto agudo de miocardio, acidosis metabólica grave, septicemia grave y coma hiperosmolar) la administración de NUMETA se debe supervisar y ajustar para cubrir las necesidades clínicas del paciente.
Hay datos limitados de la administración de Numeta en niños pretérmino menores de 28 semanas de gestación.
Cardiovascular
Úsese con precaución en pacientes con edema pulmonar o insuficiencia cardiaca. Se deberá supervisar el estado de los fluidos con atención.
Renal
Usar con precaución en pacientes con insuficiencia renal. Se debe supervisar con atención el estado de los fluidos y los electrolitos.
Antes de comenzar la perfusión deben corregirse los trastornos graves del equilibrio hidroelectrolítico, los estados graves de sobrecarga de fluidos y los trastornos metabólicos graves.
Hepáticos / Gastrointestinales
Úsese con precaución en pacientes con insuficiencia hepática grave, incluida la colestasis o un índice alto de enzimas hepáticas. Se deberán supervisar rigurosamente los parámetros de la función hepática.
Endocrino y metabolismo
Pueden producirse complicaciones metabólicas si la ingesta de nutrientes no se adapta a las necesidades del paciente o la capacidad metabólica de cualquier componente dietético dado no se
7 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos saldaros
ÍTTI
valora de forma precisa. Pueden aparecer efectos metabólicos adversos derivados de la administración de nutrientes inadecuados o excesivos, o de la composición inadecuada de una mezcla para las necesidades específicas de un paciente.
Deben comprobarse regularmente las concentraciones de triglicéridos en suero y la capacidad del organismo para metabolizar los lípidos. Si se sospecha de una alteración del metabolismo de los lípidos, se recomienda supervisar estos triglicéridos como necesidad clínica.
En caso de hiperglucemia, la velocidad de la perfusión de NUMETA debe ajustarse y/o administrarse insulina, ver sección 4.9.
Hematológico
Úsese con precaución en pacientes con trastornos graves de la coagulación sanguínea. Se deberán supervisar rigurosamente los parámetros del hemograma y la coagulación.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción farmacodinámica con NUMETA.
NUMETA no debe administrarse simultáneamente con sangre a través de la misma vía de perfusión, debido al riesgo de pseudoaglutinación.
Al igual que en otras soluciones para perfusión que contienen calcio el tratamiento concomitante con ceftriaxona y NUMETA está contraindicado en recién nacidos (< 28 días de edad), incluso si las líneas para la perfusión se usan por separado (riesgo de precipitación mortal de la ceftriaxona con la sal de calcio en la sangre del recién nacido a término). En pacientes mayores de 28 días (incluyendo adultos), no debe administrarse ceftriaxona por vía intravenosa al mismo tiempo que las soluciones que contienen calcio, incluyendo NUMETA, a través de la misma vía de perfusión (por ejemplo conector en Y).
Si se utiliza la misma línea de perfusión para la administración secuencial, debe limpiarse cuidadosamente con un líquido compatible entre las perfusiones.
El aceite de oliva y el aceite de semillas de soja tienen un contenido natural de vitamina K1 que puede contrarrestar la actividad anticoagulante de la cumarina (o los derivados de la cumarina, incluida la warfarina).
Debido al contenido en potasio de NUMETA, debe tenerse especial cuidado con pacientes tratados de forma simultánea con diuréticos ahorradores de potasio (amilorida, espironolactona, triamtereno) o con inhibidores de la enzima convertidora de la angiotensina (IECA), con los antagonistas del receptor II de la angiotensina o con los inmunosupresores tacrolimus y ciclosporina debido al riesgo de hiperpotasemia.
Los lípidos que contiene esta emulsión pueden interferir con los resultados de determinadas pruebas de laboratorio (por ejemplo, la bilirrubina, la lactato deshidrogenasa, la saturación de oxígeno, la hemoglobina en sangre) si la muestra de sangre se toma antes de que se eliminen los lípidos. Los lípidos se eliminan normalmente después de un periodo de 5 a 6 horas si no se administran más lípidos.
Ver sección 6.2 “Incompatibilidades”.
4.6 Fertilidad, embarazo y lactancia
8 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es parí oía óe medicamentos y productos santeros
ÍTTI
o en periodo de riegos en cada
No existen datos suficientes sobre la utilización de NUMETA en mujeres embarazadas lactancia. Los médicos deben evaluar detenidamente los beneficios y los posibles paciente específico antes de prescribir NUMETA.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No aplicable
4.8 Reacciones adversas
La seguridad de la administración de NUMETA ha sido evaluada en un único estudio en fase III. El estudio incluyó a ciento cincuenta y nueve (159) pacientes pediátricos a los que se administró
NUMETA.
Las reacciones adversas observadas en este estudio se resumen en la siguiente tabla.
|
Reacciones adversas de ensayos clínicos | ||
|
Clasificación de órganos del sistema (SOC) |
Frecuencia** |
Término preferido de MedDRA |
|
TRASTORNOS DEL METABOLISMO Y DE |
Frecuentes |
Hipofosfatemia* |
|
LA NUTRICIÓN |
Frecuentes |
Hiperglucemia* |
|
Frecuentes |
Hipercalcemia* | |
|
Frecuentes |
Hipertrigliceridemia* | |
|
Poco frecuentes |
Hiperlipidemia | |
|
Frecuentes |
Hiponatremia* | |
|
TRASTORNOS HEPATOBILIARES |
Poco frecuentes |
Colestasis |
* Las muestras de sangre realizadas durante la perfusión (sin estado de ayuno).
** La frecuencia se basa en las siguientes categorías: Muy frecuentes (>1/10); Frecuentes (>1/100 - <1/10), Poco frecuentes (>1/1.000 - <1/100), Raras (>1/10.000 - <1/1.000), Muy raras (<1/10.000).
Síndrome de sobrecarga de grasa: puede ser causado por la administración inadecuada (por ejemplo, sobredosis y/o velocidad de perfusión superior a la recomendada, ver sección 4.9), pero también se pueden presentar los signos y síntomas de este síndrome cuando el producto se administra de acuerdo con las instrucciones. La capacidad reducida o limitada para metabolizar los lípidos que contiene NUMETA acompañado por un aclaramiento plasmático prolongado puede ocasionar un "síndrome de sobrecarga de grasa". Este síndrome está asociado con un empeoramiento repentino del estado clínico del paciente y se caracteriza por síntomas como hiperlipidemia, fiebre, filtración de grasas al hígado, (hepatomegalia) que deteriora la función hepática, anemia, leucocitopenia, trombocitopenia, trastornos de la coagulación y manifestación del Sistema Nervioso Central (ej. Coma). Suele ser reversible cuando se detiene la perfusión de la emulsión de lípidos.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Si se administra de manera inadecuada (sobredosis y/o velocidad de perfusión superior a la recomendada), es posible que se produzcan náuseas, vómitos, temblores, alteraciones electrolíticas y
9 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia española de medicamentos y productos saldaros
ÍTTI
que aparezcan signos de hipervolemia o acidosis con consecuencias fatales. En estos casos, deberá detenerse inmediatamente la perfusión. Si se considera adecuado desde el punto de vista médico, pueden indicarse otras intervenciones.
Puede desarrollarse hiperglucemia, glucosuria y un síndrome hiperosmolar si la velocidad de perfusión de glucosa supera la eliminación.
La capacidad reducida o limitada para metabolizar los lípidos puede ocasionar un síndrome de sobrecarga de grasa, cuyos efectos suelen ser reversibles cuando se detiene la perfusión de la emulsión de lípidos, ver sección 4.8.
No se ha especificado ningún antídoto específico para la sobredosis. Los procedimientos de urgencia deben ser medidas complementarias generales, con especial atención a los sistemas respiratorio y cardiovascular. En algunos casos graves, puede ser necesaria la hemodiálisis, la hemofiltración o la hemodiafiltración.
Es esencial realizar un exhaustivo control bioquímico y tratar apropiadamente las anormalidades específicas.
5. Propiedades farmacológicas 5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Soluciones para alimentación parenteral/combinación Código ATC: B05BA10
El contenido de nitrógeno de NUMETA (20 aminoácidos de la serie L, entre los que se incluyen 8 aminoácidos esenciales) y energía (glucosa y triglicéridos) permite mantener un equilibrio adecuado nitrógeno/energía. El nitrógeno y la energía son necesarios para el funcionamiento normal de todas las células del cuerpo, además de ser importantes para la síntesis de las proteínas, el crecimiento, la cicatrización de heridas, la función inmune, la función muscular y muchas otras actividades celulares.
Esta formulación también contiene electrolitos.
El perfil de aminoácidos es el siguiente:
• Aminoácidos esenciales/aminoácidos totales: 47,5%
• Aminoácidos de cadena ramificada/aminoácidos totales: 24,0%
La emulsión de lípidos que contiene NUMETA es una mezcla de aceite de oliva refinado y aceite de soja refinado (en una proporción aproximada de 80/20), con la siguiente distribución relativa de ácidos grasos:
• 15% de ácidos grasos saturados (AGS)
• 65% de ácidos grasos monoinsaturados (AGM)
• 20% de ácidos grasos poliinsaturados (AGPI)
La proporción de fosfolípidos/triglicéridos es de 0,06. El contenido moderado de ácidos grasos esenciales (AGE) mejora el estado de los derivados superiores a la vez que corrige la insuficiencia de ácidos grasos esenciales.
10 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agenc<a española de medicamentos y sroductos samaros
ÍTTI
El aceite de oliva contiene cantidades considerables de alfa tocoferol que, combinado con una ingesta moderada de AGPI, contribuye a mejorar el estado de vitamina E y es importante para limitar la peroxidación de los lípidos.
La fuente de los carbohidratos es la glucosa. La glucosa es una fuente primaria de energía para el cuerpo.
5.2 Propiedades farmacocinéticas
Los ingredientes de la emulsión para perfusión (aminoácidos, electrolitos, glucosa, lípidos) se distribuyen, metabolizan y eliminan de la misma manera que si se hubieran administrado por separado.
El producto se administra por vía intravenosa siendo, por tanto, 100% biodisponible mientras sus componentes son distribuidos y metabolizados por todas las células del cuerpo.
5.3 Datos preclínicos sobre seguridad
Los estudios preclínicos realizados sobre los componentes de la bolsa de tres cámaras no han mostrado riesgos adicionales a aquellos mencionados en otras secciones de la Ficha Técnica..
No se han realizado estudios en animales con NUMETA (ni con la doble ni con la triple cámara activada)
6. Datos farmacéuticos
6.1 Lista de excipientes
Excipiente Compartimento
de Aminoácidos
Ácido L-Málico (1) X
Fosfatidos de huevo purificado -
Agua para preparaciones inyectables X
(1) para el ajuste del pH
6.2 Incompatibilidades
No debe añadirse ningún otro medicamento o fármaco a ninguno de los tres componentes de la bolsa ni a la solución/emulsión reconstituida sin confirmar primero la compatibilidad y estabilidad del preparado resultante (en concreto la estabilidad de la emulsión de lípidos o la formación de precipitaciones), ver sección 6.6.
Al igual que con cualquier mezcla de alimentación parenteral, se deberán tener en cuenta las proporciones de calcio y fosfato. La adición excesiva de calcio y fosfato, especialmente en forma de sales minerales, puede ocasionar la formación de precipitaciones de fosfato de calcio.
Al igual que en otras soluciones para perfusión que contienen calcio el tratamiento concomitante con ceftriaxona y NUMETA está contraindicado en recién nacidos (< 28 días de edad), incluso si las líneas para la perfusión se usan por separado (riesgo de precipitación de la ceftriaxona con la sal de calcio en la sangre del recién nacido que puede resultar mortal, ver sección 4.5.)
Compartimento de glucosa
X
X
X
X
X
X
X
Compartimento de lípidos

11 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agenc<a española de medicamentos y sroductos samaros
ÍTTI
En pacientes mayores de 28 días (incluyendo adultos), no debe administrarse ceftriaxona por vía intravenosa al mismo tiempo que las soluciones que contienen calcio, incluyendo NUMETA, a través de la misma vía de perfusión (por ejemplo conector en Y).
Si se utiliza la misma línea de perfusión para la administración secuencial, debe limpiarse cuidadosamente con un líquido compatible entre las infusiones.
NUMETA no debe administrarse simultáneamente con sangre a través de la misma vía de perfusión, ver sección 4.5.
NUMETA contiene iones de calcio lo que supone un riesgo adicional de coagulación en sangre anticoagulada/conservada con citrato, o sus componentes.
6.3 Período de validez
18 meses
Período de validez tras la reconstitución
Se recomienda utilizar el producto inmediatamente una vez abiertos los sellos no permanentes que hay entre las dos o tres cámaras. No obstante, los datos de estabilidad de las mezclas reconstituidas respaldan 7 días a una temperatura entre 2 °C y 8 °C seguidos de 48 horas a una temperatura que no supere los 30 °C.
Período de validez tras la complementación
Tras la complementación con electrolitos, oligoelementos y vitaminas de las mezclas de las bolsas de dos y tres cámaras activadas, con y sin dilución, se ha demostrado la estabilidad de uso durante 7 días a temperaturas de 2 a 8 °C seguidos de 48 horas por debajo de 30 °C.
Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, las condiciones y los tiempos de conservación antes de su uso son responsabilidad del usuario y normalmente no superarán las 24 horas de 2 °C a 8 °C, a menos que la reconstitución /dilución / adición de complementos se haya llevado a cabo en condiciones asépticas controladas y validadas.
Ver la sección 4.2 “Posología y forma de administración” y la sección 6.6. “Precauciones especiales de eliminación y otras manipulaciones”
6.4 Precauciones especiales de conservación
No congelar.
Conservar en la sobrebolsa.
6.5 Naturaleza y contenido de los envases
La bolsa con tres cámaras no compuesta por PVC consta de los siguientes componentes:
• Una lámina de plástico multicapa.
• Un puerto en el compartimiento que contiene la emulsión de lípidos. Se sella tras el llenado para evitar las adiciones en esta cámara.
12 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agenc<a española de medicamentos y sroductos samaros
• Dos puertos en las cámaras de la solución de aminoácidos y la solución de glucosa.
• Un punto de inyección que cierra el puerto del compartimiento de glucosa.
• Un punto de administración que cierra el puerto del compartimiento de aminoácidos.
Ninguno de los componentes incorpora látex de caucho natural.
Para evitar el contacto con el aire, la bolsa está envasada en el interior de una sobrebolsa que actúa como barrera de oxígeno que contiene un sobrecito con un absorbente de oxígeno, y que puede contener también un indicador de oxígeno.
Tamaños de envase disponibles:
Bolsas de 300 ml: 10 unidades por caja 1 bolsa de 300 ml
Puede que solamente estén comercializados algunos tamaños de envases
6.6 Precauciones especiales de eliminación y otras manipulaciones
Sólo para un único uso.
Se recomienda que, tras abrir los sellos no permanentes que hay entre las cámaras, se use el producto inmediatamente y no se almacene para perfusiones posteriores.
No conecte las bolsas en serie para evitar que se produzca una embolia gaseosa a consecuencia del aire residual contenido en la bolsa principal.
Confirme la integridad de la bolsa y de los sellos no permanentes. Utilícela únicamente si la bolsa no está dañada, los sellos no permanentes están intactos (es decir, no se han mezclado los contenidos de las tres cámaras), la solución de la cámara de aminoácidos y la solución de la cámara de glucosa son transparentes, incoloras o ligeramente amarillentas, están prácticamente libres de partículas visibles y la emulsión de lípidos es un líquido homogéneo de aspecto lechoso.
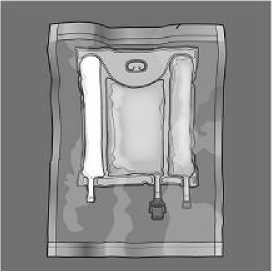
Para abrir: Quite la sobrebolsa protectora y deséchela junto con el sobrecito con el absorbente de oxígeno, si lo incorpora.
Antes de abrir la sobrebolsa, examine el color del absorbente de oxígeno, si lo incorpora. Compárelo con el color de referencia impreso junto al símbolo de OK y descrito en el área impresa de la etiqueta del indicador. No utilice el producto si el color del absorbente de oxígeno no corresponde al color de referencia impreso junto al símbolo OK.
74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencsaesparioíaóe medicamentos y oroductos samaros
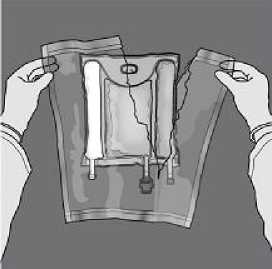
Mezcla: Asegúrese de que el producto está a temperatura ambiente antes de romper los sellos no permanentes. Coloque la bolsa en una superficie limpia y plana. No utilice la bolsa si el contenido está mezclado debido a la rotura accidental de los sellos de los compartimientos durante el transporte.
Continúe enrollando la bolsa en la dirección de los tubos y presione para abrir el segundo sello
De la vuelta a la bolsa al menos tres veces para mezclar bien el contenido. El aspecto de la solución mezclada debe ser una emulsión similar a la leche.
74012 FT-Var. 004-v1

Activación de la bolsa de 3 cámaras (rotura de los dos sellos no permanentes)
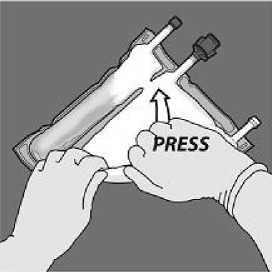

Presione para abrir el primer sello
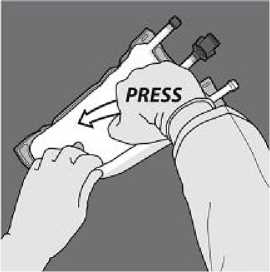
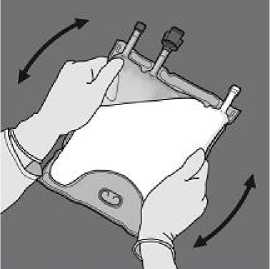
A continuación, enrolle la bolsa en el sentido contrario
Enrolle la bolsa desde la esquina del colgador en D del compartimiento con emulsión de lípidos
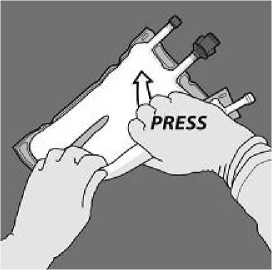
Todos los sellos se deben abrir completamente aplicando presión con una mano al enrollar la bolsa hacia los tubos
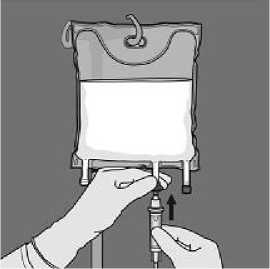
Retire el tapón protector del punto de administración e inserte el equipo de administración intravenoso.
Activación de la bolsa de 2 cámaras (rotura del sello no permanente situado entre las cámaras de aminoácidos y glucosa)
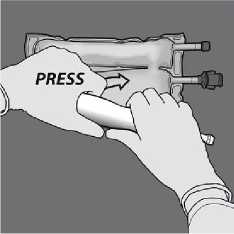
Con una mano, aplique presión enrollando la bolsa hacia los tubos.
Retire el tapón protector del punto de administración e inserte el equipo de administración intravenoso.

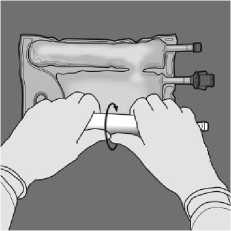

Oriente la bolsa de forma que el compartimiento con emulsión de lípidos esté lo más cerca posible del operador y enrolle la bolsa mientras protege el compartimiento con emulsión de lípidos en las palmas de las manos.
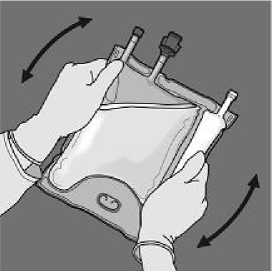
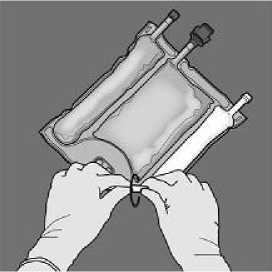
Para romper sólo el sello de aminoácidos/glucosa, comience a enrollar la bolsa desde la esquina del colgador en D del sello que separa las cámaras de aminoácidos y glucosa y presione para abrir el precinto que separa ambos compartimientos.
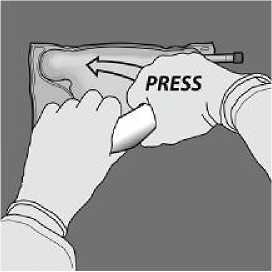
De la vuelta a la bolsa al menos tres veces para mezclar bien el contenido. El aspecto de la solución mezclada debe ser transparente, incoloro o ligeramente amarillento.
A continuación, cambie el sentido y enrolle la bolsa hacia el colgador en D, presionando con la otra mano hasta que el sello que separa las soluciones de aminoácidos y glucosa se abra completamente.
Adiciones: La bolsa tiene suficiente capacidad para que se puedan añadir electrolitos, oligoelementos, vitaminas y agua para preparaciones inyectables. Cualquier adición (incluida la de vitaminas) puede realizarse en la mezcla reconstituida (después de abrir los sellos no permanentes y mezclar el contenido de las dos o tres cámaras). También se pueden añadir vitaminas a la cámara de glucosa antes de reconstituir la mezcla (antes de abrir los sellos no permanentes y mezclar las soluciones y la emulsión).
Al realizar adiciones, se debe tener en cuenta la cantidad de electrolitos ya presentes en la bolsa para cubrir las necesidades clínicas del paciente. Puede solicitar información sobre los niveles máximos de electrolitos y las fórmulas comerciales de vitaminas y oligoelementos disponibles que se pueden añadir a las mezclas de las bolsas de dos y tres cámaras activadas de NUMETA.
Si lo desea, también puede consultarnos la compatibilidad con otros aditivos.
15 74012 FT-Var. 004-v1
Para realizar una adición:
• Se debe llevar a cabo en condiciones asépticas.
• Prepare el punto de inyección de la bolsa.
• Perfore el punto de inyección e inyecte los aditivos utilizando una aguja de inyección o un dispositivo de reconstitución.
• Mezcle el contenido de la bolsa y los aditivos.
Preparación de la perfusión:
• Se debe llevar a cabo en condiciones asépticas.
• Cuelgue la bolsa.
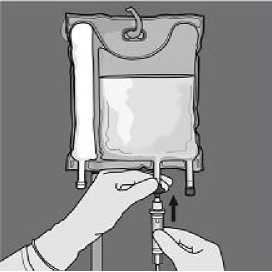
• Retire el protector de plástico de la salida de administración.
• Inserte firmemente la punta del equipo de perfusión en la salida de administración.
Administración de la perfusión:
• Sólo para un único uso.
• Administre únicamente el producto después de abrir los precintos no permanentes que hay entre las dos o tres cámaras y mezclar el contenido de las dos o tres cámaras.
• Asegúrese de que la emulsión para perfusión de la bolsa de tres cámaras final activada no muestra signos de separación de fases y que la solución para perfusión de la bolsa de dos cámaras final no muestra signos de partículas.
• Tras abrir la bolsa, debe utilizarse el contenido inmediatamente y no guardarlo nunca para su posterior perfusión.
• No conecte una bolsa a medio utilizar.
• No conecte las bolsas en serie para evitar que se produzca una embolia gaseosa a consecuencia del aire residual contenido en la bolsa principal.
• El producto que no se haya utilizado, los materiales que hayan estado en contacto con él y todos los dispositivos desechables necesarios deberán desecharse debidamente y no volver a utilizarse.
7. Titular de la autorización de comercialización
Baxter S.L.
Pouet de Camilo, 2.
46394 Ribarroja del Turia (Valencia)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
74.012
9. Fecha de la primera autorización/renovación de la autorización
Mayo 2011
16 74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia española óe medicamentos y productos samaros
10. Fecha de la revisión del texto

Agosto 2013
74012 FT-Var. 004-v1
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencsa española óe 'neceanentes y productos sitiaros
17