Novix 50 Ui/Ml Polvo Y Disolvente Para Solucion Inyectable

MINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
íit |
k agencia española de 1 medicamentos y | productos sanitarios |
PROSPECTO: INFORMACIÓN PARA EL USUARIO Novix 50 U.I./ml,
Polvo y disolvente para solución inyectable
Factor IX de coagulación humano
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
- Conserve este prospecto ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Novix y para qué se utiliza
2. Antes de usar Novix
3. Cómo usar Novix
4. Posibles efectos adversos
5. Conservación de Novix
6. Información adicional
1. QUÉ ES NOVIX Y PARA QUÉ SE UTILIZA
Novix es un medicamento que contiene el factor IX de la coagulación humana.
Novix pertenece al grupo de medicamentos denominado antihemorrágicos: factores de la coagulación sanguínea.
Novix está indicado para el tratamiento y profilaxis (prevención) de hemorragias en pacientes con hemofilia B (déficit congénito de factor IX). Estos pacientes no tienen suficiente factor IX funcional. Novix sirve para aumentar la cantidad de factor IX en sangre, permitiendo así que la sangre coagule.
2. ANTES DE USAR NOVIX
No use Novix
• Si es alérgico (hipersensible) al principio activo o a cualquiera de los demás componentes (ver información importante sobre algunos de los componentes de Novix al final de esta sección).
Si usted tiene alguna duda sobre lo anterior, consulte con su médico.
Tenga especial cuidado con Novix
• Existe la remota posibilidad de que usted pueda experimentar una reacción anafiláctica (reacción alérgica repentina grave). Si usted siente opresión torácica, sensación de mareo, vértigo o náusea, o bien se marea estando de pie, es posible que usted esté sufriendo una reacción anafiláctica a Novix. Si ello ocurre, interrumpa inmediatamente la administración del producto y pida asistencia médica.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)

• Si aparecen reacciones de hipersensibilidad (alergia p.e. fiebre, urticaria generalizada, opresión del pecho, jadeos, hipotensión y anafilaxis), durante la administración de Novix, la inyección/perfusión debe interrumpirse. Su médico decidirá sobre el tratamiento adecuado (p.e. antihistamínicos, terapia de shock).
• Es posible que su médico desee realizar alguna prueba para asegurar que la dosis que usted recibe de Novix es suficiente para alcanzar y mantener niveles adecuados de factor IX.
• Si su hemorragia no llega a controlarse con Novix, consulte a su médico inmediatamente. Es posible que usted haya desarrollado inhibidores del factor IX, por lo que su médico querrá realizar pruebas para confirmarlo. Los inhibidores del factor IX son anticuerpos presentes en la sangre que bloquean el factor IX que usted está utilizando. Ello hace que el factor IX sea menos efectivo en el control del sangrado.
• Si tiene alguna enfermedad con riesgo de trombosis (historial de enfermedades del corazón o infarto de miocardio agudo, enfermedad hepática, alteraciones tromboembólicas, trastornos en la coagulación, o en niños recién nacidos) y si a usted le administran altas dosis de factor IX en casos de cirugía mayor. Con una vigilancia adecuada se puede detectar a tiempo posibles complicaciones y adoptar las medidas oportunas. Algunas de estas complicaciones son p.e. tromboembolismo y coagulopatía de consumo.
Cuando se administran medicamentos derivados de plasma o sangre humano, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen una cuidadosa selección de los donantes, para excluir a aquellos que están en riesgo de ser portadores de enfermedades infecciosas, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar/inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente.
Esto también se refiere a virus emergentes o de naturaleza desconocida u otros tipos de infecciones.
Estas medidas se consideran efectivas para virus envueltos como el virus de la inmunodeficiencia humana (VIH), virus de hepatitis B y virus de la hepatitis C y para el virus no envuelto de la hepatitis A. Las medidas tomadas pueden tener un valor limitado frente a otros virus no envueltos como el parvovirus
B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para personas cuyo sistema inmunológico está deprimido o que padecen algún tipo de anemia (p.e. con anemia hemolítica).
Su médico puede recomendarle que considere la vacunación contra hepatitis A y B si recibe regularmente concentrados de factor IX.
Cada vez que se le administre una dosis de Novix, se recomienda dejar constancia del nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados.
Existe una posible conexión entre la aparición de inhibidores del factor IX y reacciones alérgicas. Los pacientes con inhibidores del FIX pueden tener un mayor riesgo de reacciones anafilácticas. Por consiguiente, en los pacientes que sufran una reacción alérgica debe investigarse la presencia de un inhibidor del factor IX.

Uso de otros medicamentos
• Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente cualquier otro medicamento, incluso los adquiridos sin receta médica.
• Actualmente no se conocen interacciones con otros medicamentos.
• Novix no debe mezclarse con otros medicamentos antes de la administración dado que puede afectar de forma adversa a la eficacia y seguridad del producto.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
• Informe a su médico si usted está embarazada o lactando.
• Su médico decidirá si Novix puede ser usado durante el embarazo y la lactancia.
• Dado que la hemofilia B se da raramente en la mujer, no se dispone de experiencia sobre el uso de Novix durante el embarazo y la lactancia.
Conducción y uso de máquinas
No existe ningún indicio de que Novix pueda afectar a la capacidad de conducir o utilizar máquinas. Información importante sobre algunos de los componentes de Novix
• Informe a su médico si usted sigue una dieta baja en sodio, Novix contiene 4,14 mg de sodio por ml y debe ser tomado en consideración en pacientes con dietas controladas en sodio que reciban dosis elevadas de este medicamento.
3. CÓMO USAR NOVIX
Reconstituir el producto como se describe en este apartado. El producto debe administrarse lentamente, especialmente la primera dosis (aproximadamente 3 ml/min) por vía intravenosa.
Use siempre Novix exactamente como le indicó su médico. Si tiene alguna duda, consulte a su médico o farmacéutico.
Su médico decidirá la dosis de Novix que recibirá. Esta dosis y su duración dependerán de sus necesidades individuales de tratamiento sustitutivo con factor IX y de la farmacocinética (recuperación y vida media), que debe comprobarse regularmente.
Su médico puede modificar la dosis de Novix que recibe a lo largo del tiempo.
Dosis para el tratamiento
La dosis necesaria se determina utilizando la fórmula siguiente:
Unidades requeridas = peso corporal (kg) x aumento deseado de factor IX (%) (U.I./dl) x 0,8
Dosis para profilaxis en hemorragias

En la profilaxis rutinaria para impedir hemorragias en pacientes con hemofilia B grave deben administrarse dosis de 20 a 40 U.I. de factor IX/kg de peso corporal a intervalos de 3 a 4 días. En algunos casos, especialmente en pacientes jóvenes, puede ser necesario acortar los intervalos de administración o dosis más elevadas.
Pacientes con inhibidores
Si ha desarrollado inhibidores del FIX puede necesitar una mayor cantidad de Novix para controlar la hemorragia. Si esta dosis no controla la hemorragia su médico puede considerar el uso de otro medicamento alternativo. No aumente la dosis total de Novix que utiliza para controlar su hemorragia sin consultar a su médico.
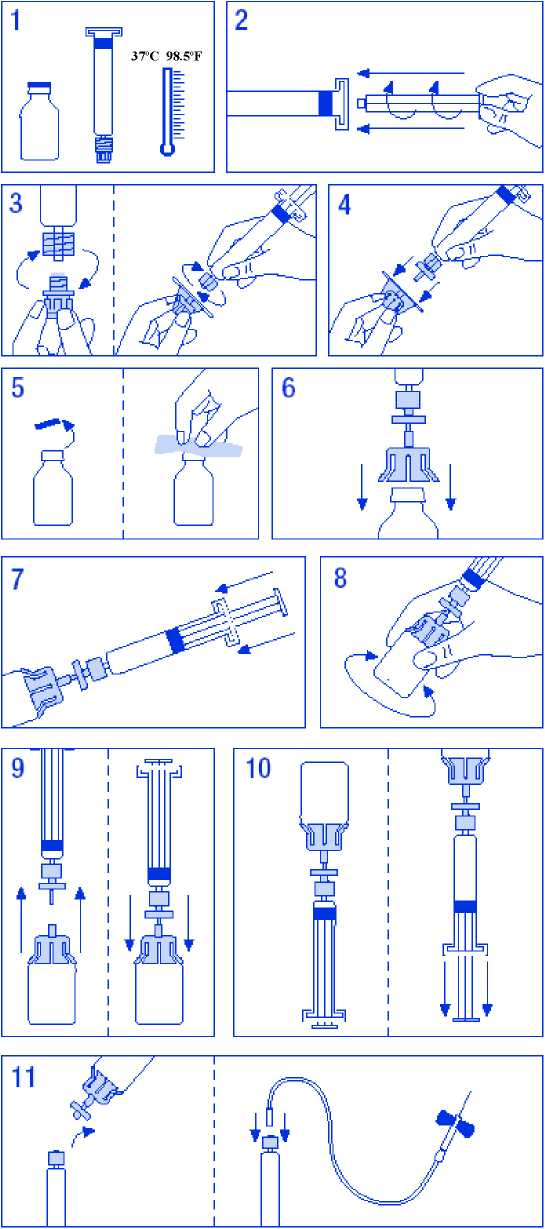
Instrucciones de uso/manipulación
Siga estas instrucciones a menos que su médico le haya dado otras indicaciones distintas.
Para la reconstitución y administración de Novix, presentación de 1500 U.I./30 ml, cuyo disolvente se presenta en viales, la preparación de la solución es la siguiente:
1. Atemperar los viales sin sobrepasar los 37 °C.
2. Desprecintar el vial de disolvente, desinfectando el tapón con una toallita con alcohol.
3. Extraer del envase la aguja de doble punta. Separar uno de los capuchones que protegen las puntas y perforar el tapón del vial de disolvente.
4. Desprecintar el vial de producto liofilizado, desinfectando el tapón con una toallita con alcohol.
5. Separar el capuchón de la otra punta de la aguja.
6. Invertir el vial de disolvente y perforar el vial de liofilizado, asegurándose de que sea trasvasado todo el disolvente y evitando la pérdida de vacío.
7. Separar el frasco de disolvente con la aguja de doble punta. Girar suavemente el vial procurando no producir espuma hasta la total disolución. No agitar.
8. Sacar el filtro del blister e insertarlo en la jeringa, recargar la jeringa con aire suficiente para el volumen total de la solución. Insertar la aguja en el filtro y perforar el vial del producto reconstituido. Inyectar el aire precargado de la jeringa, a través del filtro, para seguidamente invertir la posición del vial y aspirar el contenido en la jeringa.
9. Retirar el ensamblaje filtro-aguja y administrar lentamente por vía intravenosa utilizando la aguja mariposa suministrada a una velocidad de 3 ml/min.
Para la reconstitución y administración de Novix, presentaciones de 250 U.I./5 ml, 500 U.I./10 ml y 1000 U.I./20 ml, en que el disolvente se presenta en jeringas precargadas, la preparación de la solución es la siguiente:
1. Atemperar el vial y la jeringa de disolvente sin sobrepasar los 37 °C.
2. Acoplar el émbolo a la jeringa de disolvente.
3. Desprecintar el filtro. Separar el tapón del cono de la jeringa de disolvente y acoplarla al filtro.
4. Desprecintar el adaptador de vial y acoplarlo al conjunto filtro-jeringa.
5. Desprecintar el vial, desinfectando el tapón con una toallita con alcohol.
6. Introducir la espina del adaptador en el vial.
7. Trasvasar todo el disolvente de la jeringa al vial.
8. Girar suavemente el vial procurando no producir espuma hasta la total disolución. No agitar.
9. Separar el conjunto filtro-jeringa del resto. Aspirar aire suficiente para el volumen total de la solución. Acoplar de nuevo el conjunto filtro-jeringa al vial.
10. Invertir el vial y aspirar el contenido en la jeringa.
11. Separar la jeringa y administrar lentamente por vía intravenosa utilizando la aguja mariposa suministrada a una velocidad de 3 ml/min.

Esquema de reconstitución para el disolvente en jeringas


Si usa más Novix del que debiera
No se han comunicado casos de sobredosificación con factor IX de coagulación humano. Sin embargo, si usted ha usado Novix más de lo que debe, consulte inmediatamente a su médico o farmacéutico.
En caso de sobredosis o administración accidental, consultar al Servicio de Información Toxicológica, teléfono 91 562 04 20.
Si olvidó usar Novix
• No tome una dosis doble para compensar las dosis olvidadas.
• Continúe con la siguiente administración inmediatamente y siga a intervalos regulares tal como le indicó su médico.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Novix puede producir efectos adversos, aunque no todas las personas los sufran.
En raros casos, usted puede notar alguno de estos efectos adversos después de la administración de Novix:
• Prurito, reacciones locales en el lugar de la inyección (p.e. sensación de quemazón y enrojecimiento transitorio)
• Reacciones alérgicas (p.e. opresión torácica/sensación general de malestar, mareo, náusea y ligera bajada de tensión que puede hacer que usted se maree estando de pie)
Tampoco puede excluirse completamente la posibilidad de un shock anafiláctico. Si usted nota cualquiera de los síntomas siguientes durante la inyección/perfusión
• opresión torácica/sensación general de malestar
• mareo
• hipotensión leve (ligera disminución de la presión arterial con sensación de mareo estando de pie)
• náusea
puede ser un signo precoz de hipersensibilidad y reacción anafiláctica. Si se produce una reacción alérgica o anafiláctica, la inyección/perfusión debe interrumpirse y consultar a su médico inmediatamente.
Sin embargo, no puede excluirse totalmente la posibilidad de reacciones alérgicas a los componentes del preparado. La formación de anticuerpos neutralizantes del factor IX (inhibidores) es una complicación conocida en el tratamiento de pacientes con hemofilia B. El desarrollo de inhibidores deberá ser cuidadosamente monitorizado mediante pruebas de laboratorio y exámenes clínicos apropiados para determinar la formación de dichos inhibidores.
Existe el riesgo de complicaciones tromboembólicas con Novix particularmente si usted tiene riesgo de trombosis y/o recibe terapia a altas dosis.
• Para información sobre la seguridad viral, ver sección 2.

Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. CONSERVACIÓN DE NOVIX
Mantener fuera del alcance y de la vista de los niños.
No utilice Novix después de la fecha que aparece en el envase después de la abreviatura “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar entre 2 °C y 8 °C (en nevera).
Cuando proceda su administración ambulatoria, el producto se puede mantener a temperatura ambiente (no conservar por encima de 25 °C) durante un único período de 3 meses como máximo.
El producto no debe volver a refrigerarse después de estar conservado a temperatura ambiente.
No utilice Novix si observa que la solución presenta turbidez o sedimentos. Generalmente la solución es clara o ligeramente opalescente.
Una vez reconstituida, la solución debe desecharse si se observan partículas en su interior o algún tipo de decoloración.
La solución reconstituida debe ser utilizada inmediatamente o en el plazo de 3 horas.
Todo producto no utilizado y el material de desecho deben eliminarse de acuerdo con los requisitos locales.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesite. De esta forma ayudará a proteger el medio ambiente.
6. INFORMACIÓN ADICIONAL Composición de Novix
El principio activo es factor IX de coagulación humano.
Cada vial de Novix contiene polvo liofilizado con 250 U.I., 500 U.I., 1000 U.I. o 1500 U.I. de factor IX de coagulación humano. Una vez reconstituido, el contenido de factor IX humano es de 50 U.I./ml (250 U.I./5 ml, 500 U.I./10 ml, 1000 U.I./20 ml o 1500 U.I./30 ml).
Los demás componentes son lisina, glicina, cloruro, sodio, fosfato y citrato.
Cada envase de disolvente contiene 5 ml, 10 ml, 20 ml o 30 ml de agua para inyectables.
Ver sección 2 para información importante sobre alguno de los componentes.

Aspecto del producto
Vial conteniendo polvo blanco o amarillo pálido y vial/jeringa con agua para inyectables (disolvente).
Cada vial de Novix de las presentaciones de 250 U.I./5 ml, 500 U.I./10 ml y 1000 U.I./20 ml va acompañado de una jeringa precargada de disolvente que contiene 5 ml, 10 ml o 20 ml de agua para inyectables, junto con los accesorios necesarios para su reconstitución y administración (adaptador de vial, filtro, 2 toallitas con alcohol y aguja mariposa).
Cada vial de Novix de la presentación de 1500 U.I./30 ml va acompañado de un vial de disolvente con 30 ml de agua para inyectables, junto con los accesorios necesarios para su reconstitución y administración (aguja de doble punta, filtro, 2 toallitas con alcohol, aguja mariposa y jeringa con aguja).
Puede que sólo estén comercializados algunos tamaños de envases.
Contenido de la caja: 1 vial de liofilizado, 1 jeringa precargada/vial de disolvente y accesorios.
Titular de la autorización de comercialización y responsable de la fabricación
Instituto Grifols, S.A.
Can Guasch, 2 - Parets del Valles 08150 Barcelona - ESPAÑA
Fabricado por Instituto Grifols, S.A. bajo licencia de Bio Products Laboratory - Reino Unido Este prospecto ha sido aprobado en Agosto 2009
La información detallada en este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios.
La siguiente información está destinada únicamente a médicos o profesionales del sector sanitario.
Puede emplearse la siguiente tabla como guía de dosificación en episodios hemorrágicos y de cirugía.
|
Grado de la hemorragia/ Tipo de cirugía |
Nivel de factor IX requerido (%)(U.I./dl) |
Frecuencia de dosificación (horas)/ Duración de la terapia (días) |
|
Hemorragia | ||
|
Hemartrosis y sangrado muscular u oral menores |
20 - 40 |
Repetir cada 24 horas. Al menos 1 día, hasta que el episodio hemorrágico manifestado por dolor se detenga o hasta curación. |
|
Hemartrosis y hemorragia muscular o hematoma moderados |
30 - 60 |
Repetir la infusión cada 24 horas durante 3 - 4 días o más hasta que el dolor y la discapacidad aguda desaparezcan. |
60 - 100

Hemorragias con peligro para la vida
Repetir la infusión cada 8 - 24 horas hasta que el riesgo desaparezca.
Cirugía
Menor 30 - 60 Cada 24 horas, al menos 1 día hasta
incluyendo extracciones dentales curación.
Mayor 80 - 100 Repetir la infusión cada 8 - 24 horas
(pre- y postoperatorio) hasta la adecuada cicatrización de la
herida, y luego tratamiento durante un mínimo de 7 días para mantener un nivel de actividad de factor IX de 30% a 60% (U.I./dl).
Agencia española de
medicamentos y
productos sanitarios