Nivador 125 Mg Comprimidos Recubiertos Con Pelicula
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
agencia española de medicamentos y productos sanitarios
1. NOMBRE DEL MEDICAMENTO
NIVADOR 125 mg comprimidos recubiertos con película. NIVADOR 250 mg comprimidos recubiertos con película. NIVADOR 500 mg comprimidos recubiertos con película. NIVADOR 125 mg granulado para suspensión oral en sobres NIVADOR 250 mg granulado para suspensión oral en sobres NIVADOR 500 mg granulado para suspensión oral en sobres NIVADOR 125 mg/5 ml granulado para suspensión oral en frasco NIVADOR 250 mg/5 ml granulado para suspensión oral en frasco
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
NIVADOR comprimidos recubiertos con película
Cada comprimido contiene:
NIVADOR
125
Cefuroxima (D.O.E.) (axetilo) 125 mg
Excipientes:
parahidroxibenzoato de metilo (E218) 0,06 mg
parahidroxibenzoato de propilo (E216) 0,04 mg
NIVADOR granulado para suspensión oral en sobres
Cada sobre contiene:
NIVADOR
125
Cefuroxima (D.O.E.) (axetilo) 125 mg
Excipientes:
Sacarosa 3,062 mg
Aspartamo (E951) 21 mg
NIVADOR granulado para suspensión oral en frasco
Cada 5ml de suspensión reconstituida contienen:
NIVADOR
125
Cefuroxima (D.O.E.) (axetilo) 125 mg
Excipientes:
Sacarosa 3,062 mg
Aspartamo (E951) 21 mg
Para consultar la lista completa de excipientes, ver sección 6.1.
0,15 mg
12,248 mg 84 mg
Correo electrúnicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID


3. FORMA FARMACÉUTICA
- Comprimidos recubiertos con película.
Comprimidos de color blanco a blanquecino, biconvexos, con forma capsular.
- Granulado para suspensión oral de ingestión inmediata (sobres).
Granulado de color blanco a blanquecino.
- Granulado para suspensión oral de ingestión diferida (en frasco).
Granulado de color blanco a blanquecino.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Cefuroxima axetilo está indicada en el tratamiento oral de infecciones de intensidad leve o moderada, causadas por microorganismos sensibles (ver sección 5.1), tales como:
1. Infecciones del tracto respiratorio superior:
- Otitis media.
- Sinusitis.
- Amigdalitis y faringitis causadas por S. pyogenes (estreptococo P-hemolítico del Grupo A).
2. Infecciones del tracto respiratorio inferior:
- Bronquitis aguda y exacerbación aguda de bronquitis crónica
- Neumonía adquirida en la comunidad.
3. Infecciones no complicadas del tracto urinario.
4. Infecciones no complicadas de piel y tejidos blandos.
Se debe prestar atención a las recomendaciones oficiales sobre el uso y prescripción adecuado de agentes antibacterianos.
4.2. Posología y forma de administración
ADULTOS Y NIÑOS MAYORES DE 12 AÑOS:
- En la mayoría de las infecciones, la dosis recomendada es de 250 mg cada 12 horas.
- En infecciones del tracto respiratorio inferior:
o Bronquitis aguda y exacerbación aguda de bronquitis crónica: 250 mg cada 12 horas, que puede aumentarse a 500 mg cada 12 horas si se considera necesario. o Neumonía adquirida en la comunidad: 500 mg cada 12 horas.
- Infecciones del tracto urinario: La dosis recomendada es de 125 mg cada 12 horas; en algunos pacientes, la dosis puede elevarse a 250 mg cada 12 horas.
NIÑOS MENORES DE 12 AÑOS:
Entre 3 meses y 5 años:
- En general, 15 mg/kg/día, divididos en dos tomas.
- En niños con otitis media y en aquellos casos en los que se considere necesario, se recomienda una dosis de 15 mg/kg, dos veces al día.
Entre 5 años y 12 años:
- En general, 125 mg, cada 12 horas.
- En niños con otitis media y en aquellos casos en los que se considere necesario puede incrementarse la dosis hasta 250 mg, cada 12 horas.
La duración normal del tratamiento varía entre 5 y 10 días.
No hay experiencia en niños menores de 3 meses.
PACIENTES CON INSUFICIENCIA RENAL:
Si el aclaramiento de creatinina es inferior a 20 ml/min, se recomienda reducir la dosificación a una única dosis al día. En pacientes sometidos a diálisis periódica, se administrará una dosis suplementaria al final de cada sesión de diálisis.
FORMA DE ADMINISTRACIÓN
Los comprimidos deben ingerirse sin masticar ni machacar, con ayuda de un poco de agua o de algún otro líquido. No son adecuados para niños menores de 5 años; para estos, la forma más indicada es la suspensión oral. NIVADOR comprimidos debe tomarse después de ingerir algún alimento.
Para preparar los sobres, su contenido se debe verter en un vaso, añadiendo a continuación 1 ó 2 cucharadas de agua y mezclando bien. La suspensión se debe ingerir inmediatamente y siempre coincidiendo con la toma de alimentos.
NIVADOR granulado para suspensión oral en frasco debe reconstituirse antes de su administración (ver sección 6.6). El frasco con la suspensión debe agitarse vigorosamente antes de cada administración y la toma debe hacerse coincidiendo con la toma de alimentos.
Si se desea, la suspensión oral de NIVADOR se puede a su vez diluir en zumos de frutas fríos o leche fría y tomar inmediatamente. La suspensión reconstituida o el Granulado no deberán mezclarse con líquidos calientes.
Para una absorción óptima, cefuroxima axetilo en forma de comprimidos debe tomarse después de ingerir algún alimento y en forma de gránulos o suspensión debe tomarse siempre con los alimentos (ver sección 6.6).
4.3. Contraindicaciones
Hipersensibilidad a la cefuroxima, a otras cefalosporinas o a alguno de los excipientes.
4.4. Advertencias y precauciones especiales de empleo
Antes de la administración de NIVADOR debe investigarse la posible existencia de antecedentes de hipersensibilidad a antibióticos beta-lactámicos. Si ocurriera una reacción alérgica, se debe suprimir el tratamiento e instaurar tratamiento sintomático adecuado.
En caso de insuficiencia renal, se deben ajustar las dosis según el aclaramiento de creatinina (ver sección 4.2).
Como con otros antibióticos, el uso de cefuroxima axetilo puede dar lugar a una sobreinfección producida por Candida. El uso prolongado puede también resultar en una sobreinfección producida por otros microorganismos no sensibles (p.ej. enterococos, Clostridium difficile), que puede requerir la interrupción del tratamiento.
Se han comunicado casos de colitis pseudomembranosa con antibióticos de amplio espectro. Por tanto, es importante considerar su diagnóstico en pacientes que desarrollen diarrea grave en asociación con el uso de antibióticos.
Advertencias sobre excipientes:
Los comprimidos de NIVADOR 125 mg, 250 mg y 500 mg, pueden producir reacciones alérgicas (posiblemente retardadas) porque contienen p-Hidroxibenzoato de metilo (E218) y p-Hidroxibenzoato de propilo (E216).
Las presentaciones en sobres y frasco de este medicamento pueden ser perjudiciales para las personas con fenilcetonuria porque contienen aspartamo que es una fuente de fenilalanina.
Las personas afectadas tendrán en cuenta que:
- cada sobre de NIVADOR 125 mg granulado para suspensión oral contiene 11,8 mg de fenilalanina
- cada sobre de NIVADOR 250 mg granulado para suspensión oral contiene 23,5 mg de fenilalanina y
- cada sobre de NIVADOR 500 mg granulado para suspensión oral contiene 47 mg de fenilalanina.
- cada 5 ml de NIVADOR 125 mg/5ml granulado para suspensión oral en frasco contienen 11,8 mg de fenilalanina
- cada 5 ml de NIVADOR 250 mg/5ml granulado para suspensión oral en frasco contienen 25,2 mg de fenilalanina
Las presentaciones en sobres y frasco de este medicamento contienen sacarosa. Los pacientes con intolerancia hereditaria a la fructosa, malabsorción de glucosa o galactosa, o insuficiencia de sacarasa-isomaltasa, no deben tomar este medicamento.
NIVADOR 125 mg granulado para suspensión oral en sobres contiene unos 3g de sacarosa por sobre; NIVADOR 250 mg granulado para suspensión oral en sobres contiene unos 6g de sacarosa por sobre y NIVADOR 500 mg granulado para suspensión oral en sobres contiene unos 12 g de sacarosa por sobre, NIVADOR 125 mg/5ml granulado para suspensión oral en frasco contiene unos 3 g de sacarosa por cada 5 ml; NIVADOR 250 mg/5ml granulado para suspensión oral en frasco contiene unos 2 g de sacarosa por cada 5 ml; lo que deberá ser tenido en cuenta en pacientes con diabetes mellitus y con intolerancia a ciertos azúcares.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se recomienda la administración concomitante con antibióticos bacteriostáticos (p.ej. cloranfenicol, tetraciclinas, sulfamidas).
Se han observado alteraciones de la función renal con antibióticos de este grupo, especialmente con la administración simultánea de aminoglucósidos.
Los diuréticos potentes como la furosemida y el ácido etacrínico aumentan el riesgo de nefrotoxicidad de las cefalosporinas.
Los fármacos que reducen la acidez gástrica pueden producir una disminución de la biodisponibilidad de cefuroxima axetilo en comparación con el estado "en ayunas" y tienden a anular el efecto de potenciación de la absorción prandial en el caso de los sobres y suspensión, o post-prandial en el caso de los comprimidos. Por tanto, no se recomienda su uso simultáneo.
La administración conjunta de cefuroxima y probenecid puede aumentar los niveles plasmáticos de la cefalosporina, con posible potenciación de su acción y/o toxicología, por inhibición competitiva de su mecanismo de excreción tubular activa.
Cefuroxima axetilo puede afectar a la flora intestinal, originando una reabsorción menor de los estrógenos y una eficacia menor de los anticonceptivos orales.
Interferencias con pruebas analíticas:
Cefuroxima axetilo puede dar lugar a resultados falsos positivos en la prueba directa de Coombs y a glucosurias falsamente positivas, cuando la presencia de glucosa en orina se determina por métodos reductores (Fehling, Clinitest, etc.) pero no cuando se realiza mediante técnicas enzimáticas. También puede obtenerse un falso negativo en la prueba del ferricianuro, por lo que se recomienda que se utilice el método de la glucosa-oxidasa o el de la hexoquinasa para determinar los niveles de la glucosa plasmática o sanguínea en pacientes tratados con cefuroxima axetilo.
No interfiere en la prueba del picrato alcalino para la valoración de creatinina.
4.6. Embarazo y lactancia Embarazo
No se disponen de datos clínicos suficientes sobre la utilización de cefuroxima axetilo en mujeres embarazadas. . Los estudios en animales no muestran efectos dañinos directos o indirectos sobre el embarazo, desarrollo embrionario/fetal, parto o desarrollo postnatal (ver sección 5.3). Sin embargo, cefuroxima axetilo solo debe prescribirse a mujeres embarazadas bajo criterio médico, tras valorar cuidadosamente el posible beneficio para la madre frente al riesgo para el feto.
Lactancia
Cefuroxima se excreta en la leche materna y, en consecuencia, se debe tener precaución cuando se administre a madres en periodo de lactancia.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
NIVADOR puede producir mareos (ver sección 4.8), por lo que debe advertirse a los pacientes que antes de conducir o manejar maquinaria comprueben si su capacidad se ve afectada.
4.8. Reacciones adversas
La frecuencia de las reacciones adversas de muy frecuentes a raras se ha calculado a partir de de ensayos clínicos. Las frecuencias asignadas al resto de las reacciones adversas (como las que se producen en <1/10.000) se determinaron principalmente utilizando datos post-comercialización y se refieren a la tasa de notificación.
Las reacciones adversas que se relacionan han sido clasificadas por sistema, órgano, y frecuencia. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.: muy frecuentes (> 1/10), frecuentes (> 1/100, < 1/10), poco frecuentes (> 1/1.000, < 1/100), raras (> 1/10.000, < 1/1.000) y muy raras (< 1/10.000) incluyendo informes aislados.
Infecciones e infestaciones
Frecuentes: Crecimiento de Candida (ver sección 4.4)
Trastornos de la sangre y del sistema linfático
Frecuentes: Eosinofilia
Poco frecuentes: Prueba de Coombs positiva (ver sección 4.5), trombocitopenia, leucopenia (en
ocasiones profunda)
Muy raras: Anemia hemolítica
Las cefalosporinas tienden a quedar absorbidas en la superficie de las membranas de los eritrocitos y reaccionar con los anticuerpos dirigidos contra ellos, dando lugar a la obtención de un resultado falso positivo en la prueba de Coombs (lo que puede interferir en las pruebas sanguíneas cruzadas) y muy raramente a anemia hemolítica.
Trastornos del sistema inmunológico
Reacciones de hipersensibilidad, incluyendo:
Poco frecuentes: Erupción cutánea
Raras: Urticaria, prurito
Muy raras: Fiebre medicamentosa, enfermedad del suero, anafilaxia
Trastornos del sistema nervioso
Frecuentes: Cefalea, mareos
Trastornos gastrointestinales
Frecuentes: Molestias gastrointestinales incluyendo diarrea, náuseas, dolor abdominal
Poco frecuentes: Vómitos
Raras: Colitis pseudomembranosa.
Trastornos hepatobiliares
Frecuentes: Aumento transitorio de enzimas hepáticas (SGOT, SGPT y LDH)
Muy raras: Ictericia (predominantemente colestática), hepatitis
Trastornos de la piel y del tejido subcutáneo
Muy raras: Eritema multiforme, síndrome de Stevens-Johnson, necrolisis epidérmica tóxica
(necrolisis exantemática)
4.9. Sobredosis
La sobredosis con cefalosporinas puede producir toxicidad del sistema nervioso central que da lugar a convulsiones, principalmente en pacientes con insuficiencia renal.
En caso de intoxicación, los niveles séricos de cefuroxima pueden reducirse por hemodiálisis o diálisis peritoneal.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Cefalosporinasde segunda generación, código ATC: J01DA02 Mecanismo de acción
Cefuroxima axetilo es el 1-acetoxi-etil éster de cefuroxima, un profármaco oral de cefuroxima, antibiótico cefalosporínico bactericida. Cefuroxima axetilo debe su actividad bactericida "in vivo" al compuesto original, cefuroxima. Su acción bactericida resulta de la inhibición de la síntesis de la pared celular, por unión a proteínas esenciales específicas.
Mecanismos de resistencia:
La resistencia bacteriana a cefuroxima axetilo puede deberse a uno o más de los siguientes mecanismos:
• Hidrólisis debida a la producción de beta-lactamasas, especialmente beta-lactamasas de espectro extendido (BLEE), así como la inducción o de-represión de beta-lactamasas cromosómicas de clase A. Este mecanismo de resistencia es relevante para los bacilos gram-negativos aerobios.
• Afinidad reducida debido a un cambio en las proteínas fijadoras de penicilina (p.ej., S. aureus resistente a meticilina y S. pneumoniae resistente a penicilina).
• Alteraciones en la permeabilidad de la membrana externa, en el caso de microorganismos gram-negativos.
• Presencia de bombas de flujo.
Las cepas de S. aureus resistentes a meticilina (SAMR) son resistentes a todos los antibióticos beta-lactámicos, cefuroxima incluida. Las cepas de Streptococcus pneumoniae resistentes a penicilina presentan resistencia cruzada a cefalosporinas como cefuroxima que está mediada por una alteración de las proteínas fijadoras de penicilina. Las cepas de H. influenzae beta-lactamasa negativa con resistencia a ampicilina deben ser consideradas resistentes a cefuroxima a pesar de la aparente sensibilidad in vitro.
Así mismo, algunasl enterobacterias, especialmente Klebsiella spp. y E. coli, pueden producir beta-lactamasas de espectro extendido que causan resistencia a cefalosporinas, por lo que deben ser consideradas resistentes a a pesar de la aparente sensibilidad in vitro.
Puntos de corte
Los puntos de corte de la Concentración Mínima Inhibitoria (CMI, mg/l) establecidos por el Comité Europeo de Evaluación de Sensibilidad Antimicrobiana (EUCAST) son como siguen:
|
CMI |
(mg/l) | |
|
S |
R | |
|
Enterobacteriacea12 |
< 8 |
> 8 |
|
Staphylococcus spp. |
Nota2 | |
|
Streptococcus A, B, C, G |
< 0,5 |
> 0,5 |
|
S. pneumoniae |
< 0,5 |
> 1 |
|
H. influenzae/M. catarrhalis |
< 1 |
> 2 |
1 Los puntos de corte para enterobacterias detectarán la resistencia mediada por la mayoría BLEEs y otras beta-lactamasas clínicamente relevantes en enterobacterias. Sin embargo, algunas cepas productoras de BLEE pueden aparecer como sensibles o intermedias con estos puntos de corte. Los laboratorios deberían realizar un ensayo que específicamente detecte la presencia de BLEE.
cefuroxima axetilo es cuestionable, al menos en ciertas indicaciones, se debe buscar consejo de un experto.

Especies habitualmente sensibles
Aerobios gram-positivos
Staphylococcus aureus (sensible a meticilina)
Staphylococcus coagulasa negativo (sensibles a meticilina)
Streptococcus agalactiae
Streptococcus pneumoniae (sensible a penicilina)
Streptococcus pyogenes
Aerobios gram-negativos
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Proteus mirabilis
Anaerobios Peptococcus spp.
Peptostreptococcus spp.
Especies para las cuales la resistencia puede constituir un problema
Aerobios gram-positivos
Streptococcus pneumoniae (sensibilidad intermedia a penicilina)
Aerobios gram-negativos
Citrobacter spp.
Klebsiella spp Provindencia rettgeri
Resistentes
Aerobios gram-positivos
Enterococcus spp.
Staphylococcus aureus (resistente a meticilina)
Staphylococcus coagulasa negativo (resistentes a meticilina)
S. pneumoniae (resistente a penicilina)
Aerobios gram-negativos
Acinetobacter spp.
Enterobacter spp.
Morganella morganii Proteus vulgaris Pseudomonas spp.
Serratia spp.
Anaerobios
Bacteroides fragilis Clostridium difficile
Otros
Legionella spp.
Chlamydia pneumoniae Mycoplasma pneumoniae
5.2. Propiedades farmacocinéticas Absorción
Después de su administración oral, cefuroxima axetilo se absorbe lentamente en el tracto gastrointestinal y es hidrolizado rápidamente por esterasas no específicas de la mucosa intestinal y de la sangre, liberándose cefuroxima.
La absorción es máxima cuando cefuroxima axetilo en forma de comprimidos se administra poco después de tomar alimento. La absorción de cefuroxima axetilo en forma de suspensión aumenta en presencia de alimento.
Tras administración oral de dosis de cefuroxima axetilo de 125 mg, 250 mg, 500 mg y 1 g, los niveles séricos máximos (2-3 mg/l, 4-6 mg/l, 5-8 mg/l y 9-14 mg/l, respectivamente) aparecen aproximadamente a las 2-3 horas de la administración cuando se toma después de la comida.
La absorción de cefuroxima en suspensión es más prolongada, en comparación con los comprimidos, alcanzándose niveles séricos máximos más tardíos y bajos, siendo la biodisponibilidad sistémica menor (4-17% menos).
Distribución
La unión a proteínas plasmáticas de cefuroxima es de 33-50%.
Eliminación
La semivida de eliminación está comprendida entre 1 y 1,5 horas. Cefuroxima no se metaboliza y se excreta inalterada por filtración glomerular y secreción tubular. La administración simultánea de probenecid aumenta en un 50% el área bajo la curva de concentraciones séricas medias/tiempo. Los niveles séricos de cefuroxima se reducen por diálisis.
5.3. Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología, seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad para la reproducción.
6. DATOS FARMACÉUTICOS 6.1. Lista de excipientes
NIVADOR comprimidos recubiertos con película
Croscarmelosa sódica
Laurilsulfato de sodio
Aceite vegetal hidrogenado
Sílice coloidal anhidra
Celulosa microcristalina
Hipromelosa (E464)
Propilenglicol
Parahidroxibenzoato de metilo (E218)
Parahidroxibenzoato de propilo (E216)
Dióxido de titanio (E171)
Benzoato de sodio (E211)
NIVADOR granulado para suspensión oral.
Ácido esteárico Sabor Tutti-Frutti Povidona Sacarosa.

Aspartamo (E951) Goma xantán Acesulfamo potásico
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
NIVADOR comprimidos recubiertos con película: 3 años.
NIVADOR granulado para suspensión oral en sobres: 2 años.
NIVADOR granulado para suspensión oral en frasco: 2 años.
NIVADOR granulado para suspensión oral en frasco reconstituida: 10 dias.
6.4. Precauciones especiales de conservación
Todas las presentaciones: No conservar a temperatura superior a 30°C.
Granulado para suspensión oral en frasco reconstituida: Conservar en nevera (entre 2°C y 8°C) por un período máximo de 10 días.
6.5. Naturaleza y contenido del envase
NIVADOR comprimidos recubiertos con película: embalaje alveolar (blíster) doble de aluminio. Cada envase contiene 12 (envase normal) ó 500 comprimidos (envase clínico).
NIVADOR granulado para suspensión oral en sobres: sobres a base de un laminado comprendiendo papel, polietileno, lámina de aluminio e ionómero del ácido etilenmetacrílico, estando este último en contacto con el producto. Cada envase contiene 12 (envase normal) ó 500 sobres (envase clínico).
NIVADOR granulado para suspensión oral en frasco: frascos de vidrio tipo III, de color ámbar, provistos de un cierre a rosca a prueba de niños. El cierre contiene un revestimiento en su interior y la boca del frasco está obturada con una membrana termosellada. El envase incluye una jeringa dosificadora de 5 ml dividida en unidades de 1 ml y un adaptador a presión, que encaja en el cuello del frasco y un vasito con una línea de enrase para adicionar el agua.
6.6. Precauciones especiales de eliminación y otras manipulaciones
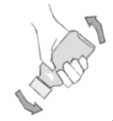
Para la reconstitución de NIVADOR granulado para suspensión en frasco se deben seguir las siguientes instrucciones:
Instrucciones para la reconstitución de NIVADOR granulado para suspensión oral en frasco:
1
2
3
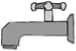
1. Agitar el frasco para desprender los gránulos. Retirar la tapa y la membrana termosellada. Si ésta última no está presente o está defectuosa el producto debe ser devuelto a la farmacia.
2. Llenar el vasito que se incluye en el estuche, con agua hasta la marca indicada. Esa cantidad de agua es suficiente para reconstituir la suspensión de 60 ml.
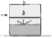
3. Añadir el agua al frasco de una vez.
4. Introducir el adaptador de la jeringa dosificadora en el cuello del frasco. Presionar hacia abajo completamente hasta que el adaptador encaje perfectamente en el cuello del frasco.
5. Volver a colocar la tapa. Invertir el frasco y agitar vigorosamente hasta obtener una suspensión homogénea.
Volver a poner el frasco en posición vertical y agitar vigorosamente.
6. Refrigerar inmediatamente en nevera a 2-8°C hasta un máximo de 10 días.


Mantener la suspensión reconstituida en nevera durante al menos una hora antes de tomar la primera dosis.
Si se desea, la suspensión oral de NIVADOR se puede a su vez diluir en zumos de frutas fríos o leche fría y tomar inmediatamente. La suspensión reconstituida o el granulado no deberán mezclarse con líquidos calientes.
Anotar en el recuadro correspondiente el día y mes en que se prepara el medicamento.
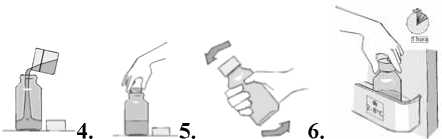
Instrucciones de uso para la jeringa dosificadora
1.

2.
3

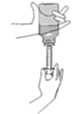
1. Quite la tapa del frasco e introduzca la jeringa dosificadora en el adaptador situado en el cuello del frasco.
2. Invierta el frasco con la jeringa. Tire del émbolo hacia abajo hasta retirar la dosis requerida. Coloque el frasco y jeringa en posición vertical. Asegúrese de que el émbolo no se mueve y retire la jeringa del adaptador.
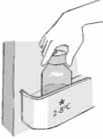
3. Con el paciente sentado en posición vertical, coloque la punta de la jeringa dentro de la boca del paciente, apuntando hacia el interior de la mejilla. Presione el émbolo de la jeringa lentamente para administrar el fármaco sin que el paciente se atragante. NO administre el fármaco a chorros.
Tras administrar la dosis vuelva a poner la tapa del frasco sin quitar el adaptador de plástico. Desmonte la jeringa y lávela con agua fría. Deje que el émbolo y el cuerpo de la jeringa se sequen al aire.
4. Vuelva a introducir el frasco inmediatamente en nevera a 2-8° C hasta la próxima dosis.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con las normativa local.
7. TITULAR DE LA AUTORIZACION DE COMERCIALIZACION
Wellcome Farmacéutica, S.A Parque Tecnológico de Madrid C/ Severo Ochoa, 2 28760 Tres Cantos (Madrid).
Teléfono: 902 202 700
Fax: 91 807 03 10
Correo electrónico: es-ci@gsk.com
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
NIVADOR 125 mg comprimidos recubiertos con película 59.195
NIVADOR 250 mg comprimidos recubiertos con película 59.194
NIVADOR 500 mg comprimidos recubiertos con película 59.193
NIVADOR 125 mg granulado para suspensión oral en sobres 59.197
NIVADOR 250 mg granulado para suspensión oral en sobres 59.198
NIVADOR 500 mg granulado para suspensión oral en sobres 60.815
NIVADOR 125 mg/5 ml granulado para suspensión oral en frasco 59.196
NIVADOR 250 mg/5 ml granulado para suspensión oral en frasco 62.815

Agencia española de
medicamentos y
productos sanitarios
Los puntos de corte S/I no relacionados con las especies de 4 mg/L divide las distribuciones de CMI naturales de las principales enterobacterias.
Para evitar esto, los puntos de corte S/I han sido incrementados a 8 mg/L. El punto de corte se corresponde con una dosis de 1.5 g x 3 y sólo para
E.coli y Klebsiella spp.
La sensibilidad de los estafilococos a la cefuroxima se deducede la sensibilidad a la meticilina.
La prevalencia de la resistencia puede variar geográficamente y con el tiempo para especies seleccionadas. Se debe obtener información local sobre el desarrollo de resistencia, sobre todo cuando se trate de infecciones graves. Cuando la prevalencia local de resistencia haga sospechar que la utilidad de