Mononine 500, 100 Ui/Ml, Polvo Y Disolvente Para Solucion Inyectable O Perfusion
"I ■"
¡m
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Mononine® 500 UI, 100 UI/ml, polvo y disolvente para solución inyectable o perfusión.
Factor IX de la coagulación humano
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
• Conserve este prospecto. Puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a Vd. personalmente y no debe darlo a otras personas. Puede perjudicarles, aún cuando sus síntomas sean los mismos que los suyos.
• Si alguno de estos efectos adversos fuera grave, o si Vd. nota algún efecto adverso no descrito en este prospecto, por favor comuníquelo a su médico o farmacéutico.
Contenido del prospecto
1. Qué es Mononine 500 y para qué se utiliza
2. Antes de usar Mononine 500
3. Cómo usar Mononine 500
4. Posibles efectos adversos
5. Conservación de Mononine 500
6. Otra información
1. Qué es MONONINE 500 y para qué se utiliza Que es Mononine 500?
Mononine 500 se presenta como polvo y disolvente. La solución obtenida se debe administrar en una vena, bien por inyección, bien por perfusión.
Mononine 500 se obtiene de plasma humano (que es la parte líquida de la sangre) y que contiene el factor IX de la coagulación humano. Se utiliza para prevenir o detener las hemorragias que están causadas por la falta congénita del factor IX (hemofilia B) en la sangre.
Para que se utiliza Mononine 500
El factor IX es muy importante para la coagulación de la sangre. La falta de factor IX significa que la sangre no coagula con la rapidez que debería hacerlo, con lo que se poduce un incremento de la tendencia al sangrado. Mononine 500 aporta factor IX con lo que se normalizan temporalmente los mecanismos de la coagulación.
La solución preparada se administra, bien por inyección, bien por perfusión en un vaso sanguíneo.
2. Antes de usar MONONINE 500
Los siguientes párrafos contienen información que Vd. y su medico deben tener en consideración antes de usar Mononine 500.
NO use Mononine 500:
• Si Vd. es alérgico al factor IX de la coagulación humano o a algún componente de Mononine 500, o a la proteína de ratón. Por favor, informe a su medico si Vd. es alérgico a algún medicamento o alimento.
• Si Vd. es una persona con un alto riesgo de formación de coágulos sanguíneos (trombosis) o si Vd. tiene una tendencia mayor de lo normal a formar coágulos sanguíneos (coagulación intravascular diseminada).
Tenga especial cuidado con Mononine 500:
• Tal como sucede con cualquier inyección de una proteína, es posible que se presenten reacciones alérgicas. Los síntomas precoces incluyen ronchas, urticaria generalizada, presión del pecho, respiración dificultosa, caída de la tensión sanguínea y anafilaxia (reacción alérgica grave que causa problemas graves en la respiración, o mareos). Si se presentan estos síntomas, Vd. debe interrumpir de inmediato la administración del medicamento y contactar con su médico.
• Mononine 500 contiene trazas de proteína de ratón, como restos de un proceso de purificación. Aunque los niveles de la proteína de ratón son extremadamente bajos, la perfusion de estas proteínas pueden provocar reacciones alérgicas.
• La formación de inhibidores (anticuerpos neutralizantes) del factor IX es una complicación conocida del tratamiento, lo que significa que el tratamiento no funciona. Si su hemorragia no se controla con Mononine 500, informe a su médico inmediatamente. Vd.debe ser controlado atentamente acerca del desarrollo de inhibidores.
• Existe un riesgo incrementado de la formación de coágulos sanguíneos en un vaso sanguíneo (complicaciones tromboembólicas), particularmente:
> Si Vd. usa productos de baja pureza (para concentrados altamente purificados, como Mononine, el riesgo se considera como muy bajo).
> Si Vd. sufre una enfermedad del hígado.
> Si Vd. ha sufrido una intervención quirúrgica recientemente.
> En niños recién nacidos.
> Si Vd. tiene factores adicionales de riesgo trombótico, como poe ejemplo embarazo, contraceptivos orales, obesidad y fumar.
• No existen datos de eficacia y seguridad para la perfusión continua en niños, en particular se desconoce el potencial para desarrollar inhibidores.
Su médico considerará cuidadosamente el beneficio del tratamiento con Mononine 500 frente al riesgo de esta complicaciones.
Seguridad vírica
Cuando los medicamentos se obtienen a partir de sangre o plasma humanos, se establecen ciertas medidas para evitar que se transmitan infecciones a los pacientes. Éstas incluyen una cuidadosa selección de las donaciones y de los donantes de sangre, para excluir el riesgo de que donaciones y donantes sean portadores de infecciones y el análisis de cada donación y de cada mezcla de plasmas para detectar signos de virus/infecciones. Los fabricantes de estos productos también incluyen etapas en el procesamiento de la sangre y del plasma que pueden inactivar o eliminar
ÍTTI
virus. A pesar de estas medidas, cuando se administran medicamentos obtenidos a partir de sangre o plasma humanos, no puede excluirse totalmente la posibilidad de transmisión de infecciones.
Esto se aplica también a virus emergentes o desconocidos o a otros tipos de infecciones.
Las medidas tomadas se consideran efectivas para virus recubiertos como el virus de la inmunodeficiencia humana (VIH, virus del sida), virus de la hepatitis B y virus de la hepatitis C (inflamación del hígado). Estas medidas pueden tener un valor limitado para virus no recubiertos como el virus de la hepatitis A y el parvovirus B19.
Las infecciones por parvovirus B19 pueden ser graves:
- para mujeres embarazadas (infecciones del niño, antes de nacer)
- individuos con el sistema inmunitario deprimido o con algún tipo de anemia (por ejemplo anemia falciforme o anemia hemolítica).
Si Vd. es tratado regular o repetidamente con derivados plasmáticos (por ejemplo el factor IX), su médico puede recomendarle que se vacune contra la hepatitis A y B.
Se recomienda encarecidamente que cada vez que se le administre Mononine 500 deje Vd. constancia en su diario de tratamiento, de la fecha de administración, del número de lote y el volumen inyectado.
Uso de otros medicamentos:
• Informe a su médico o farmacéutico si está tomando o usando, o ha tomado o usado recientemente otros medicamentos, incluso los adquiridos sin receta médica.
• El factor IX y el ácido s-aminocaproico (medicamento de naturaleza química que interrumpe la disolución de los coágulos sanguíneos) pueden usarse para el tratamiento de hemorragias bucales, o si ésta ocurre después de una herida, o después de una cirugía dental, como es la extracción dental. Sin embargo, no se posee mucha información sobre la administración del factor IX y el ácido s-aminocaproico, al mismo tiempo.
• Mononine 500 no debe mezclarse con otros medicamentos, diluyentes y disolventes, excepto aquellos que están recomendados por el fabricante (ver Sección "6. Otra información").
Embarazo y lactancia
• Si Vd. está embarazada o en periodo de lactancia, por favor consulte con su médico o farmacéutico antes de utilizar cualquier medicamento.
• Durante el embarazo y la lactancia, Mononine 500 solo debe usarse en el caso de que esté claramente indicado.
Efecto sobre la capacidad de conducir y utilizar maquinaria
Mononine 500 no afecta la capacidad de conducir vehículos o utilizar maquinaria.
3. Cómo usar MONONINE 500
Cuando use Mononine 500 siga siempre exactamente las instrucciones de su medico. Si tiene dudas consulte con su médico o farmacéutico.
.-ítp.
JPa
ÍTTI
El tratamiento de la hemofilia B debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de este tipo de trastornos.
Posología
La dosis de factor IX que Vd. necesita y la duración del tratamiento dependen de varios factores, tales como su peso corporal, la gravedad de su enfermedad, la localización e importancia de la hemorragia o la necesidad de prevenir la hemorragia durante una operación o una revisión médica.
Si le han indicado que debe usar Mononine 500 en casa, su médico se asegurará de que Vd. recibirá las instrucciones debidas de como se inyecta o se perfunde el producto y cuanto producto debe usar.
Siga las instrucciones que le ha dado su médico o las indicaciones de las enfermeras de su centro de hemofilia.
Si Vd. se ha administrado mas Mononine del que debía
No se han informado sobre síntomas de sobredosificación con el factor IX.
Reconstitución y administración
Instrucciones generales:
• El polvo debe disolverse y retirado del vial bajo condiciones asépticas.
• La solución debe ser clara o ligeramente opalescente, es decir puede brillar cuando se sobrepone contra una luz pero no debe contener partículas visibles. Después de la filtración o cuando se retira del vial, (ver, más adelante), y antes de la administración, la solución debe ser controlada mediante un control visual a fin de detectar pequeñas partículas y decoloraciones.
No usar las soluciones que presenten una turbidez visible o que contengan flóculos o partículas.
• El producto no utilizado y los materiales desechados deberán eliminarse adecuadamente según los requerimientos locales y según las instrucciones de su médico.
Reconstitución:
Atemperar los viales de Mononine 500 (vial con el polvo y el vial con el disolvente), sin abrirlos, a temperatura ambiente. Esto puede hacerse dejando los viales a temperatura ambiente durante 1 hora, o bien manteniéndolos en las manos durante unos minutos.
NO exponer los viales al calor directo. Los viales no deben calentarse por encima de la temperatura corporal (37°C).
Retirar cuidadosamente las cápsulas protectoras de los viales que contienen el polvo y el disolvente, y limpiar la parte expuesta de los tapones con una toallita empapada en alcohol. Dejar secar los viales antes de abrir el contenedor del Mix2Vial, y siga las siguientes instrucciones.
4 de 1 1 MINISTERIO DE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es paño» de medicamentos y productos san-lanos
2
4
5
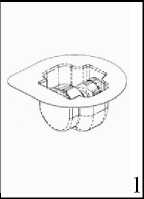
1. Abrir el envase que contiene el Mix2Vial, desgarrando el precinto
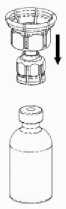
2. Retirar el Mix2Vial del contenedor, teniendo cuidado de no tocar ambos extremos del mismo. Coloque el vial del disolvente sobre una superficie plana y limpia. Sujetándolo firmemente, encaje el terminal azul del Mix2Vial en el tapón del disolvente.
3. Manteniendo el vial con el producto apoyado sobre una superficie firme, invertir el vial del disolvente con el Mix2Vial acoplado, y encajar el adaptador transparente en el tapón del vial del producto. El disolvente pasará automáticamente al vial con el polvo
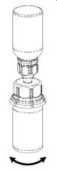
4. Con los dos viales aún acoplados, agitar suavemente mediante movimientos de rotación el vial con el polvo para garantizar la disolución total del polvo. No agitar el vial.
5. Sujetar con una mano el vial con el polvo con el Mix2Vial, sujetar con la otra mano el otro extremo que corresponde al vial del disolvente. Desenroscar el conjunto en 2 piezas. Llenar con aire una jeringa vacía y estéril.
Manteniendo el vial con el polvo en posición vertical, conectar la jeringa al Mix2Vial. Inyectar el aire en el vial con el polvo.
Trasvase de la solución y administración:
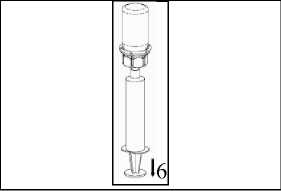
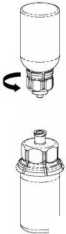
6. Manteniendo el émbolo de la jeringa presionado, invertir el sistema, aspirar la solución obtenida en la jeringa tirando despacio del émbolo.


7
7. Una vez que la solución obtenida ha sido transferida a la jeringa, sujetar firmemente el cuerpo de la jeringa (manteniendo el émbolo de la jeringa mirando hacia abajo) y desenroscar el Mix2Vial de la jeringa.
Inyección intravenosa en bolo
Usar el equipo de punción venosa que se suministra con el producto. Insertar la aguja en la vena. Dejar que entre la sangre hasta el final del tubo. Acoplar la jeringa al final roscado y con cierre del equipo de punción venosa. Inyectar lentamente la solución obtenida en la vena, siguiendo las instrucciones de su médico. Tenga cuidado de que no entre sangre en la jeringa que contiene la solución obtenida. La velocidad máxima de administración es de 2 mililitros por minuto.
Perfusión continua
Mononine 500 puede administrarse también como perfusión de larga duración (continua) durante varias horas o días. Esto debe realizarse y controlarse por su médico.
Contrólese Usted mismo acerca de cualquier efecto adverso que pudieran presentarse inmediatamente. Si Usted tiene algún efecto adverso que esté relacionado con la administración de Mononine 500, la inyección o la perfusión debe interrumpirse (ver también, Sección “Tenga especial cuidado con Mononine 500”).
Si usted tiene alguna otra pregunta sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Mononine 500 puede causar efectos adversos, aunque no todo el mundo los padecen.
Si alguno de los siguientes se presentara, consulte con su médico inmediatamente o vaya al Servicio de Emergencia o centro de hemofilia en su hospital más próximo:
• Una reacción alérgica repentina (tal como urticaria o ronchas, picor, inflamación del rostro, labios, lengua u otras partes del cuerpo).
• Dificultades en la respiración, como respiración dificultosa o entrecortada.
• Espasmos musculares.
• Pérdida de efecto (sangrado continuado).
Otros efectos adversos son:
• Reacciones alérgicas, que pueden incluir:
> Sensación de quemazón y picor, enrojecimiento e inflamación en la vena en la que se inyectó o perfundió el producto,
> inflamación de la cara o garganta u otras partes del cuerpo, escalofríos, enrojecimiento, urticaria en todo el cuerpo y ronchas,
> dolor de cabeza,
.-ítp.
ÍTTI
> caída de la presión sanguínea, desasosiego, corazón late más rápido, opresión en el pecho, respiración dificultosa,
> somnolencia (letalgia),
> sensación de sentirse enfermo,
> hormigueo.
Estos efectos adversos han sido observados raramente, pero en algunos casos pueden evolucionar a reacciones alérgicas graves (anafilaxia), incluido el shock (esto ha sido estrechamente relacionado con el desarrollote inhibidores del factor IX).
• En raras ocasiones se ha observado fiebre.
• Muy raramente se ha informado sobre una inflamación especial de los riñones (síndrome nefrótico), después del tratamiento de pacientes que tenían inhibidores del factor IX. Estos pacientes tenían un historial conocido de reacciones alérgicas.
• Tras la administración de productos que contiene el factor IX existe el riesgo de un incremento de la formación de coágulos sanguíneos que pueden provocar un ataque cardíaco (infarto de miocardio), coágulos sanguíneos en las piernas (trombosis venosa) y en los pulmones (embolismo pulmonar). El uso de Mononine 500 raramente está relacionado con estos efectos adversos.
• Usted puede desarrollar inhibidores (anticuerpos neutralizantes) contra el factor IX. En este caso el factor IX no ejerce su efecto. Si esto sucediera, se recomienda contactar con un centro especializado en hemofilia
Si ocurriera alguno de estos efectos adversos, o si Usted notara algún efecto adverso no mencionado en este prospecto, por favor comuníquelo a su médico o farmacéutico.
5. Conservación de MONONINE 500
No use Mononine 500 después de la fecha de caducidad indicada en la etiqueta y en el envase.
• Mantener fuera de la vista y del alcance de los niños.
• No congelar.
• Mantener el producto en su envase, a fin de protegerlo de la luz.
• Conservar en nevera entre + 2° y + 8° C.
• Durante el periodo de validez el producto (guardado en su embalaje original) puede ser sacado del refrigerador y almacenado a temperatura ambiente (hasta +25° C) durante un período único de 1 mes como máximo; el producto no debe refrigerarse durante este periodo. El inicio del almacenamiento a temperatura ambiente y el final de 1 mes a temperatura ambiente deben ser anotados en la caja. Al finalizar este período el producto no debe volver a guardarse en el refrigerador, por lo que debe usarse o descartarse.
• La solución obtenida debe usarse inmediatamente.
• Si la solución obtenida debe diluirse (hasta una parte en 10), la solución debe usarse en el plazo de 24 horas.
• Su médico le informará como eliminar el producto no usado y restos del material usado en la administración.
6. Otra información
Qué contiene Mononine 500
Mononine 500 contiene por vial 500 UI de factor IX de la coagulación, humano.
El producto disuelto con 5 mL de Agua para preparaciones inyectables, contiene 100 UI de de
.<5^.
"i
an
factor IX de la coagulación humano/mL, aproximadamente.
Otros componentes son:
Histidina, manitol, cloruro sódico, ácido clorhídrico o hidróxido sódico (en pequeñas cantidades para ajustar el pH). Disolvente: Agua para preparaciones inyectables.
Como se presenta Mononine 500 y contenido del envase
Mononine 500 se presenta como un polvo blanco, con la correspondiente Agua para preparaciones inyectables (disolvente).
La solución obtenida debe ser clara o ligeramente opalescente, es decir, es decir puede brillar cuando se sobrepone contra una luz pero no debe contener partículas visibles.
Presentación
Caja con 500 UI conteniendo:
- 1 vial con polvo
- 1 vial estéril con 5 mL de Agua para preparaciones inyectables
Un envase conteniendo:
- 1 trasvasador con filtro 20/13
- 1 jeringa de un solo uso (10 mL)
- 1 equipo de punción venosa
- 2 gasas con alcohol
- 1 apósito no estéril
Titular de la Autorización de comercialización y Fabricante
CSL Behring GmbH Emil-von-Behring-StraBe 76 35041 Marburg Alemania
Este medicamento está autorizado en los siguientes miembros de la Unión Europea bajo la marca, Mononine 500: Austria, Bélgica, República Checa, Francia, Alemania, Gran Bretaña, Grecia, Hungría, Italia, Luxemburgo, Holanda, Portugal, Polonia, Eslovaquia, Eslovenia, España, Suecia.
Este prospecto fue aprobado Mayo 2008
La siguiente información está destinada solamente para los médicos o profesionales de la Sanidad
Posología
El número de unidades de factor IX administradas se expresa en Unidades Internacionales (UI), en relación con el estándar de la Organización Mundial de la Salud (OMS) vigente para concentrados de factor IX. La actividad plasmática de factor IX se expresa como un porcentaje (en relación con
ÍTTI
el plasma humano normal) o en Unidades Internacionales (en relación con un estándar internacional para el factor IX en plasma).
La actividad de una Unidad Internacional (UI) de factor IX es equivalente a la cantidad de factor IX contenido en un mL de plasma humano normal. El cálculo de la dosis necesaria de factor IX se basa en la observación empírica de que 1 UI de factor IX por kg. de peso corporal., incrementa la actividad plasmática de factor IX aproximadamente en un 1% sobre la actividad normal. La dosis requerida se determina mediante la fórmula siguiente:
Unidades requeridas = peso corporal (kg) x aumento deseado de factor IX [% o UI/dL] x 1.0* *Recíproco de la recuperación observada
La posología, el método así como la frecuencia de administración se establecerán siempre en función de la eficacia clínica observada en cada caso. Los preparados de factor IX raramente requieren que se administren más de una vez al día cuando se administran en inyección en bolo.
En los siguientes episodios hemorrágicos, la actividad de factor IX no deberá ser inferior al nivel plasmático de actividad que se indica (en % del valor normal o UI/dL), durante el período correspondiente. La siguiente tabla puede emplearse como guía de dosificación en episodios hemorrágicos y cirugía:
|
TABLA 1: INYECCIÓN INTRAVENOSA EN BOLO | ||
|
Tipo de hemorragia / Tipo de cirugía |
Nivel de factor IX requerido (% o UI/dL) |
Frecuencia de dosificación (horas)/Duración de la terapia (días) |
|
HEMORRAGIAS | ||
|
Hemartrosis precoz y sangrado muscular u oral |
20-40 |
Repetir cada 24 horas. Al menos 1 día, hasta que el episodio hemorrágico manifestado por dolor se detenga o hasta cicatrización de la herida |
|
Hemartrosis más extensa y hemorragia muscular o hematoma |
30-60 |
Repetir la perfusión cada 24 horas durante 3-4 días o más hasta que el dolor y la discapacidad aguda se hayan resuelto |
|
Hemorragias con riesgo vital |
60-100 |
Repetir la perfusión cada 8-24 horas hasta que el riesgo desaparezca |
|
Cirugía | ||
|
Menor Incluyendo extracciones dentales |
30-60 |
Cada 24 horas, al menos 1 día, hasta la cicatrización |
|
Mayor |
80-100 (pre y postoperatorio) |
Repetir la perfusión cada 8-24 horas, hasta la adecuada cicatrización de la herida, y luego tratamiento durante un mínimo de 7 días más para mantener un nivel de actividad de factor IX de 30 a 60% (UI/dL) |
9 de 1 1 MINISTWODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españoiade medie amentos y proouctos sabíanos
.Uí1.
"I ■"
|
TABLA 2: PERFUSIÓN CONTINUA EN CIRUGÍA | |
|
Niveles de factor IX necesarios para alcanzar la hemostasia |
40-100% (o UI/dL) |
|
Dosis de carga inicial para conseguir el nivel deseado |
Dosis única en bolo de 90 UI por kg p.c. (Rango 75-100 UI kg de peso corporal), o guía de dosificación según farmacocinética |
|
Frecuencia de dosificación |
Perfusión intravenosa continua, dependiendo del aclaramiento y de los niveles de factor IX medidos |
|
Duración del tratamiento |
Durante 5 días. La continuación del tratamiento puede ser necesaria, dependiendo del tipo de cirugía |
Durante el tratamiento, se aconseja realizar un seguimiento apropiado de los niveles plasmáticos de factor IX a fin de determinar la dosis y la frecuencia de las perfusiones. En el caso concreto de la cirugía mayor, es imprescindible un control exacto de la terapia de sustitución mediante pruebas de la coagulación (actividad plasmática de factor IX). La respuesta individual de los pacientes al tratamiento con factor IX puede variar, tanto en los niveles de recuperación in vivo, como en la vida media.
En la profilaxis a largo plazo de las hemorragias en pacientes con hemofilia B grave, las dosis usuales son 20 a 40 UI de factor IX por kg de peso corporal cada 3 ó 4 días. En algunos casos, especialmente en los pacientes más jóvenes, pueden ser necesarias dosis mayores a las calculadas o acortar los intervalos entre administraciones.
En los pacientes deberá controlarse, el desarrollo de inhibidores del factor IX. Si no se alcanzan los niveles de actividad plasmática de factor IX esperados, o si el sangrado no se controla con la dosis adecuada, deberá realizarse una prueba para determinar la presencia de inhibidores del factor IX. En pacientes con títulos altos de inhibidores, la terapia con factor IX puede ser no efectiva, por lo que deberán considerarse otras opciones terapéuticas.
El manejo de estos pacientes deberá ser dirigida por médicos con experiencia en el tratamiento de la hemofilia.
ADMINISTRACIÓN
Mononine 500 se pude administrar por inyección intravenosa en bolo (ver Instrucciones en Sección 3), o por perfusión continua (ver Instrucciones más adelante).
Perfusión continua
Mononine 500 debe reconstituirse con Agua para inyección, tal como se describe en la Sección “Reconstitución y administración”. Después de la reconstitución, Mononine 500 puede administrarse sin diluir o diluido como perfusión continua, mediante una bomba de perfusión autorizada.
Una solución diluida se obtiene de la siguiente forma:
-Usando una técnica aséptica, diluir la solución reconstituida, filtrar y transferir la cantidad apropiada de Mononine al volumen deseado de solución salina fisiológica.
-En diluciones de una titulación de hasta 1:10 (concentración de 10 UI de factor IX/mL), la
a lili» a
sin
actividad de factor IX permanece estable durante 24 horas.
-En titulaciones superiores puede producirse una disminución de la actividad de factor IX, ésta debe controlarse para mantener los niveles hemáticos deseados.
Ejemplo para diluir 500 UI de Mononine reconstituido:
|
Potencia deseada de la dilución |
10 UI/mL |
20 UI/mL |
|
Volumen de MONONINE® reconstituido |
5,0 mL |
5,0 mL |
|
Volumen necesario de solución salina fisiológica |
45,0 mL |
20,0 mL |
|
Dilución conseguida |
1:10 |
1:5 |
-Se recomienda el uso de bolsas IV y tubos de cloruro de polivinilo (PVC).
-Mezclar mediante agitación vigorosa y comprobar que la bolsa no tiene fugas.
-Se recomienda reemplazar las bolsas con Mononine recién diluido cada 12-24 horas.
Cuando se administra Mononine 500 como perfusión continua, la velocidad de administración recomendada es de 4 UI/kg p.c./h para, mantener un estado de equilibrio de los niveles de factor IX de aproximadamente un 80%. Esto depende del perfil farmacocinético del paciente y del nivel de factor IX que se desee alcanzar. En pacientes, en los que se conoce el aclaramiento de factor IX, la velocidad de administración se puede calcular individualmente.
Velocidad de administración (UI/kg p.c./h) = aclaramiento (mL/h/kg p.c.) x incremento deseado de factor IX (UI/mL).
La seguridad y eficacia de la perfusión continua en niños no han sido estudiadas. Por lo tanto, en niños y adolescentes, la perfusión continua con MONONINE 500 sólo debe considerarse, si los datos farmacocinéticos prequirúrgicos (p. ej.: incremento de la recuperación y aclaramiento) se obtuvieron a partir de la dosis calculada, y los niveles perioperativos serán cuidadosamente controlados.