Misodel 200 Microgramos Sistema De Liberacion Vaginal
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Misodel 200 microgramos sistema de liberación vaginal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Misodel contiene 200 microgramos de misoprostol.
La tasa media de liberación de misoprostol in vivo es de aproximadamente 7 microgramos cada hora, durante un periodo de 24 horas. La liberación del fármaco continúa siempre que Misodel esté en la vagina.
Excipiente con efecto conocido: 0,13 mg de butilhidroxianisol por sistema de liberación vaginal (ver sección 4.4).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Sistema de liberación vaginal.
El polímero de inserción se encuentra dentro de un sistema de recuperación que consiste en una bolsa de poliéster de tejido inerte y una cinta. El polímero de inserción es de forma rectangular con esquinas redondeadas, de color beige, semitransparente, no biodegradable y medidas aproximadas de 30 mm de longitud, 10 mm de ancho y 0.8 mm en grosor. Misodel se hincha en presencia de humedad.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Misodel está indicado para la inducción del parto en mujeres con cérvix desfavorable, desde la semana 36 de gestación, en las que la inducción está clínicamente indicada.
4.2 Posología y forma de administración
Posología
Misodel 200 microgramos es una formulación de liberación controlada que libera misoprostol a una tasa de aproximadamente 7 microgramos cada hora durante un periodo de 24 horas.
La dosis máxima recomendada es un Misodel sistema de liberación vaginal (200 microgramos).
Extracción de Misodel
• al inicio de la fase activa del parto (dilatación cervical progresiva a 4 cm con cualquier frecuencia de contracciones o ritmo, firmes, contracciones uterinas de calidad adecuada que causan un cambio cervical progresivo que ocurren con una frecuencia de 3 o más en 10 minutos y duran 45 segundos o más)
• si las contracciones uterinas son prolongadas o excesivas
• si hay evidencia de sufrimiento del feto
• si han transcurrido 24 horas desde la inserción.
Si Misodel se cae, no remplazarlo.
En el caso de una posterior administración de oxitocina, se recomienda esperar un periodo de al menos 30 minutos tras la extracción del sistema de liberación vaginal (ver sección 4.5).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Misodel en mujeres embarazadas menores 18 años. No se dispone de datos.
Forma de administración
Misodel solo debe administrarse por personal con conocimientos en obstetricia en un hospital donde estén disponibles medios que permitan la monitorización continua fetal y uterina. La condición del cuello uterino será evaluada cuidadosamente antes de utilizar Misodel. Después de la inserción, se monitorizará regularmente la actividad uterina y condición fetal.
Misodel se proporciona en un sobre de aluminio individual, y debe conservarse en el congelador. No se requiere descongelarlo antes de su uso.
En uno de los lados del sobre de aluminio, hay una “marca de apertura”. Abra el envase a lo largo de la marca de apertura en la parte superior del sobre. No utilice tijeras u otros objetos punzantes que puedan cortar el sistema de recuperación.
Coloque Misodel en la parte alta del fornix posterior de la vagina (Figura a). Para asegurarse que Misodel continua in situ, se debe girar 90o de modo que se encuentre transversalmente en el fornix posterior de la vagina (Figura b). Se pueden utilizar lubricantes solubles en agua para ayudar a la inserción cuando sea necesario.
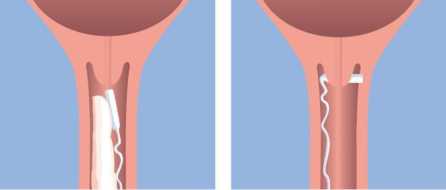
Figura a. Figura b. Figura c.
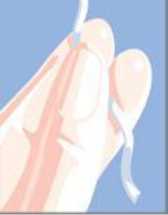
su extracción puede vagina para permitir
pero después puede
Después de que el sistema de liberación vaginal se haya insertado, la cinta para cortarse con tijeras, siempre asegurándose de que hay suficiente cinta fuera de la extraerlo.
La paciente deberá permanecer en la cama durante 30 minutos tras la inserción, deambular. Tenga cuidado de no retirar accidentalmente Misodel durante el uso del baño y en los exámenes vaginales.
Extracción
Misodel se extrae tirando suavemente de la cinta del sistema de recuperación (Figura c).
El sistema de liberación vaginal NUNCA puede extraerse del sistema de recuperación.
Misodel es una formulación de liberación controlada que se hincha en presencia de humedad, provocando la liberación del principio activo. Durante la inserción, Misodel se expandirá a 2-3 veces su tamaño original y será flexible. Después de su extracción, comprobar que se ha retirado todo el producto fuera de la vagina (sistema de inserción y de recuperación).
4.3 Contraindicaciones
Misodel está contraindicado:
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1
• Cuando el parto ha comenzado
¡m
• Cuando hay sospecha o evidencia de sufrimiento del feto antes de la inducción (por ejemplo, prueba sin estrés o con estrés fallida, tinción de líquido amniótico con meconio o diagnóstico o historia de estado fetal no tranquilizador)
• Cuando se están administrando fármacos oxitócicos y/u otros fármacos que induzcan el parto (ver sección 4.4)
• Cuando hay sospecha o evidencia de cicatriz uterina resultante de una cirugía uterina o cervical previa, por ejemplo parto por cesárea
• Cuando hay anormalidad uterina (por ejemplo útero bicorne)
• Cuando hay placenta previa o sangrado vaginal de causa desconocida tras 24 semanas de gestación en el presente embarazo
• Cuando hay mala posición fetal
• Cuando hay signos y síntomas de corioamnionitis, a menos que se haya instaurado un tratamiento previo adecuado
• Antes de la semana 36 de gestación.
4.4 Advertencias y precauciones especiales de empleo
Misodel puede producir una estimulación uterina excesiva si se deja insertado tras el comienzo de la fase activa del parto (ver sección 4.9).
Si las contracciones son prolongadas o excesivas o si apareciera cualquier signo de complicación en la madre o el bebé, se extraerá el sistema de liberación vaginal. Si las contracciones uterinas excesivas continúan tras la extracción del medicamento, deberá considerarse el tratamiento con tocolíticos.
En mujeres con preeclampsia, debe descartarse evidencia o sospecha de sufrimiento fetal (ver sección 4.3). No se han estudiado mujeres embarazadas con preeclampsia grave caracterizada por anemia hemolítica, enzimas hepáticas elevadas, recuento bajo de plaquetas (síndrome HELLP), dolencia de otro órgano diana o hallazgos del sistema nervioso central (SNC) diferentes a dolor de cabeza ligero en el ensayo pivotal Fase III (Miso-Obs-303; The EXPEDITE Study).
Misodel no se ha estudidado en mujeres con rotura de membrarnas más allá de 48 horas previas a la inserción de Misodel.
Para mujeres con Streptococcus Grupo B positivo que requieren profilaxis antibiótica, debe tenerse en cuenta el tiempo de tratamiento con los antibióticos con el fin de lograr una protección adecuada. En el estudio pivotal Fase III (Miso-Obs-303; The EXPEDITE Study), el tiempo más corto registrado para cualquier parto fue de 2,95 horas.
Extraer Misodel antes de que se inicie la administración de oxitocina. Esperar al menos 30 minutos tras la extracción de Misodel antes de administrar la oxitocina (ver secciones 4.2, 4.3 y 4.5).
Misodel solo se ha estudiado en embarazos únicos con presentación cefálica. No se han realizado estudios en gestaciones múltiples. No se ha estudiado Misodel en mujeres con más de 3 partos vaginales previos tras 24 semanas de gestación.
Solo se debe usar Misodel cuando la inducción al parto esté clínicamente indicada.
Debe usarse Misodel con precaución en pacientes con puntuación de bishop modificada (mBS) >4.
No se recomienda una segunda dosis de Misodel ya que no se han estudiado los efectos de una segunda dosis.
Se ha descrito un mayor riesgo de coagulación intravascular diseminada posparto en las pacientes en las que se les ha inducido el parto mediante un método fisiológico o farmacológico.
El butilhidroxianisol se usa como un antioxidante en el polímero de hidrogel reticulado. Solo está presente en cantidades de trazas en el producto final.
¡m
Este medicamento puede producir reacciones locales en la piel (como dermatitis de contacto) o irritación de los ojos y membranas mucosas porque contiene butilhidroxianisol.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción con Misodel.
El uso simultáneo de medicamentos oxitócicos u otros agentes que induzcan el parto está contraindicado debido al riesgo potencial de efectos uterotónicos incrementados (ver secciones 4.2, 4.3 y 4.4).
En los ensayos clínicos, se administraron otros productos que contienen prostaglandinas a las pacientes que lo necesitaron tras la extracción de Misodel sin ningún efecto aparentemente perjudicial. Tras la extracción de Misodel se esperó un periodo de una hora antes de la administración de estos productos.
4.6 Fertilidad, embarazo y lactancia
Fertilidad
A partir de los estudios de fertilidad y desarrollo embrionario temprano en ratas, hay evidencia de un posible efecto adverso de misoprostol en la implantación, sin embargo éste no es relevante para el uso clínico indicado de Misodel (ver sección 5.3).
Embarazo
Misodel se ha estudiado en mujeres embarazadas = 36 semanas de gestación.
Misodel no debe usarse antes de la semana 36 de gestación (ver sección 4.3).
Lactancia
No se han realizado estudios para investigar la cantidad de ácido de misoprostol en el calostro o leche materna tras el uso de Misodel.
Se ha detectado ácido de misoprostol en la leche humana tras la administración oral de misoprostol en forma de comprimido.
Después de la extracción de Misodel, la semivida media en el plasma del ácido de misoprostol es de aproximadamente 40 minutos. Tras cinco semividas, i.e., aproximadamente 3 horas, los niveles de ácido de misoprostol en el plasma materno son despreciables. El ácido de misoprostol puede excretarse en el calostro y leche materna, pero el nivel y duración se espera que sea muy limitado y no debe dificultar la lactancia. Con Misodel, no se han observado en el programa de desarrollo clínico efectos en los recién nacidos alimentados con leche maternal.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No relevante.
4.8 Reacciones adversas
Experiencia Estudios Clínicos
Resumen del perfil de seguridad
El perfil de reacciones adversas en la Tabla 1 está basado en cinco estudios clínicos llevados a cabo con Misodel en 874 mujeres embarazadas a término. La reacción adversa más frecuente son las contracciones uterinas anormales, trastorno en la frecuencia cardiaca fetal y parto anormal que afecta al feto.
Tabla 1
Reacciones Adversas observadas en Estudios Clínicos
|
Sistema de Clasificación de órganos MedDRA |
Muy frecuentes (>1/10) |
F recuentes (>1/100 a < 1/10) |
Poco frecuentes (>1/1.000 a < 1/100) |
|
Trastornos del sistema nervioso |
Encefalopatía isquémica hipóxica* | ||
|
Trastornos cardiacos |
Trastorno en la frecuencia cardiaca fetal ^ | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Depresión respiratoria neonatal * Síndrome de dificultad respiratoria neonatal Taquipnea transitoria del recién nacido | ||
|
Trastornos gastrointestinales |
Nausea Vómitos | ||
|
Trastornos de la piel y del tejido subcutáneo |
Erupción | ||
|
Embarazo, puerperio y enfermedades perinatales |
Parto anormal que afecta al feto n Meconio en el líquido amniótico Contracciones uterinas anormalesm |
Hemorragia antes del parto Acidosis fetal * Hemorragia postparto Separación prematura de la placenta Hipertonía uterina | |
|
Trastornos del aparato reproductor y de la mama |
Prurito genital | ||
|
Exploraciones complementarias |
Baja puntuación Apgar * Incremento de la presión sanguínea | ||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Ruptura uterina | ||
|
La tabla incluye reacciones adversas de los Estudios Miso-Obs-002, |
Miso-Obs-003, Miso-Obs-204, Miso- | ||
Obs-205 and Miso-Obs-303 (El Estudio EXPEDITE)
Reacciones adversas neonatales.
^ Trastorno en la frecuencia cardiaca fetal se comunicó como anormalidades en la frecuencia cardiaca fetal, bradicardia fetal, taquicardia fetal, ausencia inexplicable de variabilidad normal, descenso en la frecuencia
¡m
cardiaca fetal, deceleración en la frecuencia cardiaca fetal, deceleraciones tempranas o tardías, deceleraciones variables, deceleraciones prolongadas.
^ Parto anormal que afecta al feto se comunicó como taquisistolia uterina o hipertonía uterina con trastorno en la frecuencia cardiaca fetal.
m Contracciones uterinas anormales se comunicó como taquisistolia uterina.
En el estudio pivotal de Misodel (Miso-Obs-303: The EXPEDITE Study), los neonatos fueron seguidos durante el primer mes tras el parto por la admisión del hospital o visitas a salas de emergencia. No se comunicaron reacciones adversas tras el alta hospitalaria.
Notificación de sospechas de reaciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es
4.9 Sobredosis
No hay experiencia con el uso de más de una aplicación de Misodel. La formulación de liberación controlada y la posibilidad de extraer Misodel y por lo tanto de detener la liberación de misoprostol, limita el riesgo de sobredosis. Si se deja accidentalmente Misodel en su lugar tras el comienzo de la fase activa del parto puede dar lugar a síntomas de sobredosis de prostaglandinas (estimulación uterina excesiva). Si esto ocurriera, extraiga Misodel y actúe conforme con el protocolo local.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico : Otros productos ginecológicos, oxitócicos, prostaglandinas, código ATC: G02AD06.
Mecanismo de acción
Misoprostol es un análogo sintético de la Prostaglandina E1 (PGE1), un compuesto oxitócico de origen natural. Las prostaglandinas de las series F y E han demostrado incrementar la actividad colagenasa en fibroblastos del cérvix uterino de conejos in vitro y provocar la maduración cervical y contracción uterina in vivo. Estos efectos farmacodinámicos se consideran el mecanismo de acción relevante para el efecto clínico de Misodel.
Los análogos de las PGE además tienen otros muchos efectos, por ejemplo, relajación de los músculos bronquiales y traqueales, incremento de la secreción mucosa y descenso de la secreción ácida y pepsina en el estómago, incremento del flujo sanguíneo renal, incremento de las concentraciones circulantes de hormona adrenocorticotrópica y prolactina. Estos efectos farmacodinámicos no se consideran de relevancia clínica en un tratamiento corto.
Eficacia clínica y seguridad
El estudio pivotal fase III, (Miso-Obs-303: The EXPEDITE study), fue un ensayo doble-ciego, aleatorizado y multicéntrico llevado a cabo en EEUU con 1,358 mujeres embarazadas. El estudio comparó la eficacia y seguridad de Misodel con 10 mg de dinoprostona sistema de liberación vaginal (PROPESS®). Se asignaron aleatoriamente las mujeres nulíparas y paras con un cérvix desfavorable (puntuación Bishop modificada = 4) para recibir Misodel o PROPESS® durante un máximo de 24 horas de tratamiento. El objetivo principal de eficacia del estudio era el tiempo para un parto vaginal y el objetivo de principal de seguridad era la incidencia de partos por cesárea.
La Tabla 2 presenta los datos de los objetivos principales y secundarios de este estudio.
Tabla 2 Miso-Obs-303: Resultados Objetivos Principales del estudio EXPEDITE
.‘ítp.
SBS
|
Misodel 200 mcg (N=678) |
PROPESS® 10mg (N=680) |
Valor p | |
|
Mediana de tiempo hasta Parto Vaginal del Neonato (horas) Nulíparas Paras |
21.5h** 29.2 h (n=441) 13.4 h (n=237) |
32.8h** 43.1 h (n=451) 20.1 h (n=229) |
p < 0.001 p < 0.001 p < 0.001 |
|
Incidencia de Parto por Cesárea (n %) Nulíparas Paras |
176 (26.0%) 152 (34.5%) 24 (10.1%) |
184 (27.1%) 168 (37.3%) 16 (7.0%) |
p = 0.646 p = 0.386 p = 0.226 |
|
Mediana del tiempo hasta cualquier tipo de Parto del Neonato (Vaginal y Cesárea) (h) |
18.3hf |
27.3hf |
p < 0.001 |
|
Mediana del tiempo Total hasta el Inicio de la Fase Activa del Parto (horas) |
12.1hff |
18.6hff |
p < 0.001 |
|
Número total de Pacientes que recibieron Oxitocina Pre-parto [n (%)] |
324 (48.1%) (N=674) |
497 (74.1%) (N=671) |
p < 0.001 |
* Pacientes con parto por cesárea, pacientes que fueron dadas de alta sin dar a luz o aquellas que retiraron el consentimiento durante la primera hospitalización se censuraron usando el intervalo de tiempo más largo desde la administración del producto del estudio hasta el parto por cesárea o hasta que dieron a luz o recibieron el alta por parto (estimador de Kaplan Meier).
** Resumen del tiempo medio para parto vaginal (solo pacientes con parto vaginal): Misodel, 200 mcg: 16.6 h; PROPESS® 10 mg: 25.1 h
f Resumen del tiempo medio para cualquier parto: Misodel, 200 mcg: 18.2 h; PROPESS® 10 mg: 27.2 h ff Resumen del tiempo medio para comienzo del parto activo: Misodel, 200 mcg: 12.0 h; PROPESS® 10 mg: 18.0 h
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Misodel en los diferentes grupos de la población pediátrica en la inducción al parto, en la indicación autorizada ( ver sección 4.2, para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Misoprostol, un éster, se metaboliza rápidamente a su metabolito activo el ácido de misoprostol. Solo el ácido de misoprostol se detecta en plasma. El ácido se metaboliza posteriormente a metabolitos ácidos inactivos dinor y tetranor antes de excretarse en la orina.
En mujeres no gestantes, Misodel sistema de liberación vaginal presenta una tasa media de liberación controlada in vivo de aproximadamente 7 microgramos/ hora durante un periodo de 24 horas. En un estudio de 24 gestantes a término, se observó una Cmax mediana de 45.8 pg/mL con una Tmax mediana de 4 horas. La semivida de eliminación (tras la extracción del dispositivo) fue aproximadamente 40 minutos.
La unión a proteína sérica del ácido de misoprostol es menos del 90% e independiente de la concentración a dosis terapéutica.
5.3 Datos preclínicos sobre seguridad
El componente activo en Misodel, misoprostol, no muestra riesgos especiales para humanos basados en estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad y carcinogenicidad.
¡m
No se observaron efectos teratogénicos de misoprostol en ratas a dosis de hasta 10 mg/kg/día. En conejos, se observó un incremento de fetos con costillas extra a dosis de 1 mg/kg/día, probablemente asociado con toxicidad materna a este nivel de dosis. Próximo a niveles de dosis letales, se observaron varios defectos fetales en ratones. Hay evidencia de un posible efecto adverso de misoprostol en la implantación y se determinó que el Nivel de Efecto Adverso No Observado es de 0,4 mg/kg/día en fertilidad y en estudios de desarrollo embrionario temprano en ratas . Los resultados previos observados en ratones y ratas no representan un problema de seguridad para Misodel ya que su uso está contraindicado antes de 36 semanas de gestación.
Estudios de toxicidad peri/post natal en ratas identificaron una “dosis sin efecto” para los efectos de misoprostol oral sobre parámetros reproductivos a 1 mg/kg/día. Comparando estudios cinéticos de exposición en rata y humanos, se estable un factor de seguridad de 20 para Misodel liberado como una dosis de 200 mcg en la forma de una versión miniatura del sistema de liberación vaginal de misoprostol.
No hubo evidencia de irritación local en la vagina o cérvix tras la administración de Misodel a ratas preñadas.
No hay ningún peligro para humanos en cuanto a la toxicidad sistémica para los polímeros de hidrogel, sistema de recuperación de poliéster y excipientes, basados en las pruebas convencionales in vitro e in vivo y los datos de toxicidad publicados. Finalmente, los polímeros de hidrogel y el sistema de recuperación de poliéster están fabricados de compuestos inertes con buena tolerabilidad local
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polímero de hidrogel reticulado (compuesto de: macrogol, 1,2,6- hexanotriol y diisocianato de 4-4’ diciclohexilmetano).
Butilhidroxianisol (E320).
Sistema de recuperación de poliéster ( hilos de poliéster tejidos ).
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
Conservar en congelador (entre -10°C y -25°C). No require ser descongelado antes de su uso.
6.5 Naturaleza y contenido del envase
1 sistema de liberación vaginal 5 s istemas de liberación vaginal .
Cada sistema de liberación vaginal esta envasado dentro de un sobre de aluminio individual fabricado a partir de una tira de aluminio laminada que contiene un desecante y envasado en una caja de cartón.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Misodel debe sacarse del congelador y extraerse del sobre de aluminio laminado justo antes de su inserción.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local . Se debe desechar todo el producto después de la extracción.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Ferring SAU C/ Gobelas, n° 11 28023 Madrid España.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Marzo 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre de 2013.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
9 de 9