Levemir 100 U/Ml, Solucion Inyectable En Una Pluma Precargada (Flexpen)
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml solución inyectable en cartucho.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 100 unidades de insulina detemir* (equivalente a 14,2 mg). 1 cartucho contiene 3 ml equivalentes a 300 unidades.
* La insulina detemir se obtiene en Saccharomyces cerevisiae por tecnología de ADN recombinante. Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en cartucho. Penfill.
La solución es transparente, incolora y acuosa.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Levemir está indicado para el tratamiento de diabetes mellitus en adultos, adolescentes y niños de 1 año en adelante.
4.2 Posología y forma de administración
Posología
La potencia de los análogos de insulina, como la insulina detemir, se expresa en unidades, mientras que la potencia de la insulina humana se expresa en unidades internacionales. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
Levemir se puede utilizar solo como insulina basal o en combinación con bolos de insulina. También se puede utilizar en combinación con antidiabéticos orales y/o agonistas del receptor de GLP-1.
Cuando Levemir se utiliza en combinación con antidiabéticos orales o añadido a agonistas del receptor de GLP-1, se recomienda utilizar Levemir una vez al día, inicialmente a dosis de 0,1-0,2 unidades/kg o de 10 unidades en pacientes adultos. La dosis de Levemir se debe ajustar en base a las necesidades individuales del paciente.
Cuando se añade un agonista del receptor de GLP-1 a Levemir, se recomienda reducir la dosis de Levemir en un 20% para minimizar el riesgo de hipoglucemia. Posteriormente, la dosis se debe ajustar individualmente.
Para ajustes individuales de dosis, a continuación se presentan las dos siguientes recomendaciones posológicas para adultos:
Recomendación posológica para adultos con diabetes tipo 1 y tipo 2:
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 unidades |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 unidades | |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 unidades | |
|
7,1- 8,0 mmol/l (127-144 mg/dl) |
+ 2 unidades | |
|
6,1- 7,0 mmol/l (109-126 mg/dl) |
+ 2 unidades | |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
No modificar la dosis (objetivo) | |
|
3,1- 4,0 mmol/l (56-72 mg/dl) |
- 2 unidades | |
|
< 3,1 mmol/l (< 56 mg/dl) |
- 4 unidades | |
|
* Glucosa plasmática en los autocontroles Recomendación posológica sencilla para adultos con diabetes tipo 2: | ||
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir | |
|
> 6.1 mmol/l (> 110 mg/dl) |
+3 unidades | |
|
4.4-6.1 mmol/l (80-110 mg/dl) |
No modificar la dosis (objetivo) | |
|
< 4.4 mmol/l (< 80 mg/dl) |
-3 unidades | |
* Glucosa plasmática en los autocontroles
Cuando se utiliza Levemir como parte del régimen de insulina bolo-basal, Levemir se debe administrar una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir se debe ajustar de forma individual.
Puede ser necesario ajustar la dosis si el paciente aumenta su actividad física, cambia su dieta habitual o sufre una enfermedad concomitante.
Cuando se ajusta la dosis para mejorar el control glucémico, se debe advertir a los pacientes que estén atentos a los síntomas de hipoglucemia.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
Levemir se puede utilizar en pacientes de edad avanzada.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes de edad avanzada.
Insuficiencia renal y hepática
La insuficiencia renal o hepática puede reducir el requerimiento de insulina del paciente.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes con insuficiencia renal o hepática.
Población pediátrica
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante (ver sección 5.1). Cuando se cambia desde insulina basal a Levemir, es necesario considerar una reducción de la dosis de insulina basal y bolo de insulina de forma individual, para minimizar el riesgo de hipoglucemia (ver sección 4.4).
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en niños y adolescentes.
No se ha establecido la seguridad y eficacia de Levemir en niños menores de 1 año.
No se dispone de datos.
Cambio desde otras insulinas
Cuando se cambie desde otras insulinas de acción intermedia o prolongada, puede que sea necesario un ajuste de la dosis y hora de administración (ver sección 4.4).
Se recomienda un estricto control glucémico durante el cambio y las primeras semanas después del cambio (ver sección 4.4).
Puede resultar necesario ajustar el tratamiento concomitante con otros antidiabéticos (dosis y/o hora de administración de antidiabéticos orales o insulinas de acción corta/rápida).
Forma de administración
Levemir es un análogo de insulina de acción prolongada utilizado como una insulina basal. Levemir sólo se administra por vía subcutánea. Levemir no se debe administrar por vía intravenosa, ya que puede provocar una hipoglucemia grave. También debe evitarse la administración intramuscular. Levemir no debe utilizarse en bombas de perfusión de insulina.
Levemir se administra por vía subcutánea mediante inyección en la pared abdominal, el muslo, la zona superior del brazo o la región deltoidea o glútea. Siempre se debe rotar el punto de inyección dentro de la misma zona para reducir el riesgo de lipodistrofia. La duración de la acción variará según la dosis, el lugar de inyección, el flujo sanguíneo, la temperatura y el nivel de la actividad física. Se puede administrar la inyección a cualquier hora del día, pero todos los días a la misma hora. Para los pacientes que requieren dosificación dos veces al día para optimizar el control glucémico, la dosis de la tarde puede administrarse por la tarde o al acostarse.
Administración con sistemas de administración de insulina
Levemir Penfill está diseñado para ser utilizado con los sistemas de administración de insulina de Novo Nordisk y con las agujas NovoFine o NovoTwist.
Levemir Penfill se acompaña de un prospecto que detalla las instrucciones de uso a seguir.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes (ver sección 6.1).
4.4 Advertencias y precauciones especiales de empleo
El paciente debe consultar a su médico antes de viajar a diferentes zonas horarias ya que esto podría suponer que el paciente tenga que utilizar la insulina y comer a horas distintas.
Hiperglucemia
La dosificación inadecuada o la interrupción del tratamiento, especialmente en diabetes tipo 1, puede ocasionar hiperglucemia y cetoacidosis diabética. Los primeros síntomas de hiperglucemia generalmente aparecen de forma gradual, a lo largo de un período de horas o días. Estos incluyen sed, aumento de la frecuencia de micción, náuseas, vómitos, somnolencia, piel seca y enrojecida, sequedad de boca, pérdida de apetito así como aliento con olor a acetona. En diabetes tipo 1, los acontecimientos hiperglucémicos no tratados pueden dar lugar a cetoacidosis diabética la cual es potencialmente letal.
Hipoglucemia
La omisión de una comida o el ejercicio físico intenso no previsto pueden producir hipoglucemia.
En niños, se debe tener cuidado para ajustar las dosis de insulina (especialmente en regímenes de bolo-basal) con la ingesta de alimentos y la actividad física, con el fin de minimizar el riesgo de hipoglucemia.
Puede producirse una hipoglucemia si la dosis de insulina es demasiado alta en comparación con el requerimiento de insulina. En caso de hipoglucemia o sospecha de hipoglucemia no debe inyectarse Levemir. Debe considerarse un ajuste de dosis una vez se haya estabilizado la glucosa en sangre del paciente (ver secciones 4.8 y 4.9).
Los pacientes cuyo control glucémico mejora en gran medida, por ejemplo, por medio de terapia insulínica intensiva, pueden experimentar un cambio en sus síntomas usuales de aviso de hipoglucemia y deben ser avisados de esta posibilidad. Los síntomas de aviso habituales pueden desaparecer en los pacientes con diabetes de larga duración.
Las enfermedades concomitantes, especialmente las infecciones y situaciones febriles, por regla general aumentan el requerimiento de insulina del paciente. Enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, pituitaria o tiroidea, pueden requerir un cambio en la dosis de insulina.
Cuando los pacientes cambian a un tipo de insulina diferente, los síntomas iniciales de aviso de hipoglucemia pueden cambiar o ser menos pronunciados que aquéllos experimentados con su anterior insulina.
Cambio desde otras insulinas
El cambio de un paciente a otro tipo o marca de insulina se debe realizar bajo estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (insulina animal, insulina humana o análogo de insulina) y/o método de fabricación (insulina ADN recombinante versus insulina de origen animal) pueden hacer que sea necesario un cambio en la dosis. Los pacientes que han cambiado otra insulina por Levemir pueden necesitar un cambio en la dosis en comparación con la dosis utilizada con sus insulinas habituales. Si es necesario un ajuste, éste se puede realizar con la primera dosis o durante las primeras semanas o meses.
Reacciones en el lugar de inyección
Como con cualquier terapia insulínica, pueden producirse reacciones en el lugar de inyección que incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor. La continua rotación de la zona de inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones normalmente desaparecen en unos pocos días o unas pocas semanas. En raras ocasiones, las reacciones en la zona de inyección pueden requerir la interrupción de Levemir.
Hipoalbum inemia.
Los datos existentes sobre pacientes con hipoalbuminemia grave son limitados. Se recomienda monitorizar cuidadosamente a estos pacientes.
Combinación de Levemir y pioglitazona
Cuando pioglitazona fue utilizada en combinación con insulina, se notificaron casos de insuficiencia cardiaca, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca. Esto debe tenerse en cuenta si se considera el tratamiento combinado de pioglitazona y Levemir. Si se utiliza esta combinación, se debe vigilar en los pacientes la aparición de signos y síntomas de insuficiencia cardiaca, ganancia de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si tiene lugar cualquier deterioro de los síntomas cardiacos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se sabe que ciertos medicamentos interaccionan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
Antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de la monoamino oxidasa (IMAO), betabloqueantes, inhibidores de la enzima conversora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente:
Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los betabloqueantes pueden enmascarar los síntomas de hipoglucemia.
Octreotida y lanreotida pueden aumentar o reducir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucemiante de la insulina.
4.6 Fertilidad, embarazo y lactancia Embarazo
Se puede considerar el tratamiento con Levemir durante el embarazo, pero se debe evaluar el beneficio potencial frente a la posibilidad de que aumente el riesgo de un resultado adverso en el embarazo.
En general, se recomienda intensificar el control de la glucemia y la monitorización de mujeres embarazadas con diabetes durante todo el embarazo y cuando se planifica el mismo. Los requerimientos de insulina generalmente disminuyen en el primer trimestre del embarazo y aumentan posteriormente durante el segundo y tercer trimestre. Normalmente después del parto, los requerimientos de insulina vuelven rápidamente a los niveles previos al embarazo.
En un ensayo clínico controlado abierto y aleatorizado, se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid. El objetivo principal de este ensayo era el evaluar el efecto de Levemir en la regulación de la glucosa en sangre en mujeres embarazadas con diabetes (ver sección 5.1).
La tasa total de acontecimientos adversos maternos fue similar en los grupos tratados con Levemir e insulina NPH, sin embargo, se observó una frecuencia numéricamente superior de acontecimientos adversos graves en las madres (61 (40%) vs. 49 (31%)) y en los recién nacidos (36 (24%) vs. 32 (20%)) con Levemir comparado con la insuina NPH. El número de niños nacidos vivos de mujeres que quedaron embarazadas después de la aleatorización fue de 50 (83%) con Levemir y de 55 (89%) con NPH. La frecuencia de malformaciones congenitas fue de 4 (5%) con Levemir y 11 (7%) con NPH, siendo 3 (4%) malformaciones graves con Levemir y 3 (2%) con NPH.
Los 250 resultados adicionales obtenidos de los datos de poscomercialización de mujeres embarazadas expuestas a Levemir, indican que la insulina detemir no produce efectos adversos en el embarazo ni malformaciones ni toxicidad fetal/neonatal.
Los datos en animales no indican toxicidad reproductiva (ver sección 5.3).
Lactancia
Se desconoce si la insulina detemir se excreta en la leche materna. No se prevén efectos metabólicos de la insulina detemir ingerida sobre el recién nacido/lactante ya que la insulina detemir, al ser un péptido, se descompone en aminoácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia pueden necesitar un ajuste en la dosis de insulina y en la dieta.
Fertilidad
Los estudios en animales no revelan efectos perjudiciales relativos a la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen un estado especial de alerta (por ej. conducir un coche o utilizar máquinas).
Debe advertirse a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de una hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se considerará la conveniencia de conducir en estas circunstancias.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
Las reacciones adversas observadas en pacientes que usan Levemir se deben principalmente al efecto farmacológico de la insulina. Se estima que en general un 12% de los pacientes tratados experimentan reacciones adversas.
La hipoglucemia es la reacción adversa notificada más frecuentemente durante el tratamiento, ver sección c más abajo.
De las investigaciones clínicas se sabe que la hipoglucemia grave, definida como la necesidad de asistencia en el tratamiento, ocurre en aproximadamente un 6% de los pacientes tratados con Levemir.
Las reacciones en el lugar de inyección se han visto con más frecuencia durante el tratamiento con Levemir que con la insulina humana. Estas reacciones incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor en el lugar de inyección. La mayoría de las reacciones en la zona de inyección son menores y de naturaleza transitoria, es decir, que suelen desaparecer al continuar el tratamiento normalmente en unos pocos días o en pocas semanas.
Al iniciar el tratamiento con insulina pueden aparecer anomalías en la refracción y edema; estas reacciones son generalmente de carácter transitorio. Una rápida mejoría del control de la glucosa en sangre puede estar asociada a una neuropatía dolorosa aguda, que normalmente es reversible. Una intensificación de la terapia insulínica que produzca una repentina mejoría del control glucémico puede estar asociada a un empeoramiento temporal de la retinopatía diabética, mientras que un buen control glucémico prolongado disminuye el riesgo de progresión de la retinopatía diabética.
b. Tabla de efectos adversos
Los efectos adversos enumerados a continuación están basados en los datos de los ensayos clínicos y se clasifican de acuerdo a su frecuencia y a la clasificación por órganos y sistemas.
Las categorías de frecuencias vienen definidas por la siguiente convención: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); rara (> 1/10.000 a < 1/1.000); muy rara (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos del sistema inmunológico |
Poco frecuente - Reacciones alérgicas, reacciones alérgicas potenciales, urticaria, exantema y erupciones* |
|
Muy rara - Reacciones anafilácticas* | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuente - Hipoglucemia* |
|
Trastornos del sistema nervioso |
Rara - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos oculares |
Poco frecuente - Trastornos de la refracción |
|
Poco frecuente - Retinopatía diabética | |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuente - Lipodistrofia* |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente - Reacciones en la zona de inyección |
|
Poco frecuente - Edema |
* ver sección c.
c. Descripción de los efectos adversos señalados
Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones Las reacciones alérgicas, las reacciones potencialmente alérgicas, la urticaria, el exantema y las erupciones son poco frecuentes cuando Levemir se usa en régimen bolo-basal. Sin embargo tres ensayos clínicos han demostrado que, cuando se usa en combinación con antidiabéticos orales, se puede definir como frecuente (se ha observado un 2,2% de reacciones alérgicas y reacciones potencialmente alérgicas)
Reacciones anafilácticas
La aparición de reacciones de hipersensibilidad generalizada (que incluyen exantema cutáneo generalizado, prurito, sudor, molestias gastrointestinales, edema angioneurótico, dificultad en la respiración, palpitaciones e hipotensión) es muy rara pero éstas pueden ser potencialmente mortales.
Hipoglucemia
El efecto adverso notificado con mayor frecuencia es hipoglucemia. Puede aparecer si la dosis de insulina es demasiado alta en relación al requerimiento de insulina. Una hipoglucemia grave puede producir un estado de inconsciencia y/o convulsiones y puede dar lugar a una insuficiencia cerebral temporal o permanente o incluso la muerte. Los síntomas de hipoglucemia por lo general aparecen de forma repentina. Pueden incluir sudor frío, piel fría y pálida, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad no habitual, confusión, dificultad para concentrarse, mareo, apetito excesivo, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia
Puede aparecer lipodistrofia (incluidas lipohipertrofia y lipoatrofia) en el lugar de la inyección. La continua rotación del lugar de inyección dentro de un área concreta de inyección reduce el riesgo de desarrollar estas reacciones.
d. Población pediátrica
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en la población pediátrica no muestran ninguna diferencia con la población diabética general, en la cual existe una mayor experiencia.
e. Otras poblaciones especiales
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en los pacientes de edad avanzada y en los pacientes con insuficiencia renal o hepática no muestran ninguna diferencia con la población general, en la cual existe una mayor experiencia.
f. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No es posible fijar definiciones específicas relativas a la sobredosificación de las insulinas, sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si el paciente recibe una dosis superior a sus requerimientos:
• Los episodios hipoglucémicos leves se pueden tratar con administración oral de glucosa o productos azucarados. Por consiguiente se recomienda que los pacientes diabéticos lleven siempre productos azucarados.
• Los episodios hipoglucémicos graves, con pérdida de consciencia, pueden tratarse con inyección intramuscular o subcutánea de glucagón (0,5 a 1 mg), administrada por una persona entrenada, o bien glucosa por vía intravenosa administrada por un profesional sanitario. Se debe administrar glucosa intravenosa, si el paciente no responde al glucagón en 10-15 minutos. Se recomienda la administración de carbohidratos orales al paciente una vez recuperada la consciencia, a fin de prevenir una recaída.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos utilizados en diabetes. Insulinas y análogos de acción prolongada para inyección. Código ATC: A10AE05.
Mecanismo de acción y efectos farmacodinámicos
Levemir es un análogo de insulina soluble de acción prolongada con una duración de su efecto prolongada que se utiliza como insulina basal.
El efecto hipoglucemiante de Levemir se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas y a que inhibe al mismo tiempo la producción hepática de glucosa.
El perfil de acción de Levemir es menos variable y con ello más predecible, de forma estadísticamente significativa, que el de la insulina NPH (protamina neutra Hagedorn), como se puede ver a partir de los Coeficientes de Variación (CV) intraindividuales del efecto farmacodinámico total y máximo en la Tabla 1.
Tabla 1. Variabilidad intraindividual del perfil de acción de Levemir e insulina NPH
|
Punto final farmacodinámico |
Levemir CV (%) |
Insulina NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
* Área bajo la curva ** Valor p< 0,00 comparaciones con Levemir
de la Velocidad de Infusión de Glucosa para todas las
La acción prolongada de Levemir está mediada por la fuerte autoasociación de las moléculas de la insulina detemir en el lugar de inyección y la unión a la albúmina por medio de la cadena lateral del ácido graso. La insulina detemir se distribuye más lentamente a los tejidos periféricos diana que la insulina NPH. Esta combinación de mecanismos de prolongación proporciona a la insulina detemir una absorción y un perfil de acción más reproducibles que la insulina NPH.
Parámetros Farmacodinámicos para Levemir y NPH
|
Levemir |
NPH | ||||
|
U/kg |
U/kg |
U/kg |
UI/kg | ||
|
Duración de acción (hr) |
12 |
17t |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4t |
1.7 |
1.6 | |
Tvalores estimados
Figura 1. Perfiles de actividad de Levemir en pacientes con diabetes tipo 1.
La duración máxima de la acción es 24 horas, según la dosis, lo cual permite la administración de una o dos dosis diarias. Si Levemir se administra dos veces diarias, la estabilización se produce después de la administración de 2-3 dosis. En el rango de dosificación de 0,2 - 0,4 U/kg, Levemir ejerce más de un 50% de su efecto máximo entre 3 y 4 horas después de la administración y hasta aproximadamente 14 horas después de la administración.
Después de la administración subcutánea se observa una proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de la acción, efecto total).
Se ha demostrado una menor variabilidad diaria en los niveles de glucosa plasmática en ayunas (GPA) durante el tratamiento con Levemir en comparación con el tratamiento con insulina NPH, en ensayos clínicos a largo plazo.
Los ensayos en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con antidiabéticos orales demostraron que el control glucémico (HbA1c) con Levemir es comparable al obtenido con insulina NPH y al obtenido con insulina glargina y está asociado con un menor aumento de peso. Ver Tabla 2. En el ensayo de Levemir frente a insulina glargina, Levemir se administró una o dos veces al día, mientras que la insulina glargina se administró una vez al día y se vio que el 55% de los pacientes tratados con Levemir completaron las 52 semanas de tratamiento con el régimen de administración dos veces al día.
Tabla 2. Cambio en el peso corporal después del tratamiento con insulina
|
Duración del ensayo |
Levemir 1 vez al día |
Levemir 2 veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+0,7 kg |
+1,6 kg | ||
|
26 semanas |
+1,2 kg |
+2,8 kg | ||
|
52 semanas |
+2,3 kg |
+3,7 kg |
+4,0 kg |
En ensayos clínicos en los que se ha investigado el uso de antidiabéticos orales, el tratamiento combinado con Levemir dio lugar a un 61-65% de disminución de riesgo de hipoglucemias nocturnas comparado con la insulina NPH.
Se llevó a cabo un ensayo clínico abierto y aleatorizado en pacientes con diabetes tipo 2 que no alcanzaban el objetivo glucémico con antidiabéticos orales. El ensayo comenzó con un periodo de prueba de 12 semanas de tratamiento con liraglutida + metformina, donde el 61% alcanzó una HbA1c < 7%. El 39% restante (pacientes que no alcanzaron el objetivo) fueron aleatorizados para utilizar Levemir una vez al día como tratamiento añadido o continuar con liraglutida + metformina durante 52 semanas. La adición de Levemir dio como resultado una reducción adicional de la HbAic de 7,6% a 7,1% después de 52 semanas. No hubo ningún episodio hipoglucémico grave. Un episodio
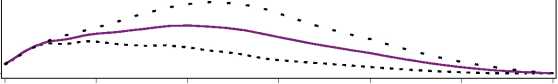
O 4 8 12 16 20 24
Tiempo transcurrido desde la inyección de Insulina (horas) Levemir..... 0.2 U/kg 0.3 U/kg____0.4 U/kg
hipoglucémico grave se define como un episodio en el que el sujeto no es capaz de tratarse a sí mismo con glucagón o en el que es necesario administrarle glucosa intravenosa. Ver tabla 3
|
Tabla 3. Datos del ensayo clínico - Adición ( |
e Levemir a liraglutida + metformina | |||
|
Semana del estudio |
Aleatorizado Levemir + liraglutida + metformina N = 160 |
Aleatorizado Liraglutida + metformina N = 149 |
Valor P | |
|
Media del cambio de la HbA1c desde el nivel basal (%) |
026 semanas |
-0,51 |
+0,02 |
< 0,0001 |
|
052 semanas |
-0,50 |
0,01 |
< 0,0001 | |
|
Proporción de pacientes que alcanzan el objetivo de HbA1c < 7% (%) |
026 semanas |
43,1 |
16,8 |
< 0,0001 |
|
052 semanas |
51,9 |
21,5 |
< 0,0001 | |
|
Cambio en el peso desde el nivel basal (kg) |
026 semanas |
-0,16 |
-0,95 |
0,0283 |
|
052 semanas |
-0,05 |
-1,02 |
0,0416 | |
|
Episodios hipoglucémicos leves (por paciente año) |
026 semanas |
0,286 |
0,029 |
0,0037 |
|
052 semanas |
0,228 |
0,034 |
0,0011 | |
Se realizó un ensayo clínico aleatorizado, doble ciego, de 26 semanas, para investigar la eficacia y seguridad de la adición de liraglutida (1,8 mg) frente a placebo en pacientes con diabetes tipo 2 no controlados adecuadamente con insulina basal, con o sin metformina. La dosis de insulina se redujo en un 20% en los pacientes con HbA1c basal <8,0% con el fin de minimizar el riesgo de hipoglucemia. Posteriormente, a los pacientes se les permitió ajustar su dosis de insulina a un valor no superior al de la dosis de pre-aleatorización. Levemir fue la insulina basal para el 33% (N = 147) de los pacientes (el 97,3% tomando metformina). En estos pacientes, la adición de liraglutida dio lugar a una mayor disminución de la HbA1c en comparación con la adición de placebo (6,93% vs. 8,24%), una mayor disminución de la glucosa plasmática en ayunas (7,20 mmol/l vs. 8,13 mmol/l) y una mayor disminución del peso corporal (-3,47 kg vs. -0,43 kg). Los valores basales de estos parámetros fueron similares en los dos grupos. Las tasas observadas de episodios hipoglucémicos leves fueron similares y no se observaron episodios hipoglucémicos graves en ninguno de los grupos.
En ensayos a largo plazo en pacientes con diabetes tipo 1 en tratamiento con insulina bolo-basal, el control de la glucosa plasmática en ayunas mejoró con Levemir en comparación con insulina NPH. El control glucémico (HbA1c) con Levemir fue comparable al de la insulina NPH, con menor riesgo de hipoglucemia nocturna y sin aumento de peso asociado.
En ensayos clínicos utilizando un régimen de dosificación de insulina bolo/basal, la frecuencia general de hipoglucemias fue similar con Levemir e insulina NPH. Los análisis de hipoglucemia nocturna en pacientes diabéticos tipo 1 mostraron un riesgo significativamente inferior de hipoglucemia nocturna leve (capacidad de autotratamiento y confirmado mediante el valor de glucosa en sangre capilar inferior a 2,8 mmol/l o 3,1 mmol/l si se expresa como glucosa en plasma) al comparar con insulina NPH, mientras que no se observaron diferencias en diabéticos tipo 2.
Con el uso de Levemir se ha observado el desarrollo de anticuerpos. Sin embargo, no parece que este hecho tenga impacto sobre el control glucémico.
Embarazo
Levemir se estudió en un ensayo clínico controlado abierto y aleatorizado, en el que se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid (ver sección 4.6).
El efecto de Levemir no fue inferior al de la insulina NPH usando como criterio de medida la HbA1c en la semana de gestación (SG) 36, y la reducción en la HbA1c media durante el embarazo fue similar con ambas insulinas, ver tabla 4.
Tabla 4. Control glucémico materno
|
Levemir |
NPH |
Diferencia/ Odds Ratio/ Rate Ratio IC 95% | |
|
HbAJc media (%) en SG 36 |
6,27 |
6,33 |
Diferencia: -0,06 [-0,21; 0,08] |
|
GPA media en SG 36 (mmol/l) |
4,76 |
5,41 |
Diferencia: -0,65 [-1,19; -0,12] |
|
Proporción de pacientes que alcanzaron el objetivo de HbAJc < 6% tanto en SG 24 como en SG 36 (%) |
41% |
32% |
Odds Ratio: 1,36 [0,78; 2,37] |
|
Número total de episodios hipoglucémicos graves durante el embarazo (por paciente año) |
1,1 |
1,2 |
Rate Ratio: 0,82 [0,39; 1,75] |
Población pediátrica
Se ha estudiado la eficacia y seguridad de Levemir en adolescentes y niños (n=1045 en total) en tres ensayos clínicos controlados aleatorizados de 12 meses de duración. Los ensayos incluyeron un total de 167 niños de entre 1 y 5 años de edad. Los ensayos demostraron que el control glucémico (HbA1c) obtenido con Levemir es comparable al obtenido con la insulina NPH e insulina degludec cuando se administra en terapia bolo/basal utilizando un margen de no inferioridad del 0,4%. En el ensayo que compara Levemir vs insulina degludec, la tasa de episodios de hiperglucemia con cetosis fue significativamente mayor para Levemir, con 1,09 y 0,68 episodios por paciente/año de exposición respectivamente. Se observó un menor aumento de peso (SD Z-score, peso corregido según el sexo y la edad) con Levemir que con insulina NPH.
El ensayo que incluía niños a partir de 2 años se prolongó durante 12 meses más (datos de un tratamiento de 24 meses en total) para evaluar la formación de anticuerpos después de un tratamiento de larga duración con Levemir. Después de que los anticuerpos frente a insulina aumentaran durante el primer año, estos disminuyeron durante el segundo año hasta llegar a un nivel ligeramente superior al nivel de antes del ensayo. Los resultados indican que el desarrollo de anticuerpos no tuvo un efecto negativo sobre el control glucémico ni sobre la dosis de Levemir.
Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 se han extrapolado de los datos de pacientes niños, adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de Levemir en pacientes adolescentes con diabetes mellitus tipo 2.
5.2 Propiedades farmacocinéticas
Absorción
La concentración máxima en suero se alcanza entre 6 y 8 horas después de la administración.
Si Levemir se administra dos veces diarias, la estabilización de la concentración en suero se alcanza
después de la administración de 2-3 dosis.
La variación intraindividual en la absorción es menor con Levemir que con otros preparados de insulina basal.
La biodisponibilidad absoluta de insulina detemir administrada por vía subcutánea es de aproximadamente un 60%.
Distribución
El volumen de distribución aparente de Levemir (aproximadamente 0,1 l/kg) indica que la fracción de insulina detemir en la sangre circulante es alta.
Los resultados de los estudios de unión a proteínas in vitro e in vivo sugieren que no existe una interacción clínicamente significativa entre la insulina detemir y los ácidos grasos u otras proteínas ligadas a medicamentos.
Metabolismo
La degradación de insulina detemir es similar a la de la insulina humana. Todos los metabolitos formados son inactivos.
Eliminación
La vida media terminal después de la administración subcutánea es determinada por la velocidad de absorción del tejido subcutáneo. La vida media terminal es de 5 a 7 horas según la dosis.
Linealidad
Después de la administración subcutánea en el rango de dosificación terapéutico se observa una proporcionalidad de la dosis en la concentración en suero (concentración máxima, extensión de la absorción).
No se han observado interacciones farmacocinéticas o farmacodinámicas entre liraglutida y Levemir cuando se administra una dosis única de Levemir 0,5 U/kg con liraglutida 1,8 mg en estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas de edad avanzada y jóvenes.
Insuficiencia renal y hepática
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas con insuficiencia renal o hepática y sujetos sanos. Ya que la farmacocinética de Levemir no se ha estudiado extensamente en esta población, se recomienda monitorizar cuidadosamente la glucosa plasmática de estos pacientes.
Sexo
No hay diferencias clínicamente significativas entre sexos en cuanto a las propiedades farmacocinéticas de Levemir.
Población pediátrica
Las propiedades farmacocinéticas de Levemir se han estudiado en niños pequeños (1-5 años), niños (6-12 años) y adolescentes (13-17 años) y se han comparado con adultos con diabetes tipo 1. No hubo diferencias clínicamente significativas en cuanto a las propiedades farmacocinéticas entre niños pequeños, niños, adolescentes y adultos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad para la reproducción y desarrollo. Los datos sobre afinidad del receptor y ensayos in vitro de mitogenicidad no indicaron signos de aumento del potencial mitogénico en comparación con la insulina humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glicerol
Fenol
Metacresol
Acetato de zinc
Fosfato disódico dihidrato
Cloruro sódico
Ácido clorhídrico (para ajuste del pH)
Hidróxido sódico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Levemir pueden provocar la degradación de la insulina detemir, por ejemplo, si el medicamento contiene tioles o sulfitos. Levemir no se debe añadir a los fluidos de perfusión.
Este medicamento no debe ser mezclado con otros medicamentos.
6.3 Período de validez Antes de abrir: 30 meses
Durante su uso o cuando se lleva como repuesto: el producto debe conservarse durante un máximo de 6 semanas.
6.4 Precauciones especiales de conservación
Antes de abrir: conservar en nevera (entre 2°C y 8°C). No guardar cerca del elemento refrigerador. No congelar.
Durante su uso o cuando se lleva como repuesto: conservar por debajo de 30°C. No refrigerar. No congelar.
Conservar el cartucho en el envase exterior para protegerlo de la luz.
Para las condiciones de conservación del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
3 ml de solución en un cartucho (vidrio tipo 1) con un émbolo (bromobutil) y un cierre de goma (bromobutil/poliisopreno).
Envases con 1, 5 y 10 cartuchos. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las agujas y Levemir Penfill no se deben compartir. El cartucho no se debe rellenar.
No utilice este medicamento si observa que la solución no es transparente, incolora y acuosa.
Si Levemir se ha congelado no debe utilizarse.
Se debe indicar al paciente que deseche la aguja después de cada inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/001
EU/1/04/278/002
EU/1/04/278/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 01 Junio 2004 Fecha de la última renovación: 16 Abril 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 100 unidades de insulina detemir* (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades.
* La insulina detemir se obtiene en Saccharomyces cerevisiae por tecnología de ADN recombinante. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada. FlexPen La solución es transparente, incolora y acuosa.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Levemir está indicado para el tratamiento de diabetes mellitus en adultos, adolescentes y niños de 1 año en adelante.
4.2 Posología y forma de administración
Posología
La potencia de los análogos de insulina, como la insulina detemir, se expresa en unidades, mientras que la potencia de la insulina humana se expresa en unidades internacionales. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
Levemir se puede utilizar solo como insulina basal o en combinación con bolos de insulina. También se puede utilizar en combinación con antidiabéticos orales y/o agonistas del receptor de GLP-1.
Cuando Levemir se utiliza en combinación con antidiabéticos orales o añadido a agonistas del receptor de GLP-1, se recomienda utilizar Levemir una vez al día, inicialmente a dosis de 0,1-0,2 unidades/kg o de 10 unidades en pacientes adultos. La dosis de Levemir se debe ajustar en base a las necesidades individuales del paciente.
Cuando se añade un agonista del receptor de GLP-1 a Levemir, se recomienda reducir la dosis de Levemir en un 20% para minimizar el riesgo de hipoglucemia. Posteriormente, la dosis se debe ajustar individualmente.
Para ajustes individuales de dosis, a continuación se presentan las dos siguientes recomendaciones posológicas para adultos:
Recomendación posológica para adultos con diabetes tipo 1 y tipo 2:
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 unidades |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 unidades | |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 unidades | |
|
7,1- 8,0 mmol/l (127-144 mg/dl) |
+ 2 unidades | |
|
6,1- 7,0 mmol/l (109-126 mg/dl) |
+ 2 unidades | |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
No modificar la dosis (objetivo) | |
|
3,1- 4,0 mmol/l (56-72 mg/dl) |
- 2 unidades | |
|
< 3,1 mmol/l (< 56 mg/dl) |
- 4 unidades | |
|
* Glucosa plasmática en los autocontroles Recomendación posológica sencilla para adultos con diabetes tipo 2: | ||
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir | |
|
> 6.1 mmol/l (> 110 mg/dl) |
+3 unidades | |
|
4.4-6.1 mmol/l (80-110 mg/dl) |
No modificar la dosis (objetivo) | |
|
< 4.4 mmol/l (< 80 mg/dl) |
-3 unidades | |
* Glucosa plasmática en los autocontroles
Cuando se utiliza Levemir como parte del régimen de insulina bolo-basal, Levemir se debe administrar una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir se debe ajustar de forma individual.
Puede ser necesario ajustar la dosis si el paciente aumenta su actividad física, cambia su dieta habitual o sufre una enfermedad concomitante.
Cuando se ajusta la dosis para mejorar el control glucémico, se debe advertir a los pacientes que estén atentos a los síntomas de hipoglucemia.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
Levemir se puede utilizar en pacientes de edad avanzada.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes de edad avanzada.
Insuficiencia renal y hepática
La insuficiencia renal o hepática puede reducir el requerimiento de insulina del paciente.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes con insuficiencia renal o hepática.
Población pediátrica
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante (ver sección 5.1). Cuando se cambia desde insulina basal a Levemir, es necesario considerar una reducción de la dosis de insulina basal y bolo de insulina de forma individual, para minimizar el riesgo de hipoglucemia (ver sección 4.4).
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en niños y adolescentes.
No se ha establecido la seguridad y eficacia de Levemir en niños menores de 1 año.
No se dispone de datos.
Cambio desde otras insulinas
Cuando se cambie desde otras insulinas de acción intermedia o prolongada, puede que sea necesario un ajuste de la dosis y hora de administración (ver sección 4.4).
Se recomienda un estricto control glucémico durante el cambio y las primeras semanas después del cambio (ver sección 4.4).
Puede resultar necesario ajustar el tratamiento concomitante con otros antidiabéticos (dosis y/o hora de administración de antidiabéticos orales o insulinas de acción corta/rápida).
Forma de administración
Levemir es un análogo de insulina de acción prolongada utilizado como una insulina basal. Levemir sólo se administra por vía subcutánea. Levemir no se debe administrar por vía intravenosa, ya que puede provocar una hipoglucemia grave. También debe evitarse la administración intramuscular. Levemir no debe utilizarse en bombas de perfusión de insulina.
Levemir se administra por vía subcutánea mediante inyección en la pared abdominal, el muslo, la zona superior del brazo o la región deltoidea o glútea. Siempre se debe rotar el punto de inyección dentro de la misma zona para reducir el riesgo de lipodistrofia. La duración de la acción variará según la dosis, el lugar de inyección, el flujo sanguíneo, la temperatura y el nivel de la actividad física. Se puede administrar la inyección a cualquier hora del día, pero todos los días a la misma hora. Para los pacientes que requieren dosificación dos veces al día para optimizar el control glucémico, la dosis de la tarde puede administrarse por la tarde o al acostarse.
Administración con FlexPen
Levemir FlexPen es una pluma precargada diseñada para ser utilizada con las agujas desechables NovoFine o NovoTwist de una longitud de hasta 8 mm. Con FlexPen se pueden seleccionar dosis de 1 a 60 unidades, en incrementos de 1 unidad.
Levemir FlexPen sigue un código de colores y se acompaña de un prospecto que detalla las instrucciones de uso a seguir.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes (ver sección 6.1).
4.4 Advertencias y precauciones especiales de empleo
El paciente debe consultar a su médico antes de viajar a diferentes zonas horarias ya que esto podría suponer que el paciente tenga que utilizar la insulina y comer a horas distintas.
Hiperglucemia
La dosificación inadecuada o la interrupción del tratamiento, especialmente en diabetes tipo 1, puede ocasionar hiperglucemia y cetoacidosis diabética. Los primeros síntomas de hiperglucemia generalmente aparecen de forma gradual, a lo largo de un período de horas o días. Estos incluyen sed, aumento de la frecuencia de micción, náuseas, vómitos, somnolencia, piel seca y enrojecida, sequedad de boca, pérdida de apetito así como aliento con olor a acetona. En diabetes tipo 1, los acontecimientos hiperglucémicos no tratados pueden dar lugar a cetoacidosis diabética la cual es potencialmente letal.
Hipoglucemia
La omisión de una comida o el ejercicio físico intenso no previsto pueden producir hipoglucemia.
En niños, se debe tener cuidado para ajustar las dosis de insulina (especialmente en regímenes de bolo-basal) con la ingesta de alimentos y la actividad física, con el fin de minimizar el riesgo de hipoglucemia.
Puede producirse una hipoglucemia si la dosis de insulina es demasiado alta en comparación con el requerimiento de insulina. En caso de hipoglucemia o sospecha de hipoglucemia no debe inyectarse
Levemir. Debe considerarse un ajuste de dosis una vez se haya estabilizado la glucosa en sangre del paciente (ver secciones 4.8 y 4.9).
Los pacientes cuyo control glucémico mejora en gran medida, por ejemplo, por medio de terapia insulínica intensiva, pueden experimentar un cambio en sus síntomas usuales de aviso de hipoglucemia y deben ser avisados de esta posibilidad. Los síntomas de aviso habituales pueden desaparecer en los pacientes con diabetes de larga duración.
Las enfermedades concomitantes, especialmente las infecciones y situaciones febriles, por regla general aumentan el requerimiento de insulina del paciente. Enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, pituitaria o tiroidea, pueden requerir un cambio en la dosis de insulina.
Cuando los pacientes cambian a un tipo de insulina diferente, los síntomas iniciales de aviso de hipoglucemia pueden cambiar o ser menos pronunciados que aquéllos experimentados con su anterior insulina.
Cambio desde otras insulinas
El cambio de un paciente a otro tipo o marca de insulina se debe realizar bajo estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (insulina animal, insulina humana o análogo de insulina) y/o método de fabricación (insulina ADN recombinante versus insulina de origen animal) pueden hacer que sea necesario un cambio en la dosis. Los pacientes que han cambiado otra insulina por Levemir pueden necesitar un cambio en la dosis en comparación con la dosis utilizada con sus insulinas habituales. Si es necesario un ajuste, éste se puede realizar con la primera dosis o durante las primeras semanas o meses.
Reacciones en el lugar de inyección
Como con cualquier terapia insulínica, pueden producirse reacciones en el lugar de inyección que incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor. La continua rotación de la zona de inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones normalmente desaparecen en unos pocos días o unas pocas semanas. En raras ocasiones, las reacciones en la zona de inyección pueden requerir la interrupción de Levemir.
Hipoalbum inemia.
Los datos existentes sobre pacientes con hipoalbuminemia grave son limitados. Se recomienda monitorizar cuidadosamente a estos pacientes.
Combinación de Levemir y pioglitazona
Cuando pioglitazona fue utilizada en combinación con insulina, se notificaron casos de insuficiencia cardiaca, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca. Esto debe tenerse en cuenta si se considera el tratamiento combinado de pioglitazona y Levemir. Si se utiliza esta combinación, se debe vigilar en los pacientes la aparición de signos y síntomas de insuficiencia cardiaca, ganancia de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si tiene lugar cualquier deterioro de los síntomas cardiacos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se sabe que ciertos medicamentos interaccionan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
Antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de la monoamino oxidasa (IMAO), betabloqueantes, inhibidores de la enzima conversora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los betabloqueantes pueden enmascarar los síntomas de hipoglucemia.
Octreotida y lanreotida pueden aumentar o reducir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucemiante de la insulina.
4.6 Fertilidad, embarazo y lactancia Embarazo
Se puede considerar el tratamiento con Levemir durante el embarazo, pero se debe evaluar el beneficio potencial frente a la posibilidad de que aumente el riesgo de un resultado adverso en el embarazo.
En general, se recomienda intensificar el control de la glucemia y la monitorización de mujeres embarazadas con diabetes durante todo el embarazo y cuando se planifica el mismo. Los requerimientos de insulina generalmente disminuyen en el primer trimestre del embarazo y aumentan posteriormente durante el segundo y tercer trimestre. Normalmente después del parto, los requerimientos de insulina vuelven rápidamente a los niveles previos al embarazo.
En un ensayo clínico controlado abierto y aleatorizado, se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid. El objetivo principal de este ensayo era el evaluar el efecto de Levemir en la regulación de la glucosa en sangre en mujeres embarazadas con diabetes (ver sección 5.1).
La tasa total de acontecimientos adversos maternos fue similar en los grupos tratados con Levemir e insulina NPH, sin embargo, se observó una frecuencia numéricamente superior de acontecimientos adversos graves en las madres (61 (40%) vs. 49 (31%)) y en los recién nacidos (36 (24%) vs. 32 (20%)) con Levemir comparado con la insuina NPH. El número de niños nacidos vivos de mujeres que quedaron embarazadas después de la aleatorización fue de 50 (83%) con Levemir y de 55 (89%) con NPH. La frecuencia de malformaciones congenitas fue de 4 (5%) con Levemir y 11 (7%) con NPH, siendo 3 (4%) malformaciones graves con Levemir y 3 (2%) con NPH.
Los 250 resultados adicionales obtenidos de los datos de poscomercialización de mujeres embarazadas expuestas a Levemir, indican que la insulina detemir no produce efectos adversos en el embarazo ni malformaciones ni toxicidad fetal/neonatal.
Los datos en animales no indican toxicidad reproductiva (ver sección 5.3).
Lactancia
Se desconoce si la insulina detemir se excreta en la leche materna. No se prevén efectos metabólicos de la insulina detemir ingerida sobre el recién nacido/lactante ya que la insulina detemir, al ser un péptido, se descompone en aminoácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia pueden necesitar un ajuste en la dosis de insulina y en la dieta.
Fertilidad
Los estudios en animales no revelan efectos perjudiciales relativos a la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen un estado especial de alerta (por ej. conducir un coche o utilizar máquinas).
Debe advertirse a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de una hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se considerará la conveniencia de conducir en estas circunstancias.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
Las reacciones adversas observadas en pacientes que usan Levemir se deben principalmente al efecto farmacológico de la insulina. Se estima que en general un 12% de los pacientes tratados experimentan reacciones adversas.
La hipoglucemia es la reacción adversa notificada más frecuentemente durante el tratamiento, ver sección c más abajo.
De las investigaciones clínicas se sabe que la hipoglucemia grave, definida como la necesidad de asistencia en el tratamiento, ocurre en aproximadamente un 6% de los pacientes tratados con Levemir.
Las reacciones en el lugar de inyección se han visto con más frecuencia durante el tratamiento con Levemir que con la insulina humana. Estas reacciones incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor en el lugar de inyección. La mayoría de las reacciones en la zona de inyección son menores y de naturaleza transitoria, es decir, que suelen desaparecer al continuar el tratamiento normalmente en unos pocos días o en pocas semanas.
Al iniciar el tratamiento con insulina pueden aparecer anomalías en la refracción y edema; estas reacciones son generalmente de carácter transitorio. Una rápida mejoría del control de la glucosa en sangre puede estar asociada a una neuropatía dolorosa aguda, que normalmente es reversible. Una intensificación de la terapia insulínica que produzca una repentina mejoría del control glucémico puede estar asociada a un empeoramiento temporal de la retinopatía diabética, mientras que un buen control glucémico prolongado disminuye el riesgo de progresión de la retinopatía diabética.
b. Tabla de efectos adversos
Los efectos adversos enumerados a continuación están basados en los datos de los ensayos clínicos y se clasifican de acuerdo a su frecuencia y a la clasificación por órganos y sistemas.
Las categorías de frecuencias vienen definidas por la siguiente convención: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); rara (> 1/10.000 a < 1/1.000); muy rara (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos del sistema inmunológico |
Poco frecuente - Reacciones alérgicas, reacciones alérgicas potenciales, urticaria, exantema y erupciones* |
|
Muy rara - Reacciones anafilácticas* | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuente - Hipoglucemia* |
|
Trastornos del sistema nervioso |
Rara - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos oculares |
Poco frecuente - Trastornos de la refracción |
|
Poco frecuente - Retinopatía diabética | |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuente - Lipodistrofia* |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente - Reacciones en la zona de inyección |
|
Poco frecuente - Edema |
* ver sección c.
c. Descripción de los efectos adversos señalados
Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones Las reacciones alérgicas, las reacciones potencialmente alérgicas, la urticaria, el exantema y las erupciones son poco frecuentes cuando Levemir se usa en régimen bolo-basal. Sin embargo tres ensayos clínicos han demostrado que, cuando se usa en combinación con antidiabéticos orales, se puede definir como frecuente (se ha observado un 2,2% de reacciones alérgicas y reacciones potencialmente alérgicas)
Reacciones anafilácticas
La aparición de reacciones de hipersensibilidad generalizada (que incluyen exantema cutáneo generalizado, prurito, sudor, molestias gastrointestinales, edema angioneurótico, dificultad en la respiración, palpitaciones e hipotensión) es muy rara pero éstas pueden ser potencialmente mortales.
Hipoglucemia
El efecto adverso notificado con mayor frecuencia es hipoglucemia. Puede aparecer si la dosis de insulina es demasiado alta en relación al requerimiento de insulina. Una hipoglucemia grave puede producir un estado de inconsciencia y/o convulsiones y puede dar lugar a una insuficiencia cerebral temporal o permanente o incluso la muerte. Los síntomas de hipoglucemia por lo general aparecen de forma repentina. Pueden incluir sudor frío, piel fría y pálida, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad no habitual, confusión, dificultad para concentrarse, mareo, apetito excesivo, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia
Puede aparecer lipodistrofia (incluidas lipohipertrofia y lipoatrofia) en el lugar de la inyección. La continua rotación del lugar de inyección dentro de un área concreta de inyección reduce el riesgo de desarrollar estas reacciones.
d. Población pediátrica
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en la población pediátrica no muestran ninguna diferencia con la población diabética general, en la cual existe una mayor experiencia.
e. Otras poblaciones especiales
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en los pacientes de edad avanzada y en los pacientes con insuficiencia renal o hepática no muestran ninguna diferencia con la población general, en la cual existe una mayor experiencia.
f. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No es posible fijar definiciones específicas relativas a la sobredosificación de las insulinas, sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si el paciente recibe una dosis superior a sus requerimientos:
• Los episodios hipoglucémicos leves se pueden tratar con administración oral de glucosa o productos azucarados. Por consiguiente se recomienda que los pacientes diabéticos lleven siempre productos azucarados.
• Los episodios hipoglucémicos graves, con pérdida de consciencia, pueden tratarse con inyección intramuscular o subcutánea de glucagón (0,5 a 1 mg), administrada por una persona entrenada, o bien glucosa por vía intravenosa administrada por un profesional sanitario. Se debe administrar glucosa intravenosa, si el paciente no responde al glucagón en 10-15 minutos. Se recomienda la administración de carbohidratos orales al paciente una vez recuperada la consciencia, a fin de prevenir una recaída.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos utilizados en diabetes. Insulinas y análogos de acción prolongada para inyección. Código ATC: A10AE05.
Mecanismo de acción y efectos farmacodinámicos
Levemir es un análogo de insulina soluble de acción prolongada con una duración de su efecto prolongada que se utiliza como insulina basal.
El efecto hipoglucemiante de Levemir se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas y a que inhibe al mismo tiempo la producción hepática de glucosa.
El perfil de acción de Levemir es menos variable y con ello más predecible, de forma estadísticamente significativa, que el de la insulina NPH (protamina neutra Hagedorn), como se puede ver a partir de los Coeficientes de Variación (CV) intraindividuales del efecto farmacodinámico total y máximo en la Tabla 1.
Tabla 1. Variabilidad intraindividual del perfil de acción de Levemir e insulina NPH
|
Punto final farmacodinámico |
Levemir CV (%) |
Insulina NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
* Área bajo la curva ** Valor p< 0,00 comparaciones con Levemir
de la Velocidad de Infusión de Glucosa para todas las
La acción prolongada de Levemir está mediada por la fuerte autoasociación de las moléculas de la insulina detemir en el lugar de inyección y la unión a la albúmina por medio de la cadena lateral del ácido graso. La insulina detemir se distribuye más lentamente a los tejidos periféricos diana que la insulina NPH. Esta combinación de mecanismos de prolongación proporciona a la insulina detemir una absorción y un perfil de acción más reproducibles que la insulina NPH.
Parámetros Farmacodinámicos para Levemir y NPH
|
Levemir |
NPH | ||||
|
U/kg |
U/kg |
U/kg |
UI/kg | ||
|
Duración de acción (hr) |
12 |
17t |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4t |
1.7 |
1.6 | |
Tvalores estimados
Figura 1. Perfiles de actividad de Levemir en pacientes con diabetes tipo 1.
La duración máxima de la acción es 24 horas, según la dosis, lo cual permite la administración de una o dos dosis diarias. Si Levemir se administra dos veces diarias, la estabilización se produce después de la administración de 2-3 dosis. En el rango de dosificación de 0,2 - 0,4 U/kg, Levemir ejerce más de un 50% de su efecto máximo entre 3 y 4 horas después de la administración y hasta aproximadamente 14 horas después de la administración.
Después de la administración subcutánea se observa una proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de la acción, efecto total).
Se ha demostrado una menor variabilidad diaria en los niveles de glucosa plasmática en ayunas (GPA) durante el tratamiento con Levemir en comparación con el tratamiento con insulina NPH, en ensayos clínicos a largo plazo.
Los ensayos en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con antidiabéticos orales demostraron que el control glucémico (HbA1c) con Levemir es comparable al obtenido con insulina NPH y al obtenido con insulina glargina y está asociado con un menor aumento de peso. Ver Tabla 2. En el ensayo de Levemir frente a insulina glargina, Levemir se administró una o dos veces al día, mientras que la insulina glargina se administró una vez al día y se vio que el 55% de los pacientes tratados con Levemir completaron las 52 semanas de tratamiento con el régimen de administración dos veces al día.
Tabla 2. Cambio en el peso corporal después del tratamiento con insulina
|
Duración del ensayo |
Levemir 1 vez al día |
Levemir 2 veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+ 0,7 kg |
+ 1,6 kg | ||
|
26 semanas |
+ 1,2 kg |
+ 2,8 kg | ||
|
52 semanas |
+ 2,3 kg |
+ 3,7 kg |
+ 4,0 kg |
En ensayos clínicos en los que se ha investigado el uso de antidiabéticos orales, el tratamiento combinado con Levemir dio lugar a un 61-65% de disminución de riesgo de hipoglucemias nocturnas comparado con la insulina NPH.
Se llevó a cabo un ensayo clínico abierto y aleatorizado en pacientes con diabetes tipo 2 que no alcanzaban el objetivo glucémico con antidiabéticos orales. El ensayo comenzó con un periodo de prueba de 12 semanas de tratamiento con liraglutida + metformina, donde el 61% alcanzó una HbA1c < 7%. El 39% restante (pacientes que no alcanzaron el objetivo) fueron aleatorizados para utilizar Levemir una vez al día como tratamiento añadido o continuar con liraglutida + metformina durante 52 semanas. La adición de Levemir dio como resultado una reducción adicional de la HbAic de 7,6% a 7,1% después de 52 semanas. No hubo ningún episodio hipoglucémico grave. Un episodio
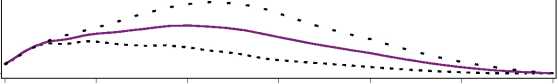
O 4 8 12 16 20 24
Tiempo transcurrido desde la inyección de Insulina (horas) Levemir..... 0.2 U/kg 0.3 U/kg____0.4 U/kg
hipoglucémico grave se define como un episodio en el que el sujeto no es capaz de tratarse a sí mismo con glucagón o en el que es necesario administrarle glucosa intravenosa. Ver tabla 3
|
Tabla 3. Datos del ensayo clínico - Adición ( |
e Levemir a liraglutida + metformina | |||
|
Semana del estudio |
Aleatorizado Levemir + liraglutida + metformina N = 160 |
Aleatorizado Liraglutida + metformina N = 149 |
Valor P | |
|
Media del cambio de la HbA1c desde el nivel basal (%) |
026 semanas |
-0,51 |
+0,02 |
< 0,0001 |
|
052 semanas |
-0,50 |
0,01 |
< 0,0001 | |
|
Proporción de pacientes que alcanzan el objetivo de HbA1c < 7% (%) |
026 semanas |
43,1 |
16,8 |
< 0,0001 |
|
052 semanas |
51,9 |
21,5 |
< 0,0001 | |
|
Cambio en el peso desde el nivel basal (kg) |
026 semanas |
-0,16 |
-0,95 |
0,0283 |
|
052 semanas |
-0,05 |
-1,02 |
0,0416 | |
|
Episodios hipoglucémicos leves (por paciente año) |
026 semanas |
0,286 |
0,029 |
0,0037 |
|
052 semanas |
0,228 |
0,034 |
0,0011 | |
Se realizó un ensayo clínico aleatorizado, doble ciego, de 26 semanas, para investigar la eficacia y seguridad de la adición de liraglutida (1,8 mg) frente a placebo en pacientes con diabetes tipo 2 no controlados adecuadamente con insulina basal, con o sin metformina. La dosis de insulina se redujo en un 20% en los pacientes con HbA1c basal <8,0% con el fin de minimizar el riesgo de hipoglucemia. Posteriormente, a los pacientes se les permitió ajustar su dosis de insulina a un valor no superior al de la dosis de pre-aleatorización. Levemir fue la insulina basal para el 33% (N = 147) de los pacientes (el 97,3% tomando metformina). En estos pacientes, la adición de liraglutida dio lugar a una mayor disminución de la HbA1c en comparación con la adición de placebo (6,93% vs. 8,24%), una mayor disminución de la glucosa plasmática en ayunas (7,20 mmol/l vs. 8,13 mmol/l) y una mayor disminución del peso corporal (-3,47 kg vs. -0,43 kg). Los valores basales de estos parámetros fueron similares en los dos grupos. Las tasas observadas de episodios hipoglucémicos leves fueron similares y no se observaron episodios hipoglucémicos graves en ninguno de los grupos.
En ensayos a largo plazo en pacientes con diabetes tipo 1 en tratamiento con insulina bolo-basal, el control de la glucosa plasmática en ayunas mejoró con Levemir en comparación con insulina NPH. El control glucémico (HbA1c) con Levemir fue comparable al de la insulina NPH, con menor riesgo de hipoglucemia nocturna y sin aumento de peso asociado.
En ensayos clínicos utilizando un régimen de dosificación de insulina bolo/basal, la frecuencia general de hipoglucemias fue similar con Levemir e insulina NPH. Los análisis de hipoglucemia nocturna en pacientes diabéticos tipo 1 mostraron un riesgo significativamente inferior de hipoglucemia nocturna leve (capacidad de autotratamiento y confirmado mediante el valor de glucosa en sangre capilar inferior a 2,8 mmol/l o 3,1 mmol/l si se expresa como glucosa en plasma) al comparar con insulina NPH, mientras que no se observaron diferencias en diabéticos tipo 2.
Con el uso de Levemir se ha observado el desarrollo de anticuerpos. Sin embargo, no parece que este hecho tenga impacto sobre el control glucémico.
Embarazo
Levemir se estudió en un ensayo clínico controlado abierto y aleatorizado, en el que se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid (ver sección 4.6).
El efecto de Levemir no fue inferior al de la insulina NPH usando como criterio de medida la HbA1c en la semana de gestación (SG) 36, y la reducción en la HbA1c media durante el embarazo fue similar con ambas insulinas, ver tabla 4.
Tabla 4. Control glucémico materno
|
Levemir |
NPH |
Diferencia/ Odds Ratio/ Rate Ratio IC 95% | |
|
HbAJc media (%) en SG 36 |
6,27 |
6,33 |
Diferencia: -0,06 [-0,21; 0,08] |
|
GPA media en SG 36 (mmol/l) |
4,76 |
5,41 |
Diferencia: -0,65 [-1,19; -0,12] |
|
Proporción de pacientes que alcanzaron el objetivo de HbAJc < 6% tanto en SG 24 como en SG 36 (%) |
41% |
32% |
Odds Ratio: 1,36 [0,78; 2,37] |
|
Número total de episodios hipoglucémicos graves durante el embarazo (por paciente año) |
1,1 |
1,2 |
Rate Ratio: 0,82 [0,39; 1,75] |
Población pediátrica
Se ha estudiado la eficacia y seguridad de Levemir en adolescentes y niños (n=1045 en total) en tres ensayos clínicos controlados aleatorizados de 12 meses de duración. Los ensayos incluyeron un total de 167 niños de entre 1 y 5 años de edad. Los ensayos demostraron que el control glucémico (HbA1c) obtenido con Levemir es comparable al obtenido con la insulina NPH e insulina degludec cuando se administra en terapia bolo/basal utilizando un margen de no inferioridad del 0,4%. En el ensayo que compara Levemir vs insulina degludec, la tasa de episodios de hiperglucemia con cetosis fue significativamente mayor para Levemir, con 1,09 y 0,68 episodios por paciente/año de exposición respectivamente. Se observó un menor aumento de peso (SD Z-score, peso corregido según el sexo y la edad) con Levemir que con insulina NPH.
El ensayo que incluía niños a partir de 2 años se prolongó durante 12 meses más (datos de un tratamiento de 24 meses en total) para evaluar la formación de anticuerpos después de un tratamiento de larga duración con Levemir. Después de que los anticuerpos frente a insulina aumentaran durante el primer año, estos disminuyeron durante el segundo año hasta llegar a un nivel ligeramente superior al nivel de antes del ensayo. Los resultados indican que el desarrollo de anticuerpos no tuvo un efecto negativo sobre el control glucémico ni sobre la dosis de Levemir.
Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 se han extrapolado de los datos de pacientes niños, adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de Levemir en pacientes adolescentes con diabetes mellitus tipo 2.
5.2 Propiedades farmacocinéticas
Absorción
La concentración máxima en suero se alcanza entre 6 y 8 horas después de la administración.
Si Levemir se administra dos veces diarias, la estabilización de la concentración en suero se alcanza
después de la administración de 2-3 dosis.
La variación intraindividual en la absorción es menor con Levemir que con otros preparados de insulina basal.
La biodisponibilidad absoluta de insulina detemir administrada por vía subcutánea es de aproximadamente un 60%.
Distribución
El volumen de distribución aparente de Levemir (aproximadamente 0,1 l/kg) indica que la fracción de insulina detemir en la sangre circulante es alta.
Los resultados de los estudios de unión a proteínas in vitro e in vivo sugieren que no existe una interacción clínicamente significativa entre la insulina detemir y los ácidos grasos u otras proteínas ligadas a medicamentos.
Metabolismo
La degradación de insulina detemir es similar a la de la insulina humana. Todos los metabolitos formados son inactivos.
Eliminación
La vida media terminal después de la administración subcutánea es determinada por la velocidad de absorción del tejido subcutáneo. La vida media terminal es de 5 a 7 horas según la dosis.
Linealidad
Después de la administración subcutánea en el rango de dosificación terapéutico se observa una proporcionalidad de la dosis en la concentración en suero (concentración máxima, extensión de la absorción).
No se han observado interacciones farmacocinéticas o farmacodinámicas entre liraglutida y Levemir cuando se administra una dosis única de Levemir 0,5 U/kg con liraglutida 1,8 mg en estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas de edad avanzada y jóvenes.
Insuficiencia renal y hepática
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas con insuficiencia renal o hepática y sujetos sanos. Ya que la farmacocinética de Levemir no se ha estudiado extensamente en esta población, se recomienda monitorizar cuidadosamente la glucosa plasmática de estos pacientes.
Sexo
No hay diferencias clínicamente significativas entre sexos en cuanto a las propiedades farmacocinéticas de Levemir.
Población pediátrica
Las propiedades farmacocinéticas de Levemir se han estudiado en niños pequeños (1-5 años), niños (6-12 años) y adolescentes (13-17 años) y se han comparado con adultos con diabetes tipo 1. No hubo diferencias clínicamente significativas en cuanto a las propiedades farmacocinéticas entre niños pequeños, niños, adolescentes y adultos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad para la reproducción y desarrollo. Los datos sobre afinidad del receptor y ensayos in vitro de mitogenicidad no indicaron signos de aumento del potencial mitogénico en comparación con la insulina humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glicerol
Fenol
Metacresol
Acetato de zinc
Fosfato disódico dihidrato
Cloruro sódico
Ácido clorhídrico (para ajuste del pH)
Hidróxido sódico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Levemir pueden provocar la degradación de la insulina detemir, por ejemplo, si el medicamento contiene tioles o sulfitos. Levemir no se debe añadir a los fluidos de perfusión.
Este medicamento no debe ser mezclado con otros medicamentos.
6.3 Período de validez Antes de abrir: 30 meses
Durante su uso o cuando se lleva como repuesto: el producto debe conservarse durante un máximo de 6 semanas.
6.4 Precauciones especiales de conservación
Antes de abrir: conservar en nevera (entre 2°C y 8°C). No guardar cerca del elemento refrigerador. No congelar.
Durante su uso o cuando se lleva como repuesto: conservar por debajo de 30°C. No refrigerar. No congelar.
Conservar Levemir FlexPen con el capuchón puesto para protegerlo de la luz.
Para las condiciones de conservación del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
3 ml de solución en un cartucho (vidrio tipo 1) con un émbolo (bromobutil) y un cierre de goma (bromobutil/poliisopreno) en una pluma precargada, desechable y multidosis hecha de polipropileno.
Envases con 1 (con o sin agujas), 5 (sin agujas) y 10 (sin agujas) plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las agujas y Levemir FlexPen no se deben compartir. El cartucho no se debe rellenar.
No utilice este medicamento si observa que la solución no es transparente, incolora y acuosa.
Si Levemir se ha congelado no debe utilizarse.
Se debe indicar al paciente que deseche la aguja después de cada inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/004
EU/1/04/278/005
EU/1/04/278/006
EU/1/04/278/010
EU/1/04/278/011
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 01 Junio 2004 Fecha de la última renovación: 16 Abril 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 100 unidades de insulina detemir* (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades.
* La insulina detemir se obtiene en Saccharomyces cerevisiae por tecnología de ADN recombinante. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada. InnoLet La solución es transparente, incolora y acuosa.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Levemir está indicado para el tratamiento de diabetes mellitus en adultos, adolescentes y niños de 1 año en adelante.
4.2 Posología y forma de administración
Posología
La potencia de los análogos de insulina, como la insulina detemir, se expresa en unidades, mientras que la potencia de la insulina humana se expresa en unidades internacionales. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
Levemir se puede utilizar solo como insulina basal o en combinación con bolos de insulina. También se puede utilizar en combinación con antidiabéticos orales y/o agonistas del receptor de GLP-1.
Cuando Levemir se utiliza en combinación con antidiabéticos orales o añadido a agonistas del receptor de GLP-1, se recomienda utilizar Levemir una vez al día, inicialmente a dosis de 0,1-0,2 unidades/kg o de 10 unidades en pacientes adultos. La dosis de Levemir se debe ajustar en base a las necesidades individuales del paciente.
Cuando se añade un agonista del receptor de GLP-1 a Levemir, se recomienda reducir la dosis de Levemir en un 20% para minimizar el riesgo de hipoglucemia. Posteriormente, la dosis se debe ajustar individualmente.
Para ajustes individuales de dosis, a continuación se presentan las dos siguientes recomendaciones posológicas para adultos:
Recomendación posológica para adultos con diabetes tipo 1 y tipo 2:
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)*
Ajuste de dosis de Levemir
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 unidades | |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 unidades | |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 unidades | |
|
7,1- 8,0 mmol/l (127-144 mg/dl) |
+ 2 unidades | |
|
6,1- 7,0 mmol/l (109-126 mg/dl) |
+ 2 unidades | |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
No modificar la dosis (objetivo) | |
|
3,1- 4,0 mmol/l (56-72 mg/dl) |
- 2 unidades | |
|
< 3,1 mmol/l (< 56 mg/dl) |
- 4 unidades | |
|
* Glucosa plasmática en los autocontroles Recomendación posológica sencilla para adultos con diabetes tipo 2: | ||
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir | |
|
> 6.1 mmol/l (> 110 mg/dl) |
+3 unidades | |
|
4.4-6.1 mmol/l (80-110 mg/dl) |
No modificar la dosis (objetivo) | |
|
< 4.4 mmol/l (< 80 mg/dl) |
-3 unidades | |
* Glucosa plasmática en los autocontroles
Cuando se utiliza Levemir como parte del régimen de insulina bolo-basal, Levemir se debe administrar una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir se debe ajustar de forma individual.
Puede ser necesario ajustar la dosis si el paciente aumenta su actividad física, cambia su dieta habitual o sufre una enfermedad concomitante.
Cuando se ajusta la dosis para mejorar el control glucémico, se debe advertir a los pacientes que estén atentos a los síntomas de hipoglucemia.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
Levemir se puede utilizar en pacientes de edad avanzada.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes de edad avanzada.
Insuficiencia renal y hepática
La insuficiencia renal o hepática puede reducir el requerimiento de insulina del paciente.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes con insuficiencia renal o hepática.
Población pediátrica
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante (ver sección 5.1). Cuando se cambia desde insulina basal a Levemir, es necesario considerar una reducción de la dosis de insulina basal y bolo de insulina de forma individual, para minimizar el riesgo de hipoglucemia (ver sección 4.4).
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en niños y adolescentes.
No se ha establecido la seguridad y eficacia de Levemir en niños menores de 1 año.
No se dispone de datos.
Cambio desde otras insulinas
Cuando se cambie desde otras insulinas de acción intermedia o prolongada, puede que sea necesario un ajuste de la dosis y hora de administración (ver sección 4.4).
Se recomienda un estricto control glucémico durante el cambio y las primeras semanas después del cambio (ver sección 4.4).
Puede resultar necesario ajustar el tratamiento concomitante con otros antidiabéticos (dosis y/o hora de administración de antidiabéticos orales o insulinas de acción corta/rápida).
Forma de administración
Levemir es un análogo de insulina de acción prolongada utilizado como una insulina basal. Levemir sólo se administra por vía subcutánea. Levemir no se debe administrar por vía intravenosa, ya que puede provocar una hipoglucemia grave. También debe evitarse la administración intramuscular. Levemir no debe utilizarse en bombas de perfusión de insulina.
Levemir se administra por vía subcutánea mediante inyección en la pared abdominal, el muslo, la zona superior del brazo o la región deltoidea o glútea. Siempre se debe rotar el punto de inyección dentro de la misma zona para reducir el riesgo de lipodistrofia. La duración de la acción variará según la dosis, el lugar de inyección, el flujo sanguíneo, la temperatura y el nivel de la actividad física. Se puede administrar la inyección a cualquier hora del día, pero todos los días a la misma hora. Para los pacientes que requieren dosificación dos veces al día para optimizar el control glucémico, la dosis de la tarde puede administrarse por la tarde o al acostarse.
Administración con Innolet
Levemir InnoLet es una pluma precargada diseñada para ser utilizada con las agujas desechables NovoFine o NovoTwist de una longitud de hasta 8 mm. Con InnoLet se pueden seleccionar dosis de 1 a 50 unidades, en incrementos de 1 unidad.
Levemir InnoLet se acompaña de un prospecto que detalla las instrucciones de uso a seguir.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes (ver sección 6.1).
4.4 Advertencias y precauciones especiales de empleo
El paciente debe consultar a su médico antes de viajar a diferentes zonas horarias ya que esto podría suponer que el paciente tenga que utilizar la insulina y comer a horas distintas.
Hiperglucemia
La dosificación inadecuada o la interrupción del tratamiento, especialmente en diabetes tipo 1, puede ocasionar hiperglucemia y cetoacidosis diabética. Los primeros síntomas de hiperglucemia generalmente aparecen de forma gradual, a lo largo de un período de horas o días. Estos incluyen sed, aumento de la frecuencia de micción, náuseas, vómitos, somnolencia, piel seca y enrojecida, sequedad de boca, pérdida de apetito así como aliento con olor a acetona. En diabetes tipo 1, los acontecimientos hiperglucémicos no tratados pueden dar lugar a cetoacidosis diabética la cual es potencialmente letal.
Hipoglucemia
La omisión de una comida o el ejercicio físico intenso no previsto pueden producir hipoglucemia.
En niños, se debe tener cuidado para ajustar las dosis de insulina (especialmente en regímenes de bolo-basal) con la ingesta de alimentos y la actividad física, con el fin de minimizar el riesgo de hipoglucemia.
Puede producirse una hipoglucemia si la dosis de insulina es demasiado alta en comparación con el requerimiento de insulina. En caso de hipoglucemia o sospecha de hipoglucemia no debe inyectarse
Levemir. Debe considerarse un ajuste de dosis una vez se haya estabilizado la glucosa en sangre del paciente (ver secciones 4.8 y 4.9).
Los pacientes cuyo control glucémico mejora en gran medida, por ejemplo, por medio de terapia insulínica intensiva, pueden experimentar un cambio en sus síntomas usuales de aviso de hipoglucemia y deben ser avisados de esta posibilidad. Los síntomas de aviso habituales pueden desaparecer en los pacientes con diabetes de larga duración.
Las enfermedades concomitantes, especialmente las infecciones y situaciones febriles, por regla general aumentan el requerimiento de insulina del paciente. Enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, pituitaria o tiroidea, pueden requerir un cambio en la dosis de insulina.
Cuando los pacientes cambian a un tipo de insulina diferente, los síntomas iniciales de aviso de hipoglucemia pueden cambiar o ser menos pronunciados que aquéllos experimentados con su anterior insulina.
Cambio desde otras insulinas
El cambio de un paciente a otro tipo o marca de insulina se debe realizar bajo estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (insulina animal, insulina humana o análogo de insulina) y/o método de fabricación (insulina ADN recombinante versus insulina de origen animal) pueden hacer que sea necesario un cambio en la dosis. Los pacientes que han cambiado otra insulina por Levemir pueden necesitar un cambio en la dosis en comparación con la dosis utilizada con sus insulinas habituales. Si es necesario un ajuste, éste se puede realizar con la primera dosis o durante las primeras semanas o meses.
Reacciones en el lugar de inyección
Como con cualquier terapia insulínica, pueden producirse reacciones en el lugar de inyección que incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor. La continua rotación de la zona de inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones normalmente desaparecen en unos pocos días o unas pocas semanas. En raras ocasiones, las reacciones en la zona de inyección pueden requerir la interrupción de Levemir.
Hipoalbum inemia.
Los datos existentes sobre pacientes con hipoalbuminemia grave son limitados. Se recomienda monitorizar cuidadosamente a estos pacientes.
Combinación de Levemir y pioglitazona
Cuando pioglitazona fue utilizada en combinación con insulina, se notificaron casos de insuficiencia cardiaca, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca. Esto debe tenerse en cuenta si se considera el tratamiento combinado de pioglitazona y Levemir. Si se utiliza esta combinación, se debe vigilar en los pacientes la aparición de signos y síntomas de insuficiencia cardiaca, ganancia de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si tiene lugar cualquier deterioro de los síntomas cardiacos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se sabe que ciertos medicamentos interaccionan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
Antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de la monoamino oxidasa (IMAO), betabloqueantes, inhibidores de la enzima conversora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los betabloqueantes pueden enmascarar los síntomas de hipoglucemia.
Octreotida y lanreotida pueden aumentar o reducir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucemiante de la insulina.
4.6 Fertilidad, embarazo y lactancia Embarazo
Se puede considerar el tratamiento con Levemir durante el embarazo, pero se debe evaluar el beneficio potencial frente a la posibilidad de que aumente el riesgo de un resultado adverso en el embarazo.
En general, se recomienda intensificar el control de la glucemia y la monitorización de mujeres embarazadas con diabetes durante todo el embarazo y cuando se planifica el mismo. Los requerimientos de insulina generalmente disminuyen en el primer trimestre del embarazo y aumentan posteriormente durante el segundo y tercer trimestre. Normalmente después del parto, los requerimientos de insulina vuelven rápidamente a los niveles previos al embarazo.
En un ensayo clínico controlado abierto y aleatorizado, se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid. El objetivo principal de este ensayo era el evaluar el efecto de Levemir en la regulación de la glucosa en sangre en mujeres embarazadas con diabetes (ver sección 5.1).
La tasa total de acontecimientos adversos maternos fue similar en los grupos tratados con Levemir e insulina NPH, sin embargo, se observó una frecuencia numéricamente superior de acontecimientos adversos graves en las madres (61 (40%) vs. 49 (31%)) y en los recién nacidos (36 (24%) vs. 32 (20%)) con Levemir comparado con la insuina NPH. El número de niños nacidos vivos de mujeres que quedaron embarazadas después de la aleatorización fue de 50 (83%) con Levemir y de 55 (89%) con NPH. La frecuencia de malformaciones congenitas fue de 4 (5%) con Levemir y 11 (7%) con NPH, siendo 3 (4%) malformaciones graves con Levemir y 3 (2%) con NPH.
Los 250 resultados adicionales obtenidos de los datos de poscomercialización de mujeres embarazadas expuestas a Levemir, indican que la insulina detemir no produce efectos adversos en el embarazo ni malformaciones ni toxicidad fetal/neonatal.
Los datos en animales no indican toxicidad reproductiva (ver sección 5.3).
Lactancia
Se desconoce si la insulina detemir se excreta en la leche materna. No se prevén efectos metabólicos de la insulina detemir ingerida sobre el recién nacido/lactante ya que la insulina detemir, al ser un péptido, se descompone en aminoácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia pueden necesitar un ajuste en la dosis de insulina y en la dieta.
Fertilidad
Los estudios en animales no revelan efectos perjudiciales relativos a la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen un estado especial de alerta (por ej. conducir un coche o utilizar máquinas).
Debe advertirse a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de una hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se considerará la conveniencia de conducir en estas circunstancias.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
Las reacciones adversas observadas en pacientes que usan Levemir se deben principalmente al efecto farmacológico de la insulina. Se estima que en general un 12% de los pacientes tratados experimentan reacciones adversas.
La hipoglucemia es la reacción adversa notificada más frecuentemente durante el tratamiento, ver sección c más abajo.
De las investigaciones clínicas se sabe que la hipoglucemia grave, definida como la necesidad de asistencia en el tratamiento, ocurre en aproximadamente un 6% de los pacientes tratados con Levemir.
Las reacciones en el lugar de inyección se han visto con más frecuencia durante el tratamiento con Levemir que con la insulina humana. Estas reacciones incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor en el lugar de inyección. La mayoría de las reacciones en la zona de inyección son menores y de naturaleza transitoria, es decir, que suelen desaparecer al continuar el tratamiento normalmente en unos pocos días o en pocas semanas.
Al iniciar el tratamiento con insulina pueden aparecer anomalías en la refracción y edema; estas reacciones son generalmente de carácter transitorio. Una rápida mejoría del control de la glucosa en sangre puede estar asociada a una neuropatía dolorosa aguda, que normalmente es reversible. Una intensificación de la terapia insulínica que produzca una repentina mejoría del control glucémico puede estar asociada a un empeoramiento temporal de la retinopatía diabética, mientras que un buen control glucémico prolongado disminuye el riesgo de progresión de la retinopatía diabética.
b. Tabla de efectos adversos
Los efectos adversos enumerados a continuación están basados en los datos de los ensayos clínicos y se clasifican de acuerdo a su frecuencia y a la clasificación por órganos y sistemas.
Las categorías de frecuencias vienen definidas por la siguiente convención: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); rara (> 1/10.000 a < 1/1.000); muy rara (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos del sistema inmunológico |
Poco frecuente - Reacciones alérgicas, reacciones alérgicas potenciales, urticaria, exantema y erupciones* |
|
Muy rara - Reacciones anafilácticas* | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuente - Hipoglucemia* |
|
Trastornos del sistema nervioso |
Rara - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos oculares |
Poco frecuente - Trastornos de la refracción |
|
Poco frecuente - Retinopatía diabética |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuente - Lipodistrofia* |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente - Reacciones en la zona de inyección |
|
Poco frecuente - Edema |
* ver sección c.
c. Descripción de los efectos adversos señalados
Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones Las reacciones alérgicas, las reacciones potencialmente alérgicas, la urticaria, el exantema y las erupciones son poco frecuentes cuando Levemir se usa en régimen bolo-basal. Sin embargo tres ensayos clínicos han demostrado que, cuando se usa en combinación con antidiabéticos orales, se puede definir como frecuente (se ha observado un 2,2% de reacciones alérgicas y reacciones potencialmente alérgicas)
Reacciones anafilácticas
La aparición de reacciones de hipersensibilidad generalizada (que incluyen exantema cutáneo generalizado, prurito, sudor, molestias gastrointestinales, edema angioneurótico, dificultad en la respiración, palpitaciones e hipotensión) es muy rara pero éstas pueden ser potencialmente mortales.
Hipoglucemia
El efecto adverso notificado con mayor frecuencia es hipoglucemia. Puede aparecer si la dosis de insulina es demasiado alta en relación al requerimiento de insulina. Una hipoglucemia grave puede producir un estado de inconsciencia y/o convulsiones y puede dar lugar a una insuficiencia cerebral temporal o permanente o incluso la muerte. Los síntomas de hipoglucemia por lo general aparecen de forma repentina. Pueden incluir sudor frío, piel fría y pálida, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad no habitual, confusión, dificultad para concentrarse, mareo, apetito excesivo, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia
Puede aparecer lipodistrofia (incluidas lipohipertrofia y lipoatrofia) en el lugar de la inyección. La continua rotación del lugar de inyección dentro de un área concreta de inyección reduce el riesgo de desarrollar estas reacciones.
d. Población pediátrica
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en la población pediátrica no muestran ninguna diferencia con la población diabética general, en la cual existe una mayor experiencia.
e. Otras poblaciones especiales
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en los pacientes de edad avanzada y en los pacientes con insuficiencia renal o hepática no muestran ninguna diferencia con la población general, en la cual existe una mayor experiencia.
f. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No es posible fijar definiciones específicas relativas a la sobredosificación de las insulinas, sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si el paciente recibe una dosis superior a sus requerimientos:
• Los episodios hipoglucémicos leves se pueden tratar con administración oral de glucosa o productos azucarados. Por consiguiente se recomienda que los pacientes diabéticos lleven siempre productos azucarados.
• Los episodios hipoglucémicos graves, con pérdida de consciencia, pueden tratarse con inyección intramuscular o subcutánea de glucagón (0,5 a 1 mg), administrada por una persona entrenada, o bien glucosa por vía intravenosa administrada por un profesional sanitario. Se debe administrar glucosa intravenosa, si el paciente no responde al glucagón en 10-15 minutos. Se recomienda la administración de carbohidratos orales al paciente una vez recuperada la consciencia, a fin de prevenir una recaída.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos utilizados en diabetes. Insulinas y análogos de acción prolongada para inyección. Código ATC: A10AE05.
Mecanismo de acción y efectos farmacodinámicos
Levemir es un análogo de insulina soluble de acción prolongada con una duración de su efecto prolongada que se utiliza como insulina basal.
El efecto hipoglucemiante de Levemir se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas y a que inhibe al mismo tiempo la producción hepática de glucosa.
El perfil de acción de Levemir es menos variable y con ello más predecible, de forma estadísticamente significativa, que el de la insulina NPH (protamina neutra Hagedorn), como se puede ver a partir de los Coeficientes de Variación (CV) intraindividuales del efecto farmacodinámico total y máximo en la Tabla 1.
Tabla 1. Variabilidad intraindividual del perfil de acción de Levemir e insulina NPH
|
Punto final farmacodinámico |
Levemir CV (%) |
Insulina NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
* Área bajo la curva ** Valor p< 0,00 comparaciones con Levemir
de la Velocidad de Infusión de Glucosa para todas las
La acción prolongada de Levemir está mediada por la fuerte autoasociación de las moléculas de la insulina detemir en el lugar de inyección y la unión a la albúmina por medio de la cadena lateral del ácido graso. La insulina detemir se distribuye más lentamente a los tejidos periféricos diana que la insulina NPH. Esta combinación de mecanismos de prolongación proporciona a la insulina detemir una absorción y un perfil de acción más reproducibles que la insulina NPH.
Parámetros Farmacodinámicos para Levemir y NPH
|
Levemir |
NPH | ||||
|
U/kg |
U/kg |
U/kg |
UI/kg | ||
|
Duración de acción (hr) |
12 |
17t |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4t |
1.7 |
1.6 | |
Tvalores estimados
Figura 1. Perfiles de actividad de Levemir en pacientes con diabetes tipo 1.
La duración máxima de la acción es 24 horas, según la dosis, lo cual permite la administración de una o dos dosis diarias. Si Levemir se administra dos veces diarias, la estabilización se produce después de la administración de 2-3 dosis. En el rango de dosificación de 0,2 - 0,4 U/kg, Levemir ejerce más de un 50% de su efecto máximo entre 3 y 4 horas después de la administración y hasta aproximadamente 14 horas después de la administración.
Después de la administración subcutánea se observa una proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de la acción, efecto total).
Se ha demostrado una menor variabilidad diaria en los niveles de glucosa plasmática en ayunas (GPA) durante el tratamiento con Levemir en comparación con el tratamiento con insulina NPH, en ensayos clínicos a largo plazo.
Los ensayos en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con antidiabéticos orales demostraron que el control glucémico (HbA1c) con Levemir es comparable al obtenido con insulina NPH y al obtenido con insulina glargina y está asociado con un menor aumento de peso. Ver Tabla 2. En el ensayo de Levemir frente a insulina glargina, Levemir se administró una o dos veces al día, mientras que la insulina glargina se administró una vez al día y se vio que el 55% de los pacientes tratados con Levemir completaron las 52 semanas de tratamiento con el régimen de administración dos veces al día.
Tabla 2. Cambio en el peso corporal después del tratamiento con insulina
|
Duración del ensayo |
Levemir 1 vez al día |
Levemir 2 veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+ 0,7 kg |
+ 1,6 kg | ||
|
26 semanas |
+ 1,2 kg |
+ 2,8 kg | ||
|
52 semanas |
+ 2,3 kg |
+ 3,7 kg |
+ 4,0 kg |
En ensayos clínicos en los que se ha investigado el uso de antidiabéticos orales, el tratamiento combinado con Levemir dio lugar a un 61-65% de disminución de riesgo de hipoglucemias nocturnas comparado con la insulina NPH.
Se llevó a cabo un ensayo clínico abierto y aleatorizado en pacientes con diabetes tipo 2 que no alcanzaban el objetivo glucémico con antidiabéticos orales. El ensayo comenzó con un periodo de prueba de 12 semanas de tratamiento con liraglutida + metformina, donde el 61% alcanzó una HbA1c < 7%. El 39% restante (pacientes que no alcanzaron el objetivo) fueron aleatorizados para utilizar Levemir una vez al día como tratamiento añadido o continuar con liraglutida + metformina durante 52 semanas. La adición de Levemir dio como resultado una reducción adicional de la HbAic de 7,6% a 7,1% después de 52 semanas. No hubo ningún episodio hipoglucémico grave. Un episodio
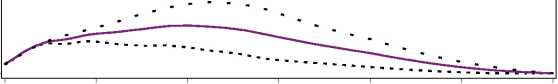
O 4 8 12 16 20 24
Tiempo transcurrido desde la inyección de Insulina (horas) Levemir..... 0.2 U/kg 0.3 U/kg____0.4 U/kg
hipoglucémico grave se define como un episodio en el que el sujeto no es capaz de tratarse a sí mismo con glucagón o en el que es necesario administrarle glucosa intravenosa. Ver tabla 3
|
Tabla 3. Datos del ensayo clínico - Adición ( |
e Levemir a liraglutida + metformina | |||
|
Semana del estudio |
Aleatorizado Levemir + liraglutida + metformina N = 160 |
Aleatorizado Liraglutida + metformina N = 149 |
Valor P | |
|
Media del cambio de la HbA1c desde el nivel basal (%) |
026 semanas |
-0,51 |
+0,02 |
< 0,0001 |
|
052 semanas |
-0,50 |
0,01 |
< 0,0001 | |
|
Proporción de pacientes que alcanzan el objetivo de HbA1c < 7% (%) |
026 semanas |
43,1 |
16,8 |
< 0,0001 |
|
052 semanas |
51,9 |
21,5 |
< 0,0001 | |
|
Cambio en el peso desde el nivel basal (kg) |
026 semanas |
-0,16 |
-0,95 |
0,0283 |
|
052 semanas |
-0,05 |
-1,02 |
0,0416 | |
|
Episodios hipoglucémicos leves (por paciente año) |
026 semanas |
0,286 |
0,029 |
0,0037 |
|
052 semanas |
0,228 |
0,034 |
0,0011 | |
Se realizó un ensayo clínico aleatorizado, doble ciego, de 26 semanas, para investigar la eficacia y seguridad de la adición de liraglutida (1,8 mg) frente a placebo en pacientes con diabetes tipo 2 no controlados adecuadamente con insulina basal, con o sin metformina. La dosis de insulina se redujo en un 20% en los pacientes con HbA1c basal <8,0% con el fin de minimizar el riesgo de hipoglucemia. Posteriormente, a los pacientes se les permitió ajustar su dosis de insulina a un valor no superior al de la dosis de pre-aleatorización. Levemir fue la insulina basal para el 33% (N = 147) de los pacientes (el 97,3% tomando metformina). En estos pacientes, la adición de liraglutida dio lugar a una mayor disminución de la HbA1c en comparación con la adición de placebo (6,93% vs. 8,24%), una mayor disminución de la glucosa plasmática en ayunas (7,20 mmol/l vs. 8,13 mmol/l) y una mayor disminución del peso corporal (-3,47 kg vs. -0,43 kg). Los valores basales de estos parámetros fueron similares en los dos grupos. Las tasas observadas de episodios hipoglucémicos leves fueron similares y no se observaron episodios hipoglucémicos graves en ninguno de los grupos.
En ensayos a largo plazo en pacientes con diabetes tipo 1 en tratamiento con insulina bolo-basal, el control de la glucosa plasmática en ayunas mejoró con Levemir en comparación con insulina NPH. El control glucémico (HbA1c) con Levemir fue comparable al de la insulina NPH, con menor riesgo de hipoglucemia nocturna y sin aumento de peso asociado.
En ensayos clínicos utilizando un régimen de dosificación de insulina bolo/basal, la frecuencia general de hipoglucemias fue similar con Levemir e insulina NPH. Los análisis de hipoglucemia nocturna en pacientes diabéticos tipo 1 mostraron un riesgo significativamente inferior de hipoglucemia nocturna leve (capacidad de autotratamiento y confirmado mediante el valor de glucosa en sangre capilar inferior a 2,8 mmol/l o 3,1 mmol/l si se expresa como glucosa en plasma) al comparar con insulina NPH, mientras que no se observaron diferencias en diabéticos tipo 2.
Con el uso de Levemir se ha observado el desarrollo de anticuerpos. Sin embargo, no parece que este hecho tenga impacto sobre el control glucémico.
Embarazo
Levemir se estudió en un ensayo clínico controlado abierto y aleatorizado, en el que se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid (ver sección 4.6).
El efecto de Levemir no fue inferior al de la insulina NPH usando como criterio de medida la HbA1c en la semana de gestación (SG) 36, y la reducción en la HbA1c media durante el embarazo fue similar con ambas insulinas, ver tabla 4.
Tabla 4. Control glucémico materno
|
Levemir |
NPH |
Diferencia/ Odds Ratio/ Rate Ratio IC 95% | |
|
HbAJc media (%) en SG 36 |
6,27 |
6,33 |
Diferencia: -0,06 [-0,21; 0,08] |
|
GPA media en SG 36 (mmol/l) |
4,76 |
5,41 |
Diferencia: -0,65 [-1,19; -0,12] |
|
Proporción de pacientes que alcanzaron el objetivo de HbAJc < 6% tanto en SG 24 como en SG 36 (%) |
41% |
32% |
Odds Ratio: 1,36 [0,78; 2,37] |
|
Número total de episodios hipoglucémicos graves durante el embarazo (por paciente año) |
1,1 |
1,2 |
Rate Ratio: 0,82 [0,39; 1,75] |
Población pediátrica
Se ha estudiado la eficacia y seguridad de Levemir en adolescentes y niños (n=1045 en total) en tres ensayos clínicos controlados aleatorizados de 12 meses de duración. Los ensayos incluyeron un total de 167 niños de entre 1 y 5 años de edad. Los ensayos demostraron que el control glucémico (HbA1c) obtenido con Levemir es comparable al obtenido con la insulina NPH e insulina degludec cuando se administra en terapia bolo/basal utilizando un margen de no inferioridad del 0,4%. En el ensayo que compara Levemir vs insulina degludec, la tasa de episodios de hiperglucemia con cetosis fue significativamente mayor para Levemir, con 1,09 y 0,68 episodios por paciente/año de exposición respectivamente. Se observó un menor aumento de peso (SD Z-score, peso corregido según el sexo y la edad) con Levemir que con insulina NPH.
El ensayo que incluía niños a partir de 2 años se prolongó durante 12 meses más (datos de un tratamiento de 24 meses en total) para evaluar la formación de anticuerpos después de un tratamiento de larga duración con Levemir. Después de que los anticuerpos frente a insulina aumentaran durante el primer año, estos disminuyeron durante el segundo año hasta llegar a un nivel ligeramente superior al nivel de antes del ensayo. Los resultados indican que el desarrollo de anticuerpos no tuvo un efecto negativo sobre el control glucémico ni sobre la dosis de Levemir.
Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 se han extrapolado de los datos de pacientes niños, adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de Levemir en pacientes adolescentes con diabetes mellitus tipo 2.
5.2 Propiedades farmacocinéticas
Absorción
La concentración máxima en suero se alcanza entre 6 y 8 horas después de la administración.
Si Levemir se administra dos veces diarias, la estabilización de la concentración en suero se alcanza
después de la administración de 2-3 dosis.
La variación intraindividual en la absorción es menor con Levemir que con otros preparados de insulina basal.
La biodisponibilidad absoluta de insulina detemir administrada por vía subcutánea es de aproximadamente un 60%.
Distribución
El volumen de distribución aparente de Levemir (aproximadamente 0,1 l/kg) indica que la fracción de insulina detemir en la sangre circulante es alta.
Los resultados de los estudios de unión a proteínas in vitro e in vivo sugieren que no existe una interacción clínicamente significativa entre la insulina detemir y los ácidos grasos u otras proteínas ligadas a medicamentos.
Metabolismo
La degradación de insulina detemir es similar a la de la insulina humana. Todos los metabolitos formados son inactivos.
Eliminación
La vida media terminal después de la administración subcutánea es determinada por la velocidad de absorción del tejido subcutáneo. La vida media terminal es de 5 a 7 horas según la dosis.
Linealidad
Después de la administración subcutánea en el rango de dosificación terapéutico se observa una proporcionalidad de la dosis en la concentración en suero (concentración máxima, extensión de la absorción).
No se han observado interacciones farmacocinéticas o farmacodinámicas entre liraglutida y Levemir cuando se administra una dosis única de Levemir 0,5 U/kg con liraglutida 1,8 mg en estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas de edad avanzada y jóvenes.
Insuficiencia renal y hepática
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas con insuficiencia renal o hepática y sujetos sanos. Ya que la farmacocinética de Levemir no se ha estudiado extensamente en esta población, se recomienda monitorizar cuidadosamente la glucosa plasmática de estos pacientes.
Sexo
No hay diferencias clínicamente significativas entre sexos en cuanto a las propiedades farmacocinéticas de Levemir.
Población pediátrica
Las propiedades farmacocinéticas de Levemir se han estudiado en niños pequeños (1-5 años), niños (6-12 años) y adolescentes (13-17 años) y se han comparado con adultos con diabetes tipo 1. No hubo diferencias clínicamente significativas en cuanto a las propiedades farmacocinéticas entre niños pequeños, niños, adolescentes y adultos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad para la reproducción y desarrollo. Los datos sobre afinidad del receptor y ensayos in vitro de mitogenicidad no indicaron signos de aumento del potencial mitogénico en comparación con la insulina humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glicerol
Fenol
Metacresol
Acetato de zinc
Fosfato disódico dihidrato
Cloruro sódico
Ácido clorhídrico (para ajuste del pH)
Hidróxido sódico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Levemir pueden provocar la degradación de la insulina detemir, por ejemplo, si el medicamento contiene tioles o sulfitos. Levemir no se debe añadir a los fluidos de perfusión.
Este medicamento no debe ser mezclado con otros medicamentos.
6.3 Período de validez Antes de abrir: 30 meses
Durante su uso o cuando se lleva como repuesto: el producto debe conservarse durante un máximo de 6 semanas.
6.4 Precauciones especiales de conservación
Antes de abrir: conservar en nevera (entre 2°C y 8°C). No guardar cerca del elemento refrigerador. No congelar.
Durante su uso o cuando se lleva como repuesto: conservar por debajo de 30°C. No refrigerar. No congelar.
Conservar Levemir InnoLet con el capuchón puesto para protegerlo de la luz.
Para las condiciones de conservación del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
3 ml de solución en un cartucho (vidrio tipo 1) con un émbolo (bromobutil) y un cierre de goma (bromobutil/poliisopreno) en una pluma precargada, desechable y multidosis hecha de polipropileno.
Envases con 1, 5 y 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las agujas y Levemir InnoLet no se deben compartir. El cartucho no se debe rellenar.
No utilice este medicamento si observa que la solución no es transparente, incolora y acuosa.
Si Levemir se ha congelado no debe utilizarse.
Se debe indicar al paciente que deseche la aguja después de cada inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/007
EU/1/04/278/008
EU/1/04/278/009
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 01 Junio 2004 Fecha de la última renovación: 16 Abril 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 100 unidades de insulina detemir* (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades.
* La insulina detemir se obtiene en Saccharomyces cerevisiae por tecnología de ADN recombinante. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada. FlexTouch La solución es transparente, incolora y acuosa.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Levemir está indicado para el tratamiento de diabetes mellitus en adultos, adolescentes y niños de 1 año en adelante.
4.2 Posología y forma de administración
Posología
La potencia de los análogos de insulina, como la insulina detemir, se expresa en unidades, mientras que la potencia de la insulina humana se expresa en unidades internacionales. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
Levemir se puede utilizar solo como insulina basal o en combinación con bolos de insulina. También se puede utilizar en combinación con antidiabéticos orales y/o agonistas del receptor de GLP-1.
Cuando Levemir se utiliza en combinación con antidiabéticos orales o añadido a agonistas del receptor de GLP-1, se recomienda utilizar Levemir una vez al día, inicialmente a dosis de 0,1-0,2 unidades/kg o de 10 unidades en pacientes adultos. La dosis de Levemir se debe ajustar en base a las necesidades individuales del paciente.
Cuando se añade un agonista del receptor de GLP-1 a Levemir, se recomienda reducir la dosis de Levemir en un 20% para minimizar el riesgo de hipoglucemia. Posteriormente, la dosis se debe ajustar individualmente.
Para ajustes individuales de dosis, a continuación se presentan las dos siguientes recomendaciones posológicas para adultos:
Recomendación posológica para adultos con diabetes tipo 1 y tipo 2:
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir |
|
> 10,0 mmol/l (180 mg/dl) |
+ 8 unidades |
|
9,1-10,0 mmol/l (163-180 mg/dl) |
+ 6 unidades | |
|
8,1 -9,0 mmol/l (145-162 mg/dl) |
+ 4 unidades | |
|
7,1- 8,0 mmol/l (127-144 mg/dl) |
+ 2 unidades | |
|
6,1- 7,0 mmol/l (109-126 mg/dl) |
+ 2 unidades | |
|
4,1-6,0 mmol/l (73-108 mg/dl) |
No modificar la dosis (objetivo) | |
|
3,1- 4,0 mmol/l (56-72 mg/dl) |
- 2 unidades | |
|
< 3,1 mmol/l (< 56 mg/dl) |
- 4 unidades | |
|
* Glucosa plasmática en los autocontroles Recomendación posológica sencilla para adultos con diabetes tipo 2: | ||
|
Valor medio de los autocontroles de la glucemia antes del desayuno (SMPG)* |
Ajuste de dosis de Levemir | |
|
> 6.1 mmol/l (> 110 mg/dl) |
+3 unidades | |
|
4.4-6.1 mmol/l (80-110 mg/dl) |
No modificar la dosis (objetivo) | |
|
< 4.4 mmol/l (< 80 mg/dl) |
-3 unidades | |
* Glucosa plasmática en los autocontroles
Cuando se utiliza Levemir como parte del régimen de insulina bolo-basal, Levemir se debe administrar una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir se debe ajustar de forma individual.
Puede ser necesario ajustar la dosis si el paciente aumenta su actividad física, cambia su dieta habitual o sufre una enfermedad concomitante.
Cuando se ajusta la dosis para mejorar el control glucémico, se debe advertir a los pacientes que estén atentos a los síntomas de hipoglucemia.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
Levemir se puede utilizar en pacientes de edad avanzada.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes de edad avanzada.
Insuficiencia renal y hepática
La insuficiencia renal o hepática puede reducir el requerimiento de insulina del paciente.
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en pacientes con insuficiencia renal o hepática.
Población pediátrica
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante (ver sección 5.1). Cuando se cambia desde insulina basal a Levemir, es necesario considerar una reducción de la dosis de insulina basal y bolo de insulina de forma individual, para minimizar el riesgo de hipoglucemia (ver sección 4.4).
Es necesario intensificar el control glucémico y ajustar individualmente la dosis de Levemir en niños y adolescentes.
No se ha establecido la seguridad y eficacia de Levemir en niños menores de 1 año.
No se dispone de datos.
Cambio desde otras insulinas
Cuando se cambie desde otras insulinas de acción intermedia o prolongada, puede que sea necesario un ajuste de la dosis y hora de administración (ver sección 4.4).
Se recomienda un estricto control glucémico durante el cambio y las primeras semanas después del cambio (ver sección 4.4).
Puede resultar necesario ajustar el tratamiento concomitante con otros antidiabéticos (dosis y/o hora de administración de antidiabéticos orales o insulinas de acción corta/rápida).
Forma de administración
Levemir es un análogo de insulina de acción prolongada utilizado como una insulina basal. Levemir sólo se administra por vía subcutánea. Levemir no se debe administrar por vía intravenosa, ya que puede provocar una hipoglucemia grave. También debe evitarse la administración intramuscular. Levemir no debe utilizarse en bombas de perfusión de insulina.
Levemir se administra por vía subcutánea mediante inyección en la pared abdominal, el muslo, la zona superior del brazo o la región deltoidea o glútea. Siempre se debe rotar el punto de inyección dentro de la misma zona para reducir el riesgo de lipodistrofia. La duración de la acción variará según la dosis, el lugar de inyección, el flujo sanguíneo, la temperatura y el nivel de la actividad física. Se puede administrar la inyección a cualquier hora del día, pero todos los días a la misma hora. Para los pacientes que requieren dosificación dos veces al día para optimizar el control glucémico, la dosis de la tarde puede administrarse por la tarde o al acostarse.
Administración con FlexTouch
Levemir FlexTouch es una pluma precargada diseñada para ser utilizada con las agujas desechables NovoFine o NovoTwist de una longitud de hasta 8 mm. Con FlexTouch se pueden seleccionar dosis de 1 a 80 unidades, en incrementos de 1 unidad.
Levemir FlexTouch sigue un código de colores y se acompaña de un prospecto que detalla las instrucciones de uso a seguir.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes (ver sección 6.1).
4.4 Advertencias y precauciones especiales de empleo
El paciente debe consultar a su médico antes de viajar a diferentes zonas horarias ya que esto podría suponer que el paciente tenga que utilizar la insulina y comer a horas distintas.
Hiperglucemia
La dosificación inadecuada o la interrupción del tratamiento, especialmente en diabetes tipo 1, puede ocasionar hiperglucemia y cetoacidosis diabética. Los primeros síntomas de hiperglucemia generalmente aparecen de forma gradual, a lo largo de un período de horas o días. Estos incluyen sed, aumento de la frecuencia de micción, náuseas, vómitos, somnolencia, piel seca y enrojecida, sequedad de boca, pérdida de apetito así como aliento con olor a acetona. En diabetes tipo 1, los acontecimientos hiperglucémicos no tratados pueden dar lugar a cetoacidosis diabética la cual es potencialmente letal.
Hipoglucemia
La omisión de una comida o el ejercicio físico intenso no previsto pueden producir hipoglucemia.
En niños, se debe tener cuidado para ajustar las dosis de insulina (especialmente en regímenes de bolo-basal) con la ingesta de alimentos y la actividad física, con el fin de minimizar el riesgo de hipoglucemia.
Puede producirse una hipoglucemia si la dosis de insulina es demasiado alta en comparación con el requerimiento de insulina. En caso de hipoglucemia o sospecha de hipoglucemia no debe inyectarse
Levemir. Debe considerarse un ajuste de dosis una vez se haya estabilizado la glucosa en sangre del paciente (ver secciones 4.8 y 4.9).
Los pacientes cuyo control glucémico mejora en gran medida, por ejemplo, por medio de terapia insulínica intensiva, pueden experimentar un cambio en sus síntomas usuales de aviso de hipoglucemia y deben ser avisados de esta posibilidad. Los síntomas de aviso habituales pueden desaparecer en los pacientes con diabetes de larga duración.
Las enfermedades concomitantes, especialmente las infecciones y situaciones febriles, por regla general aumentan el requerimiento de insulina del paciente. Enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, pituitaria o tiroidea, pueden requerir un cambio en la dosis de insulina.
Cuando los pacientes cambian a un tipo de insulina diferente, los síntomas iniciales de aviso de hipoglucemia pueden cambiar o ser menos pronunciados que aquéllos experimentados con su anterior insulina.
Cambio desde otras insulinas
El cambio de un paciente a otro tipo o marca de insulina se debe realizar bajo estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (insulina animal, insulina humana o análogo de insulina) y/o método de fabricación (insulina ADN recombinante versus insulina de origen animal) pueden hacer que sea necesario un cambio en la dosis. Los pacientes que han cambiado otra insulina por Levemir pueden necesitar un cambio en la dosis en comparación con la dosis utilizada con sus insulinas habituales. Si es necesario un ajuste, éste se puede realizar con la primera dosis o durante las primeras semanas o meses.
Reacciones en el lugar de inyección
Como con cualquier terapia insulínica, pueden producirse reacciones en el lugar de inyección que incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor. La continua rotación de la zona de inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones normalmente desaparecen en unos pocos días o unas pocas semanas. En raras ocasiones, las reacciones en la zona de inyección pueden requerir la interrupción de Levemir.
Hipoalbum inemia.
Los datos existentes sobre pacientes con hipoalbuminemia grave son limitados. Se recomienda monitorizar cuidadosamente a estos pacientes.
Combinación de Levemir y pioglitazona
Cuando pioglitazona fue utilizada en combinación con insulina, se notificaron casos de insuficiencia cardiaca, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca. Esto debe tenerse en cuenta si se considera el tratamiento combinado de pioglitazona y Levemir. Si se utiliza esta combinación, se debe vigilar en los pacientes la aparición de signos y síntomas de insuficiencia cardiaca, ganancia de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si tiene lugar cualquier deterioro de los síntomas cardiacos.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se sabe que ciertos medicamentos interaccionan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
Antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de la monoamino oxidasa (IMAO), betabloqueantes, inhibidores de la enzima conversora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los betabloqueantes pueden enmascarar los síntomas de hipoglucemia.
Octreotida y lanreotida pueden aumentar o reducir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucemiante de la insulina.
4.6 Fertilidad, embarazo y lactancia Embarazo
Se puede considerar el tratamiento con Levemir durante el embarazo, pero se debe evaluar el beneficio potencial frente a la posibilidad de que aumente el riesgo de un resultado adverso en el embarazo.
En general, se recomienda intensificar el control de la glucemia y la monitorización de mujeres embarazadas con diabetes durante todo el embarazo y cuando se planifica el mismo. Los requerimientos de insulina generalmente disminuyen en el primer trimestre del embarazo y aumentan posteriormente durante el segundo y tercer trimestre. Normalmente después del parto, los requerimientos de insulina vuelven rápidamente a los niveles previos al embarazo.
En un ensayo clínico controlado abierto y aleatorizado, se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid. El objetivo principal de este ensayo era el evaluar el efecto de Levemir en la regulación de la glucosa en sangre en mujeres embarazadas con diabetes (ver sección 5.1).
La tasa total de acontecimientos adversos maternos fue similar en los grupos tratados con Levemir e insulina NPH, sin embargo, se observó una frecuencia numéricamente superior de acontecimientos adversos graves en las madres (61 (40%) vs. 49 (31%)) y en los recién nacidos (36 (24%) vs. 32 (20%)) con Levemir comparado con la insuina NPH. El número de niños nacidos vivos de mujeres que quedaron embarazadas después de la aleatorización fue de 50 (83%) con Levemir y de 55 (89%) con NPH. La frecuencia de malformaciones congenitas fue de 4 (5%) con Levemir y 11 (7%) con NPH, siendo 3 (4%) malformaciones graves con Levemir y 3 (2%) con NPH.
Los 250 resultados adicionales obtenidos de los datos de poscomercialización de mujeres embarazadas expuestas a Levemir, indican que la insulina detemir no produce efectos adversos en el embarazo ni malformaciones ni toxicidad fetal/neonatal.
Los datos en animales no indican toxicidad reproductiva (ver sección 5.3).
Lactancia
Se desconoce si la insulina detemir se excreta en la leche materna. No se prevén efectos metabólicos de la insulina detemir ingerida sobre el recién nacido/lactante ya que la insulina detemir, al ser un péptido, se descompone en aminoácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia pueden necesitar un ajuste en la dosis de insulina y en la dieta.
Fertilidad
Los estudios en animales no revelan efectos perjudiciales relativos a la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen un estado especial de alerta (por ej. conducir un coche o utilizar máquinas).
Debe advertirse a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de una hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se considerará la conveniencia de conducir en estas circunstancias.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
Las reacciones adversas observadas en pacientes que usan Levemir se deben principalmente al efecto farmacológico de la insulina. Se estima que en general un 12% de los pacientes tratados experimentan reacciones adversas.
La hipoglucemia es la reacción adversa notificada más frecuentemente durante el tratamiento, ver sección c más abajo.
De las investigaciones clínicas se sabe que la hipoglucemia grave, definida como la necesidad de asistencia en el tratamiento, ocurre en aproximadamente un 6% de los pacientes tratados con Levemir.
Las reacciones en el lugar de inyección se han visto con más frecuencia durante el tratamiento con Levemir que con la insulina humana. Estas reacciones incluyen dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor en el lugar de inyección. La mayoría de las reacciones en la zona de inyección son menores y de naturaleza transitoria, es decir, que suelen desaparecer al continuar el tratamiento normalmente en unos pocos días o en pocas semanas.
Al iniciar el tratamiento con insulina pueden aparecer anomalías en la refracción y edema; estas reacciones son generalmente de carácter transitorio. Una rápida mejoría del control de la glucosa en sangre puede estar asociada a una neuropatía dolorosa aguda, que normalmente es reversible. Una intensificación de la terapia insulínica que produzca una repentina mejoría del control glucémico puede estar asociada a un empeoramiento temporal de la retinopatía diabética, mientras que un buen control glucémico prolongado disminuye el riesgo de progresión de la retinopatía diabética.
b. Tabla de efectos adversos
Los efectos adversos enumerados a continuación están basados en los datos de los ensayos clínicos y se clasifican de acuerdo a su frecuencia y a la clasificación por órganos y sistemas.
Las categorías de frecuencias vienen definidas por la siguiente convención: muy frecuente (> 1/10); frecuente (> 1/100 a < 1/10); poco frecuente (> 1/1.000 a < 1/100); rara (> 1/10.000 a < 1/1.000); muy rara (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos del sistema inmunológico |
Poco frecuente - Reacciones alérgicas, reacciones alérgicas potenciales, urticaria, exantema y erupciones* |
|
Muy rara - Reacciones anafilácticas* | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuente - Hipoglucemia* |
|
Trastornos del sistema nervioso |
Rara - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos oculares |
Poco frecuente - Trastornos de la refracción |
|
Poco frecuente - Retinopatía diabética | |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuente - Lipodistrofia* |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente - Reacciones en la zona de inyección |
|
Poco frecuente - Edema |
* ver sección c.
c. Descripción de los efectos adversos señalados
Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones Las reacciones alérgicas, las reacciones potencialmente alérgicas, la urticaria, el exantema y las erupciones son poco frecuentes cuando Levemir se usa en régimen bolo-basal. Sin embargo tres ensayos clínicos han demostrado que, cuando se usa en combinación con antidiabéticos orales, se puede definir como frecuente (se ha observado un 2,2% de reacciones alérgicas y reacciones potencialmente alérgicas)
Reacciones anafilácticas
La aparición de reacciones de hipersensibilidad generalizada (que incluyen exantema cutáneo generalizado, prurito, sudor, molestias gastrointestinales, edema angioneurótico, dificultad en la respiración, palpitaciones e hipotensión) es muy rara pero éstas pueden ser potencialmente mortales.
Hipoglucemia
El efecto adverso notificado con mayor frecuencia es hipoglucemia. Puede aparecer si la dosis de insulina es demasiado alta en relación al requerimiento de insulina. Una hipoglucemia grave puede producir un estado de inconsciencia y/o convulsiones y puede dar lugar a una insuficiencia cerebral temporal o permanente o incluso la muerte. Los síntomas de hipoglucemia por lo general aparecen de forma repentina. Pueden incluir sudor frío, piel fría y pálida, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad no habitual, confusión, dificultad para concentrarse, mareo, apetito excesivo, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia
Puede aparecer lipodistrofia (incluidas lipohipertrofia y lipoatrofia) en el lugar de la inyección. La continua rotación del lugar de inyección dentro de un área concreta de inyección reduce el riesgo de desarrollar estas reacciones.
d. Población pediátrica
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en la población pediátrica no muestran ninguna diferencia con la población diabética general, en la cual existe una mayor experiencia.
e. Otras poblaciones especiales
En base a los datos poscomercialización y a los ensayos clínicos, la frecuencia, tipo y gravedad de los efectos adversos observados en los pacientes de edad avanzada y en los pacientes con insuficiencia renal o hepática no muestran ninguna diferencia con la población general, en la cual existe una mayor experiencia.
f. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No es posible fijar definiciones específicas relativas a la sobredosificación de las insulinas, sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si el paciente recibe una dosis superior a sus requerimientos:
• Los episodios hipoglucémicos leves se pueden tratar con administración oral de glucosa o productos azucarados. Por consiguiente se recomienda que los pacientes diabéticos lleven siempre productos azucarados.
• Los episodios hipoglucémicos graves, con pérdida de consciencia, pueden tratarse con inyección intramuscular o subcutánea de glucagón (0,5 a 1 mg), administrada por una persona entrenada, o bien glucosa por vía intravenosa administrada por un profesional sanitario. Se debe administrar glucosa intravenosa, si el paciente no responde al glucagón en 10-15 minutos. Se recomienda la administración de carbohidratos orales al paciente una vez recuperada la consciencia, a fin de prevenir una recaída.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos utilizados en diabetes. Insulinas y análogos de acción prolongada para inyección. Código ATC: A10AE05.
Mecanismo de acción y efectos farmacodinámicos
Levemir es un análogo de insulina soluble de acción prolongada con una duración de su efecto prolongada que se utiliza como insulina basal.
El efecto hipoglucemiante de Levemir se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas y a que inhibe al mismo tiempo la producción hepática de glucosa.
El perfil de acción de Levemir es menos variable y con ello más predecible, de forma estadísticamente significativa, que el de la insulina NPH (protamina neutra Hagedorn), como se puede ver a partir de los Coeficientes de Variación (CV) intraindividuales del efecto farmacodinámico total y máximo en la Tabla 1.
Tabla 1. Variabilidad intraindividual del perfil de acción de Levemir e insulina NPH
|
Punto final farmacodinámico |
Levemir CV (%) |
Insulina NPH CV (%) |
|
AUCGIR,0-24h* |
27 |
68 |
|
GIRmax** |
23 |
46 |
* Área bajo la curva ** Valor p< 0,00 comparaciones con Levemir
de la Velocidad de Infusión de Glucosa para todas las
La acción prolongada de Levemir está mediada por la fuerte autoasociación de las moléculas de la insulina detemir en el lugar de inyección y la unión a la albúmina por medio de la cadena lateral del ácido graso. La insulina detemir se distribuye más lentamente a los tejidos periféricos diana que la insulina NPH. Esta combinación de mecanismos de prolongación proporciona a la insulina detemir una absorción y un perfil de acción más reproducibles que la insulina NPH.
Parámetros Farmacodinámicos para Levemir y NPH
|
Levemir |
NPH | ||||
|
U/kg |
U/kg |
U/kg |
UI/kg | ||
|
Duración de acción (hr) |
12 |
17t |
20 |
13 | |
|
GIRmax (mg/kg/min) |
1.1 |
1.4t |
1.7 |
1.6 | |
Tvalores estimados
Figura 1. Perfiles de actividad de Levemir en pacientes con diabetes tipo 1.
La duración máxima de la acción es 24 horas, según la dosis, lo cual permite la administración de una o dos dosis diarias. Si Levemir se administra dos veces diarias, la estabilización se produce después de la administración de 2-3 dosis. En el rango de dosificación de 0,2 - 0,4 U/kg, Levemir ejerce más de un 50% de su efecto máximo entre 3 y 4 horas después de la administración y hasta aproximadamente 14 horas después de la administración.
Después de la administración subcutánea se observa una proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de la acción, efecto total).
Se ha demostrado una menor variabilidad diaria en los niveles de glucosa plasmática en ayunas (GPA) durante el tratamiento con Levemir en comparación con el tratamiento con insulina NPH, en ensayos clínicos a largo plazo.
Los ensayos en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con antidiabéticos orales demostraron que el control glucémico (HbA1c) con Levemir es comparable al obtenido con insulina NPH y al obtenido con insulina glargina y está asociado con un menor aumento de peso. Ver Tabla 2. En el ensayo de Levemir frente a insulina glargina, Levemir se administró una o dos veces al día, mientras que la insulina glargina se administró una vez al día y se vio que el 55% de los pacientes tratados con Levemir completaron las 52 semanas de tratamiento con el régimen de administración dos veces al día.
Tabla 2. Cambio en el peso corporal después del tratamiento con insulina
|
Duración del ensayo |
Levemir 1 vez al día |
Levemir 2 veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+ 0,7 kg |
+ 1,6 kg | ||
|
26 semanas |
+ 1,2 kg |
+ 2,8 kg | ||
|
52 semanas |
+ 2,3 kg |
+ 3,7 kg |
+ 4,0 kg |
En ensayos clínicos en los que se ha investigado el uso de antidiabéticos orales, el tratamiento combinado con Levemir dio lugar a un 61-65% de disminución de riesgo de hipoglucemias nocturnas comparado con la insulina NPH.
Se llevó a cabo un ensayo clínico abierto y aleatorizado en pacientes con diabetes tipo 2 que no alcanzaban el objetivo glucémico con antidiabéticos orales. El ensayo comenzó con un periodo de prueba de 12 semanas de tratamiento con liraglutida + metformina, donde el 61% alcanzó una HbA1c < 7%. El 39% restante (pacientes que no alcanzaron el objetivo) fueron aleatorizados para utilizar Levemir una vez al día como tratamiento añadido o continuar con liraglutida + metformina durante 52 semanas. La adición de Levemir dio como resultado una reducción adicional de la HbAic de 7,6% a 7,1% después de 52 semanas. No hubo ningún episodio hipoglucémico grave. Un episodio
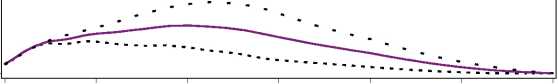
O 4 8 12 16 20 24
Tiempo transcurrido desde la inyección de Insulina (horas) Levemir..... 0.2 U/kg 0.3 U/kg____0.4 U/kg
hipoglucémico grave se define como un episodio en el que el sujeto no es capaz de tratarse a sí mismo con glucagón o en el que es necesario administrarle glucosa intravenosa. Ver tabla 3
|
Tabla 3. Datos del ensayo clínico - Adición ( |
e Levemir a liraglutida + metformina | |||
|
Semana del estudio |
Aleatorizado Levemir + liraglutida + metformina N = 160 |
Aleatorizado Liraglutida + metformina N = 149 |
Valor P | |
|
Media del cambio de la HbA1c desde el nivel basal (%) |
026 semanas |
-0,51 |
+0,02 |
< 0,0001 |
|
052 semanas |
-0,50 |
0,01 |
< 0,0001 | |
|
Proporción de pacientes que alcanzan el objetivo de HbA1c < 7% (%) |
026 semanas |
43,1 |
16,8 |
< 0,0001 |
|
052 semanas |
51,9 |
21,5 |
< 0,0001 | |
|
Cambio en el peso desde el nivel basal (kg) |
026 semanas |
-0,16 |
-0,95 |
0,0283 |
|
052 semanas |
-0,05 |
-1,02 |
0,0416 | |
|
Episodios hipoglucémicos leves (por paciente año) |
026 semanas |
0,286 |
0,029 |
0,0037 |
|
052 semanas |
0,228 |
0,034 |
0,0011 | |
Se realizó un ensayo clínico aleatorizado, doble ciego, de 26 semanas, para investigar la eficacia y seguridad de la adición de liraglutida (1,8 mg) frente a placebo en pacientes con diabetes tipo 2 no controlados adecuadamente con insulina basal, con o sin metformina. La dosis de insulina se redujo en un 20% en los pacientes con HbA1c basal <8,0% con el fin de minimizar el riesgo de hipoglucemia. Posteriormente, a los pacientes se les permitió ajustar su dosis de insulina a un valor no superior al de la dosis de pre-aleatorización. Levemir fue la insulina basal para el 33% (N = 147) de los pacientes (el 97,3% tomando metformina). En estos pacientes, la adición de liraglutida dio lugar a una mayor disminución de la HbA1c en comparación con la adición de placebo (6,93% vs. 8,24%), una mayor disminución de la glucosa plasmática en ayunas (7,20 mmol/l vs. 8,13 mmol/l) y una mayor disminución del peso corporal (-3,47 kg vs. -0,43 kg). Los valores basales de estos parámetros fueron similares en los dos grupos. Las tasas observadas de episodios hipoglucémicos leves fueron similares y no se observaron episodios hipoglucémicos graves en ninguno de los grupos.
En ensayos a largo plazo en pacientes con diabetes tipo 1 en tratamiento con insulina bolo-basal, el control de la glucosa plasmática en ayunas mejoró con Levemir en comparación con insulina NPH. El control glucémico (HbA1c) con Levemir fue comparable al de la insulina NPH, con menor riesgo de hipoglucemia nocturna y sin aumento de peso asociado.
En ensayos clínicos utilizando un régimen de dosificación de insulina bolo/basal, la frecuencia general de hipoglucemias fue similar con Levemir e insulina NPH. Los análisis de hipoglucemia nocturna en pacientes diabéticos tipo 1 mostraron un riesgo significativamente inferior de hipoglucemia nocturna leve (capacidad de autotratamiento y confirmado mediante el valor de glucosa en sangre capilar inferior a 2,8 mmol/l o 3,1 mmol/l si se expresa como glucosa en plasma) al comparar con insulina NPH, mientras que no se observaron diferencias en diabéticos tipo 2.
Con el uso de Levemir se ha observado el desarrollo de anticuerpos. Sin embargo, no parece que este hecho tenga impacto sobre el control glucémico.
Embarazo
Levemir se estudió en un ensayo clínico controlado abierto y aleatorizado, en el que se trató con un régimen bolo/basal a mujeres embarazadas con diabetes tipo 1 (n=310), con Levemir (n= 152) o insulina NPH (n=158) como insulina basal, en ambos casos en combinación con NovoRapid (ver sección 4.6).
El efecto de Levemir no fue inferior al de la insulina NPH usando como criterio de medida la HbA1c en la semana de gestación (SG) 36, y la reducción en la HbA1c media durante el embarazo fue similar con ambas insulinas, ver tabla 4.
Tabla 4. Control glucémico materno
|
Levemir |
NPH |
Diferencia/ Odds Ratio/ Rate Ratio IC 95% | |
|
HbAJc media (%) en SG 36 |
6,27 |
6,33 |
Diferencia: -0,06 [-0,21; 0,08] |
|
GPA media en SG 36 (mmol/l) |
4,76 |
5,41 |
Diferencia: -0,65 [-1,19; -0,12] |
|
Proporción de pacientes que alcanzaron el objetivo de HbAJc < 6% tanto en SG 24 como en SG 36 (%) |
41% |
32% |
Odds Ratio: 1,36 [0,78; 2,37] |
|
Número total de episodios hipoglucémicos graves durante el embarazo (por paciente año) |
1,1 |
1,2 |
Rate Ratio: 0,82 [0,39; 1,75] |
Población pediátrica
Se ha estudiado la eficacia y seguridad de Levemir en adolescentes y niños (n=1045 en total) en tres ensayos clínicos controlados aleatorizados de 12 meses de duración. Los ensayos incluyeron un total de 167 niños de entre 1 y 5 años de edad. Los ensayos demostraron que el control glucémico (HbA1c) obtenido con Levemir es comparable al obtenido con la insulina NPH e insulina degludec cuando se administra en terapia bolo/basal utilizando un margen de no inferioridad del 0,4%. En el ensayo que compara Levemir vs insulina degludec, la tasa de episodios de hiperglucemia con cetosis fue significativamente mayor para Levemir, con 1,09 y 0,68 episodios por paciente/año de exposición respectivamente. Se observó un menor aumento de peso (SD Z-score, peso corregido según el sexo y la edad) con Levemir que con insulina NPH.
El ensayo que incluía niños a partir de 2 años se prolongó durante 12 meses más (datos de un tratamiento de 24 meses en total) para evaluar la formación de anticuerpos después de un tratamiento de larga duración con Levemir. Después de que los anticuerpos frente a insulina aumentaran durante el primer año, estos disminuyeron durante el segundo año hasta llegar a un nivel ligeramente superior al nivel de antes del ensayo. Los resultados indican que el desarrollo de anticuerpos no tuvo un efecto negativo sobre el control glucémico ni sobre la dosis de Levemir.
Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 se han extrapolado de los datos de pacientes niños, adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de Levemir en pacientes adolescentes con diabetes mellitus tipo 2.
5.2 Propiedades farmacocinéticas
Absorción
La concentración máxima en suero se alcanza entre 6 y 8 horas después de la administración.
Si Levemir se administra dos veces diarias, la estabilización de la concentración en suero se alcanza
después de la administración de 2-3 dosis.
La variación intraindividual en la absorción es menor con Levemir que con otros preparados de insulina basal.
La biodisponibilidad absoluta de insulina detemir administrada por vía subcutánea es de aproximadamente un 60%.
Distribución
El volumen de distribución aparente de Levemir (aproximadamente 0,1 l/kg) indica que la fracción de insulina detemir en la sangre circulante es alta.
Los resultados de los estudios de unión a proteínas in vitro e in vivo sugieren que no existe una interacción clínicamente significativa entre la insulina detemir y los ácidos grasos u otras proteínas ligadas a medicamentos.
Metabolismo
La degradación de insulina detemir es similar a la de la insulina humana. Todos los metabolitos formados son inactivos.
Eliminación
La vida media terminal después de la administración subcutánea es determinada por la velocidad de absorción del tejido subcutáneo. La vida media terminal es de 5 a 7 horas según la dosis.
Linealidad
Después de la administración subcutánea en el rango de dosificación terapéutico se observa una proporcionalidad de la dosis en la concentración en suero (concentración máxima, extensión de la absorción).
No se han observado interacciones farmacocinéticas o farmacodinámicas entre liraglutida y Levemir cuando se administra una dosis única de Levemir 0,5 U/kg con liraglutida 1,8 mg en estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas de edad avanzada y jóvenes.
Insuficiencia renal y hepática
En cuanto a la farmacocinética de Levemir, no hubo diferencias clínicamente significativas entre personas con insuficiencia renal o hepática y sujetos sanos. Ya que la farmacocinética de Levemir no se ha estudiado extensamente en esta población, se recomienda monitorizar cuidadosamente la glucosa plasmática de estos pacientes.
Sexo
No hay diferencias clínicamente significativas entre sexos en cuanto a las propiedades farmacocinéticas de Levemir.
Población pediátrica
Las propiedades farmacocinéticas de Levemir se han estudiado en niños pequeños (1-5 años), niños (6-12 años) y adolescentes (13-17 años) y se han comparado con adultos con diabetes tipo 1. No hubo diferencias clínicamente significativas en cuanto a las propiedades farmacocinéticas entre niños pequeños, niños, adolescentes y adultos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad para la reproducción y desarrollo. Los datos sobre afinidad del receptor y ensayos in vitro de mitogenicidad no indicaron signos de aumento del potencial mitogénico en comparación con la insulina humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Glicerol
Fenol
Metacresol
Acetato de zinc
Fosfato disódico dihidrato
Cloruro sódico
Ácido clorhídrico (para ajuste del pH)
Hidróxido sódico (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Levemir pueden provocar la degradación de la insulina detemir, por ejemplo, si el medicamento contiene tioles o sulfitos. Levemir no se debe añadir a los fluidos de perfusión.
Este medicamento no debe ser mezclado con otros medicamentos.
6.3 Período de validez Antes de abrir: 30 meses
Durante su uso o cuando se lleva como repuesto: el producto debe conservarse durante un máximo de 6 semanas.
6.4 Precauciones especiales de conservación
Antes de abrir: conservar en nevera (entre 2°C y 8°C). No guardar cerca del elemento refrigerador. No congelar.
Durante su uso o cuando se lleva como repuesto: conservar por debajo de 30°C. No refrigerar. No congelar.
Conservar Levemir FlexTouch con el capuchón puesto para protegerlo de la luz.
Para las condiciones de conservación del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
3 ml de solución en un cartucho (vidrio tipo 1) con un émbolo (bromobutil) y un cierre de goma (bromobutil/poliisopreno) en una pluma precargada, desechable y multidosis hecha de polipropileno.
Envases con 1 (con o sin agujas), 5 (sin agujas) o envase múltiple con 2 x 5 (sin agujas) plumas precargadas de 3 ml. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las agujas y Levemir FlexTouch no se deben compartir. El cartucho no se debe rellenar.
No utilice este medicamento si observa que la solución no es transparente, incolora y acuosa.
Si Levemir se ha congelado no debe utilizarse.
Se debe indicar al paciente que deseche la aguja después de cada inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/012
EU/1/04/278/013
EU/1/04/278/014
EU/1/04/278/015
EU/1/04/278/016
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 01 Junio 2004 Fecha de la última renovación: 16 Abril 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del principio activo biológico
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Novo Nordisk A/S Hallas Allé DK-4440 Kalundborg Dinamarca
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Levemir InnoLet y FlexTouch
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Levemir Penfill y FlexPen
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Novo Nordisk Production SAS 45, Avenue d'Orléans F-28000 Chartres Francia
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica
C OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea del Medicamento.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml Solución inyectable en cartucho Insulina detemir
2. PRINCIPIO(S) ACTIVO
1 ml de solución contiene 100 unidades de insulina detemir (equivalente a 14,2 mg). 1 cartucho contiene 3 ml equivalentes a 300 unidades
3. LISTA DE EXCIPIENTES
glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico/hidróxido sódico para ajuste de pH y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en cartucho. Penfill.
1 x 3 ml cartucho 5 x 3 ml cartuchos 10 x 3 ml cartuchos
5. FORMA Y VÍA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Utilizar la solución sólo si es transparente, incolora y acuosa Para ser utilizado por una sola persona
8. FECHA DE CADUCIDAD
CAD
Durante el uso: utilizar en 6 semanas
Antes de abrir: conservar en nevera (entre 2°C y 8°C)
Durante el uso: no refrigerar. Conservar por debajo de 30°C No congelar
Conservar el cartucho en el embalaje exterior para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la aguja después de cada inyección
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Alié, DK-2880 Bagsv^rd, Dinamarca
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/001 1 cartucho de 3 mi EU/1/04/278/002 5 cartuchos de 3 mi EU/1/04/278/003 10 cartuchos de 3 mi
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Levemir Penfill
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA (CARTUCHO. Penfill)_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Levemir 100 unidades/ml Solución inyectable Insulina detemir Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
Penfill
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml
Solución inyectable en pluma precargada
Insulina detemir
2. PRINCIPIO ACTIVO
1 ml de solución contiene 100 unidades de insulina detemir (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades
3. LISTA DE EXCIPIENTES
glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico/hidróxido sódico para ajuste de pH y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en pluma precargada. FlexPen
1 x 3 ml pluma precargada 5 x 3 ml plumas precargadas 10 x 3 ml plumas precargadas 1 x 3 ml pluma precargada + 7 agujas NovoFine 1 x 3 ml pluma precargada + 7 agujas NovoTwist
5. FORMA Y VÍA DE ADMINISTRACIÓN
Las agujas no están incluidas
Leer el prospecto antes de utilizar este medicamento
Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Utilizar la solución sólo si es transparente como el agua, incolora y acuosa Para ser utilizado por una sola persona
Diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de hasta 8 mm
CAD
Durante el uso: utilizar en 6 semanas
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Antes de abrir: conservar en nevera (entre 2°C y 8°C) Durante el uso: no refrigerar. Conservar por debajo de 30°C No congelar
Conservar con el capuchón puesto para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la aguja después de cada inyección
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/004 1 pluma de 3 ml EU/1/04/278/005 5 plumas de 3 ml EU/1/04/278/006 10 plumas de 3 ml EU/1/04/278/010 1 pluma de 3 ml y 7 agujas NovoFine EU/1/04/278/011 1 pluma de 3 ml y 7 agujas NovoTwist
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Levemir FlexPen
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE LA PLUMA (PLUMA PRECARGADA. FlexPen)
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Levemir 100 unidades/ml Solución inyectable Insulina detemir Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
FlexPen
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml
Solución inyectable en pluma precargada
Insulina detemir
2. PRINCIPIO(S) ACTIVO
1 ml de solución contiene 100 unidades de insulina detemir (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades
3. LISTA DE EXCIPIENTES
glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico/hidróxido sódico para ajuste de pH y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en pluma precargada. InnoLet
1 x 3 ml pluma precargada 5 x 3 ml plumas precargadas 10 x 3 ml plumas precargadas
5. FORMA Y VÍA DE ADMINISTRACIÓN
Las agujas no están incluidas en el envase
Leer el prospecto antes de utilizar este medicamento
Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Utilizar la solución sólo si es transparente, incolora y acuosa Para ser utilizado por una sola persona
Diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de hasta 8 mm de longitud
8. FECHA DE CADUCIDAD
CAD
Durante el uso: utilizar en 6 semanas
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Antes de abrir: conservar en nevera (entre 2°C y 8°C) Durante el uso: no refrigerar. Conservar por debajo de 30°C No congelar
Conservar con el capuchón puesto para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la aguja después de cada inyección
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/007 1 pluma de 3 ml EU/1/04/278/008 5 plumas de 3 ml EU/1/04/278/009 10 plumas de 3 ml
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Levemir InnoLet
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE LA PLUMA (PLUMA PRECARGADA. InnoLet)
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Levemir 100 unidades/ml Solución inyectable Insulina detemir Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
InnoLet
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml
Solución inyectable en pluma precargada
Insulina detemir
2. PRINCIPIO ACTIVO
1 ml de solución contiene 100 unidades de insulina detemir (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades
3. LISTA DE EXCIPIENTES
glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico/hidróxido sódico para ajuste de pH y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en pluma precargada. FlexTouch.
1 x 3 ml pluma precargada
5 x 3 ml plumas precargadas
2 x (5 x 3 ml) plumas precargadas
1 x 3 ml pluma precargada + 7 agujas NovoFine 1 x 3 ml pluma precargada + 7 agujas NovoTwist
5. FORMA Y VÍA DE ADMINISTRACIÓN
Las agujas no están incluidas
Leer el prospecto antes de utilizar este medicamento
Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Utilizar la solución sólo si es transparente, incolora y acuosa Para ser utilizado por una sola persona
Diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de hasta 8 mm
8. FECHA DE CADUCIDAD
CAD
Durante el uso: utilizar en 6 semanas
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Antes de abrir: conservar en nevera (entre 2°C y 8°C) Durante el uso: no refrigerar. Conservar por debajo de 30°C No congelar
Conservar con el capuchón puesto para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la aguja después de cada inyección
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/012 1 pluma de 3 ml
EU/1/04/278/013 5 plumas de 3 ml
EU/1/04/278/014 5 plumas de 3 ml. Forman parte de un envase múltiple de 10 plumas.
Prohibida su venta como plumas individuales EU/1/04/278/015 1 pluma de 3 ml y 7 agujas NovoFine
EU/1/04/278/016 1 pluma de 3 ml y 7 agujas NovoTwist
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Levemir FlexTouch
1. NOMBRE DEL MEDICAMENTO
Levemir 100 unidades/ml Solución inyectable en pluma precargada Insulina detemir Vía subcutánea
2. PRINCIPIO ACTIVO
1 ml de solución contiene 100 unidades de insulina detemir (equivalente a 14,2 mg). 1 pluma precargada contiene 3 ml equivalentes a 300 unidades
3. LISTA DE EXCIPIENTES
glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico/hidróxido sódico para ajuste de pH y agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en pluma precargada. FlexTouch.
2 x (5 x 3 ml). Este es un envase múltiple de 10 plumas precargadas y está prohibida su venta como plumas precargadas individuales.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Las agujas no están incluidas
Leer el prospecto antes de utilizar este medicamento
Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE OF FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Utilizar la solución sólo si es transparente, incolora y acuosa Para ser utilizado por una sola persona
Diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de hasta 8 mm
8. FECHA DE CADUCIDAD
CAD
Durante el uso: utilizar en 6 semanas
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Antes de abrir: conservar en nevera (entre 2°C y 8°C) Durante el uso: no refrigerar. Conservar por debajo de 30°C No congelar
Conservar con el capuchón puesto para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Deseche la aguja después de cada inyección
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
12. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/04/278/014
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Levemir FlexTouch
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE LA PLUMA (PLUMA PRECARGADA FlexTouch)
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Levemir 100 unidades/ml Solución inyectable Insulina detemir Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
FlexTouch
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
B. PROSPECTO
Prospecto: información para el usuario
Levemir 100 unidades/ml solución inyectable en cartucho
Insulina detemir
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Levemir y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Levemir
3. Cómo usar Levemir
4. Posibles efectos adversos
5. Conservación de Levemir
6. Contenido del envase e información adicional
1. Qué es Levemir y para qué se utiliza
Levemir es una insulina moderna (análogo de insulina) de acción prolongada. Las insulinas modernas son versiones mejoradas de la insulina humana.
Levemir se utiliza para reducir los niveles altos de azúcar en sangre en adultos, adolescentes y niños de 1 año de edad en adelante con diabetes. La diabetes es una enfermedad en la que el cuerpo no produce suficiente insulina para controlar el nivel de azúcar en sangre.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
Levemir tiene una acción prolongada y constante de reducción de azúcar a las 3 o 4 horas siguientes a la inyección. Levemir proporciona una cobertura de insulina basal de hasta 24 horas.
2. Qué necesita saber antes de empezar a usar Levemir No use Levemir
► Si es alérgico a la insulina detemir o a cualquiera de los demás componentes de este medicamento, ver sección 6, Contenido del envase e información adicional.
► Si sospecha que va a sufrir una hipoglucemia (bajo nivel de azúcar en sangre), ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
► En bombas de perfusión de insulina.
► Si el cartucho o el dispositivo que contiene el cartucho se ha caído, se ha dañado o se ha roto.
► Si no se ha guardado de la forma correcta o se ha congelado, ver sección 5, Conservación de Levemir.
► Si la insulina no tiene un aspecto transparente, incoloro y acuoso como el agua.
Si alguna de estas circunstancias le afecta, no use Levemir. Consulte a su médico, enfermero o farmacéutico.
Antes de usar Levemir
► Compruebe la etiqueta y asegúrese de que la insulina es del tipo que le han recetado.
► Compruebe siempre el cartucho, incluyendo el tapón de goma en el extremo del cartucho. No lo
utilice si está dañado o si el tapón de goma se ha movido por encima de la banda blanca en el extremo del cartucho. Esto podría ser el resultado de que la insulina se haya salido. Si sospecha que el cartucho está dañado, devuélvalo a su proveedor. Para más información consulte el manual de su pluma.
► Utilice siempre una aguja nueva en cada inyección para prevenir contaminaciones.
► Las agujas y Levemir Penfill no deben compartirse.
Advertencias y precauciones
Algunas afecciones y actividades pueden afectar a su requerimiento de insulina. Consulte a su médico:
► Si tiene problemas de riñón, hígado, glándulas suprarrenales, hipófisis o glándula tiroidea.
► Si hace más ejercicio físico de lo normal o si desea cambiar su dieta, ya que esto puede afectar a
su nivel de azúcar en sangre.
► Si está enfermo, continúe el tratamiento con insulina y consulte a su médico.
► Si proyecta viajar al extranjero, las diferencias horarias entre países pueden afectar a su requerimiento de insulina y al momento de administración de la misma.
► Si sus niveles de albúmina son muy bajos, controle cuidadosamente sus niveles de azúcar en sangre. Hable sobre este tema con su médico.
Niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
La seguridad y eficacia de Levemir en niños menores de 1 año de edad no ha sido establecida.
No hay datos disponibles.
Otros medicamentos y Levemir
Informe a su médico, enfermero o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Algunos medicamentos afectan a su nivel de azúcar en sangre y esto puede implicar que su dosis de insulina tenga que modificarse. A continuación se indican los principales medicamentos que pueden afectar a su tratamiento con insulina.
Su nivel de azúcar en sangre puede disminuir (hipoglucemia) si toma:
• Otros medicamentos para el tratamiento de diabetes
• Inhibidores de la monoaminoxidasa (IMAO) (utilizados para tratar la depresión)
• Beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial)
• Inhibidores de la enzima conversora de la angiotensina (ECA) (utilizados para tratar ciertas enfermedades del corazón o el aumento de la tensión arterial)
• Salicilatos (utilizados para aliviar el dolor y bajar la fiebre)
• Esteroides anabólicos (como testosterona)
• Sulfonamidas (utilizadas para tratar infecciones).
Su nivel de azúcar en sangre puede aumentar (hiperglucemia) si toma:
• Anticonceptivos orales (píldora anticonceptiva)
• Tiazidas (utilizadas para tratar el aumento de la tensión arterial o la retención de líquidos excesiva)
• Glucocorticoides (como “cortisona” utilizados para tratar la inflamación)
• Hormonas tiroideas (utilizadas para tratar las alteraciones de la glándula tiroidea)
• Simpaticomiméticos (como epinefrina [adrenalina] o salbutamol o terbutalina para tratar el asma)
• Hormona de crecimiento (medicamento para estimular el crecimiento somático y del esqueleto que influye de forma pronunciada en los procesos metabólicos)
• Danazol (medicamento que actúa sobre la ovulación).
Octreotida y lanreotida (utilizados para el tratamiento de la acromegalia, un trastorno hormonal poco frecuente que se suele dar normalmente en adultos de mediana edad, causado cuando la glándula pituitaria produce un exceso de hormona de crecimiento) pueden aumentar o disminuir sus niveles de azúcar en sangre.
Los beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial) pueden debilitar o suprimir por completo los primeros síntomas de aviso que podrían ayudarle a reconocer cuándo tiene los niveles de azúcar en sangre bajos.
Pioglitazona (comprimidos utilizados para el tratamiento de diabetes tipo 2)
Algunos pacientes con diabetes tipo 2 de larga duración y enfermedad cardiaca o ictus previo que fueron tratados con pioglitazona e insulina, desarrollaron insuficiencia cardiaca. Informe a su médico, lo antes posible, si tiene signos de insuficiencia cardiaca tales como una inusual falta de aire, aumento rápido de peso o inflamación localizada (edema).
Si ha tomado cualquiera de los medicamentos aquí mencionados, informe a su médico, enfermero o farmacéutico.
Bebidas alcohólicas y uso de Levemir
► Si bebe alcohol, puede cambiar su necesidad de insulina ya que su nivel de azúcar en sangre puede verse aumentado o disminuido. Se recomienda realizar un control cuidadoso.
Embarazo y lactancia
► Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Puede que sea necesario modificar la dosis de insulina mientras esté embarazada y tras el parto. Es importante para la salud de su bebé, un control cuidadoso de su diabetes y especialmente la prevención de hipoglucemias.
► Si está en periodo de lactancia, consulte a su médico ya que podría necesitar un ajuste en la dosis de insulina.
Consulte a su médico, enfermero o farmacéutico antes de utilizar cualquier medicamento mientras esté embarazada o en periodo de lactancia.
Conducción y uso de máquinas
► Por favor, pregunte a su médico si puede conducir o manejar una máquina:
• Si tiene hipoglucemias frecuentemente.
• Si le resulta difícil reconocer las hipoglucemias.
Si sus niveles de azúcar en sangre son bajos o altos, pueden afectar a su concentración y capacidad de reacción y por lo tanto, también a su capacidad para conducir un coche o manejar una máquina. Tenga en cuenta que podría poner en peligro su vida o la de otros.
Información importante sobre alguno de los componentes de Levemir
Levemir contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, Levemir está esencialmente exento de sodio.
3. Cómo usar Levemir
Posología y cuándo administrarse la insulina
Utilice siempre la insulina y ajuste la dosis exactamente tal y como le ha recomendado su médico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
No cambie de insulina a no ser que su médico se lo diga.
Es posible que su médico deba realizarle un ajuste de la dosis si:
• su médico le cambia de un tipo o marca de insulina a otro, o
• su médico le ha añadido otro medicamento para el tratamiento de la diabetes, además de su tratamiento de Levemir.
Uso en niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
No hay experiencia con el uso de Levemir en niños menores de 1 año de edad.
Uso en grupos de pacientes especiales
Si tiene mal funcionamiento de los riñones o el hígado (insuficiencia renal o hepática), o si tiene más de 65 años, debe controlar su azúcar en sangre más frecuentemente y consultar con su médico los cambios en su dosis de insulina.
Cada cuánto inyectarse
Cuando se utiliza en combinación con comprimidos para la diabetes y/o en combinación con antidiabéticos inyectables que no sean insulina, Levemir debe administrarse una vez al día. Cuando se utiliza como parte de un régimen bolo-basal, Levemir debe administrarse una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir debe ajustarse de forma individual. La inyección puede administrarse en cualquier momento del día, pero a la misma hora todos los días. En los pacientes que necesiten dos dosis al día para optimizar su control de azúcar en sangre, la dosis de la tarde puede administrarse por la tarde o antes de acostarse.
Cómo y dónde inyectarse
Levemir se inyecta bajo la piel (administración subcutánea). Nunca debe inyectarse Levemir directamente en una vena (administración intravenosa) o músculo (administración intramuscular).
En cada inyección, cambie el lugar de inyección dentro del área concreta de piel que suela utilizar. Esto puede reducir el riesgo de desarrollar abultamientos o depresiones en la piel (ver sección 4, Posibles efectos adversos). Las mejores zonas para la inyección son las siguientes: la parte frontal del muslo, la zona del abdomen y la parte exterior superior del brazo. Mida regularmente su nivel de azúcar en sangre.
► No rellene el cartucho
► Los cartuchos de Levemir Penfill están diseñados para ser usados con los sistemas de administración de insulina de Novo Nordisk y con las agujas NovoFine o NovoTwist.
► Si está en tratamiento con Levemir Penfill y con otra insulina también en cartucho Penfill, debe utilizar dos sistemas de administración diferentes, uno para cada tipo de insulina.
► Lleve siempre consigo un cartucho Penfill de repuesto por si el que está usando se perdiese o estropease.
Cómo inyectarse Levemir
► La insulina debe inyectarse bajo su piel. Utilice la técnica de inyección aconsejada por su médico o enfermero y descrita en el manual de instrucciones de su pluma.
► Mantenga la aguja bajo la piel al menos durante 6 segundos. Mantenga el pulsador completamente presionado hasta que la aguja se haya retirado de la piel. Esto asegurará la correcta administración y limitará el posible paso del flujo de sangre a la aguja o a la insulina restante.
► No olvide retirar y desechar la aguja después de cada inyección y conservar Levemir sin la aguja puesta. Si no se desecha, el líquido puede salirse por la aguja, lo que puede producir una dosificación incorrecta.
Si usa más insulina de la que debiera
Si usa demasiada insulina, su nivel de azúcar en sangre puede llegar a ser muy bajo (hipoglucemia). Ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
Si olvidó usar su insulina
Si olvidó inyectarse insulina, su nivel de azúcar en sangre puede llegar a ser muy alto (hiperglucemia). Ver c) Efectos de la diabetes en la sección 4.
Si interrumpe el tratamiento con su insulina
No interrumpa el tratamiento con su insulina sin consultar a su médico, él le dirá lo que debe hacer. Esto podría producir niveles de azúcar en sangre muy altos (hiperglucemia grave) y cetoacidosis. Ver c) Efectos de la diabetes en la sección 4.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
a) Resumen de efectos adversos graves y muy frecuentes
Bajo nivel de azúcar en sangre (hipoglucemia) es un efecto adverso muy frecuente. Puede afectar a más de 1 de cada 10 personas.
Pueden aparecer niveles bajos de azúcar en sangre si:
• Se inyecta demasiada insulina.
• Come muy poco o se salta una comida.
• Hace más ejercicio de lo habitual.
• Bebe alcohol (Ver Bebidas alcohólicas y uso de Levemir en la sección 2).
Síntomas de aviso de bajo nivel de azúcar en sangre: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, hambre excesiva, cambios temporales en la visión, somnolencia, cansancio y debilidad no habituales, nerviosismo o temblor, ansiedad, confusión y dificultad de concentración.
Una bajada de azúcar en la sangre grave puede dar lugar a la pérdida de consciencia. Si una bajada de azúcar en sangre grave y prolongada no se trata, puede causar lesión cerebral (transitoria o permanente) e incluso la muerte. Puede recuperar la consciencia más rápidamente si le administra una inyección de glucagón una persona que sepa cómo hacerlo. Si le administran glucagón, debe tomar glucosa o un producto azucarado tan pronto como recupere la consciencia. Si no responde al tratamiento con glucagón, deberá ser tratado en un hospital.
Qué hacer si su nivel de azúcar en sangre es bajo:
► Si su nivel de azúcar en sangre es bajo, tome comprimidos de glucosa o bien un producto azucarado (caramelos, galletas, zumo de frutas). Mida su nivel de azúcar en sangre si le es posible y luego descanse. Lleve siempre consigo comprimidos de glucosa o alimentos que contengan azúcar, por si acaso lo necesita.
► Cuando los síntomas de la hipoglucemia hayan desaparecido o cuando los niveles de azúcar en sangre se hayan estabilizado, continúe el tratamiento con insulina, como de costumbre
► Si ha tenido unos niveles de azúcar en sangre tan bajos que le han causado inconsciencia, si ha necesitado que le administraran una inyección de glucagón, o si ha tenido muchas bajadas de los niveles de azúcar en sangre, hable con su médico. Quizá tenga que ajustar la cantidad o pauta de administración de insulina, alimentación o ejercicio.
Informe a los demás de que tiene diabetes y de cuáles pueden ser las consecuencias, incluyendo el riesgo de perder la consciencia debido a una bajada en el nivel de azúcar en sangre. Infórmeles de que si se queda inconsciente deben recostarle de lado y buscar inmediatamente asistencia médica. No deben darle nada de comer o beber ya que podría asfixiarse.
Reacción alérgica grave a Levemir o a alguno de sus componentes (llamada reacción alérgica sistémica) es un efecto adverso muy raro, pero potencialmente mortal. Puede afectar hasta 1 de cada 10.000 personas.
Consulte inmediatamente al médico:
• Si los signos de alergia se extienden a otras partes de su cuerpo
• Si de repente se siente enfermo y tiene sudores, vómitos, dificultad para respirar, palpitaciones, se siente mareado.
► Si nota cualquiera de estos síntomas, consulte a su médico inmediatamente.
b) Lista de otros efectos adversos
Efectos adversos poco frecuentes
Pueden afectar hasta 1 de cada 100 personas.
Signos de alergia: pueden aparecer reacciones alérgicas locales en el lugar de la inyección (dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor). Estas reacciones suelen desaparecer después de unas pocas semanas de tratamiento. Si los síntomas no desaparecen, o si se extienden por su cuerpo, consulte a su médico inmediatamente. Ver también Reacción alérgica grave más arriba.
Problemas visuales: al empezar el tratamiento con insulina puede tener problemas con su visión, pero esta alteración suele ser temporal.
Cambios en el lugar de la inyección (lipodistrofia): el tejido graso bajo la piel en la zona de inyección puede reducirse (lipoatrofia) o aumentar (lipohipertrofia). Cambiando el lugar de inyección dentro de un área, se reduce el riesgo de desarrollar estos cambios en la piel. Si nota que su piel forma depresiones o está más gruesa en el área de inyección, hable con su médico o su enfermero. Estas reacciones pueden volverse más graves o pueden afectar a la absorción de su insulina si se inyecta en ese lugar.
Hinchazón de las articulaciones: al empezar el tratamiento con insulina la acumulación de líquido puede causar inflamación de los tobillos y otras articulaciones. Este efecto suele desaparecer rápidamente. Si no, consulte a su médico.
Retinopatía diabética (una enfermedad de los ojos relacionada con la diabetes que puede llevar a la pérdida de visión): si tiene retinopatía diabética y su nivel de azúcar en sangre mejora muy rápidamente, la retinopatía puede empeorar. Consulte a su médico.
Efectos adversos raros
Pueden afectar hasta 1 de cada 1.000 personas.
Neuropatía dolorosa (dolor debido a que el nervio está dañado): si su nivel de azúcar en sangre mejora muy rápidamente, puede sufrir un dolor relacionado con el nervio, esto es lo que se llama neuropatía dolorosa aguda y es habitualmente pasajera.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
c) Efectos de la diabetes
Alto nivel de azúcar en sangre (hiperglucemia)
Pueden aparecer niveles altos de azúcar en sangre si:
• No se ha inyectado suficiente insulina.
• Si olvida inyectarse la insulina o interrumpe el tratamiento con insulina.
• Si repetidamente se inyecta menos insulina de la que necesita.
• Si padece una infección o fiebre.
• Si come más de lo normal.
• Si hace menos ejercicio físico de lo normal.
Síntomas de aviso de alto nivel de azúcar en sangre:
Los síntomas de aviso aparecen gradualmente. Estos incluyen: aumento en la necesidad de orinar, sed, pérdida de apetito, sensación de mareo (náuseas o vómitos), somnolencia o cansancio, piel seca y enrojecida, sensación de sequedad en la boca y aliento con olor afrutado (acetona).
Qué hacer si su nivel de azúcar en sangre es muy alto:
► Si nota cualquiera de los síntomas descritos: controle su nivel de azúcar en sangre, controle el nivel de acetona en la orina si es posible y consulte inmediatamente al médico.
► Estos pueden ser síntomas de un trastorno muy grave llamado cetoacidosis diabética (se acumula ácido en la sangre debido a que el cuerpo degrada la grasa en lugar del azúcar). Si no se trata, podría producir un coma diabético y la muerte.
5. Conservación de Levemir
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del cartucho y en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica. Conservar siempre el cartucho en el envase exterior, cuando no se esté utilizando, para protegerlo de la luz.
Levemir debe protegerse del calor y la luz excesivos.
Antes de abrir: Levemir Penfill que no se esté utilizando debe conservarse en la nevera entre 2°C y 8°C, alejado del elemento refrigerador. No congelar.
Durante el uso o cuando se lleva como repuesto: Levemir Penfill que esté en uso o que se lleve como repuesto no debe conservarse en nevera. Puede llevarse encima y conservarse a temperatura ambiente (por debajo de 30°C) durante 6 semanas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
Composición de Levemir
• El principio activo es insulina detemir. Cada ml contiene 100 unidades de insulina detemir. Cada cartucho contiene 300 unidades de insulina detemir en 3 ml de solución inyectable.
1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
• Los demás componentes son glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico, hidróxido sódico y agua para inyección.
Aspecto del producto y contenido del envase
Levemir se presenta como una solución inyectable.
Envases que contienen 1, 5 y 10 cartuchos de 3 ml. Puede que no todas las presentaciones estén comercializadas.
Titular de la Autorización de Comercialización y responsable de la fabricación
Titular de la Autorización de Comercialización
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca Responsable de la fabricación
El responsable de la fabricación puede identificarse por el número de lote impreso en la tapa del cartón y en la etiqueta:
- Si el segundo y el tercer caracteres son S6, P5, K7, R7, VG, FG o ZF, el responsable de la fabricación es Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca.
- Si el segundo y el tercer caracteres son H7 o T6, el responsable de la fabricación es Novo Nordisk Production SAS, 45 Avenue d'Orléans, F-28000 Chartres, Francia.
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Levemir 100 unidades/ml solución inyectable en pluma precargada
Insulina detemir
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Levemir y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Levemir
3. Cómo usar Levemir
4. Posibles efectos adversos
5. Conservación de Levemir
6. Contenido del envase e información adicional
1. Qué es Levemir y para qué se utiliza
Levemir es una insulina moderna (análogo de insulina) de acción prolongada. Las insulinas modernas son versiones mejoradas de la insulina humana.
Levemir se utiliza para reducir los niveles altos de azúcar en sangre en adultos, adolescentes y niños de 1 año de edad en adelante con diabetes. La diabetes es una enfermedad en la que el cuerpo no produce suficiente insulina para controlar el nivel de azúcar en sangre.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
Levemir tiene una acción prolongada y constante de reducción de azúcar a las 3 o 4 horas siguientes a la inyección. Levemir proporciona una cobertura de insulina basal de hasta 24 horas.
2. Qué necesita saber antes de empezar a usar Levemir No use Levemir
► Si es alérgico a la insulina detemir o a cualquiera de los demás componentes de este medicamento, ver sección 6, Contenido del envase e información adicional.
► Si sospecha que va a sufrir una hipoglucemia (bajo nivel de azúcar en sangre), ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
► En bombas de perfusión de insulina.
► Si FlexPen se ha caído, se ha dañado o se ha roto.
► Si no se ha guardado de la forma correcta o se ha congelado, ver sección 5, Conservación de Levemir.
► Si la insulina no tiene un aspecto transparente, incoloro y acuoso como el agua.
Si alguna de estas circunstancias le afecta, no use Levemir. Consulte a su médico, enfermero o farmacéutico.
Antes de usar Levemir
► Compruebe la etiqueta y asegúrese de que la insulina es del tipo que le han recetado.
► Utilice siempre una aguja nueva en cada inyección para prevenir contaminaciones.
► Las agujas y Levemir FlexPen no deben compartirse.
Advertencias y precauciones
Algunas afecciones y actividades pueden afectar a su requerimiento de insulina. Consulte a su médico:
► Si tiene problemas de riñón, hígado, glándulas suprarrenales, hipófisis o glándula tiroidea.
► Si hace más ejercicio físico de lo normal o si desea cambiar su dieta, ya que esto puede afectar a su nivel de azúcar en sangre.
► Si está enfermo, continúe el tratamiento con insulina y consulte a su médico.
► Si proyecta viajar al extranjero, las diferencias horarias entre países pueden afectar a su requerimiento de insulina y al momento de administración de la misma.
► Si sus niveles de albúmina son muy bajos, controle cuidadosamente sus niveles de azúcar en sangre. Hable sobre este tema con su médico.
Niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
La seguridad y eficacia de Levemir en niños menores de 1 año de edad no ha sido establecida.
No hay datos disponibles.
Otros medicamentos y Levemir
Informe a su médico, enfermero o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Algunos medicamentos afectan a su nivel de azúcar en sangre y esto puede implicar que su dosis de insulina tenga que modificarse. A continuación se indican los principales medicamentos que pueden afectar a su tratamiento con insulina.
Su nivel de azúcar en sangre puede disminuir (hipoglucemia) si toma:
• Otros medicamentos para el tratamiento de diabetes
• Inhibidores de la monoaminoxidasa (IMAO) (utilizados para tratar la depresión)
• Beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial)
• Inhibidores de la enzima conversora de la angiotensina (ECA) (utilizados para tratar ciertas enfermedades del corazón o el aumento de la tensión arterial)
• Salicilatos (utilizados para aliviar el dolor y bajar la fiebre)
• Esteroides anabólicos (como testosterona)
• Sulfonamidas (utilizadas para tratar infecciones).
Su nivel de azúcar en sangre puede aumentar (hiperglucemia) si toma:
• Anticonceptivos orales (píldora anticonceptiva)
• Tiazidas (utilizadas para tratar el aumento de la tensión arterial o la retención de líquidos excesiva)
• Glucocorticoides (como “cortisona” utilizados para tratar la inflamación)
• Hormonas tiroideas (utilizadas para tratar las alteraciones de la glándula tiroidea)
• Simpaticomiméticos (como epinefrina [adrenalina] o salbutamol o terbutalina para tratar el asma)
• Hormona de crecimiento (medicamento para estimular el crecimiento somático y del esqueleto que influye de forma pronunciada en los procesos metabólicos)
• Danazol (medicamento que actúa sobre la ovulación).
Octreotida y lanreotida (utilizados para el tratamiento de la acromegalia, un trastorno hormonal poco frecuente que se suele dar normalmente en adultos de mediana edad, causado cuando la glándula pituitaria produce un exceso de hormona de crecimiento) pueden aumentar o disminuir sus niveles de azúcar en sangre.
Los beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial) pueden debilitar o suprimir por completo los primeros síntomas de aviso que podrían ayudarle a reconocer cuándo tiene los niveles de azúcar en sangre bajos.
Pioglitazona (comprimidos utilizados para el tratamiento de diabetes tipo 2)
Algunos pacientes con diabetes tipo 2 de larga duración y enfermedad cardiaca o ictus previo que fueron tratados con pioglitazona e insulina, desarrollaron insuficiencia cardiaca. Informe a su médico, lo antes posible, si tiene signos de insuficiencia cardiaca tales como una inusual falta de aire, aumento rápido de peso o inflamación localizada (edema).
Si ha tomado cualquiera de los medicamentos aquí mencionados, informe a su médico, enfermero o farmacéutico.
Bebidas alcohólicas y uso de Levemir
► Si bebe alcohol, puede cambiar su necesidad de insulina ya que su nivel de azúcar en sangre puede verse aumentado o disminuido. Se recomienda realizar un control cuidadoso.
Embarazo y lactancia
► Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Puede que sea necesario modificar la dosis de insulina mientras esté embarazada y tras el parto. Es importante para la salud de su bebé, un control cuidadoso de su diabetes y especialmente la prevención de hipoglucemias.
► Si está en periodo de lactancia, consulte a su médico ya que podría necesitar un ajuste en la dosis de insulina.
Consulte a su médico, enfermero o farmacéutico antes de utilizar cualquier medicamento mientras esté embarazada o en periodo de lactancia.
Conducción y uso de máquinas
► Por favor, pregunte a su médico si puede conducir o manejar una máquina:
• Si tiene hipoglucemias frecuentemente.
• Si le resulta difícil reconocer las hipoglucemias.
Si sus niveles de azúcar en sangre son bajos o altos, pueden afectar a su concentración y capacidad de reacción y por lo tanto, también a su capacidad para conducir un coche o manejar una máquina. Tenga en cuenta que podría poner en peligro su vida o la de otros.
Información importante sobre alguno de los componentes de Levemir
Levemir contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, Levemir está esencialmente exento de sodio.
3. Cómo usar Levemir
Posología y cuándo administrarse la insulina
Utilice siempre la insulina y ajuste la dosis exactamente tal y como le ha recomendado su médico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
No cambie de insulina a no ser que su médico se lo diga.
Es posible que su médico deba realizarle un ajuste de la dosis si:
• su médico le cambia de un tipo o marca de insulina a otro, o
• su médico le ha añadido otro medicamento para el tratamiento de la diabetes, además de su tratamiento de Levemir.
Uso en niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
No hay experiencia con el uso de Levemir en niños menores de 1 año de edad.
Uso en grupos de pacientes especiales
Si tiene mal funcionamiento de los riñones o el hígado (insuficiencia renal o hepática), o si tiene más de 65 años, debe controlar su azúcar en sangre más frecuentemente y consultar con su médico los cambios en su dosis de insulina.
Cada cuánto inyectarse
Cuando se utiliza en combinación con comprimidos para la diabetes y/o en combinación con antidiabéticos inyectables que no sean insulina, Levemir debe administrarse una vez al día. Cuando se utiliza como parte de un régimen bolo-basal, Levemir debe administrarse una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir debe ajustarse de forma individual. La inyección puede administrarse en cualquier momento del día, pero a la misma hora todos los días. En los pacientes que necesiten dos dosis al día para optimizar su control de azúcar en sangre, la dosis de la tarde puede administrarse por la tarde o antes de acostarse.
Cómo y dónde inyectarse
Levemir se inyecta bajo la piel (administración subcutánea). Nunca debe inyectarse Levemir directamente en una vena (administración intravenosa) o músculo (administración intramuscular).
En cada inyección, cambie el lugar de inyección dentro del área concreta de piel que suela utilizar. Esto puede reducir el riesgo de desarrollar abultamientos o depresiones en la piel (ver sección 4, Posibles efectos adversos). Las mejores zonas para la inyección son las siguientes: la parte frontal del muslo, la zona del abdomen y la parte exterior superior del brazo. Mida regularmente su nivel de azúcar en sangre.
Cómo manejar Levemir FlexPen
Levemir FlexPen es una pluma precargada, desechable con un código de colores que contiene insulina detemir.
Lea atentamente las instrucciones de uso que se incluyen en este prospecto. Debe utilizar la pluma tal y como se describe en las instrucciones de uso.
Asegúrese siempre de que usa la pluma correcta antes de inyectarse la insulina.
Si usa más insulina de la que debiera
Si usa demasiada insulina, su nivel de azúcar en sangre puede llegar a ser muy bajo (hipoglucemia). Ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
Si olvidó usar su insulina
Si olvidó inyectarse insulina, su nivel de azúcar en sangre puede llegar a ser muy alto (hiperglucemia). Ver c) Efectos de la diabetes en la sección 4.
Si interrumpe el tratamiento con su insulina
No interrumpa el tratamiento con su insulina sin consultar a su médico, él le dirá lo que debe hacer. Esto podría producir niveles de azúcar en sangre muy altos (hiperglucemia grave) y cetoacidosis. Ver c) Efectos de la diabetes en la sección 4.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
a) Resumen de efectos adversos graves y muy frecuentes
Bajo nivel de azúcar en sangre (hipoglucemia) es un efecto adverso muy frecuente. Puede afectar a más de 1 de cada 10 personas.
Pueden aparecer niveles bajos de azúcar en sangre si:
• Se inyecta demasiada insulina.
• Come muy poco o se salta una comida.
• Hace más ejercicio de lo habitual.
• Bebe alcohol (Ver Bebidas alcohólicas y uso de Levemir en la sección 2).
Síntomas de aviso de bajo nivel de azúcar en sangre: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, hambre excesiva, cambios temporales en la visión, somnolencia, cansancio y debilidad no habituales, nerviosismo o temblor, ansiedad, confusión y dificultad de concentración.
Una bajada de azúcar en la sangre grave puede dar lugar a la pérdida de consciencia. Si una bajada de azúcar en sangre grave y prolongada no se trata, puede causar lesión cerebral (transitoria o permanente) e incluso la muerte. Puede recuperar la consciencia más rápidamente si le administra una inyección de glucagón una persona que sepa cómo hacerlo. Si le administran glucagón, debe tomar glucosa o un producto azucarado tan pronto como recupere la consciencia. Si no responde al tratamiento con glucagón, deberá ser tratado en un hospital.
Qué hacer si su nivel de azúcar en sangre es bajo:
► Si su nivel de azúcar en sangre es bajo, tome comprimidos de glucosa o bien un producto azucarado (caramelos, galletas, zumo de frutas). Mida su nivel de azúcar en sangre si le es posible y luego descanse. Lleve siempre consigo comprimidos de glucosa o alimentos que contengan azúcar, por si acaso lo necesita.
► Cuando los síntomas de la hipoglucemia hayan desaparecido o cuando los niveles de azúcar en sangre se hayan estabilizado, continúe el tratamiento con insulina, como de costumbre
► Si ha tenido unos niveles de azúcar en sangre tan bajos que le han causado inconsciencia, si ha necesitado que le administraran una inyección de glucagón, o si ha tenido muchas bajadas de los niveles de azúcar en sangre, hable con su médico. Quizá tenga que ajustar la cantidad o pauta de administración de insulina, alimentación o ejercicio.
Informe a los demás de que tiene diabetes y de cuáles pueden ser las consecuencias, incluyendo el riesgo de perder la consciencia debido a una bajada en el nivel de azúcar en sangre. Infórmeles de que si se queda inconsciente deben recostarle de lado y buscar inmediatamente asistencia médica. No deben darle nada de comer o beber ya que podría asfixiarse.
Reacción alérgica grave a Levemir o a alguno de sus componentes (llamada reacción alérgica sistémica) es un efecto adverso muy raro, pero potencialmente mortal. Puede afectar hasta 1 de cada 10.000 personas.
Consulte inmediatamente al médico:
• Si los signos de alergia se extienden a otras partes de su cuerpo
• Si de repente se siente enfermo y tiene sudores, vómitos, dificultad para respirar, palpitaciones, se siente mareado.
► Si nota cualquiera de estos síntomas, consulte a su médico inmediatamente.
b) Lista de otros efectos adversos
Efectos adversos poco frecuentes
Pueden afectar hasta 1 de cada 100 personas.
Signos de alergia: pueden aparecer reacciones alérgicas locales en el lugar de la inyección (dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor). Estas reacciones suelen desaparecer después de unas pocas semanas de tratamiento. Si los síntomas no desaparecen, o si se extienden por su cuerpo, consulte a su médico inmediatamente. Ver también Reacción alérgica grave más arriba.
Problemas visuales: al empezar el tratamiento con insulina puede tener problemas con su visión, pero esta alteración suele ser temporal.
Cambios en el lugar de la inyección (lipodistrofia): el tejido graso bajo la piel en la zona de inyección puede reducirse (lipoatrofia) o aumentar (lipohipertrofia). Cambiando el lugar de inyección dentro de un área, se reduce el riesgo de desarrollar estos cambios en la piel. Si nota que su piel forma depresiones o está más gruesa en el área de inyección, hable con su médico o su enfermero. Estas reacciones pueden volverse más graves o pueden afectar a la absorción de su insulina si se inyecta en ese lugar.
Hinchazón de las articulaciones: al empezar el tratamiento con insulina la acumulación de líquido puede causar inflamación de los tobillos y otras articulaciones. Este efecto suele desaparecer rápidamente. Si no, consulte a su médico.
Retinopatía diabética (una enfermedad de los ojos relacionada con la diabetes que puede llevar a la pérdida de visión): si tiene retinopatía diabética y su nivel de azúcar en sangre mejora muy rápidamente, la retinopatía puede empeorar. Consulte a su médico.
Efectos adversos raros
Pueden afectar hasta 1 de cada 1.000 personas.
Neuropatía dolorosa (dolor debido a que el nervio está dañado): si su nivel de azúcar en sangre mejora muy rápidamente, puede sufrir un dolor relacionado con el nervio, esto es lo que se llama neuropatía dolorosa aguda y es habitualmente pasajera.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
c) Efectos de la diabetes
Alto nivel de azúcar en sangre (hiperglucemia)
Pueden aparecer niveles altos de azúcar en sangre si:
• No se ha inyectado suficiente insulina.
• Si olvida inyectarse la insulina o interrumpe el tratamiento con insulina.
• Si repetidamente se inyecta menos insulina de la que necesita.
• Si padece una infección o fiebre.
• Si come más de lo normal.
• Si hace menos ejercicio físico de lo normal.
Síntomas de aviso de alto nivel de azúcar en sangre:
Los síntomas de aviso aparecen gradualmente. Estos incluyen: aumento en la necesidad de orinar, sed, pérdida de apetito, sensación de mareo (náuseas o vómitos), somnolencia o cansancio, piel seca y enrojecida, sensación de sequedad en la boca y aliento con olor afrutado (acetona).
Qué hacer si su nivel de azúcar en sangre es muy alto:
► Si nota cualquiera de los síntomas descritos: controle su nivel de azúcar en sangre, controle el nivel de acetona en la orina si es posible y consulte inmediatamente al médico.
► Estos pueden ser síntomas de un trastorno muy grave llamado cetoacidosis diabética (se acumula ácido en la sangre debido a que el cuerpo degrada la grasa en lugar del azúcar). Si no se trata, podría producir un coma diabético y la muerte.
5. Conservación de Levemir
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del FlexPen y en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica. Conservar siempre el capuchón de la pluma en su FlexPen, cuando no se esté utilizando, para protegerlo de la luz.
Levemir debe protegerse del calor y la luz excesivos.
Antes de abrir: Levemir FlexPen que no se esté utilizando debe conservarse en la nevera entre 2°C y 8°C, alejado del elemento refrigerador. No congelar.
Durante el uso o cuando se lleva como repuesto: Levemir FlexPen que esté en uso o que se lleve como repuesto no debe conservarse en nevera. Puede llevarse encima y conservarse a temperatura ambiente (por debajo de 30°C) durante 6 semanas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Levemir
• El principio activo es insulina detemir. Cada ml contiene 100 unidades de insulina detemir. Cada pluma precargada contiene 300 unidades de insulina detemir en 3 ml de solución inyectable. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
• Los demás componentes son glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico, hidróxido sódico y agua para inyección.
Aspecto del producto y contenido del envase
Levemir se presenta como una solución inyectable.
Envases que contienen 1 (con o sin agujas), 5 (sin agujas) y 10 (sin agujas) plumas precargadas de 3 ml. Puede que no todas las presentaciones estén comercializadas.
Titular de la Autorización de Comercialización y responsable de la fabricación
Titular de la Autorización de Comercialización
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca Responsable de la fabricación
El responsable de la fabricación puede identificarse por el número de lote impreso en la tapa del cartón y en la etiqueta:
- Si el segundo y el tercer caracteres son S6, P5, K7, R7, VG, FG o ZF, el responsable de la fabricación es Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca.
- Si el segundo y el tercer caracteres son H7 o T6, el responsable de la fabricación es Novo Nordisk Production SAS, 45 Avenue d'Orléans, F-28000 Chartres, Francia.
Al dorso se incluyen las instrucciones de uso de FlexPen.
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Instrucciones de uso de LEVEMIR solución inyectable en FlexPen
Lea atentamente las siguientes instrucciones antes de utilizar su FlexPen. Si no sigue las instrucciones cuidadosamente, puede administrarse muy poca o demasiada insulina, lo cual podría producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
FlexPen es una pluma precargada dosificadora de insulina. Se pueden seleccionar dosis de 1 a 60 unidades en incrementos de 1 unidad. FlexPen está diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de una longitud de hasta 8 mm. Como medida de precaución, lleve siempre un dispositivo de administración de insulina de repuesto por si el FlexPen que está usando se perdiese o se estropease.
Levemir FlexPen
Capuchón de la pluma
Escala de insulina restante
Selector de dosis

\~ grande de la aguja ^ 1
Agujas (ejemplo)
Capuchón exterior
Capuchón interior — de la aguja
Lengüeta de papel
Cuidados de la pluma
Debe manejar su FlexPen con cuidado.
Si se cae, daña o golpea, hay riesgo de que se salga la insulina. Esto podría causar una dosificación inexacta, lo que puede producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
Puede limpiar la parte exterior de su FlexPen con un algodón impregnado en alcohol. No debe sumergirlo, lavarlo, ni lubricarlo ya que la pluma se puede estropear.
No rellene su FlexPen.
Preparación de Levemir FlexPen
Compruebe el nombre y la etiqueta de color de su pluma para asegurarse de que contiene el tipo correcto de insulina. Esto es especialmente importante si utiliza más de un tipo de insulina. Si utiliza un tipo de insulina equivocado, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo.
A
Retire el capuchón de la pluma.

B
Retire la lengüeta de papel de una nueva aguja desechable. Enrosque la aguja recta y firmemente en su FlexPen.

C
Retire el capuchón exterior grande de la aguja y guárdelo para más tarde.

Retire el capuchón interior de la aguja y deséchelo.
No intente volver a poner nunca el capuchón interior de la aguja. Podría pincharse con la aguja.

A Utilice siempre una aguja nueva para cada inyección. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administren dosificaciones inexactas.
A Tenga cuidado de no doblar o estropear la aguja antes de su uso.
Comprobación del flujo de insulina
Antes de cada inyección se pueden producir pequeñas cantidades de aire en el cartucho durante el uso normal. Para evitar la inyección de aire y asegurar una dosificación adecuada:
E
Gire el selector de dosis hasta seleccionar 2 unidades.

F
Sujete su FlexPen con la aguja apuntando hacia arriba y golpee el cartucho suavemente con el dedo unas cuantas veces para hacer que las burbujas de aire se depositen en la parte superior del cartucho.

Manteniendo la aguja hacia arriba, presione el pulsador a fondo. El selector de dosis vuelve a 0.
Una gota de insulina debería aparecer en la punta de la aguja. Si no, cambie la aguja y repita el procedimiento hasta un máximo de 6 veces.
Si una gota de insulina no aparece todavía, la pluma es defectuosa y debe utilizar una nueva.

A Asegúrese siempre de que aparezca una gota en la punta de la aguja antes de inyectarse. Así se
asegura de que la insulina fluye. Si no aparece una gota, no se inyectará insulina, aunque el
selector de dosis se mueva. Esto puede indicar que la aguja está bloqueada o dañada.
A Compruebe siempre el flujo antes de inyectarse. Si no comprueba el flujo, podría recibir una
cantidad de insulina insuficiente o incluso inexistente. Esto podría producir un nivel de azúcar
en sangre demasiado alto.
Selección de dosis
Compruebe que el selector de dosis señala el 0.
H
Gire el selector de dosis para seleccionar el número de unidades que necesita inyectarse.
La dosis se puede corregir hacia delante y hacia atrás girando el selector de dosis en cualquier
dirección hasta que la dosis corregida esté alineada con el marcador de dosis. Cuando gire el selector
de dosis tenga cuidado de no presionar el pulsador, ya que la insulina se puede salir.
No puede seleccionar una dosis mayor que el número de unidades que quedan en el cartucho.

A Antes de inyectarse la insulina, utilice siempre el selector de dosis y el marcador de dosis para ver cuántas unidades ha seleccionado.
A No cuente los clics de la pluma. Si selecciona una dosis incorrecta y se la inyecta, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo. No utilice la escala de insulina restante, ya que solo muestra la cantidad aproximada de insulina que queda en la pluma.
Inyección
Inserte la aguja bajo la piel. Utilice la técnica de inyección indicada por su médico o enfermero.
I
Inyecte la dosis presionando el pulsador hasta el fondo de tal forma que el 0 se quede alineado con el
marcador de dosis. Tenga cuidado de presionar el pulsador solamente cuando se esté inyectando.
Girando el selector de dosis no inyectará insulina.

J
Mantenga el pulsador completamente presionado y mantenga la aguja bajo la piel durante al menos 6 segundos. Esto asegurará que se ha inyectado la dosis completa.
Retire la aguja de la piel y una vez lo haya hecho deje de presionar el pulsador.
Asegúrese siempre que el selector de dosis vuelve a 0 después de la inyección. Si el selector de dosis se detiene antes de llegar a 0, no se ha administrado la dosis completa, lo que podría resultar en un nivel de azúcar en sangre demasiado alto.

K
Tape la aguja con el capuchón exterior grande sin tocarla. Cuando la aguja esté cubierta, presione con cuidado el capuchón exterior grande completamente y entonces desenrosque la aguja.
Deséchela con cuidado y ponga el capuchón de la pluma de nuevo en su FlexPen.

A Retire siempre la aguja después de cada inyección y conserve su FlexPen sin la aguja puesta. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administren dosificaciones inexactas.
Otra información importante
A Las personas que atienden a estos pacientes deben tener mucho cuidado cuando manejen agujas usadas para reducir el riesgo de pinchazos accidentales e infecciones.
A Deseche su FlexPen usado con cuidado sin dejar la aguja puesta.
A Nunca comparta la pluma o las agujas con otras personas. Esto podría producir infecciones.
A Nunca comparta la pluma con otras personas. Su medicamento podría ser perjudicial para la
salud de estas personas.
A Mantenga siempre la pluma y las agujas fuera de la vista y del alcance de otras personas, especialmente de los niños.
Prospecto: información para el usuario
Levemir 100 unidades/ml solución inyectable en pluma precargada
Insulina detemir
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Levemir y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Levemir
3. Cómo usar Levemir
4. Posibles efectos adversos
5. Conservación de Levemir
6. Contenido del envase e información adicional
1. Qué es Levemir y para qué se utiliza
Levemir es una insulina moderna (análogo de insulina) de acción prolongada. Las insulinas modernas son versiones mejoradas de la insulina humana.
Levemir se utiliza para reducir los niveles altos de azúcar en sangre en adultos, adolescentes y niños de 1 año de edad en adelante con diabetes. La diabetes es una enfermedad en la que el cuerpo no produce suficiente insulina para controlar el nivel de azúcar en sangre.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
Levemir tiene una acción prolongada y constante de reducción de azúcar a las 3 o 4 horas siguientes a la inyección. Levemir proporciona una cobertura de insulina basal de hasta 24 horas.
2. Qué necesita saber antes de empezar a usar Levemir No use Levemir
► Si es alérgico a la insulina detemir o a cualquiera de los demás componentes de este medicamento, ver sección 6, Contenido del envase e información adicional.
► Si sospecha que va a sufrir una hipoglucemia (bajo nivel de azúcar en sangre), ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
► En bombas de perfusión de insulina.
► Si InnoLet se ha caído, se ha dañado o se ha roto.
► Si no se ha guardado de la forma correcta o se ha congelado, ver sección 5, Conservación de Levemir.
► Si la insulina no tiene un aspecto transparente, incoloro y acuoso como el agua.
Si alguna de estas circunstancias le afecta, no use Levemir. Consulte a su médico, enfermero o farmacéutico.
► Compruebe la etiqueta y asegúrese de que la insulina es del tipo que le han recetado.
► Utilice siempre una aguja nueva en cada inyección para prevenir contaminaciones.
► Las agujas y Levemir InnoLet no deben compartirse.
Advertencias y precauciones
Algunas afecciones y actividades pueden afectar a su requerimiento de insulina. Consulte a su médico:
► Si tiene problemas de riñón, hígado, glándulas suprarrenales, hipófisis o glándula tiroidea.
► Si hace más ejercicio físico de lo normal o si desea cambiar su dieta, ya que esto puede afectar a su nivel de azúcar en sangre.
► Si está enfermo, continúe el tratamiento con insulina y consulte a su médico.
► Si proyecta viajar al extranjero, las diferencias horarias entre países pueden afectar a su requerimiento de insulina y al momento de administración de la misma.
► Si sus niveles de albúmina son muy bajos, controle cuidadosamente sus niveles de azúcar en sangre. Hable sobre este tema con su médico.
Niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
La seguridad y eficacia de Levemir en niños menores de 1 año de edad no ha sido establecida.
No hay datos disponibles.
Otros medicamentos y Levemir
Informe a su médico, enfermero o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Algunos medicamentos afectan a su nivel de azúcar en sangre y esto puede implicar que su dosis de insulina tenga que modificarse. A continuación se indican los principales medicamentos que pueden afectar a su tratamiento con insulina.
Su nivel de azúcar en sangre puede disminuir (hipoglucemia) si toma:
• Otros medicamentos para el tratamiento de diabetes
• Inhibidores de la monoaminoxidasa (IMAO) (utilizados para tratar la depresión)
• Beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial)
• Inhibidores de la enzima conversora de la angiotensina (ECA) (utilizados para tratar ciertas enfermedades del corazón o el aumento de la tensión arterial)
• Salicilatos (utilizados para aliviar el dolor y bajar la fiebre)
• Esteroides anabólicos (como testosterona)
• Sulfonamidas (utilizadas para tratar infecciones).
Su nivel de azúcar en sangre puede aumentar (hiperglucemia) si toma:
• Anticonceptivos orales (píldora anticonceptiva)
• Tiazidas (utilizadas para tratar el aumento de la tensión arterial o la retención de líquidos excesiva)
• Glucocorticoides (como “cortisona” utilizados para tratar la inflamación)
• Hormonas tiroideas (utilizadas para tratar las alteraciones de la glándula tiroidea)
• Simpaticomiméticos (como epinefrina [adrenalina] o salbutamol o terbutalina para tratar el asma)
• Hormona de crecimiento (medicamento para estimular el crecimiento somático y del esqueleto que influye de forma pronunciada en los procesos metabólicos)
• Danazol (medicamento que actúa sobre la ovulación).
Octreotida y lanreotida (utilizados para el tratamiento de la acromegalia, un trastorno hormonal poco frecuente que se suele dar normalmente en adultos de mediana edad, causado cuando la glándula pituitaria produce un exceso de hormona de crecimiento) pueden aumentar o disminuir sus niveles de azúcar en sangre.
Los beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial) pueden debilitar o suprimir por completo los primeros síntomas de aviso que podrían ayudarle a reconocer cuándo tiene los niveles de azúcar en sangre bajos.
Pioglitazona (comprimidos utilizados para el tratamiento de diabetes tipo 2)
Algunos pacientes con diabetes tipo 2 de larga duración y enfermedad cardiaca o ictus previo que fueron tratados con pioglitazona e insulina, desarrollaron insuficiencia cardiaca. Informe a su médico, lo antes posible, si tiene signos de insuficiencia cardiaca tales como una inusual falta de aire, aumento rápido de peso o inflamación localizada (edema).
Si ha tomado cualquiera de los medicamentos aquí mencionados, informe a su médico, enfermero o farmacéutico.
Bebidas alcohólicas y uso de Levemir
► Si bebe alcohol, puede cambiar su necesidad de insulina ya que su nivel de azúcar en sangre puede verse aumentado o disminuido. Se recomienda realizar un control cuidadoso.
Embarazo y lactancia
► Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Puede que sea necesario modificar la dosis de insulina mientras esté embarazada y tras el parto. Es importante para la salud de su bebé, un control cuidadoso de su diabetes y especialmente la prevención de hipoglucemias.
► Si está en periodo de lactancia, consulte a su médico ya que podría necesitar un ajuste en la dosis de insulina.
Consulte a su médico, enfermero o farmacéutico antes de utilizar cualquier medicamento mientras esté embarazada o en periodo de lactancia.
Conducción y uso de máquinas
► Por favor, pregunte a su médico si puede conducir o manejar una máquina:
• Si tiene hipoglucemias frecuentemente.
• Si le resulta difícil reconocer las hipoglucemias.
Si sus niveles de azúcar en sangre son bajos o altos, pueden afectar a su concentración y capacidad de reacción y por lo tanto, también a su capacidad para conducir un coche o manejar una máquina. Tenga en cuenta que podría poner en peligro su vida o la de otros.
Información importante sobre alguno de los componentes de Levemir
Levemir contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, Levemir está esencialmente exento de sodio.
3. Cómo usar Levemir
Posología y cuándo administrarse la insulina
Utilice siempre la insulina y ajuste la dosis exactamente tal y como le ha recomendado su médico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
No cambie de insulina a no ser que su médico se lo diga.
Es posible que su médico deba realizarle un ajuste de la dosis si:
• su médico le cambia de un tipo o marca de insulina a otro, o
• su médico le ha añadido otro medicamento para el tratamiento de la diabetes, además de su tratamiento de Levemir.
Uso en niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
No hay experiencia con el uso de Levemir en niños menores de 1 año de edad.
Uso en grupos de pacientes especiales
Si tiene mal funcionamiento de los riñones o el hígado (insuficiencia renal o hepática), o si tiene más de 65 años, debe controlar su azúcar en sangre más frecuentemente y consultar con su médico los cambios en su dosis de insulina.
Cada cuánto inyectarse
Cuando se utiliza en combinación con comprimidos para la diabetes y/o en combinación con antidiabéticos inyectables que no sean insulina, Levemir debe administrarse una vez al día. Cuando se utiliza como parte de un régimen bolo-basal, Levemir debe administrarse una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir debe ajustarse de forma individual. La inyección puede administrarse en cualquier momento del día, pero a la misma hora todos los días. En los pacientes que necesiten dos dosis al día para optimizar su control de azúcar en sangre, la dosis de la tarde puede administrarse por la tarde o antes de acostarse.
Cómo y dónde inyectarse
Levemir se inyecta bajo la piel (administración subcutánea). Nunca debe inyectarse Levemir directamente en una vena (administración intravenosa) o músculo (administración intramuscular). En cada inyección, cambie el lugar de inyección dentro del área concreta de piel que suela utilizar. Esto puede reducir el riesgo de desarrollar abultamientos o depresiones en la piel (ver sección 4, Posibles efectos adversos). Las mejores zonas para la inyección son las siguientes: la parte frontal del muslo, la zona del abdomen y la parte exterior superior del brazo. Mida regularmente su nivel de azúcar en sangre.
Cómo manejar Levemir InnoLet
Levemir InnoLet es una pluma precargada, desechable que contiene insulina detemir.
Lea atentamente las instrucciones de uso que se incluyen en este prospecto. Debe utilizar la pluma tal y como se describe en las instrucciones de uso.
Asegúrese siempre de que usa la pluma correcta antes de inyectarse la insulina.
Si usa más insulina de la que debiera
Si usa demasiada insulina, su nivel de azúcar en sangre puede llegar a ser muy bajo (hipoglucemia). Ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
Si olvidó inyectarse insulina, su nivel de azúcar en sangre puede llegar a ser muy alto (hiperglucemia). Ver c) Efectos de la diabetes en la sección 4.
Si interrumpe el tratamiento con su insulina
No interrumpa el tratamiento con su insulina sin consultar a su médico, él le dirá lo que debe hacer. Esto podría producir niveles de azúcar en sangre muy altos (hiperglucemia grave) y cetoacidosis. Ver c) Efectos de la diabetes en la sección 4.Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
a) Resumen de efectos adversos graves y muy frecuentes
Bajo nivel de azúcar en sangre (hipoglucemia) es un efecto adverso muy frecuente. Puede afectar a más de 1 de cada 10 personas.
Pueden aparecer niveles bajos de azúcar en sangre si:
• Se inyecta demasiada insulina.
• Come muy poco o se salta una comida.
• Hace más ejercicio de lo habitual.
• Bebe alcohol (Ver Bebidas alcohólicas y uso de Levemir en la sección 2).
Síntomas de aviso de bajo nivel de azúcar en sangre: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, hambre excesiva, cambios temporales en la visión, somnolencia, cansancio y debilidad no habituales, nerviosismo o temblor, ansiedad, confusión y dificultad de concentración.
Una bajada de azúcar en la sangre grave puede dar lugar a la pérdida de consciencia. Si una bajada de azúcar en sangre grave y prolongada no se trata, puede causar lesión cerebral (transitoria o permanente) e incluso la muerte. Puede recuperar la consciencia más rápidamente si le administra una inyección de glucagón una persona que sepa cómo hacerlo. Si le administran glucagón, debe tomar glucosa o un producto azucarado tan pronto como recupere la consciencia. Si no responde al tratamiento con glucagón, deberá ser tratado en un hospital.
Qué hacer si su nivel de azúcar en sangre es bajo:
► Si su nivel de azúcar en sangre es bajo, tome comprimidos de glucosa o bien un producto azucarado (caramelos, galletas, zumo de frutas). Mida su nivel de azúcar en sangre si le es posible y luego descanse. Lleve siempre consigo comprimidos de glucosa o alimentos que contengan azúcar, por si acaso lo necesita.
► Cuando los síntomas de la hipoglucemia hayan desaparecido o cuando los niveles de azúcar en sangre se hayan estabilizado, continúe el tratamiento con insulina, como de costumbre
► Si ha tenido unos niveles de azúcar en sangre tan bajos que le han causado inconsciencia, si ha necesitado que le administraran una inyección de glucagón, o si ha tenido muchas bajadas de los niveles de azúcar en sangre, hable con su médico. Quizá tenga que ajustar la cantidad o pauta de administración de insulina, alimentación o ejercicio.
Informe a los demás de que tiene diabetes y de cuáles pueden ser las consecuencias, incluyendo el riesgo de perder la consciencia debido a una bajada en el nivel de azúcar en sangre. Infórmeles de que si se queda inconsciente deben recostarle de lado y buscar inmediatamente asistencia médica. No deben darle nada de comer o beber ya que podría asfixiarse.
Reacción alérgica grave a Levemir o a alguno de sus componentes (llamada reacción alérgica sistémica) es un efecto adverso muy raro, pero potencialmente mortal. Puede afectar hasta 1 de cada 10.000 personas.
Consulte inmediatamente al médico:
• Si los signos de alergia se extienden a otras partes de su cuerpo
• Si de repente se siente enfermo y tiene sudores, vómitos, dificultad para respirar, palpitaciones, se siente mareado.
► Si nota cualquiera de estos síntomas, consulte a su médico inmediatamente.
b) Lista de otros efectos adversos
Efectos adversos poco frecuentes
Pueden afectar hasta 1 de cada 100 personas.
Signos de alergia: pueden aparecer reacciones alérgicas locales en el lugar de la inyección (dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor). Estas reacciones suelen desaparecer después de unas pocas semanas de tratamiento. Si los síntomas no desaparecen, o si se extienden por su cuerpo, consulte a su médico inmediatamente. Ver también Reacción alérgica grave más arriba.
Problemas visuales: al empezar el tratamiento con insulina puede tener problemas con su visión, pero esta alteración suele ser temporal.
Cambios en el lugar de la inyección (lipodistrofia): el tejido graso bajo la piel en la zona de inyección puede reducirse (lipoatrofia) o aumentar (lipohipertrofia). Cambiando el lugar de inyección dentro de un área, se reduce el riesgo de desarrollar estos cambios en la piel. Si nota que su piel forma depresiones o está más gruesa en el área de inyección, hable con su médico o su enfermero. Estas reacciones pueden volverse más graves o pueden afectar a la absorción de su insulina si se inyecta en ese lugar.
Hinchazón de las articulaciones: al empezar el tratamiento con insulina la acumulación de líquido puede causar inflamación de los tobillos y otras articulaciones. Este efecto suele desaparecer rápidamente. Si no, consulte a su médico.
Retinopatía diabética (una enfermedad de los ojos relacionada con la diabetes que puede llevar a la pérdida de visión): si tiene retinopatía diabética y su nivel de azúcar en sangre mejora muy rápidamente, la retinopatía puede empeorar. Consulte a su médico.
Efectos adversos raros
Pueden afectar hasta 1 de cada 1.000 personas.
Neuropatía dolorosa (dolor debido a que el nervio está dañado): si su nivel de azúcar en sangre mejora muy rápidamente, puede sufrir un dolor relacionado con el nervio, esto es lo que se llama neuropatía dolorosa aguda y es habitualmente pasajera.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
c) Efectos de la diabetes
Alto nivel de azúcar en sangre (hiperglucemia)
Pueden aparecer niveles altos de azúcar en sangre si:
• No se ha inyectado suficiente insulina.
• Si olvida inyectarse la insulina o interrumpe el tratamiento con insulina.
• Si repetidamente se inyecta menos insulina de la que necesita.
• Si padece una infección o fiebre.
• Si come más de lo normal.
• Si hace menos ejercicio físico de lo normal.
Síntomas de aviso de alto nivel de azúcar en sangre:
Los síntomas de aviso aparecen gradualmente. Estos incluyen: aumento en la necesidad de orinar, sed, pérdida de apetito, sensación de mareo (náuseas o vómitos), somnolencia o cansancio, piel seca y enrojecida, sensación de sequedad en la boca y aliento con olor afrutado (acetona).
Qué hacer si su nivel de azúcar en sangre es muy alto:
► Si nota cualquiera de los síntomas descritos: controle su nivel de azúcar en sangre, controle el nivel de acetona en la orina si es posible y consulte inmediatamente al médico.
► Estos pueden ser síntomas de un trastorno muy grave llamado cetoacidosis diabética (se acumula ácido en la sangre debido a que el cuerpo degrada la grasa en lugar del azúcar). Si no se trata, podría producir un coma diabético y la muerte.
5. Conservación de Levemir
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del InnoLet y en el envase después de “CAD”.La fecha de caducidad es el último día del mes que se indica. Conservar siempre el capuchón de la pluma en su InnoLet, cuando no se esté utilizando, para protegerlo de la luz.
Levemir debe protegerse del calor y la luz excesivos.
Antes de abrir: Levemir InnoLet que no se esté utilizando debe conservarse en la nevera entre 2°C y 8°C, alejado del elemento refrigerador. No congelar.
Durante el uso o cuando se lleva como repuesto: Levemir InnoLet que esté en uso o que se lleve como repuesto no debe conservarse en nevera. Puede llevarse encima y conservarse a temperatura ambiente (por debajo de 30°C) durante 6 semanas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Levemir
• El principio activo es insulina detemir. Cada ml contiene 100 unidades de insulina detemir. Cada pluma precargada contiene 300 unidades de insulina detemir en 3 ml de solución inyectable. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
• Los demás componentes son glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico, hidróxido sódico y agua para inyección.
Aspecto del producto y contenido del envase
Levemir se presenta como una solución inyectable.
Envases que contienen 1, 5 y 10 plumas precargadas de 3 ml. Puede que no todas las presentaciones estén comercializadas.
Titular de la Autorización de Comercialización y responsable de la fabricación Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca Al dorso se incluyen las instrucciones de uso de InnoLet.
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Instrucciones de uso de LEVEMIR solución inyectable en InnoLet
Lea atentamente las instrucciones antes de utilizar su InnoLet. Si no sigue las instrucciones cuidadosamente, puede administrarse muy poca o demasiada insulina, lo cual podría producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
InnoLet es una pluma precargada sencilla y compacta, capaz de administrar de 1 a 50 unidades en incrementos de 1 unidad. InnoLet está diseñado para ser utilizado con las agujas desechables NovoFine o NovoTwist de una longitud de hasta 8 mm. Como medida de precaución, lleve siempre un sistema de administración de insulina de repuesto por si el InnoLet que está usando se perdiese o se estropease.
Escala de
insulina
restante

Aguja desechable (ejemplo)
Ep— Aguja
Capuchón de la pluma

Lengüeta _Protector
de papel interior de la
U aguja

Protector exterior grande de la aguja
Primeros pasos
Compruebe el nombre y la etiqueta de color de InnoLet para asegurarse de que contiene el tipo correcto de insulina. Esto es especialmente importante si utiliza más de un tipo de insulina. Si utiliza un tipo de insulina equivocado, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo. Retire el capuchón de la pluma.
Montaje de la aguja
• Utilice siempre una aguja nueva para cada inyección. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administren dosificaciones inexactas.
• Tenga cuidado de no doblar o estropear la aguja antes de su uso.
• Retire la lengüeta de papel de una nueva aguja desechable.
• Enrosque recta y firmemente la aguja en su InnoLet (figura A).
• Retire el protector exterior grande y el protector interior de la aguja. El protector exterior grande de la aguja se puede guardar en el compartimento que hay para ello.
No intente volver a poner nunca el capuchón interior de la aguja. Podría pincharse con la aguja.

Preparación para eliminar el aire antes de cada inyección
Durante el uso pueden quedar pequeñas cantidades de aire en la aguja y en el cartucho de insulina.
Para evitar la inyección de aire y asegurar una dosificación correcta:
• Marque 2 unidades girando el selector de dosis en el sentido de las agujas del reloj.
• Sujete InnoLet con la aguja hacia arriba y golpee el cartucho suavemente con el dedo unas cuantas veces (figura B), para hacer que las burbujas de aire se depositen en la parte superior del cartucho.
• Manteniendo la aguja hacia arriba, presione el pulsador y el selector de dosis volverá a 0.
• Asegúrese siempre de que aparezca una gota en la punta de la aguja antes de inyectarse (figura B). Así se asegura de que la insulina fluye. Si esto no ocurre, cambie la aguja y repita el procedimiento 6 veces como máximo.
Si todavía no aparece una gota de insulina, el dispositivo es defectuoso y no debe utilizarse.
• Si no aparece una gota, no se inyectará insulina, aunque el selector de dosis se mueva. Esto puede indicar que la aguja está bloqueada o dañada.
• Compruebe siempre InnoLet antes de inyectarse. Si no comprueba InnoLet, podría recibir una cantidad de insulina insuficiente o incluso inexistente. Esto podría producir un nivel de azúcar en sangre demasiado alto.

Selección de dosis
• Compruebe siempre que el pulsador está completamente metido y el selector de dosis está en 0.
• Marque el número de unidades requerido girando el selector de dosis en el sentido de las agujas del reloj (figura C).
• Se oirá un clic por cada unidad marcada. La dosis se puede corregir a más o a menos girando el selector de dosis. Asegúrese de que no gira el selector de dosis o corrige la dosis una vez que la aguja esté bajo su piel. Esto podría producir una dosificación inexacta que puede hacer que su nivel de azúcar en sangre sea demasiado alto o demasiado bajo.
Antes de inyectarse la insulina, utilice siempre el selector de dosis y el marcador de dosis para ver cuántas unidades ha seleccionado. No cuente los clics de la pluma. Si selecciona una dosis incorrecta y se la inyecta, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo. No utilice la escala de insulina restante, ya que solo muestra la cantidad aproximada de insulina que queda en la pluma.
No se puede seleccionar una dosis mayor que el número de unidades que quedan en el cartucho.

Inyección de insulina
• Introduzca la aguja bajo la piel. Utilizar la técnica de inyección aconsejada por su médico.
• Administre la dosis presionando el pulsador a fondo (figura D). Se oirán clics según el selector de dosis vuelve a 0.
• Después de la inyección, mantenga la aguja bajo la piel al menos durante 6 segundos para asegurar que se ha administrado toda la dosis.
• Asegúrese que no bloquea el selector de dosis mientras se inyecta, ya que el selector de dosis debe volver a 0 según se presiona el pulsador. Asegúrese siempre que el selector de dosis vuelve a 0 después de la inyección. Si el selector de dosis se detiene antes de llegar a 0, no se ha administrado la dosis completa, lo que podría resultar en un nivel de azúcar en sangre demasiado alto.
• Deseche la aguja después de cada inyección.

Retirada de la aguja
Coloque el protector exterior grande de la aguja y desenrósquela (figura E). Deséchela con cuidado.
Ponga de nuevo el capuchón de la pluma en su InnoLet para proteger la insulina de la luz.

Utilice siempre una aguja nueva para cada inyección. Retire siempre y deseche la aguja después de cada inyección y conserve su InnoLet sin la aguja puesta. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administren dosificaciones inexactas.
Otra información importante
Las personas que atienden a estos pacientes deben tener mucho cuidado cuando manejen agujas usadas para reducir el riesgo de pinchazos accidentales e infecciones.
Deseche su InnoLet usado con cuidado sin dejar la aguja puesta.
Nunca comparta la pluma o las agujas con otras personas. Esto podría producir infecciones.
Nunca comparta la pluma con otras personas. Su medicamento podría ser perjudicial para la salud de estas personas.
Mantenga siempre su Innolet y las agujas fuera de la vista y del alcance de otras personas, especialmente de los niños.
Cuidados de la pluma
InnoLet está diseñado para funcionar con precisión y seguridad. Debe manejarse con cuidado. Si se cae, daña o golpea hay riesgo de que se salga la insulina. Esto podría causar una dosificación inexacta, lo que puede producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
Puede limpiar su InnoLet con un algodón impregnado en alcohol. No debe sumergirlo, lavarlo ni lubricarlo. Esto puede dañar el mecanismo y podría causar una dosificación incorrecta, lo que puede producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
No rellene su InnoLet.
Prospecto: información para el usuario
Levemir 100 unidades/ml solución inyectable en pluma precargada
Insulina detemir
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, enfermero o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Levemir y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Levemir
3. Cómo usar Levemir
4. Posibles efectos adversos
5. Conservación de Levemir
6. Contenido del envase e información adicional
1. Qué es Levemir y para qué se utiliza
Levemir es una insulina moderna (análogo de insulina) de acción prolongada. Las insulinas modernas son versiones mejoradas de la insulina humana.
Levemir se utiliza para reducir los niveles altos de azúcar en sangre en adultos, adolescentes y niños de 1 año de edad en adelante con diabetes. La diabetes es una enfermedad en la que el cuerpo no produce suficiente insulina para controlar el nivel de azúcar en sangre.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
Levemir tiene una acción prolongada y constante de reducción de azúcar a las 3 o 4 horas siguientes a la inyección. Levemir proporciona una cobertura de insulina basal de hasta 24 horas.
2. Qué necesita saber antes de empezar a usar Levemir No use Levemir
► Si es alérgico a la insulina detemir o a cualquiera de los demás componentes de este medicamento, ver sección 6, Contenido del envase e información adicional.
► Si sospecha que va a sufrir una hipoglucemia (bajo nivel de azúcar en sangre), ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
► En bombas de perfusión de insulina.
► Si FlexTouch se ha caído, se ha dañado o se ha roto.
► Si no se ha guardado de la forma correcta o se ha congelado, ver sección 5, Conservación de Levemir.
► Si la insulina no tiene un aspecto transparente, incoloro y acuoso como el agua.
Si alguna de estas circunstancias le afecta, no use Levemir. Consulte a su médico, enfermero o farmacéutico.
Antes de usar Levemir
► Compruebe la etiqueta y asegúrese de que la insulina es del tipo que le han recetado.
► Utilice siempre una aguja nueva en cada inyección para prevenir contaminaciones.
► Las agujas y Levemir FlexTouch no deben compartirse.
Advertencias y precauciones
Algunas afecciones y actividades pueden afectar a su requerimiento de insulina.
Consulte a su médico:
► Si tiene problemas de riñón, hígado, glándulas suprarrenales, hipófisis o glándula tiroidea.
► Si hace más ejercicio físico de lo normal o si desea cambiar su dieta, ya que esto puede afectar a su nivel de azúcar en sangre.
► Si está enfermo, continúe el tratamiento con insulina y consulte a su médico.
► Si proyecta viajar al extranjero, las diferencias horarias entre países pueden afectar a su requerimiento de insulina y al momento de administración de la misma.
► Si sus niveles de albúmina son muy bajos, controle cuidadosamente sus niveles de azúcar en sangre. Hable sobre este tema con su médico.
Niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
La seguridad y eficacia de Levemir en niños menores de 1 año de edad no ha sido establecida.
No hay datos disponibles.
Otros medicamentos y Levemir
Informe a su médico, enfermero o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Algunos medicamentos afectan a su nivel de azúcar en sangre y esto puede implicar que su dosis de insulina tenga que modificarse. A continuación se indican los principales medicamentos que pueden afectar a su tratamiento con insulina.
Su nivel de azúcar en sangre puede disminuir (hipoglucemia) si toma:
• Otros medicamentos para el tratamiento de diabetes
• Inhibidores de la monoaminoxidasa (IMAO) (utilizados para tratar la depresión)
• Beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial)
• Inhibidores de la enzima conversora de la angiotensina (ECA) (utilizados para tratar ciertas enfermedades del corazón o el aumento de la tensión arterial)
• Salicilatos (utilizados para aliviar el dolor y bajar la fiebre)
• Esteroides anabólicos (como testosterona)
• Sulfonamidas (utilizadas para tratar infecciones).
Su nivel de azúcar en sangre puede aumentar (hiperglucemia) si toma:
• Anticonceptivos orales (píldora anticonceptiva)
• Tiazidas (utilizadas para tratar el aumento de la tensión arterial o la retención de líquidos excesiva)
• Glucocorticoides (como “cortisona” utilizados para tratar la inflamación)
• Hormonas tiroideas (utilizadas para tratar las alteraciones de la glándula tiroidea)
• Simpaticomiméticos (como epinefrina [adrenalina] o salbutamol o terbutalina para tratar el asma)
• Hormona de crecimiento (medicamento para estimular el crecimiento somático y del esqueleto que influye de forma pronunciada en los procesos metabólicos)
• Danazol (medicamento que actúa sobre la ovulación).
Octreotida y lanreotida (utilizados para el tratamiento de la acromegalia, un trastorno hormonal poco frecuente que se suele dar normalmente en adultos de mediana edad, causado cuando la glándula pituitaria produce un exceso de hormona de crecimiento) pueden aumentar o disminuir sus niveles de azúcar en sangre.
Los beta-bloqueantes (utilizados para tratar el aumento de la tensión arterial) pueden debilitar o suprimir por completo los primeros síntomas de aviso que podrían ayudarle a reconocer cuándo tiene los niveles de azúcar en sangre bajos.
Pioglitazona (comprimidos utilizados para el tratamiento de diabetes tipo 2)
Algunos pacientes con diabetes tipo 2 de larga duración y enfermedad cardiaca o ictus previo que fueron tratados con pioglitazona e insulina, desarrollaron insuficiencia cardiaca. Informe a su médico, lo antes posible, si tiene signos de insuficiencia cardiaca tales como una inusual falta de aire, aumento rápido de peso o inflamación localizada (edema).
Si ha tomado cualquiera de los medicamentos aquí mencionados, informe a su médico, enfermero o farmacéutico.
Bebidas alcohólicas y uso de Levemir
► Si bebe alcohol, puede cambiar su necesidad de insulina ya que su nivel de azúcar en sangre puede verse aumentado o disminuido. Se recomienda realizar un control cuidadoso.
Embarazo y lactancia
► Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Puede que sea necesario modificar la dosis de insulina mientras esté embarazada y tras el parto. Es importante para la salud de su bebé, un control cuidadoso de su diabetes y especialmente la prevención de hipoglucemias.
► Si está en periodo de lactancia, consulte a su médico ya que podría necesitar un ajuste en la dosis de insulina.
Consulte a su médico, enfermero o farmacéutico antes de utilizar cualquier medicamento mientras esté embarazada o en periodo de lactancia.
Conducción y uso de máquinas
► Por favor, pregunte a su médico si puede conducir o manejar una máquina:
• Si tiene hipoglucemias frecuentemente.
• Si le resulta difícil reconocer las hipoglucemias.
Si sus niveles de azúcar en sangre son bajos o altos, pueden afectar a su concentración y capacidad de reacción y por lo tanto, también a su capacidad para conducir un coche o manejar una máquina. Tenga en cuenta que podría poner en peligro su vida o la de otros.
Información importante sobre alguno de los componentes de Levemir
Levemir contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, Levemir está esencialmente exento de sodio.
3. Cómo usar Levemir
Posología y cuándo administrarse la insulina
Utilice siempre la insulina y ajuste la dosis exactamente tal y como le ha recomendado su médico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
Levemir se puede utilizar con insulinas de acción rápida administradas en relación con las comidas.
En el tratamiento de la diabetes mellitus tipo 2, Levemir también se puede utilizar en combinación con comprimidos para la diabetes y/o con antidiabéticos inyectables que no sean insulina.
No cambie de insulina a no ser que su médico se lo diga.
Es posible que su médico deba realizarle un ajuste de la dosis si:
• su médico le cambia de un tipo o marca de insulina a otro, o
• su médico le ha añadido otro medicamento para el tratamiento de la diabetes, además de su tratamiento de Levemir.
Uso en niños y adolescentes
Levemir se puede utilizar en adolescentes y niños de 1 año de edad en adelante.
No hay experiencia con el uso de Levemir en niños menores de 1 año de edad.
Uso en grupos de pacientes especiales
Si tiene mal funcionamiento de los riñones o el hígado (insuficiencia renal o hepática), o si tiene más de 65 años, debe controlar su azúcar en sangre más frecuentemente y consultar con su médico los cambios en su dosis de insulina.
Cada cuánto inyectarse
Cuando se utiliza en combinación con comprimidos para la diabetes y/o en combinación con antidiabéticos inyectables que no sean insulina, Levemir debe administrarse una vez al día. Cuando se utiliza como parte de un régimen bolo-basal, Levemir debe administrarse una o dos veces al día dependiendo de las necesidades del paciente. La dosis de Levemir debe ajustarse de forma individual. La inyección puede administrarse en cualquier momento del día, pero a la misma hora todos los días. En los pacientes que necesiten dos dosis al día para optimizar su control de azúcar en sangre, la dosis de la tarde puede administrarse por la tarde o antes de acostarse.
Cómo y dónde inyectarse
Levemir se inyecta bajo la piel (administración subcutánea). Nunca debe inyectarse Levemir directamente en una vena (administración intravenosa) o músculo (administración intramuscular). En cada inyección, cambie el lugar de inyección dentro del área concreta de piel que suela utilizar. Esto puede reducir el riesgo de desarrollar abultamientos o depresiones en la piel (ver sección 4, Posibles efectos adversos). Las mejores zonas para la inyección son las siguientes: la parte frontal del muslo, la zona del abdomen y la parte exterior superior del brazo. Mida regularmente su nivel de azúcar en sangre.
Cómo manejar Levemir FlexTouch
Levemir FlexTouch es una pluma precargada, desechable con un código de colores que contiene insulina detemir.
Lea atentamente las instrucciones de uso que se incluyen en este prospecto. Debe utilizar la pluma tal y como se describe en las instrucciones de uso.
Asegúrese siempre de que usa la pluma correcta antes de inyectarse la insulina.
Si usa más insulina de la que debiera
Si usa demasiada insulina, su nivel de azúcar en sangre puede llegar a ser muy bajo, (hipoglucemia). Ver a) Resumen de efectos adversos graves y muy frecuentes en la sección 4.
Si olvidó usar su insulina
Si olvidó inyectarse insulina, su nivel de azúcar en sangre puede llegar a ser muy alto, (hiperglucemia). Ver c) Efectos de la diabetes en la sección 4.
Si interrumpe el tratamiento con su insulina
No interrumpa el tratamiento con su insulina sin consultar a su médico, él le dirá lo que debe hacer. Esto podría producir niveles de azúcar en sangre muy altos (hiperglucemia grave) y cetoacidosis. Ver c) Efectos de la diabetes en la sección 4.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
a) Resumen de efectos adversos graves y muy frecuentes
Bajo nivel de azúcar en sangre (hipoglucemia) es un efecto adverso muy frecuente. Puede afectar a más de 1 de cada 10 personas.
Pueden aparecer niveles bajos de azúcar en sangre si:
• Se inyecta demasiada insulina.
• Come muy poco o se salta una comida.
• Hace más ejercicio de lo habitual.
• Bebe alcohol (Ver Bebidas alcohólicas y uso de Levemir en la sección 2).
Síntomas de aviso de bajo nivel de azúcar en sangre: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, hambre excesiva, cambios temporales en la visión, somnolencia, cansancio y debilidad no habituales, nerviosismo o temblor, ansiedad, confusión y dificultad de concentración.
Una bajada de azúcar en la sangre grave puede dar lugar a la pérdida de consciencia. Si una bajada de azúcar en sangre grave y prolongada no se trata, puede causar lesión cerebral (transitoria o permanente) e incluso la muerte. Puede recuperar la consciencia más rápidamente si le administra una inyección de glucagón una persona que sepa cómo hacerlo. Si le administran glucagón, debe tomar glucosa o un producto azucarado tan pronto como recupere la consciencia. Si no responde al tratamiento con glucagón, deberá ser tratado en un hospital.
Qué hacer si su nivel de azúcar en sangre es bajo:
► Si su nivel de azúcar en sangre es bajo, tome comprimidos de glucosa o bien un producto azucarado (caramelos, galletas, zumo de frutas). Mida su nivel de azúcar en sangre si le es posible y luego descanse. Lleve siempre consigo comprimidos de glucosa o alimentos que contengan azúcar, por si acaso lo necesita.
► Cuando los síntomas de la hipoglucemia hayan desaparecido o cuando los niveles de azúcar en sangre se hayan estabilizado, continúe el tratamiento con insulina, como de costumbre
► Si ha tenido unos niveles de azúcar en sangre tan bajos que le han causado inconsciencia, si ha necesitado que le administraran una inyección de glucagón, o si ha tenido muchas bajadas de los niveles de azúcar en sangre, hable con su médico. Quizá tenga que ajustar la cantidad o pauta de administración de insulina, alimentación o ejercicio.
Informe a los demás de que tiene diabetes y de cuáles pueden ser las consecuencias, incluyendo el riesgo de perder la consciencia debido a una bajada en el nivel de azúcar en sangre. Infórmeles de que si se queda inconsciente deben recostarle de lado y buscar inmediatamente asistencia médica. No deben darle nada de comer o beber ya que podría asfixiarse.
Reacción alérgica grave a Levemir o a alguno de sus componentes (llamada reacción alérgica sistémica) es un efecto adverso muy raro, pero potencialmente mortal. Puede afectar hasta 1 de cada 10.000 personas.
Consulte inmediatamente al médico:
• Si los signos de alergia se extienden a otras partes de su cuerpo
• Si de repente se siente enfermo y tiene sudores, vómitos, dificultad para respirar, palpitaciones, se siente mareado.
► Si nota cualquiera de estos síntomas, consulte a su médico inmediatamente.
b) Lista de otros efectos adversos
Efectos adversos poco frecuentes
Pueden afectar hasta 1 de cada 100 personas.
Signos de alergia: pueden aparecer reacciones alérgicas locales en el lugar de la inyección (dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y picor). Estas reacciones suelen desaparecer después de unas pocas semanas de tratamiento. Si los síntomas no desaparecen, o si se extienden por su cuerpo, consulte a su médico inmediatamente. Ver también Reacción alérgica grave más arriba.
Problemas visuales: al empezar el tratamiento con insulina puede tener problemas con su visión, pero esta alteración suele ser temporal.
Cambios en el lugar de la inyección (lipodistrofia): el tejido graso bajo la piel en la zona de inyección puede reducirse (lipoatrofia) o aumentar (lipohipertrofia). Cambiando el lugar de inyección dentro de un área, se reduce el riesgo de desarrollar estos cambios en la piel. Si nota que su piel forma depresiones o está más gruesa en el área de inyección, hable con su médico o su enfermero. Estas reacciones pueden volverse más graves o pueden afectar a la absorción de su insulina si se inyecta en ese lugar.
Hinchazón de las articulaciones: al empezar el tratamiento con insulina la acumulación de líquido puede causar inflamación de los tobillos y otras articulaciones. Este efecto suele desaparecer rápidamente. Si no, consulte a su médico.
Retinopatía diabética (una enfermedad de los ojos relacionada con la diabetes que puede llevar a la pérdida de visión): si tiene retinopatía diabética y su nivel de azúcar en sangre mejora muy rápidamente, la retinopatía puede empeorar. Consulte a su médico.
Efectos adversos raros
Pueden afectar hasta 1 de cada 1.000 personas.
Neuropatía dolorosa (dolor debido a que el nervio está dañado): si su nivel de azúcar en sangre mejora muy rápidamente, puede sufrir un dolor relacionado con el nervio, esto es lo que se llama neuropatía dolorosa aguda y es habitualmente pasajera.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información
sobre la seguridad de este medicamento.
c) Efectos de la diabetes
Alto nivel de azúcar en sangre (hiperglucemia)
Pueden aparecer niveles altos de azúcar en sangre si:
• No se ha inyectado suficiente insulina.
• Si olvida inyectarse la insulina o interrumpe el tratamiento con insulina.
• Si repetidamente se inyecta menos insulina de la que necesita.
• Si padece una infección o fiebre.
• Si come más de lo normal.
• Si hace menos ejercicio físico de lo normal.
Síntomas de aviso de alto nivel de azúcar en sangre:
Los síntomas de aviso aparecen gradualmente. Estos incluyen: aumento en la necesidad de orinar, sed, pérdida de apetito, sensación de mareo (náuseas o vómitos), somnolencia o cansancio, piel seca y enrojecida, sensación de sequedad en la boca y aliento con olor afrutado (acetona).
Qué hacer si su nivel de azúcar en sangre es muy alto:
► Si nota cualquiera de los síntomas descritos: controle su nivel de azúcar en sangre, controle el nivel de acetona en la orina si es posible y consulte inmediatamente al médico.
► Estos pueden ser síntomas de un trastorno muy grave llamado cetoacidosis diabética (se acumula ácido en la sangre debido a que el cuerpo degrada la grasa en lugar del azúcar). Si no se trata, podría producir un coma diabético y la muerte.
5. Conservación de Levemir
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del FlexTouch y en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar siempre el capuchón de la pluma en su FlexTouch, cuando no se esté utilizando, para protegerlo de la luz.
Levemir debe protegerse del calor y la luz excesivos.
Antes de abrir: Levemir FlexTouch que no se esté utilizando debe conservarse en la nevera entre 2°C y 8°C, alejado del elemento refrigerador. No congelar.
Durante el uso o cuando se lleva como repuesto: Levemir FlexTouch que esté en uso o que se lleve como repuesto no debe conservarse en nevera. Puede llevarse encima y conservarse a temperatura ambiente (por debajo de 30°C) durante 6 semanas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Levemir
• El principio activo es insulina detemir. Cada ml contiene 100 unidades de insulina detemir. Cada pluma precargada contiene 300 unidades de insulina detemir en 3 ml de solución
inyectable. 1 unidad de insulina detemir corresponde a 1 unidad internacional de insulina humana.
• Los demás componentes son glicerol, fenol, metacresol, acetato de zinc, fosfato disódico dihidrato, cloruro sódico, ácido clorhídrico, hidróxido sódico y agua para inyección.
Aspecto del producto y contenido del envase
Levemir se presenta como una solución inyectable.
Envases que contienen 1 (con o sin agujas), 5 (sin agujas) o envase múltiple con 2 x 5 (sin agujas) plumas precargadas de 3 ml. Puede que no todas las presentaciones estén comercializadas.
Titular de la Autorización de Comercialización y responsable de la fabricación
Novo Nordisk A/S, Novo Allé, DK-2880 Bagsv^rd, Dinamarca
Al dorso se incluyen las instrucciones de uso de FlexTouch.
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Instrucciones de uso de Levemir 100 unidades/ml solución inyectable en pluma precargada (FlexTouch)
Lea atentamente estas instrucciones antes de utilizar su pluma precargada FlexTouch. Si no
sigue las instrucciones cuidadosamente, puede administrarse muy poca o demasiada insulina, lo cual podría producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
No utilice la pluma sin haber recibido la formación adecuada de su médico o enfermero.
Empiece comprobando la pluma para asegurarse de que contiene Levemir 100 unidades/ml y
después observe las ilustraciones para familiarizarse con las diferentes partes de la pluma y de la aguja.
Si es usted invidente o tiene visión reducida y no puede leer el contador de dosis de la pluma, no utilice esta pluma sin ayuda. Busque la ayuda de una persona que vea bien y esté formada en el uso de la pluma precargada FlexTouch.
Su pluma Levemir FlexTouch es una pluma precargada de insulina. Levemir FlexTouch contiene 300 unidades de insulina y con ella se pueden seleccionar dosis de 1 a 80 unidades, en incrementos de 1 unidad.
Levemir FlexTouch está diseñada para ser utilizada con las agujas desechables de un solo uso NovoFine o NovoTwist de una longitud de hasta 8 mm.
Levemir FlexTouch
Escala de Ventana de Eti(lueta de Contador Marcador Selector Botón insulina insulina a p , a de dosis de dosis de dosis de dosis

Aguja (ejemplo)
Capuchón
interior de Aguja Lengüeta de
la aguja papel
Capuchón exterior de la aguja


Preparación de la pluma Levemir FlexTouch
Compruebe el nombre y la etiqueta de color de su pluma Levemir FlexTouch para asegurarse de que contiene el tipo de insulina que necesita. Esto es especialmente importante si utiliza más de un tipo de insulina. Si utiliza un tipo de insulina equivocado, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo.
A. Retire el capuchón de la pluma.

B. Compruebe que la insulina de su pluma tiene un aspecto transparete e incoloro.
Mire a través de la ventana de insulina. Si la insulina tiene un aspecto turbio, no utilice la pluma.

C. Coja una nueva aguja desechable y retire la lengüeta de papel.

D. Enrosque la aguja recta en la pluma. Asegúrese de que la aguja está bien sujeta.

E. Retire el capuchón exterior de la aguja y guárdelo. Lo necesitará después de la inyección para retirar correctamente la aguja de la pluma.
Retire el capuchón interior de la aguja y tírelo. Si intenta ponerlo de nuevo, podría pincharse accidentalmente con la aguja.
Puede aparecer una gota de insulina en la punta de la aguja. Es normal.

A Utilice siempre una aguja nueva para cada inyección. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administren dosificaciones inexactas.
A Nunca utilice una aguja doblada o dañada.
Comprobación del flujo de insulina
Asegúrese de que se administra la dosis completa comprobando el flujo de insulina antes de seleccionar e inyectar la dosis.
F. Gire el selector de dosis hasta seleccionar 2 unidades.

G. Sujete la pluma con la aguja apuntando hacia arriba.
Golpee suavemente con el dedo la parte superior de la pluma unas cuantas veces para que las burbujas de aire suban a la parte superior.

H. Presione el pulsador con el pulgar hasta que el contador de dosis vuelva a 0. El 0 debe quedar alineado con el marcador de dosis. Una gota de insulina aparecerá en la punta de la aguja.
Si no aparece ninguna gota, repita los pasos de la F a la H hasta 6 veces. Si después de estos nuevos intentos no aparece una gota, cambie la aguja y repita los pasos de la F a la H una vez más.
No utilice la pluma si aún así no aparece una gota de insulina.

A Asegúrese siempre de que aparece una gota en la punta de la aguja antes de inyectarse. Así se asegura de que la insulina fluye. Si no aparece una gota, no se inyectará insulina, aunque el contador de dosis se mueva. Esto puede indicar que la aguja está bloqueada o dañada.
A Compruebe siempre el flujo antes de inyectarse. Si no comprueba el flujo, podría recibir una cantidad de insulina insuficiente o incluso inexistente. Esto podría producir un nivel de azúcar en sangre demasiado alto.
Selección de dosis
Utilice el selector de dosis en la pluma Levemir FlexTouch para seleccionar su dosis. Puede seleccionar hasta 80 unidades en cada dosis.
I. Seleccione la dosis que necesita. Puede girar el selector de dosis hacia delante y hacia atrás. Deténgase cuando el número correcto de unidades esté alineado con el marcador de dosis.
El selector de dosis hace clic de forma diferente cuando se gira hacia delante, hacia atrás o se pasa del número de unidades que quedan.
Cuando la pluma contiene menos de 80 unidades, el contador de dosis se detiene en el número de unidades que quedan.

A Antes de inyectarse la insulina utilice siempre el selector de dosis y el marcador de dosis para ver cuántas unidades ha seleccionado.
No cuente los clics de la pluma. Si selecciona una dosis incorrecta y se la inyecta, su nivel de azúcar en sangre puede llegar a ser demasiado alto o demasiado bajo.
No utilice la escala de insulina restante, ya que solo muestra la cantidad aproximada de insulina que queda en la pluma.
<D ¿Cuánta insulina queda?
La escala de insulina muestra la cantidad aproximada de insulina que queda en la pluma.

Para saber cuánta insulina queda exactamente, utilice el contador de dosis:
Gire el selector de dosis hasta que el contador de dosis se detenga. Si muestra 80, significa que quedan al menos 80 unidades en su pluma. El número que aparece alineado con el marcador muestra cuántas unidades quedan.
Si muestra menos de 80, el número indica la cantidad de unidades que quedan en la pluma.
Gire el selector de dosis hacia atrás hasta que el contador de dosis muestre 0.
Si necesita más insulina de las unidades que quedan en la pluma, puede dividir la dosis entre dos plumas.

Ejemplo
Contador de dosis parado: quedan 52 unidades

A Tenga mucho cuidado de hacer el cálculo correctamente si divide su dosis.
Si no está seguro, inyéctese la dosis completa con una pluma nueva. Si divide incorrectamente la dosis, se inyectará muy poca o demasiada insulina, lo cual puede producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
Inyección de la dosis
Asegúrese de que se administra la dosis completa utilizando de la técnica correcta de inyección.
J. Inserte la aguja bajo la piel tal y como le han enseñado su médico o enfermero. Asegúrese de que puede ver el contador de dosis. No toque el contador de dosis con los dedos. Esto podría interrumpir la inyección.
Presione el pulsador hasta que el contador de dosis vuelva a 0. El 0 debe quedar alineado con el marcador de dosis. Podría oir o sentir un clic.
® Después de que el contador de dosis haya vuelto a 0, mantenga la aguja bajo la piel durante al menos 6 segundos para asegurarse de que se ha administrado la dosis completa.

K. Retire la aguja de la piel.
A continuación, puede aparecer una gota de insulina en la punta de la aguja. Esto es normal y no afecta a la dosis que se acaba de inyectar.

® Deseche siempre la aguja después de cada inyección. Así reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administre una dosificación incorrecta. Si la aguja se atasca, no se inyectará insulina.
L. Sobre una superficie plana arrastre la punta de la aguja hasta introducirla en el capuchón exterior. No toque la aguja o el capuchón.
Cuando la aguja esté cubierta, presione con cuidado el capuchón exterior a fondo y a continuación desenrosque la aguja. Deséchela con cuidado y ponga el capuchón de la pluma de nuevo después de cada uso.
Cuando la pluma esté vacía, tírela sin la aguja puesta tal y como le han indicado su médico, enfermero, farmacéutico o autoridades locales.

Á Mire siempre el contador de dosis para saber cuántas unidades se inyecta. El contador de dosis mostrará el número exacto de unidades. No cuente los clics de la pluma.
Mantenga presionado el botón de dosis hasta que el contador de dosis vuelva a 0 después de la inyección. Si el contador de dosis se detiene antes de volver a 0, no se habrá administrado la dosis completa, lo que podría resultar en un nivel de azúcar en sangre demasiado alto.
A Nunca intente volver a poner el capuchón interior de la aguja. Podría pincharse con la aguja.
A Retire siempre la aguja después de cada inyección y conserve su pluma sin la aguja puesta. Así se reduce el riesgo de contaminación, infección, pérdida de insulina, que las agujas se atasquen y de que se administre una dosificación incorrecta.
Cuidados de la pluma
Trate su pluma con cuidado. El manejo brusco o el mal uso pueden causar una dosificación inexacta, lo que puede producir un nivel de azúcar en sangre demasiado alto o demasiado bajo.
• No deje la pluma en el coche ni en otro lugar donde pueda calentarse o enfriarse en exceso.
• No exponga la pluma al polvo, la suciedad o líquidos.
• No lave, sumerja ni lubrique la pluma. Si es necesario, límpiela con un paño humedecido con un detergente suave.
• Procure que la pluma no se caiga ni golpee contra superficies duras. Si se le cae o sospecha que pueda tener un problema, coloque una nueva aguja y compruebe el flujo de insulina antes de inyectarse la dosis.
• No intente rellenar la pluma.Una vez vacía, se debe desechar.
• No intente reparar la pluma o separar sus componentes.
A Información importante
• Lleve siempre su pluma con usted.
• Lleve siempre una pluma de repuesto y agujas nuevas consigo, en caso de pérdida o rotura.
• Mantenga siempre la pluma y las agujas fuera de la vista y del alcance de otras personas,
especialmente de los niños.
• Nunca comparta la pluma o las agujas con otras personas. Esto podría producir infecciones cruzadas.
• Nunca comparta la pluma con otras personas. Su medicamento podría ser perjudicial para la salud de estas personas.
• Las personas que atienden a estos pacientes deben tener mucho cuidado cuando manejen agujas usadas para reducir el riesgo de daño con la aguja e infección cruzada.
124