Kabiven Periferico Emulsion Para Perfusion
Prospecto: información para el usuario Kabiven Periférico emulsión para perfusión
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted:
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es Kabiven Periférico y para qué se utiliza
2. Qué necesita saber antes de empezar a usa Kabiven Periférico
3. Cómo usar Kabiven Periférico
4. Posibles efectos adversos
5. Conservación de Kabiven Periférico
6. Contenido del envase e información adicional
1. Qué es Kabiven Periférico y para qué se utiliza
Kabiven Periférico se presenta en una bolsa de tres cámaras con sobrebolsa, que contiene los siguientes medicamentos: aminoácidos (componentes utilizados para construir proteínas), lípidos, glucosa y electrolitos.
Proporciona energía (en forma de azúcar y lípidos) y aminoácidos (proteínas) a su flujo sanguíneo cuando usted no puede alimentarse normalmente.
Se utiliza como parte de una dieta intravenosa equilibrada, conjuntamente con sales, elementos traza y vitaminas para cumplir de forma completa con sus necesidades nutricionales.
2. Qué necesita saber antes de que se le administre Kabiven Periférico
No use Kabiven Periférico:
• si es alérgico a alguna sustancia activa o a alguno de los componentes de este medicamento (listados
en sección 6)
• si es alérgico a productos que contengan huevo, soja o cacahuete
• si tiene demasiadas sustancias grasas (como colesterol) en su sangre
• si tiene su función hepática gravemente disminuida
• si sufre shock agudo (dando lugar a pérdida de sangre importante o reacción alérgica)
• si tiene alteraciones hemorrágicas asociadas con una situación conocida (como síndrome
hemofagocitótico) o si su sangre no coagula adecuadamente
• si presenta una situación en la que su organismo tiene problemas en la utilización de proteínas o
aminoácidos
• si tiene problemas graves en sus riñones
• si presenta hiperglicemia (demasiado azúcar en su sangre) que requiere la administración de más
de 6 unidades de insulina por hora
• si tiene niveles elevados de electrolitos (sales) en su sangre
• si tiene acidosis metabólica (los niveles de ácido en sus líquidos corporales y tejidos son demasiado
elevados)
• si presenta demasiado líquido en su organismo - hiperhidratación
• si tiene líquido en sus pulmones (edema pulmonar agudo)
• si está en coma
• si padece problemas de corazón
• si está deshidratado con bajos niveles de sales
• si tiene sepsis grave (una situación en la que su organismo padece una infección grave)
Advertencias y precauciones
Informe a su médico antes de que se le administre Kabiven Periférico si tiene
• función hepática disminuida
• diabetes descompensada
• una situación en la que su organismo presenta problemas en la utilización de lípidos de forma
adecuada
• alteración en los riñones
• cualquier problema en el páncreas
• problemas de tiroides - hipotiroidismo
• sepsis (una situación en la que su organismo sufre una infección)
• su organismo tiene problemas para la eliminación de electrolitos
• una situación en la que no hay suficiente oxígeno en sus células corporales
• osmolaridad sérica incrementada
Si durante la perfusión usted sufre fiebre, erupción cutánea, escalofríos o dificultad para respirar, informe al profesional sanitario inmediatamente. Estos síntomas pueden ser causados por una reacción alérgica o porque usted ha recibido demasiado medicamento (ver sección 4).
Este medicamento puede afectar a los resultados de otras pruebas que le realicen. Es importante que le comunique al médico que va a realizar las pruebas, que está recibiendo Kabiven Periférico.
Su médico puede realizarle de forma regular análisis de sangre para garantizar que su organismo está recibiendo Kabiven Periférico correctamente.
Niños
Kabiven Periférico no será administrado a recién nacidos o niños menores de dos años de edad.
Uso de Kabiven Periférico con otros medicamentos
Informe a su médico o farmacéutico, si está tomando, ha tomado recientemente o podría tener que tomar otros medicamentos.
Informe a su médico si está tomando
• un fármaco conocido como heparina que es utilizado para prevenir la formación de coágulos de
sangre y para ayudar a la dispersión de los mismos
• warfarina como vitamina K1, que se encuentra en el aceite de soja y que podría afectar a la
capacidad de coagulación de la sangre
• insulina para el tratamiento de la diabetes
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéútico antes de utilizar este medicamento.
La seguridad de uso de Kabiven Periférico durante el embarazo y la lactancia no ha sido comprobada. Si es necesaria la nutrición a través de sus venas (nutrición parenteral) durante el embarazo o la lactancia, su médico le administrará Kabiven Periférico sólo después de una exhaustiva consideración.
Conducción y uso de máquinas
No se espera que Kabiven Periférico afecte a la capacidad para conducir y usar máquinas.
3. Cómo usar Kabiven Periférico
Recibirá su medicamento mediante perfusión (gotero intravenoso).
La dosis de Kabiven Periférico y qué tamaño de bolsa es utilizado, depende de su peso corporal en kilogramos y de la capacidad de su organismo para utilizar lípidos y azúcar. Kabiven Periférico será perfundido lentamente durante un período de 12-24 horas. Su médico decidirá la dosis correcta que debe recibir usted o su hijo. Puede ser monitorizado durante el tratamiento.
Niños
Kabiven Periférico no es adecuado para su uso en recién nacidos o en niños de menos de dos años de edad.
Si toma mas Kabiven Periférico del que debe
Es muy poco probable que usted reciba más perfusión de la que debería, ya que su médico o enfermera le monitorizarán durante el tratamiento. Los efectos de una sobredosis pueden incluir náuseas, vómitos, escalofríos y retención de líquidos. También se ha reportado hiperglicemia (demasiado azúcar en su sangre) y alteraciones de electrolitos. En el caso de sobredosis, existe el riesgo de recibir demasiados lípidos. Es el llamado “síndrome de sobrecarga lipídica”. Para más información, ver la sección 4 “Posibles efectos adversos”. Si usted experimenta cualquiera de los síntomas descritos arriba o cree que ha recibido demasiado Kabiven Periférico, informe a su médico o enfermera inmediatamente. La perfusión puede ser detenida inmediatamente o continuar a dosis reducida.
Si tiene cualquier duda relacionada con el uso de este producto, pregunte a su médico o enfermera.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Kabiven Periférico puede producir efectos adversos, aunque no todas las personas los sufran.
Kabiven Periférico puede causar una reacción alérgica (muy raro, puede afectar hasta 1 de cada 10.000 pacientes). Informe a su médico inmediatamente si:
• aparece en su organismo una erupción cutánea con ronchas y picor
• usted tiene temperatura muy elevada
• usted tiene dificultades para respirar
Otros efectos adversos incluyen:
Efectos adversos frecuentes (puede afectar hasta 1 de cada 10 pacientes)
• ligero aumento de la temperatura corporal
• inflamación de la vena en la que se administra la perfusión
Efectos adversos poco frecuentes (puede afectar hasta 1 de cada 100 pacientes)
• escalofríos
• cansancio
• dolor de estómago
• dolor de cabeza
• sensación de enfermedad
• aumento de los enzimas hepáticos. Su médico le indicará si esto ocurre Efectos adversos muy raros (puede afectar hasta 1 de cada 10.000 pacientes)
• presión sanguínea elevada o baja
• dificultad para respirar
• erecciones prolongadas y dolorosas en hombres
• problemas en su sangre
Síndrome de sobrecarga lipídica
Esto podría ocurrir si su organismo tuviera problemas en la utilización de los lípidos, y usted hubiera recibido demasiado Kabiven Periférico. También puede ocurrir debido a un cambio repentino en su situación (como problemas en sus riñones o infección). Los síntomas posibles son fiebre, niveles elevados de lípidos en su sangre, en sus células y en sus tejidos, alteraciones en varios órganos y coma. Todos estos síntomas generalmente desaparecerán si la perfusión se detiene.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Kabiven Periférico
Mantener este medicamento fuera de la vista y del alcance de los niños
Su médico o el farmacéutico del hospital son responsables de la correcta conservación, utilización y eliminación de la perfusión Kabiven Periférico. No conservar por encima de 25 C. No congelar y mantener siempre el envase en el contenedor externo.
La emulsión no debe ser utilizada después de la fecha de caducidad indicada en la etiqueta. Cualquier resto de emulsión sobrante debe ser retirada a través de los procedimientos hospitalarios autorizados.
6. Contenido del envase e información adicional
Composición de Kabiven Periférico
Kabiven Periferico está disponible en un sistema de bolsa de tres cámaras. Cada bolsa contiene los siguientes diferentes volúmenes dependiendo de los cuatro tamaños de envase:
|
2400 ml |
1920 ml |
1440 ml | |
|
Glucosa (Glucosa 11%) |
1475 ml |
1180 ml |
885 ml |
|
Aminoacidos y electrolitos (Vamin 18 |
500 ml |
400 ml |
300 ml |
|
Novum) Emulsión lipídica (Intralipid 20%) |
425 ml |
340 ml |
255 ml |
- Los principios activos son
|
2400 ml |
1920 ml |
1440 ml | |
|
Aceite de soja purificado |
85 g |
68 g |
51 g |
|
Glucosa monohidrato |
178 g |
143 g |
107 g |
|
Correspondiente a Glucosa (anhidra) |
162 g |
130 g |
97 g |
|
Alanina |
8,0 g |
6,4 g |
4,8 g |
|
Arginina |
5,6 g |
4,5 g |
3,4 g |
|
Acido aspártico |
1,7 g |
1,4 g |
1,0 g |
|
Acido glutámico |
2,8 g |
2,2 g |
1,7 g |
Glicina
Histidina
Isoleucina
Leucina
Lisina clorhidrato
Correspondiente a Lisina
Metionina
Fenilalanina
Prolina
Serina
Treonina
Triptófano
Tirosina
Valina
Cloruro cálcico 2H2O Correspondiente a Cloruro cálcico Glicerofosfato sódico (anhidro) Sulfato magnésico 7H2O Correspondiente a Sulfato magnésico Cloruro potásico Acetato sódico 3H2O Correspondiente a acetato sódico
|
4,0 g |
3,2 g |
2,4 g |
|
3,4 g |
2,7 g |
2,0 g |
|
2,8 g |
2,2 g |
1,7 g |
|
4,0 g |
3,2 g |
2,4 g |
|
5,6 g |
4,5 g |
3,4 g |
|
4,5 g |
3,6 g |
2,7 g |
|
2,8 g |
2,2 g |
1,7 g |
|
4,0 g |
3,2 g |
2,4 g |
|
3,4 g |
2,7 g |
2,0 g |
|
2,2 g |
1,8 g |
1,4 g |
|
2,8 g |
2,2 g |
1,7 g |
|
0,95 g |
0,76 g |
0,57 g |
|
0,12 g |
0,092 g |
0,069 g |
|
3,6 g |
2,9 g |
2,2 g |
|
0,49 g |
0,39 g |
0,29 g |
|
0,37 g |
0,30 g |
0,22 g |
|
2,5 g |
2,0 g |
1,5 g |
|
1,6 g |
1,3 g |
0,99 g |
|
0,80 g |
0,64 g |
0,48 g |
|
3,0 g |
2,4 g |
1,8 g |
|
4,1 g |
3,3 g |
2,5 g |
|
2,4 g |
2,0 g |
1,5 g |
- Los excipientes son
Fosfolípidos de huevo purificados Glicerol
Hidróxido sódico
Ácido acético glacial
Agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Las soluciones de glucosa y aminoácidos son transparentes e incoloras o ligeramente amarillas, y la emulsión lipídica es blanca. Kabiven Periférico consiste en una bolsa de tres cámaras y una sobrebolsa. Entre la bolsa interna y la sobrebolsa se coloca un absorbente de oxígeno. La bolsa interna está separada en tres cámaras mediante soldaduras tipo peel. Los contenidos de las tres cámaras deben ser mezclados antes de su uso, mediante la apertura de las soldaduras peel.
Tamaños de envase
1 x 1440 ml, 4 x 1440 ml 1 x 1920 ml, 4 x 1920 ml (Biofine)
1 x 2400 ml, 3 x 2400 ml (Biofine)
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Fresenius Kabi AB SE-751 74 Uppsala, Suecia
Responsable de la fabricación
Fresenius Kabi AB SE-751 74 Uppsala, Suecia
o
Fresenius Kabi
Fresenius Kabi Austria GmbH Hafnerstrasse 36, 8055 Graz-Austria
Este producto medicinal está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
|
Bélgica |
Kabiven Peri |
|
Dinamarca |
Kabiven Perifer |
|
Finlandia |
Kabiven Perifer |
|
Francia |
Perikabiven |
|
Alemania |
Kabiven Peripher |
|
Grecia |
Kabiven Peripheral |
|
Islandia |
Kabiven Perifer |
|
Irlanda |
Kabiven Peripheral |
|
Italia |
Periven |
|
Holanda |
Kabiven Perifeer |
|
Noruega |
Kabiven Perifer |
|
Portugal |
Kabiven Peripheral |
|
España |
Kabiven Periférico |
|
Suecia |
Kabiven Perifer |
|
Reino Unido |
Kabiven Peripheral |
Fecha de la última revisión de este prospecto: Marzo 2015
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Esta información está destinada únicamente a profesionales del sector sanitario
Advertencias y precauciones de uso
Para evitar el riesgo asociado a una velocidad de perfusión demasiado rápida, se recomienda llevar a cabo una perfusión continua y bien controlada, si es posible utilizando una bomba volumétrica.
Teniendo en cuenta el elevado riesgo de infección asociado al uso de una vena central, deben tomarse precauciones asépticas estrictas para evitar cualquier contaminación durante la inserción del catéter y la manipulación.
Deben monitorizarse los niveles séricos de glucosa, electrolitos y osmolaridad, así como el balance hídrico, el equilibrio ácido-base y los tests de enzimas hepáticos.
Ante cualquier signo o síntoma de reacción anafiláctica (como fiebre, escalofríos, erupción cutánea o disnea) debe interrumpirse inmediatamente la perfusión.
Kabiven Periférico no debe ser administrado simultáneamente con sangre en el mismo equipo de perfusión, debido al riesgo de pseudoaglutinación.
Puede aparecer tromboflebitis si se utilizan venas periféricas para las perfusiones. El punto de inserción del catéter debe ser observado diariamente para detectar signos locales de tromboflebitis.
Método de administración
Vía intravenosa, perfusión en una vena periférica o central.
Para proporcionar nutrición parenteral total, deben añadirse elementos traza, vitaminas y posiblemente electrolitos (teniendo en cuenta los electrolitos ya presentes en Kabiven Periférico), a Kabiven Periférico de acuerdo con las necesidades del paciente.
Velocidad de perfusión
La velocidad de perfusión máxima para glucosa es 0,25 g/kg pc/h. La dosificación de aminoácidos no debería exceder 0,1 g/kg pc/h. La dosificación de lípidos no debería superar 0,15 g/kg pc/h.
La velocidad de perfusión no debe exceder 3,7 ml/kg peso corporal/hora (correspondiente a 0,25 g de glucosa, 0,09 g de aminoácidos y 0,13 g de lípidos/kg peso corporal). El período de perfusión recomendado es de 12-24 horas.
Precauciones para la eliminación
No utilizar el envase si no está intacto. Utilizar sólo si las soluciones de glucosa y aminoácidos son transparentes e incoloras o ligeramente amarillas, y la emulsión lipídica es blanca y homogénea. Los contenidos de las tres cámaras separadas deben ser mezclados antes de su uso y previamente a cualquier adición realizada a través del puerto de aditivos.
Después de la separación de las soldaduras peel, la bolsa debe ser invertida varias veces, para garantizar una mezcla homogénea que no muestre evidencia de separación de fases.
Para un solo uso. Debe rechazarse cualquier mezcla sobrante después de la perfusión.
Compatibilidad
Sólo pueden añadirse a Kabiven Periférico, soluciones medicinales o nutricionales cuya compatibilidad haya sido comprobada. Existen datos de compatibilidad de los diferentes aditivos y tiempos de almacenamiento de distintas mezclas disponibles bajo petición.
Las adiciones deben realizarse asépticamente.
Caducidad después de la mezcla
Después de la apertura de las soldaduras peel, se ha demostrado una estabilidad química y física de la bolsa de tres cámaras mezclada, de 24 horas a 25 C.
Caducidad después de la mezcla con aditivos
Después de romper las soldaduras peel y mezclar las tres soluciones, pueden realizarse adiciones a través del puerto de adición de medicamentos.
Desde un punto de vista microbiológico, el producto debería utilizarse inmediatamente después de realizar las adiciones. Si no es utilizado inmediatamente, el tiempo de conservación hasta su utilización y las condiciones previas a su uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas a 2-8 °C. Si el almacenamiento no puede evitarse y si las adiciones son realizadas bajo condiciones asépticas controladas y validadas, la emulsión mezclada puede ser conservada durante 6 días a 2-8 °C antes de ser utilizada. Después de extraerla de la conservación a 2-8 °C, la mezcla debe ser perfundida en 24 horas.
Instrucciones de uso Kabiven Periférico La bolsa
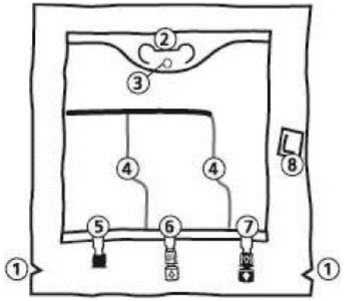
1. Muescas en la sobrebolsa
2. Colgador
3. Anilla para colgar la bolsa
4. Soldaduras peel
5. Puerto sin salida (sólo se usa durante la Fabricación)
6. Puerto de adición
7. Puerto de perfusión
8. Absorbente de oxígeno
1. Extracción de la sobrebolsa
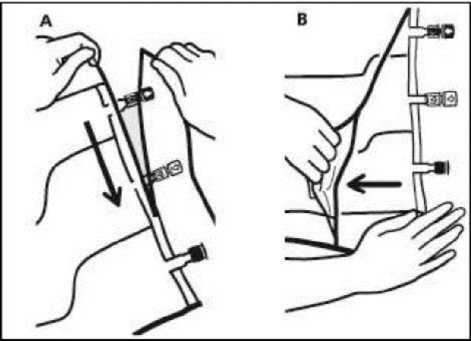
• Para extraer la sobrebolsa, sujetarla en posición horizontal y rasgar por la muesca hacia los puertos a lo largo del borde superior (A).
• Entonces, simplemente rasgar a lo largo del envase; separar la sobrebolsa y desecharla junto con el absorbente de oxígeno (B).
Mezcla
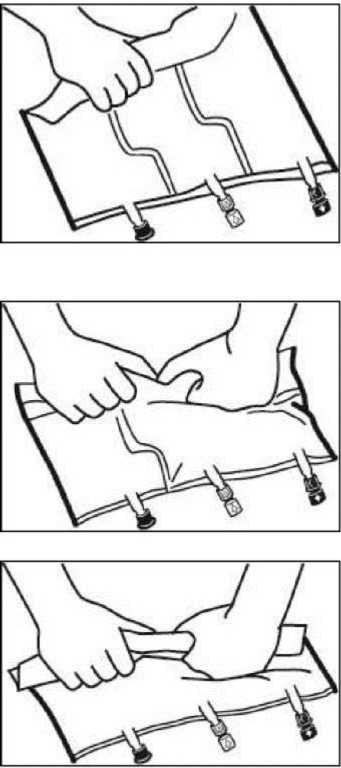
• Colocar la bolsa en una superficie plana.
• Enrollar la bolsa desde la parte del colgador hacia la parte de los puertos, primero con la mano derecha y a continuación aplicando una presión constante con la mano izquierda hasta que las soldaduras verticales se hayan abierto. Las soldaduras peel verticales se abren debido a la presión del líquido. Las soldaduras peel también pueden ser abiertas antes de retirar la sobrebolsa.
Nota: los líquidos se mezclan fácilmente aunque la soldadura horizontal permanezca cerrada.
• Mezclar los contenidos de las tres cámaras invirtiendo la bolsa tres veces hasta que los componentes estén completamente mezclados.
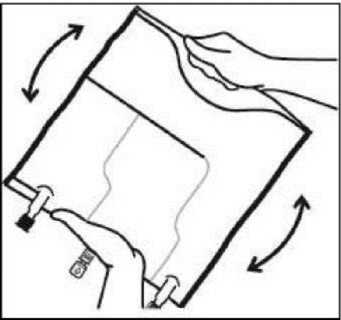
3. Finalización de la preparación
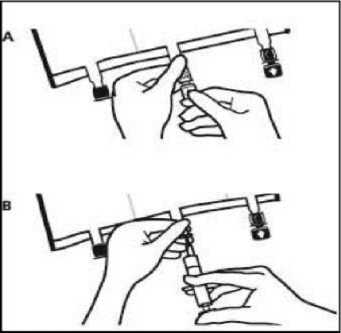
• Colocar la bolsa de nuevo sobre una superficie plana. Poco antes de inyectar los aditivos, romper el puerto de adición blanco por la marca en forma de flecha (A).
Nota: La membrana del puerto de aditivos es estéril
• Sujetar la base del puerto de aditivos. Insertar la aguja, inyectar los aditivos (de compatibilidad conocida) por el centro del punto de inyección (B).
• Mezclar completamente entre cada adición, invirtiendo la bolsa tres veces. Utilizar jeringas con agujas de calibre 18-23 y una longitud máxima de 40 mm.
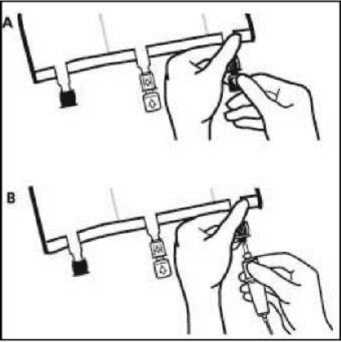
• Poco antes de insertar el set de perfusión, romper el puerto de perfusión azul por la marca en forma de flecha (A).
Nota: La membrana del puerto de perfusión es estéril
• Usar un equipo de perfusión no venteado o cerrar la entrada del aire del equipo venteado.
• Sujetar la base del puerto de perfusión.
• Introducir el punzón a través del puerto de perfusión. El punzón deberá estar totalmente insertado para asegurar su retención.
Nota: La parte interna del puerto de perfusión es estéril
4. Colgado de la bolsa
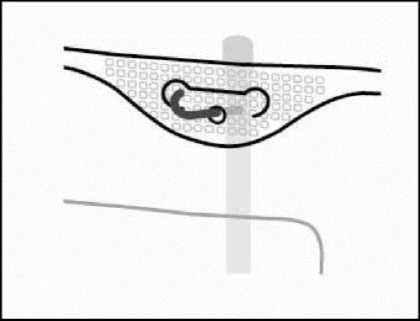
Colgar la bolsa por la anilla que hay bajo el colgador.
13 de 13