Intrinsa 300 Microgramos/24 Horas Parche Transdermico
Información obsoleta, busque otroANEXO I
8)

1. NOMBRE DEL MEDICAMENTO
Intrinsa 300 microgramos/24 horas parche transdérmico
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
Cada parche de 28 cm2 contiene 8,4 mg de testosterona y proporciona 300 microgramos de testosterona en 24 horas.
Para consultar la lista completa de excipientes, ver sección 6.1.
8)
3. FORMA FARMACÉUTICA
Parche transdérmico.
Parche transdérmico fino, transparente, matricial y de forma ovalada, compuesto por
por tres c
lámina de soporte translúcida, una matriz adherente con el principio activo y un recubrimiento protector,
capas: una
que se retira antes de la aplicación. La superficie de cada parche lleva impreso T001.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Intrinsa está indicado en el tratamiento del trastorno ooforectomizadas bilateralmente e histerectomizada tratamiento concomitante con estrógenos.
ción
La dosis diaria recomendada de testosterona es de 300 microgramos. Esta dosis se consigue aplicando el parche dos veces por semana de forma continuada. El parche debe remplazarse por uno nuevo cada 3-4 días. Sólo se puede llev ar un parche a la vez.
Tratamiento concomitante con estrógenos
Antes de iniciar el tratamiento con Intrinsa y durante la reevaluación rutinaria del tratamiento, se deben tener en cuenta el uso apropiado y las restricciones asociadas con el tratamiento con estrógenos. Sólo se recomienda el uso continuado de Intrinsa mientras que se considere apropiado el uso concomitante de estrógenos (es decir, la dosis mínima eficaz durante el menor tiempo posible).
4.2 Posología y forma de administració
Posología
nos (es

sexual hipoactivo (TDSH) en las mujeres pausia inducida quirúrgicamente) que reciben
No se recomienda utilizar Intrinsa en pacientes tratadas con estrógeno equino conjugado (EEC), ya que su c^cia no ha sido demostrada (ver secciones 4.4 y 5.1).
eficac
uración del tratamiento
La respuesta al tratamiento con Intrinsa se debe evaluar a los 3-6 meses del inicio del tratamiento para determinar si procede continuar el tratamiento. Se deberá reevaluar a aquellas pacientes que no obtengan un beneficio significativo y considerar la interrupción del tratamiento.
Como la eficacia y seguridad de Intrinsa no se han evaluado en estudios de una duración mayor de un año, se recomienda reevaluar el tratamiento cada 6 meses.
Poblaciones especiales
Deterioro renal
No se han realizado estudios en pacientes con insuficiencia renal.
Deterioro hepático
No se han realizado estudios en pacientes con deterioro hepático.
Personas de edad avanzada
x>
Se recomienda el uso de Intrinsa en las mujeres menopáusicas a causa de la cirugía, hasta los 60 años. De acuerdo con la prevalencia del trastorno del deseo sexual hipoactivo, los datos son limitados después de los 60 años.
gión in
8)
Población _ pediátrica
Intrinsa no debe utilizarse en la población pediátrica. Forma de administración
El lado adhesivo del parche debe aplicarse sobre una zona de piel limpia y seca de la región inferior del abdomen, por debajo de la cintura. Se debe variar los lugares de aplicación, con un intervalo de 7 días como mínimo entre aplicaciones en un mismo lugar. Los parches no se deben aplicar en las mamas o en otras regiones del cuerpo. Se recomienda usar una zona de piel sin pliegues y que no esté cubierta con prendas apretadas. La zona no debe estar grasienta, lesionada o irritada. Para impedir interferencias con las propiedades adhesivas de Intrinsa, no deben aplicarse cremas, lociones o polvos en la piel donde se va a aplicar el parche.
El parche se debe aplicar inmediatamente después de abrir el sobre y retirar ambas partes del recubrimiento protector. Se debe presionar el parche con firmeza sobre la zona durante unos 10 segundos, asegurándose de que el contacto con la piel es adecuado, espe cialmente alrededor de los bordes. Si se levanta alguna zona del parche, ésta se debe presionar. Si el parche se desprende prematuramente, puede volver a aplicarse. Si no es posible volver a aplicar el mismo parche, deberá aplicar un parche nuevo en otra zona. En cualquiera de los casos, deberá mame^erse la pauta de tratamiento original. El parche se ha diseñado para mantenerse en su posición durante la ducha, el baño, nadar o el ejercicio.
C°
o o a
Hipersensibilidad al principio activo o a alguno de los excipientes.
Historia conocida, sospechada o p asada de cáncer de mama o sospecha o historia conocida de neoplasia dependiente de estrógenos, o cualquier otra afección compatible con contraindicaciones para el uso de estrógenos.
s y precauciones especiales de empleo
Las esp
Advertenci
ciales

Reacciones androgénicas
El médico debe controlar el tratamiento periódicamente por la posible aparición de reacciones adversas androgénicas potenciales (p. ej. acné, cambios en el crecimiento del pelo o pérdida de pelo). Se debe aconsejar a las pacientes que vigilen la aparición de estos efectos adversos androgénicos. Los signos de irilización, como voz más grave, hirsutismo o clitoromegalia, pueden ser irreversibles y debe considerarse la interrupción del tratamiento. En los estudios clínicos estas reacciones fueron reversibles en la mayoría de las pacientes (ver sección 4.8).
Hipersensibilidad
Pueden aparecer eritema cutáneo grave, edema local y ampollas por hipersensibilidad al parche en el lugar de aplicación. Si esto ocurre, se deberá suspender el uso del parche.
Seguridad a largo _plazo, incluido el cáncer de mama
La seguridad de Intrinsa no se ha evaluado en estudios doble ciego controlados con placebo de una duración mayor de un año. Hay poca información sobre la seguridad a largo plazo, incluyendo los efectos sobre el tejido mamario, el sistema cardiovascular y el aumento de resistencia a la insulina. Los datos publicados acerca de la influencia de testosterona sobre el riesgo de cáncer de mama en las mujeres son escasos, no concluyentes y contradictorios. Actualmente se desconoce el efecto a largo plazo del tratamiento con testosterona sobre la mama, por lo que debe controlarse estrechamente la aparición de un cáncer de mama en las pacientes según la práctica clínica aceptada actualmente y las necesidades de cada caso.
Enfermedades cardiovasculares
No se han estudiado pacientes con enfermedad cardiovascular conocida. Se vigilará estrechamente a las pacientes con factores de riesgo cardiovascular, en particular, hipertensión, y pacientes con enfermedad cardiovascular conocida, monitorizando específicamente los cambios de la presión arterial y el peso.
Pacientes diabéticos
Los efectos metabólicos de la testosterona pueden disminuir la glucemia en pacientes diabéticas y, por tanto, las necesidades de insulina. No se han estudiado pacientes con diabetes mellitus
\A
Efectos sobre el endometrio
La información sobre los efectos de la testosterona sobre el endometrio es escasa. Los pocos datos que evalúan el efecto de la testosterona sobre el endometrio no permiten extraer conclusiones sobre la incidencia del cáncer de endometrio.
A?
r una c
Edema
*
El edema (con o sin insuficiencia cardiaca congestiva) puede ser una complicación grave en pacientes con enfermedad cardiaca, renal o hepática previa, debido a dosis altas de testosterona u otros esteroides anabolizantes. No obstante, no se espera este efecto debido a la baja dosis de testosterona que libera el parche de Intrinsa.
Precauciones de uso
Intrinsa no debe utilizarse en las mujeres con menopausia natural
No se han evaluado la eficacia y la seguridad de Intrinsa en las mujeres con menopausia natural con TDSH durante el tratamiento concomitante con estrógenos, con o sin progestágeno. No se recomienda Intrinsa en las mujeres con menopausia natural.
Intrinsa no debe utilizarse las mujeres concomitantemente con estrógenos equinos conjugados Si bien Intrinsa está indicado con el tratamiento concomitante con estrógenos, el subgrupo de pacientes que reciben estrógenos equinos conjugados orales (conjugated equine estrogen, CEE) no mostró una mejoría significativa de la función sexual. Por consiguiente, Intrinsa no debe usarse en las mujeres que reciben CEE concomitantes (ver secciones 4.2 y 5.1).
Concentrado mes de las hormonas tiroideas

Los andrógenos pueden reducir los niveles de la globulina transportadora de tiroxina, dando lugar a una reducción de los niveles séricos de T4 total y a un aumento de la recaptación de T3 y T4 por resina. Sin embargo, los niveles de hormona tiroidea libre no se alteran, y no existen signos clínicos de disfunción tiroidea.
Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. El efecto de los anticoagulantes puede aumentar cuando se administran junto a testosterona, por lo que se debe vigilar estrechamente a las pacientes que reciben anticoagulantes orales, especialmente al principio y al final del tratamiento con testosterona.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Intrinsa no deberá usarse en las mujeres que están o puedan quedarse embarazadas.
La testosterona induce efectos virilizantes en los fetos femeninos cuando se administra a mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
El uso de Intrinsa debe interrumpirse en caso de exposición inadvertida durante el embarazo.
Lactancia
Las mujeres en lactancia no deberán usar Intrinsa.
Fertilidad
No se dispone de datos acerca del efecto de Intrinsa sobre la fertilidad.
8)
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
r
La influencia de Intrinsa sobre la capacidad para conducir y utilizar máquinas es nula. Sin embargo, se debe informar a los pacientes que durante el tratamiento con Intrinsa se han notificado migraña, insomnio, trastorno de la atención y diplopía.
.ry
4.8 Reacciones adversas
A/
Resumen del perfil de seguridad
La reacción adversa notificada con mayor frecuencia (30,4%) fueron r eacciones en el lugar de aplicación. La mayoría de estas reacciones adversas consistieron en eritema leve y picor, y no condujeron al abandono del tratamiento por la paciente.
v>
También se han notificado casos de hirsutismo de forma muy frecuente. La mayor parte de los casos afectaban a la barbilla y el labio superior, eran leves (> 90%), y menos del 1% de todas las pacientes tratadas abandonaron los ensayos a consecuencia d. la aparición de hirsutismo. El hirsutismo fue reversible en la mayoría de las pacientes.
Otras reacciones androgénicas notificaras de forma frecuente fueron acné, voz más grave y alopecia. Más del 90% de estas notificaciones fueron consideradas leves. Estas reacciones fueron reversibles en la mayoría de las pacientes. Menos del 1% de las pacientes abandonaron los ensayos por alguna de estas reacciones adversas. El resto de las reacciones adversas frecuentes se resolvieron en la mayoría de las pacientes.
Lista tabulada de las re-xLones adversas
Durante la exposic;ón doble ciego durante 6 meses se produjeron las siguientes reacciones adversas en el grupo de tratamiento (n = 549) con una incidencia mayor que en el grupo placebo (n = 545) y los investigadores las evaluaron como posible o probablemente relacionadas con el tratamiento con Intrinsa. Si la frecuen :ia. de alguna reacción adversa fue mayor en el conjunto de los ensayos fase III (pacientes que reciñeron Intrinsa n = 1.498, pacientes que recibieron placebo n = 1.297), esta frecuencia se indica en la tabla. Las frecuencias se describen como muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000) o muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Infecciones e infestaciones |
Sinusitis | ||
|
Trastornos de la sangre y del sistema linfático |
Factor de coagulación anormal | ||
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos del metabolismo y de la nutrición |
Aumento del apetito | ||
|
Trastornos psiquiátricos |
Insomnio |
Agitación, ansiedad | |
|
Trastornos del sistema nervioso |
Migraña |
Trastorno de atención, disgeusia, alteración del equilibrio, hiperestesia, parestesias orales, accidente isquémico transitorio | |
|
Trastornos oculares |
Diplopía, enrojecimiento ocmar | ||
|
Trastornos cardiacos |
Palpitaciones | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Voz grave |
Congestión nasal, opresión ce garganta | |
|
Trastornos gastrointestinales |
Dolor abdominal |
Diarrea, sequedad de boca, nausea | |
|
Trastornos de la piel y del tejido subcutáneo |
Hirsutismo |
Acné, alopecia |
Eczema, aumento de sudoración, rosácea |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artritis | ||
|
Trastornos del aparato reproductor y de la mama |
Dolor de mama |
Quiste de mama, ingurgitación clitorídea, aumento de tamaño del clítoris, prurito genital, sensación de quemazón vaginal | |
|
Trastornos generales y alteraciones en el lugar de administración |
Reacción en el lugar de aplicación (eritema, picor) |
<y |
Anasarca, astenia, opresión torácica, molestias torácicas |
|
Exploraciones complementarias *o |
o°* |
Aumento de peso |
Fibrinógeno anormal en sangre, aumento de la frecuencia cardiaca, aumento de la alanina aminotransferasa, aumento de la aspartato aminotransferasa, aumento de la bilirrubina en sangre, alteraciones de la prueba de función hepática, aumento de los triglicéridos en sangre |
4.9 Sobredosis
El modo de administración de Intrinsa hace que la sobredosis sea improbable. La retirada del parche provoca un descenso rápido de los niveles séricos de testosterona (ver sección 5.2).
n desce
5. PROPIEDADES FARMACOLÓGICAS 5 1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Hormonas sexuales y moduladores del sistema genital, andrógenos; código ATC: G03BA03
Mecanismo de acción
La testosterona, el principal andrógeno circulante en la mujer, es un esteroide natural segregado por los ovarios y las glándulas suprarrenales. En las mujeres premenopáusicas, la tasa de producción de testosterona es de 100 a 400 microgramos/24 horas, de los cuales la mitad proceden del ovario en forma de testosterona o de precursor. Los niveles séricos de andrógenos caen al envejecer la mujer. En las
mujeres que se han sometido a una ooforectomía bilateral, los niveles séricos de testosterona caen aproximadamente en un 50% en los primeros días tras la intervención.
Intrinsa es un tratamiento transdérmico para el TDSH que mejora el deseo sexual mientras que se alcanzan concentraciones de testosterona compatibles con los niveles premenopáusicos.
Eficacia clínica y seguridad
Para evaluar la eficacia y seguridad de Intrinsa se realizaron dos estudios multicéntricos, doble ciego controlados con placebo de seis meses de duración en 562 (INTIMATE SM1) y 533 (INTIMATE SM2) mujeres ooforectomizadas e histerectomizadas (menopausia quirúrgica) de 20 a 70 años con TDSH que recibían tratamiento concomitante con estrógenos. Se evaluaron la actividad sexual satisfactoria total (variable principal), el deseo sexual y la angustia asociada a un deseo sexual bajo (variables secundarias) con instrumentos validados.
ecundaria
En el análisis combinado a las 24 semanas, la diferencia de la frecuencia media de contactos totalmente satisfactorios entre Intrinsa y placebo fue de 1,07 en 4 semanas.
benefic
Un porcentaje significativamente mayor de mujeres tratadas con Intrinsa mostró un beneficio en las tres variables, que se consideró clínicamente significativo, frente a las mujeres que recibieron placebo. En los datos combinados en fase III, en los que se excluyeron a las pacientes que tomaban EEC orales, en las que no se apreció una mejoría significativa de la función sexual, el 50,7% de las mujeres tratadas con Intrinsa (n = 274) y el 29,4% de las tratadas con placebo (n = 269) se considerar on respondedoras en cuanto a la actividad sexual satisfactoria total (variable principal), definiéndose previamente como respondedoras a las mujeres que tuvieron un aumento superior a 1 en actividades satisfactorias en un período de
4 semanas.
Los efectos de Intrinsa se observaron a las 4 semanas medido) y en todos los periodos mensuales de eficaci
acia v
N>
és de iniciar el tratamiento (primer periodo rados posteriormente.
La eficacia frente a placebo fue significativa en varios subgrupos que incluían pacientes separadas según las siguientes características basales: edad (todos los subgrupos hasta los 65 años de edad); peso corporal (hasta 80 kg) y ooforectomía (de hasta hace 15 años atrás).
a vía y ti
El análisis de subgrupos sugirió que la vía y tipo de estrógenos concomitantes (estradiol transdérmico, estrógenos equinos conjugados (EEC) por vía oral, estrógenos orales no EEC) pueden influir en la respuesta de la paciente. El an üis.s de respondedoras de los estudios pivotales en fase II y III mostró una mejoría significativa en los tres criterios de valoración clínicos fundamentales frente a placebo en las pacientes que recibían ectrogenos concomitantes transdérmicos u orales no CEE. Sin embargo, no se demostró una mejoría significativa de la actividad sexual en el subgrupo de pacientes que recibían CEE orales frente a placebo (ver secciones 4.2 y 4.4).
5.2 Propiedades farmacocinéticas
Absorción
La testosterona que contiene Intrinsa se transporta a través de la piel intacta por un proceso de difusión pasi a que está controlado principalmente por la penetración a través del estrato córneo. Intrinsa está diseñado para liberar sistemáticamente 300 microgramos/día. Después de aplicar el parche en la piel del abdomen, las concentraciones séricas máximas de testosterona se alcanzan en 24-36 horas, con una variabilidad interindividual amplia. Las concentraciones séricas de testosterona alcanzan el estado de equilibrio estacionario mediante la aplicación de un segundo parche cuando se aplica en una pauta de administración de dos veces por semana. El uso de Intrinsa no influyó en las concentraciones séricas de la globulina transportadora de hormonas sexuales (sex hormone binding globuline, SHBG), de los estrógenos o de las hormonas suprarrenales.
Concentraciones séricas de testosterona y SHBG en pacientes tratadas con Intrinsa en los estudios clínicos de seguridad y eficacia
Hormona
Valor basal
Semana 24
Semana 52
|
N |
Media (SEM) |
N |
Media (SEM) |
N |
Media (SEM) | |
|
Testosterona libre (pg/ml) |
544 |
0,92 (0,03) |
412 |
4,36 (0,16) |
287 |
4,44 (0,31) |
|
Testosterona total (ng/dl) |
547 |
17,6 (0,4) |
413 |
79,7 (2,7) |
288 |
74,8 (3,6) |
|
DHT (ng/dl) |
271 |
7,65 (0,34) |
143 |
20,98 (0,98) |
169 |
21,04 (0,97) |
|
SHBG (nmol/l) |
547 |
91,7 (2,5) |
415 |
93,9 (2,8) |
290 |
90,0 (3,6) |
|
DHT = dihidrotestosterona, SHBG = globulina transportadora de hormonas sexua SEM = Error estándar de la media |
es | |||||
Distribución
En las mujeres, la testosterona circulante se une principalmente a la SHBG del suero (65-80%) y a la albúmina (20-30%), dejando sólo un 0,5-2% como fracción libre. La afinidad de la unión a la SHBG-sérica es relativamente alta y se considera que la fracción unida a SHBG no contribuye a la actividad biológica. La unión a la albúmina tiene una afinidad relativamente baja y es reversible. La fracción unida a la albúmina y la fracción no unida componen la denominada testosterona “biodisponible" La cantidad de SHBG y de albúmina en suero y la concentración de testosterona total determinan la distribución de la testosterona libre y biodisponible. La concentración sérica de la SHBG se ve influida por de la vía de administración del tratamiento estrogénico concomitante.
Biotransformación

La testosterona se metaboliza principalmente en el hígado. En su metabolismo se producen varios 17-cetosteroides y su metabolismo adicional produce glucurónidos inaccvrs y otros conjugados. Los metabolitos activos de la testosterona son el estradiol y la dihidrotestost^rona (DHT). La DHT tiene una afinidad mayor por la SHBG que la testosterona. Las concentracio. íes de DHT aumentaron paralelamente a las de testosterona durante el tratamiento con Intrinsa. No hubo diferencias significativas en los niveles séricos de estradiol y estrona en pacientes tratadas con Intrinsa durante hasta 52 semanas comparados con los niveles basales.
Al retirar el parche de Intrinsa, las concentraciones sircas de testosterona vuelven cerca de los valores basales en 12 horas, debido a su semivida de eliminación corta (en torno a 2 horas). No hubo evidencias de acumulación de testosterona más allá de 'as 52 semanas de tratamiento.
Eliminación D . . ...... .
La testosterona se excreta principalmente por orina en forma de conjugados de ácido glucuromco y sulfúrico de testosterona y sus metabolitos.
5.3 Datos preclínicos sobre seguridad
Los estudios toxicológicos sólo han revelado efectos que se pueden explicar por el perfil hormonal de testosterona.
Se ha demostrado que la testosterona no es genotóxica. Los estudios no clínicos sobre la relación entre el tratamiento con testosterona y el cáncer sugieren que dosis altas pueden favorecer el crecimiento tumoral en órganos sexuales, glándulas mamarias e hígado en animales de laboratorio. Se desconoce la significancia de estos datos en relación con la administración de Intrinsa en pacientes.

testosterona tiene un efecto masculinizante en los fetos hembra de rata cuando se administra por vía bcutánea en dosis de 0,5 o 1 mg/día (como éster propionato) a ratas gestantes durante la organogénesis.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Capa cobertora
Lámina cobertora translúcida de polietileno
Tinta de impresión
amarillo ocaso FCF (E110)
litolrubina BK (E180)
pigmento azul de ftalocianina de cobre.
Matriz autoadhesiva con el fármaco Oleato de sorbitano
Copolímero acrílico adhesivo que contiene copolímero de 2-Etilhexiacrilato - 1-Vinil-2-pirrolidona.
Recubrimiento protector Lámina de poliéster siliconizada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. No refrigerar o congelar.
6.5 Naturaleza y contenido del envase
Cada parche está envasado en un sobre laminado sellado. El material del sobre contiene papel de grado alimentario/LDPE/lámina de aluminio/copolímero de ácido metacrílico etileno (del exterior al interior). El copolímero del ácido metacrílico etileno (Surlyn) es la capa de termosellado que permite que las dos láminas que forman el sobre se sellen por calor.
<N
os algu
Envases con 2, 8 y 24 parches.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
El parche transdérmico no debe tirarse al inodoro.
El parche usado debe doblarse por la mitad, pegándose el parche a sí mismo, y debe desecharse de una manera segura, a f_n d“ matenerlo lejos de los niños (por ejemplo, en una papelera).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7'
8*
TIT
TULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
w
Ol
arner Chilcott UK Limited Old Belfast Road
Millbrook, Lame County Antrim
BT40 2SH Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/352/001-003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 28 de julio de 2006 Fecha de la última renovación: 28 de julio de 2011
encia Europea de
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la A Medicamentos http://www.ema.europa.eu/ n


A.
TITULAR(ES) DE LA AUTORIZACIÓN DE FABRICACIÓN RESPONSABLE(S) DE LA LIBERAC ÓN DE LOS LOTES
B.
CONDICIONES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN


A. TITULAR(ES) DE LA AUTORIZACION DE FABRICACION RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del(de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
Warner Chilcott Deutschland GmbH Dr.-Otto-Rohm-Strasse 2-4 64331 Weiterstadt Alemania
8)
Warner Chilcott France
Parc d’activité de la Grande Breche
5 rue Désir Prévost
91070 Bondoufle
Francia
iZaCIÓN
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES DE LA AUTORIZACIÓN DE COMERCIAL
IALIZA
CONDICIONES O RESTRICCIONES DE DISPENSACIÓN Y USO IMPUESTAS AL TITULAR DE LA AUTORIZACIÓN DE COMERCIAL IZaCIÓN
Medicamento sujeto a prescripción médica.
• CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURAY EFICAZDELMEDICAMENTO
No procede.
ión de Co
• OTRAS CONDICIONES sQT Sistema de Farmacovigilancia
El Titular de la Autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, incluido en el Módulo 1.8.1. de la Autorización de Comercialización, esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado. El TAC seguirá remitiendo Informes Periódicos de Seguridad semestrales a menos que el Comité de Medicamentos de Uso Humano especifique lo contrario.
Plan de Gestión de Riesgos
d
(yP
(C
El TAC se compromete a realizar los estudios y las actividades adicionales de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del Plan de Gestión de Riesgos (PGR) del 19 de septiembre de 2010, incluido en el Módulo 1.8.2 de la Autorización de Comercialización cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la directriz del CHMP sobre Sistemas de Gestión de Riesgos para medicamentos de uso humano, el PGR actualizado se debe presentar junto con el siguiente Informe Periódico de Seguridad (IPS).
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o a las actividades de minimización de riesgos
• Dentro de los 60 días posteriores a la consecución de un hito importante (farmacovigilancia o minimización de riesgos)
• A petición de a Agencia Europea de Medicamentos.

ANEXO III
ETIQUETADO Y PROSPECTO
3>


INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR EMBALAJE EXTERIOR (Caja de 2, 8 o 24 parches)_
1. NOMBRE DEL MEDICAMENTO
Intrinsa 300 microgramos/24 horas, parche transdérmico Testosterona
____
6'
2. PRINCIPIO(S) ACTIVO(S)
1 parche de 28 cm2 contiene 8,4 mg de testosterona y proporciona 300 microgramos en 2 4 horas.

Leer el prospecto antes de utilizar este medicamento. y>v
6. ADVERTENCIA especial de que el medicamento debe mantenerse
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mamen».
en^r rui
era del alcance y de la vista de los niños.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C. No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Warner Chilcott UK Limited Old Belfast Road Millbrook, Lame County Antrim BT40 2SH Reino Unido
15. INSTRUCCIONES de uso
|
12. |
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN |
|
EU/1/06/352/001-003 | |
|
13. |
NÚMERO DE LOTE |
|
Lote |
Cp |
|
14. |
CONDICIONES GENERALES DE DISPENSACIÓN |
Medicamento sujeto a prescripción médica.
16. INFORMACIÓN EN BRAILLE
intr
<s
insa
Introduzca la solapa aquí para cerrar.
Cuándo aplicar el parche:
El parche debe cambiarse dos veces por semana. Elija sus dos días y marque la caja. Cambie el parche sólo en esos dos días. o Domingo + Miércoles o Lunes + Jueves o Martes + Viernes o Miércoles + Sábado o Jueves + Domingo o Viernes + Lunes o Sábado + Martes
Continúe usando este producto mientras su médico se lo prescriba.

INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
SOBRE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
|
Intrinsa 300 microgramos/24 horas, parche transdérmico Testosterona Vía transdérmica |
& | |
|
2. FORMA DE ADMINISTRACIÓN |
_/V7_ | |
|
Leer el prospecto antes de utilizar este medicamento. |
_wO_ | |
|
3. FECHA DE CADUCIDAD | ||
|
EXP | ||
|
4. NÚMERO DE LOTE , |
Nv | |
Lot
EN O
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
LUM
1 parche transdérmico
1 parche de 28 cm2 contiene 8,4 mg de testosterona y libera 300 microgramos en 24 horas.
.<?
<&

PROSPECTO: INFORMACIÓN PARA EL USUARIO
Intrinsa 300 microgramos/24 horas, parche transdérmico
Testosterona
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1.
2.
3.
4.
5.
6.
Qué es Intrinsa y para qué se utiliza Antes de usar Intrinsa
Cómo usar Intrinsa Posibles efectos adversos Conservación de Intrinsa Información adicional
1. QUÉ ES INTRINSA Y PARA QUÉ SE UTILIZA
Intrinsa es un parche transdérmico que libera constantemente pequeñas cantidades de testosterona, que se absorbe a través de la piel hacia el torrente sanguíneo. La testosterona de Intrinsa es la misma hormona que se produce de forma natural en hombres y mujeres.
Después de la extracción de los ovarios, los niveles de testosterona descienden a la mitad comparados con los de antes de la operación. El descenso de testostfona se ha asociado al deseo sexual bajo, disminución de pensamientos sexuales y disminución de la excitación sexual. Todas o algunas de estas molestias pueden causar angustia personal o dificultades de relación. El término médico de esta afección es trastorno del deseo sexual hipoactivo, también conocido como TDSH.
.
Intrinsa se usa para tratar el TDSH.
Intrinsa está indicado en las m jjeres de hasta 60 años de edad que:
- tienen deseo sexual bajo que les provoca angustia o preocupación y
- se han extraído am oos ovarios, y
- se ha extraído el útero (histerectomía), y
- están recibiendo tratamiento con estrógenos.
Puede tardar más de un mes en observar una mejoría. Si no ha notado un efecto positivo de Intrinsa en 3-6 meses, d ;be informar a su médico, quien le indicará que debe interrumpir el tratamiento.
AN
TES DE USAR INTRINSA
N
2.
o use Intrinsa
Si es alérgico (hipersensible) a la testosterona o a cualquiera de los demás componentes de Intrinsa (ver la sección “Información adicional” al final de este prospecto).
Si sabe que ha padecido en el pasado, padece ahora o cree que podría padecer cáncer de mama o cualquier otro cáncer que, según su médico, haya sido causado o estimulado por estrógenos femeninos, lo que se conoce como cánceres “dependientes de estrógenos”.
Si tiene otras afecciones que, en opinión de su médico, no sean apropiadas para el uso de estrógenos o testosterona.
Tenga especial cuidado con Intrinsa
- Si tiene historia de enfermedad cardiaca, hepática o renal. El edema puede ser una complicación a causa de las dosis altas de testosterona; sin embargo, esto no se espera por la dosis baja de testosterona administrada por el parche de Intrinsa.
- Si usted padece cáncer del tejido que recubre el útero (cáncer de endometrio), tenga en cuenta que se dispone de poca información sobre los efectos de la testosterona sobre el revestimiento del útero (endometrio).
- Si es usted diabética, ya que la testosterona puede reducir los niveles de glucosa en sangre.

- Si tiene historia de acné adulto excesivo, pelo corporal o facial, pérdida de pelo, aumento de tamaño del clítoris o voz más grave o ronca.
ar Intrinsa.
Si usted nota cualquiera de estas afecciones, comuníquelo a su médico antes de comenzar a usar Su médico le aconsejará sobre lo que debe hacer.
La eficacia de Intrinsa se reduce si su tratamiento con estrógenos es de un tipo determinado ('estrógenos equinos conjugados’). Por tanto, debe comentar con su médico el tipo de estrógenos que toma, y le aconsejará sobre el tipo más adecuado para asociar a Intrinsa. V
Si interrumpe el tratamiento con estrógenos también deberá dejar de usar Iutrim a. Tenga en cuenta que los estrógenos deben administrarse durante el menor tiempo posible.
s. Intri
Use Intrinsa sólo mientras experimente un efecto positivo del tratamieno. No hay información sobre la seguridad de Intrinsa después de 12 meses.
Hay pocos datos sobre su uso en las mujeres mayores de 60 años Intrinsa está indicado para su uso por mujeres hasta los 60 años, a quienes se les han extirpado los dos ovarios y el útero.
Se desconoce si Intrinsa aumenta el riesgo de padecer cáncer de mama y cáncer de endometrio. Su médico vigilará estrechamente su riesgo de padecer cáncer de mama y cáncer de endometrio.
Niños y adolescentes
Intrinsa no debe usarse en los niños ni en los adolescentes.
cv
Toma de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Informe a su médico si está tomando tratamiento con antiagregantes (anticoagulantes).
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Intrinsa sólo está indicado en las mujeres menopáusicas tras la extracción de los ovarios y el útero.
No use Intrinsa si está o sospecha que puede estar embarazada o que puede quedarse embarazada, porque puede perjudicar al feto.
No us’ Intrinsa en caso de estar dando el pecho, ya que puede provocar daños al niño.
C
P
Conducción y uso de máquinas
uede conducir y usar máquinas mientras usa Intrinsa.
3. CÓMO USAR INTRINSA
Siga exactamente las instrucciones de administración de Intrinsa indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas sobre las instrucciones o si desea más información. La dosis habitual es de un parche dos veces por semana (cada 3 ó 4 días); ver más adelante, “Cómo y cuándo cambiar el parche”. El principio activo se libera del parche constantemente durante 3 ó 4 días (correspondiente a 300 microgramos cada 24 horas) y se absorbe a través de la piel.
Dónde adherir el parche
- Pegue el parche en la parte inferior del abdomen, por debajo de la cintura. No pegue el parche en las mamas o en las nalgas.
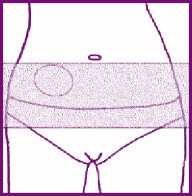
Compruebe que la piel de la zona de aplicación está: limpia y seca (sin lociones, hidratantes o polvos) tan lisa como sea posible (sin arrugas ni pliegues cutáneos importantes) sin cortes ni irritaciones (sin erupciones u otros problemas cutáneos) en una zona sin demasiado roce con la ropa preferiblemente, sin pelo.
Cuando se cambie el parche, pegue el parche nuevo en una zona diferente de la piel de su abdomen, de lo contrario puede provocar irritaciones cutáneas.
Sólo se puede llevar un parche a la vez.
>
\
Si también utiliza parches de estrógenos, asegúrese de que el parche de Intrinsa y el parche de estrógenos no se superpongan.
No se ponga un parche nuevo en la misma zona, al menos hasta una semana después.
a zona
Cómo adherirse el parche Paso 1 Abra el sobre rasgándolo. No use tijeras, porque puede dañar accidentalmente el parche. Extraiga el parche. Aplíquese el parche :nm ediatamente después de extraerlo del sobre.

che in
Paso 2 Mientus sujeta el parche, quite la mitad del recubrimiento protector que cubre la superficie adherente del parche. Evite tocar la superficie adherente del parche con los dedos.
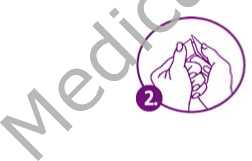
Paso 3 Ponga el lado adherente del parche sobre la piel de la zona seleccionada. Presione firmemente el lado adherente del parche unos 10 segundos.
Paso 4 Doble hacia atrás el parche y quite con cuidado la otra mitad del recubrimiento. Presione
rche,
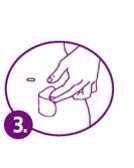
firmemente todo el parche contra la piel con la palma de la mano unos 10 segundos. Compruebe con los dedos que los bordes del parche se adhieren a la piel. Si se levanta alguna zona del parche
presiónela.

dos pa
Cómo y cuándo cambiar el parche
- Tendrá que cambiar el parche cada 3 ó 4 días, lo que significa que usa rá dos parches cada semana. Esto significa que se lleva un parche durante 3 días y el otro, 4 días Decida qué dos días de cada semana va a cambiar el parche, y cámbiese el parche en los mismos dos días cada semana.
Por ejemplo: Si decide empezar el tratamiento un lunes siempre en jueves y en lunes.
, entonce
es debe cambiarse el parche
o
✓
o
o
o
o
o
Domingo + mi ércoles Lunes + jueves Martes + viernes es + sábad domi
ado
Miércol
Jueves + domingo Viernes + lunes Sábado + martes
Como recordatorio, marque el embalaje exterior los días que haya elegido de cambio de parche.
El día de cambio de parche, quítese el parche usado y péguese inmediatamente el parche nuevo en una zona diferente de piel de su abdomen. Continúe su tratamiento mientras su médico se lo aconseje.
amb
Doble el parche usado por la mitad, pegándolo sobre sí mismo, y elimínelo de un modo seguro de para mantenerlo alejado de los niños (p. ej., en un cubo de basura). Los medicamentos no se deben tirar por ’os desagües (no los tire por el inodoro). Pregunte a su farmacéutico como deshacerse de los env ases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio iente.
¿Qué sucede con la ducha, el baño y el ejercicio?
Se puede duchar, bañar, nadar y hacer ejercicio siguiendo su vida normal mientras use el parche. El parche está diseñado para mantenerse en su lugar en esas ocasiones. No obstante, no frote la zona en que ha colocado el parche demasiado fuertemente.
¿Qué sucede con los baños solares?
Compruebe siempre que su parche está cubierto con ropa.
¿Y si el parche se afloja, se levantan los bordes o se cae?
Si el parche empieza a desprenderse, puede hacer que se pegue de nuevo si lo presiona firmemente. Si no puede hacer que el parche se pegue bien, quítese el parche suelto y use un parche nuevo. Después, continúe con su calendario normal de días de cambio de parche, aunque ello signifique tirar un parche que ha usado menos de 3-4 días.
Si usted usa más parches de los que debiera
Si se ha aplicado más de un parche a la vez
Quítese todos los parches que tenga adheridos a la piel y consulte con su médico o farmacéutico para más información sobre la forma de continuar el tratamiento con Intrinsa. La sobredosis con Intrinsa es improbable cuando se usa según se indica, porque la testosterona se elimina rápidamente del cuerpo una vez que se quita el parche.
.6'
Si olvidó usar un parche
Si olvidó cambiar el parche
Cámbiese el parche en cuanto se acuerde, y después continúe con su calendario normal de días de cambio de parche, aunque ello signifique tirar un parche que ha usado menos de 3-4 días.
Volver a su calendario habitual, le ayudará a recordar cuándo ha de cambiarse el parche.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.

4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Intrinsa puede producir efectos adversos, aunque no todas las personas los sufran.
Informe a su médico inmediatamente:
- Si nota pérdida de pelo (un efecto adverso frecuente, que puede afectar hasta a una de cada
10 personas), aumento de tamaño del clítoris (un efecto adverso poco frecuente, que puede afectar hasta a una de cada 100 personas), aumento de 'a cantidad de pelo en la barbilla o el labio superior (un efecto adverso muy frecuente, que puede afectar a más de una de cada 10 personas), voz más grave o ronca (un efecto adverso frecuente), aunque estos efectos adversos sean leves. Habitualmente son reversibles si se interrumpe el tratamiento con Intrinsa.
Usted debe ser capaz de vigilar en s: misma el aumento del acné (un efecto adverso frecuente), el aumento del crecimiento de pelo en la cara, la caída del cabello, el agravamiento de la voz o el aumento de tamaño de su clítoris, ya que todos ellos pueden ser signos de los efectos adversos de la testosterona, que es el principio activo de Intrinsa.
Si observa cualquier reacción cutánea en el lugar de aplicación (un efecto adverso muy frecuente), como enrojecimiento, edema o formación de ampollas. El tratamiento se debe interrumpir si aparecen reacciones importantes en el lugar de aplicación.
Otros efectos adversos frecuentes
La mayoría de ellos son de naturaleza leve y reversible.
- migraña

ins omnio/incapacidad para dormir correctamente dolor mamario aumento de peso dolor de estómago
Otros efectos adversos poco frecuentes
La mayoría de ellos son de naturaleza leve y reversible.
- sinusitis (inflamación de los senos nasales)
- anomalía de los factores de la coagulación
- hipersensibilidad (reacciones alérgicas)
- aumento del apetito
- agitación
- ansiedad
trastorno de la atención disgeusia (distorsión del sentido del gusto) alteración del equilibrio
hiperestesia (aumento anormal de la sensibilidad a los estímulos de los sentidos) parestesia oral (sensación de adormecimiento u hormigueos en la boca) ataque isquémico transitorio (una especie de ictus) diplopía (visión doble) enrojecimiento de los ojos
palpitaciones (latidos cardiacos rápidos e irregulares) congestión nasal
-y
8)
sensación de opresión en la garganta diarrea
sequedad de la boca náuseas eczema
aumento de la sudoración rosácea (enrojecimiento de la cara) artritis
quiste mamario congestión del clítoris
prurito genital (sensación generalizada de picor) sensación de escozor vaginal anasarca (hinchazón generalizada de la piel) astenia (falta de energía y fuerza) sensación de opresión en el pecho sensación de molestia en el pecho
anormalidad el fibrinógeno de la sangre (anormalidad de la coagulación sanguínea) aumento de la frecuencia cardiaca aumento de la alanina aminotransferasa, aumento de la aspartato aminotransferasa, aumento de la bilirrubina sanguínea, anormalidad de las pruebas de función del hígado, aumento de los triglicéridos sanguíneos (todas ellas son medidas de la función del hígado).
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. CONSERVACION
TRINSA
Mantener fuera d el alcance y de la vista de los niños.
No utilice Intrinsa después de la fecha de caducidad que aparece en el envase y en el sobre, después de CAD/EXP. La fecha de caducidad es el último día del mes que se indica.
No consei ar a temperatura superior a 30°C.
No ref igerar o congelar.
INFORMACION ADICIONAL
os medicamentos no se deben tirar por los desagües ni a la basura (no los tire por el inodoro).
unte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. e esta forma ayudará a proteger el medio ambiente.
Composición de Intrinsa
El principio activo es testosterona. Cada parche contiene 8,4 mg de testosterona que libera 300 microgramos de testosterona en 24 horas.
Los demás componentes son: Oleato de sorbitano, copolímero de 2-Etilhexiacrilato -1-Vinil-2-pirrolidona.
Capa cobertora
Lámina cobertora translúcida de polietileno impresa con tinta que contiene amarillo ocaso FCF (E110), litolrubina BK (E180) y pigmento azul de ftalocianina de cobre.
Recubrimiento protector Lámina de poliéster siliconizada.
Aspecto del producto y contenido del envase
Intrinsa es un parche fino, transparente, de forma ovalada, con T001 impreso en el dorso de cada parche. Cada parche está sellado en un sobre.
Se comercializan los siguientes tamaños de envase: 2, 8 y 24 parches. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Warner Chilcott UK Limited Old Belfast Road Millbrook, Larne County Antrim BT40 2SH Reino Unido
Responsable de la fabricación
Warner Chilcott Deutschland GmbH Dr.-Otto-Rohm-Strasse 2-4 64331 Weiterstadt Alemania
Warner Chilcott France
Parc d’activité de la Grande Breche
5 rue Désir Prévost
91070 Bondoufle
Francia
.O
«P
Este prospecto ha sido aprobado en
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.em a.europa.eu
<&
óx
.<?
<y
ANEXO IV
RAZONES PARA UNA RENOVACIÓN ADICIONAL
<>
o°

Razones para una renovación adicional
A partir de los datos que han surgido desde que se otorgó la Autorización de Comercialización inicial, el Comité de Medicamentos de Uso Humano (CHMP) considera que el balance beneficio-riesgo de Intrinsa sigue siendo positivo, pero considera que su perfil de seguridad debe controlarse de cerca por las siguientes razones:
El uso para una indicación no recogida en la ficha técnica constituye un riesgo de seguridad. El CHMP está preocupado porque los datos del estudio THIN (The Health Improvement Database - La Base de Datos de Mejora de la Salud) sugieren que aproximadamente el 70% de los usuarios están fuera de la indicación.
El CHMP decidió que el Titular de la Autorización de Comercialización (TAC) debe seguir presentando Informes Periódico de Seguridad (IPS) semestrales.
Por lo tanto, a partir del perfil de seguridad de Intrinsa, que requiere la presentación de IPS semestrales, el CHMP concluyó que el TAC debe presentar una solicitud de renovación adicional en un plazo de cinco años.
\A
.O
/

29