Intanza 9 Microgramos/Cepa Suspension Inyectable
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
INTANZA 9 microgramos/cepa suspensión inyectable Vacuna antigripal (virus fraccionados, inactivados)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-179A)............9 microgramos HA**
Cepa derivada de A/Texas/50/2012 (H3N2): (NYMC X-223A)......................9 microgramos HA**
B/Massachusetts/2/2012........................................................................................9 microgramos HA**
Por dosis de 0,1 ml
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
Esta vacuna cumple con la recomendación de la OMS (Hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2014/2015.
Para consultar la lista completa de excipientes, ver sección 6.1.
INTANZA puede contener residuos de huevos como la ovoalbúmina y residuos de neomicina, formaldehído y octoxinol-9, utilizados durante el proceso de fabricación (ver sección 4.3).
3. FORMA FARMACÉUTICA
Suspensión inyectable.
Suspensión incolora y opalescente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Profilaxis de la gripe en adultos hasta los 59 años, especialmente en personas con un mayor riesgo de complicaciones asociadas.
El uso de INTANZA debe basarse en las recomendaciones oficiales.
4.2 Posología y forma de administración Posología
Adultos hasta 59 años: 0,1 ml.
Población pediátrica
INTANZA no está recomendado para uso en niños y adolescentes menores de 18 años debido a la escasez de datos de seguridad y eficacia.
Forma de administración
La inmunización debe realizarse por vía intradérmica.
El lugar de administración recomendado es la zona del deltoides.
Precauciones que deben tomarse antes de manipular o administrar este medicamento
Para consultar las instrucciones de preparación del medicamento antes de la administración, ver
sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1, o a cualquiera de los residuos tales como huevos (ovoalbúmina, proteínas de pollo), neomicina, formaldehído y octoxinol-9.
La inmunización se debe retrasar en pacientes con enfermedad febril o infección aguda.
4.4 Advertencias y precauciones especiales de empleo
Como con todas las vacunas inyectables, siempre se debe disponer del tratamiento y la supervisión médica apropiada en el caso de que ocurra un episodio anafiláctico tras la administración de la vacuna (ver sección 4.8).
INTANZA no debe ser administrada intravascularmente en ningún caso.
La respuesta de los anticuerpos en pacientes con inmunodepresión endógena o iatrogénica puede ser insuficiente.
Los datos disponibles para INTANZA en pacientes inmunocomprometidos, son muy limitados.
En el caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario volver a vacunar.
Para consultar interferencia con análisis serológicos: ver sección 4.5.
4.5 Interacción con otros medicamentos y otras formas de interacción
INTANZA puede administrarse simultáneamente con otras vacunas. La inmunización debe realizarse en extremidades distintas. Debe tenerse en cuenta que las reacciones adversas pueden intensificarse.
Los pacientes bajo terapia inmunosupresora pueden presentar una respuesta inmunológica disminuida a la vacuna.
Se han observado resultados falsos positivos tras la vacunación con vacuna antigripal, en ensayos serológicos que utilizan el método ELISA para detectar anticuerpos frente a VIH-1, virus de la Hepatitis C y especialmente HTLV-1. Se debe utilizar la técnica Western Blot para refutar los falsos positivos de los resultados del test de ELISA. Los resultados falsos positivos transitorios pueden ser debidos a la respuesta de IgM que produce la vacuna.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos clínicos disponibles sobre la exposición de INTANZA en embarazadas. En un estudio en animales no se mostraron efectos dañinos directos o indirectos sobre el embarazo, desarrollo embrionico/fetal, parto o desarrollo posnatal.
Las vacunas antigripales inactivadas se pueden utilizar en todas las fases del embarazo. Las series de datos de seguridad disponibles son más amplias para el segundo y tercer trimestres de embarazo que para el primer trimestre. Sin embargo los datos sobre el uso de vacunas antigripales inactivadas a nivel mundial no indican que tengan ningún efecto perjudicial para el feto o la madre embarazada atribuible a la vacuna.
Lactancia
La vacuna INTANZA puede utilizarse durante el período de lactancia.
Fertilidad
No hay datos de fertilidad disponibles en humanos. Un estudio con INTANZA en animales no mostró efectos perjudiciales sobre la fertilidad femenina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
INTANZA no tiene ó tiene una influencia insignificante en la capacidad de conducir y utilizar máquinas.
4.8 Reacciones adversas
a. Resumen sobre el perfil de seguridad
La seguridad de INTANZA se ha evaluado en dos ensayos clínicos abiertos y aleatorizados, en los que 2.384 vacunados recibieron una inyección de INTANZA.
La evaluación de la seguridad se realizó en todos los sujetos durante las 3 semanas siguientes a la vacunación y se recogieron las reacciones adversas graves durante 6 meses de seguimiento.
Las reacciones más frecuentes que se produjeron tras la administración de la vacuna, fueron las reacciones locales en el lugar de inyección.
Las reacciones locales aparentes fueron más frecuentes después de la administración intradermal en comparación con la vacuna de administración intramuscular.
La mayoría de las reacciones se resolvieron espontáneamente entre 1 y 3 días después del inicio de las mismas.
El perfil de seguridad sistémica de INTANZA es similar en comparación con la vacuna de administración intramuscular.
Tras inyecciones repetidas anualmente, el perfil de seguridad de INTANZA es similar al de las inyecciones previas.
b. Resumen tabulado de las reacciones adversas
Los siguientes datos resumen las frecuencias de las reacciones adversas que se registraron en los ensayos clínicos y durante la experiencia mundial post-comercialización, después de la vacunación, de acuerdo a la siguiente convención: Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
Frecuencia no conocida |
|
Trastornos de la sangre y del sistema linfático |
Linfoade- nopatía | |||||
|
Trastornos del sistema inmunológico |
Reacciones alérgicas, incluyendo reacciones generalizadas en la piel, reacciones como urticaria, reacciones anafilácticas, angioedema, shock. | |||||
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Parestesia | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, rash |
Sudorac ión | ||||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgia |
Artralgia | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Malestar, Reacciones locales: Enrojecimiento*, inflamación, induración, dolor, prurito |
Escalofríos, fiebre, Reacciones locales: equimosis |
Astenia |
* En algunos casos, el enrojecimiento local duró hasta 7 días
c. Acontecimientos adversos potenciales
En base a la experiencia con las vacunas de virus de la gripe inactivados trivalentes administradas por vía intramuscular ó por vía subcutánea profunda, se pueden notificar los siguientes acontecimientos:
Trastornos de la sangre y del sistema linfático Trombocitopenia transitoria.
Trastornos del sistema nervioso
Neuralgia, convulsiones febriles, trastornos neurológicos, tales como encefalomielitis, neuritis y síndrome de Guillain-Barré.
Trastornos vasculares
Vasculitis asociada en muy raras ocasiones con implicación renal transitoria.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Es poco probable que la sobredosis produzca algún efecto desfavorable.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Vacunas contra la gripe.
Código ATC: J07BB02
Inmunogenicidad
La seroprotección se obtiene normalmente en 2-3 semanas. La duración de la inmunidad postvacunal a cepas homólogas o a cepas estrechamente relacionadas con las de la vacuna varía, pero es normalmente de 6-12 meses.
En un ensayo comparativo aleatorizado de fase III, 1.796 sujetos de 18 a 59 años recibieron 0,1 ml de INTANZA por vía intradérmica y 453 sujetos de 18 a 59 años recibieron 0,5 ml de la vacuna de gripe trivalente inactivada administrada por vía intramuscular.
En este ensayo comparativo se evaluó la tasa de seroprotección*, la tasa de seroconversión ó incremento significativo de los títulos**, y el cociente de la media geométrica del título de anticuerpos (GMTR) anti-HA (medido por HI), de acuerdo a unos criterios predefinidos.
Los resultados obtenidos fueron los siguientes (los valores entre paréntesis muestran el intervalo de confianza del 95%):
|
Anticuerpos Anti-HA cepa específicos |
A/H1N1 A/New Caledonia/20/99 N=1.296 |
A/H3N2 A/Wisconsin/67/2005 N=1.297 |
B B/Malaysia/2506/2004 N=1.294 |
|
Tasa de seroprotección |
87,2% (85,2; 89,0) |
93,5% (92,0; 94,8) |
72,9% (70,4; 75,3) |
|
Tasa de seroconversión/ incremento significativo |
57,5% (54,7; 60,2) |
66,5% (63,8; 69,0) |
56,7% (54,0; 59,4) |
|
GMTR |
9,17 (8,33; 10,1) |
11,5 (10,4; 12,7) |
6,39 (5,96; 6,84) |
* Seroprotección = título de HI > 40
** Seroconversión = título de HI negativos pre-vacunacion y título de HI post-vacunación > 40, incremento significativo = títulos HI positivos pre-vacunación y al menos un incremento de 4 veces en el título de HI post-vacunación
GMTR: Cociente de la media geométrica del título individual (Títulos pre/post-vacunación).
INTANZA es tan inmunogénica como la vacuna de la gripe trivalente inactivada de administración intramuscular comparada, para cada una de las 3 cepas de gripe en sujetos entre 18 y 59 años.
En las tres cepas de gripe, las tasas de seroprotección de la vacuna intramuscular comparada, estaban dentro de un rango entre 74,8% y 95,4%, las tasas de seroconversión o incremento significativo estaban dentro de un rango entre 56,4% y 69,3% y las GMTR estaban dentro de un rango entre 6,63 y
11,2 veces sobre los títulos de HI basales.
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos, a partir de estudios en animales. La vacuna fue inmunogénica en ratones y conejos. En los estudios de toxicidad sistémica a dosis repetidas en conejos no hubo ninguna evidencia de toxicidad sistémica. Sin embargo, la administración única y repetida provocó eritema local y edema transitorios. La genotoxicidad y el potencial carcinogénico no fueron evaluados, ya que estos estudios no son apropiados para vacunas. Los estudios de fertilidad y toxicidad para la reproducción en hembras no han identificado ningún riesgo potencial específico para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio Cloruro de potasio Fosfato de disodio dihidrato Fosfato dihidrógeno de potasio Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, esta vacuna no debe mezclarse con otros medicamentos.
6.3 Período de validez 1 año.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
6.5 Naturaleza y contenido del envase
0,1 ml de suspensión en jeringa precargada (vidrio) con sistema de microinyección, con una microaguja, equipada con un tapón de émbolo (elastómero de clorobutilo) y un tapón en el extremo (elastómero termoplástico y polipropileno) y un sistema de protección de la aguja. Envases con 1, 10, ó 20.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
La vacuna debe alcanzar la temperatura ambiente antes de su utilización.
La vacuna no debe utilizarse si presenta partículas extrañas en la suspensión.
No es necesario agitar antes de su uso.
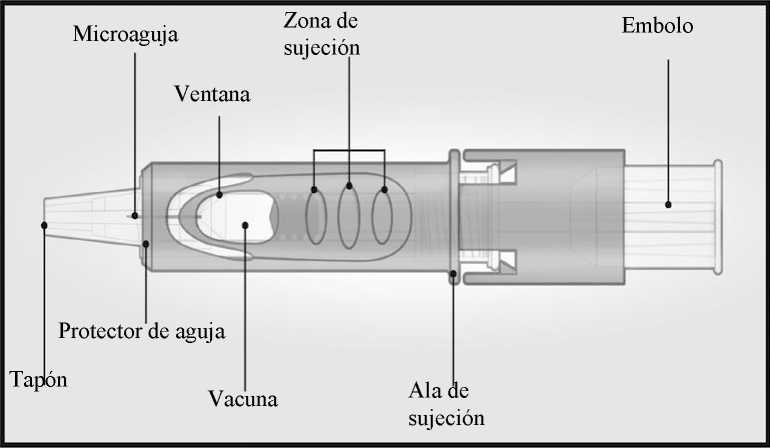
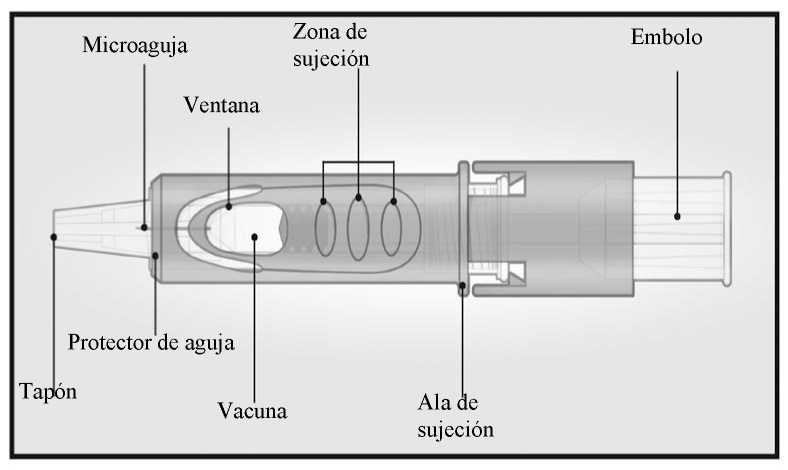
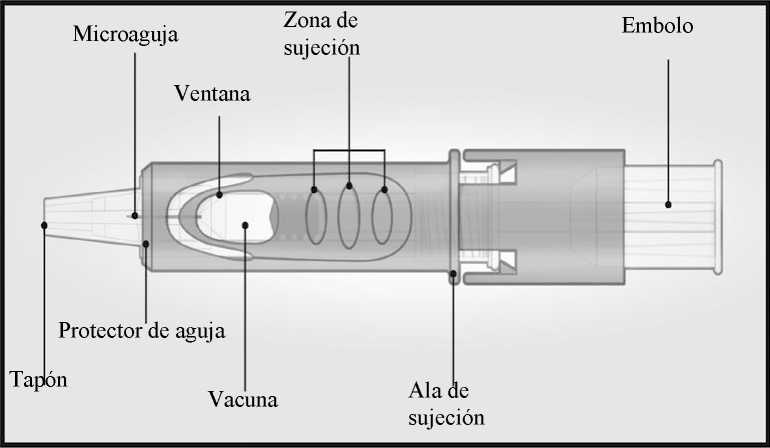
El sistema de micro-inyección para inyección intradérmica consiste en una jeringa precargada con microaguja (1,5 mm) y un sistema protector de la aguja.
El sistema de protección de la aguja está diseñado para cubrir la microaguja después de su uso.
Sistema de micro-inyección
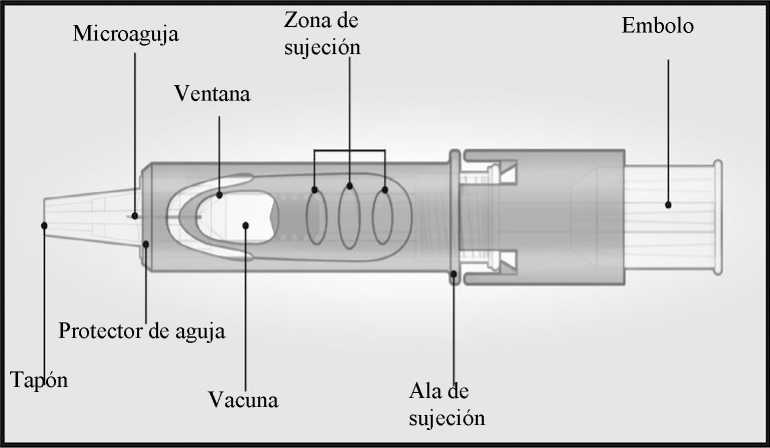
INSTRUCCIONES DE USO
Por favor lea las instrucciones antes de su uso
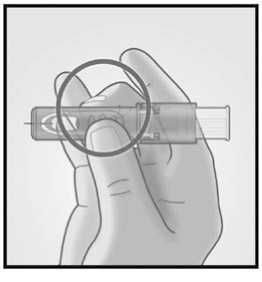
1/ RETIRAR EL TAPÓN DE LA AGUJA 2/ SUJETAR EL SISTEMA DE MICRO-
INYECCIÓN ENTRE EL PULGAR Y EL
DEDO CORAZÓN
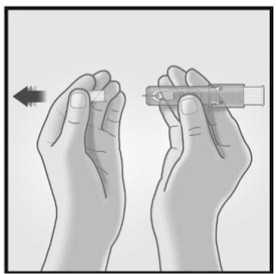
Retirar el tapón de la aguja del sistema de micro-inyección
No purgar el aire a través de la aguja.
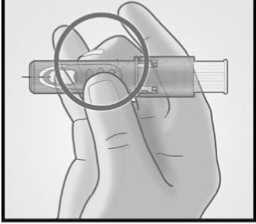
Sujetar el sistema colocando solamente los dedos pulgar y corazón sobre la zona de sujeción; el dedo índice no se apoya.
No colocar los dedos sobre la ventana.
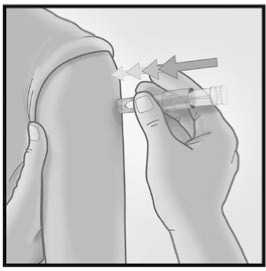
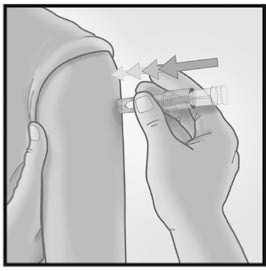
Una vez que la microaguja se ha introducido, mantener una leve presión en la superficie de la piel e inyectar usando el dedo índice para presionar sobre el émbolo. No es necesario aspirar antes de administrar la vacuna.
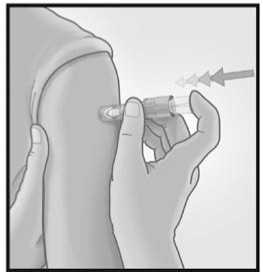
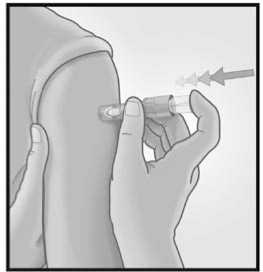
3/ INTRODUCIR LA AGUJA RAPIDAMENTE PERPENDICULAR A LA PIEL
Introducir la aguja
perpendicular a la piel, en la zona del deltoides, en un movimiento corto y rápido.
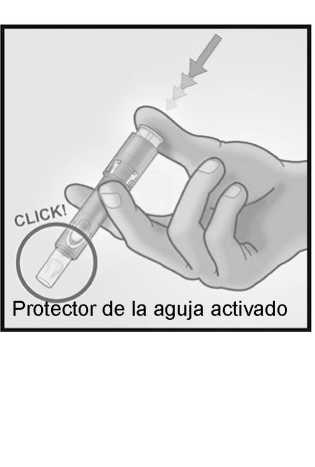
5/ ACTIVAR EL PROTECTOR DE LA AGUJA PRESIONANDO CON FIRMEZA SOBRE EL ÉMBOLO
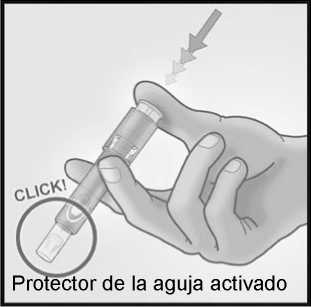
Retirar la aguja de la piel.
Mantenga la aguja alejada de usted y de las personas a su alrededor.
Con la misma mano, presione con firmeza con el pulgar sobre el émbolo para activar el protector de la aguja.
Oirá un clic y un protector aparecerá para cubrir la aguja. Eliminar inmediatamente el sistema en el contenedor dispuesto a tal efecto.
Se considera una inyección correcta tanto si aparece como si no aparece pápula.
En caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario re-vacunar.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francia
8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/505/001
EU/1/08/505/002
EU/1/08/505/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN /RENOVACIÓN DE LA AUTORIZACIÓN.
Fecha de la primera autorización: 24 de febrero de 2009 Fecha de la última revalidación: 24 de febrero de 2014
10. FECHA DE REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
INTANZA 15 microgramos/cepa suspensión inyectable Vacuna antigripal (virus fraccionados, inactivados)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-179A)..........15 microgramos HA**
Cepa derivada de A/Texas/50/2012 (H3N2): (NYMC X-223A)...................15 microgramos HA**
B/Massachusetts/2/2012......................................................................................15 microgramos HA**
Por dosis de 0,1 ml
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
Esta vacuna cumple con la recomendación de la OMS (Hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2014/2015.
Para consultar la lista completa de excipientes, ver sección 6.1.
INTANZA puede contener residuos de huevos como la ovoalbúmina y residuos de neomicina, formaldehído y octoxinol-9, utilizados durante el proceso de fabricación (ver sección 4.3).
3. FORMA FARMACÉUTICA
Suspensión inyectable.
Suspensión incolora y opalescente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Profilaxis de la gripe en adultos de 60 años y mayores, especialmente en personas con un mayor riesgo de complicaciones asociadas.
El uso de INTANZA debe basarse en las recomendaciones oficiales.
4.2 Posología y forma de administración Posología
Adultos de 60 años ó mayores: 0,1 ml.
Población pediátrica
INTANZA no está recomendado para uso en niños y adolescentes menores de 18 años debido a la escasez de datos de seguridad y eficacia.
Forma de administración
La inmunización debe realizarse por vía intradérmica.
El lugar de administración recomendado es la zona del deltoides.
Precauciones que deben tomarse antes de manipular o administrar este medicamento
Para consultar las instrucciones de preparación del medicamento antes de la administración, ver
sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1, o a cualquiera de los residuos tales como huevos (ovoalbúmina, proteínas de pollo), neomicina, formaldehído y octoxinol-9.
La inmunización se debe retrasar en pacientes con enfermedad febril o infección aguda.
4.4 Advertencias y precauciones especiales de empleo
Como con todas las vacunas inyectables, siempre se debe disponer del tratamiento y la supervisión médica apropiada en el caso de que ocurra un episodio anafiláctico tras la administración de la vacuna (ver sección 4.8).
INTANZA no debe ser administrada intravascularmente en ningún caso.
La respuesta de los anticuerpos en pacientes con inmunodepresión endógena o iatrogénica puede ser insuficiente.
Los datos disponibles para INTANZA en pacientes inmunocomprometidos, son muy limitados.
En el caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario volver a vacunar.
Para consultar interferencia con análisis serológicos: ver sección 4.5.
4.5 Interacción con otros medicamentos y otras formas de interacción
INTANZA puede administrarse simultáneamente con otras vacunas. La inmunización debe realizarse en extremidades distintas. Debe tenerse en cuenta que las reacciones adversas pueden intensificarse.
Los pacientes bajo terapia inmunosupresora pueden presentar una respuesta inmunológica disminuida a la vacuna.
Se han observado resultados falsos positivos tras la vacunación con vacuna antigripal, en ensayos serológicos que utilizan el método ELISA para detectar anticuerpos frente a VIH-1, virus de la Hepatitis C y especialmente HTLV-1. Se debe utilizar la técnica Western Blot para refutar los falsos positivos de los resultados del test de ELISA. Los resultados falsos positivos transitorios pueden ser debidos a la respuesta de IgM que produce la vacuna.
4.6 Fertilidad, embarazo y lactancia
Esta información no es aplicable ya que esta vacuna se administra en adultos de 60 años ó mayores.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
INTANZA no tiene ó tiene una influencia insignificante sobre la capacidad de conducir y utilizar máquinas.
4.8 Reacciones adversas
a. Resumen sobre el perfil de seguridad
La seguridad de INTANZA se ha evaluado en tres ensayos clínicos abiertos y aleatorizados, en los que 3.372 vacunados recibieron una inyección de INTANZA.
La evaluación de la seguridad se realizó en todos los sujetos durante las 3 semanas siguientes a la vacunación y se recogieron las reacciones adversas graves durante 6 meses de seguimiento para 2.974 sujetos (incluidos en dos de los tres ensayos clínicos).
Las reacciones más frecuentes que se produjeron tras la administración de la vacuna, fueron las reacciones locales en el lugar de inyección.
Las reacciones locales aparentes fueron más frecuentes después de la administración intradermal en comparación con la vacuna de administración intramuscular adyuvada o no adyuvada.
La mayoría de las reacciones se resolvieron espontáneamente entre 1 y 3 días después del inicio de las mismas.
El perfil de seguridad sistémica de INTANZA es similar en comparación con la vacuna de administración intramuscular adyuvada o no adyuvada.
Tras inyecciones repetidas anualmente, el perfil de seguridad de INTANZA es similar al de las inyecciones previas.
b. Resumen tabulado de las reacciones adversas
Los siguientes datos resumen las frecuencias de las reacciones adversas que se registraron en los ensayos clínicos y durante la experiencia mundial post-comercialización, después de la vacunación, de acuerdo a la siguiente convención: Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
Frecuencia no conocida |
|
Trastornos del sistema inmunológi-co |
Reacciones alérgicas, incluyendo reacciones generaliza-das en la piel, tales como urticaria, reacciones anafilácticas, angioedema, shock. | |||||
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Parestesia, neuritis | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Sudo- ración |
Prurito, rash | ||||
|
Trastornos musculoesqueléti-cos y del tejido conjuntivo |
Mialgia |
Artral- gia | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones locales: Enrojecimiento*, induración, inflamación, prurito, dolor |
Malestar, escalofríos, fiebre, Reacciones locales: equimosis |
Fatiga |
* En algunos casos, el enrojecimiento local duró hasta 7 días
c. Acontecimientos adversos potenciales
En base a la experiencia con las vacunas de virus de la gripe inactivados trivalentes administradas por vía intramuscular ó por vía subcutánea profunda, se pueden notificar los siguientes acontecimientos:
Trastornos de la sangre y del sistema linfático Trombocitopenia transitoria, linfadenopatía transitoria.
Trastornos del sistema nervioso
Neuralgia, convulsiones febriles, trastornos neurológicos, tales como encefalomielitis y síndrome de Guillain-Barré.
Trastornos vasculares
Vasculitis asociada en muy raras ocasiones con implicación renal transitoria.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Es poco probable que la sobredosis produzca algún efecto desfavorable.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Vacunas contra la gripe Código ATC: J07BB02
Inmunogenicidad
La seroprotección se obtiene normalmente en 2-3 semanas. La duración de la inmunidad postvacunal a cepas homólogas o a cepas estrechamente relacionadas con las de la vacuna varía, pero es normalmente de 6-12 meses.
En un ensayo pivotal comparativo aleatorizado de fase III, 2.606 sujetos de más de 60 años recibieron 0,1 ml de INTANZA por vía intradérmica y 1.089 sujetos de más de 60 años recibieron 0,5 ml de la vacuna de gripe trivalente inactivada administrada por vía intramuscular.
En este ensayo comparativo se evaluó la media geométrica de los títulos de anticuerpos (GMTs), la tasa de seroprotección*, la tasa de seroconversión ó incremento significativo de los títulos**, y el cociente de la media geométrica del título individual (GMTR) de los anticuerpos anti-HA (medido por HI), de acuerdo a unos criterios predefinidos.
Los resultados obtenidos fueron los siguientes (los valores entre paréntesis muestran el intervalo de confianza del 95%):
|
15 ug Intradérmica | |||
|
A/H1N1 |
A/H3N2 |
B | |
|
A/New Caledonia/ 20/99 |
A/Wisconsin/ 67/2005 |
B/Malaysia/ 2506/2004 | |
|
N = 2.585 |
N = 2.586 |
N = 2.582 | |
|
Media geométrica de los títulos (1/dil) |
81,7 |
298,0 |
39,9 |
|
(78,0 ; 85,6) |
(282 ; 315) |
(38,3 ; 41,6) | |
|
Tasa de seroproteción (%) * |
77,0 (75,3; 78,6) |
93,3 (92,3; 94,3) |
55,7 (53,8; 57,6) |
|
Seroconversión o incremento significativo de los títulos (%) ** |
38,7 (36,8 ; 40,6) |
61,3 (59,3 ; 63,1) |
36,4 (34,5 ; 38,3) |
|
Cociente de la media geométrica del título individual (GMTR) |
3,97 (3,77 ; 4,18) |
8,19 (7,68 ; 8,74) |
3,61 (3,47 ; 3,76) |
* Seroprotección = título de HI > 40
** Seroconversión = título de HI negativos pre-vacunacion y título de HI post-vacunación > 40, incremento significativo = títulos HI positivos pre-vacunación y al menos un incremento de 4 veces en el título de HI post-vacunación
GMTR: Cociente de la media geométrica del título individual (Títulos pre/post-vacunación).
INTANZA es al menos tan inmunogénica como el comparador, vacuna trivalente inactivada de la gripe administrada por vía intramuscular, para cada una de las 3 cepas de gripe, en sujetos a partir de los 60 años y mayores.
En comparación, la vacuna intramuscular, presentó, para las tres cepas de gripe, valores de GMT que oscilaron entre 34,8 (1/dil) y 181.0 (1/dil), tasas de seropotección entre 48,9 % y 87,9 %, tasas de seroconversión o incremento significativo de los títulos entre 30,0 % y 46,9% y GMTR que oscilaron entre 3,04 y 5,35 veces sobre los títulos basales de HI.
En un ensayo en fase III aleatorizado, comparativo, 398 sujetos mayores de 65 años recibieron 0,1 ml de INTANZA por vía intradérmica y 397 sujetos mayores de 65 años recibieron 0,5 ml de una vacuna trivalente de gripe inactivada adyuvada (con MF-59) en la misma dosis, administrada por vía intramuscular.
INTANZA es tan inmunogénica como la vacuna trivalente adyuvada (Conteniendo MF-59) con la que comparamos, en términos de GMT para cada una de las 3 cepas, con el método SRH y para 2 cepas con el método de la HI.
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos, a partir de estudios en animales. La vacuna fue inmunogénica en ratones y conejos. En los estudios de toxicidad sistémica a dosis repetidas en conejos no hubo ninguna evidencia de toxicidad sistémica. Sin embargo, la administración única y repetida provocó eritema local y edema transitorios. La genotoxicidad y el potencial carcinogénico no fueron evaluados, ya que estos estudios no son apropiados para vacunas. Los estudios de fertilidad y toxicidad para la reproducción en hembras no han identificado ningún riesgo potencial específico para los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio Cloruro de potasio Fosfato de disodio dihidrato Fosfato dihidrógeno de potasio Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, esta vacuna no debe mezclarse con otros medicamentos.
6.3 Período de validez 1 año.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
6.5 Naturaleza y contenido del envase
0,1 ml de suspensión en jeringa precargada (vidrio) con sistema de microinyección, con una microaguja, equipada con un tapón de émbolo (elastómero de clorobutilo) y un tapón en el extremo (elastómero termoplástico y polipropileno) y un sistema de protección de la aguja. Envases con 1, 10, ó 20.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
La vacuna debe alcanzar la temperatura ambiente antes de su utilización.
La vacuna no debe utilizarse si presenta partículas extrañas en la suspensión.
No es necesario agitar antes de su uso.
El sistema de micro-inyección para inyección intradérmica consiste en una jeringa precargada con microaguja (1,5 mm) y un sistema protector de la aguja.
El sistema de protección de la aguja está diseñado para cubrir la microaguja después de su uso.
Sistema de micro-inyección
INSTRUCCIONES DE USO
Por favor lea las instrucciones antes de su uso
1/ RETIRAR EL TAPÓN DE LA AGUJA 2/ SUJETAR EL SISTEMA DE MICRO-
INYECCIÓN ENTRE EL PULGAR Y EL
DEDO CORAZÓN
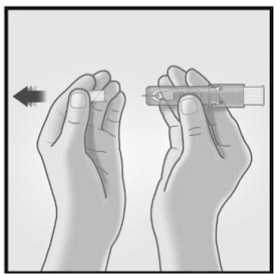
Retirar el tapón de la aguja del sistema de micro-inyección.
No purgar el aire a través de la aguja.
Sujetar el sistema colocando solamente los dedos pulgar y corazón sobre la zona de sujeción; el dedo índice no se apoya.
No colocar los dedos sobre la ventana.
3/ INTRODUCIR LA AGUJA RAPIDAMENTE PERPENDICULAR A LA PIEL
Introducir la aguja
perpendicular a la piel, en la zona del deltoides, en un movimiento corto y rápido.
Una vez que la micro aguja se ha introducido, mantener una leve presión en la superficie de la piel e inyectar usando el dedo índice para presionar sobre el émbolo. No es necesario aspirar antes de administrar la vacuna.
5/ ACTIVAR EL PROTECTOR DE LA AGUJA PRESIONANDO CON FIRMEZA SOBRE EL ÉMBOLO
Retirar la aguja de la piel.
Mantenga la aguja alejada de usted y de las personas a su alrededor.
Con la misma mano, presione con firmeza con el pulgar sobre el émbolo para activar el protector de la aguja.
Oirá un clic y un protector aparecerá para cubrir la aguja.
Eliminar inmediatamente el sistema en el contenedor dispuesto a tal efecto.
Se considera una inyección correcta tanto si aparece como si no aparece pápula.
En caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario re-vacunar.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francia
8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/505/004
EU/1/08/505/005
EU/1/08/505/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN /RENOVACIÓN DE LA AUTORIZACIÓN.
Fecha de la primera autorización: 24 de febrero de 2009 Fecha de la última revalidación: 24 de febrero de 2014
10. FECHA DE REVISIÓN DEL TEXTO
MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES RELATIVAS AL USO SEGURO Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) del (de los) principio(s) activo(s) biológico(s)
Sanofi Pasteur Parc Industriel d’Incarville 27100 Val-de-Reuil Francia
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Sanofi Pasteur Parc Industriel d’Incarville 27100 Val-de-Reuil Francia
Sanofi Pasteur
Campus Mérieux
1541 avenue Marcel Mérieux
69280 Marcy L’Etoile
Francia
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO Medicamento sujeto a prescripción médica.
• Liberación oficial de lotes
De conformidad con el artículo 114 de la Directiva 2001/83/EC modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes Periódicos de Seguridad (IPS)
El titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INTANZA 9 microgramos/cepa suspensión inyectable Vacuna antigripal (virus fraccionados, inactivados) Campaña 2014/2015
2. PRINCIPIO(S) ACTIVO(S)_
Virus de la gripe (fraccionados, inactivados) de las siguientes cepas: Cepa derivada de A/California/7/2009 (H1N1)pdm09 Cepa derivada de A/Texas/50/2012 (H3N2)
B/Massachusetts/2/2012
9 pg de hemaglutinina por cepa por dosis de 0,1 ml
Cloruro de sodio, cloruro de potasio, fosfato de disodio dihidrato, fosfato dihidrógeno de potasio, agua para preparaciones inyectables.
Suspensión inyectable
1 jeringa precargada (0,1 ml) con sistema de micro-inyección 10 jeringas precargadas (0,1 ml) con sistema de micro-inyección 20 jeringas precargadas (0,1 ml) con sistema de micro-inyección
Vía intradérmica
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACION
Conservar en nevera. No congelar.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD SNC 162 avenue Jean Jaures 69007 Lyon Francia
12. NUMERO(S) DE AUTORIZACION DE COMERCIALIZACION
EU/1/08/505/001 - Envase de 1 jeringa precargada con sistema de micro-inyección EU/1/08/505/002 - Envase de 10 jeringas precargadas con sistema de micro-inyección EU/1/08/505/003 - Envase de 20 jeringas precargadas con sistema de micro-inyección
13. NUMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACION EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
INTANZA 15 microgramos/cepa suspensión inyectable Vacuna antigripal (virus fraccionados, inactivados) Campaña 2014/2015
2. PRINCIPIO(S) ACTIVO(S)_
Virus de la gripe (fraccionados, inactivados) de las siguientes cepas:
Cepa derivada de A/California/7/2009 (H1N1)pdm09 Cepa derivada de A/Texas/50/2012 (H3N2)
B/Massachusetts/2/2012
15 pg de hemaglutinina por cepa por dosis de 0,1 ml
3. LISTA DE EXCIPIENTES
Cloruro de sodio, cloruro de potasio, fosfato de disodio dihidrato, fosfato dihidrógeno de potasio, agua para preparaciones inyectables.
Suspensión inyectable.
1 jeringa precargada 0,1 ml) con sistema de micro-inyección 10 jeringas precargadas (0,1 ml) con sistema de micro-inyección 20 jeringas precargadas (0,1 ml) con sistema de micro-inyección
Vía intradérmica
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera. No congelar.
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Sanofi Pasteur MSD SNC 162 avenue Jean Jaures 69007 Lyon Francia
EU/1/08/505/004 - Envase de 1 jeringa precargada con sistema de micro-inyección EU/1/08/505/005 - Envase de 10 jeringas precargadas con sistema de micro-inyección EU/1/08/505/006 - Envase de 20 jeringas precargadas con sistema de micro-inyección
Lote
Se acepta la justificación para no incluir la información en Braille
ETIQUETA DE LA JERINGA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
INTANZA 9 pg/cepa 2014/2015 Vacuna antigripal Vía intradérmica
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
6. OTROS
Sanofi Pasteur MSD SNC
ETIQUETA DE LA JERINGA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
INTANZA 15 pg/cepa 2014/2015 Vacuna antigripal Vía intradérmica
2. FORMA DE ADMINISTRACION
3. FECHA DE CADUCIDAD
EXP
4. NUMERO DE LOTE
Lot
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
6. OTROS
Sanofi Pasteur MSD SNC
B. PROSPECTO
INTANZA 9 microgramos/cepa suspensión inyectable
Vacuna antigripal (virus fraccionados, inactivados)
Lea todo el prospecto detenidamente antes de que usted sea vacunado porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Esta vacuna se le ha recetado solamente a usted y no debe dársela a otras personas.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es INTANZA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar INTANZA
3. Cómo usar INTANZA
4. Posibles efectos adversos
5. Conservación de INTANZA
6. Contenido del envase e información adicional
1. Qué es INTANZA y para qué se utiliza
INTANZA es una vacuna. Esta vacuna está indicada para protegerle a usted frente a la gripe. Esta vacuna se administra a adultos hasta los 59 años, especialmente en las personas que tienen un mayor riesgo de complicaciones asociadas.
Cuando se inyecta INTANZA, el sistema inmune (las defensas naturales del cuerpo) producirá protección frente a la infección por gripe.
INTANZA le ayudará a protegerse frente a la gripe si está causada por una de las tres cepas de virus de la gripe contenidas en la vacuna, u otras cepas estrechamente relacionadas con ellas. La eficacia completa de la vacuna generalmente se alcanza 2 ó 3 semanas después de la vacunación.
2. Qué necesita saber antes de empezar a usar INTANZA
No use INTANZA:
- si usted es alérgico a:
• Los principios activos,
• A cualquiera de los demás componentes de esta vacuna (incluidos en la sección 6),
• A cualquiera de los componentes que pueden estar presentes en cantidades mínimas, como huevos (ovoalbúmina, proteínas de pollo), neomicina, formaldehído o al octoxinol 9.
- si usted padece una enfermedad que se acompañe de fiebre o una infección aguda, la vacunación debe posponerse hasta que se haya recuperado.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar INTANZA.
- Consulte a su médico antes de vacunarse si usted tiene una respuesta inmunológica debilitada (inmunodeprimidos) debido a una enfermedad o medicamentos ya que la vacuna podría no funcionar bien en este caso.
- Esta vacuna no debe ser administrada en una vena (por vía intravenosa) bajo ninguna circunstancia.
- Si, por alguna razón, se le practica un análisis de sangre a los pocos días de la vacunación frente
a la gripe, por favor informe a su médico. Se pueden ver afectados los análisis para HIV-1, virus de la hepatitis C y HTLV-1.
Niños y adolescentes
No se recomienda el uso de INTANZA en niños y adolescentes menores de 18 años.
Uso de INTANZA con otras vacunas o medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
- Otras vacunas: INTANZA puede administrarse al mismo tiempo que otras vacunas, en diferentes extremidades. Se debe tener en cuenta que los efectos adversos pueden intensificarse.
- Informe a su médico si ha utilizado medicamentos que pueden reducir la respuesta inmunológica: tales como los corticoesteroides (p.e. cortisona), los medicamentos frente al cáncer (quimioterapia), radioterapia u otros medicamentos que afectan al sistema inmunitario. En este caso, la vacuna podría no funcionar correctamente.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Las vacunas antigripales se pueden utilizar en todas las fases del embarazo. Las series de datos de seguridad disponibles son más amplias para el segundo y tercer trimestres de embarazo que para el primer trimestre. Sin embargo los datos sobre el uso de vacunas antigripales a nivel mundial no indican que pueda tener efectos perjudiciales sobre el embarazo o el bebé.
Su médico podrá decidir si usted debe ser vacunada con esta vacuna.
Esta vacuna puede ser utilizada durante el periodo de lactancia.
Conducción y uso de máquinas
Esta vacuna no tiene ó tiene una influencia insignificante sobre la capacidad de conducir y utilizar máquinas.
3. Cómo usar INTANZA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es 0,1 ml para adultos entre 18 y 59 años.
INTANZA se administrará por su médico o enfermero.
INTANZA se administrará con una inyección en la capa superficial de la piel (preferentemente sobre el músculo de la parte superior del brazo).
Si tiene cualquier duda sobre el uso de este producto, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Debe acudir a su médico inmediatamente si experimenta síntomas de angioedema, tales como:
• Hinchazón de cara, garganta o faringe
• Dificultad para tragar
• Urticaria y dificultad para respirar
Los efectos adversos más frecuentes que se han observado con el uso de INTANZA durante los ensayos clínicos y después de la comercialización de la vacuna, son:
Reacciones muy frecuentes (pueden afectar a más de 1 de cada 10 individuos)
- En el lugar de inyección: enrojecimiento, hinchazón, endurecimiento, picor y dolor.
- Malestar general, dolor de cabeza y dolor muscular.
Reacciones frecuentes (pueden afectar hasta 1 de cada 10 individuos)
- Manchas rojo-violáceas en la piel en el lugar de inyección.
- Escalofríos y fiebre (38°C ó más elevada).
Reacciones poco frecuentes (pueden afectar hasta 1 de cada 100 individuos)
- Cansancio, inflamación en las glándulas del cuello, axila ó ingle, hormigueo o adormecimiento, dolor en las articulaciones, picor y erupción cutánea.
Reacciones raras (pueden afectar hasta 1 de cada 1.000 individuos)
- Aumento de la sudoración.
Reacciones de frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
- Reacciones alérgicas incluyendo reacciones en la piel que se pueden extender a todo el cuerpo incluyendo urticaria, reacciones alérgicas graves (reacciones anafilácticas), hinchazón de la cara, lengua o faringe, dificultad para tragar, urticaria y dificultad para respirar (angioedema), fallo del sistema circulatorio llegando a situaciones de urgencia médica (shock).
La mayoría de los efectos adversos enumerados anteriormente desaparecieron sin tratamiento en 1 a 3 días después del inicio. En algunos casos, el enrojecimiento en el lugar de inyección se prolongó hasta 7 días.
Los siguientes efectos adversos han sido notificados con otras vacunas frente a la gripe. Estos efectos adversos pueden ocurrir con INTANZA:
• Disminución temporal en el número de ciertas células de la sangre denominadas plaquetas, lo que puede dar lugar a la formación excesiva de manchas rojo-violáceas en la piel o sangrado.
• Dolor en las terminaciones nerviosas, convulsiones asociadas con fiebre, trastornos del sistema nervioso incluyendo inflamación del cerebro o médula espinal, inflamación de los nervios, o síndrome de Guillain-Barré que causa debilidad extrema y parálisis.
• Inflamación de los vasos sanguíneos que pueden dar lugar, en muy raras ocasiones, a problemas transitorios de riñón.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede
comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V
proporcionar más
Mediante la comunicación de efectos adversos usted puede contribuir a información sobre la seguridad de este medicamento.
5. Conservación de INTANZA
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en el envase después de CAD o EXP. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de INTANZA
Los principios activos son virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-179A)............9 microgramos HA**
Cepa derivada de A/Texas/50/2012 (H3N2): (NYMC X-223A).......................9 microgramos HA**
B/Massachusetts/2/2012.........................................................................................9 microgramos HA**
Por dosis de 0,1 ml
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
Esta vacuna cumple con las recomendaciones de la Organización Mundial de la Salud (Hemisferio Norte) y la decisión de la Unión Europea para la campaña 2014/2015.
Los demás componentes son: cloruro de sodio, cloruro de potasio, fosfato de disodio dihidrato, fosfato dihidrógeno de potasio y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
La vacuna es una suspensión opalescente e incolora.
INTANZA se presenta en una jeringa precargada con un sistema de micro-inyección que contiene 0,1 ml de suspensión inyectable en envases de 1, 10 ó 20.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francia
Responsable de la fabricación:
Sanofi Pasteur - Parc Industriel d’Incarville- 27100 Val-de-Reuil- Francia
Sanofi Pasteur, Campus Mérieux - 1541, avenue Marcel Mérieux - 69280 Marcy l’Etoile - Francia
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien |
Lietuva |
|
Sanofi Pasteur MSD |
Sanofi - Aventis Lietuva, UAB |
|
Tél/Tel: +32 2 726.95.84 |
Tel.: +370 5 2730967 |
|
Etarapna Sanofi Pasteur S.A Tea.: +359 2 980 08 33 |
Luxembourg/Luxemburg Sanofi Pasteur MSD Tél: +32 2 726.95.84 |
|
Ceská republika Sanofi Pasteur divize vakcín sanofi-aventis, s.r.o. Tel: +420 233 086 111 |
Magyarország sanofi-aventis zrt Tel.: +36 1 505 0055 |
|
Danmark Sanofi Pasteur MSD Tlf: +45 23 32 69 29 |
Malta Cherubino Ltd Tel.: +356 21 343270 |
|
Deutschland Sanofi Pasteur MSD GmbH Tel: +49 6224 594-0 |
Nederland Sanofi Pasteur MSD Tel: +31.23.567.96.00 |
|
Eesti Sanofi-Aventis Estonia OÜ Tel.: +372 627 3488 |
Norge Sanofi Pasteur MSD Tlf: +47.67.50.50.20 |
|
EXXáSa BIANEH A.E. Tr(k: +30.210.8009111 |
Osterreich Sanofi Pasteur MSD GmbH Tel: +43.1.890 34 91 14 |
|
España Sanofi Pasteur MSD S.A. Tel: +34.91.371.78.00 |
Polska Sanofi Pasteur Sp. z o.o. Tel.: +48 22 280 05 00 |
|
France Sanofi Pasteur MSD SNC Tél: +33.4.37.28.40.00 |
Portugal Sanofi Pasteur MSD, SA Tel: +351 21 470 4550 |
|
Hrvatska sanofi-aventis Croatia d.o.o Tel: + 385 1 6003 400 |
Romania sanofi - aventis Romania SRL Tel.: +40(21) 317 31 36 |
|
Ireland Sanofi Pasteur MSD Ltd Tel: +353 1 468 5600 |
Slovenija ALPE s.p. Tel.: +386 (0)1 432 62 38 |
|
Ísland Sanofi Pasteur MSD Sími: +32.2.726.95.84 |
Slovenská republika sanofi-aventis Pharma Slovakia s.r.o. divízia vakcín Sanofi Pasteur Tel.: +421 2 33 100 100 |
|
Italia Sanofi Pasteur MSD Spa Tel: +39 06.664.09.211 |
Suomi/Finland Sanofi Pasteur MSD Puh/Tel: +358 9 565 88 30 |
|
Kúrcpog r. A. Zxapáxn? & £ia AxS. Tr(k.: +357 - 22 76 62 76 |
Sverige Sanofi Pasteur MSD Tel: +46.8.564.888.60 |
|
Latvija |
United Kingdom |
|
Sanofi Aventis Latvia SIA Vakcinu nodala |
Sanofi Pasteur MSD Ltd |
|
Tel.: +371 67114978 |
Tel: +44.1.628.785.291 |
Fecha de la última revisión de este prospecto: MM/AAAA Otras fuentes de información
La información detallada de esta vacuna está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
• Como con todas las vacunas inyectables, siempre se debe disponer del tratamiento y la supervisión médica apropiada en el caso de que ocurra un episodio anafiláctico tras la administración de la vacuna.
• Antes de la administración, se dejará que la vacuna alcance la temperatura ambiente.
• La vacuna no debe ser utilizada si presenta partículas extrañas en la suspensión
• No es necesario agitar la vacuna antes de usarla.
• El sistema de micro-inyección para inyecciones intradérmicas consiste en una jeringa precargada con una micro-aguja (1,5 mm) y un sistema protector de aguja.
El sistema protector de la aguja está diseñado para cubrir la micro-aguja tras su utilización.
Sistema de micro-inyección
INSTRUCCIONES DE USO
Por favor lea las instrucciones antes de su uso
1/ RETIRAR EL TAPÓN 2/ SUJETAR EL SISTEMA DE MICRO-
INYECCIÓN ENTRE EL PULGAR Y EL DEDO CORAZÓN
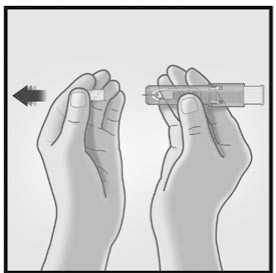
Retirar el tapón de la aguja del sistema de micro-inyección.
No purgar el aire a través de la aguja.
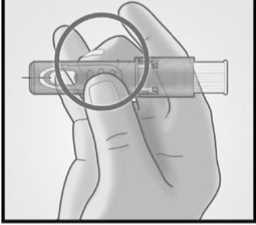
Sujetar el sistema colocando solamente los dedos pulgar y corazón sobre la zona de sujeción; el dedo índice no se apoya.
No colocar los dedos sobre la ventana.
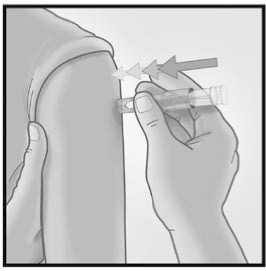
Una vez que la microaguja se ha introducido, mantener una leve presión en la superficie de la piel e inyectar usando el dedo índice para presionar sobre el émbolo. No es necesario aspirar antes de administrar la vacuna.
3/ INTRODUCIR LA AGUJA RAPIDAMENTE PERPENDICULAR A LA PIEL
Introducir la aguja
perpendicular a la piel, en la zona del deltoides, en un movimiento corto y rápido.
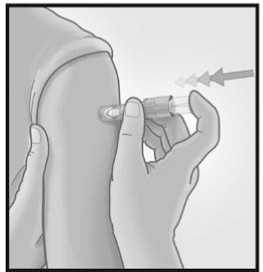
5/ ACTIVAR EL PROTECTOR DE LA AGUJA PRESIONANDO CON FIRMEZA SOBRE EL ÉMBOLO
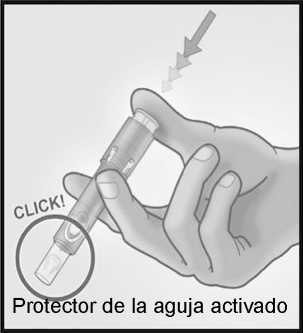
Retirar la aguja de la piel.
Mantenga la aguja alejada de usted y de las personas a su alrededor.
Con la misma mano, presione con firmeza con el pulgar sobre el émbolo para activar el protector de la aguja.
Oirá un clic y un protector aparecerá para cubrir la aguja.
Eliminar inmediatamente el sistema en el contenedor dispuesto a tal efecto.
Se considera una inyección correcta tanto si aparece como si no aparece pápula.
En caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario re-vacunar.
Ver también sección 3 “Cómo usar INTANZA”
INTANZA 15 microgramos/cepa suspensión inyectable
Vacuna antigripal (virus fraccionados, inactivados)
Lea todo el prospecto detenidamente antes de que usted sea vacunado porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Esta vacuna se le ha recetado solamente a usted y no debe dársela a otras personas.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es INTANZA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar INTANZA
3. Cómo usar INTANZA
4. Posibles efectos adversos
5. Conservación de INTANZA
6. Contenido del envase e información adicional
1. Qué es INTANZA y para qué se utiliza
INTANZA es una vacuna. Esta vacuna está indicada para protegerle a usted frente a la gripe. Esta vacuna se administra a adultos de 60 años ó mayores, especialmente en las personas que tienen un mayor riesgo de complicaciones asociadas.
Cuando se inyecta INTANZA, el sistema inmune (las defensas naturales del cuerpo) producirá protección frente a la infección por gripe.
INTANZA le ayudará a protegerse frente a la gripe si está causada por una de las tres cepas de virus de la gripe contenidas en la vacuna, u otras cepas estrechamente relacionadas con ellas. La eficacia completa de la vacuna generalmente se alcanza 2 ó 3 semanas después de la vacunación.
2. Qué necesita saber antes de empezar a usar INTANZA
No use INTANZA:
- si usted es alérgico a:
• Los principios activos,
• A cualquiera de los demás componentes de esta vacuna (incluidos en la sección 6),
• A cualquiera de los componentes que pueden estar presentes en cantidades mínimas, como huevos (ovoalbúmina, proteínas de pollo), neomicina, formaldehído o al octoxinol 9.
- si usted padece una enfermedad que se acompañe de fiebre o una infección aguda, la vacunación debe posponerse hasta que se haya recuperado.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar INTANZA.
- Consulte a su médico antes de vacunarse si usted tiene una respuesta inmunológica debilitada (inmunodeprimidos) debido a una enfermedad o medicamentos ya que la vacuna podría no funcionar bien en este caso.
- Esta vacuna no debe ser administrada en una vena (por vía intravenosa) bajo ninguna circunstancia.
- Si, por alguna razón, se le practica un análisis de sangre a los pocos días de la vacunación frente a la gripe, por favor informe a su médico. Se pueden ver afectados los análisis para HIV-1, virus de la hepatitis C y HTLV-1.
Niños y adolescentes
No se recomienda el uso de INTANZA en niños y adolescentes menores de 18 años.
Uso de INTANZA con otras vacunas o medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que
utilizar cualquier otro medicamento.
- Otras vacunas: INTANZA puede administrarse al mismo tiempo que otras vacunas, en diferentes extremidades. Se debe tener en cuenta que los efectos adversos pueden intensificarse.
- Informe a su médico si ha utilizado medicamentos que pueden reducir la respuesta inmunológica: tales como los corticoesteroides (p.e. cortisona), los medicamentos frente al cáncer (quimioterapia), radioterapia u otros medicamentos que afectan al sistema inmunitario. En este caso, la vacuna podría no funcionar correctamente.
Embarazo, lactancia y fertilidad
Esta información no es aplicable ya que esta vacuna se administra en adultos de 60 años ó mayores.
Conducción y uso de máquinas
Esta vacuna no tiene ó tiene una influencia insignificante sobre la capacidad de conducir y utilizar
máquinas.
3. Cómo usar INTANZA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es 0,1 ml para adultos de 60 años o mayores.
INTANZA se administrará por su médico o enfermero.
INTANZA se administrará con una inyección en la capa superficial de la piel (preferentemente sobre el músculo de la parte superior del brazo).
Si tiene cualquier duda sobre el uso de este producto, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Debe acudir a su médico inmediatamente si experimenta síntomas de angioedema, tales como:
• Hinchazón de cara, garganta o faringe
• Dificultad para tragar
• Urticaria y dificultad para respirar
Los efectos adversos más frecuentes que se han observado con el uso de INTANZA durante los ensayos clínicos y después de la comercialización de la vacuna, son:
Reacciones muy frecuentes (pueden afectar a más de 1 de cada 10 individuos)
- En el lugar de inyección: enrojecimiento, endurecimiento, hinchazón, picor y dolor.
- Dolor de cabeza y dolor muscular.
Reacciones frecuentes (pueden afectar hasta 1 de cada 10 individuos)
- Manchas rojo-violáceas en la piel en el lugar de inyección.
- Malestar, fiebre (38°C ó más elevada) y escalofríos.
Reacciones poco frecuentes (pueden afectar hasta 1 de cada 100 individuos)
- Cansancio, dolor en las articulaciones e incremento de la sudoración.
Reacciones raras (pueden afectar hasta 1 de cada 1.000 individuos)
- Sensación de hormigueo o entumecimiento, inflamación de los nervios, picor y erupción.
Reacciones de frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
- Reacciones alérgicas incluyendo reacciones en la piel que se pueden extender a todo el cuerpo incluyendo urticaria, reacciones alérgicas graves (reacciones anafilácticas), hinchazón de la cara, lengua o faringe, dificultad para tragar, urticaria y dificultad para respirar (angioedema), fallo del sistema circulatorio llegando a situaciones de urgencia médica (shock).
La mayoría de los efectos adversos enumerados anteriormente desaparecieron sin tratamiento en 1 a 3 días después del inicio. En algunos casos, el enrojecimiento en el lugar de inyección se prolongó hasta 7 días.
Los siguientes efectos adversos han sido notificados con otras vacunas frente a la gripe. Estos efectos adversos pueden ocurrir con INTANZA:
• Disminución temporal en el número de ciertas células de la sangre denominadas plaquetas, lo que puede dar lugar a la formación excesiva de manchas rojo-violáceas en la piel o sangrado, inflamación temporal de las glándulas del cuello, axila e ingle.
• Dolor en las terminaciones nerviosas, convulsiones asociadas con fiebre, trastornos del sistema nervioso incluyendo inflamación del cerebro o médula espinal o síndrome de Guillain-Barré que causa debilidad extrema y parálisis.
• Inflamación de los vasos sanguíneos que pueden dar lugar, en muy raras ocasiones, a problemas transitorios de riñón.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de INTANZA
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en el envase después de CAD o EXP. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
Composición de INTANZA
Los principios activos son virus de la gripe (fraccionados, inactivados) de las siguientes cepas*:
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-179A)..........15 microgramos HA**
Cepa derivada de A/Texas/50/2012 (H3N2): (NYMC X-223A)....................15 microgramos HA**
B/Massachusetts/2/2012........................................................................................15 microgramos HA**
Por dosis de 0,1 ml
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
Esta vacuna cumple con las recomendaciones de la Organización Mundial de la Salud (Hemisferio Norte) y la decisión de la Unión Europea para la campaña 2014/2015.
Los demás componentes son: cloruro de sodio, cloruro de potasio, fosfato de disodio dihidrato, fosfato dihidrógeno de potasio y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
La vacuna es una suspensión opalescente e incolora.
INTANZA se presenta en una jeringa precargada con un sistema de micro-inyección que contiene 0,1 ml de suspensión inyectable en envases de 1, 10 ó 20.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francia
Responsable de la fabricación:
Sanofi Pasteur - Parc Industriel d’Incarville- 27100 Val-de-Reuil- Francia
Sanofi Pasteur, Campus Mérieux - 1541, avenue Marcel Mérieux - 69280 Marcy l’Etoile - Francia
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Sanofi Pasteur MSD Tél/Tel: +32 2 726.95.84 |
Lietuva Sanofi - Aventis Lietuva, UAB Tel.: +370 5 2730967 |
|
Etarapna Sanofi Pasteur S.A. Tea.: +359 2 980 08 33 |
Luxembourg/Luxemburg Sanofi Pasteur MSD Tél: +32 2 726.95.84 |
|
Ceská republika Sanofi Pasteur divize vakcín sanofi-aventis, s.r.o. Tel: +420 233 086 111 |
Magyarország sanofi-aventis zrt Tel.: +36 1 505 0055 |
|
Danmark Sanofi Pasteur MSD Tlf: +45 23 32 69 29 |
Malta Cherubino Ltd Tel.: +356 21 343270 |
|
Deutschland Sanofi Pasteur MSD GmbH Tel: +49 6224 594-0 |
Nederland Sanofi Pasteur MSD Tel: +31.23.567.96.00 |
|
Eesti Sanofi-Aventis Estonia OÜ Tel.: +372 627 3488 |
Norge Sanofi Pasteur MSD Tlf: +47.67.50.50.20 |
|
EkXáda BIANEH A.E. Tr|^: +30.210.8009111 |
Osterreich Sanofi Pasteur MSD GmbH Tel: +43.1.890 34 91 14 |
|
España Sanofi Pasteur MSD S.A. Tel: +34.91.371.78.00 |
Polska Sanofi Pasteur Sp. z o.o. Tel.: +48 22 280 05 00 |
|
France Sanofi Pasteur MSD SNC Tél: +33.4.37.28.40.00 |
Portugal Sanofi Pasteur MSD, SA Tel: +351 21 470 4550 |
|
Hrvatska sanofi-aventis Croatia d.o.o Tel: + 385 1 6003 400 |
Romania sanofi - aventis Romania SRL Tel.: +40(21) 317 31 36 |
|
Ireland Sanofi Pasteur MSD Ltd Tel: +353 1 468 5600 |
Slovenija ALPE s.p. Tel.: +386 (0)1 432 62 38 |
|
Ísland Sanofi Pasteur MSD Sími: +32.2.726.95.84 |
Slovenská republika sanofi-aventis Pharma Slovakia s.r.o. divízia vakcín Sanofi Pasteur Tel.: +421 2 33 100 100 |
|
Italia Sanofi Pasteur MSD Spa Tel: +39 06.664.09.211 |
Suomi/Finland Sanofi Pasteur MSD Puh/Tel: +358 9 565 88 30 |
|
Kúrcpog r. A. Zxapáxn? & £ia AxS. Tr|T,: +357 - 22 76 62 76 |
Sverige Sanofi Pasteur MSD Tel: +46.8.564.888.60 |
|
Latvija Sanofi Aventis Latvia SIA Vakcinu nodala Tel.: +371 67114978 |
United Kingdom Sanofi Pasteur MSD Ltd Tel: +44.1.628.785.291 |
Fecha de la última revisión de este prospecto: MM/AAAA Otras fuentes de información
La información detallada de esta vacuna está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
• Como con todas las vacunas inyectables, siempre se debe disponer del tratamiento y la supervisión médica apropiada en el caso de que ocurra un episodio anafiláctico tras la administración de la vacuna.
• Antes de la administración, se dejará que la vacuna alcance la temperatura ambiente.
• La vacuna no debe ser utilizada si presenta partículas extrañas en la suspensión.
• No es necesario agitar la vacuna antes de usarla.
• El sistema de micro-inyección para inyecciones intradérmicas consiste en una jeringa precargada con una micro-aguja (1,5 mm) y un sistema protector de aguja.
El sistema protector de la aguja está diseñado para cubrir la micro-aguja tras su utilización.
Sistema de micro-inyección
INSTRUCCIONES DE USO
Por favor lea las instrucciones antes de su uso
1/ RETIRAR EL TAPÓN 2/ SUJETAR EL SISTEMA DE MICRO-
INYECCIÓN ENTRE EL PULGAR Y EL DEDO CORAZÓN
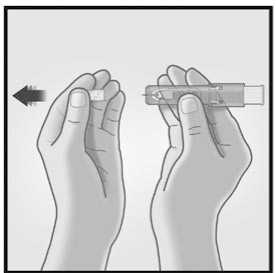
Retirar el tapón de la aguja del sistema de micro-inyección.
No purgar el aire a través de la aguja.
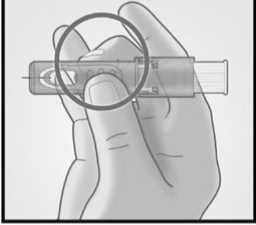
Sujetar el sistema colocando solamente los dedos pulgar y corazón sobre la zona de sujeción; el dedo índice no se apoya.
No colocar los dedos sobre la ventana.
Una vez que la microaguja se ha introducido, mantener una leve presión en la superficie de la piel e inyectar usando el dedo índice para presionar sobre el émbolo. No es necesario aspirar antes de administrar la vacuna.
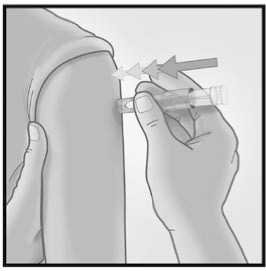
3/ INTRODUCIR LA AGUJA RAPIDAMENTE PERPENDICULAR A LA PIEL
Introducir la aguja
perpendicular a la piel, en la zona del deltoides, en un movimiento corto y rápido.
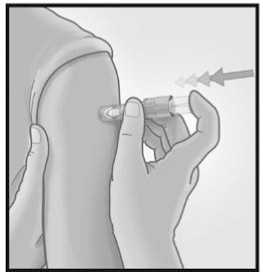
5/ ACTIVAR EL PROTECTOR DE LA AGUJA PRESIONANDO CON FIRMEZA SOBRE EL ÉMBOLO
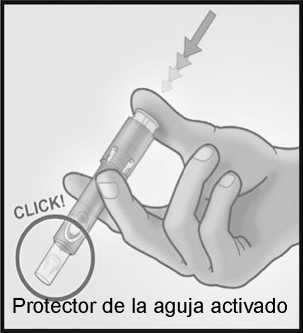
Retirar la aguja de la piel.
Mantenga la aguja alejada de usted y de las personas a su alrededor.
Con la misma mano, presione con firmeza con el pulgar sobre el émbolo para activar el protector de la aguja.
Oirá un clic y un protector aparecerá para cubrir la aguja.
Eliminar inmediatamente el sistema en el contenedor dispuesto a tal efecto.
Se considera una inyección correcta tanto si aparece como si no aparece pápula.
En caso de presencia de líquido en el lugar de inyección después de la administración de la vacuna, no es necesario re-vacunar.
Ver también sección 3 “Cómo usar INTANZA”
45