Increlex 10 Mg/Ml, Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
INCRELEX 10 mg/ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada mililitro contiene 10 mg de mecasermina*.
Cada vial contiene 40 mg de mecasermina.
*La mecasermina es un factor de crecimiento insulínico tipo 1 (IGF-1) humano producido en células de Escherichia coli por tecnología ADN recombinante.
Excipiente con efecto conocido:
Un mililitro contiene 9 mg de alcohol bencílico.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyección). Solución acuosa, transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de larga duración de trastornos del crecimiento en niños y adolescentes (de 2 a 18 años) con un déficit primario grave del factor de crecimiento insulínico tipo 1 (déficit primario de IGF).
El déficit primario de IGF grave viene definido por las siguientes características:
• Puntuación de Desviación Estándar (SDS) para la talla < -3,0
• Niveles basales de IGF-1 por debajo del percentil 2,5 para la edad y el sexo correspondientes
• Niveles suficientes de hormona del crecimiento (GH)
• Exclusión de formas secundarias de déficit de IGF-1 como la malnutrición, el hipotiroidismo o el tratamiento crónico a dosis farmacológicas de esteroides antiinflamatorios.
En el déficit primario de IGF-1 grave se incluyen pacientes que presentan mutaciones en el receptor de la GH (GHR), en la vía de señalización activada por el GHR, y con anomalías en el gen del IGF-1. Como estos pacientes no presentan insuficiencia de GH, no es de esperar que respondan adecuadamente al tratamiento con GH exógena. Se recomienda confirmar el diagnóstico con un test de generación de IGF-1.
4.2 Posología y forma de administración
El tratamiento con INCRELEX debe ser supervisado por un médico que tenga experiencia en el diagnóstico y tratamiento de pacientes con trastornos del crecimiento.
Posología
La dosis debe determinarse de manera individual para cada paciente. La dosis inicial recomendada de mecasermina es de 0,04 mg/kg de peso corporal dos veces al día inyectada por vía subcutánea. Si no se produce ninguna reacción adversa importante durante al menos una semana, se puede aumentar la dosis en incrementos de 0,04 mg/kg hasta un máximo de 0,12 mg/kg dos veces al día. Aún no han sido evaluadas dosis superiores a 0,12 mg/kg dos veces al día en niños con un déficit primario de IGF-1 grave.
Se puede administrar una dosis inferior si la dosis recomendada no es bien tolerada por el paciente. El éxito del tratamiento debe ser valorado en base a la velocidad de crecimiento. La dosis mínima con la cual se consigue individualmente un incremento significativo de la altura es de 0,04 mg/kg dos veces al día.
Población pediátrica
No se ha establecido la seguridad y eficacia de INCRELEX en niños de menos de 2 años. No se dispone de datos.
Por tanto, INCRELEX no está recomendado en niños menores de 2 años.
Forma de administración
INCRELEX debe administrarse por inyección subcutánea un poco antes o después de una comida o tentempié. Si aún con una ingesta de comida adecuada se produce hipoglucemia a las dosis recomendadas, es necesario reducir la dosis. Si por cualquier motivo el paciente no pudiera comer, conviene aplazar la administración de INCRELEX. Nunca debe aumentarse la dosis de mecasermina para compensar una o más dosis omitidas.
Es conveniente ir rotando los lugares de inyección de una administración a otra.
INCRELEX no debe administrarse por vía intravenosa.
Precauciones que deben tomarse antes de manipular o administrar este medicamento
La solución debe ser transparente inmediatamente después de sacarla de la nevera. Si la solución está
turbia, o contiene partículas, no debe inyectarse (ver sección 6.6).
INCRELEX debe administrarse usando agujas y jeringas estériles desechables. Se recomienda utilizar jeringas de pequeño volumen que permitan extraer del vial la dosis prescrita con una exactitud razonable.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Neoplasia activa o sospecha de la misma. El tratamiento debe suspenderse si aparece algún indicio de neoplasia.
Dado que INCRELEX contiene alcohol bencílico, no debe administrarse a neonatos o recién nacidos prematuros.
4.4 Advertencias y precauciones especiales de empleo
Antes de iniciar el tratamiento con INCRELEX es necesario corregir cualquier carencia nutricional o insuficiencia tiroidea.
INCRELEX no es un sustituto del tratamiento con GH.
INCRELEX no debe emplearse para estimular el crecimiento de pacientes con epífisis ya cerradas.
INCRELEX debe administrarse un poco antes o después de una comida o tentempié, ya que puede tener efectos hipoglucémicos similares a los de la insulina. Debe prestarse especial atención a niños pequeños, niños con antecedentes de hipoglucemia y niños con problemas para comer. Los pacientes deben evitar cualquier actividad de alto riesgo en las 2-3 horas siguientes a la administración de la dosis, especialmente al principio del tratamiento con INCRELEX y hasta que se haya conseguido establecer una dosis bien tolerada de INCRELEX. Si una persona con hipoglucemia grave está inconsciente o no puede ingerir alimentos normalmente, puede necesitar una inyección de glucagón. Las personas con antecedentes de hipoglucemia grave deben tener siempre glucagón a mano. Al prescribirse por primera vez, el médico debe explicar a los padres cuáles son los signos, síntomas y tratamiento de la hipoglucemia, incluidas las inyecciones de glucagón.
En el caso de pacientes diabéticos, al usar INCRELEX puede ser necesario reducir las dosis de insulina u otros medicamentos hipoglucemiantes.
Antes de empezar el tratamiento con INCRELEX se recomienda realizar un ecocardiograma a todos los pacientes. También es conveniente hacer un ecocardiograma cuando el paciente termine el tratamiento. Si se observan anomalías en el ecocardiograma o el paciente presenta síntomas cardiovasculares, conviene realizar un seguimiento ecocardiográfico.
Con el uso de INCRELEX se han notificado casos de hipertrofia del tejido linfático (p. ej., amigdalar) asociada con complicaciones tales como ronquidos, apnea del sueño y derrames crónicos del oído medio. Deben llevarse a cabo exploraciones de manera periódica así como cuando aparezcan síntomas clínicos para descartar posibles complicaciones o para iniciar un tratamiento adecuado.
Al igual que ocurre con la administración terapéutica de GH, en pacientes tratados con INCRELEX se han notificado casos de hipertensión intracraneal (HI) con papiledema, cambios visuales, cefalea, náuseas y/o vómitos. Los signos y síntomas asociados con la hipertensión intracraneal remitieron tras la interrupción del tratamiento. Conviene hacer una funduscopia al comenzar el tratamiento con INCRELEX, así como periódicamente durante el transcurso del mismo y cuando aparezcan síntomas clínicos.
En pacientes que experimentan un crecimiento rápido puede producirse epifisiólisis de la cabeza femoral (con la posibilidad de derivar en necrosis avascular) y/o progresión de la escoliosis. Durante el tratamiento con INCRELEX conviene tener en cuenta estas patologías, así como otros síntomas y signos que se sabe que están asociados al tratamiento con GH en general. Debe valorarse a cualquier paciente que comience a cojear o se queje de dolor en la cadera o en la rodilla.
Durante la experiencia post-comercialización, se han notificado casos de hipersensibilidad, urticaria, prurito y eritema en pacientes tratados con INCRELEX. Estos casos han sido tanto sistémicos como locales en el lugar de inyección. Se ha notificado un pequeño número de casos indicativos de anafilaxis que requirieron hospitalización. Debe informarse a los padres y a los pacientes de la posibilidad de que dichas reacciones aparezcan, y de que si se produce una reacción alérgica sistémica deben suspender el tratamiento y acudir rápidamente al médico.
Debe reconsiderarse el tratamiento si después de un año los pacientes continúan sin responder al mismo.
Las personas con reacciones alérgicas al IGF-1 inyectado, que presenten niveles elevados de IGF-1 en sangre después de la inyección o no respondan al tratamiento, pueden estar produciendo anticuerpos contra el IGF-1 inyectado. En tales casos deben seguirse las instrucciones para la determinación de anticuerpos.
Excipientes
INCRELEX contiene 9 mg/ml de alcohol bencílico como conservante.
El alcohol bencílico puede provocar reacciones tóxicas y anafilactoides en lactantes y en niños de hasta 3 años de edad.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial, lo que se considera esencialmente exento de sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Puede ser necesario reducir la dosis de insulina y de otros medicamentos hipoglucemiantes (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil / Contracepción en hombres y mujeres
Antes del tratamiento con INCRELEX, se recomienda a todas las mujeres en edad fértil disponer de una prueba de embarazo con resultados negativos. También se recomienda que todas las mujeres en edad fértil usen métodos de anticoncepción adecuados.
Embarazo
No existen datos suficientes o son limitados, sobre la utilización de mecasermina en mujeres embarazadas.
Los estudios en animales son insuficientes con respecto a la toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos.
INCRELEX no debería utilizarse durante el embarazo excepto si fuese claramente necesario.
Lactancia
No es aconsejable la lactancia materna si se está recibiendo INCRELEX.
Fertilidad
INCRELEX se ha analizado en un estudio teratológico en ratas sin efectos en el feto con dosis de hasta 16 mg/kg (20 veces la DHMR basado en el área de superficie corporal) y en un estudio de teratología en conejos sin efectos en el feto a dosis de 0,5 mg/kg (2 veces la DHMR en base al área de superficie corporal). INCRELEX no presenta efectos en la fertilidad en ratas utilizando dosis intravenosas de 0,25, 1 y 4 mg/día (hasta 4 veces la exposición clínica con la DHMR basada en el AUC).
Los efectos de INCRELEX en los niños no natos no han sido estudiados. Por tanto la información médica es insuficiente para determinar si hay riesgos significativos para un feto. No se han realizado estudios con INCRELEX en madres en lactancia. INCRELEX no debe administrarse en mujeres embarazadas o en periodo de lactancia. En todas las mujeres premenopáusicas que reciban INCRELEX es necesario un ensayo de embarazo negativo y una adecuada contracepción.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La hipoglucemia es una reacción adversa muy frecuente. En caso de un episodio de hipoglicemia INCRELEX puede tener una influencia importante en la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Los datos de reacciones adversas se han extraído de un total de 413 pacientes de ensayos clínicos con IGFD primario grave. Los datos también se recogieron a partir de la vigilancia post-comercialización.
Las reacciones adversas notificadas más frecuentemente de los ensayos clínicos fueron cefalea (44%), hipoglucemia (28%), vómitos (26%), hipertrofia en el lugar de la inyección (17%), y otitis media (17%).
La hipertensión intracraneal/aumento de la presión intracraneal se produjo en 4 (0,96%) de los pacientes de los ensayos clínicos y aparecía en sujetos de 7-9 años no tratados previamente.
Durante los ensayos clínicos en otras indicaciones en un total de aproximadamente 300 pacientes, en un 8% de pacientes se recibieron notificaciones de hipersensibilidad sistémica y/o local. También hubo notificaciones de hipersensibilidad sistémica del uso post-comercialización, de los que algunos casos fueron indicativos de anafilaxis. También se recibieron notificaciones post-comercialización de reacciones alérgicas locales.
Algunos pacientes pueden desarrollar anticuerpos frente a INCRELEX. No se observó ninguna atenuación del crecimiento como consecuencia del desarrollo de anticuerpos.
Lista tabulada de reacciones adversas
En la tabla 1 figuran las reacciones adversas muy frecuentes (> 1/10), frecuentes (> 1/100 y < 1/10) y poco frecuentes (>1/1000, <1/100) notificadas durante los ensayos clínicos. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Durante la utilización postautorización de INCRELEX se han identificado otras reacciones adversas. Debido a que estas reacciones adversas se notifican voluntariamente a partir de una población de tamaño incierto, no es posible estimar de forma fiable su frecuencia.
Tabla 1: Reacciones adversas
|
Clasificación por órganos y sistemas |
Reacciones observadas en los ensayos clínicos |
Reacciones observadas en la postcomercialización |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes: Hipertrofia del timo | |
|
Trastornos del sistema inmune |
No conocida: hipersensibilidad sistémica (anafilaxis, urticaria generalizada, angioedema, disnea). Reacciones alérgicas locales en el lugar de la inyección (prurito, urticaria) | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes: Hipoglucemia Frecuentes: Crisis hipoglucémica hiperglucemia | |
|
Trastornos psiquiátricos |
Poco frecuentes: Depresión, nerviosismo | |
|
Trastornos del sistema nervioso |
Muy frecuentes: Cefalea Frecuentes: Convulsiones, mareo, temblor Poco frecuentes: hipertensión intracraneal benigna | |
|
Trastornos oculares |
Frecuentes: Papiledema | |
|
Trastornos del oído y del laberinto |
Muy frecuentes: otitis media Frecuentes: Hipoacusia, otalgia, presencia de líquido en el oído medio | |
|
Trastornos cardiacos |
Frecuentes: Murmullo cardiaco, taquicardia Poco frecuentes: cardiomegalia, hipertrofia ventricular, insuficiencia mitral, insuficiencia tricuspídea | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes: Síndrome de apnea del sueño, hipertrofia adenoidea, hipertrofia amigdalar, ronquidos | |
|
Trastornos gastrointestinales |
Muy frecuentes: Vómitos, dolor abdominal superior Frecuentes: dolor abdominal | |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes: Hipertrofia cutánea, textura capilar anormal |
No conocida: alopecia |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Muy frecuentes: artralgia, dolor en extremidades Frecuentes: escoliosis, mialgia |
|
Clasificación por órganos y sistemas |
Reacciones observadas en los ensayos clínicos |
Reacciones observadas en la postcomercialización |
|
Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) |
Frecuentes: nevus melanocítico | |
|
Trastornos del aparato reproductor y de la mama |
Frecuentes: Ginecomastia | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes: Hipertrofia del lugar de inyección, hematoma en el lugar de la inyección Frecuentes: dolor en el lugar de la inyección, reacción en el lugar de la inyección, hematoma en el lugar de la inyección, eritema en lugar de la inyección, induración en el lugar de la inyección, hemorragia en el lugar de la inyección, irritación en el lugar de la inyección Poco frecuentes: erupción en el lugar de la inyección, hinchazón en el lugar de la inyección, lipohipertrofia | |
|
Exploraciones complementarias |
Poco frecuentes: aumento de peso | |
|
Procedimientos médicos y quirúrgicos |
Frecuentes: Inserción de tubo de timpanostomía |
Descripción de reacciones adversas seleccionadas Hipersensibilidad local/sistémica
Ensayo clínico: Durante los ensayos clínicos en otras indicaciones (en total aproximadamente 300 pacientes) el 8% de los pacientes notificaron reacciones de hipersensibilidad sistémica y/o local. Todos los casos fueron de gravedad leve o moderada y ninguno fue grave.
Notificaciones post-comercialización: la hipersensibilidad sistémica incluyó síntomas como anafilaxis, urticaria generalizada, angioedema y disnea. Los síntomas indicativos de anafilaxis incluyeron urticaria, angioedema y disnea. Algunos pacientes requirieron hospitalización. Tras la readministración, los síntomas no vuelven a reproducirse en todos los pacientes. También hubo notificaciones de reacciones alérgicas locales en el lugar de la inyección. Típicamente fueron prurito y urticaria.
Hipoglucemia
De los 115 (28%) sujetos con uno o más episodios de hipoglucemia, hubo 6 pacientes que sufrieron una crisis hipoglucémica en una o más ocasiones. Generalmente, los síntomas de hipoglucemia se evitaban tomando una comida o tentempié un poco antes o después de la administración de INCRELEX.
Hipertrofia en el lugar de la inyección
Esta reacción se produjo en 71 (17%) de los sujetos de los ensayos clínicos y generalmente se asoció con la incorrecta rotación de las inyecciones. El problema se resolvía rotando adecuadamente el lugar de inyección.
Hipertrofia amigdalar
Esto se detectó en 38 (9%) de los sujetos, especialmente en los primeros 1 a 2 años de terapia, con un menor crecimiento amigdalar en los años siguientes.
Ronquidos
Aparecieron normalmente durante el primer año de tratamiento, y se notificaron en 30 sujetos (7%). Hipertensión intracraneal/aumento de la presión intracraneal
Se produjo en 4 sujetos (0,96%); en dos sujetos INCRELEX se suspendió y no se reanudó posteriormente; en dos sujetos el evento no recurrió tras reiniciar INCRELEX a una dosis reducida. Los 4 sujetos se recuperaron del evento sin secuelas.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Una sobredosis aguda podría provocar hipoglucemia. Una sobredosis prolongada podría provocar signos y síntomas de acromegalia o gigantismo.
El tratamiento de la sobredosis aguda de mecasermina debe concentrarse en aliviar los efectos hipoglucémicos. Debe ingerirse comida o glucosa por vía oral. Si la sobredosis provoca pérdida del conocimiento, puede ser necesario administrar glucosa por vía intravenosa o glucagón por vía parenteral para contrarrestar los efectos hipoglucémicos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Hormonas hipotalámicas y de la hipófisis y sus análogos.
Somatropina y agonistas de la somatropina, código ATC: H01AC03
La mecasermina es un factor de crecimiento insulínico tipo 1 humano (rhIGF-1) producido por tecnología ADN recombinante. El IGF-1 consta de una única cadena de 70 aminoácidos con tres puentes disulfuro intramoleculares y con una masa molecular de 7649 Da. La secuencia aminoacídica del producto es idéntica a la del IGF-1 humano endógeno. La proteína rhIGF-1 se sintetiza en bacterias (E. coli) que han sido modificadas mediante la introducción del gen del IGF-1 humano.
Mecanismo de acción
El factor de crecimiento insulínico tipo 1 (IGF-1) es el principal mediador hormonal del crecimiento en estatura. En condiciones normales, la hormona del crecimiento (GH) se une a su receptor en el hígado y otros tejidos, estimulando la síntesis y secreción de IGF-1. En los tejidos diana, el IGF-1 activa el receptor de IGF-1 de tipo 1, un receptor homólogo del receptor de insulina, disparando una cascada de señalización intracelular que estimula múltiples procesos con el consiguiente crecimiento en estatura. Los efectos metabólicos del IGF-1 están dirigidos en parte a estimular la captación de glucosa, ácidos grasos y aminoácidos, con lo que el metabolismo puede sustentar el crecimiento tisular.
Efectos farmacodinámicos
Se ha demostrado que el IGF-1 humano endógeno tiene los siguientes efectos:
Crecimiento tisular
El crecimiento esquelético tiene lugar en las placas epifisarias de los extremos de los huesos en crecimiento. La GH y el IGF-1 estimulan directamente el crecimiento y el metabolismo de las células de la placa epifisaria.
Crecimiento de órganos: el tratamiento con rhIGF-1 de ratas con un déficit de IGF-1 provoca un crecimiento de los órganos y de todo el cuerpo.
Crecimiento celular: los receptores de IGF-1 están presentes en casi todos los tipos de células y tejidos. El IGF-1 tiene actividad mitógena, produciendo un aumento del número de células del organismo.
Metabolismo de los hidratos de carbono
El IGF-1 suprime la producción hepática de glucosa, estimula la utilización de glucosa periférica y puede disminuir la concentración de glucosa en sangre y provocar hipoglucemia.
El IGF-1 inhibe la secreción de insulina.
Metabolismo óseo y mineral
El IGF-1 circulante tiene un papel importante en la adquisición y mantenimiento de la masa ósea. El IGF-1 aumenta la densidad ósea.
Eficacia clínica y seguridad
Se han llevado a cabo cinco ensayos clínicos (4 abiertos y 1 doble ciego, controlados con placebo) con INCRELEX. Se administraron dosis subcutáneas de mecasermina, normalmente entre 60 y 120 microgramos/kg dos veces al día, a 92 pacientes pediátricos con déficit primario de IGF-1 grave. Los criterios de inclusión en los estudios fueron: una estatura extremadamente baja, baja tasa de crecimiento, bajas concentraciones plasmáticas de IGF-1 y una secreción normal de GH. Ochenta y tres (83) de 92 pacientes no habían recibido antes tratamiento con INCRELEX y 81 completaron al menos un año de tratamiento con INCRELEX. Antes de iniciarse el tratamiento, las características de los 81 pacientes evaluados en los análisis de la eficacia primaria y secundaria para todos los estudios combinados eran las siguientes (media ± desviación estándar (SD)): edad cronológica (años): 6,8 ±
3,8; altura (cm): 84,1 ±15,8; Puntuación de Desviación Estándar (SDS) (SDS, del inglés “Standard deviation score”) de la talla: -6,9 ± 1,8; velocidad de crecimiento en estatura (cm/año): 2,6 ± 1,7; SDS de la velocidad de crecimiento en estatura: -3,4 ± 1,6; IGF-1 (ng/ml): 24,5 ± 27,9; SDS del IGF-1:
-4,2 ± 2,0; y edad ósea (años): 3,8 ± 2,8. De estos, 72 (89%) tenían un fenotipo similar al del síndrome de Laron; 7 (9%) tenían supresión del gen de la GH, 1 (1%) tenía anticuerpos neutralizantes frente a GH y 1 (1%) presentaba deficiencia de GH genética aislada. Cuarenta y seis (57%) de los pacientes eran varones; 66 (81%) eran de raza blanca. Setenta y cuatro (91%) de los pacientes estaban en la prepubertad al inicio del tratamiento.
En la tabla 2 se recogen los resultados anuales de la velocidad de crecimiento en estatura, el SDS de la velocidad de crecimiento en estatura y el SDS de la talla hasta los 8 años. Setenta y cinco pacientes disponían de datos de velocidad de crecimiento en estatura antes del tratamiento. Las velocidades de crecimiento en estatura para un determinado año de tratamiento se compararon, mediante una prueba de la t de Student para datos apareados, con las velocidades correspondientes antes del tratamiento de los mismos pacientes al completar ese año de tratamiento. Las velocidades de crecimiento de los años 2 a 8 fueron estadísticamente superiores al valor basal. Para los 21 sujetos sin tratamiento previo con talla cercana a la adulta, la media (±DE) de la diferencia entre el aumento de talla observado respecto al esperado por Laron fue de aproximadamente 13 cm (±8 cm) tras un promedio de 11 años de tratamiento.
Tabla 2: Resultados de talla anuales en función del número de años de tratamiento con INCRELEX
|
Pre-tto |
Año 1 |
Año 2 |
Año 3 |
Año 4 |
Año 5 |
Año 6 |
Año 7 |
Año 8 | |
|
Velocidad de crecimiento en | |||||||||
|
estatura (cm/año): | |||||||||
|
N |
75 |
75 |
63 |
62 |
60 |
53 |
39 |
25 |
19 |
|
Media (SD) |
2,6 (1,7) |
8,0 (2,3) |
5,9 (1,7) |
5,5 (1,8) |
5,2 (1,5) |
4,9 (1,5) |
4,8 (1,4) |
4,3 (1,5) |
4,4 (1,5) |
|
Media (SD) del |
+5,4 |
+3,2 |
+2,8 |
+2,5 |
+2,1 |
+1,9 |
+1,4 |
+1,3 | |
|
cambio con respecto |
(2,6) |
(2,6) |
(2,4) |
(2,5) |
(2,1) |
(2,1) |
(2,2) |
(2,8) | |
|
al pre-tto | |||||||||
|
Valor de p del cambio con respecto |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
0,0001 |
0,0001 |
0,0042 |
0,0486 | |
|
al pre-tto [1] | |||||||||
|
SDS de la velocidad | |||||||||
|
de crecimiento en | |||||||||
|
estatura | |||||||||
|
N |
75 |
75 |
62 |
62 |
58 |
50 |
37 |
22 |
15 |
|
Media (SD) |
-3,4 (1,6) |
1,7 (2,8) |
-0,0 |
-0,1 |
-0,2 |
-0,3 |
-0,2 |
-0,5 |
-0,2 |
|
(1,7) |
(1,9) |
(1,9) |
(1,7) |
(1,6) |
(1,7) |
(1,6) | |||
|
Media (SD) del |
+5,2 |
+3,4 |
+3,3 |
+3,2 |
+3,2 |
+3,3 |
+3,0 |
+3,3 | |
|
cambio con respecto |
(2,9) |
(2,4) |
(2,3) |
(2,1) |
(2,1) |
(2,0) |
(2,1) |
(2,7) | |
|
al pre-tto Valor de p del |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
0,0001 |
<0,0001 |
<0,0001 |
0,0003 | |
|
cambio con respecto | |||||||||
|
al pre-tto [1] | |||||||||
|
SDS de la talla | |||||||||
|
N |
81 |
81 |
67 |
66 |
64 |
57 |
41 |
26 |
19 |
|
Media (SD) |
-6,9 (1,8) |
-6,1 |
-5,6 |
-5,3 |
-5,1 |
-5,0 |
-4,9 |
-4,9 |
-5,1 |
|
(1,8) |
(1,7) |
(1,7) |
(1,7) |
(1,7) |
(1,6) |
(1,7) |
(1,7) | ||
|
Media (SD) del |
+0,8 |
+1,2 |
+1,4 |
+1,6 |
+1,7 |
+1,8 |
+1,7 |
+1,7 | |
|
cambio con respecto |
(0,6) |
(0,9) |
(1,1) |
(1,2) |
(1,3) |
(1,1) |
(1,0) |
(1,0) | |
|
al pre-tto | |||||||||
|
Valor de p del cambio con respecto |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
0,0001 |
<0,0001 | |
|
al pre-tto [1] |
Pre-tto = previo al tratamiento SD = desviación típica; SDS = StandardDeviation Score (o Puntuación de Desviación Estándar)
[1] Valores de p para la comparación con los valores previos al tratamiento obtenidos mediante una prueba de la t de Student para datos apareados.
Para pacientes con edad ósea disponible durante al menos 6 años tras el inicio del tratamiento, el aumento medio de la edad ósea fue comparable al incremento medio de la edad cronológica; para estos sujetos, no parece haber un avance clínicamente significativo de la edad ósea respecto a la edad cronológica.
La eficacia es dependiente de la dosis. La dosis de 120 microgramos/kg administrada SC dos veces al día, se asoció con las mayores respuestas de crecimiento.
Entre todos los pacientes incluidos para la evaluación de seguridad (n=92), el 83% notificaron al menos un acontecimiento adverso durante el transcurso de los estudios. No hubo ninguna muerte durante los estudios. Ningún sujeto abandonó el estudio a causa de los acontecimientos adversos.
La hipoglucemia fue el acontecimiento adverso notificado con mayor frecuencia, pero generalmente fue manejable cuando se prestó especial atención a las comidas en relación con la dosificación.
Este medicamento se ha autorizado en "circunstancias excepcionales".
Esta modalidad de aprobación significa que debido a la rareza de la enfermedad no ha sido posible obtener información completa de este medicamento.
La Agencia Europea de Medicamentos revisará anualmente la información nueva de este medicamento que pueda estar disponible, y esta Ficha Técnica se actualizará cuando sea necesario.
5.2 Propiedades farmacocinéticas
Características generales
Absorción
Aún no se ha determinado la biodisponibilidad absoluta de la mecasermina administrada por vía subcutánea en pacientes con déficit primario de IGF-1 grave. Se ha descrito que la biodisponibilidad de la mecasermina tras administración subcutánea a individuos sanos es del orden del 100%.
Distribución
En la sangre, el IGF-1 se encuentra unido a seis proteínas de unión al IGF (IGFBP), con aproximadamente un 80% formando un complejo con IGFBP-3 y una subunidad lábil (ALS) a pH ácido. Los pacientes con un déficit primario de IGF-1 grave tienen menos IGFBP-3, por lo que el aclaramiento de IGF-1 en estos enfermos es mayor que en las personas sanas. El volumen de distribución de IGF-1 total (media ± SD) tras la administración subcutánea de INCRELEX, estimado a partir de 12 pacientes con déficit primario de IGF-1 grave, es de 0,257 (± 0,073) l/kg con una dosis de mecasermina de 0,045 mg/kg, y es de esperar que aumente a medida que aumenta la dosis de mecasermina. La información sobre cuál es la concentración de IGF-1 libre tras la administración de INCRELEX es limitada.
Biotransformación
El IGF-1 se metaboliza tanto en el hígado como en los riñones.
Eliminación
La semivida (tJ/2) terminal media del IGF-1 total tras una única administración subcutánea de 0,12 mg/kg, estimada a partir de tres pacientes pediátricos con un déficit primario de IGF-1 grave, es de 5,8 horas. El aclaramiento del IGF-1 total es inversamente proporcional a los niveles plasmáticos de IGFBP-3, y el aclaramiento sistémico total del IGF-1 (CL/F) estimado a partir de 12 pacientes es de 0,04 l/h/kg con 3 mg/l de IGFBP-3.
Poblaciones especiales
Pacientes de edad avanzada:
La farmacocinética de INCRELEX aún no se ha estudiado en personas de más de 65 años de edad.
Niños
La farmacocinética de INCRELEX aún no se ha estudiado en niños menores de 12 años de edad.
Sexo
En niños de más de 12 años con déficit primario de IGF-1, así como en adultos sanos, no se observaron diferencias farmacocinéticas aparentes para INCRELEX entre varones y mujeres.
No hay información disponible.
Insuficiencia renal
No se han llevado a cabo estudios en niños con insuficiencia renal.
Insuficiencia hepática
No se han llevado a cabo estudios para determinar el efecto de la insuficiencia hepática sobre la farmacocinética de la mecasermina.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas o genotoxicidad.
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales con niveles de exposición similares a los clínicos y con posible repercusión en el uso clínico fueron las siguientes:
Toxicidad para la reproducción
Se ha estudiado la toxicidad para la reproducción en ratas y conejos tras la administración intravenosa, pero no subcutánea (la forma de administración normal). Estos estudios no ponen de manifiesto ningún efecto perjudicial directo o indirecto para la fertilidad y el embarazo, pero como la forma de administración es diferente no queda clara la importancia de estos resultados. No se ha estudiado la transferencia placentaria de la mecasermina.
Potencial carcinogénico
Se administró mecasermina por vía subcutánea a ratas Sprague Dawley a dosis de 0; 0,25; 1; 4 y 10 mg/kg/día hasta un máximo de 2 años. Se observó un aumento de la incidencia de feocromocitoma e hiperplasia de la médula suprarrenal en las ratas machos a dosis de 1 mg/kg/día o más (> 1 vez la exposición clínica a la dosis máxima recomendada en seres humanos [MRHD] según el AUC) y en las ratas hembras a todas las dosis (> 0,3 veces la exposición clínica a la MRHD según el AUC).
Se observó un aumento de la incidencia de queratoacantoma en la piel de las ratas machos a dosis de 4 y 10 mg/kg/día (> 4 veces la exposición clínica a la MRHD según el AUC). En los animales tratados con 10 mg/kg/día (7 veces la exposición clínica a la MRHD según el AUC), tanto machos como hembras, se observó un aumento de la incidencia de carcinoma de la glándula mamaria. En los estudios de carcinogénesis se observó sobremortalidad secundaria a la hipoglucemia inducida por el IGF-1.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Alcohol bencílico Cloruro sódico Polisorbato 20 Ácido acético, glacial Acetato sódico
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Una vez abierto:
Se ha demostrado la estabilidad física y química en uso durante 30 días entre 2 °C y 8 °C.
Desde el punto de vista microbiológico, una vez abierto, el producto se puede almacenar durante un máximo de 30 días entre 2 °C y 8 °C. Otros tiempos y condiciones de almacenamiento en uso son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Mantener el vial perfectamente cerrado para protegerlo de la luz.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Cuatro mililitros de solución en un vial de 5 ml (vidrio de tipo I) cerrado con un tapón (polímero de bromobutilo e isopreno) y una cápsula (plástico lacado).
Estuche de 1 vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
INCRELEX se suministra como una solución multi-dosis.
La solución debe ser transparente inmediatamente después de sacarla de la nevera. La solución no debe inyectarse si está turbia o contiene partículas (ver sección 4.2).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Ipsen Pharma 65, quai Georges Gorse 92100 Boulogne-Billancourt Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/402/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 03/08/2007 Fecha de la última renovación: 03/08/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POST-AUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN EN CIRCUNSTANCIAS EXCEPCIONALES
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico.
Lonza Biologics, Inc.
97 South Street
Hopkinton, Massachusetts 01748 EEUU.
Nombre y dirección del fabricante responsable de la liberación de los lotes
Beaufour Ipsen Industrie Rue d'Ethe Virton 28100 Dreux Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos;
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Medidas adicionales de minimización de riesgos
El titular de la autorización de comercialización debe asegurarse de que todos los médicos que previsiblemente vayan a recetar INCRELEX reciban en el momento del lanzamiento un “paquete de información para el médico” que incluya:
• Información del producto
• Información sobre INCRELEX para médicos (tarjeta de información, guía de dosificación y un calculador de dosis)
• Paquete de información para el paciente
La información sobre INCRELEX destinada a los médicos debe incluir las siguientes cuestiones clave:
• Hay que explicar a los padres cuáles son los signos, los síntomas y el tratamiento de la hipoglucemia, incluida la inyección de glucagón.
• Para evitar posibles complicaciones o iniciar un tratamiento apropiado, conviene realizar un reconocimiento otorrinolaringológico a los pacientes regularmente o en cuanto aparezca cualquier síntoma clínico.
• Debe realizarse una oftalmoscopia de rutina antes de comenzar el tratamiento y regularmente durante el transcurso del mismo o en cuanto aparezca cualquier síntoma clínico.
• INCRELEX está contraindicado en el caso de una neoplasia activa o de sospecha de la misma y el tratamiento debe suspenderse si aparece algún indicio de neoplasia.
• En los pacientes que experimenten un crecimiento rápido puede producirse epifisiólisis de la cabeza femoral y/o progresión de la escoliosis. Durante el tratamiento con INCRELEX conviene supervisar estas patologías.
• Hay que informar a los padres y a los pacientes de que pueden aparecer reacciones alérgicas sistémicas y que si se producen, deben suspender el tratamiento y acudir rápidamente al médico.
• Información del muestreo sobre la inmunogenicidad.
La información sobre INCRELEX destinada a los pacientes debe incluir lo siguiente:
• INCRELEX debe administrarse un poco antes o después de una comida o tentempié, ya que tiene efectos hipoglucémicos similares a los de la insulina.
• Los signos y síntomas de la hipoglucemia. Instrucciones sobre el tratamiento de la hipoglucemia. Los padres y cuidadores deben asegurarse de que el niño tenga siempre a mano una fuente de azúcar. Instrucciones para la administración de glucagón por si se produce una hipoglucemia grave.
• Si por cualquier motivo el paciente no pudiera comer, conviene aplazar la administración de INCRELEX. Nunca debe duplicarse la dosis de INCRELEX para compensar una o más dosis omitidas.
• Deben evitar cualquier actividad de alto riesgo (p. ej. una actividad física intensa) en las 2-3 horas siguientes a la administración de la dosis, especialmente al principio del tratamiento con INCRELEX y hasta que se haya conseguido establecer una dosis bien tolerada de INCRELEX.
• Instrucciones para cambiar y rotar el lugar de inyección entre una inyección y otra para evitar una lipohipertrofia.
• Instrucciones para notificar la aparición o un empeoramiento de los ronquidos una vez iniciado el tratamiento con INCRELEX, lo cual podría indicar un aumento del tamaño de las amígdalas o vegetaciones.
• Tienen que informar a su médico si experimentan una cefalea intensa y visión borrosa junto con náuseas y vómitos.
• Tienen que informar a su médico si comienzan a cojear o experimentan molestias de cadera o rodilla, para poder hacer una valoración.
Incluirá además una guía de dosificación y un calculador de dosis que el médico y los pacientes puedan usar para consignar información sobre el aumento individualizado de la dosis, con el fin de reducir al mínimo el riesgo de que se produzcan errores de medicación e hipoglucemia.
E. OBLIGACIÓN ESPECÍFICA DE REALIZAR MEDIDAS POST-AUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN EN CIRCUNSTANCIAS EXCEPCIONALES
Al ser esta una autorización de comercialización en circustancias excepcionales y según lo que establece el artículo 14(8) del Reglamento (CE) 726/2004, el TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Hacer un estudio de seguridad a largo plazo comenzando el tratamiento con |
Informe final el |
|
mecasermina en las primeras etapas de la infancia y continuándolo hasta la edad adulta con el fin de investigar: |
2023 |
|
• La toxicidad a largo plazo de pacientes que experimentan cambios en el | |
|
desarrollo | |
|
• La posible aparición de tumores malignos y otros riesgos | |
|
Los informes intermedios se presentarán cada dos años hasta que haya concluido un seguimiento de 5 años del último paciente. |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
INCRELEX 10 mg/ml solución inyectable. Mecasermina
2. PRINCIPIO(S) ACTIVO(S)
Cada mililitro contiene 10 mg de mecasermina. Cada vial contiene 40 mg de mecasermina.
3. LISTA DE EXCIPIENTES
Los demás componentes son alcohol bencílico, cloruro sódico, polisorbato 20, ácido acético glacial, acetato sódico y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable.
Un vial multiuso de 4 ml.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Una vez abierto, usar antes de 30 días.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
No congelar.
Mantener el vial perfectamente cerrado para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Ipsen Pharma 65, quai Georges Gorse 92100 Boulogne-Billancourt Francia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/402/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
INCRELEX
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
INCRELEX 10 mg/ml inyectable
Mecasermina
SC
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
EXP | |
|
4. |
NÚMERO DE LOTE |
|
Lot | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
4 ml | |
|
6. |
OTROS |
B. PROSPECTO
Prospecto: información para el usuario
INCRELEX 10 mg/ml solución inyectable
Mecasermina
▼Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es INCRELEX y para qué se utiliza
2. Qué necesita saber antes de empezar a usar INCRELEX
3. Cómo usar INCRELEX
4. Posibles efectos adversos
5. Conservación de INCRELEX
6. Contenido del envase e información adicional
1. Qué es INCRELEX y para qué se utiliza
- INCRELEX es una solución líquida que contiene mecasermina, que es un factor de crecimiento insulínico tipo 1 (IGF-1) sintético, que es similar al IGF-1 que fabrica su organismo.
- INCRELEX se utiliza para tratar a niños y adolescentes de 2 a 18 años que son demasiado bajos para su edad porque su organismo no puede fabricar suficiente IGF-1. Esta enfermedad se denomina déficit primario de IGF-1.
2. Qué necesita saber antes de empezar a usar INCRELEX No use INCRELEX
- Si usted es alérgico (hipersensible) a la mecasermina o a cualquiera de los otros ingredientes de este medicamento (incluidos en la sección 6).
- Si usted padece cáncer.
- En neonatos o recién nacidos prematuros porque contiene alcohol bencílico. Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar INCRELEX
- Si usted sufre una desviación lateral de la columna (escoliosis). Conviene supervisar la progresión de la escoliosis.
- Si desarrolla cojera o dolor en la rodilla o cadera
- Si usted presenta un aumento del tamaño de las amígdalas (hipertrofia amigdalar). Conviene someterse a reconocimientos periódicos.
- Si usted presenta síntomas que indiquen un aumento de la presión en el cerebro (hipertensión intracraneal), como cambios visuales, dolor de cabeza, náuseas y/o vómitos; consulte a su médico.
- Si usted presenta una reacción localizada en el lugar de inyección o una reacción alérgica generalizada a INCRELEX. Acuda al médico lo antes posible si usted desarrolla una erupción cutánea localizada. Busque asistencia médica inmediatamente si usted tiene una reacción alérgica generalizada (urticaria, problemas para respirar, desvanecimiento o colapso y sensación general de malestar).
- Si usted ha dejado de crecer (se ha producido el cierre de las placas de crecimiento óseo). En este caso INCRELEX no puede ayudarle a crecer y no debe utilizarlo.
Niños de menos de 2 años
No se ha estudiado el uso de este medicamento en niños menores de 2 años, por lo tanto, no está recomendado.
Otros medicamentos e INCRELEX
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente, o podría tener que tomar cualquier otro medicamento.
Informe a su médico especialmente si usted se trata con insulina u otros medicamentos antidiabéticos. Puede ser necesario ajustar la dosis de estos medicamentos.
Embarazo, lactancia y fertilidad
Para todas las mujeres en edad fértil se recomienda una prueba de embarazo negativa antes de iniciar el tratamiento con INCRELEX. También se recomienda que todas las mujeres en edad fértil utilicen medidas anticonceptivas adecuadas durante el tratamiento.
El tratamiento con INCRELEX debe suspenderse si se produce un embarazo.
INCRELEX no debe administrarse a una madre en lactancia.
Conducción y uso de máquinas
INCRELEX puede causar hipoglucemia (efecto adverso muy frecuente) que puede afectar a su capacidad para conducir y utilizar máquinas, ya que su capacidad para concentrarse o reaccionar puede estar reducida.
Usted debe evitar cualquier actividad de alto riesgo (p. ej. conducir, etc) en las 2-3 horas siguientes a la administración de la dosis, especialmente al principio del tratamiento con INCRELEX y hasta que se haya encontrado una dosis de INCRELEX que no produzca efectos adversos que hagan de estas actividades un riesgo.
INCRELEX contiene alcohol bencílico
INCRELEX contiene 9 mg/ml de alcohol bencílico como conservante.
El alcohol bencílico puede provocar reacciones tóxicas y alérgicas en lactantes y en niños de hasta 3 años de edad.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial, lo que se considera esencialmente “exento de sodio”.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
La dosis normal es de 0,04 a 0,12 mg por kg de peso del paciente administrada dos veces al día. Consulte las “Instrucciones de uso” que figuran al final de este prospecto.
Inyecte INCRELEX justo debajo de su piel un poco antes o después de una comida o tentempié, ya que puede tener efectos hipoglucemiantes tipo insulina y por tanto, puede disminuir los niveles de azúcar en sangre (ver hipoglucemia en la sección 4). No se inyecte la dosis de INCRELEX si usted no puede comer por cualquier motivo. No intente compensar la dosis omitida administrando el doble de dosis la siguiente vez. La siguiente dosis debe administrarse como siempre, con una comida o tentempié.
Inyecte INCRELEX justo debajo de su piel en algún punto del brazo, el muslo, la zona del estómago (abdomen) o las nalgas. No inyecte nunca en una vena o en un músculo. Cambie el lugar de inyección en cada ocasión.
No use INCRELEX si no es transparente e incoloro.
El tratamiento con INCRELEX es un tratamiento a largo plazo. Consulte a su médico para más información.
Si usa más INCRELEX del que debiera
INCRELEX, como la insulina, puede disminuir los niveles de azúcar en sangre (ver hipoglucemia en la sección 4).
Si se ha inyectado más INCRELEX del recomendado, contacte con su médico inmediatamente.
Una sobredosis aguda puede provocar hipoglucemia (baja concentración de glucosa en sangre). La sobredosis prolongada puede provocar un aumento de tamaño de ciertas partes del cuerpo (p. ej., las manos, pies, partes de la cara) o un crecimiento excesivo de todo el cuerpo.
El tratamiento de la sobredosis aguda de INCRELEX debe concentrarse en invertir la hipoglucemia. Debe ingerirse comida o bebidas azucaradas. Si el paciente no está lo suficientemente consciente para tomar bebidas azucaradas, puede ser necesaria una inyección intramuscular de glucagón para invertir la hipoglucemia. Su médico o enfermera le enseñarán cómo inyectar el glucagón.
Si olvidó usar INCRELEX
No tome una dosis doble para compensar las dosis olvidadas.
Si se ha saltado una dosis, la siguiente dosis no debe ser mayor para compensar. La siguiente dosis debe administrarse como siempre, con una comida o tentempié.
Si interrumpe el tratamiento con INCRELEX
Una interrupción o finalización prematura del tratamiento con INCRELEX puede reducir el éxito de la terapia de crecimiento. Pregunte a su médico antes de interrumpir el tratamiento.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Los efectos adversos más frecuentemente notificados con INCRELEX son: bajo azúcar en sangre (hipoglucemia), vómitos, reacciones en el lugar de la inyección, dolor de cabeza e infecciones del oído medio. También se han notificado reacciones alérgicas graves con INCRELEX. Si usted experimenta cualquiera de estos efectos, siga el consejo que se da para cada efecto en las siguientes secciones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
Reacciones alérgicas graves (anafilaxis)
Tras el uso de INCRELEX se ha comunicado urticaria generalizada, dificultad al respirar, somnolencia, inflamación de la cara y/o garganta. Si desarrolla una reacción alérgica grave, debe interrumpir INCRELEX inmediatamente y buscar asistencia médica urgente.
También se han notificado reacciones alérgicas locales en el lugar de la inyección (picor, urticaria).
Caída de cabello (alopecia)
Con el uso de INCRELEX también se ha notificado la caída de cabello.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
Bajo azúcar en sangre (hipoglucemia)
INCRELEX puede disminuir los niveles de azúcar en sangre. Los signos de bajo azúcar son: somnolencia, cansancio, inquietud, hambre, irritabilidad, problemas de concentración, sudores, náuseas y latidos rápidos o irregulares.
La hipoglucemia grave puede causar inconsciencia, convulsiones/accesos epilépticos o muerte. Interrumpa INCRELEX inmediatamente y busque asistencia médica urgente si usted desarrolla convulsiones/accesos epilépticos o inconsciencia.
Si usted toma INCRELEX, debe evitar participar en actividades de riesgo elevado (como actividad física intensa) en las 2 a 3 horas siguientes a la inyección de INCRELEX, especialmente al inicio del tratamiento con INCRELEX.
Antes de comenzar el tratamiento con INCRELEX, el médico o la enfermera le explicarán cómo tratar la hipoglucemia. Usted debe tener siempre a mano una fuente de azúcar, como zumo de naranja, gel de glucosa, dulces o leche por si aparecen síntomas de hipoglucemia. En caso de hipoglucemia grave, si usted no responde y no puede tomar una bebida azucarada, debe administrarse una inyección de glucagón. El médico o la enfermera le enseñarán cómo administrar la inyección. La inyección de glucagón aumenta la concentración de glucosa en sangre. Es importante que usted siga una dieta equilibrada que incluya, además de alimentos azucarados, proteínas y grasas como carne y queso.
Hipertrofia en el lugar de inyección (el tejido en el lugar de la inyección aumenta de tamaño) y hematomas
Esto se puede evitar cambiando el lugar de inyección en cada ocasión (rotación del lugar de inyección).
Aparato digestivo
Con el tratamiento con INCRELEX se han producido casos de vómitos y dolor en la parte superior de la barriga.
Infecciones
En niños en tratamiento con INCRELEX se han observado infecciones del oído medio.
Sistema músculo-esquelético
Con el tratamiento con INCRELEX ha habido casos de dolor en articulaciones y dolor en extremidades.
Sistema nervioso
Con el tratamiento con INCRELEX se han producido casos de dolor de cabeza.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
Convulsiones
Con el tratamiento con INCRELEX se han observado casos de convulsiones (accesos).
Con el tratamiento con INCRELEX también se han comunicado casos de mareo y temblores.
Anomalías cardíacas
Con el tratamiento con INCRELEX se han comunicado casos de pulso acelerado y ruidos cardíacos anómalos.
Aumento de azúcar en sangre (hiperglucemia)
Con el tratamiento con INCRELEX también se ha observado aumento de azúcar en sangre.
Aumento de las amígdalas/adenoides
INCRELEX puede aumentar el tamaño de las amígdalas/adenoides. Entre los signos de un aumento del tamaño de las amígdalas/adenoides se incluyen: ronquidos, dificultad para respirar o tragar, apnea del sueño (un trastorno en el que se producen episodios breves de suspensión de la respiración durante el sueño) o presencia de líquido en el oído medio, además de infecciones del oído. La apnea del sueño puede provocar somnolencia diurna excesiva. Acuda al médico si estos síntomas resultan molestos. El médico debe examinar las amígdalas con regularidad.
Aumento del tamaño del timo
En el tratamiento con INCRELEX se ha observado aumento del tamaño del timo (un órgano especializado del sistema inmune).
Papiledema
Durante el tratamiento con INCRELEX el médico o un óptico puede observar una inflamación de la parte posterior del ojo (debida al aumento de presión en el cerebro).
Hipoacusia (pérdida de audición)
Con el tratamiento con INCRELEX se ha observado hipoacusia (pérdida de audición), dolor en el oído y líquido en el oído medio. Informe a su médico si usted desarrolla problemas de audición.
Empeoramiento de la escoliosis (producido por un crecimiento rápido)
Si usted padece escoliosis, será necesario que se someta a exámenes frecuentes para comprobar si ha aumentado la desviación de la columna. En el tratamiento con INCRELEX también se han observado casos de dolor muscular.
Aparato reproductor
Con el tratamiento con INCRELEX se han observado casos de aumento mamario.
Aparato digestivo
En el tratamiento con INCRELEX se han dado casos de dolor de barriga.
Cambios cutáneos y capilares
Con el tratamiento con INCRELEX se han observado casos de engrasamiento de la piel, lunares, y alteración de la textura capilar.
Reacciones en el lugar de la inyección
Las reacciones comunicadas con el tratamiento con INCRELEX incluyen dolor, irritación, hemorragia, hematoma, enrojecimiento y endurecimiento. Las reacciones del lugar de inyección se pueden evitar cambiando el lugar de inyección en cada ocasión (rotación del lugar de inyección).
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
Aumento de la presión cerebral (Hipertensión intracraneal)
INCRELEX puede provocar a veces un aumento temporal de la presión cerebral. Entre los posibles síntomas de la hipertensión intracraneal se incluyen los cambios visuales, el dolor de cabeza, las náuseas y/o vómitos. Informe a su médico inmediatamente si usted padece cualquiera de estos síntomas. Su médico comprobará si se debe a una hipertensión intracraneal. Si este fuera el caso, puede que su médico decida suspender o reducir temporalmente el tratamiento con INCRELEX. INCRELEX se puede volver a administrar cuando haya pasado el episodio.
Anomalías cardíacas
En algunos pacientes tratados con INCRELEX, el examen del corazón (ecocardiograma) ha puesto de manifiesto un aumento de tamaño del músculo cardíaco y anomalías en el funcionamiento de las válvulas cardíacas. Su médico puede hacerle un ecocardiograma antes, durante y después del tratamiento con INCRELEX.
Reacciones en el lugar de la inyección
Con el tratamiento con INCRELEX se han comunicado reacciones que incluyen erupción cutánea, hinchazón y bultos de grasa. Las reacciones del lugar de inyección se pueden evitar cambiando el lugar de inyección en cada ocasión (rotación del lugar de inyección).
Aumento de peso
Con el tratamiento con INCRELEX se han comunicado casos de aumento de peso.
Otros efectos adversos poco frecuentes con el tratamiento con INCRELEX incluyen depresión, nerviosismo.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de INCRELEX
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Mantener el vial perfectamente cerrado para protegerlo de la luz.
Después de usarse por primera vez, el vial puede ser almacenado hasta 30 días entre 2 °C y 8 °C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
- El principio activo es la mecasermina. Un mililitro contiene 10 mg de mecasermina. Cada vial contiene 40 mg de mecasermina.
- Los demás componentes son: alcohol bencílico, cloruro sódico, polisorbato 20, ácido acético glacial, acetato sódico y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
INCRELEX es una solución inyectable (inyección) transparente e incolora suministrada en un vial de vidrio cerrado con un tapón y una cápsula. El vial contiene 4 ml de solución.
Tamaño de envase de 1 vial.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Ipsen Pharma 65, quai Georges Gorse 92100 Boulogne-Billancourt Francia
Responsable de la fabricación:
Beaufour Ipsen Industrie Rue d'Ethe Virton 28100 Dreux Francia
medicamento dirigiéndose al representante local del
Italia
Ipsen SpA
Via del Bosco Rinnovato n.6 Milanofiori Nord Palazzo U7 20090 Assago (Mi)
Tel: + 39 - 02 - 39 22 41
Latvija
Ipsen Pharma Kalnciema iela 33-5 Riga LV 1046 Tel: +371 67622233
Lietuva, Hrvatska
Ipsen Pharma Lietuvos filialas ojo Forto 47 LT-48100 Kaunas Tel. + 370 37 337854
Magyarország
Ipsen Pharma SAS Magyarországi Kereskedelmi Képviselet Árbóc utca 6.
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien,
Luxembourg/Luxemburg
Ipsen NV
Guldensporenpark 87 B-9820 Merelbeke Belgie /Belgique/Belgien Tél/Tel: + 32 9 243 96 00
Románia, Et.irapirn
Ipsen Pharma
Str. Grigore Alexandrescu nr 59, cládirea HQ Sector 1, 010623, Bucuresti,
Románia
Tel/ Tea.: + 40 (021) 231 27 20
Ceská Republika
Ipsen Pharma, o.s.
Evropská 136/810 CZ-160 00 Praha 6 Tel: + 420 242 481 821
Danmark, Norge, Suomi/Finland, Sverige, Ísland
Institut Produits Synthese (IPSEN) AB Kista Science Tower
|
Farógatan 33 SE - 164 51 Kista Sverige/Ruotsi/Svíkjóó Tlf/Puh/Tel/Sími: +46 8 451 60 00 |
H-1133 Budapest Tel: +36 1 555 5930 |
|
Deutschland, Osterreich Ipsen Pharma GmbH Willy-Brandt-Str. 3 D-76275 Ettlingen Tel: + 49 7243 184-80 |
Nederland Ipsen Farmaceutica B.V. Taurusavenue 33 B NL-2132 LS Hoofddorp Tel: + 31 23 55 41 600 |
|
Eesti ESTOBIIN OÜ Udeselja 4-4 EE-11913 Tallinn Tel: +372 51 55 810 |
Polska Ipsen Poland Sp. z o.o. Al. Jana Pawla II 29 PL-00-867 Warszawa Tel.: + 48 (0) 22 653 68 00 |
|
EXXáda, Kúnpoq, Malta Ipsen EnE Ay. Anpnxpíon 63 ATapog GR-17456 AOqva ETAáSa Tr(k: + 30 - 210 - 984 3324 |
Portugal Ipsen Portugal - Produtos Farmacéuticos S.A. Alameda Fernao Lopes, no 16-11°, Miraflores P-1495 - 190 Algés Tel: + 351 - 21 - 412 3550 |
|
España Ipsen Pharma, S.A. Torre Realia, Plaza de Europa, 41 - 43 08908 L’Hospitalet de Llobregat Barcelona Tel: + 34 - 936 - 858 100 |
Slovenija PharmaSwiss d.o.o Brodisce 32 SI-1236 Trzin Tel: + 386 1 236 47 00 |
|
France Ipsen Pharma 65 quai Georges Gorse F-92100 Boulogne-Billancourt Tél: + 33 - 1 - 58 33 50 00 |
United Kingdom Ipsen Ltd. 190 Bath Road Slough, Berkshire SL13XE Tel: + 44 - (0)1753 - 62 77 00 |
|
Ireland Ipsen Pharmaceuticals Ltd. Blanchardstown Industrial Park Blanchardstown IRL-Dublin 4 Tel: + 353 - 1 - 8098200 |
Slovenská republika Liek s.r.o. Hviezdoslavova 19 SK-903 01 Senec Tel: + 421 245 646 322 |
|
Fecha de la última revisión de este prospecto: |
Este medicamento se ha autorizado en "circunstancias excepcionales".
Esta modalidad de aprobación significa que debido a la rareza de su enfermedad no ha sido posible obtener información completa de este medicamento.
La Agencia Europea de Medicamentos revisará anualmente la información nueva del medicamento que pueda estar disponible, y este prospecto se actualizará cuando sea necesario.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo
<......................................................................................................................>
INSTRUCCIONES DE USO
INCRELEX debe administrarse usando agujas y jeringas estériles desechables que puede
proporcionarle su médico/farmacéutico/enfermera. Hay que utilizar jeringas de pequeño volumen que
permitan extraer del vial la dosis prescrita con una exactitud razonable.
Preparación de la dosis:
1. Lávese las manos antes de preparar INCRELEX para la inyección.
2. Use una aguja y una jeringa desechables nuevas cada vez que administre una dosis. No use las jeringas y las agujas más de una vez. Deshágase de ellas de manera adecuada en un contenedor para objetos punzantes (por ejemplo, un contenedor para residuos biológicos peligrosos), un recipiente de plástico rígido (por ejemplo, una botella de detergente) o un recipiente de metal (como una lata de café vacía) No comparta nunca las agujas y las jeringas.
3. Compruebe que el líquido es transparente e incoloro. No lo utilice después de la fecha de caducidad (que aparece en la etiqueta después de CAD y se refiere al último día del mes), o si está turbio u observa que contiene partículas. Si un vial se congela, deshágase de él adecuadamente. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que ya no utiliza.
4. Si va a usar un vial nuevo, quite la tapa de protección. No quite el tapón de caucho.
5. Frote el tapón de caucho del vial con un algodón empapado en alcohol para evitar que el vial se contamine con los gérmenes que pudieran introducirse al insertar repetidas veces la aguja (ver la figura 1).
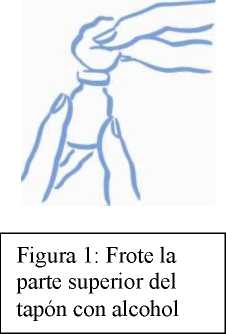
Antes de introducir la aguja en el vial, tire del émbolo hacia atrás para introducir en la jeringa una cantidad de aire equivalente a la dosis prescrita. Clave la aguja a través del tapón de caucho del vial y empuje el émbolo para inyectar aire dentro del vial (ver la figura 2).
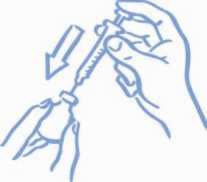
Figura 2: Inyecte aire en el vial
7.
Deje la jeringa dentro del vial y déles la vuelta a ambos. Sujete la jeringa y el vial con fuerza (ver la figura 3).
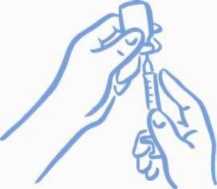
Figura 3: Prepárese para la extracción
Asegúrese de que la punta de la aguja está dentro del líquido (ver la figura 4). Tire del émbolo para cargar la dosis correcta en la jeringa (ver la figura 5).
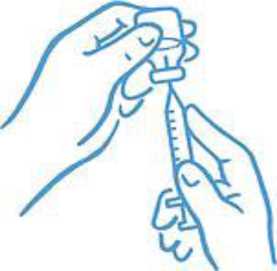
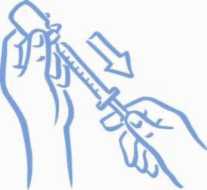
Figura 4: Punta dentro del líquido
Figura 5: Extraiga la dosis correcta
9. Antes de sacar la aguja del vial, compruebe si hay burbujas de aire en la jeringa. Si hay burbujas de aire, sujete el vial y la jeringa con la aguja recta hacia arriba y golpee ligeramente en un lado de la jeringa hasta que las burbujas floten hacia arriba. Expulse las burbujas con el émbolo y extraiga líquido de nuevo hasta conseguir la dosis correcta (ver la figura 6).

Figura 6: Extraiga las burbujas de aire y llene de nuevo la jeringa
Saque la aguja del vial y sustituya la tapa protectora. No deje que la aguja toque nada. Ahora ya está listo para inyectar (ver la figura 7).

Inyección de la dosis:
Inyecte INCRELEX siguiendo las instrucciones del médico.
No administre la inyección si usted no va a poder comer un poco antes o después de la inyección.
1. Escoja una zona para la inyección, ya sea el brazo, el muslo, una nalga o el abdomen (ver más abajo). Conviene cambiar el lugar de inyección en cada ocasión (rotar el lugar de inyección).
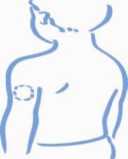
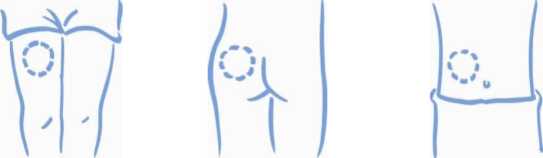
Nalga Abdomen
de la piel donde va a inyectar. El lugar de
Brazo Muslo
2.
Use alcohol o agua y jabón para limpiar la zona inyección debe estar seco antes de la inyección.
3. Pellizque ligeramente la piel. Inserte la aguja como le enseñó el médico. Suelte la piel (ver la figura A).
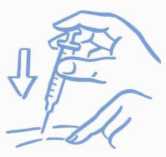
Figura A: Pellizque ligeramente la piel e inyecte como le explicaron
4. Empuje despacio el émbolo de la jeringa hasta el final, procurando inyectar todo el líquido. Tire recto de la aguja para sacarla y presione suavemente el punto de inyección con una gasa o un algodón durante unos segundos. No frote el área (ver la figura B).

5. Siga las instrucciones del médico para deshacerse de la aguja y la jeringa. No le ponga la tapa de nuevo a la jeringa. La aguja y la jeringa usadas deben ponerse en un contenedor para objetos punzantes (por ejemplo, un contenedor para residuos biológicos peligrosos), un recipiente de plástico rígido (por ejemplo, una botella de detergente) o un recipiente de metal (como una lata de café vacía). Estos recipientes deben sellarse y desecharse de manera adecuada del modo que le explique su médico.
39