Hypnomidate 2 Mg/Ml Solucion Inyectable
FICHA TÉCNICA
1. Nombre del medicamento
HYPNOMIDATE 2 mg/ml solución inyectable
2. Composición cualitativa y cuantitativa
HYPNOMIDATE se presenta como una solución inyectable en ampollas de 10 ml.
Cada ampolla de 10 ml contiene 20 mg de etomidato (2 mg/ml).
Excipientes: contiene propilenglicol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. Forma farmacéutica
Solución inyectable.
La solución de HYPNOMIDATE es una solución acuosa estéril para uso intravenoso, transparente, incolora y libre de partículas extrañas visibles.
4. Datos clínicos
4.1. Indicaciones terapéuticas
HYPNOMIDATE está indicado para la inducción de anestesia general.
4.2. Posología y forma de administración Posología
Se debe ajustar la dosis dependiendo de la respuesta individual de cada paciente y del efecto clínico.
La dosis hipnótica efectiva de HYPNOMIDATE es de 0,3 mg/kg de peso corporal, suficiente para obtener una duración del sueño de 4-5 minutos. Esta dosis puede adaptarse al peso corporal.
El medicamento sólo debe usarse por médicos expertos en intubación endotraqueal. Deben estar disponibles equipos de respiración artificial.
Población pediátrica
En niños menores de 15 años, si no se alcanza una profundidad de sueño suficiente con la dosis habitual en adultos, puede ser necesario incrementar la dosis un 30% máximo, es decir, hasta 0,4 mg/kg de peso corporal, valorando cuidadosamente el posible riesgo frente al beneficio esperado (ver sección 5.2 Poblaciones especiales: Población pediátrica).
Pacientes de edad avanzada
Se debe administrar una dosis única de 0,15-0,2 mg/kg de peso corporal y posteriormente ajustarse dependiendo de los efectos (ver sección 4.4 Advertencias y precauciones especiales de empleo y sección 5.2 Poblaciones especiales: Pacientes de edad avanzada)
Forma de administración Vía intravenosa.
HYPNOMIDATE debe inyectarse lentamente por vía intravenosa.
La hipnosis se puede prolongar mediante inyecciones adicionales de HYPNOMIDATE.
No se debe sobrepasar la cantidad total de 3 ampollas (30 ml).
Debido a que HYPNOMIDATE no tiene efecto analgésico, es recomendable administrar intravenosamente un opioide adecuado, por ejemplo 1-2 ml de fentanilo, 1-2 minutos antes de la inyección de HYPNOMIDATE.
4.3. Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes.
4.4. Advertencias y precauciones especiales de empleo HYPNOMIDATE debe ser administrado únicamente por vía intravenosa.
Debe evitarse la inyección intraarterial ya que puede provocar necrosis tisular. La inyección paravenosa causa dolor local severo.
En experimentos con animales, etomidato ha demostrado poseer potencial porfirogénico. Por lo tanto, no debe administrarse en pacientes con alteraciones hereditarias de la biosíntesis de hemo, a menos que no exista una alternativa más segura.
La inducción con HYPNOMIDATE puede estar acompañada de un ligero y transitorio descenso en la presión sanguínea debido a una reducción de la resistencia vascular periférica. En pacientes debilitados en los cuales la hipotensión puede ser peligrosa, se deben tomar las siguientes medidas:
1. Mantener al paciente en posición supina durante la inducción
2. Asegurar un buen acceso intravenoso para controlar el volumen sanguíneo circulatorio
3. Administrar HYPNOMIDATE mediante inyección intravenosa lenta (por ejemplo, 10 ml en un minuto).
4. Evitar la administración de otros agentes inductores si es posible
Cuando se utilice HYPNOMIDATE debe estar disponible un equipo de reanimación cardio-pulmonar para controlar la depresión respiratoria y la posibilidad de apnea.
Dosis de inducción de etomidato se han asociado con una reducción en plasma de las concentraciones de cortisol y aldosterona (ver sección 5.1 Propiedades farmacodinámicas). Se debe considerar suplementos con cortisol exógeno en pacientes que padecen estrés severo, particularmente aquellos con disfunción adrenocortical.
Debería evitarse la administración de etomidato en infusión continua o en dosis repetidas porque puede producir una supresión prolongada de cortisol endógeno y aldosterona.
En tales situaciones no es útil la estimulación de la glándula adrenal con hormona Adrenocorticotropa (ACTH).
Etomidato se debe usar con precaución en pacientes con insuficiencia cortico-suprarrenal subyacente como en los pacientes con sepsis.
Se debe reducir la dosis de HYPNOMIDATE en pacientes con cirrosis hepática o en aquellos que hayan recibido previamente agentes neurolépticos, opioides o sedantes.
Pueden ocurrir movimientos espontáneos en uno o más grupos de músculos, particularmente cuando no se ha administrado premedicación. Estos movimientos se han atribuido a la desinhibición subcortical. Pueden evitarse en gran parte por la administración intravenosa de pequeñas dosis de fentanilo con diazepam, 1 -2 minutos antes de la inducción con HYPNOMIDATE.
Se ha observado durante la administración de HYPNOMIDATE, especialmente cuando se inyecta en una vena pequeña, mioclonía y dolor en el lugar de la inyección, incluyendo dolor en las venas. Esto puede evitarse en gran parte por aplicación intravenosa de una pequeña dosis de opioides adecuados, por ejemplo fentanilo, 1 ó 2 minutos antes de la inducción.
HYPNOMIDATE debería usarse con precaución en pacientes de edad avanzada, ya que se ha comunicado con dosis mayores a las recomendadas la existencia de un riesgo potencial de disminución del rendimiento cardíaco (ver sección 4.2 Posología y forma de administración - dosis recomendadas en pacientes de edad avanzada).
Ya que HYPNOMIDATE no tiene acción analgésica, durante la intervención quirúrgica se deben utilizar analgésicos apropiados.
Información sobre los excipientes:
Este medicamento contiene propilenglicol. Puede producir síntomas parecidos a los del alcohol, por lo que puede disminuir la capacidad para conducir o manejar maquinaria.
4.5. Interacción con otros medicamentos y otras formas de interacción
El efecto hipnótico del etomidato puede verse incrementado por fármacos neurolépticos, opioides y sedantes, y por el alcohol.
La inducción con etomidato puede ir acompañada de una ligera y transitoria reducción de la resistencia periférica que puede incrementar el efecto de otros fármacos reductores de la presión sanguínea.
Efecto de otros fármacos sobre etomidato
La coadministración de etomidato con alfentanilo disminuye la vida media terminal del etomidato en aproximadamente 29 minutos. Se debe tener precaución cuando se administren etomidato y alfentanilo conjuntamente ya que las concentraciones de etomidato pueden disminuir por debajo del umbral hipnótico.
Cuando se administra con fentanilo intravenoso (IV) el aclaramiento plasmático total y el volumen de distribución de etomidato se ve disminuido de 2 a 3 veces sin que haya ningún cambio en la vida media. Cuando el etomidato se coadministra con fentanilo intravenoso (IV), puede ser necesario reducir la dosis de etomidato.
Efecto de etomidato sobre otros fármacos
La coadministración de etomidato y ketamina parece que no tiene un efecto significativo en las concentraciones plasmáticas o en los parámetros farmacocinéticos de la ketamina o su principal metabolito, norketamina.
4.6. Fertilidad, embarazo y lactancia Embarazo
No se han observado efectos embriotóxicos primarios o efectos teratogénicos en animales (ver apartado 5.3 Datos preclínicos sobre seguridad).
HYPNOMIDATE debe ser utilizado durante el embarazo solo si el beneficio potencial supera el riesgo en el feto.
Etomidato atraviesa la placenta cuando se usa para anestesia obstétrica. La puntuación Apgar de neonatos cuyas madres habían recibido etomidato fue comparable a la de los neonatos tras el uso de otros agentes hipnóticos. Se observó una bajada transitoria en los niveles de cortisol durante unas 6 horas en los neonatos después de que a la madre se le administrara HYPNOMIDATE. Los valores disminuidos permanecieron dentro del rango normal.
Lactancia
Se ha identificado etomidato en la leche materna. El efecto de etomidato en neonatos es desconocido. Se debe interrumpir la lactancia durante el tratamiento y por un período de aproximadamente 24 horas tras el tratamiento con HYPNOMIDATE.
Fertilidad
En un estudio de reproducción en animales los resultados mostraron que HYPNOMIDATE no tiene efecto sobre la fertilidad a las dosis recomendadas.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de HYPNOMIDATE sobre la capacidad para conducir y utilizar máquinas es importante. Aunque el paciente pueda recuperar el nivel de alerta normal pasados de 30 a 60 minutos tras el despertar,no se recomienda el uso de maquinaria potencialmente peligrosa o la conducción de vehículos durante las primeras 24 horas después de la administración. El regreso al nivel de alerta normal puede variar según la duración de la intervención, la dosis total administrada de etomidato y la medicación concomitante utilizada. Por lo tanto, la decisión de permitir la conducción o el uso de maquinaria debe ser una decisión realizada por el equipo de post-anestesiología.
4.8. Reacciones adversas
Se evaluó la seguridad de HYPNOMIDATE en 812 sujetos que participaron en 4 ensayos clínicos abiertos de HYPNOMIDATE usado para la inducción de la anestesia general. Estos sujetos recibieron al menos una dosis de HYPNOMIDATE y proporcionaron datos de seguridad. En base a los datos de seguridad obtenidos de estos ensayos clínicos, las reacciones adversas al medicamento (RAM) comunicadas con más frecuencia (> 5% de incidencia) fueron (con su % de incidencia): discinesia (10,3%) y dolor venoso (7,6%).
Incluyendo las reacciones adversas anteriormente mencionadas, en la siguiente tabla se muestran las reacciones adversas que se han notificado con el uso de HYPNOMIDATE tanto en los ensayos clínicos como durante la experiencia post-comercialización.
Las categorías de frecuencia se definen de la siguiente manera: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (>1/10.000 a <1/1000); Muy raras (<1/10.000); Frecuencia no conocida (no se puede estimar a partir de los datos disponibles de los ensayos clínicos).
Tabla 1: Reacciones Adversas al Medicamento
|
Clasificación de |
Reacciones Adversas al Medicamento |
|
órgano y sistema |
Categoría de frecuencia |
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Frecuencia no conocida | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad (incluyendo shock anafiláctico, reacción anafiláctica y reacción anafilactoide) | |||
|
Trastornos endocrinos |
Insuficiencia adrenal | |||
|
Trastornos del sistema nervioso |
Discinesia |
Mioclonía |
Hipertonía, Contracción involuntaria de los músculos, Nistagmo |
Convulsión (incluyendo convulsiones tónico clónicas generalizadas) |
|
Trastornos cardiacos |
Bradicardia, Extrasístoles, Extrasístoles ventriculares |
Paro cardiaco, Bloqueo auriculoventricular completo | ||
|
Trastornos vasculares |
Dolor venoso, Hipotensión |
Flebitis, Hipertensión |
Shock, Tromboflebitis (incluyendo tromboflebitis superficial y trombosis venosa profunda) | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Apnea, Hiperventilación, Estridor |
Hipoventilación, Hipo, Tos |
Depresión respiratoria, Broncoespasmo (incluyendo desenlace fatal) | |
|
Trastornos gastrointestinales |
Vómitos, Náuseas |
Hipersecreción salivar | ||
|
Trastornos de la piel y del tejido subcutáneo |
Exantema |
Eritema |
Síndrome de Stevens-Johnson, Urticaria | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Rigidez muscular |
Trismo | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor en el lugar de la inyección | |||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Complicación anestésica, Retraso en la recuperación de la anestesia, Analgesia inadecuada, |
|
Náuseas debidas al procedimiento |
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación benefio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Famracovigilancia de Medicamentos de Uso Humano https://www.notificaram.es
4.9. Sobredosis
Signos y síntomas
Una sobredosis de etomidato, administrada en bolus, aumenta la profundidad del sueño y puede_causar hipotensión, secreción cortical disminuida, depresión respiratoria e incluso una parada respiratoria. Si ocurre una parada respiratoria, es obligatorio practicar ventilación asistida. También puede ocurrir desorientación y retraso en el despertar.
Tratamiento
Además de las medidas de soporte adecuadas (por ejemplo ventilación asistida), puede ser necesaria la administración de 50-100 mg de hidrocortisona (no de hormona adrenocorticotropa [ACTH]).
5. Propiedades farmacológicas
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros anestésicos generales, código ATC: N01AX07
Etomidato es un hipnótico de acción corta para uso intravenoso en anestesia. En adultos una dosis de 0,20,3 mg/kg de peso corporal (aproximadamente 1 ampolla de 10 ml de HYPNOMIDATE) induce la hipnosis en 10 segundos y dura aproximadamente 5 minutos (o generalmente más en pacientes premedicados con sedantes).
A niveles cerebrales adecuados para la hipnosis, etomidato tiene propiedades anticonvulsivantes y protege los tejidos cerebrales del daño celular inducido por hipoxia. No tiene, sin embargo efecto analgésico, lo cual impide su uso como mono-anestésico. Etomidato se hidroliza rápidamente, predominantemente en el hígado. Por tanto la recuperación es rápida y en muy raras ocasiones va acompañada de somnolencia y mareos. Etomidato tiene un efecto mínimo sobre las funciones cardiaca y circulatoria. No libera histamina ni altera la función hepática.
Supresión adrenal
Cuando se usa etomidato para la inducción de la anestesia, se produce una disminución en plasma de cortisol y aldosterona, que permanece disminuida durante 6 a 8 horas. Estos niveles normalmente retornan a la línea del principio en 24 horas. Etomidato parece ser un inhibidor específico y reversible de la 11-beta-hidroxilación de la síntesis esteroide adrenal.
5.2. Propiedades farmacocinéticas Perfil en plasma
Después de la administración intravenosa, el transcurso de los niveles de etomidato en plasma se puede describir por un modelo tricompartimental reflejado por los procesos de distribución, metabolismo y eliminación.
Distribución
Etomidato se une a las proteínas plasmáticas en aproximadamente un 76,5%. Etomidato es distribuido rápidamente al cerebro y otros tejidos. El volumen de distribución es de aproximadamente 4,5 l/kg.
Metabolismo y eliminación
Etomidato se metaboliza en el hígado. Después de 24 horas, el 75 % de la dosis administrada de etomidato se elimina principalmente en la orina como metabolitos. Sólo el 2% de etomidato es excretado inalterado por la orina. La vida media terminal de aproximadamente 3-5 horas refleja la lenta distribución de etomidato desde el compartimento periférico profundo.
Relación concentración-efecto
La concentración plasmática mínima inductora de efecto hipnótico es de aproximadamente 0,3 pg/ml. Poblaciones especiales
Población pediátrica: En un estudio que incluyó a 12 niños (edad 7-13 años, peso 22-48 kg), el volumen de distribución inicial ajustado por peso corporal fue 2,4 veces más alto que en adultos (0,66 versus 0,27 l/kg) y el aclaramiento del fármaco en niños fue aproximadamente 58 % más alto que en adultos. Estos datos sugieren la necesidad de dosis más altas en niños en comparación con adultos.
Insuficiencia hepática: se ha comunicado en pacientes cirróticos que han recibido etomidato en combinación con fentanilo una prolongación de la vida media de eliminación. Se debe considerar en estos pacientes una reducción en la velocidad de infusión.
Pacientes de edad avanzada: el aclaramiento de etomidato disminuye en ancianos mayores de 65 años comparado con pacientes más jóvenes. Las primeras concentraciones plasmáticas son más altas en ancianos, debido a un volumen de distribución inicial más pequeño en estos pacientes comparado con pacientes más jóvenes. Las dosis requeridas pueden por lo tanto reducirse en pacientes ancianos.
5.3. Datos preclínicos sobre seguridad
Únicamente se observaron reacciones en los estudios no clínicos con exposiciones consideradas superiores a la máxima humana, lo que indica poca relevancia para su uso clínico. En ratas, se observó un descenso de la supervivencia de las crías a dosis tóxicas para la madre.
6 . Datos farmacéuticos
6.1. Lista de excipientes
Propilenglicol, agua para preparaciones inyectables.
6.2. Incompatibilidades
La solución inyectable no debe ser mezclada con otros productos.
6.3. Periodo de validez 3 años
6.4. Precauciones especiales de conservación Almacenar entre 15 y 25°C.
Mantener fuera de la vista y del alcance de los niños.
,<áp,
6.5. Naturaleza y contenido del envase
HYPNOMIDATE (2mg/ml) se presenta en ampollas de vidrio incoloras de 10 ml (Tipo I), provistas de anillos de apertura.
Cada envase contiene 5 ampollas.
6.6. Precauciones especiales de eliminación y otras manipulaciones
Ampollas:
Utilizar guantes al abrir la ampolla.
1. Mantener la ampolla entre el pulgar y el índice, dejando la punta de la ampolla libre.
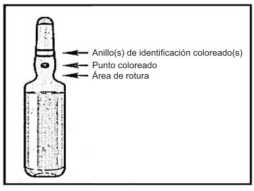
2. Con la otra mano, sujetar la punta de la ampolla presionando el índice contra el cuello de la ampolla, y el pulgar en el punto coloreado en paralelo a los anillos de identificación coloreados.
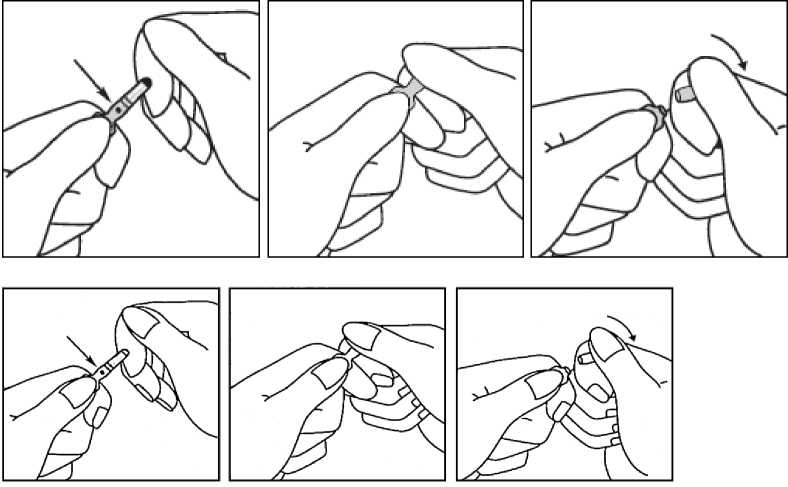
3. Mantener el pulgar en el punto, romper con firmeza la punta de la ampolla mientras se sostiene firmemente la otra parte de la ampolla en la mano.
En caso de exposición accidental de la piel al producto se debe aclarar la zona de exposición con abundante agua. Evítese el uso de jabón, alcohol y otros materiales de limpieza, ya que pueden causar abrasiones químicas o físicas en la piel.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. Titular de la autorización de comercialización
Janssen-Cilag S.A.
P° de Las Doce Estrellas, 5-7 28042 Madrid
8. Número(s) de autorización de comercialización
N° Registro AEMPS: 57.562
9. Fecha de la primera autorización/ renovación de la autorización
23/10/1989
10. Fecha de la revisión del texto
Octubre 2016
9 de 9