Hemangiol 3,75Mg/Ml Solucion Oral
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1 NOMBRE DEL MEDICAMENTO
HEMANGIOL 3,75 mg/ml solución oral
2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 4,28 mg de hidrocloruro de propranolol, equivalentes a 3,75 mg de propranolol base.
Para consultar la lista completa de excipientes, ver sección 6.1.
3 FORMA FARMACÉUTICA
Solución oral.
Solución oral transparente, incolora o ligeramente amarilla, con olor afrutado.
4 DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
HEMANGIOL está indicado para el tratamiento del hemangioma infantil proliferativo que precisa tratamiento sistémico:
• Hemangioma potencialmente mortal o que pone en peligro la capacidad funcional.
• Hemangioma ulcerado con dolor y/o ausencia de respuesta a las medidas básicas de cuidado de heridas.
• Hemangioma con riesgo de cicatrices permanentes o desfiguración.
Se debe iniciar el tratamiento en lactantes de 5 semanas a 5 meses de edad (ver sección 4.2).
4.2 Posología y forma de administración
El tratamiento con HEMANGIOL debe ser iniciado por un médico experimentado en el diagnóstico, tratamiento y manejo clínico del hemangioma infantil, en un contexto clínico controlado en el que se disponga de medios adecuados para el manejo de las reacciones adversas, incluidas aquellas que precisen medidas urgentes.
Posología
La posología se expresa como propranolol base.
La dosis inicial recomendada es de 1 mg/kg/día, administrada en dos dosis separadas de 0,5 mg/kg. Se recomienda aumentar la dosis hasta la dosis terapéutica bajo supervisión médica como sigue: 1 mg/kg/día durante 1 semana, después 2 mg/kg/día durante 1 semana, y después 3 mg/kg/día como dosis de mantenimiento.
La dosis terapéutica es de 3 mg/kg/día, que se debe administrar en 2 dosis separadas de 1,5 mg/kg, una por la mañana y otra a última hora de la tarde, con un intervalo mínimo de 9 horas entre las dos dosis. El medicamento se debe ingerir durante la alimentación del niño o inmediatamente después de la misma.
Si el niño no come, o si vomita, se recomienda omitir la dosis.
En caso de que el niño escupa una dosis o no tome todo el medicamento, no se debe dar otra dosis antes de la siguiente dosis programada.
Durante la fase inicial de ajuste de dosis, cada uno de los incrementos de dosis debe ser manejado y supervisado por un médico en las mismas condiciones que la administración de la dosis inicial.
Después de la fase inicial de ajuste de dosis, el médico volverá a ajustar la dosis de acuerdo con los cambios en el peso del niño.
Se debe realizar el seguimiento clínico del niño, y el reajuste de dosis, al menos cada mes.
Duración del tratamiento
HEMANGIOL se debe administrar durante un período de 6 meses.
La suspensión del tratamiento no precisa una disminución progresiva de la dosis.
En la minoría de los pacientes que presentan una recaída de los síntomas después de la suspensión del tratamiento, el tratamiento puede reiniciarse en las mismas condiciones, obteniendo una respuesta satisfactoria.
Poblaciones específicas
En ausencia de datos de eficacia clínica y seguridad, no se debe utilizar HEMANGIOL en niños menores de 5 semanas.
No hay datos de eficacia clínica y de seguridad en los estudios clínicos realizados con HEMANGIOL que permitan recomendar su inicio en niños de más de 5 meses de edad.
Lactantes con insuficiencia hepática o renal
En ausencia de datos, no se recomienda la administración del producto a lactantes con insuficiencia hepática o renal (ver sección 4.4).
Forma de administración Para uso oral.
HEMANGIOL se debe administrar durante la alimentación del niño o inmediatamente después de la misma, para evitar el riesgo de hipoglucemia. Se debe administrar directamente en la boca del niño utilizando la jeringa para uso oral dosificadora, calibrada en mg de propranolol base, que se suministra con el frasco de la solución oral (ver las instrucciones de uso en la sección 3 del prospecto).
No se debe agitar el frasco antes de su uso.
Cuando sea necesario, el medicamento puede diluirse en una pequeña cantidad de leche infantil, de zumo de manzana y/o de naranja adaptado para la edad del paciente. No poner el medicamento en el biberón lleno.
Para niños de hasta 5 Kg de peso, se puede mezclar la dosis con una cucharadita de leche infantil (aproximadamente 5 ml). Para niños de más de 5 kg de peso se puede mezclar la dosis con una cucharada de leche infantil o zumo de fruta, (aproximadamente 15 ml) administrada en el biberón. La mezcla se debe utilizar en las 2 horas siguientes.
Una misma persona debe administrar HEMANGIOL y la alimentación al niño a fin de evitar el riesgo de hipoglucemia. Si participan personas diferentes, es esencial una buena comunicación para garantizar la seguridad del niño.
4.3 Contraindicaciones
• Lactantes prematuros, en los que no se haya alcanzado la edad corregida de 5 semanas (la edad corregida se calcula restando el número de semanas de prematuridad de la edad real).
• Lactantes alimentados con lactancia materna, si la madre está recibiendo fármacos contraindicados con propranolol.
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1
• Asma o antecedentes de broncoespasmo.
• Bloqueo auriculoventricular de segundo o tercer grado.
• Enfermedad del nódulo sinusal (incluyendo bloqueo sinoauricular).
|
Edad |
0-3 meses |
3-6 meses |
6-12 meses |
|
Frecuencia cardíaca |
100 |
90 |
80 |
• Bradicardia por debajo de los siguientes límites:__
|
(latidos/min) |
• Presión arterial baja por debajo de los siguientes límites:
|
Edad |
0-3 meses |
3-6 meses |
6-12 meses |
|
Presión arterial (mmHg) |
65/45 |
70/50 |
80/55 |
• Shock cardiogénico.
• Insuficiencia cardíaca no controlada con medicación.
• Angina de Prinzmetal.
• Trastornos circulatorios arteriales periféricos graves (fenómeno de Raynaud).
• Lactantes propensos a hipoglucemia.
• Feocromocitoma.
4.4 Advertencias y precauciones especiales de empleo
Inicio del tratamiento
Antes de iniciar el tratamiento con propranolol se debe realizar una revisión para detectar riesgos asociados al uso de propranolol. Se debe realizar un análisis de la historia clínica y una exploración clínica completa que incluya la frecuencia cardíaca y la auscultación cardíaca y pulmonar.
En caso de sospecha de alteración cardíaca, se debe solicitar el consejo de un especialista antes de iniciar el tratamiento, para determinar cualquier contraindicación del paciente.
En caso de alteración broncopulmonar aguda, se debe posponer el inicio del tratamiento.
Trastornos cardiovasculares
El propranolol, debido a su acción farmacológica, puede producir o empeorar la bradicardia y las alteraciones de la presión arterial. Se debe diagnosticar bradicardia si la frecuencia cardíaca disminuye en más de 30 lpm respecto al valor inicial. La bradicardia se define por debajo de los siguientes límites:
|
Edad |
0-3 meses |
3-6 meses |
6-12 meses |
|
Frecuencia cardíaca (latidos/min) |
100 |
90 |
80 |
Después de la primera toma, y de cada uno de los incrementos de dosis, se debe realizar una exploración clínica, que incluya la presión arterial y la frecuencia cardíaca, al menos cada hora, durante al menos 2 horas. En caso de bradicardia sintomática o de bradicardia menor de 80 lpm se debe solicitar inmediatamente el consejo de un especialista.
En caso de bradicardia o de hipotensión grave y/o sintomática que se produzca en cualquier momento durante el tratamiento, se debe suspender el tratamiento y se debe solicitar el consejo de un especialista.
Hipoglucemia
El propranolol impide que se produzca la respuesta de las catecolaminas endógenas para corregir la hipoglucemia. Enmascara los signos de alerta adrenérgicos de la hipoglucemia, particularmente la taquicardia, los temblores, la ansiedad y el hambre. Puede agravar la hipoglucemia en niños, especialmente en caso de ayunas, vómitos o sobredosis.
Estos episodios hipoglucémicos asociados a la ingesta de propranolol se pueden manifestar excepcionalmente en forma de convulsiones y/o de coma.
Si se producen signos clínicos de hipoglucemia, es necesario hacer que el niño beba una solución líquida azucarada y suspender temporalmente el tratamiento. Hace falta un seguimiento adecuado del niño hasta que desaparezcan los síntomas.
En niños con diabetes se debe aumentar el seguimiento de la glucemia.
Trastornos respiratorios
En caso de infección respiratoria inferior asociada a disnea y sibilancias, se debe suspender temporalmente el tratamiento. Se pueden administrar agonistas beta2 y corticoesteroides inhalados. Se puede considerar volver a administrar propranolol cuando el niño se haya recuperado por completo; en caso de recurrencia se debe suspender permanentemente el tratamiento.
En caso de broncoespasmo aislado, se debe suspender permanentemente el tratamiento.
Insuficiencia cardíaca:
La estimulación simpática puede ser un componente vital que mantenga la función circulatoria en pacientes con insuficiencia cardíaca congestiva, y su inhibición con betabloqueantes puede precipitar una insuficiencia más grave.
Síndrome PHACE
Los datos disponibles sobre la seguridad del propranolol en el síndrome PHACE son muy limitados.
El propranolol puede aumentar el riesgo de accidente cerebrovascular en pacientes con síndrome PHACE con malformaciones cerebrovasculares graves porque reduce la presión arterial y atenúa el flujo sanguíneo a través de vasos sanguíneos ocluidos, estrechos o estenóticos.
Los niños que presentan un hemangioma infantil facial grande deben ser sometidos a un reconocimiento exhaustivo para detectar una posible arteriopatía asociada al síndrome PHACE, realizando una angiografía por resonancia magnética de cabeza y cuello y un estudio de imagen cardíaca que incluya el cayado aórtico, antes de considerar su tratamiento con propanolol.
Se debe solicitar el consejo de un especialista.
Lactancia materna:
El propranolol pasa a la leche materna, por lo que las madres que reciben tratamiento con propranolol y están amamantando a su hijo deben informar de ello a su médico.
Insuficiencia hepática o renal
El propranolol se metaboliza en el hígado y se excreta por los riñones. En ausencia de datos en niños, no se recomienda el uso de propranolol en caso de insuficiencia renal o hepática (ver sección 4.2).
Hipersensibilidad
En pacientes que tengan probabilidad de experimentar una reacción anafiláctica grave, independientemente de su origen, y particularmente con medios de contraste yodados, el tratamiento con betabloqueantes puede producir empeoramiento de la reacción y resistencia al tratamiento con adrenalina a dosis normales.
Anestesia general
Los betabloqueantes producen una atenuación de la taquicardia refleja y un aumento del riesgo de hipotensión. Es necesario alertar al anestesiólogo sobre el hecho de que el paciente está siendo tratado con betabloqueantes.
Cuando se programa cirugía en un paciente, se debe suspender el tratamiento con betabloqueantes al menos 48 horas antes de la intervención.
Hiperpotasemia
Se han descrito casos de hiperpotasemia en pacientes con hemangioma ulcerado grande. En estos pacientes se debe realizar una monitorización de los electrolitos.
Psoriasis
Se ha descrito empeoramiento de la enfermedad con betabloqueantes en pacientes que sufrían psoriasis. Por lo tanto, se debe evaluar detenidamente la necesidad de tratamiento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En ausencia de estudios específicos en niños, las interacciones medicamentosas con el propranolol son las que se conocen en adultos. Ante cualquier combinación se deben considerar las dos situaciones siguientes (que no son mutuamente excluyentes):
• Lactantes que reciben cualquier otro medicamento, sobre todo los que se mencionan a continuación.
• Lactantes alimentados con lactancia materna por madres que toman cualquier otro medicamento, sobre todo los que se mencionan a continuación. En este caso se debe discutir la necesidad de interrumpir la lactancia materna.
Se debe realizar una estrecha vigilancia clínica de cualquier alteración de la tolerancia al propranolol.
No se recomienda el uso concomitante
Bloqueantes de los canales de calcio inductores de bradicardia (diltiazem, verapamilo, bepridil)
La administración simultánea con propranolol puede producir alteraciones del automatismo (bradicardia extrema, parada sinusal), alteraciones en la conducción sinoauricular y auriculoventricular, e incremento del riesgo de arritmias ventriculares (taquicardia ventricular polimorfa en entorchado [torsades de pointes]), además de insuficiencia cardíaca.
Esta combinación sólo se debe administrar con una supervisión clínica estrecha y un ECG, particularmente al comienzo del tratamiento.
Interacciones que precisan precaución
Medicamentos cardiovasculares
Antiarrítmicos
• La propafenona tiene propiedades inotrópicas negativas y betabloqueantes que pueden ser aditivas a las del propranolol, a pesar de un estudio tranquilizador en voluntarios sanos.
• El metabolismo del propranolol se reduce por la administración simultánea de quinidina, lo que da lugar a un aumento de 2-3 veces de su concentración sanguínea y a mayores grados de beta bloqueo clínico.
• La amiodarona es un antiarrítmico con propiedades cronotrópicas negativas que pueden ser aditivas a las que se observan con los betabloqueantes, como el propranolol. Se espera que se produzcan trastornos del automatismo y de la conducción por la supresión de los mecanismos compensadores simpáticos.
• El metabolismo de la lidocaína se inhibe por la administración simultánea de propranolol, lo que da lugar a un aumento de la concentración de lidocaína del 25%. Se ha descrito toxicidad de la lidocaína (reacciones adversas neurológicas y cardíacas) después de la administración simultánea de propranolol.
Glucósidos digitálicos
Tanto los glucósidos digitálicos como los betabloqueantes ralentizan la conducción auriculoventricular y reducen la frecuencia cardíaca. Su uso simultáneo puede aumentar el riesgo de bradicardia.
Dihidropiridinas
Se debe tener precaución cuando pacientes tratados con un betabloqueante reciben una dihidropiridina. Ambos fármacos pueden inducir hipotensión y/o insuficiencia cardíaca en pacientes cuya función cardíaca esté controlada parcialmente, por los efectos inotrópicos aditivos. Su uso simultáneo puede reducir la respuesta simpática refleja que se produce cuando hay vasodilatación distal excesiva.
Antihipertensivos (inhibidores de la ECA, antagonistas de los receptores de la angiotensina II, diuréticos, alfabloqueantes para cualquier indicación, antihipertensivos de acción central, reserpina, etc.)
Cuando se combinan con betabloqueantes, los fármacos que reducen la presión arterial pueden producir o empeorar la hipotensión, notablemente la hipotensión ortostática. En relación con los antihipertensivos de acción central, los betabloqueantes pueden empeorar la hipertensión de rebote que puede producirse después de la suspensión brusca de la clonidina, y el propranolol se debe retirar varios días antes de suspender la clonidina.
Medicamentos no cardiovasculares
Corticoesteroides
Los pacientes con hemangioma infantil pueden tener un incremento del riesgo si han recibido o reciben concomitantemente tratamiento con corticoesteroides, ya que la supresión suprarrenal puede dar lugar a pérdida de la respuesta contrarreguladora del cortisol, con aumento del riesgo de hipoglucemia. Esto también se aplica a los niños que son alimentados con lactancia materna por madres tratadas con corticoesteroides, en caso de dosis elevadas o tratamiento prolongado.
Antiinflamatorios no esteroideos
Se ha notificado que los antiinflamatorios no esteroideos (AINE) atenúan el efecto antihipertensivo de los fármacos bloqueantes de los receptores betaadrenérgicos.
Fármacos inductores de hipotensión ortostática
Los fármacos que inducen hipotensión postural (derivados de nitratos, inhibidores de la fosfodiesterasa de tipo 5, antidepresivos tricíclicos, antipsicóticos, agonistas dopaminérgicos, levodopa, amifostina, baclofeno...) pueden sumar sus afectos a los de los betabloqueantes.
Inductores enzimáticos
Las concentraciones plasmáticas de propranolol pueden disminuir por administración simultánea de inductores enzimáticos como rifampicina y fenobarbital.
Hipoglucemiantes
Todos los betabloqueantes pueden enmascarar determinados síntomas de hipoglucemia: palpitaciones y taquicardia.
Se debe administrar con precaución propranolol junto al tratamiento hipoglucemiante en pacientes diabéticos ya que puede prolongar la respuesta hipoglucémica a la insulina. En este caso se debe informar al cuidador, y se debe aumentar el seguimiento de las concentraciones sanguíneas de glucosa, particularmente al inicio del tratamiento.
Medicamentos hipolipemiantes
La administración simultánea de colestiramina y colestipol con propranolol dio lugar a una disminución de la concentración de propranolol de hasta el 50%.
Anestésicos halogenados
Pueden reducir la contractilidad miocárdica y la respuesta compensadora vascular cuando se administran con propranolol. Se pueden utilizar fármacos betaestimulantes para contrarrestar el bloqueo beta.
4.6 Fertilidad, embarazo y lactancia
Embarazo No procede.
Lactancia materna
Madres que dan lactancia materna: ver sección 4.4 y sección 4.5.
Fertilidad:
Aunque algunos efectos reversibles sobre la fertilidad de machos y hembras fueron notificados en la literatura con ratas adultas tratadas con dosis elevadas de propranolol, en el estudio realizado en animales jóvenes no se encontró ningún efecto sobre la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos de hemangioma infantil proliferativo, las reacciones adversas descritas con más frecuencia en lactantes tratados con HEMANGIOL fueron los trastornos del sueño y el agravamiento de infecciones del aparato respiratorio, como bronquitis y bronquiolitis, asociadas a tos y fiebre, diarrea y vómitos.
En conjunto, las reacciones adversas notificadas en el programa de uso compasivo y en la literatura se relacionaron con hipoglucemia (y episodios relacionados, como convulsiones hipoglucémicas) y agravamiento de las infecciones respiratorias con dificultad respiratoria.
Tabla de reacciones adversas
En la tabla siguiente se presentan las reacciones adversas, descritas con cualquier dosis y duración del tratamiento, en tres estudios clínicos en los que participaron 435 pacientes tratados con HEMANGIOL en dosis de 1 mg/kg/día o de 3 mg/kg/día, durante 6 meses como máximo
Su frecuencia se define utilizando las convenciones siguientes: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1000 a < 1/100); raras (> 1/10.000 a < 1/1000); muy raras (< 1/10.000); desconocidas (no se puede estimar a partir de los datos disponibles). Debido al tamaño de la base de datos de los ensayos clínicos, las categorías rara y muy rara no se representan.
En la clasificación por órganos y sistemas, las reacciones adversas se presentan en orden de gravedad decreciente.
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Frecuencia desconocida | |
|
Infecciones e infestaciones |
Bronquitis |
Bronquiolitis | ||
|
Disminución del | ||||
|
Trastornos del metabolismo y de la nutrición |
apetito | |||
|
Trastorno del |
Agitación | |||
|
Trastornos |
sueño |
Pesadillas | ||
|
psiquiátricos |
Irritabilidad | |||
|
Trastornos del |
Somnolencia |
Convulsión | ||
|
sistema nervioso |
hipoglucémica | |||
|
Trastornos cardíacos |
Bloqueo AV |
Bradicardia | ||
|
Trastornos |
Frialdad periférica |
Hipotensión | ||
|
vasculares |
Vasoconstricción |
Fenómeno de Raynaud
|
Trastornos respiratorios, torácicos y mediastínicos |
Broncoespasmo | ||
|
Trastornos |
Diarrea |
Estreñimiento | |
|
gastrointestinales |
Vómitos |
Dolor abdominal | |
|
Trastornos de la piel y del tejido subcutáneo |
Eritema |
Urticaria Alopecia |
Muy frecuentes Frecuentes Poco frecuentes Frecuencia
desconocida
Exploraciones
complementarias
Disminución de la Disminución de la Agranulocitosis presión arterial glucosa en la Hiperpotasemia
sangre
Disminución de la
frecuencia
cardíaca
Neutropenia_
Descripción de reacciones adversas seleccionadas
En relación con las infecciones del tracto respiratorio inferior como la bronquitis y la bronquiolitis, se ha observado agravamiento de los síntomas (incluyendo broncoespasmo) en pacientes tratados con HEMANGIOL debido al efecto broncoconstrictor del propranolol. Estos efectos raras veces llevan a la suspensión definitiva del tratamiento (ver sección 4.4).
Los trastornos del sueño correspondieron a insomnio, mala calidad del sueño e hipersomnio. Se observaron otros trastornos del sistema nervioso central, principalmente durante los primeros períodos del tratamiento.
Se notificó diarrea con frecuencia, y no siempre se asoció a una enfermedad infecciosa gastrointestinal. La aparición de diarrea parece depender de la dosis entre 1 y 3 mg/kg/día. Ninguno de los casos fue grave, ni llevó a la suspensión del tratamiento.
Los episodios cardiovasculares notificados durante los estudios clínicos fueron asintomáticos. En el contexto de la monitorización cardiovascular de 4 horas durante los días de ajuste de dosis, se observó disminución de la frecuencia cardíaca (de aproximadamente 7 lpm) y de la presión arterial sistólica (menos de 3 mmHg) después de la administración del fármaco. Un caso de bloqueo auriculoventricular de segundo grado en un paciente con trastorno de conducción subyacente llevó a la suspensión definitiva del tratamiento. Casos aislados de bradicardia e hipotensión sintomáticas han sido notificados en la literatura.
Las disminuciones de la glucemia observadas durante los estudios clínicos fueron asintomáticas. Sin embargo, durante el programa de uso compasivo y en la literatura se han notificado varios casos de hipoglucemia con convulsiones hipoglucémicas relacionadas, especialmente en caso de un período de ayunas durante una enfermedad concomitante (ver sección 4.4).
El tratamiento concomitante con corticoesteroides sistémicos puede aumentar el riesgo de hipoglucemia (ver sección 4.5).
En la bibliografía médica se ha notificado hiperpotasemia en algunos pacientes con hemangiomas ulcerados grandes (ver sección 4.4).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
La toxicidad de los betabloqueantes es una extensión de sus efectos terapéuticos.
• Los síntomas cardíacos de la intoxicación leve a moderada son disminución de la frecuencia cardíaca e hipotensión. Puede producirse bloqueo auriculoventricular, retraso de la conducción intraventricular e insuficiencia cardíaca congestiva con una intoxicación más grave.
• Puede producirse broncoespasmo, particularmente en pacientes con asma.
• Puede producirse hipoglucemia, y las manifestaciones de la hipoglucemia (temblor, taquicardia) pueden estar enmascarados por otros efectos clínicos de la toxicidad del betabloqueante.
El propranolol es muy liposoluble y puede atravesar la barrera hematoencefálica y producir convulsiones.
Tratamiento sintomático y de soporte:
Se debe conectar al paciente a un monitor cardíaco y se deben monitorizar las constantes vitales, el estado mental y la glucemia. Deben administrarse líquidos intravenosos para la hipotensión, y atropina para la bradicardia. Se debe administrar glucagón, y después catecolaminas, si el paciente no responde adecuadamente a los líquidos intravenosos. Puede utilizarse isoproterenol y teofilina para el broncoespasmo.
5 PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes betabloqueantes, no selectivos, código ATC: C07AA05 Mecanismo de acción
Los posibles mecanismos de acción del propranolol en el hemangioma infantil proliferativo descritos en la literatura podrían incluir diversos mecanismos, todos ellos muy relacionados:
• Efecto hemodinámico local (vasoconstricción, que es una consecuencia clásica del bloqueo beta adrenérgico, con disminución de la perfusión de la lesión del hemangioma infantil).
• Efecto antiangiógeno (disminución de la proliferación de las células endoteliales vasculares, reducción de la neovascularización y la formación de túbulos vasculares, reducción de la secreción de metaloproteinasa 9 de matriz).
• Efecto activador de la apoptosis de las células endoteliales capilares
• Reducción de las vías de transducción de señales tanto de VEGF como de bFGF, y de la
consiguiente angiogenia/proliferación.
Efectos farmacodinámicos
El propranolol es un betabloqueante que se caracteriza por tres propiedades farmacológicas:
• Ausencia de actividad bloqueante beta-1 cardioselectiva.
• Efecto antiarrítmico.
• Ausencia de actividad agonista parcial (o actividad simpaticomimética intrínseca).
Eficacia clínica y seguridad en la población pediátrica
La eficacia del propranolol en lactantes (de 5 semanas a 5 meses de edad en el momento del inicio del tratamiento) con hemangioma infantil proliferativo que precisa tratamiento sistémico se ha demostrado en un estudio pivotal fase II/III aleatorizado, controlado, multicéntrico, multidosis y adaptativo dirigido a comparar cuatro regímenes de propranolol (1 ó 3 mg/kg/día durante 3 ó 6 meses) con un placebo (doble ciego).
Se administró el tratamiento a 456 pacientes (401 propranolol a una dosis de 1 ó 3 mg/kg/día durante 3 ó 6 meses; 55 placebo), incluyendo una fase inicial de ajuste de dosis de 3 semanas. Los pacientes (71,3% niñas; 37% tenían 35-90 días de edad y 63% tenían 91-150 días de edad) tenían un hemangioma que precisaba tratamiento, en la cabeza en el 70%, y la mayoría de los hemangiomas infantiles eran localizados (89%).
Se definió el éxito del tratamiento como la resolución completa o casi completa del hemangioma que precisaba tratamiento, lo cual se evaluó con valoraciones centralizadas independientes con enmascaramiento realizadas con fotografías a la semana 24, siempre que no se hubiera suspendido prematuramente el tratamiento.
El régimen de 3 mg/kg/día durante 6 meses (seleccionado al final de la parte de la fase II del estudio) tuvo una tasa de éxito del 60,4%, en comparación con el 3,6% en el grupo placebo (valor de p < 0,0001). No se identificaron diferencias en la respuesta al propranolol por subgrupos de edad (35-90 días/91-150 días), sexo y localización del hemangioma (cabeza/cuerpo). Se observó mejoría del hemangioma a las 5 semanas del tratamiento con propranolol en el 88% de los pacientes. En el 11,4% de los pacientes fue necesario repetir el tratamiento después de la interrupción del mismo.
Por motivos éticos relacionados con el uso de placebo, no se pudo establecer la eficacia en pacientes con hemangioma de riesgo elevado. Se dispone de datos sobre la eficacia del propranolol en pacientes con hemangioma de riesgo elevado, tanto en la literatura médica como en un programa específico de uso compasivo realizado con HEMANGIOL.
De acuerdo con un estudio retrospectivo, una minoría de pacientes (12%) necesitó el reinicio del tratamiento sistémico. Cuando se reinició el tratamiento, se observó una respuesta satisfactoria en la inmensa mayoría de los pacientes.
5.2 Propiedades farmacocinéticas
Adultos
Absorción y distribución:
El propranolol se absorbe casi por completo después de la administración oral. Sin embargo, experimenta un extenso metabolismo de primer paso hepático, y en promedio tan sólo aproximadamente el 25% de propranolol llega a la circulación sistémica. Las concentraciones plasmáticas máximas se producen aproximadamente 1-4 horas después de una dosis oral. La administración de alimentos ricos en proteínas aumenta la biodisponibilidad del propranolol en aproximadamente el 50%, sin modificar el tiempo hasta la concentración máxima.
El propranolol es un sustrato del transportador intestinal glicoproteína P (gp-P). Sin embargo, se ha visto que la gp-P no influye en la absorción intestinal del propranolol en el intervalo de dosis terapéutico habitual.
Aproximadamente el 90% del propranolol circulante está unido a proteínas plasmáticas (albúmina y glicoproteína ácida alfa1). El volumen de distribución del propranolol es de aproximadamente 4 L/kg. El propranolol atraviesa la barrera hematoencefálica y la placenta, y pasa a la leche materna.
Biotransformación y eliminación:
El propranolol se metaboliza por tres vías principales: hidroxilación aromática (principalmente 4-hidroxilación), N-desalquilación seguida por oxidación adicional de las cadenas laterales, y glucuronidación directa. Las contribuciones porcentuales de estas vías al metabolismo total son el 42%, el 41% y el 17%, respectivamente, aunque hay mucha variabilidad de unas personas a otras. Los cuatro metabolitos finales principales son glucurónido de propranolol, ácido naftiloxiláctico y ácido glucurónido, y conjugados sulfatados de 4-hidroxipropranolol. En estudios in vitro se ha visto que CYP2D6 (hidroxilación aromática), CYP1A2 (oxidación de cadenas) y en menor medida CYP2C19 participan en el metabolismo del propranolol.
En personas sanas no se observaron diferencias entre los metabolizadores rápidos y los metabolizadores lentos para CYP2D6 en relación con el aclaramiento oral y la vida media de eliminación.
La vida media plasmática del propranolol varía desde 3 hasta 6 horas. Menos del 1% de una dosis se excreta como fármaco sin modificar en la orina.
Población _ pediátrica
Se ha investigado la farmacocinética de dosis repetidas de HEMANGIOL administrado a una dosis de 3 mg/kg/día en 2 tomas en 19 lactantes de 35 a 150 días de edad al comienzo del tratamiento. La evaluación farmacocinética se realizó en estado de equilibrio, después de 1 ó 3 meses de tratamiento.
El propranolol se absorbió rápidamente, y la concentración plasmática máxima en general se produjo 2 horas después de la administración, con un valor medio de aproximadamente 79 ng/ml, independientemente de la edad del lactante.
El aclaramiento oral aparente medio fue de 2,71 L/h/kg en lactantes de 65-120 días, y 3,27 L/h/kg en lactantes de 181-240 días de edad. Una vez corregidos por el peso corporal, los principales parámetros farmacocinéticos del propranolol (como el aclaramiento plasmático) determinados en lactantes fueron similares a los que se han descrito para adultos en la literatura médica.
Se cuantificó el metabolito 4-hidroxipropranolol, y su exposición plasmática supuso menos del 7% de la exposición del fármaco original.
Durante este estudio farmacocinético de lactantes con hemangioma que ponía en peligro la capacidad funcional, hemangioma en determinadas localizaciones anatómicas que a menudo dejan cicatrices permanentes o deformidades, hemangioma facial grande, hemangioma de menor tamaño en áreas expuestas, hemangioma ulcerado grande y hemangioma pedunculado, también se estudió la eficacia como criterio de evaluación secundario. El tratamiento con propranolol produjo una mejoría rápida (en los primeros 7-14 días) en todos los pacientes, y se observó resolución del hemangioma que precisaba tratamiento en el 36,4% de los pacientes a los 3 meses.
5.3 Datos preclínicos sobre seguridad
En animales, después de la administración en dosis única, se considera que el propranolol es moderadamente tóxico, con una DL50 oral de aproximadamente 600 mg/kg. Los principales efectos notificados después de la administración en dosis repetidas del propranolol en ratas adultas y jóvenes fueron la disminución transitoria de peso corporal y el aumento del peso corporal, asociados a una disminución transitoria del peso de los distintos órganos. Estos efectos fueron completamente reversibles cuando se suspendió el tratamiento.
En estudios de administración con la dieta en los que se trató a ratones y ratas con hidrocloruro de propranolol durante hasta 18 meses a dosis de hasta 150 (mg/kg)/día, no hubo datos de carcinogénesis relacionada con el medicamento.
Aunque algunos datos eran equívocos, de acuerdo con los datos in vitro e in vivo disponibles, se puede concluir que el propranolol carece de potencial genotóxico.
En ratas hembras adultas, el propranolol administrado por vía intrauterina o intravaginal es un potente fármaco antiimplantación a una dosis >4 mg por animal, y los efectos son reversibles. En ratas machos adultos, la administración repetida de propranolol a niveles de dosis elevadas (>7,5 mg/kg) indujo lesiones histopatológicas en testículos, epidídimo y vesículas seminales, disminución de la movilidad de los espermatozoides, de la concentración de espermatozoides y de las concentraciones plasmáticas de testosterona, y un aumento significativo de las alteraciones de la cabeza y la cola de los espermatozoides. Estos efectos en general se revirtieron por completo después de la finalización del tratamiento. Se obtuvieron resultados similares después de la administración intratesticular de propranolol, y utilizando modelos in vitro. Sin embargo, en el estudio realizado en animales jóvenes tratados durante todo el período del desarrollo que correspondía a la lactancia, la infancia y la adolescencia, no se observaron efectos sobre la fertilidad en machos y hembras (ver sección 4.6).
Se evaluaron los posibles efectos del propranolol sobre el desarrollo de ratas jóvenes después de la administración oral diaria desde el día posnatal 4 (DPN 4) hasta el DPN 21 a niveles de dosis de 0, 10, 20 y 40 mg/kg/día.
Se observó mortalidad, con una relación desconocida aunque improbable con el tratamiento, con 40 mg/kg/día, lo que llevó a un NOAEL de 20 mg/kg/día para la toxicidad en animales jóvenes.
En relación con el desarrollo reproductor, el crecimiento y el desarrollo neurológico, no hubo efectos relacionados con el propranolol, ni hallazgos significativos desde el punto de vista toxicológico con 40 mg/kg/día, lo que se correlacionó con unos límites de seguridad de 1,2 en hembras y 2,9 en machos, basados en una exposición media al propranolol a DPN 21.
6 DATOS FARMACÉUTICOS
• Hidroxietilcelulosa
• Sacarina sódica
• Aroma fresa (contiene propilenglicol)
• Aroma vainilla (contiene propilenglicol)
• Ácido cítrico monohidratado
• Agua purificada
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Período de validez
Antes de su apertura: 3 años.
Después de la primera apertura: 2 meses.
6.4 Precauciones especiales de conservación
Conservar el frasco en el embalaje exterior para protegerlo de la luz.
No congelar.
Conservar el frasco y la jeringa juntos en el estuche entre cada uso.
6.5 Naturaleza y contenido del envase
Solución de 120 ml, en un frasco de vidrio de color ámbar con un inserto de polietileno de baja densidad y un tapón de rosca de polipropileno a prueba de niños; se suministra con una jeringa para uso oral de polipropileno dosificadora en mg de propranolol base.
Tamaño del envase: 1.
6.6 Precauciones especiales de eliminación
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
PIERRE FABRE DERMATOLOGIE
45 place Abel Gance F- 92100 Boulogne
8 NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/919/001
9 FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23 de Abril de 2014
10 FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes Farmea
10, rue Bouché Thomas ZAC d'Orgemont F-49000 Angers Francia
PIERRE FABRE MEDICAMENT PRODUCTION - CHATEAURENARD Site SIMAPHAC, Zone Industrielle de Chateaurenard 45220 CHATEAURENARD Francia
PIERRE FABRE MEDICAMENT PRODUCTION Site PROGIPHARM, Rue du Lycée 45500 GIEN Francia
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del hotel en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 8 meses después de la autorización.
Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de gestión de riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos;
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Medidas adicionales de minimización de riesgos
El TAC debe entregar un paquete educativo para la indicación propuesta, dirigido a todos los cuidadores que se espera que preparen y administren HEMANGIOL a los niños. Este paquete educativo tiene como finalidad concienciar sobre el posible riesgo de hipotensión, bradicardia y broncoespasmo después de la toma de HEMANGIOL, y ofrecer indicaciones sobre cómo monitorizar y manejar ese riesgo.
También se dirige a enseñar a los cuidadores a alimentar correctamente a los niños durante el tratamiento a fin de evitar el riesgo de hipoglucemia.
El TAC debe acordar el contenido y el formato del material educativo, junto con un plan de comunicación, con la autoridad competente nacional antes de la distribución del paquete educativo. El paquete educativo debe estar disponible para su distribución antes del lanzamiento de la nueva indicación (tratamiento del hemangioma infantil proliferativo) en el Estado Miembro.
Los materiales educativos para los cuidadores que traten a niños con HEMANGIOL deben incluir los siguientes elementos fundamentales de seguridad:
• Información sobre las situaciones en las que no se debe administrar HEMANGIOL
• Información sobre el procedimiento correcto de preparación y administración del producto, incluyendo:
- Instrucciones sobre cómo preparar la solución de HEMANGIOL
- Consejos sobre cómo alimentar al niño durante el tratamiento
- Información sobre cómo detectar y manejar cualquier signo de hipoglucemia durante el tratamiento con HEMANGIOL
- Instrucciones sobre cuándo se debe interrumpir la administración de HEMANGIOL
• Necesidad de monitorizar y contactar con los profesionales sanitarios si se producen los siguientes síntomas y signos después del tratamiento:
- Para la bradicardia y la hipotensión: fatiga, frialdad, palidez, color azulado de la piel y desvanecimiento.
- Para la hipoglucemia: síntomas leves como palidez, cansancio, sudoración, temblores, palpitaciones, ansiedad, hambre, dificultad para levantarse; síntomas graves como somnolencia excesiva, dificultad para obtener una respuesta, problemas de alimentación, disminución de la temperatura, convulsiones (crisis), pausas breves en la respiración, pérdida de la conciencia
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Y EL ACONDICIONAMIENTO PRIMARIO
CAJA DE CARTÓN/FRASCOS
1. NOMBRE DEL MEDICAMENTO
HEMANGIOL 3,75 mg/ml, solución oral Propranolol
2. PRINCIPIO(S) ACTIVO(S)
1 ml de solución contiene 4,28 mg de hidrocloruro de propranolol, equivalentes a 3,75 mg de propranolol.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución oral 120 ml.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
VIA ORAL.
Leer el prospecto antes de utilizar este medicamento.
Usar con la jeringa para uso oral dosificadora en mg de propranolol que se incluye en el envase. No utilizar ningún otro dispositivo de medida.
No agitar el frasco antes de su uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Después de la primera apertura del frasco, el medicamento debe ser utilizado en un plazo máximo de 2 meses.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar el frasco en el embalaje exterior para protegerlo de la luz. Entre cada uso guardar el frasco y la jeringa juntos en el estuche.
No congelar.
|
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN UTILIZADO Y DE LOS MATERIALES DERIVADOS CORRESPONDA) |
DEL DE |
MEDICAMENTO NO SU USO (CUANDO | ||
|
11. NOMBRE Y DIRECCIÓN DEL COMERCIALIZACIÓN |
TITULAR DE |
LA |
AUTORIZACIÓN |
DE |
PIERRE FABRE DERMATOLOGIE
45 place Abel Gance F- 92100 Boulogne
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/919/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
HEMANGIOL
B. PROSPECTO
Prospecto: información para el usuario
HEMANGIOL 3,75 mg/ml, solución oral
Propranolol
Lea todo el prospecto detenidamente antes de que su hijo empiece a tomar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a su hijo, y no debe dárselo a otras personas aunque tengan los mismos síntomas que su hijo, ya que puede perjudicarles.
• Si su hijo experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es HEMANGIOL y para qué se utiliza
2. Qué necesita saber antes de que su hijo empiece a tomar HEMANGIOL
3. Cómo tomar HEMANGIOL
4. Posibles efectos adversos
5. Conservación de HEMANGIOL
6. Contenido del envase e información adicional
1 Qué es HEMANGIOL y para qué se utiliza Qué es HEMANGIOL
El nombre de su medicamento es HEMANGIOL. El principio activo es propranolol.
El propranolol pertenece a un grupo de medicamentos conocidos como betabloqueantes.
Para qué se utiliza
Este medicamento se utiliza para tratar una enfermedad llamada hemangioma. Un hemangioma es un acúmulo extra de vasos sanguíneos que han formado un bulto en la piel o debajo de la misma. El hemangioma puede ser superficial o profundo. A veces se llama “marca de fresa” porque la superficie de un hemangioma se parece un poco a una fresa.
Hemangiol se inicia en niños que tienen desde 5 semanas hasta 5 meses de edad, cuando:
- la localización y/o la extensión de las lesiones ponen en peligro la vida o la función de un órgano (podrían alterar órganos vitales o sentidos como la visión o la audición);
- el hemangioma está ulcerado y es doloroso, y/o no responde a medidas básicas de cuidado de heridas;
- hay riesgo de cicatrices permanentes o desfiguración.
2 Qué necesita saber antes de que su hijo empiece a tomar HEMANGIOL
No use HEMANGIOL
Si su hijo:
• ha nacido prematuramente y no ha alcanzado la edad corregida de 5 semanas (la edad corregida es la edad que tendría un lactante prematuro si hubiera nacido en la fecha prevista);
• es alérgico al propranolol o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6). Una reacción alérgica puede incluir una erupción cutánea, picor o dificultad respiratoria;
• tiene asma o antecedentes de dificultades respiratorias;
• tiene una frecuencia cardíaca lenta para su edad. Debe consultar con su médico si no está seguro/a;
• tiene un problema cardíaco (como trastornos del ritmo cardíaco e insuficiencia cardíaca);
• tiene una presión arterial muy baja;
• tiene problemas circulatorios que hacen que los dedos de los pies y de las manos estén entumecidos y pálidos;
• tiene propensión a una concentración baja de azúcar en sangre;
• tiene la presión arterial elevada por un tumor de la glándula suprarrenal. Esto se llama “feocromocitoma”.
Si usted está dando de mamar a su hijo y si está tomando medicamentos que no se deben utilizar con HEMANGIOL (ver “Si está dando de mamar a su hijo” y “Uso de HEMANGIOL con otros medicamentos”), no administre este medicamento a su hijo.
Advertencias y precauciones
Antes de que su hijo empiece a tomar HEMANGIOL, informe a su médico:
• si su hijo tiene problemas de hígado o riñones. Este medicamento no se recomienda en caso de
insuficiencia hepática o renal;
• si su hijo ha tenido alguna vez una reacción alérgica. Una reacción alérgica puede incluir una
erupción cutánea, picor o dificultad respiratoria;
• si su hijo tiene psoriasis (una enfermedad de la piel que produce placas rojas y secas de piel
endurecida), porque este medicamento puede empeorar los síntomas de esta enfermedad;
• si su hijo tiene diabetes: en este caso se debe aumentar la frecuencia de monitorización de la
glucosa sanguínea de su hijo.
• si su hijo tiene síndrome PHACE (un trastorno que combina hemangioma y malformaciones
vasculares que pueden afectar a los vasos sanguíneos cerebrales), porque este medicamento puede aumentar el riesgo de ictus cerebral.
Signos importantes que se deben buscar después de la administración de HEMANGIOL Riesgo de hipotensión y bradicardia (frecuencia cardíaca lenta)
HEMANGIOL puede reducir la presión arterial (hipotensión) y la frecuencia cardíaca (bradicardia). Por este motivo, su hijo debe ser sometido a una estrecha monitorización clínica y de la frecuencia cardíaca durante 2 horas después de la primera toma y después de un aumento de la dosis. Posteriormente, durante el tratamiento su médico le realizará exploraciones clínicas periódicas a su hijo.
Llame inmediatamente a su médico si su hijo tiene cualquier signo como fatiga, sensación de frío, palidez, coloración azulada de la piel o desvanecimiento mientras toma HEMANGIOL.
Riesgos de hipoglucemia
Este medicamento puede enmascarar los signos de alarma de la hipoglucemia (también conocida como concentración baja de azúcar en sangre), especialmente si el niño está en ayunas, si tiene vómitos o en caso de sobredosis. Estos signos pueden ser:
• Leves: palidez, cansancio, sudoración, temblor, palpitaciones, ansiedad, hambre, dificultad para
levantarse.
• Graves: somnolencia excesiva, dificultad para responder, problemas para alimentarle, disminución
de la temperatura corporal, convulsiones (crisis), pausas breves en la respiración, pérdida de la conciencia.
tratamiento. Si su hijo no come, si presenta otra enfermedad o si vomita, se recomienda omitir la dosis. NO ADMINISTRE HEMANGIOL A SU HIJO HASTA QUE SE HAYA ALIMENTADO CORRECTAMENTE.
Si su hijo tiene algún signo de hipoglucemia mientras toma HEMANGIOL, si es posible adminístrele un líquido oral que contenga azúcar y, si persisten los síntomas, llame rápidamente a su médico o vaya directamente al hospital._
Riesgos de broncoespasmo
Interrumpa el tratamiento y contacte inmediatamente con su médico si después de administrar HEMANGIOL a su hijo observa los siguientes síntomas indicativos de broncoespasmo (restricción transitoria de los conductos bronquiales que produce dificultad respiratoria): tos, respiración rápida o difícil o silbidos, asociados o no a piel de color azulado.
Riesgo de hiperpotasemia
HEMANGIOL puede aumentar la concentración sanguínea de potasio (hiperpotasemia) en caso de hemangioma ulcerado grande. En esta situación se debe medir la concentración sanguínea de potasio de su hijo.
Si a su hijo se le va a administrar anestesia general
Informe a su médico de que su hijo está tomando HEMANGIOL. Esto se debe a que su hijo puede tener la presión arterial baja si se le administran determinados anestésicos mientras toma este medicamento (ver “Uso de HEMANGIOL con otros medicamentos”). Podría ser necesario interrumpir HEMANGIOL al menos 48 horas antes de la anestesia.
Si está dando de mamar a su hijo
• Informe a su médico antes de administrar este medicamento.
• No administre este medicamento a su hijo si usted está tomando medicamentos que no se deben
utilizar con HEMANGIOL (ver “Uso de HEMANGIOL con otros medicamentos”).
Uso de HEMANGIOL con otros medicamentos
• Informe a su médico, farmacéutico o enfermero si está administrando, ha administrado
recientemente o podría tener que administrar cualquier otro medicamento a su hijo. Esto se debe a que HEMANGIOL puede modificar la forma en la que actúan otros medicamentos, y algunos medicamentos pueden influir en la forma en la que actúa HEMANGIOL.
• Además, si está dando de mamar a su hijo, es importante que informe a su médico, farmacéutico o
enfermero de los medicamentos que está tomando usted, porque pueden pasar a la leche materna e interferir con el tratamiento de su hijo. Su médico le aconsejará si es necesario interrumpir la lactancia materna o no.
En particular, en caso de que esté dando de mamar a su hijo, informe a su médico o farmacéutico si usted o su hijo está tomando:
• medicamentos para la diabetes;
• medicamentos para problemas del corazón y de los vasos sanguíneos, como latidos cardíacos
irregulares, dolor en el pecho o angina, presión arterial elevada o insuficiencia cardíaca;
• medicamentos para tratar la ansiedad y la depresión, además de problemas más graves de salud
mental, y la epilepsia;
• medicamentos para tratar la tuberculosis;
• medicamentos para tratar el dolor y la inflamación;
• medicamentos utilizados para reducir las grasas en la sangre;
• medicamentos utilizados para la anestesia.
Si tiene cualquier otra pregunta, consulte con su médico o farmacéutico.
3 Cómo usar HEMANGIOL
El tratamiento de su hijo ha sido iniciado por un médico que tiene experiencia en el diagnóstico, el tratamiento y el manejo del hemangioma infantil.
Siga exactamente las instrucciones de administración a su hijo de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Nunca modifique usted mismo la dosis que está administrando a su hijo. Todos los incrementos de dosis y todos los ajustes por el peso de su hijo los debe realizar su médico.
Dosis
• La dosis se basa en el peso del niño.
• La dosis inicial es de 1 mg/kg/día, que se debe administrar en dos dosis separadas (de 0,5 mg/kg,
una por la mañana y otra a última hora de la tarde), con un intervalo mínimo de 9 horas entre las dos dosis.
• La dosis recomendada es de 3 mg/kg/día, administrada en dos dosis separadas de 1,5 mg/kg, y a la
que se llega gradualmente con incrementos semanales bajo supervisión médica 1 mg/kg/día la primera semana, después 2 mg/kg/día la segunda semana, y después 3 mg/kg/día hasta el final del tratamiento).
Cómo administrar HEMANGIOL a su hijo
• El medicamento se debe administrar durante la alimentación del niño o inmediatamente después
de la misma.
• La dosis siempre se debe medir con la jeringuilla oral que se suministra con el frasco.
• Administre HEMANGIOL directamente en la boca de su hijo utilizando la jeringa para uso oral
que se incluye con el frasco. Cuando sea necesario, puede diluir el producto en una pequeña cantidad de leche infantil o de zumo de manzana y/o de naranja adaptado para la edad del niño, y administrarlo a su hijo en un biberón. No mezcle el medicamento con un biberón lleno de leche o zumo.
Para niños de hasta 5 kg de peso, puede mezclar la dosis con una cucharadita de leche infantil (aproximadamente 5 ml). Para niños de más de 5 kg de peso se puede mezclar la dosis con una cucharada de leche infantil o zumo de fruta (aproximadamente 15 ml).
Utilice la mezcla en las 2 horas siguientes a su preparación.
• Alimente con frecuencia su hijo para evitar el ayuno prolongado.
• Si su hijo no come, o si vomita, se recomienda omitir la dosis.
• Si su hijo vomita una dosis, o si no está segura/o de que haya recibido todo el medicamento, no le
administre otra dosis, simplemente esperé hasta la siguiente dosis programada.
• Una misma persona debe administrar HEMANGIOL y la alimentación del niño a fin de evitar el
riesgo de hipoglucemia. Si participan personas diferentes, es esencial una buena comunicación para garantizar la seguridad de su hijo.
Instrucciones de uso:
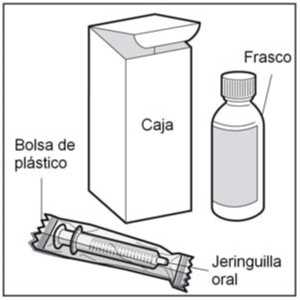
• Paso 1. Extraiga del estuche los diferentes elementos
El estuche contiene los siguientes elementos que necesitará para administrar el medicamento:
- El frasco de vidrio conteniendo 120 ml de solución oral de propranolol.
- La jeringa para uso oral dosificadora en mg que se incluye con este medicamento.
Extraer del estuche el frasco y la jeringa para uso oral, y saque la jeringa de la bolsa de plástico.
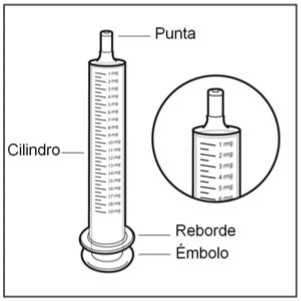
• Paso 2. Compruebe la dosis
Compruebe la dosis de HEMANGIOL en miligramos (mg) tal y como la ha recetado su médico. Localice este número en la jeringa para uso oral.
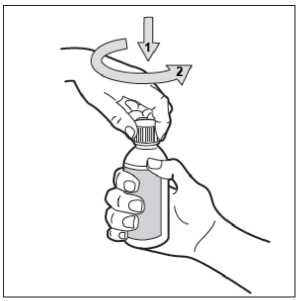
• Paso 3. Abra el frasco
El frasco tiene un tapón a prueba de niños. Esta es la manera de abrirlo: apriete hacia abajo el tapón de plástico a la vez que gira el tapón en sentido contrario a las agujas del reloj (hacia la izquierda).
No agite el frasco antes de su uso.
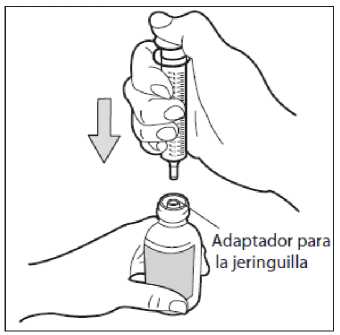
• Paso 4. Introduzca la jeringa
Introduzca la punta de la jeringa para uso oral en el frasco en posición vertical, y empuje el émbolo en todo su recorrido.
No extraiga el adaptador para la jeringa de la boca del frasco.
Utilice sólo la jeringa para uso oral que se suministra con el medicamento para medir y administrar la dosis. No utilice una cucharilla ni ningún otro dispositivo dispensador.
• Paso 5: Extraiga la dosis
Con la jeringa para uso oral colocada, gire el frasco para ponerlo boca abajo. Tire del émbolo de la jeringa hasta el número de mg que necesita.
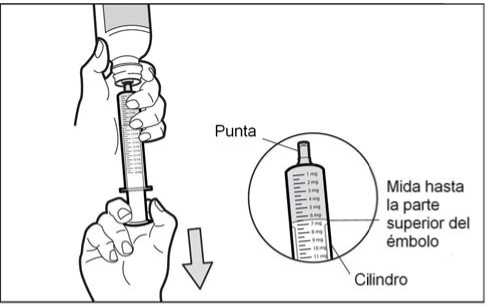
• Paso 6: Compruebe la ausencia de burbujas de aire
Si ve burbujas de aire en la jeringa, sujete la jeringa verticalmente, empuje el émbolo hacia arriba lo suficiente para expulsar por completo todas las burbujas de aire grandes, y reajústelo hasta la dosis prescrita por el médico.
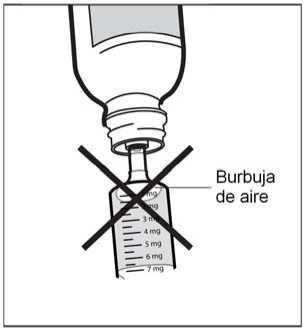
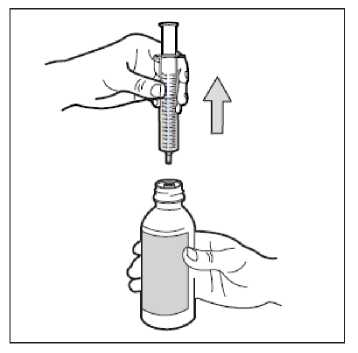
• Paso 7. Extraiga la jeringa
Gire el frasco para ponerlo en posición vertical, y separe del frasco toda la jeringa. Tenga cuidado de no empujar el émbolo durante este paso.
• Paso 8. Cierre el frasco
Vuelva a poner el tapón de plástico en el frasco girándolo en sentido de las agujas del reloj (hacia la
derecha).
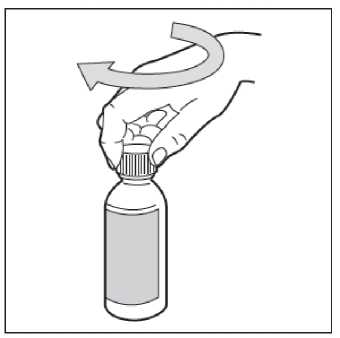
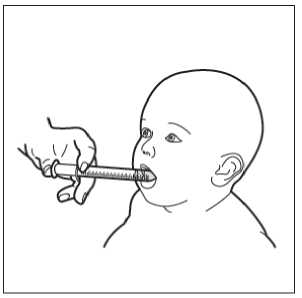
• Paso 9. Administre HEMANGIOL a su hijo
Introduzca la jeringa en la boca de su hijo y apóyela en la parte interna de la mejilla.
Ahora ya puede expulsar lentamente HEMANGIOL desde la jeringa directamente en la boca de su hijo.
No acueste al niño inmediatamente después de administrarle el medicamento.
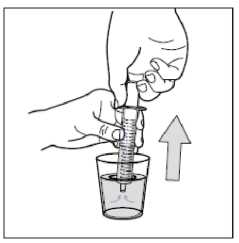
• Paso 10: Limpie la jeringa.
No desmonte la jeringa. Aclare la jeringa vacía en un vaso de agua limpia después de cada uso:
1- Tome un vaso de agua limpia
2- Tire del émbolo hasta el extremo
3- Tire el agua en el fregadero
4- Repita 3 veces este proceso de limpieza.
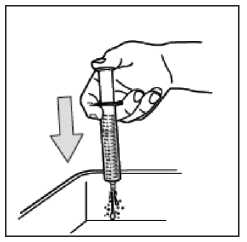
No utilice ningún producto con jabón o alcohol para limpiarla. Seque el exterior con un paño.
No introduzca la jeringa en un esterilizador ni en un lavaplatos.
Guarde el frasco y la jeringa juntos en el estuche hasta el siguiente uso, en un lugar seguro en el que el niño no lo pueda ver o al que no pueda llegar. Tire la jeringa cuando se haya acabado el frasco.
Si administra a su hijo más HEMANGIOL del que debe
Si ha administrado a su hijo más HEMANGIOL del que debe, consulte inmediatamente con su médico.
Si olvidó administrar HEMANGIOL a su hijo
No administre una dosis doble para compensar las dosis olvidadas. Continúe el tratamiento con la frecuencia habitual. Una dosis por la mañana y otra a última hora de la tarde.
Si interrumpe el tratamiento de su hijo con HEMANGIOL
HEMANGIOL puede dejar de administrarse de repente al final del tratamiento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4 Posibles efectos adversos
Además, después de la administración de HEMANGIOL se deben buscar importantes signos de alarma de posibles efectos adversos como presión arterial baja, frecuencia cardíaca baja, concentración de azúcar en sangre baja o broncoespasmo. Ver sección 2 de este prospecto.
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
• bronquitis (inflamación de los bronquios),
• trastornos del sueño (insomnio, sueño de mala calidad y dificultad para despertarse),
• diarrea y vómitos.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas):
• broncoespasmo (dificultad respiratoria),
• bronquiolitis (inflamación de bronquios pequeños con dificultad respiratoria y silbidos en el pecho, asociada a tos y fiebre),
• disminución de la presión arterial,
• disminución del apetito,
• agitación, pesadillas, irritabilidad,
• somnolencia,
• extremidades frías,
• estreñimiento, dolor abdominal,
• eritema (enrojecimiento cutáneo).
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
• trastornos de conducción o de ritmo cardíaco (latidos cardíacos lentos o irregulares),
• urticaria (reacción alérgica de la piel), alopecia (pérdida de cabello),
• disminución de la concentración de azúcar en sangre,
• reducción del número de leucocitos (células de la serie blanca en la sangre).
La frecuencia de los siguientes efectos adversos es desconocida (no se puede estimar a partir de los datos disponibles)
• convulsiones (crisis) relacionadas con la hipoglucemia (concentración anormalmente baja de
glucosa en sangre),
• bradicardia (frecuencia cardíaca anormalmente baja),
• presión arterial baja,
• cifras muy bajas de leucocitos (células de la serie blanca en la sangre) que luchan contra las
infecciones,
• problemas circulatorios que hacen que los dedos de los pies y de las manos estén entumecidos y
pálidos,
• elevación de la concentración de potasio en sangre.
Comunicación de efectos adversos
Si su hijo experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5 Conservación de HEMANGIOL
Mantener este medicamento fuera de la vista y del alcance de los niños.
No se debe congelar este medicamento. Conservar el frasco en el embalaje exterior para protegerlo de la luz. Guardar la jeringa para uso oral junto con el frasco en el estuche entre cada uso.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco. La fecha de caducidad es el último día del mes que se indica.
Después de la primera apertura del frasco, el medicamento se debe usar en un plazo máximo de 2 meses.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y los medicamentos que ya no necesita. De esta manera, ayudará a proteger el medio ambiente.
6 Contenido del envase e información adicional Composición de HEMANGIOL
• El principio activo es propranolol. Cada ml contiene 4,28 mg de hidrocloruro de propranolol,
equivalente a 3,75 mg/ml de propranolol.
• Los demás ingredientes son hidroxietilcelulosa, sacarina sódica, aroma fresa (contiene
propilenglicol), aroma vainilla (contiene propilenglicol), ácido cítrico monohidratado y agua purificada.
Aspecto de HEMANGIOL y contenido del envase
• HEMANGIOL es una solución oral transparente, incolora o de un color ligeramente amarillo, con
olor afrutado.
• Se suministra en un frasco de vidrio de color ámbar de 120 ml, con un tapón de rosca a prueba de
niños. Envase de 1 frasco.
• Con cada frasco se suministra una jeringa para uso oral de polipropileno dosificadora en mg de
propranolol.
Titular de la autorización de comercialización PIERRE FABRE DERMATOLOGIE
45 Place Abel Gance 92100 BOULOGNE FRANCIA
Responsable de la fabricación FARMEA
10 rue Bouché Thomas ZAC Sud d’Orgemont 49000 ANGERS FRANCIA
O
PIERRE FABRE MEDICAMENT PRODUCTION
Site SIMAPHAC, Zone Industrielle de Chateaurenard
45220 CHATEAURENARD
FRANCIA
O
PIERRE FABRE MEDICAMENT PRODUCTION
Site PROGIPHARM, Rue du Lycée
45500 GIEN
FRANCIA
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
32