Haloperidol Esteve 10 Mg Comprimidos
am
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agenos españoaóe medKamentosy productos sannanos
1. NOMBRE DEL MEDICAMENTO
Haloperidol Esteve 10 mg comprimidos Haloperidol Esteve 2 mg/ml gotas orales en solución Haloperidol Esteve 5 mg/ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Haloperidol Esteve 10 mg comprimidos Cada comprimido contiene 10 mg de haloperidol.
Haloperidol Esteve 2 mg/ml gotas orales en solución: Cada ml contiene 2 mg de haloperidol (20 gotas equivalen a 1 ml).
Excipientes: 1,875 mg deparahidroxibenzoato de metilo.
Haloperidol Esteve 5 mg/ml solución inyectable: Cada ml de solución inyectable contiene 5 mg de haloperidol.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Haloperidol Esteve 10 mg comprimidos: Comprimidos.
Comprimido blanco, circular, biconvexo, ranurado por una cara y anagrama “H-E” por la otra.
Haloperidol Esteve 2 mg /ml gotas orales en solución: Gotas orales en solución.
Solución clara e incolora.
Haloperidol Esteve 5 mg/ml solución inyectable: Solución inyectable.
Solución clara, incolora y transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Como neuroléptico en:
Delirios y alucinaciones en:
o esquizofrenia aguda y crónica o paranoia
o confusión aguda, alcoholismo (síndrome de Korsakoff)
Delirio hipocondríaco
Trastornos de la personalidad: paranoide, esquizoide, esquizotípica, antisocial, límite y otras personalidades
En el tratamiento de la agitación psicomotriz en:
Manía, demencia, retraso mental, alcoholismo
Trastornos de la personalidad: obsesivo-compulsiva, paranoide, histriónica y otras personalidades
Agitación, agresividad y conductas de evitación en pacientes geriátricos
Trastornos de la conducta y del carácter en niños
Movimientos coreicos
Hipo persistente
Tics, tartamudeo y síntomas del síndrome de Gilles de la Tourette y coreas relacionadas.
En anestesiología:
Premedicación y mezclas anestésicas.
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españolare median entos y productos sanitarios
Como antiemético en:
¡m
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos españoaóe medrcamentosy productos sanéanos
Náuseas y vómitos de diversa etiología. Haloperidol es el medicamento de elección cuando los medicamentos clásicos para el tratamiento de las náuseas y los vómitos no son suficientemente efectivos.
4.2 Posología y forma de administración
Haloperidol Esteve 5mg/ml solución inyectable está indicado únicamente para la administración intramuscular.
Las dosis que se sugieren a continuación son solo promedios y siempre se debe tratar de ajustar la dosis a la respuesta del paciente. Esto generalmente implica un aumento de la dosis durante la fase aguda y una reducción gradual durante la fase de mantenimiento, al objeto de determinar la mínima dosis eficaz. Solo se deberán administrar altas dosis en pacientes que no respondan adecuadamente a dosis bajas.
Uso en adultos:
Como neuroléptico:
Fase aguda: episodios agudos de esquizofrenia, delirium tremens, paranoia, confusión y síndrome de Korsakoff. Se administrarán 5-10 mg por vía intramuscular, esta dosis se repetirá cada hora hasta conseguir un control adecuado de los síntomas, hasta un máximo de 60 mg/día. Cuando se administre por vía oral se necesitará prácticamente el doble de la dosis antes mencionada.
Fase crónica: esquizofrenia, alcoholismo, trastornos de la personalidad. Se emplearán dosis de 1-3 mg tres veces al día por vía oral, que podrán aumentarse hasta 10-20 mg tres veces al día, en función de la respuesta.
En la agitación psicomotriz:
Fase aguda: manía, demencia, alcoholismo, trastornos de la personalidad, trastornos de la conducta y el carácter, hipo persistente, movimientos coreicos, tics, tartamudeo. Se emplearán dosis de 5-10 mg por vía intramuscular.
Fase crónica: Se emplearán dosis de 0,5-1 mg tres veces al día por vía oral, que podrán aumentarse hasta 2-3 mg tres veces al día en caso de que no se obtenga respuesta.
En el síndrome de Gilles de la Tourette la dosis de mantenimiento puede alcanzar los 10 mg diarios o más.
Como antiemético:
Vómito inducido de origen central: Se empleará una dosis de 5 mg por vía intramuscular.
Profilaxis del vómito postoperatorio: Se administrarán 2,5-5 mg por vía intramuscular al final de la intervención quirúrgica.
Uso en ancianos:
Se deberá iniciar el tratamiento empleando la mitad de la dosis indicada para adultos, y en caso necesario, se ajustará de acuerdo con los resultados obtenidos.
Uso en niños:
Se empleará una dosis de 0,1 mg/ 3 kg de peso corporal tres veces al día, que deberá ser ajustada en caso necesario.
En caso de fracaso terapéutico, no prolongar el tratamiento más de un mes.
Contraindicaciones
4.3
Hipersensibilidad al haloperidol o a alguno de los excipientes.
Estado comatoso.
Depresión del SNC producida por el alcohol u otros medicamentos depresores.
Enfermedad de Parkinson.
Lesión de los ganglios basales.
4.4 Advertencias y precauciones especiales de empleo
Se han comunicado casos, clasificados como raros, de muerte súbita en pacientes psiquiátricos en tratamiento con medicamentos antipsicóticos entre los que se incluye el haloperidol.
Poblaciones especiales:
El uso de antipsicóticos en pacientes ancianos con demencia, se ha asociado con un incremento de la mortalidad. Un metaanálisis de 17 ensayos clínicos con antipsicóticos atípicos controlados con placebo, con una duración modal de 10 semanas, puso de manifiesto un aumento de la mortalidad de 1,6 a 1,7 respecto a placebo. El índice de mortalidad en un ensayo clínico controlado típico, de 10 semanas de duración fue de aproximadamente 4,5 % para el grupo en tratamiento con el antipsicótico y de aproximadamente 2,6 % para el grupo placebo. Pese a que las causas de muerte fueron múltiples, fundamentalmente se relacionaron con acontecimientos cardiovasculares (insuficiencia cardiaca, muerte súbita) o infecciones (fundamentalmente. neumonía). Estudios observacionales sugieren que, de forma similar a lo que ocurre con los antipsicóticos atípicos, el tratamiento con antipsicóticos típicos puede producir un incremento de la mortalidad. No está claro hasta que punto los hallazgos de dichos estudios observacionales, relativos al aumento de la mortalidad, se pueden atribuir al uso de antipsicóticos en vez de a las características propias de los pacientes.
Se recomienda extremar la precaución en los niños (fundamentalmente si existe una infección aguda o deshidratación) ya que la aparición de reacciones distónicas graves es especialmente importante en esta edad. Puesto que haloperidol se metaboliza en el hígado, se recomienda precaución en pacientes con enfermedad hepática, ajustando la dosis según el grado de funcionalismo hepático. Asimismo, debe administrarse con precaución en pacientes ancianos debido a su mayor sensibilidad a la sedación e hipotensión, así como en enfermedades cardiovasculares graves y en la insuficiencia renal. En este último grupo de pacientes, se recomienda ajustar la dosis de haloperidol en base al grado de disfunción renal.
El ajuste de la dosis de haloperidol en estos grupos especiales de pacientes se realizará según criterio clínico.
Efectos cardiovasculares
Se han comunicado casos, clasificados como muy raros, de prolongación del QT y/o arritmias ventriculares, además de raros casos de muerte súbita con el uso de haloperidol. Estas reacciones adversas pueden ocurrir con mayor frecuencia cuando se emplean dosis elevadas en pacientes predispuestos.
Por este motivo, se recomienda precaución en pacientes en situaciones que lleven implícita una prolongación del QT (síndrome del QT prolongado, hipopotasemia, desequilibrio electrolítico, tratamiento con medicamentos que producen prolongación del QT, enfermedades cardiovasculares, antecedentes familiares de prolongación del QT), especialmente si haloperidol se administra por vía intramuscular. El riesgo de prolongación del QT y/o de sufrir arritmias ventriculares puede verse incrementado cuando se usan dosis elevadas. En caso de administración intramuscular se debe tener especial precaución por la posibilidad de aparición de alteraciones graves del ritmo cardiaco.
Haloperidol Esteve 5 mg/ml solución inyectable está indicado únicamente para la administración intramuscular.
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos españoaóe medrcamentosy productos sanéanos
IBj an
Se han notificado casos aislados de taquicardia e hipotensión en pacientes en tratamiento con haloperidol.
Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con medicamentos antipsicóticos presentan frecuentemente factores de riesgo para el TEV, se deben identificar estos factores antes y durante el tratamiento con Haloperidol Esteve y adoptar medidas preventivas.
Síndrome neuroléptico maligno
De forma común a lo que ocurre con otros medicamentos antipsicóticos, el uso de haloperidol se ha asociado con la aparición de síndrome neuroléptico maligno, una respuesta idiosincrásica rara caracterizada por hipertermia, rigidez muscular generalizada, inestabilidad autonómica y alteración de la conciencia. La hipertermia es frecuentemente un signo temprano de este síndrome. Se deberá suspender inmediatamente el tratamiento antipsicótico e instaurar una terapia de soporte adecuada, así como realizar una monitorización cuidadosa.
Discinesia tardía
Al igual que ocurre con otros antipsicóticos, en algunos pacientes en tratamientos prolongados, o tras la suspensión del tratamiento, puede aparecer discinesia tardía. El síndrome se caracteriza principalmente por la aparición de movimientos rítmicos involuntarios de la lengua, la cara, la boca o la mandíbula, que pueden ser permanentes en algunos pacientes. Este síndrome puede ser enmascarado cuando se reinstaura el tratamiento, cuando se aumenta la dosis o cuando se cambia a otro antipsicótico. Se debe suspender el tratamiento tan pronto como sea posible.
Síntomas extrapiramidales
De forma común a lo que ocurre con todos los neurolépticos, durante el tratamiento con haloperidol pueden producirse síntomas extrapiramidales, p.ej. temblor, rigidez, hipersalivación, bradicinesia, acatisia, distonía aguda.
Siempre que sea necesario se prescribirán antiparkinsonianos anticolinérgicos, pero no deberán prescribirse de forma rutinaria como medida profiláctica. En caso de requerir medicación antiparkinsoniana concomitante, deberá continuarse tras la discontinuación de haloperidol en caso de que su excreción sea más rápida que la de este último, para evitar el desarrollo o empeoramiento de los síntomas extrapiramidales. El médico deberá tener en cuenta el posible incremento de la presión intraocular cuando se administren anticolinérgicos, incluyendo antiparkinsonianos, concomitantemente con haloperidol.
Crisis/convulsiones
Existen evidencias de que haloperidol puede actuar como desencadenante de convulsiones. Por tanto, se recomienda precaución en pacientes con historia conocida de epilepsia u otras alteraciones predisponentes a las convulsiones (por ejemplo, abstinencia alcohólica y daño cerebral).
Trastornos hepatobiliares
Puesto que haloperidol se metaboliza en el hígado, se recomienda precaución en pacientes con enfermedad hepática, ajustando la dosis según el grado de funcionalismo hepático. Se han notificado casos aislados de alteraciones de la función hepática o hepatitis colestásica fundamentalmente.
Trastornos relacionados con el sistema endocrino
La tiroxina puede facilitar la toxicidad de haloperidol. El tratamiento antipsicótico en pacientes con hipertiroidismo solo debe utilizarse con mucha precaución, debiendo acompañarse siempre de un tratamiento para lograr un estado eutiroideo.
Los efectos hormonales de los neurolépticos antipsicóticos incluyen hiperprolactinemia, que puede causar galactorrea, ginecomastia, y oligo o amenorrea. Se han notificado casos, muy raros, de hipoglucemia y síndrome de secreción inadecuada de hormona antidiurética.
Consideraciones adicionales
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españolare median entos y productos sanitarios
úii
En la esquizofrenia, la respuesta al tratamiento con medicamentos antipsicóticos puede ser tardía.
También en caso de discontinuación del tratamiento, la recurrencia de los síntomas puede no ser aparente durante varias semanas o meses. Síntomas agudos de retirada del medicamento como náuseas, vómitos e insomnio han sido descritos raramente después de una suspensión brusca de altas dosis de antipsicóticos, pudiendo producirse recaídas, por lo que se recomienda una suspensión gradual del medicamento.
Como con todos los agentes antipsicóticos, haloperidol no debe usarse aisladamente cuando la depresión sea predominante. Puede combinarse con antidepresivos para tratar aquellas alteraciones en las que coexisten psicosis y depresión.
No se recomienda la exposición al sol durante el tratamiento ya que pueden aparecer reacciones de fotosensibilidad.
Por sus efectos anticolinérgicos, aunque mínimos, pueden agravarse patologías como el glaucoma de ángulo cerrado, la hipertrofia prostática o la retención urinaria.
La administración por vía parenteral (inyectables) puede producir dolor e irritación en el lugar de administración. Se han descrito algunos casos de formación de nódulos después de la administración por vía intramuscular.
Advertencias sobre excipientes
Haloperidol Esteve 2 mg/ml gotas orales en solución
Puede producir reacciones alérgicas (posiblemente retardadas) y, excepcionalmente, broncoespasmo porque contiene parahidroxibenzoato de metilo.
4.5 Interacción con otros medicamentos y otras formas de interacción
Como con otros medicamentos antipsicóticos, se recomienda precaución cuando se prescriba haloperidol junto con medicamentos que prolonguen el intervalo QT.
Haloperidol se metaboliza a través de varias rutas metabólicas, incluyendo la glucuronización y la oxidación a través del sistema enzimático citocromo P450 (CYP 3 A4 o CYP 2D6). La inhibición de estas rutas metabólicas por otros medicamentos o la disminución de la actividad enzimática del CYP 2D6 puede dar lugar a un aumento de la concentración de haloperidol y en consecuencia a un aumento del riesgo de sufrir reacciones adversas, incluyendo la prolongación del QT. En estudios farmacocinéticos, se han comunicado aumentos de ligeros a moderados de las concentraciones de haloperidol cuando se ha administrado de forma concomitante con medicamentos caracterizados como sustratos o inhibidores de las isoenzimas CYP 3 A4 o CYP 2D6, tales como itraconazol, nefazodona, buspirona, venlafaxina, alprazolam, fluvoxamina, quinidina, fluoxetina, sertralina, clorpromazina y prometazina. Un descenso de la actividad de la enzima CYP 2D6 puede producir un aumento de las concentraciones de haloperidol. Se han observado aumentos en el QT cuando haloperidol ha sido administrado con una combinación de los inhibidores metabólicos ketoconazol (400 mg/día) y paroxetina (20 mg /día). Puede ser necesario reducir la dosis de haloperidol.
Debe ser administrado con precaución cuando se use en combinación con medicamentos que produzcan un desequilibrio electrolítico
Efecto de otros medicamentos sobre Haloperidol Esteve
Cuando al tratamiento con haloperidol se añaden tratamientos prolongados con inductores enzimáticos, tales como carbamazepina, fenobarbital, rifampicina, se produce una reducción significativa de los niveles plasmáticos de haloperidol. Por lo tanto, durante el tratamiento combinado se deberá ajustar la dosis de Haloperidol Esteve cuando sea necesario. Tras suspender estos medicamentos puede ser necesario reducir la dosis de Haloperidol Esteve.
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agenos espádete óe medeamentosy productos sanitarios
zk$a
:m
El valproato sódico, medicamento con conocido efecto inhibidor de la glucuronización, no afecta a las concentraciones plasmáticas de haloperidol.
Efecto de Haloperidol Esteve sobre otros medicamentos
De forma común a lo que ocurre con todos los neurolépticos, Haloperidol puede potenciar la depresión del Sistema Nervioso Central (SNC) producida por otros depresores del SNC, incluyendo el alcohol, hipnóticos, sedantes o analgésicos potentes. Se ha descrito un efecto aumentado sobre el SNC cuando se ha usado en combinación con metildopa.
Haloperidol puede antagonizar la acción de adrenalina y otros simpaticomiméticos y revertir el efecto hipotensor de los bloqueantes adrenérgicos como la guanetidina.
Haloperidol puede reducir el efecto antiparkinsoniano de levodopa.
El haloperidol es un inhibidor del isoenzima CYP 2D6. Haloperidol inhibe el metabolismo de los antidepresivos tricíclicos, produciendo un aumento de los niveles plasmáticos de estos medicamentos.
Otras formas de interacción
Se han notificado en raras ocasiones los siguientes síntomas tras la administración concomitante de litio y haloperidol: encefalopatía, síntomas extrapiramidales, discinesia tardía, síndrome neuroléptico maligno, trastorno del tronco encefálico, síndrome cerebral agudo y coma. La mayoría de estos síntomas fueron reversibles. Aún no está claro si estos casos representan una entidad clínica diferente.
Sin embargo, si estos síntomas aparecen, se recomienda suspender inmediatamente el tratamiento en pacientes en tratamiento concomitante con litio y Haloperidol Esteve.
Se ha notificado un antagonismo del efecto del anticoagulante fenindiona (anticoagulante).
4.6 Embarazo y lactancia
Los estudios en animales han mostrado que haloperidol tiene efectos teratógenos (ver sección 5.3).
Los neonatos expuestos a fármacos antipsicóticos (incluyendo haloperidol) durante el tercer trimestre del embarazo, tienen riesgo de presentar síntomas extrapiramidales y/o síntomas de retirada que pueden variar en severidad tras el parto. Estos síntomas en neonatos pueden incluir agitación, hipertonia, hipotonia, temblor, somnolencia, distress respiratorio, o trastornos alimentarios.
No se ha observado un aumento significativo de anomalías fetales en estudios con haloperidol en una población amplia. Se han comunicado casos aislados de defectos congénitos después de la exposición fetal a haloperidol, mayormente en combinación con otros medicamentos. Haloperidol Esteve sólo deberá ser usado durante el embarazo cuando el beneficio potencial justifique el posible riesgo para el feto.
Haloperidol se excreta en la leche materna. Si se considera esencial el uso de Haloperidol Esteve se deberán evaluar los beneficios de la lactancia frente a los posibles riesgos. Se han observado síntomas extrapiramidales en lactantes de madres tratadas con haloperidol.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Haloperidol puede producir cierto grado de sedación o deterioro del estado de alerta, particularmente con dosis altas y al principio del tratamiento. Estos efectos pueden ser potenciados por el alcohol.
Debe aconsejarse a los pacientes que no conduzcan o manipulen maquinaria durante el tratamiento hasta conocer la susceptibilidad a estos efectos.
4.8 Reacciones adversas
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos españoaóe medrcamentosy productos sanéanos
úfe
an
Se evaluó la seguridad de haloperidol en 284 pacientes que participaron en 3 estudios controlados con placebo, y en 1.295 pacientes que participaron en 16 ensayos clínicos doble ciego controlados con comparador activo, todos ellos en tratamiento con haloperidol. La seguridad de haloperidol decanoato fue evaluada en 410 sujetos que participaron en 3 ensayos clínicos con comparador activo (uno comparando haloperidol con flufenazina y dos comparando la formulación decanoato con la formulación oral), 9 ensayos clínicos abiertos y 1 dosis-respuesta.
En base a los datos de seguridad obtenidos de los ensayos clínicos anteriores, las reacciones adversas comunicadas con mayor frecuencia (% incidencia) fueron: trastorno extrapiramidal (34), insomnio (19), agitación (15), hipercinesia (13), cefalea (12), trastorno psicótico (9), depresión (8), peso aumentado (8), hipotensión ortostática (7) y somnolencia (5).
Incluyendo las reacciones adversas mencionadas anteriormente, las siguientes reacciones adversas han sido observadas en ensayos clínicos así como notificadas tras la comercialización de haloperidol y haloperidol decanoato.
Las frecuencias expuestas siguen la siguiente convención:
Muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Trastornos de la sangre y del sistema linfático Poco frecuentes: leucopenia
Frecuencia no conocida: agranulocitosis, neutropenia, pancitopenia, trombocitopenia
Trastornos del sistema inmunológico Poco frecuentes: hipersensibilidad Frecuencia no conocida: reacción anafiláctica
Trastornos endocrinos Raras: hiperprolactinemia
Frecuencia no conocida: secreción inadecuada de hormona antidiurética
Trastornos del metabolismo y de la nutrición Frecuencia no conocida: hipoglucemia
Trastornos psiquiátricos
Muy frecuentes: agitación, insomnio
Frecuentes: depresión, trastorno psicótico
Poco frecuentes: estado confusional, libido disminuida, pérdida de la libido, inquietud Trastornos del sistema nervioso
Muy frecuentes: trastorno extrapiramidal, hipercinesia, cefalea
Frecuentes: discinesia tardía, crisis oculogíricas, distonía, discinesia, acatisia, bradicinesia, hipocinesia, hipertonía, somnolencia, fascies parkinsoniana, temblor, mareo Poco frecuentes: convulsión, parkinsonismo, acinesia, rigidez en rueda dentada, sedación, contracciones musculares involuntarias
Raras: disfunción motora, síndrome neuroléptico maligno, nistagmus
Trastornos oculares Frecuentes: deterioro visual Poco frecuentes: visión borrosa
Trastornos cardiacos Poco frecuentes: taquicardia
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos españoaóe medrcamentosy productos sanéanos
IBj an
Frecuencia no conocida: fibrilación ventricular, Torsade de pointes, taquicardia ventricular, extrasístoles
Trastornos vasculares
Frecuentes: hipotensión ortostática, hipotensión
Frecuencia no conocida: se han notificado casos de tromboembolismo venoso incluyendo embolia pulmonar y casos de trombosis venosa profunda con medicamentos antipsicóticos.
Trastornos respiratorios, torácicos y mediastínicos Poco frecuentes: disnea Raras: broncoespasmo
Frecuencia no conocida: edema laringeo, laringoespasmo Trastonos gastrointestinales
Frecuentes: estreñimiento, boca seca, hipersecreción salival, náuseas, vómitos
Trastornos hepatobiliares
Frecuentes: prueba anormal de función hepática
Poco frecuentes: hepatitis, ictericia
Frecuencia no conocida: insuficiencia hepática aguda, colestasis
Trastornos de la piel y del tejido subcutáneo Frecuentes: erupción
Poco frecuentes: reacción de fotosensibilidad, urticaria, prurito, hiperhidrosis Frecuencia no conocida: vasculitis leucocitoclástica, dermatitis exfoliativa
Trastornos musculoesqueléticos y del tejido conjuntivo
Poco frecuentes: torticolis, rigidez muscular, espasmos musculares, rigidez musculoesquelética Raras: trismo, sacudidas musculares
Trastornos renales y urinarios Frecuentes: retención urinaria
Embarazo, puerperio y condiciones perinatales:
Frecuencia no conocida: síndrome de supresión de fármacos en neonatos (ver sección 4.6)
Trastornos del aparato reproductor y de la mama Frecuentes: disfunción eréctil
Poco frecuentes: amenorrea, dismenorrea, galactorrea, molestia en las mamas, dolor en las mamas Raras: menorragia, trastorno menstrual, disfunción sexual Frecuencia no conocida: ginecomastia, priapismo
Trastornos generales y alteraciones en el lugar de administración Poco frecuentes: alteración de la marcha, hipertermia, edema Frecuencia no conocida: muerte súbita, edema de cara, hipotermia
Exploraciones complementarias
Frecuentes: peso aumentado, peso disminuido
Raras: QT prolongado en el electrocardiograma,
4.9 Sobredosis
Síntomas
Las manifestaciones consisten en una exageración de los efectos farmacológicos así como de las reacciones adversas. Los síntomas más prominentes son reacciones extrapiramidales graves, hipotensión y sedación. Una reacción extrapiramidal se manifiesta por rigidez muscular y temblor generalizado o localizado. Es también posible que aparezca hipertensión antes que hipotensión.
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agenca española óe medcamentoisy productos san ••aros
úii
En casos extremos, el paciente podría parecer comatoso con depresión respiratoria e hipotensión que podría ser lo suficientemente grave como para producir un estado similar al estado de shock. Debe también considerarse el riesgo de arritmias ventriculares, posiblemente asociadas con una prolongación del QT.
Tratamiento
El tratamiento es de soporte puesto que no existe antídoto específico. Se aconseja el lavado gástrico o la inducción de la emesis, a menos que el paciente se encuentre confuso, comatoso o tenga convulsiones.
En los pacientes comatosos debe establecerse una vía aérea mediante un tubo orofaríngeo o endotraqueal. La depresión respiratoria puede precisar respiración asistida.
Deben monitorizarse los signos vitales y el ECG hasta que éste se normalice. Las arritmias graves deben tratarse con fármacos antiarrítmicos apropiados.
La hipotensión y el colapso circulatorio pueden ser contrarrestados con la administración intravenosa de fluidos, plasma o concentrados de albúmina y agentes vasopresores como dopamina o noradrenalina. No debe utilizarse adrenalina puesto que puede producir hipotensión ortostática.
En caso de reacciones extrapiramidales graves, deben administrarse fármacos antiparkinsonianos por vía parenteral (p.ej. mesilato de benzotropina 1-2 mg IM oIV).
5. PROPIEDADES FARMACOLÓGICAS 5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antipsicóticos. Derivados de butirofenona, código ATC: N05AD01
Haloperidol es un neuroléptico perteneciente a la familia de las butirofenonas. Es un potente antagonista de los receptores dopaminérgicos cerebrales, y por consiguiente, está clasificado entre los neurolépticos de gran potencia. Haloperidol no posee actividad antihistamínica ni anticolinérgica.
Como consecuencia directa del bloqueo dopaminérgico a nivel central, haloperidol tiene un efecto potente sobre los trastornos delirantes y las alucinaciones (probablemente debido a la acción sobre la neurotransmisión dopaminérgica en los sistemas límbico y mesocortical) y una actividad sobre los ganglios basales (haz nigroestriado). Produce también una potente sedación psicomotriz, que le hace apropiado para el tratamiento de la manía y otros estados de agitación (ver sección 4.1).
La actividad sobre los ganglios basales probablemente sea la causa de los efectos motores extrapiramidales (distonía, acatisia y parkinsonismo).
Los efectos dopaminérgicos a nivel periférico explican la actividad frente a las náuseas y los vómitos (vía zona gatillo quimiorreceptora), la relajación de los esfínteres gastrointestinales y el aumento de la liberación de prolactina (por medio de la inhibición de la actividad del factor inhibidor de prolactina a nivel de la adenohipófisis).
5.2 Propiedades farmacocinéticas
Absorción
La biodisponibilidad, tras la administración oral, es del 60-70%. Las concentraciones plasmáticas máximas de haloperidol se alcanzan entre las 2 y las 6 horas tras la administración oral y alrededor de 20 minutos después de la administración intramuscular.
Distribución
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agenos espádete óe medeamentosy productos sanitarios
1¡fe
on
La unión a proteínas plasmáticas es del 92%. El volumen de distribución en el estado estacionario es grande (7,9±2,5 L/kg). Haloperidol atraviesa fácilmente la barrera hematoencefálica.
Metabolismo
Haloperidol se metaboliza a través de varias rutas metabólicas incluyendo el sistema enzimático citocromo P450 (particularmente CYP 3 A4 o CYP 2D6) y glucuronidación.
Eliminación
La semivida plasmática media (eliminación terminal) es de 24 horas (variando entre 12 y 38 horas) tras la administración oral y de 21 horas (variando entre 13 y 36 horas) tras la administración intramuscular. La excreción se produce a través de las heces (60%) y la orina (40%). Alrededor del 1% de la dosis ingerida se excreta de forma inalterada a través de la orina.
Concentraciones terapéuticas
Se ha sugerido que para obtener respuesta terapéutica se requieren concentraciones plasmáticas de haloperidol de 4 pg/L a 20-25 pg/L (como límite máximo)
5.3 Datos preclínicos sobre seguridad
Los datos de estudios preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad, genotoxicidad y carcinogenicidad. En roedores, la administración de haloperidol mostró un descenso de la fertilidad, teratogenicidad limitada, así como efectos embriotóxicos.
En varios estudios in vivo publicados, se encontró que haloperidol era capaz de bloquear el canal HERG cardiaco. En un número de estudios in vivo, la administración intravenosa de haloperidol en algunos modelos animales produjo un aumento significativo del QT, a dosis de aproximadamente 0,3 mg/kg IV, obteniéndose unas concentraciones plasmáticas máximas 3 a 7 veces las concentraciones plasmáticas eficaces en humanos de 4 a 20 ng/ml. Estas dosis intravenosas capaces de prolongar el QT no causaron arritmias. En algunos estudios la administración de dosis intravenosas mayores, de 1 a 5 mg/kg de haloperidol, produjeron una prolongación del QT y/o arritmias ventriculares, con valores de concentraciones plasmáticas máximas de 19 a 68 veces las concentraciones plasmáticas eficaces en humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Haloperidol Esteve 10 mg comprimidos: almidón de maíz, hidrógenofosfato de calcio dihidrato y estearato de calcio.
Haloperidol Esteve 2 mg/ml gotas orales en solución: ácido láctico, parahidroxibenzoato de metilo (E-218) y agua purificada.
Haloperidol Esteve 5 mg/ml solución inyectable: ácido láctico y agua para preparaciones inyectables.
6.2 Incompatibilidades Ninguna conocida
6.3 Periodo de validez
Haloperidol Esteve 10 mg comprimidos: 3 años Haloperidol Esteve 2 mg/ml gotas orales en solución 3 años Haloperidol Esteve 5 mg/ml solución inyectable: 5 años
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos españoaóe medrcamentosy productos sanéanos
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Haloperidol Esteve 10 mg comprimidos se presenta en blister de PVC/ aluminio, en envases conteniendo 30 comprimidos.
Haloperidol Esteve 2 mg/ml gotas orales en solución se presenta en frasco de polietileno de alta y baja densidad, con obturador cuentagotas de polietileno de baja densidad, y tapón children proof de polietileno de alta densidad, conteniendo 15 ml o 30 ml.
Haloperidol Esteve 5 mg/ml solución inyectable se presenta en ampolla de vidrio clase hidrolítica I color topacio, en envases conteniendo 5 ampollas de 1 ml.
6.6 Precauciones especiales de eliminación y otras manipulaciones Gotas orales en solución
Haloperidol Esteve gotas orales en solución se presenta en un frasco gotero con tapón a prueba de niños, cuyas instrucciones de apertura son las siguientes:
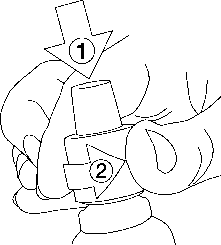
Presionar el tapón de plástico hacia abajo mientras se gira en sentido contrario a las agujas del reloj. Una vez quitado el tapón se puede obtener el número de gotas necesario, por medio del cuentagotas acoplado en el frasco.
Ampollas
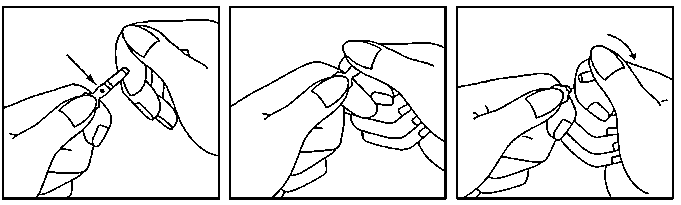
1. Mantener la ampolla entre el dedo pulgar e índice, dejando libre el extremo superior de la ampolla.
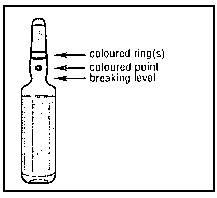
2. Con la otra mano sostener el extremo superior de la ampolla colocando el dedo índice contra el cuello de la ampolla, y el pulgar sobre el punto de color, paralelo al/ a los anillo(s) de identificación de color.
3. Manteniendo el pulgar sobre el punto, romper firmemente el extremo superior de la ampolla mientras sostiene con firmeza la otra parte de la ampolla en la mano.
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Aíjíieaesoai&aíB matee amantes y 30*jc1cs sai;.teros
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pensa Pharma, S.A.U
Jorge Comín (médico pediatra), 3
46015- Valencia (Valencia)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Haloperidol Esteve 10 mg comprimidos: 58.343 Haloperidol Esteve 2 mg/ml gotas orales en solución: 58.355 Haloperidol Esteve 5 mg/ml solución inyectable: 58.345
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
01 Noviembre 1994 / 31 Agosto 2004
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiemre de 2012
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Aíjíieaesoai&aíB matee amantes y 30*jc1cs sai;.teros