Fydrane 0,2 Mg/Ml + 3,1 Mg/Ml + 10 Mg/Ml Solucion Inyectable
Prospecto: información para el usuario
FYDRANE 0,2 mg/ml +3,1 mg/ml +10 mg/ml, solución inyectable
tropicamida /fenilefrina hidrocloruro / lidocaína hidrocloruro
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es FYDRANE y para qué se utiliza
2. Qué necesita saber antes de empezar a usar FYDRANE
3. Cómo usar FYDRANE
4. Posibles efectos adversos
5. Conservación de FYDRANE
6. Contenido del envase e información adicional
1. Qué es FYDRANE y para qué se utiliza Qué es FYDRANE
Este medicamento es una solución para inyectar en el ojo.
Contiene tres principios activos:
bloquean el paso de los impulsos a a un grupo de medicamentos que
• Tropicamida que pertenece al grupo de medicamentos que través de los nervios (conocidos como anticolinérgicos),
• Fenilefrina (como fenilefrina hidrocloruro) que pertenece mimetizan los efectos de los impulsos transmitidos a través de determinados nervios (que pertenecen a los alfa-simpaticomiméticos),
• Lidocaína (como lidocaína hidrocloruro) que pertenece a un grupo de medicamentos llamados anestésicos locales de tipo amida.
Para qué se utiliza
Este medicamento se utiliza únicamente en adultos.
Será administrado por su cirujano oftalmólogo mediante una inyección en el ojo al inicio de la cirugía de cataratas (opacidad del cristalino) para dilatar la pupila de su ojo (midriasis) y obtener anestesia en su ojo durante el procedimiento quirúrgico.
2. Qué necesita saber antes de empezar a usar FYDRANE No le debe ser administrado FYDRANE:
- si es alérgico a la tropicamida, fenilefrina hidrocloruro y/o lidocaína hidrocloruro o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6),
- si es alérgico a anestésicos de tipo amida,
- si es alérgico a derivados de la atropina.
Advertencias y precauciones
FYDRANE no está recomendado:
• en cirugía de cataratas combinada con cierto tipo de cirugía del ojo (vitrectomía),
• si la parte anterior (cámara anterior) de su ojo es poco profunda,
• si ha sufrido alguna vez un aumento agudo de la presión ocular (glaucoma agudo de ángulo cerrado).
Consulte con su médico si tiene:
• presión arterial elevada (hipertensión)
• engrosamiento de las paredes arteriales (aterosclerosis)
• cualquier enfermedad cardiaca y, particularmente, si ésta afecta a la frecuencia cardiaca,
• una contraindicación a medicamentos que aumentan la presión arterial (aminas vasopresoras) por vía sistémica,
• glándula tiroides hiperactiva (hipertiroidismo),
• trastornos de la glándula prostática,
• convulsiones (epilepsia),
• cualquier enfermedad del hígado o problemas de riñón,
• cualquier problema respiratorio,
• pérdida de función muscular y debilidad (miastenia gravis).
Uso de FYDRANE con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Este medicamento no debe ser utilizado:
• durante el embarazo
• durante la lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
FYDRANE tiene una influencia moderada sobre la capacidad de conducir y utilizar máquinas. Por consiguiente, no debe conducir y/o utilizar máquinas hasta que su visión sea normal.
FYDRANE contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, considerándose por tanto “exento de sodio”.
3. Cómo usar FYDRANE
Sólo debe ser administrado este medicamento si ha demostrado, en una visita previa, una dilatación pupilar satisfactoria con un midriático tópico.
Dosis y método de administración
• FYDRANE solución para inyección debe ser administrado por un cirujano oftalmólogo, con anestesia local, al inicio de la cirugía de cataratas.
• La dosis recomendada es de 0,2 ml de solución en una única inyección. No deben inyectarse dosis adicionales ya que no se han demostrado efectos acumulativos y debido a que se ha observado un aumento en la pérdida de células endoteliales (células de la capa que recubren la superficie posterior de la córnea).
• La misma dosis es utilizada en adultos y en personas de edad avanzada.
Si le administran demasiada cantidad, o demasiada poca, FYDRANE:
Su medicación será administrada por un cirujano oftalmólogo. Es improbable que le administren una sobredosis.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede tener efectos adversos, aunque no todas las personas los sufran.
Las complicaciones conocidas más graves ocurren durante o después de la cirugía de cataratas:
Poco frecuentes: pueden afectar a hasta 1 de cada 100 personas
• Lesión en la lente (rotura de la cápsula posterior),
• Inflamación de la retina (edema macular cistoide).
Por favor, solicite atención médica urgente en estos casos.
Otros efectos adversos:
Poco frecuentes: pueden afectar a hasta 1 de cada 100 personas
• Dolor de cabeza,
• Inflamación de la córnea (queratitis), aumento de la presión en el ojo, enrojecimiento del ojo (hiperemia ocular),
• Presión arterial elevada (hipertensión).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www. notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de FYDRANE
Mantener fuera de la vista y del alcance de los niños.
No use este medicamento después de la fecha de caducidad que aparece en la caja, blíster y ampolla después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Para el uso en un único ojo. Este medicamento debe ser utilizado inmediatamente después de abrir la ampolla.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda, pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de FYDRANE
- Los principios activos son tropicamida 0,04 mg, fenilefrina hidrocloruro 0,62 mg y lidocaína hidrocloruro 2 mg por cada dosis de 0,2 ml, equivalente a 0,2 mg de tropicamida, 3,1 mg de fenilefrina hidrocloruro y 10 mg de lidocaína hidrocloruro para 1 ml.
- Los demás componentes son: cloruro de sodio, fosfato disódico dodecahidrato, fosfato disódico dihidrato, edetato de disodio y agua para preparaciones inyectables.
Aspecto del producto y tamaño del envase
FYDRANE es una solución para inyección transparente, de color amarillo a ligeramente pardusco y prácticamente libre de partículas visibles, envasado en una ampolla de vidrio topacio de 1 ml. Cada ampolla contiene 0,6 ml de la solución para inyección y se presenta en un blíster sellado de papel/PVC.
Cada envase contiene 1, 20 ó 100 ampollas (con una aguja con filtro de 5 micrómetros para ser utilizado únicamente para extraer el contenido del vial). Todos los componentes son para un único uso.
No todos los tamaños de envase pueden estar comercializados.
Titular de la autorización de comercialización
LABORATOIRES THEA
RUE LOUIS BLÉRIOT, 12
F-63017 CLERMONT-FERRAND CEDEX 2
FRANCIA
Responsable de la fabricación
DELPHARM TOURS
RUE PAUL LANGEVIN
37170 CHAMBRAY LES TOURS
FRANCIA
O
LABORATOIRES THEA
RUE LOUIS BLÉRIOT, 12
F-63017 CLERMONT-FERRAND CEDEX 2
FRANCIA
Representante local:
LABORATORIOS THEA, S.A.
Pg Sant Joan, 91 08009 Barcelona
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Austria, Bélgica, Bulgaria, Chipre, Croacia, República Checa, Dinamarca, Finlandia, Francia, Alemania, Grecia, Islandia, Italia, Luxemburgo, Holanda, Polonia, Portugal, Rumanía, República Eslovaca, Eslovenia,
Suecia, Reino Unido...........................................................Mydrane
Irlanda,España..............................................................................................Fydrane
Noruega.............................................................................................................Mydane
Fecha de la última revisión de este prospecto: Julio 2015
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS): http://www.aemps.es/
Esta información está destinada únicamente a profesionales del sector sanitario:
Incompatibilidades
En la literatura no se han notificado incompatibilidades de los principios activos con la mayoría de productos utilizados en la cirugía de cataratas, y tampoco durante los ensayos clínicos. Para los viscoelásticos habituales, esto ha sido también confirmado por pruebas de interacción farmacológica.
Advertencias
No utilizar si el blíster está dañado o roto. Abrir únicamente en condiciones de asepsia. La esterilidad del contenido del blíster está garantizada.
Cómo preparar y administrar FYDRANE
Uso único de la solución para un ojo por vía intracameral únicamente.
FYDRANE debe administrarse mediante inyección intraocular en la cámara anterior del ojo (inyección intracameral), por un cirujano oftalmólogo, en las condiciones asépticas recomendadas para la cirugía de cataratas.
Antes de la inyección intracameral, la solución debe ser visualmente inspeccionada y sólo debe ser utilizada si es una solución transparente con un ligero color amarillo a ligeramente pardusco y prácticamente libre de partículas visibles.
ÍP.
L*--»
m
La dosis recomendada es de 0, 2 ml de FYDRANE; no se debe inyectar una dosis adicional ya que no se han demostrado efectos acumulativos significativos y porque se observó un aumento de pérdida de células del endotelio.
El producto debe ser utilizado inmediatamente después de abrir la ampolla y no debe ser reutilizado para el otro ojo o para cualquier otro paciente.
Para preparar FYDRANE para la administración intracameral, siga por favor las siguientes instrucciones:
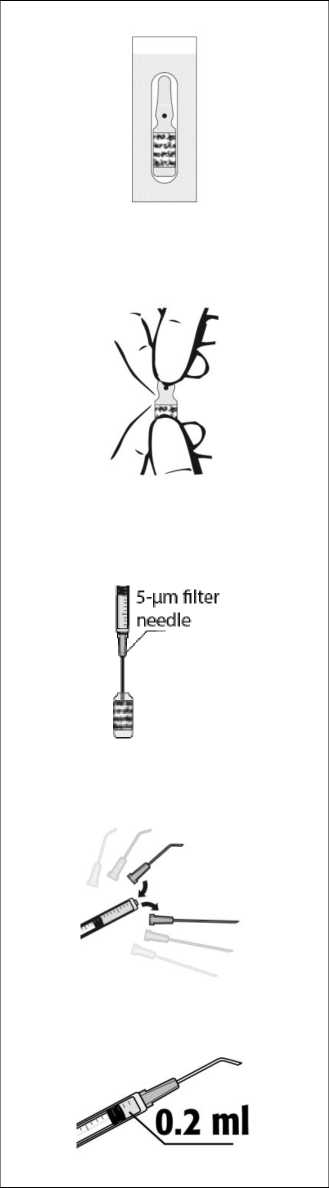
1. Inspeccionar el blíster sin abrir para asegurarse de que está intacto. Abrir el blíster desprendiendo la lámina.
2. Abrir la ampolla que contiene el medicamento. Para abrir la ampolla OPC (One Point Cut, único punto de abertura) proceder del modo siguiente: sostener la parte inferior de la ampolla con el pulgar apuntando al punto de color. Sujetar la parte superior de la ampolla con la otra mano y, colocando el pulgar en el punto de color, ejercer presión hacia atrás para romper el vidrio por el corte existente bajo dicho punto.
3. Colocar la aguja estéril con filtro de 5 pm (suministrada) en una jeringa estéril. Retirar el capuchón protector de la aguja estéril con filtro de 5 pm y extraer al menos 0,2 ml de solución inyectable de la ampolla a la jeringa.
4. Desconectar la aguja de la jeringa y acoplar la jeringa a una cánula adecuada para la cámara anterior.
5. Con cuidado, expulsar el aire de la jeringa. Ajustar a 0,2 ml. La jeringa está lista para la inyección.
¡m
6. Inyectar lentamente el volumen de 0,2 ml de la jeringa en la cámara anterior del ojo, mediante una única inyección, a través del puerto lateral o el puerto principal.
Después de su uso, eliminar debidamente la solución restante. No debe conservarse para un uso posterior.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. Desechar las agujas utilizadas en un contenedor para materiales punzantes.
7 de 7