Foscan 1 Mg/Ml Solucion Inyectable
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Fosean 1 mg/ml solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 1 mg de temoporfina.
Excipientes:
Cada ml contiene 376 mg de etanol anhidro y 560 mg de propilenglicol. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable Solución violeta oscuro
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Foscan está indicado para el tratamiento paliativo de pacientes con carcinoma avanzado de células escamosas en la cabeza y el cuello, que hayan fracasado a terapias anteriores y resulten inadecuados para radioterapia, cirugía o quimioterapia sistémica.
4.2 Posología y forma de administración
La terapia fotodinámica de Foscan solo debe administrarse en centros oncológicos especializados en los cuales un equipo multidisciplinario evalúa el tratamiento del paciente, y bajo la supervisión de médicos con experiencia en la terapia fotodinámica.
Posología
La dosis es de 0,15 mg/kg peso corporal.
Población pediátrica
No existe indicación relevante para el uso de Foscan en la población pediátrica.
Forma de administración
Foscan se administra a través de una cánula intravenosa residente en una vena proximal grande de una extremidad, preferiblemente en la fosa antecubital, como una sola inyección intravenosa lenta a lo largo de un mínimo de 6 minutos. La permeabilidad de la cánula residente debe ser ensayada antes de la inyección, y hay que adoptar todas las precauciones posibles contra la extravasación (ver sección 4.4).
El color púrpura oscuro de la solución, junto con los viales de color ámbar, hace imposible realizar una comprobación visual en busca de partículas. Por lo tanto, hay que emplear un filtro en línea como medida de precaución, el cual se incluye en el paquete. Foscan no debe ser diluido o lavado con cloruro sódico u otra solución acuosa.
La dosis necesaria de Foscan se administra mediante inyección intravenosa lenta, durante un tiempo mínimo de 6 minutos. 96 horas después de la administración de Foscan, el lugar del tratamiento ha de ser iluminado con luz a 652 nm de una fuente de láser aprobada. Debe aplicarse la luz a toda la
superficie del tumor por medio de una fibra óptica de microlente aprobada. Siempre que sea posible, la zona iluminada debe extenderse más allá del margen del tumor en una distancia de 0,5 cm.
La luz no debe administrarse antes de 90 horas ni después de 110 horas de la inyección de Foscan.
La dosis de luz incidente es de 20 J/cm2, aplicada con una irradiancia de 100 mW/cm2 a la superficie del tumor, lo cual supone un tiempo de iluminación de unos 200 segundos.
Cada campo ha de ser iluminado solo una vez en cada tratamiento. Se pueden iluminar múltiples campos no solapados. Hay que asegurarse que ninguna región de tejido recibe una dosis de luz superior a la especificada. Los tejidos fuera del área objetivo deben ser protegidos completamente para evitar la fotoactivación por luz dispersada o reflejada.
Se puede aplicar un segundo curso de tratamiento, a elección del médico que aplica el tratamiento, en pacientes en los que se considere adecuada una necrosis y eliminación adicional del tumor, con un intervalo mínimo recomendado de 4 semanas entre tratamientos.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes
• Porfiria u otras enfermedades exacerbadas por la luz
• Hipersensibilidad a las porfirinas
• Tumores que se sabe que están erosionando un vaso sanguíneo importante en el lugar de iluminación o adyacente a él
• Un procedimiento quirúrgico previsto en los 30 días siguientes
• Enfermedad oftálmica coexistente que probablemente requiera un examen con lámpara de hendidura en los 30 días siguientes
• Terapia existente con un agente fotosensibilizante
4.4 Advertencias y precauciones especiales de empleo
Todos los pacientes que reciben Foscan se volverán temporalmente fotosensibles. Hay que adoptar precauciones para evitar la exposición de la piel y los ojos a la luz solar directa o a luces artificiales intensas durante los primeros 15 días después de la inyección. Las reacciones de fotosensibilidad de la piel son provocadas por la luz visible; por tanto, los filtros solares ultravioletas no proporcionan protección alguna. Es importante que los pacientes sean reintroducidos a la luz normal gradualmente (ver las directrices sobre protección de la luz para los pacientes al final de esta sección).
Durante los 6 meses siguientes al tratamiento con Foscan se debe evitar la exposición prolongada a la luz solar directa del brazo en el que se le haya aplicado la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el brazo en el que se le haya aplicado la inyección utilizando una camisa de manga larga y de color.
Los médicos deben saber que la mayoría de las toxicidades asociadas a la terapia fotodinámica son efectos locales observados como consecuencia de la fotoactivación. La fotoactivación induce el daño en el tejido local, lo que origina una respuesta inflamatoria aguda. Esta respuesta se asocia frecuentemente a edema y dolor, seguidos de necrosis. El efecto fotodinámico también puede dar lugar a daño en el tejido circundante que puede producir fístula, perforación o rotura vascular además de infección y la consiguiente sepsis. Por lo tanto, es importante que durante la fotoactivación con la iluminación láser se tomen medidas para proteger de la fotoactivación el tejido normal que rodea el tumor mediante técnicas de iluminación y pantallas adecuadas. Para controlar los riesgos es importante controlar proactivamente los efectos locales y disminuir la fotoactivación en las zonas no tumorales.
Hay que tener especial cuidado para prevenir la extravasación en el lugar de la inyección. Si se produce una extravasación hay que proteger la zona de la luz durante al menos 3 meses. No existe ningún beneficio conocido por inyectar otra sustancia en el lugar de la extravasación.
Se han notificado reacciones adversas, entre ellas colangitis, colecistitis, absceso hepático y perforación del esófago después del uso no autorizado en el tratamiento de las estenosis malignas de
3
las vías biliares y del mesotelioma. Existe un riesgo de daño en la zona circundante tras la fotoactivación.
Solo deben llevarse a cabo procedimientos quirúrgicos no planificados o de emergencia donde se ha administrado Foscan durante los 30 días anteriores si es absolutamente necesario y los beneficios potenciales compensan el riesgo para el paciente. Hay que tomar todas las precauciones para evitar la iluminación directa del paciente con lámparas quirúrgicas durante estos procedimientos. Se recomienda el uso de lámparas frontales.
Algunos oxímetros de pulso pueden producir luz de una longitud de onda próxima a la empleada para la fotoactivación de Foscan. Los oxímetros deben ser recolocados al menos cada 10-15 minutos para evitar el riesgo de quemaduras cutáneas locales.
Durante el tratamiento, el dolor, en general, y el dolor en el lugar de la inyección, enumerados en la sección 4.8 pueden necesitar el uso de AINE o de analgésicos opiáceos en un periodo de tiempo corto. El dolor aparece al día siguiente de la iluminación y normalmente dura entre 2 y 4 semanas.
La iluminación de las vías respiratorias puede originar inflamación y edema locales. Se deben prever las complicaciones resultantes (es decir, disnea e incluso obstrucción de las vías respiratorias que pueden dar lugar a, por ejemplo, intubación o traqueotomía). Se debe contemplar el tratamiento profiláctico con corticoesteroides.
Los clínicos deben aconsejar a los pacientes que observen las siguientes precauciones que se presentan en el Prospecto:
|
Tiempo después de la inyección de Foscan |
¿Qué debo hacer para evitar quemaduras? |
|
Día 1 (0-24 horas) |
Permanecer dentro de casa en una habitación oscura. Mantener corridas las cortinas y usar bombillas de 60 W o menos. Evitar la exposición directa al sol. |
|
Días 2-7 |
Puede volver a utilizar de forma gradual una luz normal en interiores. Recuerde evitar la luz solar directa que entre por la ventana o la luz directa de aparatos domésticos tales como lámparas de lectura. Se puede ver la televisión. Puede salir al exterior después del anochecer. Si es absolutamente necesario salir al exterior durante las horas de luz, debe cubrirse toda la piel, incluyendo la cara y las manos, y llevar gafas oscuras. El tipo de ropa que debe llevar es: • Sombrero de ala ancha: para la cabeza, cuello, nariz y orejas. • Bufanda: para la cabeza y cuello. • Gafas de sol con paneles laterales: para los ojos y la piel circundante. • Jersey de manga larga: para el tronco/brazos. • Pantalón largo: para el abdomen/piernas. • Guantes: para las manos, muñecas y dedos. • Calcetines: para los pies y tobillos. • Zapatos cerrados: para los pies. • No lleve ropa muy fina porque no le protegerá de la luz intensa. Lleve ropa oscura de tejido denso. • Si se expone a la luz por error, puede notar una sensación punzante o |
|
quemazón en la piel. Debe ponerse a cubierto de la luz de inmediato. Durante esta semana puede tener los ojos muy sensibles a las luces intensas. Puede sentir dolor de ojos o de cabeza cuando se encienden las luces. Si tiene este problema, póngase unas gafas de sol. | |
|
Días 8-14 |
Ahora puede empezar a salir durante las horas de luz. Manténgase en lugares con luz tenue o salga cuando esté nublado. Siga llevando ropa oscura de tejido denso. Empiece el día 8 con 10-15 minutos al exterior. Si no observa ningún enrojecimiento de la piel en las 24 horas siguientes, puede aumentar gradualmente el tiempo que pasa fuera durante la semana. Evite el sol directo o la luz artificial intensa. Permanezca a la sombra. |
|
A partir del día 15 |
Su sensibilidad a la luz recupera gradualmente la normalidad. Debe probarlo con cuidado exponiendo el dorso de la mano al sol durante 5 minutos. Espere 24 horas para ver si hay algún enrojecimiento. Si hay enrojecimiento, debe evitar el sol directo durante otras 24 horas. Después puede repetir la prueba. Si no hay enrojecimiento, puede aumentar gradualmente la exposición al sol día tras día. No permanezca al sol durante más de 15 minutos la primera vez. La mayoría de las personas podrán volver a su rutina normal el día 22. El primer día después de la prueba cutánea puede permanecer al sol directo durante 15 minutos. Puede incrementar su exposición otros 15 minutos cada día, esto es, el segundo día 30 minutos, el tercer día 45 minutos, el cuarto día 60 minutos y así sucesivamente. Si en cualquier momento nota una sensación punzante o quemazón, u observa un enrojecimiento de la piel después de la exposición al sol, espere hasta que esto desaparezca antes de exponer la piel a la luz de nuevo durante este plazo. Durante 30 días después del tratamiento con Foscan, evite las pruebas de visión que utilicen luces brillantes. Durante 3 meses después del tratamiento con Foscan, evite las camas de bronceado por UV. No tome el sol. Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada a la luz solar de la zona del brazo la que le hayan aplicado la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el lugar de la inyección utilizando ropa de manga larga y de color. |
Este medicamento contiene un 48 vol. % de etanol en volumen (alcohol), esto es, hasta 4,2 g por dosis, equivalente a 84 ml de cerveza, 35 ml de vino por dosis. Perjudicial para personas que padecen alcoholismo. Debe ser tenido en cuenta en mujeres embarazadas o en periodo de lactancia, en niños y en grupos de alto riesgo como pacientes con enfermedad hepática o epilepsia. La cantidad de alcohol de este medicamento puede alterar los efectos de otros medicamentos. La cantidad de alcohol de este medicamento puede afectar a la capacidad para conducir o utilizar máquinas.
4.5 Interacción con otros medicamentos y otras formas de interacción
Si se utiliza temoporfina con otros principios activos fotosensibilizantes existe la posibilidad de exacerbación de la fotosensibilidad de la piel. Se ha registrado una reacción de este tipo con el 5-fluorouracilo tópico.
No se han observado otras interacciones. Un estudio in vitro con tejido hepático humano no ha revelado ningún potencial de interacción farmacológica por inhibición de las enzimas del citocromo P450 por la temoporfina.
4.6 Fertilidad, embarazo y lactancia
No existen datos acerca del uso de la temoporfina en mujeres embarazadas. Los estudios en animales son insuficientes respecto a los efectos sobre el desarrollo embrionario/fetal (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. La temoporfina no debería utilizarse durante el embarazo excepto si fuese claramente necesario.
Los estudios en animales sugieren un efecto tóxico en el embarazo temprano (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. Por consiguiente, debe evitarse el embarazo durante los 3 meses siguientes al tratamiento con temoporfina.
No se sabe si la temoporfina se excreta en la leche humana. Las mujeres que reciben Foscan no deben dar el pecho hasta por lo menos un mes después de la inyección.
No se han estudiado los efectos de Foscan sobre la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La cantidad de alcohol de este medicamento puede afectar a la capacidad para conducir o utilizar máquinas.
Sobre la base del perfil farmacodinámico, se cree que la temoporfina es segura o que es improbable que produzca efectos. Para evitar problemas de fotosensibilidad, se recomienda no conducir durante los primeros 15 días después de la inyección y utilizar máquinas solo si resulta práctico hacerlo en condiciones de iluminación atenuada conforme a las precauciones de iluminación recomendada (ver sección 4.4). La conducción y el uso de maquinaria pueden reanudarse en condiciones de iluminación normal o a la luz del día una vez que la fotosensibilidad demuestre haber remitido.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Todos los pacientes que reciben Foscan se vuelven temporalmente fotosensibles y deben ser instruidos para que sigan las precauciones de evitar la luz solar y las luces artificiales intensas. Las reacciones adversas tabuladas y observadas con mayor frecuencia son las relativas a alteraciones gastrointestinales, reacciones adversas en la piel y trastornos generales y alteraciones en el lugar de administración.
La mayor parte de las toxicidades asociadas con la terapia fotodinámica son efectos locales en la región de iluminación y a veces en los tejidos circundantes. Las reacciones adversas locales son características de una respuesta tisular inflamatoria aguda inducida por la fotoactivación y normalmente incluyen edema y dolor seguidos de necrosis (ver sección 4.4).
Sin embargo, las reacciones de fotosensibilidad pueden ocurrir incluso cumpliendo con las directrices de protección de la luz (ver sección 4.4 anterior), y evitando la luz artificial innecesaria durante la iluminación se reduce este riesgo.
El bajo número de pacientes tratados no permitió la identificación de las reacciones adversas que pueden clasificarse como poco frecuentes y raras. El dolor en el lugar de la inyección es transitorio y puede reducirse disminuyendo la velocidad de inyección. Para el tratamiento de otros tipos de dolor enumerados en esta sección, consultar la sección 4.4.
Tabla de reacciones adversas
Las frecuencias enumeradas a continuación se definen utilizando la siguiente convención: muy frecuentes (>1/10); frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras <1/10.000, frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación por órganos y sistemas |
Reacciones adversas |
|
Infecciones e infestaciones |
Frecuentes: Infección localizada en la zona de fotoactivación, p. ej.: faringitis, estomatitis Frecuencia no conocida: Sepsis1 |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes: Anemia |
|
Trastornos del sistema nervioso |
Frecuentes: Mareo, sensación de ardor |
|
Trastornos vasculares |
Muy frecuentes: Hemorragia Frecuencia no conocida: Rotura vascular: ver sección 4.3 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuencia no conocida: Obstrucción de las vías respiratorias2 |
|
Trastornos gastrointestinales |
Muy frecuentes: Estreñimiento, estomatitis necrosante, disfagia Frecuentes: Vómitos, náuseas, ulceración de la boca |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes: Ampolla, eritema, hiperpigmentación de la piel, reacción de fotosensibilidad, necrosis de la piel3 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes: Trismo2 Frecuencia no conocida: Fístula3 |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes: Dolor en la zona de fotoactivación, p. ej.: dolor facial, cefalea, dolor en la zona de inyección, edema en la zona de fotoactivación, p. ej.: edema de cara, edema de lengua Frecuentes: Pirexia, reacción en la zona de inyección, edema |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Muy frecuentes: Cicatriz3 Frecuentes: Quemadura térmica, quemadura solar3 |
Puede esperarse que las reacciones adversas asociadas con la sobredosis se limiten a reacciones de fotosensibilidad. La exposición a la luz ambiental tras una sobredosis conlleva un aumento del riesgo de reacciones de fotosensibilidad. Las investigaciones clínicas publicadas han demostrado que la duración y la intensidad de la fotosensibilidad a la dosis recomendada de 0,15 mg/kg se reducían en un tercio con respecto a una dosis de 0,3 mg/kg. Ciertos estudios animales han revelado algunos cambios hematológicos y químicos sanguíneos (reducción de las plaquetas, eritrocitos y hemoglobina, aumento de los neutrófilos, fibrinógeno, bilirrubina, triglicéridos y colesterol).
Se requiere un seguimiento estricto del régimen de reducción de la luz. Debe llevarse a cabo una prueba de fotosensibilidad de la piel antes de que el paciente regrese a unas condiciones normales de luz.
No se conoce ningún síntoma sistémico específico asociado con la sobredosis. El tratamiento debe ser sintomático.
Existe información limitada acerca de los efectos de la sobre-exposición a la luz de láser durante el tratamiento. Se notificó un incremento de los daños a los tejidos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, otros agentes antineoplásicos, código ATC: L01XD05.
La temoporfina es un agente fotosensibilizante empleado para la terapia fotodinámica de tumores.
La actividad farmacológica se inicia por fotoactivación de la temoporfina con luz no térmica a 652 nm tras su administración intravenosa. El efecto terapéutico está mediado por la formación de especies de oxígeno altamente reactivas, un proceso dependiente de la interacción intracelular de la temoporfina con la luz y el oxígeno.
En un ensayo clínico con 147 pacientes con carcinoma avanzado de células escamosas de cabeza y cuello, se observó respuesta del tumor, definida como una reducción de un mínimo del 50 % de la masa del tumor durante un mínimo de cuatro semanas, en el 25 % de los pacientes después de un solo tratamiento. Se observó una respuesta local completa según los criterios de la OMS en el 14 % de los pacientes. Las respuestas del tumor se intensifican en pacientes con lesiones completamente iluminadas de 10 mm o inferior de profundidad.
La mediana observada de la duración de la respuesta del tumor para todos los pacientes fue de 57 días para la respuesta general y de 84 días para la respuesta completa.
Treinta y siete pacientes recibieron al menos 2 tratamientos con Foscan. Diez pacientes obtuvieron una respuesta del tumor durante el retratamiento. De éstos, 6 tuvieron una respuesta local completa según los criterios de la OMS.
5.2 Propiedades farmacocinéticas
La temoporfina es una sustancia de bajo aclaramiento con una semivida plasmática terminal en pacientes de 65 horas Los niveles plasmáticos máximos se producen 2-4 horas después de la inyección, y posteriormente los niveles plasmáticos disminuyen de forma biexponencial. Se observa un amplio volumen de distribución que es intermedio entre el agua corporal total y la extracelular. La temoporfina no se acumula en los tejidos. La fijación a las proteínas plasmáticas es el 85-87 %. La temoporfina se fija a las lipoproteínas plasmáticas y a las proteínas de alta densidad tales como la albúmina de la sangre. A los 15 días después de la perfusión, la concentración plasmática de temoporfina disminuye hasta el estado inicial puntote tal forma que los pacientes pueden iniciar generalmente un retorno gradual a condiciones normales de luz exterior.
Se dispone de datos limitados acerca de la eliminación de la temoporfina en humanos. Los datos en animales indican que la temoporfina se elimina exclusivamente por el hígado a través de la bilis y se excreta en las heces. Dos metabolitos importantes de la temoporfina se eliminan a través de bilis. No se produce recirculación enterohepática de estos metabolitos. Ambos metabolitos presentan conjugación. No se observa ningún metabolito en la circulación sistémica.
5.3 Datos preclínicos sobre seguridad
En estudios a dosis repetidas en ratas y perros, los principales efectos adversos de la temoporfina fueron la fototoxicidad y las reacciones adversas en el lugar de la inyección. Con todas las dosis de Foscan se observó irritación local después de la administración intravenosa. La administración de dosis altas del medicamento, provocaron la muerte en perros y conejos. No se hallaron otros signos de toxicidad, sin embargo, en perros tratados con la dosis terapéutica recomendada, la exposición sistémica superó a la de los seres humanos.
La genotoxicidad de la temoporfina ha sido investigada de forma limitada. Debido a la formación de especies de oxígeno reactivas, la temoporfina comporta un riesgo menor de que se produzca mutagenicidad. Este riesgo puede controlarse reduciendo al mínimo la exposición directa a la luz (ver sección 4.4).
En estudios de toxicidad durante el desarrollo en conejos (embriotoxicidad), la temoporfina, a exposiciones sistémicas iguales a las obtenidas en seres humanos con la dosis terapéutica recomendada, provocó un incremento de la pérdida temprana posterior a la implantación. Aunque no se observó ningún otro efecto sobre el desarrollo, las dosis aplicadas no superaron suficientemente la dosis terapéutica humana para proporcionar un margen de seguridad adecuado.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Etanol, anhidro (E1510)
Propilenglicol (E1520)
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
5 años
Una vez abierto, la solución debe utilizarse inmediatamente
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Viales de vidrio ámbar de tipo I con un tapón de elastómero de bromobutilo y un sello de aluminio, conteniendo 1 ml, 3 ml o 6 ml de solución inyectable.
Cada envase contiene 1 vial y un filtro con conexiones Luer para jeringuilla y cánula.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Deben adoptarse precauciones adecuadas al manipular este medicamento. Los estudios han demostrado que Foscan no es irritante. Cada vial representa una sola dosis y la solución no utilizada debe ser desechada.
Foscan es fotosensible. Una vez extraído de su embalaje debe administrarse inmediatamente. Cuando sea inevitable un retraso, la solución deberá protegerse de la luz.
Foscan no debe diluirse con soluciones acuosas.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
biolitec pharma ltd.
Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/197/003
EU/1/01/197/004
EU/1/01/197/005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 24/octubre/2001 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA): http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Fosean 4 mg/ml solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 4 mg de temoporfina.
Excipientes:
Cada ml contiene 376 mg de etanol anhidro y 560 mg de propilenglicol. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable Solución violeta oscuro
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Foscan está indicado para el tratamiento paliativo de pacientes con carcinoma avanzado de células escamosas en la cabeza y el cuello, que hayan fracasado a terapias anteriores y resulten inadecuados para radioterapia, cirugía o quimioterapia sistémica.
4.2 Posología y forma de administración
La terapia fotodinámica de Foscan solo debe administrarse en centros oncológicos especializados en los cuales un equipo multidisciplinario evalúa el tratamiento del paciente, y bajo la supervisión de médicos con experiencia en la terapia fotodinámica.
Posología
La dosis es de 0,15 mg/kg peso corporal.
Población pediátrica
No existe indicación relevante para el uso de Foscan en la población pediátrica.
Forma de administración
Foscan se administra a través de una cánula intravenosa residente en una vena proximal grande de una extremidad, preferiblemente en la fosa antecubital, como una sola inyección intravenosa lenta a lo largo de un mínimo de 6 minutos. La permeabilidad de la cánula residente debe ser ensayada antes de la inyección, y hay que adoptar todas las precauciones posibles contra la extravasación (ver sección 4.4).
El color púrpura oscuro de la solución, junto con los viales de color ámbar, hace imposible realizar una comprobación visual en busca de partículas. Por lo tanto, hay que emplear un filtro en línea como medida de precaución, el cual se incluye en el paquete. Foscan no debe ser diluido o lavado con cloruro sódico u otra solución acuosa.
La dosis necesaria de Foscan se administra mediante inyección intravenosa lenta, durante un tiempo mínimo de 6 minutos. 96 horas después de la administración de Foscan, el lugar del tratamiento ha de ser iluminado con luz a 652 nm de una fuente de láser aprobada. Debe aplicarse la luz a toda la
superficie del tumor por medio de una fibra óptica de microlente aprobada. Siempre que sea posible, la zona iluminada debe extenderse más allá del margen del tumor en una distancia de 0,5 cm.
La luz no debe administrarse antes de 90 horas ni después de 110 horas de la inyección de Foscan.
La dosis de luz incidente es de 20 J/cm2, aplicada con una irradiancia de 100 mW/cm2 a la superficie del tumor, lo cual supone un tiempo de iluminación de unos 200 segundos.
Cada campo ha de ser iluminado solo una vez en cada tratamiento. Se pueden iluminar múltiples campos no solapados. Hay que asegurarse que ninguna región de tejido recibe una dosis de luz superior a la especificada. Los tejidos fuera del área objetivo deben ser protegidos completamente para evitar la fotoactivación por luz dispersada o reflejada.
Se puede aplicar un segundo curso de tratamiento, a elección del médico que aplica el tratamiento, en pacientes en los que se considere adecuada una necrosis y eliminación adicional del tumor, con un intervalo mínimo recomendado de 4 semanas entre tratamientos.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes
• Porfiria u otras enfermedades exacerbadas por la luz
• Hipersensibilidad a las porfirinas
• Tumores que se sabe que están erosionando un vaso sanguíneo importante en el lugar de iluminación o adyacente a él
• Un procedimiento quirúrgico previsto en los 30 días siguientes
• Enfermedad oftálmica coexistente que probablemente requiera un examen con lámpara de hendidura en los 30 días siguientes
• Terapia existente con un agente fotosensibilizante
4.4 Advertencias y precauciones especiales de empleo
Todos los pacientes que reciben Foscan se volverán temporalmente fotosensibles. Hay que adoptar precauciones para evitar la exposición de la piel y los ojos a la luz solar directa o a luces artificiales intensas durante los primeros 15 días después de la inyección. Las reacciones de fotosensibilidad de la piel son provocadas por la luz visible; por tanto, los filtros solares ultravioletas no proporcionan protección alguna. Es importante que los pacientes sean reintroducidos a la luz normal gradualmente (ver las directrices sobre protección de la luz para los pacientes al final de esta sección).
Durante los 6 meses siguientes al tratamiento con Foscan se debe evitar la exposición prolongada a la luz solar directa del brazo en el que se le haya aplicado la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el brazo en el que se le haya aplicado la inyección utilizando una camisa de manga larga y de color.
Los médicos deben saber que la mayoría de las toxicidades asociadas a la terapia fotodinámica son efectos locales observados como consecuencia de la fotoactivación. La fotoactivación induce el daño en el tejido local, lo que origina una respuesta inflamatoria aguda. Esta respuesta se asocia frecuentemente a edema y dolor, seguidos de necrosis. El efecto fotodinámico también puede dar lugar a daño en el tejido circundante que puede producir fístula, perforación o rotura vascular además de infección y la consiguiente sepsis. Por lo tanto, es importante que durante la fotoactivación con la iluminación láser se tomen medidas para proteger de la fotoactivación el tejido normal que rodea el tumor mediante técnicas de iluminación y pantallas adecuadas. Para controlar los riesgos es importante controlar proactivamente los efectos locales y disminuir la fotoactivación en las zonas no tumorales.
Hay que tener especial cuidado para prevenir la extravasación en el lugar de la inyección. Si se produce una extravasación hay que proteger la zona de la luz durante al menos 3 meses. No existe ningún beneficio conocido por inyectar otra sustancia en el lugar de la extravasación.
Se han notificado reacciones adversas, entre ellas colangitis, colecistitis, absceso hepático y perforación del esófago después del uso no autorizado en el tratamiento de las estenosis malignas de
12
las vías biliares y del mesotelioma. Existe un riesgo de daño en la zona circundante tras la fotoactivación.
Solo deben llevarse a cabo procedimientos quirúrgicos no planificados o de emergencia donde se ha administrado Foscan durante los 30 días anteriores si es absolutamente necesario y los beneficios potenciales compensan el riesgo para el paciente. Hay que tomar todas las precauciones para evitar la iluminación directa del paciente con lámparas quirúrgicas durante estos procedimientos. Se recomienda el uso de lámparas frontales.
Algunos oxímetros de pulso pueden producir luz de una longitud de onda próxima a la empleada para la fotoactivación de Foscan. Los oxímetros deben ser recolocados al menos cada 10-15 minutos para evitar el riesgo de quemaduras cutáneas locales.
Durante el tratamiento, el dolor, en general, y el dolor en el lugar de la inyección, enumerados en la sección 4.8 pueden necesitar el uso de AINE o de analgésicos opiáceos en un periodo de tiempo corto. El dolor aparece al día siguiente de la iluminación y normalmente dura entre 2 y 4 semanas.
La iluminación de las vías respiratorias puede originar inflamación y edema locales. Se deben prever las complicaciones resultantes (es decir, disnea e incluso obstrucción de las vías respiratorias que pueden dar lugar a, por ejemplo, intubación o traqueotomía). Se debe contemplar el tratamiento profiláctico con corticoesteroides.
Los clínicos deben aconsejar a los pacientes que observen las siguientes precauciones que se presentan en el Prospecto:
|
Tiempo después de la inyección de Foscan |
¿Qué debo hacer para evitar quemaduras? |
|
Día 1 (0-24 horas) |
Permanecer dentro de casa en una habitación oscura. Mantener corridas las cortinas y usar bombillas de 60 W o menos. Evitar la exposición directa al sol. |
|
Días 2-7 |
Puede volver a utilizar de forma gradual una luz normal en interiores. Recuerde evitar la luz solar directa que entre por la ventana o la luz directa de aparatos domésticos tales como lámparas de lectura. Se puede ver la televisión. Puede salir al exterior después del anochecer. Si es absolutamente necesario salir al exterior durante las horas de luz, debe cubrirse toda la piel, incluyendo la cara y las manos, y llevar gafas oscuras. El tipo de ropa que debe llevar es: • Sombrero de ala ancha: para la cabeza, cuello, nariz y orejas. • Bufanda: para la cabeza y cuello. • Gafas de sol con paneles laterales: para los ojos y la piel circundante. • Jersey de manga larga: para el tronco/brazos. • Pantalón largo: para el abdomen/piernas. • Guantes: para las manos, muñecas y dedos. • Calcetines: para los pies y tobillos. • Zapatos cerrados: para los pies. • No lleve ropa muy fina porque no le protegerá de la luz intensa. Lleve ropa oscura de tejido denso. • Si se expone a la luz por error, puede notar una sensación punzante o quemazón en la piel. Debe ponerse a cubierto de la luz de inmediato. |
|
Durante esta semana puede tener los ojos muy sensibles a las luces intensas. Puede sentir dolor de ojos o de cabeza cuando se encienden las luces. Si tiene este problema, póngase unas gafas de sol. | |
|
Días 8-14 |
Ahora puede empezar a salir durante las horas de luz. Manténgase en lugares con luz tenue o salga cuando esté nublado. Siga llevando ropa oscura de tejido denso. Empiece el día 8 con 10-15 minutos al exterior. Si no observa ningún enrojecimiento de la piel en las 24 horas siguientes, puede aumentar gradualmente el tiempo que pasa fuera durante la semana. Evite el sol directo o la luz artificial intensa. Permanezca a la sombra. |
|
A partir del día 15 |
Su sensibilidad a la luz recupera gradualmente la normalidad. Debe probarlo con cuidado exponiendo el dorso de la mano al sol durante 5 minutos. Espere 24 horas para ver si hay algún enrojecimiento. Si hay enrojecimiento, debe evitar el sol directo durante otras 24 horas. Después puede repetir la prueba. Si no hay enrojecimiento, puede aumentar gradualmente la exposición al sol día tras día. No permanezca al sol durante más de 15 minutos la primera vez. La mayoría de las personas podrán volver a su rutina normal el día 22. El primer día después de la prueba cutánea puede permanecer al sol directo durante 15 minutos. Puede incrementar su exposición otros 15 minutos cada día, esto es, el segundo día 30 minutos, el tercer día 45 minutos, el cuarto día 60 minutos y así sucesivamente. Si en cualquier momento nota una sensación punzante o quemazón, u observa un enrojecimiento de la piel después de la exposición al sol, espere hasta que esto desaparezca antes de exponer la piel a la luz de nuevo durante este plazo. Durante 30 días después del tratamiento con Foscan, evite las pruebas de visión que utilicen luces brillantes. Durante 3 meses después del tratamiento con Foscan, evite las camas de bronceado por UV. No tome el sol. Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada a la luz solar de la zona del brazo la que le hayan aplicado la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el lugar de la inyección utilizando ropa de manga larga y de color. |
Este medicamento contiene un 48 vol. % de etanol en volumen (alcohol), esto es, hasta 1,0 g por dosis, equivalente a 21 ml de cerveza, 9 ml de vino por dosis. Perjudicial para personas que padecen alcoholismo. Debe ser tenido en cuenta en mujeres embarazadas o en periodo de lactancia, en niños y en grupos de alto riesgo como pacientes con enfermedad hepática o epilepsia.
4.5 Interacción con otros medicamentos y otras formas de interacción
Si se utiliza temoporfina con otros principios activos fotosensibilizantes existe la posibilidad de exacerbación de la fotosensibilidad de la piel. Se ha registrado una reacción de este tipo con el 5-fluorouracilo tópico.
No se han observado otras interacciones. Un estudio in vitro con tejido hepático humano no ha revelado ningún potencial de interacción farmacológica por inhibición de las enzimas del citocromo P450 por la temoporfina.
4.6 Fertilidad, embarazo y lactancia
No existen datos acerca del uso de la temoporfina en mujeres embarazadas. Los estudios en animales son insuficientes respecto a los efectos sobre el desarrollo embrionario/fetal (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. La temoporfina no debería utilizarse durante el embarazo excepto si fuese claramente necesario.
Los estudios en animales sugieren un efecto tóxico en el embarazo temprano (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. Por consiguiente, debe evitarse el embarazo durante los 3 meses siguientes al tratamiento con temoporfina.
No se sabe si la temoporfina se excreta en la leche humana. Las mujeres que reciben Foscan no deben dar el pecho durante al menos una mes después de la inyección.
No se han estudiado los efectos de Foscan sobre la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Sobre la base del perfil farmacodinámico, se cree que la temoporfina es segura o que es improbable que produzca efectos. Para evitar problemas de fotosensibilidad, se recomienda no conducir durante los primeros 15 días después de la inyección y utilizar máquinas solo si resulta práctico hacerlo en condiciones de iluminación atenuada conforme a las precauciones de iluminación recomendada (ver sección 4.4). La conducción y el uso de maquinaria pueden reanudarse en condiciones de iluminación normal o a la luz del día una vez que la fotosensibilidad demuestre haber remitido.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Todos los pacientes que reciben Foscan se vuelven temporalmente fotosensibles y deben ser instruidos para que sigan las precauciones de evitar la luz solar y las luces artificiales intensas. Las reacciones adversas tabuladas y observadas con mayor frecuencia son las relativas a alteraciones gastrointestinales, reacciones adversas en la piel y trastornos generales y alteraciones en el lugar de administración.
La mayor parte de las toxicidades asociadas con la terapia fotodinámica son efectos locales en la región de iluminación y a veces en los tejidos circundantes. Las reacciones adversas locales son características de una respuesta tisular inflamatoria aguda inducida por la fotoactivación y normalmente incluyen edema y dolor seguidos de necrosis (ver sección 4.4).
Sin embargo, las reacciones de fotosensibilidad pueden ocurrir incluso cumpliendo con las directrices de protección de la luz (ver sección 4.4 anterior), y evitando la luz artificial innecesaria durante la iluminación se reduce este riesgo.
El bajo número de pacientes tratados no permitió la identificación de las reacciones adversas que pueden clasificarse como poco frecuentes y raras. El dolor en el lugar de la inyección es transitorio y puede reducirse disminuyendo la velocidad de inyección. Para el tratamiento de otros tipos de dolor enumerados en esta sección, consultar la sección 4.4.
Tabla de reacciones adversas
Las frecuencias enumeradas a continuación se definen utilizando la siguiente convención: muy frecuentes (>1/10); frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras <1/10.000, frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación por órganos y sistemas |
Reacciones adversas |
|
Infecciones e infestaciones |
Frecuentes: Infección localizada en la zona de fotoactivación, p. ej.: faringitis, estomatitis Frecuencia no conocida: Sepsis1 |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes: Anemia |
|
Trastornos del sistema nervioso |
Frecuentes: Mareo, sensación de ardor |
|
Trastornos vasculares |
Muy frecuentes: Hemorragia Frecuencia no conocida: Rotura vascular: ver sección 4.3 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuencia no conocida: Obstrucción de las vías respiratorias3 |
|
Trastornos gastrointestinales |
Muy frecuentes: Estreñimiento, estomatitis necrosante, disfagia Frecuentes: Vómitos, náuseas, ulceración de la boca |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes: Ampolla, eritema, hiperpigmentación de la piel, reacción de fotosensibilidad, necrosis de la piel2 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes: Trismo3 Frecuencia no conocida: Fístula2 |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes: Dolor en la zona de fotoactivación, p. ej.: dolor facial, cefalea, dolor en la zona de inyección, edema en la zona de fotoactivación, p. ej.: edema de cara, edema de lengua Frecuentes: Pirexia, reacción en la zona de inyección, edema |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Muy frecuentes: Cicatriz2 Frecuentes: Quemadura térmica, quemadura solar2 |
1 Como consecuencia de la infección local
2 En la zona de fotoactivación
3 Como consecuencia del edema local
4.9 Sobredosis
En caso de sobredosis, el tratamiento con láser ocasionaría una necrosis del tumor más profunda que la esperada con la dosis recomendada. Solo debe llevarse a cabo la iluminación del tumor si el beneficio potencial justifica el riesgo potencial de la necrosis excesiva. Si el tumor no es iluminado, debe dejarse un plazo de al menos 4 semanas entre la sobredosis y la nueva administración de Foscan.
Puede esperarse que las reacciones adversas asociadas con la sobredosis se limiten a reacciones de fotosensibilidad. La exposición a la luz ambiental tras una sobredosis conlleva un aumento del riesgo de reacciones de fotosensibilidad. Las investigaciones clínicas publicadas han demostrado que la duración y la intensidad de la fotosensibilidad a la dosis recomendada de 0,15 mg/kg se reducían en un tercio con respecto a una dosis de 0,3 mg/kg. Ciertos estudios animales han revelado algunos cambios hematológicos y químicos sanguíneos (reducción de las plaquetas, eritrocitos y hemoglobina, aumento de los neutrófilos, fibrinógeno, bilirrubina, triglicéridos y colesterol).
Se requiere un seguimiento estricto del régimen de reducción de la luz. Debe llevarse a cabo una prueba de fotosensibilidad de la piel antes de que el paciente regrese a unas condiciones normales de luz.
No se conoce ningún síntoma sistémico específico asociado con la sobredosis. El tratamiento debe ser sintomático.
Existe información limitada acerca de los efectos de la sobre-exposición a la luz de láser durante el tratamiento. Se notificó un incremento de los daños a los tejidos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos otros agentes antineoplásicos, código ATC: L01XD05.
La temoporfina es un agente fotosensibilizante empleado para la terapia fotodinámica de tumores.
La actividad farmacológica se inicia por fotoactivación de la temoporfina con luz no térmica a 652 nm tras su administración intravenosa. El efecto terapéutico está mediado por la formación de especies de oxígeno altamente reactivas, un proceso dependiente de la interacción intracelular de la temoporfina con la luz y el oxígeno.
En un ensayo clínico con 147 pacientes con carcinoma avanzado de células escamosas de cabeza y cuello, se observó respuesta del tumor, definida como una reducción de un mínimo del 50 % de la masa del tumor durante un mínimo de cuatro semanas, en el 25 % de los pacientes después de un solo tratamiento. Se observó una respuesta local completa según los criterios de la OMS en el 14 % de los pacientes. Las respuestas del tumor se intensifican en pacientes con lesiones completamente iluminadas de 10 mm o inferior de profundidad.
La mediana observada de la duración de la respuesta del tumor para todos los pacientes fue de 57 días para la respuesta general y de 84 días para la respuesta completa.
Treinta y siete pacientes recibieron al menos 2 tratamientos con Foscan. Diez pacientes obtuvieron una respuesta del tumor durante el retratamiento. De éstos, 6 tuvieron una respuesta local completa según los criterios de la OMS.
5.2 Propiedades farmacocinéticas
La temoporfina es una sustancia de bajo aclaramiento con una semivida plasmática terminal en pacientes de 65 horas Los niveles plasmáticos máximos se producen 2-4 horas después de la inyección, y posteriormente los niveles plasmáticos disminuyen de forma biexponencial. Se observa un amplio volumen de distribución que es intermedio entre el agua corporal total y la extracelular. La temoporfina no se acumula en los tejidos. La fijación a las proteínas plasmáticas es el 85-87 %. La temoporfina se fija a las lipoproteínas plasmáticas y a las proteínas de alta densidad tales como la albúmina de la sangre. A los 15 días después de la perfusión, la concentración plasmática de temoporfina disminuye hasta el estado inicial puntote tal forma que los pacientes pueden iniciar generalmente un retorno gradual a condiciones normales de luz exterior.
Se dispone de datos limitados acerca de la eliminación de la temoporfina en humanos. Los datos en animales indican que la temoporfina se elimina exclusivamente por el hígado a través de la bilis y se excreta en las heces. Dos metabolitos importantes de la temoporfina se eliminan a través de bilis. No se produce recirculación enterohepática de estos metabolitos. Ambos metabolitos presentan conjugación. No se observa ningún metabolito en la circulación sistémica.
5.3 Datos preclínicos sobre seguridad
En estudios a dosis repetidas en ratas y perros, los principales efectos adversos de la temoporfina fueron la fototoxicidad y las reacciones adversas en el lugar de la inyección. Con todas las dosis de Fosean se observó irritación local después de la administración intravenosa. La administración de dosis altas del medicamento, provocaron la muerte en perros y conejos. No se hallaron otros signos de toxicidad, sin embargo, en perros tratados con la dosis terapéutica recomendada, la exposición sistémica superó a la de los seres humanos.
La genotoxicidad de la temoporfina ha sido investigada de forma limitada. Debido a la formación de especies de oxígeno reactivas, la temoporfina comporta un riesgo menor de que se produzca mutagenicidad. Este riesgo puede controlarse reduciendo al mínimo la exposición directa a la luz (ver sección 4.4).
En estudios de toxicidad durante el desarrollo en conejos (embriotoxicidad), la temoporfina, a exposiciones sistémicas iguales a las obtenidas en seres humanos con la dosis terapéutica recomendada, provocó un incremento de la pérdida temprana posterior a la implantación. Aunque no se observó ningún otro efecto sobre el desarrollo, las dosis aplicadas no superaron suficientemente la dosis terapéutica humana para proporcionar un margen de seguridad adecuado.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Etanol, anhidro (E1510)
Propilenglicol (E1520)
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez 5 años
Una vez abierto, la solución debe utilizarse inmediatamente
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Viales de vidrio ámbar de tipo I con un tapón de elastómero de bromobutilo y un sello de aluminio, conteniendo 3,5 ml o 5 ml de solución inyectable.
Cada envase contiene 1 vial y un filtro con conexiones Luer para jeringuilla y cánula.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Deben adoptarse precauciones adecuadas al manipular este medicamento. Los estudios han demostrado que Foscan no es irritante. Cada vial representa una sola dosis y la solución no utilizada debe ser desechada.
Foscan es fotosensible. Una vez extraído de su embalaje debe administrarse inmediatamente. Cuando sea inevitable un retraso, la solución deberá protegerse de la luz
Fosean no debe diluirse con soluciones acuosas.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
biolitec pharma ltd.
Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/197/001
EU/1/01/197/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 24/ octubre/2001 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA): http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes biolitec pharma ltd.
Block 8, Unit 10 Blanchardstown Corporate Park Dublin 15 Irlanda
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
El TAC debe operar un Sistema de Gestión de Riesgos y presentar un Plan de Gestión de Riesgos (PGR). |
Julio de 2014 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Fosean 1 mg/ml solución inyectable. Temoporfina.
2. PRINCIPIO(S) ACTIVO(S)
Cada ml contiene 1 mg de temoporfina.
3. LISTA DE EXCIPIENTES
Etanol anhidro y propilenglicol (ver el prospecto para más información)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 1 mg/1 ml Solución inyectable 3 mg/3 ml Solución inyectable 6 mg/6 ml Filtro estéril
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Dosis única. Desechar la cantidad sobrante después de su uso.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
biolitec pharma ltd. Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/197/003 (1 ml) EU/1/01/197/004 (3 ml) EU/1/01/197/005 (6 ml)
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta justificación para no incluir información en Braille
1. NOMBRE DEL MEDICAMENTO
Fosean 4 mg/ml solución inyectable. Temoporfina.
2. PRINCIPIO(S) ACTIVO(S)
Cada ml contiene 4 mg de temoporfina.
3. LISTA DE EXCIPIENTES
Etanol anhidro y propilenglicol (ver el prospecto para más información)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 14 mg/3,5 ml Solución inyectable 20 mg/5 ml Filtro estéril
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
Dosis única. Desechar la cantidad sobrante después de su uso.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
biolitec pharma ltd. Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/197/001 (3,5 ml) EU/1/01/197/002 (5 ml).
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta justificación para no incluir información en Braille
ETIQUETA DEL VIAL, 1 MG/ML_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Fosean 1 mg/ml solución inyectable. Temoporfina.
Vía intravenosa.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 mg/1 ml 3 mg/3 ml 6 mg/6 ml
6. OTROS
ETIQUETA DEL VIAL, 4 MG/ML_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Fosean 4 mg/ml solución inyectable. Temoporfina.
Vía intravenosa.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
14 mg/3,5 ml 20 mg/5 ml
6. OTROS
Fosean 1 mg/ml solución inyectable
Temoporfina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Foscan y para qué se utiliza.
2. Antes de usar Foscan.
3. Cómo usar Foscan.
4. Posibles efectos adversos
5. Conservación de Foscan
6. Información adicional
1. QUÉ ES FOSCAN Y PARA QUÉ SE UTILIZA
Foscan es un medicamento fotosensibilizador de la porfirina, para el tratamiento llamado terapia fotodinámica, que incrementa su sensibilidad a la luz y es activado por luz mediante un láser.
Foscan se utiliza para el tratamiento del cáncer de cabeza y cuello en pacientes que no pueden ser tratados con otras terapias.
2. ANTES DE USAR FOSCAN
No use Foscan:
- si es alérgico (hipersensible) a la temoporfina o a cualquiera de los demás componentes de Foscan (ver apartado 6 Información adicional),
- si es alérgico (hipersensible) a las porfirinas,
- si padece porfiria, o cualquier otra enfermedad que empeore con la luz,
- si el tumor tratado pasa por un vaso sanguíneo grande,
- si va a ser operado en los próximos 30 días,
- si padece una enfermedad de la vista que requiere un examen con luz fuerte durante los próximos 30 días,
- si ya está siendo tratado con un agente fotosensibilizante.
Tenga especial cuidado con Foscan
• Foscan provocará que se vuelva sensible a la luz durante unos 15 días después de la inyección. Esto significa que la luz natural normal o las luces artificiales intensas le pueden provocar quemaduras en la piel. Para impedirlo, debe seguir cuidadosamente las instrucciones para exponerse gradualmente a niveles crecientes de luz en interiores durante la primera semana y a luz tamizada y tenue en exteriores durante la segunda semana después del tratamiento (consulte la tabla del final de este prospecto).
• Por favor, consulte esto con su médico después de recibir una inyección de Foscan.
• Las cremas con filtro solar no evitan esta sensibilidad.
• Poco a poco irá perdiendo la sensibilidad a la luz. Normalmente, las personas pueden empezar a recibir luz exterior normal después de 15 días.
• Durante los 30 días siguientes al tratamiento con Foscan, no permita que un óptico u oftalmólogo le examine los ojos con luces intensas.
• Durante los 3 meses siguientes al tratamiento con Fosean, no utilice camas de rayos UV ni tome el sol.
• Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada directa a la luz solar en la zona del brazo en el que le hayan puesto la inyección. Como medida de precaución, si planea realizar una actividad prolongada al aire libre, proteja el sitio de la inyección utilizando ropa de manga larga y de color.
La siguiente tabla de instrucciones indica qué debe hacer para evitar quemaduras de la piel.
Debe seguir estas instrucciones cuidadosamente.
Por favor consulte a su médico, enfermera o farmacéutico si tiene alguna duda.
|
Tiempo después de la inyección de Foscan |
¿Qué debo hacer para evitar quemaduras? |
|
Día 1 (0-24 horas) |
Permanecer dentro de casa en una habitación oscura. Mantener corridas las cortinas y usar bombillas de 60 W o menos. Evitar la exposición directa al sol. |
|
Días 2-7 |
Puede volver a utilizar de forma gradual una luz normal en interiores. Recuerde evitar la luz solar directa que entra por la ventana o la luz directa de aparatos domésticos tales como lámparas de lectura. Se puede ver la televisión. Puede salir al exterior después del anochecer. Si es absolutamente necesario salir al exterior durante las horas de luz, debe cubrirse toda la piel, incluyendo la cara y las manos, y llevar gafas oscuras. El tipo de ropa que debe llevar es: • Sombrero de ala ancha: para la cabeza, cuello, nariz y orejas. • Bufanda: para la cabeza y cuello. • Gafas de sol con paneles laterales: para los ojos y la piel circundante. • Jersey de manga larga: para el tronco/brazos. • Pantalón largo: para el abdomen/piernas. • Guantes: para las manos, muñecas y dedos. • Calcetines: para los pies y tobillos. • Zapatos cerrados: para los pies. • No lleve ropa muy fina, porque no le protegerá de la luz intensa. Lleve ropa oscura de tejido denso. • Si se expone a la luz por error, puede notar una sensación punzante o quemazón en la piel. Debe ponerse a cubierto de la luz de inmediato. Durante esta semana puede tener los ojos muy sensibles a las luces intensas. Puede sentir dolor de ojos o de cabeza cuando se encienden las luces. Si tiene este problema, póngase unas gafas de sol. |
|
Días 8-14 |
Ahora puede empezar a salir durante las horas de luz. Manténgase en lugares con luz tenue o salga cuando esté nublado. Siga llevando ropa oscura de tejido denso. Empiece el día 8 con 10-15 minutos al exterior. Si no observa ningún enrojecimiento de la piel en las 24 horas siguientes, puede aumentar gradualmente el tiempo que pasa fuera durante la semana. Evite el sol directo o la luz artificial intensa. Permanezca a la sombra. |
|
A partir del día 15 |
Su sensibilidad a la luz recupera gradualmente la normalidad. Debe probarlo con cuidado exponiendo el dorso de la mano al sol durante 5 minutos. Espere 24 horas para ver si hay algún enrojecimiento. Si hay enrojecimiento, debe evitar el sol directo durante otras 24 horas. Después puede repetir la prueba. Si no hay enrojecimiento, puede aumentar gradualmente la exposición al sol día tras día. No permanezca al sol durante más de 15 minutos la primera vez. La mayoría de las personas podrán volver a su rutina normal el día 22. El primer día después de la prueba cutánea puede permanecer al sol directo durante 15 minutos. Puede incrementar su exposición otros 15 minutos cada día, esto es, el segundo día 30 minutos, el tercer día 45 minutos, el cuarto día 60 minutos y así sucesivamente. Si en cualquier momento nota una sensación punzante o quemazón, u observa un enrojecimiento de la piel después de la exposición al sol, espere hasta que esto desaparezca antes de exponer la piel a la luz de nuevo durante este plazo. Durante 30 días después del tratamiento con Foscan, evite las pruebas de visión que utilicen luces brillantes. Durante 3 meses después del tratamiento con Foscan, evite las camas de bronceado por UV. No tome el sol. Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada a la luz solar de la zona del brazo en la que le hayan puesto la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el lugar de la inyección utilizando ropa de manga larga y de color. |
Uso de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Uso de Fosean con alimentos y bebidas:
Los alimentos y bebidas normales no afectan a su tratamiento con Foscan.
Embarazo
• Debe evitar quedarse embarazada durante los 3 meses siguientes al tratamiento con Foscan.
• Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento si está embarazada.
Lactancia
No dé el pecho durante hasta que haya pasado al menos 1 mes después de la inyección de Foscan.
Conducción y uso de máquinas:
• La cantidad de alcohol de este medicamento puede afectar a su capacidad para conducir o utilizar máquinas.
• No se recomienda conducir o usar máquinas durante los primeros 15 días después de la inyección de Foscan, debido a las restricciones recomendadas sobre exposición a la luz.
Información importante sobre algunos de los componentes de Foscan:
Aviso:
• Este producto contiene un 48 vol. % de etanol en volumen (alcohol), esto es, hasta 4,2 g por dosis, equivalente a 84 ml de cerveza, 35 ml de vino por dosis. Este producto es perjudicial para personas que padecen alcoholismo. Debe tenerse en cuenta en el caso de mujeres embarazadas o en periodo de lactancia, en niños y en grupos de riesgo como pacientes con enfermedad hepática o epilepsia.
La cantidad de alcohol de este medicamento puede alterar los efectos de otros medicamentos.
3. CÓMO USAR FOSCAN
• Su médico o enfermera le administrará Foscan por inyección lenta en una vena, que tardará unos 6 minutos aproximadamente.
• Si es necesario, su médico o enfermera le pondrán otra inyección después de, como mínimo,
4 semanas.
• Cuatro días después de la inyección, el médico tratará su cáncer con luz de láser. Su médico le cubrirá el tejido normal que rodea su cáncer y a continuación apuntará la luz de láser directamente al cáncer durante unos 5 minutos. La luz de láser no está caliente y no quema.
Si le administran más Foscan del que debieran
• Es posible que no le puedan aplicar el tratamiento con láser.
• Puede ser sensible a la luz durante más de 15 días.
Debe seguir cuidadosamente las instrucciones para evitar quemaduras en la piel.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Foscan puede producir efectos adversos, aunque no todas las personas los sufran.
• Todo el que utiliza Foscan se vuelve sensible a la luz durante unos 15 días después de la inyección.
• Debe seguir las instrucciones que le den para evitar la luz solar y la luz artificial intensa.
• Estas instrucciones están escritas en este prospecto. Su médico le indicará también qué debe hacer.
Si no sigue estas instrucciones, puede sufrir graves quemaduras solares que le provoquen cicatrices permanentes.
La mayoría de los efectos adversos relacionados con el tratamiento fotodinámico son efectos locales observados como consecuencia de la activación de Foscan con el láser. Puede sentir dolor después del tratamiento con láser. Este dolor se controlará con analgésicos. Informe a su médico o enfermero si tiene dolor o si los analgésicos que le han dado no le alivian el dolor. Además, probablemente observe hinchazón y enrojecimiento alrededor de la zona tratada. Puede que le den algún medicamento para reducir la hinchazón. Después de 2 a 4 días, la zona tratada ennegrecerá. Esto se debe a las células cancerosas muertas (necrosis). Foscan también puede dañar el tejido que rodea el tumor.
Efectos adversos muy frecuentes (que probablemente ocurran en al menos 1 de cada 10 pacientes)
• Puede que sienta dolor cuando le inyecten Fosean.
• Después del tratamiento con láser, puede sentir dolor en la zona tratada, p. ej.: dolor en la cara o dolor de cabeza.
• Asimismo, puede producirse sangrado, úlceras, hinchazón en la zona tratada como hinchazón de cara o de lengua, y cicatrices.
• Puede tener estreñimiento.
Puede que, debido a estos efectos, le resulte difícil comer o beber.
Efectos adversos frecuentes (que probablemente ocurran en al menos 1 de cada 100 pacientes)
• Puede producirse irritación, sensación de quemazón o daño cutáneo en la zona donde le administren Foscan, pero no durará mucho tiempo.
• También puede sufrir úlceras, ampollas, enrojecimiento u oscurecimiento de la piel.
• Vómitos
• Fiebre
• Náuseas
• Anemia
• Fotosensibilidad
• Quemaduras solares
• Quemaduras
• Dificultad para tragar
• Vértigo
• Puede notar hinchazón o rigidez en la mandíbula. Algunas personas pueden desarrollar una infección en la zona tratada, p. ej.: inflamación de boca o garganta.
Acontecimientos que ocurren con frecuencia desconocida
• Bloqueo de las vías respiratorias como consecuencia de la hinchazón de la zona tratada
• Fístula en la zona tratada
• Sepsis
• Rotura vascular
Se han notificado efectos adversos graves como inflamación de las vías biliares o de la vesícula biliar, absceso hepático o perforación en la zona tratada con el uso en tumores que no son de cabeza y cuello. Consulte a su médico para obtener más información.
Si aprecia cualquier efecto adverso serio o no mencionado en este prospecto, informe a su médico o farmacéutico. 4
Composición de Fosean:
- El principio activo es la temoporfina. Cada ml contiene 1 mg de temoporfina.
- Los demás componentes son etanol anhidro (E1510) y propilenglicol (E1520).
Aspecto de Fosean y contenido del envase:
Foscan solución inyectable es una solución de color morado oscuro que se presenta en un vial de vidrio color ámbar, conteniendo 1 ml, 3 ml o 6 ml de solución.
Cada envase contiene un vial de vidrio y un filtro.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación:
Titular de la autorización de comercialización
biolitec pharma ltd.
Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
Teléfono: +49 8151 7743011 Fax: +49 3641 5195333
Fabricante
biolitec pharma ltd.
Block 8, Unit 10 Blanchardstown Corporate Park Dublin 15 Irlanda
Este prospecto ha sido aprobado en {Mes/año}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA): http://www.ema.europa.eu
Esta información está destinada únicamente a médicos o profesionales del sector sanitario
Fosean 1 mg/ml solución inyectable Temoporfina
1. CONTENIDO DEL ENVASE
La sustancia activa es la temoporfina. Cada ml de solución contiene 1 mg de temoporfina. Los excipientes son etanol anhidro y propilenglicol. Se proporciona un filtro con conexiones Luer para jeringuilla y cánula.
Cada envase contiene un vial con 1 ml, 3 ml o 6 ml de solución inyectable.
Cada vial es una única dosis y la solución no utilizada debe desecharse.
2. CÁLCULO DE LA DOSIS
Calcular la dosis necesaria de Foscan de acuerdo con el peso corporal del paciente. La dosis es de 0,15 mg/kg de peso corporal.
3. ADMINISTRACIÓN DE FOSCAN (96 horas antes de la iluminación con láser del lugar del tratamiento)
Foscan debe administrarse por vía intravenosa a través de una cánula residente en una vena proximal grande de una extremidad, preferiblemente en la fosa antecubital. La permeabilidad de la cánula residente debe probarse antes de administrar la inyección.
El color púrpura oscuro de la solución, junto con el vial de color ámbar, hace que resulte imposible realizar una comprobación visual en busca de partículas. Por esta razón, debe emplearse un filtro en línea como medida de precaución, dicho filtro se incluye en el envase.
Recoger todo el contenido del vial que contiene Foscan con una jeringuilla y expulsar el aire (Figura 1).
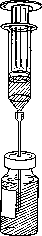
Figura 1
Fijar el filtro a la jeringuilla (Figura 2).
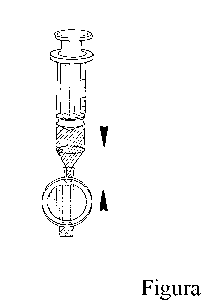
2
Pulsar el émbolo de la jeringuilla para llenar todo el espacio muerto dentro del filtro. Continuar pulsando el émbolo para expulsar el exceso de Foscan hasta que quede el volumen necesario en la jeringuilla, incluyendo suficiente para cubrir el espacio muerto de la cánula intravenosa (Figura 3).
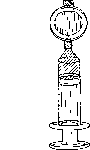
Figura 3
Fijar la jeringuilla y el filtro a la cánula. Administrar la dosis necesaria de Foscan por inyección intravenosa lenta durante 6 minutos como mínimo (Figura 4).
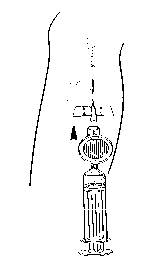
Figura 4
Quitar la cánula intravenosa inmediatamente después de la inyección. NO lavar con soluciones acuosas tales como solución inyectable de cloruro sódico al 9 mg/ml (0,9 %) o agua para preparaciones inyectables.
Hay que tener especial cuidado para evitar la extravasación en el lugar de la inyección. Si se produce una extravasación, debe protegerse la zona expuesta de la luz durante un periodo de, al menos, 3 meses. No se conoce ningún beneficio por inyectar en el lugar de la extravasación otra sustancia.
Foscan es fotosensible. Una vez extraído de su vial debe ser administrado de inmediato. Cuando es inevitable que se produzca un retraso, la solución debe protegerse de la luz.
Por favor, consulte el manual de empleo del láser y de la fibra óptica de microlente.
96 horas después de la administración de Fosean, el lugar del tratamiento debe iluminarse con luz a 652 nm de una fuente de láser aprobada. Debe aplicarse la luz a toda la superficie del tumor por medio de una fibra óptica de microlente aprobada. Siempre que sea posible, la zona iluminada debe extenderse más allá del margen del tumor a una distancia de 0,5 cm.
La luz no debe administrarse antes de 90 horas ni después de 110 horas de la inyección de Foscan.
La dosis de luz incidente es de 20 J/cm2, aplicada por la fibra óptica de microlente en un campo circular a la superficie del tumor con una irradiancia de 100 mW/cm2, lo cual implica un tiempo de iluminación de 200 segundos.
Cada campo debe iluminarse una única vez en cada tratamiento. Se pueden iluminar múltiples campos no solapados. Hay que asegurarse de que ninguna región de tejido recibe una dosis de luz superior a la especificada. Los tejidos fuera del área objetivo deben protegerse completamente para evitar la fotoactivación por luz dispersada o reflejada.
5. INFORMACIÓN DE SEGURIDAD
Foscan no es irritante.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Fosean 4 mg/ml solución inyectable Temoporfina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Foscan y para qué se utiliza.
2. Antes de usar Foscan.
3. Cómo usar Foscan.
4. Posibles efectos adversos
5. Conservación de Foscan
6. Información adicional
1. QUÉ ES FOSCAN Y PARA QUÉ SE UTILIZA
Foscan es un medicamento fotosensibilizador de la porfirina, para el tratamiento llamado terapia fotodinámica, que incrementa su sensibilidad a la luz y es activado por luz mediante un láser.
Foscan se utiliza para el tratamiento del cáncer de cabeza y cuello en pacientes que no pueden ser tratados con otras terapias.
2. ANTES DE USAR FOSCAN
No use Foscan:
- si es alérgico (hipersensible) a la temoporfina o a cualquiera de los demás componentes de Foscan (ver apartado 6 Información adicional),
- si es alérgico (hipersensible) a las porfirinas,
- si padece porfiria, o cualquier otra enfermedad que empeore con la luz,
- si el tumor tratado pasa por un vaso sanguíneo grande,
- si va a ser operado en los próximos 30 días,
- si padece una enfermedad de la vista que requiere un examen con luz fuerte durante los próximos 30 días,
- si ya está siendo tratado con un agente fotosensibilizante.
Tenga especial cuidado con Foscan
• Foscan provocará que se vuelva sensible a la luz durante unos 15 días después de la inyección. Esto significa que la luz natural normal o las luces artificiales intensas le pueden provocar quemaduras en la piel. Para impedirlo, debe seguir cuidadosamente las instrucciones para exponerse gradualmente a niveles crecientes de luz en interiores durante la primera semana y a luz tamizada y tenue en exteriores durante la segunda semana después del tratamiento (consulte la tabla del final de este prospecto).
• Por favor, consulte esto con su médico después de recibir una inyección de Foscan.
• Las cremas con filtro solar no evitarán esta sensibilidad.
• Poco a poco irá perdiendo la sensibilidad a la luz. Normalmente, las personas pueden empezar a recibir luz exterior normal después de 15 días.
• Durante los 30 días siguientes al tratamiento con Foscan, no permita que un óptico u oftalmólogo le examine los ojos con luces intensas.
• Durante los 3 meses siguientes al tratamiento con Fosean, no utilice camas de rayos UV ni tome el sol.
• Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada directa a la luz solar en la zona del brazo en el que le hayan puesto la inyección. Como medida de precaución, si planea realizar una actividad prolongada al aire libre, proteja el sitio de la inyección utilizando ropa de manga larga y de color.
La tabla de instrucciones le indica qué debe hacer para evitar quemaduras de la piel. Debe seguir estas instrucciones cuidadosamente.
Por favor consulte a su médico, enfermera o farmacéutico si tiene alguna duda.
|
Tiempo después de la inyección de Foscan |
¿Qué debo hacer para evitar quemaduras? |
|
Día 1 (0-24 horas) |
Permanecer dentro de casa en una habitación oscura. Mantener corridas las cortinas y usar bombillas de 60 W o menos. Evitar la exposición directa al sol. |
|
Días 2-7 |
Puede volver a utilizar de forma gradual una luz normal en interiores. Recuerde evitar la luz solar directa que entra por la ventana o la luz directa de aparatos domésticos tales como lámparas de lectura. Se puede ver la televisión. Puede salir al exterior después del anochecer. Si es absolutamente necesario salir al exterior durante las horas de luz, debe cubrirse toda la piel, incluyendo la cara y las manos, y llevar gafas oscuras. El tipo de ropa que debe llevar es: • Sombrero de ala ancha: para la cabeza, cuello, nariz y orejas. • Bufanda: para la cabeza y cuello. • Gafas de sol con paneles laterales: para los ojos y la piel circundante. • Jersey de manga larga: para el tronco/brazos. • Pantalón largo: para el abdomen/piernas. • Guantes: para las manos, muñecas y dedos. • Calcetines: para los pies y tobillos. • Zapatos cerrados: para los pies. • No lleve ropa muy fina, porque no le protegerá de la luz intensa. Lleve ropa oscura de tejido denso. • Si se expone a la luz por error, puede notar una sensación punzante o quemazón en la piel. Debe ponerse a cubierto de la luz de inmediato. Durante esta semana puede tener los ojos muy sensibles a las luces intensas. Puede sentir dolor de ojos o de cabeza cuando se encienden las luces. Si tiene este problema, póngase unas gafas de sol. |
|
Días 8-14 |
Ahora puede empezar a salir durante las horas de luz. Manténgase en lugares con luz tenue o salga cuando esté nublado. Siga llevando ropa oscura de tejido denso. Empiece el día 8 con 10-15 minutos al exterior. Si no observa ningún enrojecimiento de la piel en las 24 horas siguientes, puede aumentar gradualmente el tiempo que pasa fuera durante la semana. Evite el sol directo o la luz artificial intensa. Permanezca a la sombra. |
|
A partir del día 15 |
Su sensibilidad a la luz recupera gradualmente la normalidad. Debe probarlo con cuidado exponiendo el dorso de la mano al sol durante 5 minutos. Espere 24 horas para ver si hay algún enrojecimiento. Si hay enrojecimiento, debe evitar el sol directo durante otras 24 horas. Después puede repetir la prueba. Si no hay enrojecimiento, puede aumentar gradualmente la exposición al sol día tras día. No permanezca al sol durante más de 15 minutos la primera vez. La mayoría de las personas podrán volver a su rutina normal el día 22. El primer día después de la prueba cutánea puede permanecer al sol directo durante 15 minutos. Puede incrementar su exposición otros 15 minutos cada día, esto es, el segundo día 30 minutos, el tercer día 45 minutos, el cuarto día 60 minutos y así sucesivamente. Si en cualquier momento nota una sensación punzante o quemazón, u observa un enrojecimiento de la piel después de la exposición al sol, espere hasta que esto desaparezca antes de exponer la piel a la luz de nuevo durante este plazo. Durante 30 días después del tratamiento con Foscan, evite las pruebas de visión que utilicen luces brillantes. Durante 3 meses después del tratamiento con Foscan, evite las camas de bronceado por UV. No tome el sol. Durante los 6 meses siguientes al tratamiento con Foscan, evite la exposición prolongada a la luz solar de la zona del brazo en la que le hayan puesto la inyección. Como medida de precaución, si se planea una actividad prolongada al aire libre, proteja el lugar de la inyección utilizando ropa de manga larga y de color. |
Uso de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Uso de Fosean con alimentos y bebidas:
Los alimentos y bebidas normales no afectarán a su tratamiento con Foscan.
Embarazo
• Debe evitar quedarse embarazada durante los 3 meses siguientes al tratamiento con Foscan.
• Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento si está embarazada.
Lactancia
No dé el pecho durante al menos 1 mes después de la inyección de Foscan.
Conducción y uso de máquinas:
• No se recomienda conducir o usar máquinas durante los primeros 15 días después de la inyección de Foscan, debido a las restricciones recomendadas sobre exposición a la luz.
Información importante sobre algunos de los componentes de Fosean:
Aviso:
• Este producto contiene un 48 vol. % de etanol en volumen (alcohol), esto es, hasta 1,0 g por dosis, equivalente a 21 ml de cerveza, 9 ml de vino por dosis. Este producto es perjudicial para las personas que padecen alcoholismo.
Debe ser tenido en cuenta en las mujeres embarazadas o en periodo de lactancia, en niños y en grupos de riesgo como pacientes con enfermedad hepática o epilepsia.
3. CÓMO USAR FOSCAN
• Su médico o enfermera le administrará Foscan por inyección lenta en una vena, que tardará unos 6 minutos aproximadamente.
• Si es necesario, su médico o enfermera le pondrán otra inyección al menos 4 semanas más tarde.
• Cuatro días después de la inyección, su médico tratará su cáncer con luz de láser. Su médico le cubrirá el tejido normal que rodea su cáncer y a continuación apuntará la luz de láser directamente al cáncer durante unos 5 minutos. La luz de láser no está caliente y no quema.
Si le administran más Foscan del que debieran
• Tal vez no se le pueda aplicar el tratamiento con láser.
• Puede ser sensible a la luz durante más de 15 días.
Debe seguir cuidadosamente las instrucciones para evitar quemaduras en la piel.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Foscan puede producir efectos adversos, aunque no todas las personas los sufran.
• Todo el que utiliza Foscan se vuelve sensible a la luz durante unos 15 días después de la inyección.
• Debe seguir las instrucciones que le den para evitar la luz solar y la luz artificial intensa.
• Estas instrucciones están escritas en este prospecto. Su médico le indicará también qué debe hacer.
Si no sigue estas instrucciones, puede sufrir graves quemaduras solares que provocan cicatrices permanentes.
La mayoría de los efectos adversos relacionados con el tratamiento fotodinámico son efectos locales observados como consecuencia de la activación de Foscan con el láser. Puede sentir dolor después del tratamiento con láser. Este dolor se controlará con analgésicos. Informe a su médico o enfermero si tiene dolor o si los analgésicos que le han dado no le alivian el dolor. Además, probablemente observe hinchazón y enrojecimiento alrededor de la zona tratada. Puede que le den algún medicamento para reducir la hinchazón. Después de 2 a 4 días, la zona tratada ennegrecerá. Esto se debe a las células cancerosas muertas (necrosis). Foscan también puede dañar el tejido que rodea el tumor.
Efectos adversos muy frecuentes (que probablemente ocurran en al menos 1 de cada 10 pacientes)
• Puede sentir algún dolor cuando se le inyecte Foscan.
• Después del tratamiento con láser, puede sentir dolor en la zona tratada, p. ej.: dolor en la cara o dolor de cabeza.
• Asimismo podrá haber sangrado, úlceras, hinchazón en la zona tratada como hinchazón de cara o de lengua, y cicatrices.
• Podrá tener estreñimiento.
Estos efectos podrán hacer que le resulte difícil comer o beber.
Efectos adversos frecuentes (que probablemente ocurran en al menos 1 de cada 100 pacientes)
• Puede producirse irritación, sensación de quemazón o daño cutáneo donde se administre Foscan, pero no durará mucho.
• También puede sufrir úlceras, ampollas, enrojecimiento u oscurecimiento de la piel.
• Vómitos
• Fiebre
• Náuseas
• Anemia
• Fotosensibilidad
• Quemaduras solares
• Quemaduras
• Dificultad para tragar
• Mareos
• Puede haber hinchazón o presentar rigidez en la mandíbula. Algunas personas pueden desarrollar una infección en la zona tratada, p.ej.: inflamación de boca o garganta.
Acontecimientos que ocurren con frecuencia desconocida
• Bloqueo de las vías respiratorias como consecuencia de la hinchazón de la zona tratada
• Fístula en la zona tratada
• Sepsis
• Rotura vascular
Se han notificado efectos adversos graves como inflamación de las vías biliares o de la vesícula biliar, absceso hepático o perforación en la zona tratada con el uso en tumores que no son de cabeza y cuello. Consulte a su médico para obtener más información.
Si aprecia cualquier efecto serio o adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. CONSERVACIÓN DE FOSCAN
Mantener fuera del alcance y de la vista de los niños.
No utilice Foscan después de la fecha de caducidad que aparece en la etiqueta y en la caja. La fecha de caducidad es el último día del mes que se indica.
Foscan se almacenará en la farmacia del hospital.
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz. Una vez extraído el medicamento del envase debe utilizarse inmediatamente.
Cada vial es una única dosis y el resto de medicamento no utilizado debe desecharse.
Los medicamentos no se deben tirar por los desagües ni a la basura. De esta forma, ayudará a proteger el medio ambiente. 5
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación:
Titular de la autorización de comercialización
biolitec pharma ltd.
Unit 9A
Plato Business Park Damastown Dublin 15 Irlanda
Teléfono: +49 8151 7743011 Fax: +49 3641 5195333
Fabricante
biolitec pharma ltd.
Block 8, Unit 10 Blanchardstown Corporate Park Dublin 15 Irlanda
Este prospecto ha sido aprobado en {Mes/año}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA): http://www.ema.europa.eu.
Esta información está destinada únicamente a médicos o profesionales del sector sanitario
Fosean 4 mg/ml solución inyectable Temoporfina
1. CONTENIDO DEL ENVASE
La sustancia activa es la temoporfina. Cada ml de solución contiene 4 mg de temoporfina. Los excipientes son etanol anhidro y propilenglicol. Se proporciona un filtro con conexiones Luer para jeringuilla y cánula.
Cada envase contiene un vial con 3,5 ml o 5 ml de solución inyectable.
Cada vial representa una dosis única y la solución no utilizada debe desecharse.
2. CÁLCULO DE LA DOSIS
Calcular la dosis necesaria de Foscan de acuerdo con el peso corporal del paciente. La dosis es de 0,15 mg/kg de peso corporal.
3. ADMINISTRACIÓN DE FOSCAN (96 horas antes de la iluminación con láser del lugar del tratamiento)
Foscan debe administrarse por vía intravenosa a través de una cánula residente en una vena proximal grande de una extremidad, preferiblemente en la fosa antecubital. La permeabilidad de la cánula residente debe ser ensayada antes de la inyección.
El color púrpura oscuro de la solución, junto con el vial de color ámbar, hace imposible realizar una comprobación visual en busca de partículas. Por tanto, debe emplearse un filtro en línea como medida de precaución, el cual se incluye en el envase.
Recoger todo el contenido del vial que contiene Foscan con una jeringuilla y expulsar el aire (Figura 1).
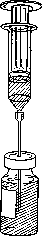
Figura 1
Fijar el filtro a la jeringuilla (Figura 2).
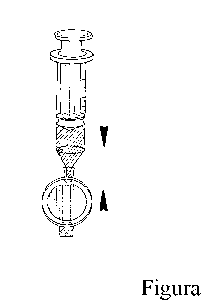
2
Pulsar el émbolo de la jeringuilla para llenar todo el espacio muerto dentro del filtro. Continuar pulsando el émbolo para expulsar el exceso de Foscan hasta que quede el volumen necesario en la jeringuilla, incluyendo suficiente para cubrir el espacio muerto de la cánula intravenosa (Figura 3).
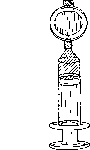
Figura 3
Fijar la jeringuilla y el filtro a la cánula. Administrar la dosis necesaria de Foscan por inyección intravenosa lenta durante 6 minutos como mínimo (Figura 4).
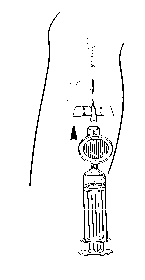
Figura 4
Quitar la cánula intravenosa inmediatamente después de la inyección. NO lavar con soluciones acuosas tales como solución inyectable de cloruro sódico al 9 mg/ml (0,9 %) o agua para preparaciones inyectables.
Hay que tener especial cuidado para evitar la extravasación en el lugar de la inyección. Si se produce una extravasación, proteger la zona de la luz durante al menos 3 meses. No existe ningún beneficio conocido por inyectar en el lugar de la extravasación otra sustancia.
Foscan es fotosensible. Una vez extraído de su acondicionamiento debe ser administrado de inmediato. Cuando es inevitable que se produzca un retraso, la solución debe ser protegida de la luz.
4. ILUMINACIÓN CON LÁSER DEL LUGAR DEL TRATAMIENTO
Le rogamos vea el manual de empleo del láser y el folleto de empleo de la fibra óptica de microlente.
96 horas después de la administración de Fosean, el lugar del tratamiento debe iluminarse con luz a 652 nm de una fuente de láser aprobada. Debe aplicarse la luz a toda la superficie del tumor por medio de una fibra óptica de microlente aprobada. Siempre que sea posible, la zona iluminada debe extenderse más allá del margen del tumor en una distancia de 0,5 cm.
La luz no debe administrarse antes de 90 horas ni después de 110 horas de la inyección de Foscan.
La dosis de luz incidente es de 20 J/cm2, aplicada por la fibra óptica de microlente en un campo circular a la superficie del tumor con una irradiancia de 100 mW/cm2, lo cual implica un tiempo de iluminación de 200 segundos.
Cada campo ha de ser iluminado solo una vez en cada tratamiento. Se pueden iluminar múltiples campos no solapados. Hay que asegurarse que ninguna región de tejido recibe una dosis de luz superior a la especificada. Los tejidos fuera del área objetivo deben ser protegidos completamente para evitar la fotoactivación por luz dispersada o reflejada.
5. INFORMACIÓN DE SEGURIDAD
Foscan no es irritante.
48
Como consecuencia de la infección local
Como consecuencia del edema local
4.9 Sobredosis
En caso de sobredosis, el tratamiento con láser ocasionaría una necrosis del tumor más profunda que la esperada con la dosis recomendada. Solo debe llevarse a cabo la iluminación del tumor si el beneficio potencial justifica el riesgo potencial de la necrosis excesiva. Si el tumor no es iluminado, debe dejarse un plazo de al menos 4 semanas entre la sobredosis y la nueva administración de Foscan.
En la zona de fotoactivación
CONSERVACIÓN DE FOSCAN
Mantener fuera del alcance y de la vista de los niños.
No utilice Foscan después de la fecha de caducidad que aparece en la etiqueta y en la caja. La fecha de caducidad es el último día del mes que se indica.
Foscan se almacenará en la farmacia del hospital.
No conservar a temperatura superior a 25°C.
Conservar en el embalaje original para protegerlo de la luz. Una vez extraído el medicamento del envase debe utilizarse inmediatamente.
Cada vial es una única dosis y el resto de medicamento no utilizado debe desecharse. Los medicamentos no se deben tirar por los desagües ni a la basura. De esta forma, ayudará a proteger el medio ambiente.
INFORMACIÓN ADICIONAL Composición de Foscan:
- El principio activo es la temoporfina. Cada ml contiene 4 mg de temoporfina.
- Los demás componentes son etanol anhidro (E1510) y propilenglicol (E1520).
Aspecto de Foscan y contenido del envase:
Foscan solución inyectable es una solución de color morado oscuro en un vial de vidrio color ámbar, Conteniendo 3,5 ml o 5 ml de solución.
Cada envase contiene un vial de vidrio y un filtro.