Fluenz Tetra Suspension Para Pulverizacion Nasal
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a un seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Fluenz Tetra suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Virus influenza reagrupado* (vivo atenuado) de las siguientes cuatro cepas**:
107,°±°,5 uff***
107,°±°,5 uff***
107,°±°,5 uff***
107,°±°,5 uff***
A/California/7/2009 cepa similar a (H1N1)pdm09 (A/Bolivia/559/2013, MEDI 255962)
A/Hong Kong/4801/2014 cepa similar a (H3N2) (A/New Caledonia/71/2014, MEDI 263122)
B/Brisbane/60/2008 cepa similar a (B/Brisbane/60/2008, MEDI 228030)
B/Phuket/3073/2013 cepa similar a (B/Phuket/3073/2013, MEDI 254977)
.......................................................................................................por dosis de 0,2 ml
* multiplicado en huevos de gallina fertilizados de gallineros sanos.
** producidas en células VERO por tecnología genética inversa. Este producto contiene organismos modificados genéticamente (OMG).
*** unidades de focos fluorescentes
Esta vacuna cumple con la recomendación de la OMS (hemisferio norte) y la decisión de la UE para la temporada 2016/2017.
La vacuna puede contener residuos de las siguientes sustancias: proteínas del huevo
(p. ej., ovoalbúmina) y gentamicina. La cantidad máxima de ovoalbúmina es menos de 0,024
microgramos por dosis de 0,2 ml (0,12 microgramos por ml).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para pulverización nasal
La suspensión es incolora a amarilla clara, transparente a opalescente. Puede presentar pequeñas partículas blancas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Profilaxis de la gripe en niños y adolescentes a partir de los 24 meses y menores de 18 años.
El uso de Fluenz Tetra debe basarse en recomendaciones oficiales.
4.2 Posología y forma de administración
Posología
Niños y adolescentes a partir de los 24 meses:
0,2 ml (administrados a razón de 0,1 ml en cada fosa nasal).
Para niños que no han sido vacunados antes contra la gripe estacional, debe administrarse una segunda dosis tras un intervalo mínimo de 4 semanas.
Fluenz Tetra no debe usarse en bebés ni en niños de menos de 24 meses por motivos de seguridad relacionados con el aumento de las tasas de hospitalización y sibilancias en esta población (ver sección 4.8).
Forma de administración
La inmunización debe llevarse a cabo por administración nasal.
No inyectar Fluenz Tetra.
Fluenz Tetra se administra como dosis dividida en ambas fosas nasales. Tras administrar la mitad de la dosis en una fosa nasal, administrar la otra mitad de la dosis en la otra fosa nasal inmediatamente o poco después. El paciente puede respirar con normalidad mientras se administra la vacuna; no hace falta inhalar ni aspirar activamente por la nariz.
Ver sección 6.6 para conocer las instrucciones de administración.
4.3 Contraindicaciones
- Hipersensibilidad a los principios activos, a alguno de los excipientes incluidos en la sección 6.1 (p. ej., la gelatina), a la gentamicina (un posible residuo vestigial), a los huevos o a las proteínas del huevo (p. ej., la ovoalbúmina).
- Niños y adolescentes con inmunodeficiencia clínica por afecciones o por tratamientos inmunosupresores como: leucemias agudas y crónicas, linfoma, infección sintomática por el VIH, deficiencias inmunitarias celulares y dosis elevadas de corticoesteroides. Fluenz Tetra no está contraindicado para su empleo en personas con infección asintomática por el VIH, ni en personas que reciben corticoesteroides tópicos/inhalados o corticoesteroides sistémicos a dosis bajas, ni en quienes reciben corticoesteroides como tratamiento sustitutivo, p. ej. en la insuficiencia suprarrenal.
- Niños y adolescentes menores de 18 años que reciben tratamiento con salicilato, debido a la asociación del síndrome de Reye con los salicilatos y la infección por cepas salvajes del virus influenza.
4.4 Advertencias y precauciones especiales de empleo
Como ocurre con la mayoría de las vacunas, se debe disponer siempre de supervisión y tratamiento médico adecuados para tratar un episodio anafiláctico o de hipersensibilidad grave tras la administración de Fluenz Tetra.
Fluenz Tetra no debe administrarse a niños y adolescentes con asma grave o sibilancias activas ya que estos individuos no han sido estudiados correctamente en los ensayos clínicos.
Se debe comunicar a los receptores de la vacuna que Fluenz Tetra es una vacuna de virus vivos atenuados y tiene potencial de transmisión a contactos inmunodeprimidos. Los receptores de la vacuna deben intentar evitar, en lo posible, el contacto estrecho con personas gravemente inmunodeprimidas (p. ej., receptores de transplantes de médula ósea que requieren aislamiento) durante 1-2 semanas después de la vacunación. La incidencia máxima de recuperación del virus vacunal tuvo lugar 2-3 días después de la vacunación en los estudios clínicos con Fluenz. En circunstancias en las que sea inevitable el contacto con personas gravemente inmunodeprimidas, el posible riesgo de transmisión del virus vacunal contra la gripe debe evaluarse frente al riesgo de adquirir y transmitir cepas salvajes del virus influenza.
Fluenz Tetra no debe inyectarse en ningún caso.
No existen datos relacionados con la seguridad de la administración intranasal de Fluenz Tetra en niños con malformación craneofacial no reparada.
4.5 Interacción con otros medicamentos y otras formas de interacción
No administrar Fluenz Tetra a niños ni a adolescentes que estén recibiendo tratamiento con salicilato (ver sección 4.3). No utilizar salicilatos en niños ni en adolescentes durante las 4 semanas posteriores a la vacunación a menos que esté médicamente indicado, ya que se ha registrado el síndrome de Reye tras el uso de salicilatos durante la infección por cepas salvajes del virus influenza.
Se ha estudiado la coadministración de Fluenz trivalente con las vacunas vivas atenuadas contra el sarampión, las paperas, la rubéola, la varicela y el poliovirus de administración oral. No se han observado cambios clínicamente relevantes en la respuesta inmunitaria al sarampión, las paperas, la varicela, al poliovirus de administración oral o a Fluenz. La respuesta inmunitaria a la vacuna de la rubéola se vio alterada de forma significativa. No obstante, esta alteración podría carecer de relevancia clínica con el programa de inmunización con dos dosis de la vacuna contra la rubéola.
Esta observación con Fluenz trivalente es relevante para el uso de Fluenz Tetra, ya que Fluenz Tetra (vacuna contra el virus influenza viva atenuada, nasal) es idéntico a Fluenz con la única diferencia de que a Fluenz Tetra se le ha añadido una cuarta cepa (una segunda cepa B).
No se ha estudiado la coadministración de Fluenz Tetra con vacunas inactivadas.
No se ha evaluado el uso concurrente de Fluenz Tetra con antivirales activos contra los virus influenza A y/o B. No obstante, basándose en el potencial de los antivirales contra la gripe para reducir la efectividad de Fluenz Tetra, se recomienda no administrar la vacuna hasta 48 horas después de la interrupción del tratamiento antiviral contra la gripe. La administración de antivirales contra la gripe en el plazo de dos semanas después de la vacunación puede afectar a la respuesta de la vacuna.
Si se administran simultáneamente antivirales contra la gripe y Fluenz Tetra, debe contemplarse la revacunación según criterio médico.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Hay datos limitados relativos al uso de Fluenz Tetra en mujeres embarazadas. No hubo evidencia de resultados adversos maternos significativos en 138 mujeres embarazadas que recibieron Fluenz trivalente según registro de una base de datos de reclamaciones de seguros médicos de EE. UU.
En 27 registros de administración de Fluenz a mujeres embarazadas del Sistema de Notificación de Reacciones Adversas a las Vacunas de EE. UU., no se observaron patrones inusuales de complicación durante el embarazo o en el feto.
Aunque los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción, y los datos posteriores a la comercialización, procedentes de la administración accidental de la vacuna, ofrecen cierta garantía, no se recomienda utilizar Fluenz Tetra durante el embarazo.
Lactancia
Se desconoce si Fluenz Tetra se excreta en la leche materna. Por tanto, como algunos virus se excretan en la lecha materna, Fluenz Tetra no debe utilizarse durante la lactancia.
Fertilidad
No existen datos acerca de los posibles efectos de Fluenz Tetra sobre la fertilidad masculina y femenina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Fluenz Tetra sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La experiencia de seguridad con Fluenz trivalente es relevante para el uso de Fluenz Tetra, ya que Fluenz Tetra (vacuna contra el virus influenza viva atenuada, nasal) es idéntico a Fluenz con la única diferencia de que a Fluenz Tetra se le ha añadido una cuarta cepa (una segunda cepa B).
Los datos de seguridad acerca del uso de Fluenz Tetra se basan en datos de estudios clínicos con esta vacuna en 1.382 niños y adolescentes de 2 a 17 años, en estudios clínicos con Fluenz en más de 29.000 niños y adolescentes de 2 a 17 años y en estudios de seguridad con Fluenz posteriores a su autorización en más de 84.000 niños y adolescentes de 2 a 17 años. Se ha obtenido experiencia adicional con el uso de Fluenz durante su comercialización.
En estudios clínicos, el perfil de seguridad de Fluenz Tetra fue similar al perfil de Fluenz. La reacción adversa observada con más frecuencia en los estudios clínicos fue la congestión nasal/rinorrea
Lista de reacciones adversas
Las frecuencias de las reacciones adversas se definen como:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Trastornos del sistema inmunológico
Poco frecuentes: reacciones de hipersensibilidad (incluyendo edema facial, urticaria y reacciones anafilácticas muy raras)
Trastornos del metabolismo y de la nutrición Muy frecuentes: disminución del apetito
Trastornos del sistema nervioso Muy frecuentes: cefalea
Trastornos respiratorios, torácicos y mediastínicos Muy frecuentes: congestión nasal/rinorrea Poco frecuentes: epistaxis
Trastornos de la piel y del tejido subcutáneo Poco frecuentes: exantema
Trastornos musculoesqueléticos y del tejido conjuntivo Frecuentes: mialgia
Trastornos generales y alteraciones en el lugar de administración Muy frecuentes: malestar Frecuentes: pirexia
En un estudio clínico controlado con tratamiento activo (MI CP111) se observó un aumento de la tasa de hospitalización (por cualquier causa) hasta 180 días después de la dosis final de vacunación en bebés y niños de 6 - 11 meses (Fluenz 6,1% frente a vacuna inyectable contra la gripe 2,6%). La mayoría de las hospitalizaciones se debieron a infecciones gastrointestinales y del tracto respiratorio y se produjeron después de más de 6 semanas tras la vacunación. La tasa de hospitalización no se vio incrementada en los receptores de Fluenz mayores de 12 meses. En el mismo estudio se observó un aumento de la tasa de sibilancias hasta 42 días en bebés y niños de 6 - 23 meses (Fluenz 5,9% frente a vacuna inyectable contra la gripe 3,8%). La tasa de sibilancias no se vio incrementada en los receptores de Fluenz mayores de 24 meses. Fluenz Tetra no está indicado para uso en bebés ni en niños menores de 24 meses (ver sección 4.2).
Se han observado también casos muy raros del síndrome de Guillain Barré y de exacerbación de los síntomas del síndrome de Leigh (encefalomiopatía mitocondrial) durante el período de comercialización de Fluenz.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Ha habido casos ocasionales de administración del doble de la dosis recomendada de Fluenz trivalente durante el período de post-comercialización. Las reacciones adversas registradas fueron similares a las observadas con la dosis única recomendada de Fluenz.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas contra la gripe, influenza viva atenuada, código ATC: J07BB03
Desde 1985, dos linajes distintos de los virus influenza B (Victoria y Yamagata) han circulado por todo el mundo. Fluenz Tetra es una vacuna tetravalente que contiene antígenos para cuatro cepas del virus influenza, una cepa A/(H1N1), una cepa A/(H3N2) y dos cepas B (una de cada linaje). Fluenz Tetra se ha fabricado según el mismo proceso que Fluenz. Las cepas del virus influenza de Fluenz Tetra están (a) adaptadas al frío (af); son (b) sensibles a la temperatura (st); y están (c) atenuadas (at). Como consecuencia, se multiplican en la nasofaringe e inducen una inmunidad protectora.
Estudios clínicos
La experiencia clínica con Fluenz es relevante para Fluenz Tetra ya que ambas vacunas se han fabricado siguiendo el mismo proceso y tienen composiciones superpuestas.
Estudios pediátricos
Eficacia de Fluenz
Los datos de eficacia de Fluenz en la población pediátrica consisten en 9 estudios controlados que incluyeron a más de 20.000 bebés, niños y adolescentes, realizados durante 7 temporadas de gripe. Cuatro estudios controlados con placebo incluyeron revacunación en la segunda temporada. Fluenz ha demostrado superioridad en 3 estudios controlados con tratamiento activo con vacuna inyectable contra la gripe. Ver en las Tablas 1 y 2 un resumen de los resultados de eficacia en la población pediátrica.
Tabla 1 Eficacia de Fluenz en estudios pediátricos controlados con placebo
|
Número del estudio |
Región |
Intervalo de edada |
Número de participantese n el estudiob |
Temporad a de gripe |
Eficacia (IC al 95%) c Cepas coincidente s |
Eficacia (IC al 95%)c Todas las cepas independientement e de la coincidencia |
|
D153-P50 |
Europa |
6 a 35 M |
1.616 |
2000 2001 |
85,4% (74,3; 92,2) |
85,9% (76,3; 92,0) |
|
2 |
2001 2002 |
88,7% (82,0; 93,2) |
85,8% (78,6; 90,9) | |||
|
D153-P50 |
África, Latinoaméric a |
6 a 35 M |
1.886 |
2001 |
73,5% (63,6; 81,0)d |
72,0% (61,9; 79,8)d |
|
4 |
2002 |
73,6% (33,3; 91,2) |
46,6% (14,9; 67,2) | |||
|
D153-P51 3 |
Asia/Oceanía |
6 a 35 M |
1.041 |
2002 |
62,2% (43,6; 75,2) |
48,6% (28,8; 63,3) |
|
D153-P52 2 |
Europa, Asia/Oceanía Latinoaméric a |
11 a24 M |
1.150 |
2002 2003 |
78,4% (50,9; 91,3) |
63,8% (36,2; 79,8) |
|
D153-P50 |
Asia/Oceanía |
12 a 35 |
2.764 |
2000 2001 |
72,9% (62,8; 80,5) |
70,1% (60,9; 77,3) |
|
1 |
M |
2001 2002 |
84,3% (70,1; 92,4)e |
64,2% (44,2; 77,3)e | ||
|
AV006 |
EE. UU. |
15 a 71 |
1.259 |
1996 1997 |
93,4% (87,5; 96,5) |
93,4% (87,5; 96,5) |
|
M |
1997 1998 |
100% (63,1; 100) |
87,1% (77,7; 92,6)f |
a M = meses.
b Número de participantes en el estudio para el análisis de eficacia en el año 1. c Reducción de la enfermedad de gripe confirmada por cultivo con respecto al placebo. d Los datos presentados para el ensayo clínico D153-P504 son de participantes en el estudio que recibieron dos dosis de la vacuna en estudio. En los participantes en el estudio sin vacunación anterior que recibieron una dosis en el año 1, la eficacia fue del 57,7% (IC al 95%: 44,7; 67,9) y del 56,3% (IC al 95%: 43,1; 66,7), respectivamente, lo cual respalda la necesidad de dos dosis de vacuna en niños sin vacunación anterior. e En los participantes en el estudio que recibieron 2 dosis en el año 1 y placebo en el año 2, la eficacia en el año 2 fue del 56,2% (IC al 95%: 30,5; 72,7) y del 44,8% (IC al 95%: 18,2; 62,9), respectivamente, en D153-P501, respaldando así la necesidad de la revacunación en la segunda temporada. f La principal cepa circulante era antigénicamente diferente de la cepa H3N2 vacunal; la eficacia contra la cepa no coincidente A/H3N2 fue del 85,9% (IC al 95%: 75,3; 91,9).
Tabla 2 Eficacia relativa de Fluenz en estudios pediátricos controlados con tratamiento activo con vacuna inyectable contra la gripe
|
Número del estudio |
Región |
Intervalo de edada |
Número de participantes en el estudio |
Temporada de gripe |
Eficacia mejorada (IC al 95%)b Cepas coincidentes |
Eficacia mejorada (IC al 95%)b Todas las cepas independientemente de la coincidencia |
|
MI-CP111 |
EE. UU., Europa, Asia/Oceanía |
6 a 59 M |
7.852 |
2004 - 2005 |
44,5% (22,4; 60,6) menos casos que el inyectable |
54,9% (45,4; 62,9)c menos casos que el inyectable |
|
D153-P514 |
Europa |
6 a 71 M |
2.085 |
2002 - 2003 |
52,7% (21,6; 72,2) menos casos que el inyectable |
52,4% (24,6; 70,5)d menos casos que el inyectable |
|
D153-P515 |
Europa |
6 a 17 A |
2.211 |
2002 - 2003 |
34,7% (3,9; 56,0) menos casos que el inyectable |
31,9% (1,1; 53,5) menos casos que el inyectable |
a M = meses. A = años. Intervalo de edad como se describió en el protocolo del estudio. b Reducción de la enfermedad de gripe confirmada por cultivo con respecto a la vacuna inyectable contra la gripe.
c Fluenz demostró un 55,7% (39,9; 67,6) menos de casos que la vacuna inyectable contra la gripe en 3.686 bebés y niños de 6 - 23 meses y un 54,4% (41,8; 64,5) menos de casos en 4.166 niños de 24 - 59 meses. d Fluenz demostró un 64,4% (1,4; 88,8) menos de casos que la vacuna inyectable contra la gripe en 476 bebés y niños de 6 - 23 meses y un 48,2% (12,7; 70,0) menos casos en 1.609 niños de 24 - 71 meses.
Seguridad de Fluenz
Condiciones crónicas
Aunque se ha establecido la seguridad en niños y adolescentes con asma de leve a moderado, los datos en niños con otras enfermedades pulmonares o con enfermedades cardiovasculares, metabólicas o renales crónicas son limitados.
En un estudio (D153-P515) con niños de 6 a 17 años con asma (Fluenz trivalente: n=1.114, vacuna de la gripe inyectable trivalente: n=1.115), no hubo diferencias significativas entre los grupos de tratamiento en la incidencia de las exarcebaciones de asma, el pico de flujo espiratorio medio, las puntuaciones de síntomas de asma o las puntuaciones de despertares nocturnos. La incidencia de sibilancia en los 15 días posteriores a la vacunación fue menor en los pacientes que recibieron Fluenz con respecto a los pacientes que recibieron vacuna inactivada (19,5% frente a 23,8%, P=0,02).
En un estudio con niños y adolescentes de 9 a 17 años con asma de moderado a grave (Fluenz trivalente: n=24, placebo: n=24), el principal criterio de seguridad, el cambio en el porcentaje del volumen espiratorio forzado pronosticado en 1 segundo (VEFi) medido antes y después de la vacunación no fue diferente entre los grupos de tratamiento.
En estudios con adultos con un alto porcentaje de individuos con condiciones médicas crónicas subyacentes, el perfil de seguridad de Fluenz trivalente fue similar al perfil de seguridad observado en individuos sin estas condiciones.
Pacientes inmunodeprimidos
En 24 niños infectados con VIH y 25 niños negativos en VIH de 1 a 7 años, y en 243 niños y adolescentes infectados con VIH de 5 a 17 años en tratamiento con terapia antirretroviral estable, la frecuencia y duración de la eliminación del virus de la vacuna fueron similares a las observadas en individuos sanos. No se identificaron efectos adversos en la carga viral de VIH o en los recuentos de
CD4 tras la administración de Fluenz trivalente. Veinte niños y adolescentes inmunodeprimidos de leves a moderados de 5 a 17 años (en tratamiento con quimioterapia y/o radioterapia o que habían recibido quimioterapia recientemente) fueron aleatorizados 1:1 con Fluenz trivalente o placebo. La frecuencia y duración de la eliminación del virus de la vacuna en estos niños y adolescentes fueron similares a las observadas en niños y adolescentes sanos. No se ha evaluado la eficacia de Fluenz y Fluenz Tetra a la hora de evitar la gripe en individuos inmunodeprimidos.
Inmunogenicidad de Fluenz Tetra
Se realizó un estudio de no inferioridad, multicéntrico, aleatorizado, doble ciego y controlado con tratamiento activo para valorar la inmunogenicidad de Fluenz Tetra en comparación con Fluenz (control activo) en niños y adolescentes de 2 a 17 años. Se aleatorizaron por centro un total de 2.312 niños y adolescentes en una proporción de 3:1:1 para recibir Fluenz Tetra o una de dos formulaciones de vacuna Fluenz comparativa, cada una con una cepa B que se correspondía con una de las dos cepas B de Fluenz Tetra (una cepa B del linaje Yamagata y una cepa B del linaje Victoria).
La inmunogenicidad se evaluó comparando la media geométrica de los títulos (MGT) de anticuerpos de inhibición de la hemaglutinación (HAI) en suero específicos de la cepa tras la dosis. Fluenz Tetra demostró la no inferioridad inmunológica a las dos formulaciones de Fluenz ya que el límite superior para cada uno de los cuatro ICs al 95% para las proporciones de MGT de anticuerpos de HAI específicos de la cepa tras la dosis fue de < 1,5.
Estudios en adultos
Varios estudios frente a placebo han mostrado que Fluenz puede tener cierta eficacia en adultos.
No obstante, no se pudo alcanzar una conclusión acerca del beneficio clínico de esta vacuna en adultos dado que los resultados observados en algunos estudios frente a vacunas inyectables contra la influenza insinuaron una menor eficacia de Fluenz.
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales no clínicos de toxicidad a dosis repetidas, toxicidad para la reproducción y el desarrollo, tolerancia local y neurovirulencia.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Sacarosa
Fosfato potásico dibásico Fosfato potásico monobásico Gelatina (porcina, Tipo A)
Clorhidrato de arginina Monohidrato de glutamato monosódico Agua para inyección
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 18 semanas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar el aplicador nasal en el embalaje exterior para protegerlo de la luz.
Antes del uso, la vacuna puede sacarse de la nevera una vez durante un periodo máximo de 12 horas a una temperatura de hasta 25 °C. Si no se ha utilizado tras este periodo de 12 horas, la vacuna debe desecharse.
6.5 Naturaleza y contenido del envase
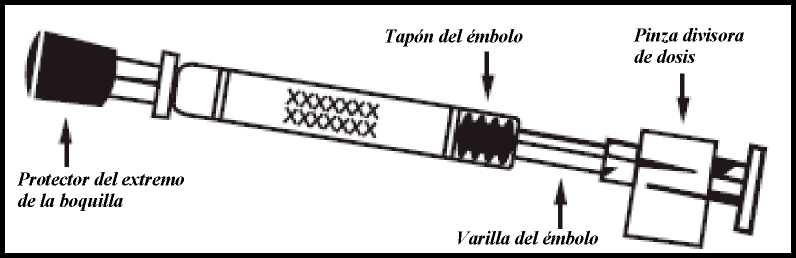
Fluenz Tetra se suministra como una suspensión de 0,2 ml en un aplicador nasal de un solo uso (de vidrio Tipo 1) con boquilla (de polipropileno con válvula de transferencia de polietileno), cápsula protectora del extremo de la boquilla (goma sintética), varilla del émbolo, tapón del émbolo (goma de butilo) y una pinza divisora de dosis.
Tamaño del envase de 1 o 10 unidades.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Administración
Fluenz Tetra DEBE UTILIZARSE POR VÍA NASAL ÚNICAMENTE.
• NO UTILIZAR CON UNA AGUJA. No inyectar.

• No utilizar Fluenz Tetra si la fecha de caducidad ha expirado o si el pulverizador está dañado, por ejemplo si el émbolo está suelto o desplazado del pulverizador o si hay algún signo de pérdida de contenido.
• Fluenz Tetra se administra como dosis dividida en ambas fosas nasales.
• Tras administrar la mitad de la dosis en una fosa nasal, administrar la otra mitad de la dosis en la otra fosa nasal inmediatamente o poco después.
• El paciente puede respirar normalmente mientras se administra la vacuna; no hace falta inhalar ni aspirar activamente por la nariz.
• Consultar el diagrama de administración de Fluenz Tetra (Figura 1) para conocer las instrucciones de administración paso a paso.
Figura 1 Administración de Fluenz Tetra
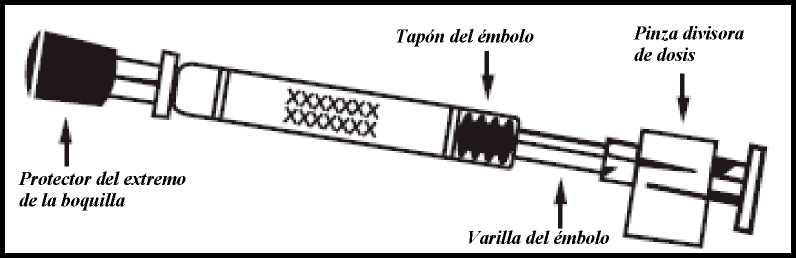
Comprobar la fecha de caducidad
El producto debe utilizarse antes de la fecha indicada en la etiqueta del aplicador.
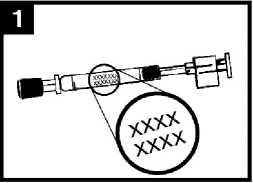
Preparar el aplicador
Retirar la cápsula de goma protectora del extremo. No retirar la pinza divisora de dosis que hay en el otro extremo del aplicador.
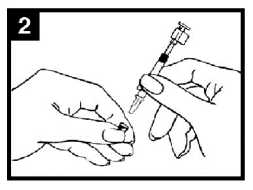
Colocar el aplicador
Con el paciente en posición vertical, colocar el extremo dentro de la fosa nasal para garantizar que Fluenz Tetra se administra en la nariz.
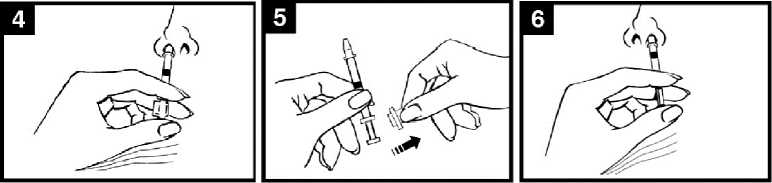
Presionar el émbolo
Con un solo movimiento, presionar el émbolo lo más rápidamente posible hasta que la pinza divisora de dosis impida continuar.
Retirar la pinza divisora de dosis
Para administrar en la otra fosa nasal, pinzar y retirar la pinza divisora de dosis del émbolo.
Pulverizar en la otra fosa nasal
Colocar el extremo inmediatamente
dentro de la otra fosa nasal y, con un solo movimiento, presionar el émbolo lo más rápidamente posible
para administrar el resto de la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local para desechos médicos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MedImmune, LLC Lagelandseweg 78 6545 CG Nimega Países Bajos (Tel) +31 24 371 7310
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/887/001
EU/1/13/887/002
EU/1/13/887/003
EU/1/13/887/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 04 de diciembre 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DE LOS PRINCIPIOS ACTIVOS BIOLÓGICOS Y FABRICANTE RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante de los principios activos biológicos
MedImmune, UK Limited Plot 6, Renaissance Way Boulevard Industry Park Speke
Liverpool L24 9JW United Kingdom
Nombre y dirección del fabricante responsable de la liberación de los lotes
MedImmune, UK Limited Plot 6, Renaissance Way Boulevard Industry Park Speke
Liverpool L24 9JW United Kingdom
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamentos sujetos a prescripción médica.
• Liberación oficial de los lotes
De conformidad con el Artículo 114 de la Directiva 2001/83/CE modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización. Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ENVASE DE 1 APLICADOR NASAL DE UN SOLO USO ENVASE DE 1 APLICADOR NASAL DE UN SOLO USO (EN EMBALAJE CON TRÍPTICO)
ENVASE DE 10 APLICADORES NASALES DE UN SOLO USO (EN BANDEJAS) ENVASE DE 10 APLICADORES NASALES DE UN SOLO USO_
1. NOMBRE DEL MEDICAMENTO
Fluenz Tetra suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal) Temporada 2016/2017
2. PRINCIPIO(S) ACTIVO(S)
Virus influenza reagrupado* (vivo atenuado) de las siguientes cuatro cepas**:
A/California/7/2009 cepa similar a (H1N1)pdm09 (A/Bolivia/559/2013, MEDI 255962)
A/Hong Kong/4801/2014 cepa similar a (H3N2) (A/New Caledonia/71/2014, MEDI 263122)
B/Brisbane/60/2008 cepa similar a (B/Brisbane/60/2008, MEDI 228030)
B/Phuket/3073/2013 cepa similar a (B/Phuket/3073/2013, MEDI 254977)
107’0±0’5 UFF*
107’0±0’5 UFF*
107,°±°,5 UFF**
107,°±°,5 uff***
por dosis de 0,2 ml
* multiplicado en huevos de gallina fertilizados de gallineros sanos. ** producidas en células VERO por tecnología genética inversa.
*** unidades de focos fluorescentes.
Esta vacuna cumple las recomendaciones de la OMS (Hemisferio Norte) y la decisión de la UE para la temporada 2016/2017.
3. LISTA DE EXCIPIENTES
Contiene también: sacarosa, fosfato potásico dibásico, fosfato potásico monobásico, gelatina (porcina, Tipo A), clorhidrato de arginina, monohidrato de glutamato monosódico, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión para pulverización nasal 1 aplicador nasal de un solo uso (0,2 ml)
10 aplicadores nasales de un solo uso (0,2 ml cada uno)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Solamente para uso por vía nasal. No inyectar.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
No congelar. Proteger de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MedImmune, LLC Lagelandseweg 78 6545 CG Nimega Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/887/002 <1 pulverizador> EU/1/13/887/001 <10 pulverizadores> EU/1/13/887/003 <1 pulverizador> EU/1/13/887/004 <10 pulverizadores>
13. NÚMERO DE LOTE
Lote
|
14. |
CONDICIONES GENERALES DE DISPENSACIÓN | |
|
Medicamento sujeto a prescripción médica | ||
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Se acepta la justificación para no incluir la información en Braille | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
Incluido el código de barras 2D que lleva el identificador único. | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
|
PC: |
{número} | |
|
SN: {número} | ||
|
NN: {número} | ||
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS ENVASE DE 5 APLICADORES NASALES DE UN SOLO USO
1. NOMBRE DEL MEDICAMENTO
Fluenz Tetra suspensión para pulverización nasal Vacuna contra el virus influenza (viva atenuada, nasal) Temporada 2016/2017
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MedImmune, LLC
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS_
Solamente para uso por vía nasal. No inyectar.
5 aplicadores nasales de un solo uso (0,2 ml cada uno) Conservar en nevera. No congelar.
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
APLICADOR NASAL DE UN SOLO USO
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Fluenz Tetra
Vacuna contra el virus influenza Temporada 2016/2017
2. FORMA DE ADMINISTRACIÓN
Solamente para uso por vía nasal.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
LOT
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Fluenz Tetra suspensión para pulverización nasal
Vacuna contra el virus influenza (viva atenuada, nasal)
Este medicamento está sujeto a un seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de administrar la vacuna, porque contiene información importante para usted o para su hijo.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
- Esta vacuna se le ha recetado solamente a usted o a su hijo y no debe dársela a otras personas.
- Si considera que alguno de los efectos adversos que sufre es grave, consulte a su médico, enfermero o farmacéutico. Esto incluye cualquier efecto adverso posible no mencionado en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Fluenz Tetra y para qué se utiliza
2. Qué necesita saber antes de administrar Fluenz Tetra
3. Cómo se administra Fluenz Tetra
4. Posibles efectos adversos
5. Conservación de Fluenz Tetra
6. Contenido del envase e información adicional
1. Qué es Fluenz Tetra y para qué se utiliza
Fluenz Tetra es una vacuna para prevenir la gripe. Se utiliza en niños y adolescentes de más de 24 meses y menos de 18 años. Fluenz Tetra le ayudará a protegerse de las cuatro cepas de virus contenidas en la vacuna y otras cepas estrechamente relacionadas con ellas.
Cómo actúa Fluenz Tetra
Fluenz Tetra es idéntico a Fluenz (vacuna nasal para la gripe que contiene tres cepas), la única diferencia es que Fluenz Tetra ofrece protección frente a una cepa adicional.
Cuando se administra la vacuna a una persona, el sistema inmunitario (el sistema de defensa natural del organismo) produce su propia protección contra el virus de la gripe. Ninguno de los componentes de la vacuna puede provocar la gripe.
Los virus de la vacuna Fluenz Tetra se cultivan en huevos de gallina. Cada año, la vacuna actúa contra cuatro cepas de la gripe, siguiendo las recomendaciones anuales de la Organización Mundial de la Salud.
2. Qué necesita saber antes de administrar Fluenz Tetra No se le administrará Fluenz Tetra:
• si es alérgico a los huevos, a las proteínas del huevo, a la gentamicina, a la gelatina o a cualquiera de los demás componentes de esta vacuna (estos se enumeran en la sección 6 “Contenido del envase e información adicional”). Para conocer los signos de las reacciones alérgicas, ver la sección 4 “Posibles efectos adversos”.
• si padece un trastorno de la sangre o un cáncer que afecte al sistema inmunitario.
• si su médico le ha dicho que tiene usted el sistema inmunitario debilitado a consecuencia de una enfermedad, medicamento u otro tratamiento.
• si ya está tomando ácido acetilsalicílico (una sustancia presente en muchos medicamentos utilizados para aliviar el dolor y bajar la fiebre). Esto se debe al riesgo de una enfermedad muy rara pero grave (el síndrome de Reye).
Si se cumple alguna de estas condiciones, informe a su médico, enfermero o farmacéutico. Advertencias y precauciones
Informe a su médico, enfermero o farmacéutico antes de la vacunación:
• si el niño tiene menos de 24 meses. No se debe vacunar a los niños menores de 24 meses debido al riesgo de los efectos adversos.
• si padece asma grave o actualmente sibilancias.
• si está en contacto estrecho con alguien que tiene el sistema inmunitario fuertemente debilitado (por ejemplo, un paciente trasplantado de médula ósea que necesita aislamiento).
Si se cumple alguna de estas condiciones, informe a su médico, enfermero o farmacéutico antes de la vacunación. Él o ella decidirá si Fluenz Tetra es adecuado para usted.
Otros medicamentos, otras vacunas y Fluenz Tetra
Informe a su médico, enfermero o farmacéutico si la persona vacunada está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento, incluyendo medicamentos que no requieran prescripción.
• No administre ácido acetilsalicílico (una sustancia presente en muchos medicamentos utilizados para aliviar el dolor y bajar la fiebre) a niños durante 4 semanas después de la vacunación con Fluenz Tetra a menos que su médico, enfermero o farmacéutico le indique lo contrario. Esto se debe al riesgo de sufrir síndrome de Reye, una enfermedad muy rara, pero grave, que puede perjudicar al cerebro y al hígado.
• Se recomienda no administrar Fluenz Tetra al mismo tiempo que medicamentos antivirales como oseltamivir y zanamivir. Esto se debe a que la vacuna podría perder eficacia.
Su médico, enfermero o farmacéutico decidirán si se puede administrar Fluenz Tetra al mismo tiempo que otras vacunas.
Embarazo y lactancia
• Si está embarazada, cree que podría estar embarazada, tiene intención de quedarse embarazada o está en periodo de lactancia, consulte a su médico, enfermero o farmacéutico antes de utilizar esta vacuna. Fluenz Tetra no se recomienda para mujeres embarazadas o en periodo
de lactancia.
Conducción y uso de máquinas
• La influencia de Fluenz Tetra sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
3. Cómo se administra Fluenz Tetra
Fluenz Tetra se administrará bajo la supervisión de un médico, enfermero o farmacéutico.
Fluenz Tetra solo debe utilizarse en pulverización nasal.
Fluenz Tetra no debe inyectarse.
Fluenz Tetra se administrará como una pulverización en cada fosa nasal. Puede respirar con normalidad mientras se le administra Fluenz Tetra. No hace falta que inhale ni aspire activamente.
Posología
La dosis recomendada para niños y adolescentes es de 0,2 ml de Fluenz Tetra, administrados a razón de 0,1 ml en cada fosa nasal. Los niños que no han sido vacunados antes contra la gripe recibirán una segunda dosis de seguimiento tras un intervalo mínimo de 4 semanas. Siga las instrucciones de su médico, enfermero o farmacéutico acerca de si su hijo debe acudir para la segunda dosis y cuándo.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, enfermero o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran. En los estudios clínicos realizados con esta vacuna, la mayoría de efectos adversos fueron breves y de naturaleza leve.
Consulte a su médico, enfermero o farmacéutico si desea más información acerca de los posibles efectos adversos de Fluenz Tetra.
Algunos efectos adversos pueden ser graves.
Muy raros
(pueden afectar hasta 1 de cada 1.000.000 personas)
• reacciones alérgicas graves: entre los signos de reacción alérgica pueden figurar dificultad para respirar e hinchazón de la cara o de la lengua.
Informe a su médico de inmediato o busque atención sanitaria urgente si nota alguno de estos síntomas.
Otros posibles efectos adversos de Fluenz Tetra Muy frecuentes
(pueden afectar a más de 1 de cada 10personas):
• nariz congestionada o con mocos
• disminución del apetito
• debilidad
• dolor de cabeza
Frecuentes
(pueden afectar hasta 1 de cada 10personas):
• fiebre
• dolores musculares
Poco frecuentes
(pueden afectar hasta 1 de cada 100personas):
• erupción cutánea
• hemorragia nasal
• reacciones alérgicas
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fluenz Tetra
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en la etiqueta del aplicador después de las letras EXP.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Conserve el aplicador nasal en el embalaje exterior para protegerlo de la luz.
Antes del uso, la vacuna puede sacarse de la nevera una vez durante un periodo máximo de 12 horas a una temperatura de hasta 25 °C. Si no se ha utilizado tras este periodo de 12 horas, la vacuna debe desecharse.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Fluenz Tetra
Los principios activos son:
Virus influenza reagrupado* (vivo atenuado) de las siguientes cuatro cepas**:
A/California/7/2009 cepa similar a (H1N1)pdm09 (A/Bolivia/559/2013, MEDI 255962)
A/Hong Kong/4801/2014 cepa similar a (H3N2) (A/New Caledonia/71/2014, MEDI 263122)
B/Brisbane/60/2008 cepa similar a (B/Brisbane/60/2008, MEDI 228030)
B/Phuket/3073/2013 cepa similar a (B/Phuket/3073/2013, MEDI 254977)
107,°±0,5 UFF***
10
,7,0 ± 0,5
UFF*
107,°±°,5 uff***
.......................................................................................................por dosis de 0,2 ml
* multiplicado en huevos de gallina fertilizados de gallineros sanos.
** producidas en células VERO por tecnología genética inversa. Este producto contiene organismos modificados genéticamente (OMG).
*** unidades de focos fluorescentes
Esta vacuna cumple con la recomendación de la OMS (Organización Mundial de la Salud, Hemisferio Norte) y la decisión de la UE para la temporada 2016/2017.
Los demás componentes son sacarosa, fosfato potásico dibásico, fosfato potásico monobásico, gelatina (porcina, Tipo A), clorhidrato de arginina, monohidrato de glutamato monosódico y agua para inyección.
Aspecto de Fluenz Tetra y contenido del envase
Esta vacuna se presenta en suspensión para pulverización nasal en un aplicador nasal de un solo uso (0,2 ml) en un tamaño de envase de 1 y 10 unidades. Puede que solamente estén disponibles en su país algunos tamaños de envases.
La suspensión es de incolora a amarilla clara, de transparente a ligeramente turbia. Puede presentar pequeñas partículas blancas.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: MedImmune, LLC, Lagelandseweg 78, 6545 CG Nijmegen, Países Bajos, (Tel) +31 24 371 7310
Responsable de la fabricación: MedImmune, UK Limited, Plot 6, Renaissance Way, Boulevard Industry Park, Speke, Liverpool, L24 9JW, Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien Lietuva
AstraZeneca S.A./N.V. UAB AstraZeneca Lietuva
Tel: +32 2 370 48 11 Tel: +370 5 2660550
Etarapna
Acrpa3eHeKa Etarapna EOOfl Tea.: +359 24455000
Ceská republika
AstraZeneca Czech Republic s.r.o.
Tel: +420 222 807 111
Danmark
AstraZeneca A/S Tlf: +45 43 66 64 62
Deutschland
AstraZeneca GmbH Tel: +49 41 03 7080
Eesti
AstraZeneca Tel: +372 6549 600
EXXáSa
AstraZeneca A.E.
T^: +30 210 6871500
España
AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00
Luxembourg/Luxemburg
AstraZeneca S.A./N.V.
Tél/Tel: +32 2 370 48 11
Magyarország
AstraZeneca Kft.
Tel.: +36 1 883 6500
Malta
Associated Drug Co. Ltd Tel: +356 2277 8000
Nederland
AstraZeneca BV Tel: +31 79 363 2222
Norge
AstraZeneca AS Tlf: +47 21 00 64 00
Osterreich
AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0
Polska
AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 245 73 00
France
AstraZeneca
Tél: +33 1 41 29 40 00
Hrvatska
AstraZeneca d.o.o.
Tel: +385 1 4628 000
Ireland
AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100
Ísland
Vistor hf.
Sími: +354 535 7000 Italia
AstraZeneca S.p.A.
Tel: +39 02 98011
Kórcpog
A^skt©p Oap^aKeuxiKq AxS T^: +357 22490305
Latvija
SIA AstraZeneca Latvija Tel: +371 67377100
Portugal
AstraZeneca Produtos Farmacéuticos, Lda. Tel: +351 21 434 61 00
Romanía
AstraZeneca Pharma SRL Tel: +40 21 317 60 41
Slovenija
AstraZeneca UK Limited Tel: +386 1 51 35 600
Slovenská republika
AstraZeneca AB, o.z.
Tel: +421 2 5737 7777
Suomi/Finland
AstraZeneca Oy Puh/Tel: +358 10 23 010
Sverige
AstraZeneca AB Tel: +46 8 553 26 000
United Kingdom
AstraZeneca UK Ltd Tel: +44 1582 836 836
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Instrucciones para profesionales sanitarios
Esta información está destinada únicamente a profesionales del sector sanitario:
Fluenz Tetra debe utilizarse por vía nasal únicamente.
• No utilizar con una aguja. No inyectar.

• No utilizar Fluenz Tetra si la fecha de caducidad ha expirado o si el pulverizador está dañado, por ejemplo si el émbolo está suelto o desplazado del pulverizador o si hay algún signo de pérdida de contenido.
• Fluenz Tetra se administra como dosis dividida en ambas fosas nasales tal y como se describe a continuación. (Ver también Cómo se administra Fluenz Tetra, en la sección 3).
• Tras administrar la mitad de la dosis en una fosa nasal, administrar la otra mitad de la dosis en la otra fosa nasal inmediatamente o poco después.
• El paciente puede respirar normalmente mientras se administra la vacuna; no hace falta inhalar ni aspirar activamente por la nariz.
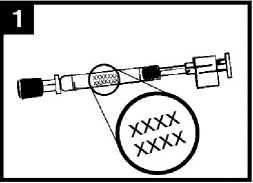
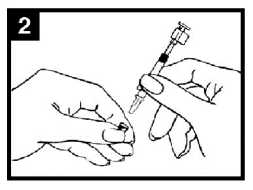
Comprobar la fecha de caducidad
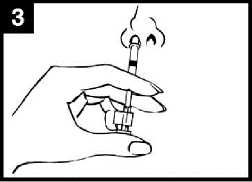
El producto debe utilizarse antes de la fecha indicada en la etiqueta del aplicador.
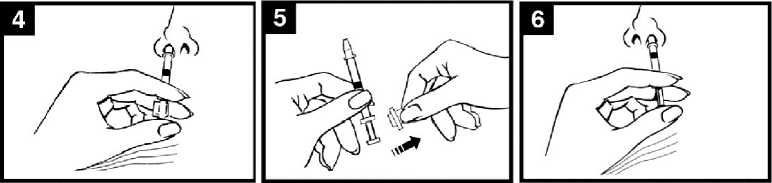
Presionar el émbolo
Con un solo movimiento, presionar el émbolo lo más rápidamente posible hasta que la pinza divisora de dosis impida continuar.
Preparar el aplicador
Retirar la cápsula de goma protectora del extremo. No retirar la pinza divisora de dosis que hay en el otro extremo del aplicador.
Retirar la pinza divisora de dosis
Para administrar en la otra fosa nasal, pinzar y retirar la pinza divisora de dosis del émbolo.
Colocar el aplicador
Con el paciente en posición vertical, colocar el extremo dentro de la fosa nasal para garantizar que Fluenz Tetra se administra en la nariz.
Pulverizar en la otra fosa nasal
Colocar el extremo inmediatamente dentro de la otra fosa nasal
y, con un solo movimiento, presionar el émbolo lo más rápidamente posible
para administrar el resto de la vacuna.
Ver la sección 5 para obtener información acerca de la conservación y eliminación
30