Flixotide 125 Microgramos, Suspensión Para Inhalación En Envase A Presión
Información obsoleta, busque otro1.
NOMBRE DEL MEDICAMENTO
Flixotide 50 microgramos, suspensión para inhalación en envase a presión Flixotide 125 microgramos, suspensión para inhalación en envase a presión Flixotide 250 microgramos, suspensión para inhalación en envase a presión Flixotide Accuhaler 100 microgramos, polvo para inhalación Flixotide Accuhaler 250 microgramos, polvo para inhalación Flixotide Accuhaler 500 microgramos, polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2.1 Flixotide, suspensión para inhalación en envase a presión Cada aplicación contiene:
Flixotide 50 Flixotide 125 Flixotide 250
Fluticasona, propionato 50 microgramos 125 microgramos 250 microgramos
(0,83 mg/g) (1,67 mg/g) (3,33 mg/g)
2.2 Flixotide Accuhaler, polvo para inhalación Cada alvéolo contiene:
Flixotide 250 250 microgramos
Flixotide 500 500 microgramos
Flixotide 100
Fluticasona, propionato 100 microgramos
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Flixotide 50, 125 y 250, se presentan en suspensión para inhalación en envase a presión. Flixotide Accuhaler 100, 250 y 500 se presentan en polvo para inhalación.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
ASMA:
Adultos
Tratamiento profiláctico en:
Asma leve (valores de Flujo Espiratorio Máximo superiores al 80% pronosticado en condiciones basales con una variabilidad inferior al 20%): Pacientes que requieren una medicación broncodilatadora sintomática intermitente para el asma con una frecuencia mayor que esporádicamente.
Asma moderada (valores de Flujo Espiratorio Máximo del 60 - 80% pronosticados en condiciones basales con una variabilidad del 20 - 30%): Pacientes que requieren medicación regular para el asma y pacientes con asma inestable o que empeora con la terapia profiláctica hasta ahora aplicada o con broncodilatadores únicamente.
Asma grave (valores de Flujo Espiratorio Máximo menores del 60% pronosticado en condiciones basales con variabilidad superior al 30%): Pacientes con asma crónica grave. Al cambiarles al propionato de fluticasona por inhalación, muchos pacientes con dependencia de los corticoides sistémicos, para poder controlar adecuadamente los síntomas, pueden reducir significativamente o suprimir su necesidad de corticosteroides orales.
Niños
- Niños que requieren medicación preventiva para el asma, incluyendo pacientes no controlados con
la medicación profiláctica actualmente disponible.
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA (EPOC):
Tratamiento sintomático de pacientes con EPOC en los que se ha identificado una respuesta beneficiosa durante los primeros 3-6 meses de tratamiento.
4.2 Posología y forma de administración
Flixotide, suspensión para inhalación en envase a presión y Flixotide Accuhaler, polvo para inhalación se administrarán sólo por vía inhalatoria.
Deberá informarse a los pacientes de la naturaleza profiláctica de la terapia con propionato de fluticasona por inhalación y de que deben tomarlo regularmente aunque estén asintomáticos. El inicio del efecto es de 4 a 7 días.
La dosis de propionato de fluticasona debe ajustarse de acuerdo con la respuesta individual.
Si los pacientes encontraran que el alivio con broncodilatadores de corta duración se vuelve menos eficaz o necesitan más inhalaciones de las habituales, deberán solicitar atención médica.
Cuando se prescriba Flixotide, suspensión para inhalación en envase a presión, se señalará la presentación que proporcione la dosis indicada con un mínimo de 2 inhalaciones.
Los pacientes con dificultad en coordinar la inhalación con la inspiración en el empleo de Flixotide, suspensión para inhalación en envase a presión podrán utilizar una cámara de inhalación.
4.2.1 ASMA:
Adultos y niños de más de 16 años de edad 100 a 1.000 microgramos dos veces al día.
La dosis inicial de propionato de fluticasona a inhalar deberá ser la adecuada a la gravedad de la enfermedad.
Asma leve: 100 a 250 microgramos dos veces al día.
Asma moderada: 250 a 500 microgramos dos veces al día.
Asma grave: 500 a 1.000 microgramos dos veces al día.
La dosis puede ajustarse a continuación hasta controlar los síntomas o reducirse a la mínima dosis eficaz de acuerdo con la respuesta individual.
Alternativamente, la dosis inicial de propionato de fluticasona puede calibrarse como la mitad de la dosis total diaria de dipropionato de beclometasona o budesonida cuando se administra por vía inhalatoria.
Niños de más de 4 años de edad 50 a 100 microgramos dos veces al día.
Los niños deberán comenzar con una dosis inicial de propionato de fluticasona por inhalación que sea adecuada a la gravedad de su enfermedad. Esta puede ser de 50 o 100 microgramos dos veces al día.
La dosis puede ajustarse a continuación hasta controlar los síntomas o reducirse a la mínima dosis eficaz de acuerdo con la respuesta individual.
Niños de 1 a 4 años de edad
La administración de propionato de fluticasona por vía inhalatoria es beneficiosa en niños más pequeños para el control de los síntomas asmáticos frecuentes y persistentes.
En los ensayos clínicos realizados con niños de 1 a 4 años de edad se ha demostrado que se alcanza un control óptimo del asma con la administración de 100 microgramos dos veces al día, administrados mediante un dispositivo espaciador para pacientes pediátricos provisto de una mascarilla (tal como el dispositivo espaciador Babyhaler).
El diagnóstico y el tratamiento del asma deberán revisarse con regularidad.
Ancianos y pacientes con insuficiencia hepática o renal
No hay necesidad de ajustar la dosis en ancianos ni en pacientes con disfunción hepática o renal. En caso de insuficiencia hepática grave, deberá controlarse la función cortical (ver sección 4.4).
4.2.2 ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA (EPOC):
Adultos: 500 microgramos dos veces al día.
Se advertirá a los pacientes que deben usar Flixotide diariamente para alcanzar un beneficio óptimo. El beneficio se observa generalmente en 3 a 6 meses. Sin embargo, si no hay mejoría tras 3 a 6 meses de tratamiento, entonces el paciente ha de someterse a un examen médico.
4.3 Contraindicaciones
Flixotide, suspensión para inhalación en envase a presión y Flixotide Accuhaler, polvo para inhalación están contraindicados en pacientes con antecedentes de hipersensibilidad a cualquiera de sus componentes (ver sección 6.1).
Advertencias y precauciones especiales de empleo
4.4
El tratamiento del asma debe seguir un programa escalonado, siendo evaluada la respuesta del paciente mediante criterios clínicos y pruebas de función respiratoria. Deberá prestarse especial atención a aquellos pacientes que precisen un incremento en la dosis de p2-agonistas de corta duración para controlar los síntomas del asma. Si se produce esta situación, deberá revisarse el plan terapéutico del paciente. Un deterioro repentino y progresivo en el control del asma puede ser potencialmente peligroso para la vida del paciente, y se debe considerar la posibilidad de aumentar la dosis de esteroides. Se debe estudiar en los pacientes de riesgo la necesidad de verificar diariamente el Flujo Espiratorio Máximo.
Flixotide no debe utilizarse en los ataques agudos sino como tratamiento habitual a largo plazo. Los pacientes precisarán un broncodilatador inhalado de acción rápida y corta para el alivio de los síntomas agudos de asma.
En caso de falta de respuesta o exacerbaciones de leves a moderadas, se aumentará la dosis de propionato de fluticasona inhalado, y si fuera necesario se dará un corticoide sistémico y/o antibiótico si hay infección.
Hubo un aumento de notificaciones de infecciones de las vías respiratorias bajas (especialmente neumonía y bronquitis) durante el estudio de TORCH en pacientes con EPOC que recibieron propionato de fluticasona comparado con placebo (ver sección 4.8). Los pacientes de edad avanzada, pacientes con un índice de masa corporal bajo (<25 kg/m2) y los pacientes clasificados como muy graves (VEMS <30 % del normal) tuvieron mayor riesgo de desarrollar neumonía con independencia del tratamiento. Los médicos deben permanecer alerta ante el posible desarrollo de neumonía y otras infecciones de las vías respiratorias bajas en pacientes con EPOC, ya que las características clínicas de tales infecciones se superponen con frecuencia con las de las exacerbaciones. Si un paciente con EPOC grave ha experimentado neumonía, se debe reevaluar el tratamiento con Flixotide.
Deberá comprobarse la técnica de inhalación del paciente tratado con Flixotide suspensión para inhalación en envase a presión, para asegurar que la pulsación del inhalador va sincronizada con la inspiración a fin de asegurar una óptima entrada del fármaco en los pulmones.
Es posible que algunos pacientes puedan notar alguna sensación o sabor diferente, con respecto a las formulaciones de Flixotide 50 microgramos, 125 microgramos y 250 microgramos, suspensión para inhalación en envase a presión que utilizaban previamente.
En pacientes con alteración hepática grave se efectuará regularmente un seguimiento de la función de la corteza suprarrenal. En caso de observarse una insuficiencia en la función cortical, la dosis de propionato de fluticasona puede reducirse escalonadamente y bajo cuidadosa vigilancia.
Al igual que con otra terapia para administración por vía inhalatoria, puede aparecer broncoespasmo paradójico, aumentando de forma inmediata la sibilancia tras la administración. Deberá de interrumpirse inmediatamente la administración de Flixotide, examinar al paciente e instituir una terapia alternativa si fuera necesario.
Pueden aparecer efectos sistémicos con cualquier corticosteroide administrado por vía inhalatoria, especialmente cuando se administran dosis elevadas durante largos períodos. La probabilidad de que estos efectos aparezcan es mucho menor que con corticosteroides administrados por vía oral. Los posibles efectos sistémicos incluyen síndrome de Cushing, aspecto cushingoide, supresión corticosuprarrenal, retraso en el crecimiento de los niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma. Por tanto, es importante someter al paciente a controles periódicos y reducir la dosis de corticosteroide inhalado a la dosis mínima con la cual se mantenga un control eficaz (ver sección 4.8).
El tratamiento prolongado con altas dosis de corticosteroides inhalados puede causar supresión corticosuprarrenal y crisis corticosuprarrenal aguda. Los niños y adolescentes menores de 16 años que reciben dosis más altas que las permitidas de fluticasona (habitualmente más de 1000 microgramos al día), pueden estar, en particular, en situación de riesgo. Las situaciones que podrían potencialmente desencadenar una crisis corticosuprarrenal aguda incluyen: trauma, cirugía, infección o cualquier reducción rápida de la dosis. Los síntomas que aparecen son habitualmente vagos y pueden incluir anorexia, dolor abdominal, pérdida de peso, cansancio, cefalea, náuseas, vómitos, hipotensión, disminución del nivel de conciencia, hipoglucemia y convulsiones. Se debe de valorar la administración adicional de corticosteroides por vía sistémica durante periodos de estrés o cirugía electiva.
Se recomienda controlar de forma regular la altura de los niños que reciben tratamiento prolongado con corticosteroides inhalados.
Se debe tratar con especial cuidado y controlar regularmente la función corticosuprarrenal a los pacientes a los que se cambia el tratamiento a base de corticosteroides orales con propionato de fluticasona por vía inhalatoria.
Tras la introducción del propionato de fluticasona por vía inhalatoria, la retirada de la terapia sistémica debe ser gradual y se debe advertir a los pacientes y/o sus familiares de que ante situaciones de estrés tales como ingresos hospitalarios o intervenciones quirúrgicas, informen al médico acerca del tratamiento para que éste valore la necesidad de terapia adicional con corticoides sistémicos.
Similarmente la sustitución del tratamiento esteroideo sistémico por terapia inhalada puede desenmascarar a veces procesos alérgicos extrapulmonares tales como rinitis alérgica o eczemas previamente controlados por el fármaco sistémico. Estas alergias deben tratarse sintomáticamente con antihistamínicos y/o preparaciones tópicas, incluyendo esteroides tópicos.
El tratamiento con Flixotide, suspensión para inhalación en envase a presión o Flixotide Accuhaler, polvo para inhalación no debe suspenderse repentinamente.
Muy raramente se han notificado casos de aumento de los niveles de glucosa en sangre (ver sección 4.8). Por ello, esta circunstancia debe tenerse en cuenta a la hora de prescribir esta medicación a pacientes con un historial de diabetes mellitus.
Como con todos los corticosteroides inhalados, deberá tenerse especial cuidado en pacientes con tuberculosis activa o larvada.
Durante su uso postcomercialización se han notificado interacciones medicamentosas clínicamente significativas en pacientes tratados con propionato de fluticasona y ritonavir, dando lugar a efectos sistémicos de tipo corticosteroide incluyendo síndrome de Cushing y supresión corticosuprarrenal. Por lo tanto, debería evitarse el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos secundarios sistémicos de tipo corticosteroide (ver sección 4.5).
Advertencias sobre excipientes:
Flixotide Accuhaler contiene lactosa. Puede provocar reacciones alérgicas en pacientes con alergia a la proteína de la lecha de vaca.
Los pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben usar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En circunstancias normales, se obtienen bajas concentraciones plasmáticas de propionato de fluticasona después de la inhalación, debido a un intenso primer paso hepático y a un alto
aclaramiento sistémico producido por el citocromo P450 3A4 en el intestino e hígado. Por lo tanto es improbable que se produzcan interacciones medicamentosas, clínicamente significativas en las que intervenga el propionato de fluticasona.
En un estudio sobre la interacción del fármaco llevado a cabo en sujetos sanos, se ha demostrado que ritonavir (potente inhibidor del citocromo P450 3A4) puede aumentar de manera considerable las concentraciones de propionato de fluticasona en plasma, dando lugar a una notable disminución de las concentraciones de cortisol en suero. Durante su uso postcomercialización se han notificado interacciones medicamentosas clínicamente significativas en pacientes tratados con propionato de fluticasona intranasal o inhalado y ritonavir, dando lugar a efectos sistémicos de tipo corticosteroide incluyendo síndrome de Cushing y supresión corticosuprarrenal. Por lo tanto, debería evitarse el uso concomitante de propionato de fluticasona y ritonavir, a menos que el beneficio potencial para el paciente sea mayor que el riesgo de aparición de efectos sistémicos de tipo corticosteroide.
En varios estudios realizados se ha demostrado que otros inhibidores del citocromo P450 3A4 producen incrementos insignificantes (eritromicina) y menores (ketoconazol) de la exposición sistémica al propionato de fluticasona, sin reducción notable de las concentraciones de cortisol en suero. No obstante se aconseja tener precaución si se administran conjuntamente inhibidores potentes del citocromo P450 3A4 (ejemplo ketoconazol) ya que pueden aumentar la exposición sistémica al propionato de fluticasona.
4.6 Embarazo y lactancia
Embarazo: No hay evidencia suficiente acerca de la seguridad en mujeres embarazadas. La administración sistémica de corticosteroides a animales preñados puede causar anormalidades en el desarrollo fetal, incluyendo paladar hendido y retraso en el crecimiento intrauterino. Aunque la exposición sistémica es menor con corticoides inhalados, sólo debe de valorarse la administración de Flixotide a mujeres embarazadas si el beneficio esperado para la madre supera cualquier posible riesgo para el feto. En este caso, se deberá de utilizar la dosis mínima eficaz requerida para mantener un control adecuado del asma.
Lactancia: No se ha investigado la excreción de propionato de fluticasona en leche humana. En ratas, el propionato de fluticasona se excreta a través de la leche. Únicamente se deberá de valorar la administración de Flixotide a mujeres en periodo de lactancia si el beneficio esperado para la madre es superior al posible riesgo para el niño.
En estudios con animales, el propelente norflurano no ha producido efectos en el feto, pero no hay estudios en el hombre. Se desconoce si el nuevo propelente norflurano, o sus metabolitos, pasan a la leche materna.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No es probable que el propionato de fluticasona produzca ningún efecto.
4.8 Reacciones adversas
Las reacciones adversas que se relacionan a continuación han sido clasificadas por órgano, sistemas y frecuencia. Las frecuencias se han definido de la siguiente forma: muy frecuentes (>1/10), frecuentes (>1/100 y <1/10), poco frecuentes (>1/1.000 y <1/100), raras (> 1/10.000 y 1<1.000) y muy raras (<1/10.000) incluyendo informes aislados. Las reacciones muy frecuentes, frecuentes y poco frecuentes se han identificado a partir de los datos de ensayos clínicos. Las reacciones raras y muy raras se han identificado a través de las notificaciones de profesionales sanitarios.
Infecciones e infestaciones:
Muy frecuentes: Candidiasis orofaríngea. Para su prevención, puede ser útil que los pacientes se enjuaguen la boca con agua después de utilizar tanto el Inhalador como el Accuhaler.
Frecuentes: Neumonía y bronquitis (en pacientes con EPOC).
Trastornos del sistema inmunológico
Se han comunicado reacciones de hipersensibilidad con las siguientes manifestaciones:
Poco frecuentes: Reacciones de hipersensibilidad cutánea.
Muy raras: Angioedema (principalmente edema facial y orofaríngeo), síntomas respiratorios (disnea y/o broncoespasmo) y reacciones anafilácticas.
Trastornos endocrinos:
Posibles efectos sistémicos (ver sección 4.4).
Muy raras: Síndrome de Cushing, aspecto cushingoide, supresión corticosuprarrenal, retraso en el crecimiento, disminución de la densidad mineral ósea, cataratas y glaucoma.
Trastornos del metabolismo y de la nutrición:
Muy raras: Hiperglucemia.
Trastornos psiquiátricos
Muy raras: Ansiedad, trastornos del sueño y alteraciones del comportamiento, incluyendo hiperactividad e irritabilidad (fundamentalmente en niños).
Trastornos del sistema nervioso
Muy frecuentes: Cefalea.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: Ronquera, irritación de la garganta.
Muy raras: Broncoespasmo paradójico (ver sección 4.4).
Algunos pacientes pueden padecer ronquera y candidiasis en boca y garganta. Ambos cuadros pueden aliviarse haciendo gargarismos con agua tras utilizar este producto. La candidiasis sintomática puede tratarse con terapia antifúngica tópica mientras continúa el tratamiento con Flixotide.
Trastornos de la piel y del tejido subcutáneo
Frecuentes: Contusiones.
4.9 Sobredosis
Síntomas y signos
La inhalación de forma aguda de dosis de propionato de fluticasona superiores a las recomendadas aprobadas puede producir una supresión temporal de la función corticosuprarrenal. Esta situación no requiere normalmente tomar ninguna medida urgente, ya que la función corticosuprarrenal se recupera en algunos días, como se comprueba con las determinaciones de cortisol en plasma.
Sobredosis crónica de propionato de fluticasona inhalado: véase el apartado riesgo de supresión corticosuprarenal (sección 4.4). Puede ser necesario realizar un seguimiento de la reserva corticosuprarrenal. En casos de sobredosis de propionato de fluticasona, puede continuarse la terapia con una posología adecuada para el control de los síntomas (ver sección 4.4).
Tratamiento
Se debe vigilar estrechamente a los pacientes que reciben dosis más altas de las autorizadas. La dosis debe reducirse paulatinamente.
5. PROPIEDADES FARMACOLÓGICAS
FTFLIX - 35.1 (GSD 29 febrero 2011)
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Glucocorticoides, código ATC: R03BA05. Mecanismo de acción
El propionato de fluticasona administrado por vía inhalatoria a las dosis recomendadas tiene una acción antiinflamatoria glucocorticoidea potente en el interior de los pulmones que se traduce en una reducción de los síntomas y de las exacerbaciones del asma. Los síntomas de EPOC disminuyen significativamente y la función pulmonar mejora, independientemente de la edad del paciente, sexo, función pulmonar basal, hábito de fumar o atopia. Ello puede dar origen a una mejoría significativa de la calidad de vida. Estos resultados se alcanzan sin los efectos indeseables observados cuando los glucocorticosteroides se administran por vía sistémica.
La eficacia del propionato de fluticasona en pacientes con EPOC no se puede predecir a partir de la respuesta “positiva o negativa” a una pauta corta con esteroides orales. Las ventajas en términos de síntomas, exacerbaciones o estado de salud se observan generalmente en un plazo de 6 meses.
Función corticosuprarrenal
La producción total diaria de hormonas corticosuprarrenales permanece dentro del rango normal durante el tratamiento crónico con propionato de fluticasona por inhalación, incluso con las dosis más altas recomendadas en niños y adultos. Tras la transferencia de otros esteroides inhalados al propionato de fluticasona inhalado, la producción diaria mejora gradualmente a pesar del uso intermitente pasado y presente de los esteroides orales, demostrándose así el retorno de la función corticosuprarrenal normal con el propionato de fluticasona inhalado. La reserva corticosuprarrenal permanece también normal durante el tratamiento crónico con el propionato de fluticasona por inhalación, lo que se verifica mediante un incremento normal con la prueba de estimulación. Sin embargo, puede persistir durante un tiempo considerable alguna disfunción residual de la reserva corticosuprarrenal como consecuencia de los tratamientos previos, lo cual debe ser tenido en cuenta (ver sección 4.4).
Estudios clínicos
Hay una reducción significativa de los síntomas de EPOC y una mejora en la función pulmonar con independencia de la edad del paciente, el género, la función pulmonar basal, hábito tabáquico o estado de atopia. Esto puede tener como resultado una mejora significativa en la calidad de la vida.
Estudio TORCH (TOwards a Revolution in COPD Health):
TORCH ha sido un estudio de 3 años de duración para valorar el efecto del tratamiento con salmeterol-propionato de fluticasona Accuhaler 50/500 microgramos dos veces al día, salmeterol Accuhaler 50 microgramos dos veces al día, propionato de fluticasona (PF) Accuhaler 500 microgramos dos veces al día o placebo sobre mortalidad por todas las causas en pacientes con EPOC. Los pacientes con EPOC con valores basales (pre broncodilatador) de VEMS <60% del predicho fueron aleatorizados al tratamiento bajo doble ciego. Durante el estudio, a los pacientes se les permitió la terapia habitual de EPOC a excepción de otros corticosteroides inhalados, broncodilatadores de larga duración y corticosteroides sistémicos a largo plazo. Se determinó la supervivencia a los 3 años de todos los pacientes, con independencia de la posible retirada del estudio. El criterio de valoración primario fue la reducción de la mortalidad por todas las causas a los 3 años para salmeterol-propionato de fluticasona vs placebo.
|
Placebo |
Salmeterol 50 |
FP 500 |
Salmeterol-propionato de fluticasona 50/500 | |
|
N = 1.524 |
N = 1.521 |
N = 1.534 |
N = 1.533 | |
|
Mortalidad por todas las causas a los 3 años | ||||
|
Número de muertes |
231 |
205 |
246 |
193 |
|
(%) |
(15,2%) |
(13,5%) |
(16,0%) |
(12,6%) |
|
Cociente de riesgos vs placebo (ICs) valor p |
N/A |
0,879 (0,73; 1,06) |
1,060 (0,89; 1,27) |
0,825 (0,68; 1,00 ) |
|
0,180 |
0,525 |
0,0521 | ||
|
Cociente de riesgos salmeterol-propionato de fluticasona 50/500 vs |
N/A |
0,932 |
0,774 |
N/A |
|
componentes (ICs) |
(0,77; 1,13) |
(0,64; 0,93) | ||
|
valor p |
0,481 |
0,007 | ||
1. Valor p no significativo después de ajustar para 2 análisis intermedios en la comparación de la valoración primaria de eficacia mediante un análisis log-rank, estratificado por la condición de fumador
Hubo una tendencia hacia una mayor supervivencia en sujetos tratados con salmeterol-propionato de fluticasona comparado con placebo durante 3 años, sin embargo ésta no logró el nivel de significación estadística p<0.05.
El porcentaje de pacientes que murieron durante los 3 años debido a causas relacionadas con EPOC fue 6,0% para el placebo, 6,1% para el salmeterol, 6,9% para PF y 4,7% para salmeterol-propionato de fluticasona.
La media de exacerbaciones moderadas a graves por año disminuyó significativamente con salmeterol-propionato de fluticasona cuando se comparó con el tratamiento con salmeterol, PF y el placebo (tasa media en el grupo de salmeterol-propionato de fluticasona 0,85 comparado con 0,97 en el grupo de salmeterol, 0,93 en el grupo de PF y 1,13 en el placebo). Esto se traduce en una reducción en la tasa de exacerbaciones moderadas a severas del 25% (IC 95%: 19% a 31%; p<0,001) comparado con placebo, un 12% comparado con salmeterol (IC 95%: 5% a 19%; p=0,002) y 9% comparado con PF (IC 95%: 1% a 16%; p=0,024). Salmeterol y PF redujeron significativamente las tasas de exacerbación comparadas con placebo en un 15% (IC 95%: 7% a 22%; p<0,001) y 18% (IC 95%: 11% a 24%; p<0,001) respectivamente.
La Calidad de Vida Relacionada con la Salud, evaluada mediante el Cuestionario Respiratorio de St George (SGRQ) mejoró con todos los tratamientos activos en comparación con placebo. Una disminución de 4 unidades se considera clínicamente relevante. La mejora media a los tres años para salmeterol-propionato de fluticasona comparado con placebo fue -3,1 unidades (IC 95%: -4,1 a -2,1; p<0,001), comparado con salmeterol fue -2,2 unidades (p<0,001) y comparado con PF fue -1,2 unidades (p=0,017).
La probabilidad estimada a 3 años de padecer neumonía, notificada como acontecimiento adverso, fue del 12,3% para el grupo placebo, 13,3% para salmeterol, 18,3% para FP y 19,6% para salmeterol-propionato de fluticasona (cociente de riesgos para salmeterol-propionato de fluticasona vs placebo: 1,64, IC 95%: 1,33 a 2,01; p<0,001). No hubo incremento de las muertes relacionadas con neumonía; el número de muertes atribuidas a neumonía mientras duró el tratamiento fue de 7 para el grupo placebo, 9 para salmeterol, 13 para FP y 8 para salmeterol-propionato de fluticasona. No se produjo una diferencia significativa en la probabilidad de fractura ósea (5,1% placebo, 5,1% salmeterol, 5,4% FP y 6,3% salmeterol-propionato de fluticasona; cociente de riesgos para salmeterol-propionato de fluticasona vs placebo: 1,22, IC 95%: 0,87 a 1,72, p=0,248).
Los ensayos clínicos controlados con placebo de 6 a 12 meses de duración han mostrado que el uso regular de salmeterol-propionato de fluticasona Accuhaler 50/500 microgramos mejora la función pulmonar y reduce la sensación de ahogo y la utilización de medicación de rescate.
5.2. Propiedades farmacocinéticas Absorción
La biodisponibilidad absoluta del propionato de fluticasona para cada uno de los dispositivos de aspiración disponibles se ha estimado a partir de estudios y de comparaciones entre estudios de datos farmacocinéticos de propionato de fluticasona inhalado e intravenoso. En sujetos adultos sanos la biodisponibilidad absoluta se ha estimado en un 7,8% para propionato de fluticasona Accuhaler y en un 10,9% para propionato de fluticasona inhalador, respectivamente. Se ha observado un menor grado de exposición sistémica a propionato de fluticasona inhalado en pacientes con asma o EPOC. La absorción sistémica ocurre principalmente a través de los pulmones y es inicialmente rápido y después prolongado. El resto de la dosis inhalada puede ser tragada pero contribuye mínimamente a la exposición sistémica, debido a la baja solubilidad acuosa y metabolismo pre-sistémico, teniendo como resultado una disponibilidad oral menor del 1%. Hay un incremento lineal de la exposición sistémica conforme aumenta la dosis inhalada.
Distribución
El propionato de fluticasona tiene un amplio volumen de distribución en equilibrio (aproximadamente 300 L). La unión a proteínas plasmáticas es moderadamente alta (91%).
Metabolismo
El propionato de fluticasona se aclara muy rápidamente de la circulación sistémica, principalmente por metabolización a un ácido carboxílico inactivo, mediante la enzima CYP3A4 del citocromo P450. Se debe prestar atención cuando se co-administra con inhibidores conocidos del CYP3A4, ya que la exposición sistémica al propionato de fluticasona puede verse potencialmente aumentada.
Eliminación
La disposición del propionato de fluticasona se caracteriza por un aclaramiento plasmático alto (1.150 ml/min) y una vida media terminal de aproximadamente 8 h. El aclaramiento renal del propionato de fluticasona es insignificante (menos del 0,2%) y menos del 5% como metabolito.
5.3. Datos preclínicos sobre seguridad
Los estudios toxicológicos sólo han mostrado la clase de efectos típicos de un corticosteroide potente a dosis que exceden de las propuestas para el uso terapéutico.
El propionato de fluticasona no fue mutagénico en las pruebas estándar de Ames, de fluctuación de E. coli, mutación génica de S. cerevisiae o en el ensayo con células ováricas de hámster chino. No fue clastogénico en los ensayos de micronúcleo con ratón y de linfocitos humanos cultivados.
En un estudio acerca de la fertilidad y de la función reproductora general realizado en ratas, la administración por vía subcutánea de 50 microgramos/kg/día a hembras y de 100 microgramos/kg/día (la dosis se redujo posteriormente a 50 microgramos/kg/día) a machos de propionato de fluticasona no tuvo efecto alguno sobre el apareamiento o la fertilidad.
Se han realizado estudios con animales para evaluar la actividad del propionato de fluticasona sobre el desarrollo embrionario de ratones, ratas y conejos. La administración subcutánea de propionato de fluticasona a ratones preñados causó los efectos típicos de esta clase de fármaco. La administración de una dosis maternalmente tóxica de 150 microgramos/kg originó reducción en la ganancia de peso en las madres y, como era de esperar, indujo paladar hendido en algunos fetos.
En ratas, la administración de una dosis elevada de 100 microgramos/kg fue tóxica para las madres, al observarse reducción en la ganancia de peso y causó retraso en el desarrollo embrionario que se hizo evidente por la aparición de retraso en la osificación y una pequeña incidencia de onfalocele. Los estudios con conejos demostraron la particular sensibilidad de esta especie a esta clase de fármaco. Dosis de 30 microgramos/kg y superiores no fueron compatibles con el sostenimiento de un embarazo y dosis de 0,57 y 4,0 microgramos/kg causaron reducción en el peso fetal y paladar hendido con la dosis más elevada. Sin embargo, la administración por vía oral de dosis de hasta 300microgramos/kg no causaron maternotoxicidad ni embriotoxicidad. En estudios de fertilidad realizados con ratas, dosis de hasta 50 microgramos/kg afectaron el peso corporal de las madres y efectos asociados a la dosis sobre el crecimiento en las generaciones F0 y F1. No obstante, no hubo efecto alguno sobre la fertilidad o el apareamiento. Dosis de hasta 50 microgramos/kg de propionato de fluticasona no tuvieron efectos perceptibles sobre el desarrollo peri- y postnatal en ratas.
No se dispone de estudios suficientes y bien controlados con mujeres embarazadas. Se desconoce si tras administración por vía inhalatoria, el propionato de fluticasona pasa a leche materna. Pequeñas cantidades de glucocorticosteroides administrados por vía sistémica se excretan en leche materna. Actualmente, no hay evidencia de acción teratogénica en humanos.
El propelente no clorofluorocarbonado, norflurano, ha mostrado carecer de efecto tóxico a concentraciones del gas muy elevadas, muy superiores a aquéllas que probablemente reciban los pacientes, en una amplia variedad de especies animales expuestas diariamente durante periodos de dos años.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Flixotide suspensión para inhalación en envase a presión Norflurano.
Flixotide Accuhaler, polvo para inhalación Lactosa (monohidrato). (Contiene proteínas lácteas).
6.2 Incompatibilidades No se han descrito.
6.3 Periodo de validez
Flixotide, suspensión para inhalación en envase a presión: 24 meses. Flixotide Accuhaler, polvo para inhalación: 18 meses.
6.4 Precauciones especiales de conservación
Flixotide, suspensión para inhalación en envase a presión, al igual que otros aerosoles, puede sufrir una disminución del efecto terapéutico si el cartucho se enfría. Proteger de la luz solar directa y no congelar, no conservar a temperatura superior a 30°C. El cartucho no debe perforarse, romperse o quemarse aun cuando aparentemente esté vacío. Colocar el protector de la boquilla empujando firmemente y cerrando de un golpe, para que la tapa quede en su sitio.
Flixotide Accuhaler, polvo para inhalación proporciona una buena protección del contenido de los alvéolos frente a los factores ambientales; no obstante, no conservar a temperatura superior a 30°C. Conservar protegido de la humedad. El dispositivo está protegido por un envoltorio de aluminio que sólo debe abrirse cuando se va a usar por primera vez. Una vez abierto el envoltorio de aluminio debe desecharse.
6.5 Naturaleza y contenido del envase
Flixotide, Inhalador
Cartuchos fabricados con una aleación de aluminio que está provisto de una válvula dosificadora. Los cartuchos encajan en unos aplicadores que incorporan un orificio atomizador y están provistos de un protector contra el polvo. Cada cartucho proporciona 60 ó 120 aplicaciones.
Flixotide, Accuhaler
Flixotide Accuhaler se presenta en forma de un dispositivo de plástico que contiene una tira de doble lámina de aluminio con 60 alvéolos regularmente distribuidos. El dispositivo está envasado dentro de un envoltorio de aluminio.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Instrucciones de uso/manipulación
Flixotide, suspensión para inhalación en envase a presión Comprobación del inhalador
Antes de usar por primera vez el inhalador o bien si no ha sido utilizado durante una semana o más tiempo, quitar el protector de la boquilla apretando suavemente por los lados, agitar el inhalador concienzudamente, y liberar al aire dos dosis para asegurar, de esta manera, el funcionamiento del inhalador.
Uso del inhalador
1.- Quitar el protector de la boquilla, apretando suavemente por los lados.

Comprobar que no hay partículas extrañas por dentro y por fuera del inhalador, incluyendo la boquilla.
3.-
Agitar bien el cartucho del inhalador para asegurar la eliminación de cualquier partícula extraña y que el contenido del inhalador se mezcla adecuadamente.

4.
Sujetar el inhalador verticalmente entre los dedos índice y pulgar, colocando el pulgar sobre la base por debajo de la boquilla.

5. Echar tanto aire como razonablemente se pueda e introducir a continuación la boquilla en la
boca, entre los dientes, cerrando los labios sobre el aparato pero sin morderlo.

6. Inmediatamente después de comenzar a tomar aire por la boca, pulsar el inhalador para liberar el
propionato de fluticasona y continuar tomando aire profunda y constantemente.

7. Contener la respiración y sacar el inhalador de la boca. Continuar conteniendo la respiración
tanto como razonablemente se pueda.

8. Si se va a administrar otra inhalación, mantener el inhalador derecho y esperar durante aproximadamente medio minuto antes de repetir los pasos 3 a 7.
9. Después, enjuagar su boca con agua y escupirla.
FTFLIX - 35.1 (GSD 29 febrero 2011)
10. Volver a colocar el protector de la boquilla empujando firmemente y ajustándolo hasta oír un chasquido.
Importante
No efectuar rápidamente los pasos 5, 6 y 7. Es importante iniciar la respiración tan lentamente como se pueda, justamente antes de pulsar el inhalador. Practicar delante de un espejo durante las primeras veces. Si se observa una "especie de niebla" saliendo de la parte superior del inhalador o de los lados de la boca, comenzar de nuevo desde el paso 2.
Los pacientes que encuentren dificultad en coordinar el manejo del inhalador con la inhalación, pueden utilizar alternativamente una cámara para inhalación.
Las personas con manos frágiles, deberán sujetar el inhalador con ambas manos para lo cual, se pondrán los dos dedos índice en la parte superior del inhalador y los dos pulgares en la base, por debajo de la boquilla.

Niños
Los niños pequeños pueden necesitar ayuda, teniendo un adulto que manejar el inhalador por ellos. Animar al niño a echar el aire y accionar el inhalador justo después de que el niño comience a tomar aire. Practicar juntos la técnica.
Existen dispositivos espaciadores pediátricos, que se usan con una máscara, como el Babyhaler, para asegurar la correcta administración a niños.
Limpieza
Limpiar el inhalador una vez a la semana, por lo menos.
a. - Quite el protector de la boquilla.
b. - No saque el cartucho metálico de la carcasa de plástico.
c. - Limpie el interior y exterior de la boquilla con un pañuelo o paño seco.
d. - Vuelva a colocar el protector de la boquilla.
Puede añadirse al agua un detergente suave o una solución del tipo de las usadas para limpiar biberones. Enjuagar concienzudamente con agua limpia antes de secar. NO PONER EL CARTUCHO METÁLICO EN EL AGUA.
Flixotide Accuhaler, polvo para inhalación
El dispositivo está envasado en un envoltorio de aluminio para mantenerlo protegido de la humedad. Este sólo debe abrirse cuando se vaya a utilizar por primera vez. Una vez abierto el envoltorio de aluminio se debe desechar. El dispositivo tiene dos posiciones: cerrado y abierto.
CERRADO
Al abrir el estuche y sacar por primera vez el dispositivo del envoltorio de aluminio, estará cerrado.
Carcasa externa \_
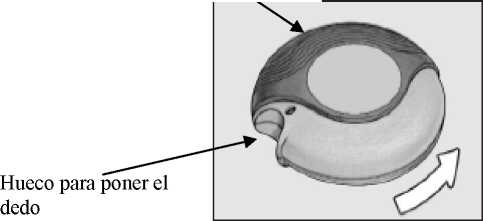
El inhalador se abre en esta dirección
ABIERTO
El dispositivo contiene 60 dosis individuales del medicamento en forma de polvo. El indicador de dosis señala cuántas dosis quedan.
Carcasa externa
Aplicador bucal o boquilla
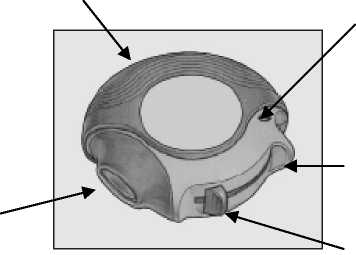
Indicador de dosis Lleno Vacío 60 ■ 0
Hueco para poner el dedo
Palanca
Cada dosis está precisamente medida y protegida higiénicamente. No se requiere ni mantenimiento ni rellenado.
El indicador de dosis en la parte superior del dispositivo señala cuántas dosis quedan. Los números de 5 a 0 aparecerán en ROJO para así advertir que quedan pocas dosis.
El manejo del dispositivo es fácil. Cuando se necesite una dosis, seguir las cinco sencillas instrucciones siguientes:
|
A. |
Abrir |
|
B. |
Deslizar |
|
C. |
Inhalar |
|
D. |
Cerrar |
|
E. |
Enjuagar |
Funcionamiento del dispositivo
Al deslizar la palanca del dispositivo se abre un pequeño orificio en el aplicador bucal o boquilla y queda disponible una dosis ya preparada para ser inhalada. Cuando se cierra el dispositivo, la palanca automáticamente retrocede a su posición original quedando preparada para la siguiente dosis que necesite. La carcasa externa protege el dispositivo cuando no se utiliza.
Abrir - Cómo usar el dispositivo
A.
Para abrir el dispositivo, coger con una mano la carcasa extema y colocar el dedo pulgar de la otra mano en el hueco reservado para ello. Empujar con el dedo alejándolo de usted hasta donde llegue.

B. Deslizar
Mantener el dispositivo con la boquilla hacia usted. Deslizar la palanca alejándola hasta donde llegue - se percibirá un sonido "clic". El dispositivo está preparado para su uso. Cada vez que la palanca se echa hacia atrás, queda disponible una dosis para su inhalación. Esto lo muestra el contador de dosis. No manipular la palanca pues quedarían dosis disponibles que
serían desperdiciadas.
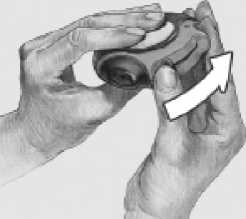
i
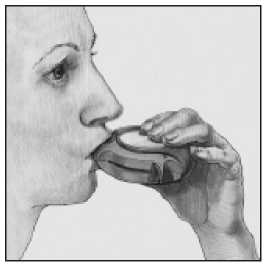
C. Inhalar
• Antes de empezar a inhalar una dosis, leer atentamente todo este apartado.
• Mantener el dispositivo alejado de la boca. Espirar lo que razonablemente se pueda -no hacerlo dentro del dispositivo
• Colocar la boquilla en los labios. Inspirar progresiva e intensamente - a través del dispositivo, no por la nariz.
• Sacar el dispositivo de la boca.
• Mantener la respiración unos 10 segundos o tanto tiempo como sea posible.
• Espirar lentamente.
Cerrar
D.
Para cerrar el dispositivo, poner el dedo pulgar en el hueco reservado para ello y deslizado hacia usted, hasta donde llegue.
Al cerrar el dispositivo, se escuchará un golpe seco. La palanca automáticamente vuelve a su posición original y queda de nuevo colocada. El dispositivo está ahora preparado para volverlo a utilizar.

E. Enjuagar
Después, enjuagar su boca con agua y escupirla.
Si el médico ha prescrito dos inhalaciones, cerrar el dispositivo y repetir las instrucciones A a E. RECORDAR
Mantener el dispositivo seco.
Mantener el dispositivo cerrado cuando no se utilice.
No espirar dentro del dispositivo.
Deslizar la palanca únicamente cuando esté preparado para tomar una dosis.
No exceder la dosis fijada. Mantener fuera del alcance de los niños.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline, S.A.
Parque Tecnológico de Madrid C/ Severo Ochoa, 2 8760 Tres Cantos (Madrid)
NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
8.
Flixotide 50 pg, suspensión para inhalación en envase a presión: n° registro:60.477 Flixotide 125 pg, suspensión para inhalación en envase a presión: n° registro:60.478 Flixotide 250 pg, suspensión para inhalación en envase a presión: n° registro:60.479 Flixotide Accuhaler 100 pg, polvo para inhalación: n° registro:60.480 Flixotide Accuhaler 250 pg, polvo para inhalación: n° registro:60.481 Flixotide Accuhaler 500 pg, polvo para inhalación: n° registro:60.482
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Febrero de 2007.
10. FECHA DE LA REVISIÓN DEL TEXTO
Diciembre 2011
FTFLIX - 35.1 (GSD 29 febrero 2011)