Feiba 1000 Uf Polvo Y Disolvente Para Solucion Inyectable
Prospecto: información para el paciente FEIBA 1000 UF polvo y disolvente para solución inyectable Complejo coagulante antiinhibidor
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.4.
Contenido del prospecto
1. Qué es FEIBA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar FEIBA
3. Cómo usar FEIBA
4. Posibles efectos adversos
5. Conservación de FEIBA
6. Contenido del envase e información adicional
1. Qué es FEIBA y para qué se utiliza
Feiba pertenece a un grupo de medicamentos llamados antihemorrágicos.
Feiba se utiliza para tratar y prevenir hemorragias en pacientes con hemofilia A con inhibidor del factor VIII. Debe considerarse la gravedad del episodio hemorrágico, el título del inhibidor y la respuesta anamnésica del paciente si es conocida.
2. Qué necesita saber antes de empezar a usar FEIBA No use Feiba
Si es alérgico a los principios activos o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
En las situaciones siguientes, Feiba no se debe utilizar si se dispone de alternativas terapéuticas.
• Si tiene una enfermedad llamada Coagulación Intravascular Diseminada (CID) (enfermedad de la sangre en la que se forman pequeños coágulos en los vasos sanguíneos).
• Si tiene insuficiencia hepática.
• Si tiene una enfermedad cardiaca, trombosis o embolia aguda (obstrucción de un vaso sanguíneo). Si tiene alguna duda, consulte con su médico.
Advertencias y precauciones
Consulte a su médico o farmacéutico o enfermero antes de empezar a usar Feiba.
• Pueden aparecer reacciones de hipersensibilidad, como en el caso de todos los productos derivados de plasma que se administran por vía intravenosa. Para poder reconocer una reacción alérgica lo antes posible, debe conocer que los primeros síntomas potenciales de una reacción de hipersensibilidad pueden ser: eritema (enrojecimiento de la piel), erupción cutánea, urticaria, picores, inflamación de los labios y de la lengua, pitidos en el pecho, opresión en el pecho, indisposición, mareo, caída repentina de la tensión arterial. Otros síntomas de reacciones de hipersensibilidad a productos derivados de plasma incluyen letargia y cansancio. Si aparece alguno de estos síntomas, se debe parar la administración inmediatamente y contactar con su médico. Los síntomas descritos pueden indicar un shock anafiláctico (reacción alérgica grave). Los síntomas graves requieren un tratamiento temprano de urgencia.
• Su médico solamente reutilizará Feiba en pacientes con sospecha de hipersensibilidad al producto o a alguno de sus componentes después de valorar detenidamente el beneficio esperado y el riesgo de la reexposición y/o de no esperar ninguna reacción con otro tratamiento preventivo o terapia alternativa.
• Si experimenta cambios en la tensión arterial, dificultades para respirar, tos o dolor en el pecho, se debe parar la administración inmediatamente y contactar con su médico. Su médico iniciará las medidas de diagnóstico y terapéuticas apropiadas.
• En pacientes con hemofilia con inhibidor o inhibidores adquiridos a los factores de coagulación. Durante el tratamiento con Feiba, estos pacientes pueden tener un aumento en la tendencia a desarrollar hemorragia y un aumento del riesgo de trombosis al mismo tiempo.
Durante el tratamiento con Feiba han aparecido acontecimientos tromboembólicos, incluyendo Coagulación Intravascular Diseminada (CID) (enfermedad de la sangre en la que se forman pequeños coágulos en los vasos sanguíneos), trombosis venosa, embolia pulmonar, infarto de miocardio y accidente cerebrovascular (ictus). Algunos de los acontecimientos tromboembólicos han ocurrido con el tratamiento de altas dosis de Feiba. El uso concomitante con Factor VIIa recombinante puede aumentar el desarrollo de un acontecimiento tromboembólico.
Seguridad viral
Cuando se administran medicamentos derivados de plasma o sangre humano, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen una cuidadosa selección de los donantes, para excluir a aquellos que están en riesgo de ser portadores de enfermedades infecciosas, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar/inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente Esto también se refiere a virus emergentes o de naturaleza desconocida u otros tipos de infecciones.
Estas medidas se consideran eficaces para virus envueltos como el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B y el virus de la hepatitis C y para los virus no envueltos de la hepatitis A . Las medidas adoptadas pueden tener un valor limitado para virus no envueltos tales como el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para individuos cuyo sistema inmunitario está deprimido o para pacientes con algún tipo de anemia (por ejemplo enfermedad drepanocítica o anemia hemolítica).
Se recomienda encarecidamente que cada vez que se administre una dosis de Feiba, se deje constancia del nombre del medicamento y número de lote administrado con el fin de mantener un registro de los lotes utilizados.
Es posible que su médico le recomiende vacunarse frente a hepatitis A y hepatitis B, si a usted se le administra de forma regular o repetida medicamentos obtenidos de plasma humano.
Uso de Feiba con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
No se han realizado estudios adecuados y bien controlados del uso combinado o secuencial de Feiba y Factor VlIa recombinante o antifibrinolíticos.
Cuando se utilizan antifibrinolíticos sistémicos, como ácido tranexámico o ácido aminocaproico, durante el tratamiento con Feiba se debe considerar la posibilidad de aparición de acontecimientos tromboembólicos. Por lo tanto, no se deben utilizar antifibrinolíticos hasta aproximadamente 6 a 12 horas después de la administración de Feiba.
De acuerdo a los datos in vitro disponibles y a las observaciones clínicas, no se puede excluir una interacción potencial medicamentosa con el uso concomitante con Factor VIIa recombinante que potencialmente produzca un acontecimiento tromboembólico.
Después de la administración de dosis elevadas de Feiba, el aumento transitorio de los anticuerpos de superficie de la hepatitis B transferidos pasivamente puede provocar una interpretación errónea de los resultados positivos del test serológico.
Feiba no debe mezclarse con otros medicamentos antes de su administración ya que esto puede perjudicar a la eficacia y seguridad del producto. Es conveniente lavar la vía venosa con solución salina isotónica antes y después de la administración de Feiba.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, o cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Su médico decidirá si Feiba puede ser usado durante el embarazo y la lactancia. Debido al aumento del riesgo de trombosis durante el embarazo, Feiba solo debe ser administrado bajo una estrecha supervisión médica y sólo si se encuentra claramente indicado.
Para información sobre el riesgo de infección por parvovirus B19 ver sección advertencias y precauciones. Conducción y uso de máquinas
No se conocen efectos sobre la capacidad de conducir y usar máquinas.
Feiba contiene citrato de sodio y cloruro de sodio
Los pacientes con dietas pobres en sodio deben tener en cuenta que este medicamento puede contener aproximadamente 80 mg (3,48 mmol) de sodio por vial.
3. Cómo usar FEIBA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La frecuencia y la dosis a administrar deben siempre guiarse por la eficacia clínica en cada caso individual. La dosis y duración del tratamiento dependen de la gravedad de la alteración de la hemostasia, de la localización y extensión de la hemorragia y del estado clínico del paciente.
Como guía general se recomienda una dosis de 50 a 100 unidades de Feiba por kg de peso corporal, no excediendo una dosis diaria de 200 U/kg de peso corporal. Debido a factores específicos de los pacientes, la respuesta a un agente de by-pass puede variar y en determinadas situaciones hemorrágicas, los pacientes pueden tener una respuesta insuficiente a un agente y pueden responder a otro. En caso de que se produzca una respuesta insuficiente a un determinado agente de by-pass, se debe considerar la utilización de otro. Calentar el producto a temperatura ambiente o a temperatura corporal antes de su administración, si es necesario.
Feiba solo se debe reconstituir inmediatamente antes de su administración. La solución reconstituida debe inyectarse o perfundirse lentamente por vía intravenosa tan pronto como sea posible (el producto no
contiene conservantes). Se recomienda la administración de no más de 2 U/kg/min, a menos que la gravedad de la hemorragia requiera y justifique el uso de dosis superiores.
Agitar suavemente hasta que todo el producto esté disuelto. Asegurar que todo el producto se encuentra disuelto ya que, de lo contrario, pasarán menos unidades de Feiba a través del filtro del equipo.
Si se administra por perfusión, utilizar un equipo de perfusión desechable con un filtro adecuado de, al menos, 149 qm de tamaño de poro.
No administrar si la solución está turbia o contiene precipitado. Desechar la solución no administrada.
No utilizar el producto si su sistema de barrera de esterilidad o su envase están dañados o muestran cualquier signo de deterioro.
Reconstitución del liofilizado con el equipo BAXJECT II Hi-Flow:
Usar una técnica aséptica durante todo el procedimiento.
1. Calentar el vial de disolvente (agua esterilizada para preparaciones inyectables) sin abrir a temperatura ambiente, por ejemplo, utilizando un baño de agua estéril para calentar durante varios minutos (máximo 37°C), si es necesario.
2. Quitar los protectores de los viales de Feiba y de disolvente y desinfectar los tapones de goma de ambos viales. Colocar los viales en una superficie lisa.
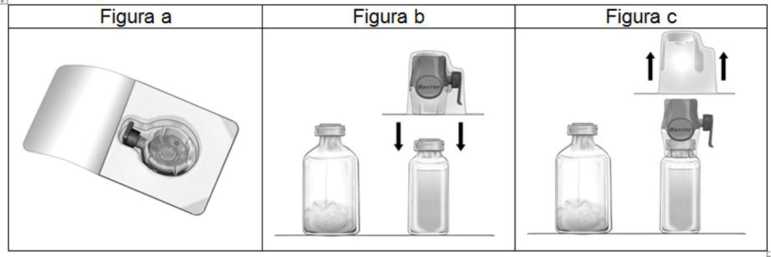
3. Abrir el envoltorio del accesorio BAXJECT II Hi-Flow quitando la tapa de papel sin tocar el interior (figura a). No sacar el equipo del envoltorio.
4. Dar la vuelta al envoltorio e insertar la punta de plástico a través del tapón del disolvente (Figura b). Coger el envoltorio por su extremo y sacar el equipo BAXJECT II Hi-Flow de su envoltorio (Figura c). No quitar el protector azul del equipo BAXJECT II Hi-Flow.
el
5. Con el equipo de reconstitución unido al vial de disolvente, invertir el sistema de tal forma que el vial de disolvente esté en la parte superior del equipo. Insertar la punta de plástico de color púrpura del equipo BAXJECT II Hi-Flow dentro del tapón de Feiba. El vacío hará que disolvente penetre en el vial de Feiba (Figura d).
6. Agitar con suavidad, sin sacudir, todo el sistema hasta que todo el material se haya disuelto. Asegúrese de que Feiba esté completamente disuelto, de otra manera el material activo no pasará a través del filtro del equipo.
Inyección/Perfusión:
Usar una técnica aséptica durante todo el procedimiento.
1. Quitar el protector azul del equipo BAXJECT II Hi-Flow. Conectar firmemente la jeringa al equipo BAXJECT II Hi-Flow (NO INTRODUCIR AIRE EN LA JERINGA) (Figura e). Se recomienda encarecidamente utilizar una jeringa luer lock con objeto de asegurar una conexión
firme entre la jeringa y el equipo BAXJECT II Hi-Flow (girar la jeringa en el sentido de las agujas del
reloj hasta que se pare cuando llegue al tope).
2. Invertir el sistema hasta que el producto disuelto se encuentre en la parte de arriba. Introducir la solución de Feiba en la jeringa, tirando del émbolo hacia atrás LENTAMENTE y asegurar que la conexión firme entre el BAXJECT II Hi-Flow y la jeringa se mantiene durante todo el proceso mientras se tira del émbolo de la jeringa (Figura f).
3. Desconectar la jeringa.
4. Si se produce espuma dentro de la jeringa, esperar a que la espuma se compacte. Administrar lentamente por vía intravenosa la solución con el equipo de perfusión suministrado (o una aguja desechable).
|
Figura d |
Figura e |
Figura f | |
|
i* |
♦ | ||
|
l | |||
No exceder una velocidad de inyección/perfusión de 2 unidades de Feiba por kg de peso corporal por minuto.
Toda la solución no utilizada, los viales vacíos y las agujas no utilizadas deben desecharse de forma adecuada.
Uso en niños
La experiencia en niños menores de 6 años es limitada; se debe adaptar el mismo régimen posológico que en adultos a la situación clínica del niño.
Si usa más Feiba del que debe
En caso de sobredosis aumenta el riesgo de complicaciones tromboémbolicas (formación de coágulos de sangre con enrojecimiento en los vasos sanguíneos), Coagulación Intravascular Diseminada (CID) (enfermedad de la sangre en la que se forman pequeños coágulos en los vasos sanguíneos) o infarto de miocardio.
En caso de sobredosis o ingestión accidental, consulte inmediatamente a su médico o llame al Servicio de Información Toxicológica. Teléfono 91 562 04 20, indicando el medicamento y la cantidad administrada.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Se utilizan las siguientes frecuencias para evaluar los efectos adversos:
muy frecuentes: pueden afectar a más de 1 de cada 10 personas frecuentes: pueden afectar hasta 1 de cada 10 personas poco frecuentes: pueden afectar hasta 1 de cada 100 personas raros: pueden afectar hasta 1 de cada 1.000 personas muy raros: pueden afectar hasta 1 de cada 10.000 personas no conocida: no puede estimarse a partir de los datos disponibles
Los siguientes efectos adversos se han notificado en los ensayos clínicos como frecuentes:
Hipersensibilidad
Dolor de cabeza
Mareo
Hipotensión
Erupción cutánea
Anticuerpo de superficie de la hepatitis B positivo
Los siguientes efectos adversos se han notificado durante la experiencia postcomercialización como frecuencia no conocida:
Trastornos de la sangre y del sistema linfático: Coagulación Intravascular Diseminada (CID) (enfermedad de la sangre en la que se forman coágulos en los vasos sanguíneos), aumento del título de inhibidor.
Trastornos del sistema inmunológico: reacciones alérgicas, erupción cutánea en todo el cuerpo (urticaria).
Trastornos del sistema nervioso: sensación de entumecimiento en las extremidades (hipoestesia), sensibilidad anormal o reducida (parestesia), accidente cerebrovascular (accidente trombótico, accidente embólico), somnolencia, sensación del gusto alterada (disgeusia).
Trastornos cardiacos: ataque cardíaco (infarto de miocardio), palpitación del corazón (taquicardia). Trastornos vasculares: formación de coágulos de la sangre (eventos tromboembólicos), aumento de la tensión arterial (hipertensión), rubor.
Trastornos respiratorios, torácicos y mediastínicos: obstrucción de la arteria pulmonar (embolia pulmonar), obstrucción del paso del aire (broncoespasmo), pitidos en el pecho, tos, dificultad al respirar (disnea).
Trastornos gastrointestinales: vómitos, diarrea, malestar abdominal, sensación de enfermedad (náusea). Trastornos de la piel y del tejido subcutáneo: sensación de entumecimiento en la cara, inflamación de la cara, de la lengua y de los labios (angioedema), erupción cutánea en todo el cuerpo (urticaria), picor (prurito).
Trastornos generales y alteraciones en el lugar de administración: dolor en el lugar de la inyección, malestar general, sensación de calor, escalofríos, fiebre, dolor en el pecho, malestar en el pecho. Exploraciones complementarias: disminución de la tensión arterial.
La inyección o perfusión rápida puede causar un dolor punzante y una sensación de entumecimiento en la cara y en las extremidades así como una caída de la tensión arterial.
Infartos de miocardio fueron notificados después de la administración de dosis superiores a la dosis máxima diaria y/o con aplicaciones prolongadas y/o de la presencia de factores de riesgo tromboembólicos. Para información sobre la seguridad viral, ver la sección 2.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos
directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www .notificaram.es.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de FEIBA
No conservar a temperatura superior a 25°C. No congelar.
Conservar el medicamento en el embalaje exterior para protegerlo de la luz.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE ® de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Feiba 1000 UF
El principio activo es 1000 UF de complejo coagulante antiinhibidor en máximo 1200 mg de proteína total. Feiba contiene los factores II, IX y X principalmente no activados, así como el factor VII activado. El antígeno del Factor VIII coagulante (F VIII C: Ag) está presente en la concentración máxima de 0,1 UI/1 UF. El producto está libre, o contiene sólo trazas del sistema calicreína-cinina.
Los demás componentes son: citrato de sodio, cloruro de sodio y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
El producto se presenta como un polvo liofilizado o sólido friable blanco, blanquecino o verde pálido.
El polvo liofilizado y el disolvente se presentan en viales de vidrio. Ambos viales están cerrados con tapones de goma. La solución reconstituida tiene un pH entre 6,8 y 7,6.
Contenido del envase:
- 1 vial con Feiba 1000 UF - polvo para solución inyectable.
- 1 vial con 20 ml de agua para preparaciones inyectables.
- Accesorios para la reconstitución y administración: un equipo BAXJECT II Hi-Flow (equipo para reconstitución sin aguja para transferir y mezclar los productos de los dos viales dentro de
la jeringa), una jeringa desechable, una aguja desechable y una aguja mariposa con pinza (equipo
tipo mariposa para perfusión).
Titular de la autorización de comercialización y responsable de la fabricación Titular
Baxalta Spain S.L.
Parque Empresarial San Fernando, Edificio Londres
28830- San Femando de Henares, Madrid - España
Responsable de la fabricación
Baxter AG IndustriestraPe, 67 A-1221 Viena, Austria
Este prospecto ha sido aprobado en Octubre 2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
ESTA INFORMACIÓN ESTÁ DESTINADA ÚNICAMENTE A MÉDICOS O PROFESIONALES DEL SECTOR SANITARIO:
El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
Posología
Como guía general se recomiendan dosis de 50 a 100 UF/kg, sin exceder una dosis diaria de 200 UF/kg. No debe sobrepasarse 100 UF/kg/dosis, ni dosis diarias de 200 UF/kg, a menos que la gravedad de la hemorragia requiera y justifique el uso de dosis superiores.
La dosis es independiente del título de inhibidor del paciente. La respuesta al tratamiento puede variar de paciente a paciente.
La dosis y la duración de la terapia dependen de la gravedad de la alteración de la función hemostática, de la localización y gravedad de la hemorragia y del estado clínico del paciente.
IMPORTANTE
La dosis y la frecuencia de la administración se establecerán siempre en función de la efectividad clínica en cada caso.
Población pediátrica
La experiencia en niños menores de 6 años es limitada; se debe adaptar el mismo régimen posológico que en adultos a la situación clínica del niño.
Hemorragias en articulaciones, músculos o tejido blando:
Para hemorragias leves y moderadas se recomienda una dosis de 50 a 75 UF/kg, cada 12 horas.
El tratamiento debe continuar hasta que aparezcan claros signos de mejoría clínica, tales como disminución del dolor, reducción de la tumefacción o movilización de la articulación.
Hemorragias en membranas mucosas:
Se recomienda una dosis de 50 UF/kg cada 6 horas, bajo estricta vigilancia del paciente (lugar del sangrado, repetición del hematocrito).
Profilaxis de hemorragias perioperatorias:
Se recomienda administrar Feiba cada 6 a 12 horas, oscilando la dosis diaria entre 100-200 UF/kg de peso corporal.
Monitorización
Debido al complejo mecanismo de acción, no se dispone de una monitorización directa de los principios activos. Las pruebas de coagulación como el tiempo de coagulación de sangre total (TCT), el tromboelastograma (TEG), y el tiempo parcial de tromboplastina activado (TTPa), generalmente muestran sólo pequeños acortamientos, que no se correlacionan necesariamente con la mejoría clínica. Por estas razones la utilidad de estos ensayos para monitorizar el tratamiento con Feiba, es muy limitada.
Forma de administración
Inyectar o perfundir lentamente por vía intravenosa. Se recomienda no administrar más de 2 UF/kg/min.
La solución reconstituida debe administrarse lo antes posible por vía intravenosa (la solución no contiene conservantes). Después de la reconstitución, se debe inspeccionar la solución por si contiene partículas o está decolorada antes de su administración. No administrar si la solución está turbia o contiene depósitos. Desechar debidamente toda solución que no se hubiese administrado.
Monitorización de la terapia
No debe sobrepasarse 100 UF/kg/dosis, ni dosis diarias de 200 UF/kg. Los pacientes que reciben más de 100 UF/kg deben ser monitorizados para el desarrollo de CID y/o isquemia coronaria aguda y signos u otros síntomas de acontecimientos tromboembólicos. A la aparición del primer signo o síntoma de acontecimiento tromboembólico, la perfusión se debe interrumpir inmediatamente y se deben adoptar las medidas de diagnóstico y terapéuticas necesarias.
Cuando se utiliza para parar una hemorragia, el producto se debe administrar únicamente el tiempo que sea absolutamente necesario para conseguir el efecto terapéutico deseado.
La administración de Feiba en pacientes con inhibidores puede producir un incremento inicial “anamnéstico” de los niveles del inhibidor. Durante la administración continuada de Feiba, los niveles del inhibidor pueden descender a lo largo del tiempo.
Tanto los datos clínicos como los datos publicados sugieren que la eficacia de Feiba no se reduce. Solamente se encuentran disponibles datos clínicos limitados de la aplicación de Feiba para la profilaxis en pacientes hemofílicos.
Pruebas de laboratorio y eficacia clínica
Los ensayos in vitro para controlar la eficacia, tales como TTPa, tiempo de coagulación total (TCT) y tromboelastrograma (TEG) no tienen necesariamente una correlación con la mejora clínica. Por esta razón, no se debe buscar la normalización de estos valores mediante un incremento de dosis de Feiba.
Importancia del recuento plaquetario
En caso de respuesta inadecuada al tratamiento con Feiba, se recomienda realizar un recuento plaquetario, dado que se considera necesario un número suficiente de plaquetas funcionalmente intactas para que el tratamiento con Feiba sea eficaz.
10 de 10