Faslodex 250 Mg/5 Ml Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Faslodex 250 mg solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada contiene 250 mg de fulvestrant en 5 ml de solución. Excipientes con efecto conocido
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución viscosa, transparente, de incolora a amarilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Faslodex está indicado para el tratamiento de mujeres postmenopáusicas con cáncer de mama localmente avanzado o metastásico y con receptor estrogénico positivo, cuya enfermedad ha recidivado durante o después del tratamiento adyuvante con antiestrógenos o bien cuya enfermedad ha progresado durante un tratamiento antiestrogénico.
4.2 Posología y forma de administración
Posología
Mujeres adultas (incluyendo mujeres de edad avanzada)
La dosis recomendada es 500 mg una vez al mes, con una dosis adicional de 500 mg administrada dos semanas después de la dosis inicial.
Población especial
Insuficiencia renal
No se recomiendan ajustes de la dosis para las pacientes con insuficiencia renal de leve a moderada (aclaramiento de creatinina >30 ml/min). No se ha evaluado la seguridad ni la eficacia en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min), y, por lo tanto, se recomienda precaución en estas pacientes (ver sección 4.4).
Insuficiencia hepática
No se recomienda realizar ajustes en la dosis de pacientes con insuficiencia hepática de leve a moderada. No obstante, Faslodex debe utilizarse con precaución en estas pacientes ya que puede aumentar la exposición a fulvestrant. No existen datos en pacientes con insuficiencia hepática grave (ver secciones 4.3, 4.4 y 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Faslodex en niños de 0 a 18 años. Los datos actualmente disponibles se incluyen en las secciones 5.1 y 5.2, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
Faslodex se debe administrar mediante dos inyecciones consecutivas intramusculares lentas de 5 ml (1-2 minutos/inyección), una en cada glúteo.
Para las instrucciones de administración detalladas, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Embarazo y lactancia (ver sección 4.6).
Insuficiencia hepática grave (ver secciones 4.4 y 5.2).
4.4 Advertencias y precauciones especiales de empleo
Faslodex se debe emplear con precaución en pacientes con insuficiencia hepática de leve a moderada (ver secciones 4.2, 4.3 y 5.2).
Faslodex se debe emplear con precaución en pacientes con insuficiencia renal grave (aclaramiento de creatinina inferior a 30 ml/min).
Dada la vía de administración intramuscular, Faslodex se debe utilizar con precaución cuando se trate a pacientes con diátesis hemorrágica, trombocitopenia, o en tratamiento con anticoagulantes.
En mujeres con cáncer de mama avanzado se observan frecuentemente accidentes tromboembólicos, como se ha apreciado en los ensayos clínicos con Faslodex (ver sección 4.8). Debe considerarse este hecho cuando se prescriba Faslodex a pacientes en riesgo.
No existen datos a largo plazo del efecto de fulvestrant sobre el hueso. Debido al mecanismo de acción de este fármaco, existe un riesgo potencial de osteoporosis.
Población pediátrica
Faslodex no está recomendado para uso en niños y adolescentes puesto que no se ha establecido la seguridad y eficacia en este grupo de pacientes (ver sección 5.1).
4.5 Interacción con otros medicamentos y otras formas de interacción
Un estudio clínico de interacción con midazolam (sustrato del CYP3A4) demostró que fulvestrant no inhibe el CYP3A4. Estudios clínicos de interacción con rifampicina (inductor del CYP3A4) y ketoconazol (inhibidor del CYP3A4) no han mostrado un cambio clínicamente importante en la eliminación de fulvestrant. Por consiguiente, no es necesario un ajuste de dosis en pacientes que están recibiendo de forma concomitante fulvestrant e inhibidores o inductores del CYP3A4.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Se debe indicar a las pacientes en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento.
Embarazo
Faslodex está contraindicado durante el embarazo (ver sección 4.3). Fulvestrant ha mostrado que atraviesa la placenta tras dosis únicas intramusculares en ratas y conejos hembra. Los estudios en animales han mostrado toxicidad reproductiva, incluyendo una mayor incidencia de anomalías y muertes fetales (ver sección 5.3). Si se presenta un embarazo mientras se toma Faslodex, la paciente debe ser informada de los posibles riesgos para el feto y del riesgo potencial de aborto espontáneo.
Lactancia
Durante el tratamiento con Faslodex se debe interrumpir la lactancia. Fulvestrant se excreta en la leche de las ratas lactantes. No se conoce si fulvestrant se excreta en la leche humana. Teniendo en cuenta las potenciales reacciones adversas graves debidas a fulvestrant en los lactantes, el uso durante la lactancia está contraindicado (ver sección 4.3).
Fertilidad
No se han estudiado los efectos de Faslodex sobre la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Faslodex sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. No obstante, debido a que muy frecuentemente se ha comunicado astenia con Faslodex, las pacientes que experimenten esta reacción adversa cuando conduzcan o utilicen maquinaria deberán proceder con precaución.
4.8 Reacciones adversas
Esta sección proporciona información basada en todas las reacciones adversas de los ensayos clínicos, estudios post-comercialización o notificaciones espontáneas. Las reacciones adversas comunicadas con más frecuencia son reacciones en el lugar de la inyección, astenia, náuseas y elevación de enzimas hepáticos (ALT, AST, ALP).
Las siguientes categorías de frecuencia para reacciones adversas al medicamento (RAMs) fueron calculadas en base al grupo de tratamiento con Faslodex 500 mg en los análisis globales de seguridad de los estudios CONFIRM (Estudio D6997C00002), FINDER 1 (Estudio D6997C00004), FINDER 2 (Estudio D6997C00006) y NEWEST (Estudio D6997C00003), que comparaban Faslodex 500 mg con Faslodex 250 mg. Las frecuencias de la siguiente tabla se basaron en todos los acontecimientos adversos notificados, independientemente de la valoración del investigador en cuanto a causalidad.
Las reacciones adversas enumeradas a continuación están clasificadas en función de la frecuencia y la Clasificación por Órgano y Sistema (SOC). Los grupos de frecuencia están definidos de acuerdo a la siguiente clasificación: Muy frecuentes (>1/10), Frecuentes (>1/100 a <1/10), Poco frecuentes (>1/1.000 a <1/100). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1 Reacciones Adversas al Medicamento
|
Reacciones adversas por órgano y sistema, y frecuencia | ||
|
Infecciones e infestaciones |
Frecuentes |
Infecciones del tracto urinario |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuentes |
Reducción del recuento de plaquetas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Reacciones de hipersensibilidad |
|
Trastornos del metabolismo y de la nutrición |
Frecuentes |
Anorexiaa |
|
Trastornos del sistema nervioso |
Frecuentes |
Cefalea |
|
Trastornos vasculares |
Frecuentes |
Tromboembolismo venoso3, sofocos |
|
Trastornos gastrointestinales |
Muy frecuentes |
Náuseas |
Incluye reacciones adversas al medicamento para las cuales no se puede evaluar la contribución exacta de Faslodex, debido a la enfermedad subyacente.
|
Frecuentes |
Vómitos, diarrea | |
|
Trastornos hepatobiliares |
Muy frecuentes |
Elevación de enzimas hepáticos (ALT, AST, ALP)a |
|
Frecuentes |
Bilirrubina elevada3 | |
|
Poco frecuentes |
Fallo hepático3, hepatitis, gamma-GT elevada | |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes |
Dolor de espaldaa |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Moniliasis vaginal, leucorrea, hemorragia vaginal |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia^ reacciones en el lugar de la inyecciónb |
|
Poco frecuentes |
Hemorragia en el lugar de la inyección, hematoma en el lugar de la inyección |
a
b
El término ‘reacciones en el lugar de la inyección’ no incluye los términos ‘hemorragia en el lugar de la inyección’ y ‘hematoma en el lugar de la inyección’.
c
El acontecimiento no se observó en los estudios clínicos principales (CONFIRM, FINDER 1, FINDER 2, NEWEST). La frecuencia se ha calculado empleando el límite superior del intervalo de confianza al 95% para la estimación puntual. Esto se calcula como 3/560 (donde 560 es el número de pacientes en los estudios clínicos principales), lo que se equipara a una categoría de frecuencia de “poco frecuente”.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V*.
4.9 Sobredosis
No existe experiencia de sobredosis en humanos. Los estudios en animales sugieren que no se pusieron de manifiesto, con las dosis más altas de fulvestrant, efectos distintos de los relacionados directa o indirectamente con la actividad antiestrogénica (ver sección 5.3). En caso de sobredosis, se recomienda tratamiento sintomático de soporte.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Terapia endocrina, Antiestrógenos, código ATC: L02BA03 Mecanismo de acción y efectos farmacodinámicos
Fulvestrant es un antagonista competitivo del receptor estrogénico (RE) con una afinidad comparable a estradiol. Fulvestrant bloquea las acciones tróficas de los estrógenos sin actividad agonista parcial (de tipo estrógeno). El mecanismo de acción está asociado con la regulación a la baja de los niveles de la proteína del receptor de estrógeno. Los ensayos clínicos en mujeres postmenopáusicas con cáncer de mama primario han mostrado que fulvestrant regula significativamente a la baja la proteína del RE en los
tumores RE positivos, en comparación con placebo. Existió además un descenso significativo en la expresión del receptor de progesterona, consecuente con una falta de efectos estrogénicos agonistas intrínsecos. En mujeres postmenopáusicas con tumores de mama, también se ha demostrado que, como tratamiento neoadyuvante, 500 mg de fulvestrant regulan a la baja el RE y el marcador de proliferación Ki67 en mayor grado que 250 mg de este medicamento.
Eficacia clínica y seguridad en el cáncer de mama avanzado
Se llevó a cabo un ensayo clínico fase III en 736 mujeres postmenopáusicas con cáncer de mama avanzado que presentaban recurrencia de la enfermedad durante o después de terapia endocrina adyuvante, o progresión tras terapia endocrina para la enfermedad avanzada. El estudio incluyó 423 pacientes cuya enfermedad había recurrido o progresado durante la terapia con antiestrógeno (subgrupo AE) y 313 pacientes cuya enfermedad había recurrido o progresado durante la terapia con un inhibidor de la aromatasa (subgrupo IA). Este ensayo comparó la eficacia y seguridad de Faslodex 500 mg (n=362) con Faslodex 250 mg (n=374). La variable principal fue la supervivencia libre de progresión (PFS); las variables secundarias claves de eficacia incluyeron tasa de respuesta objetiva (ORR), tasa de beneficio clínico (CBR) y supervivencia global (OS). Los resultados de eficacia del estudio CONFIRM se resumen en la Tabla 2.
Tabla 2 Resumen de resultados de la variable principal de eficacia (PFS) y variables secundarias claves de eficacia en el estudio CONFIRM
|
Variable |
Tipo de cálculo; |
Faslodex 500 mg |
Faslodex 250 mg |
Comparación entre grupos (Faslodex 500 mg/Faslodex |
250 mg) | |
|
comparación |
(N=362) |
(N=374) |
“Hazard |
IC al |
Valor de p | |
|
de tratamiento |
ratio” |
95% | ||||
|
PFS |
Mediana K-M en meses; “hazard ratio” | |||||
|
Todas las pacientes |
6,5 |
5,5 |
0,80 |
0,68, 0,94 |
0,006 | |
|
-Subgrupo AE (n=423) |
8,6 |
5,8 |
0,76 |
0,62, 0,94 |
0,013 | |
|
-Subgrupo IA (n=313)a |
5,4 |
4,1 |
0,85 |
0,67, 1,08 |
0,195 | |
|
OSb |
Mediana K-M | |||||
|
en meses; | ||||||
|
“hazard ratio” | ||||||
|
Todas las pacientes |
26,4 |
22,3 |
0,81 |
0,69, 0,96 |
0,016c | |
|
-Subgrupo AE (n=423) |
30,6 |
23,9 |
0,79 |
0,63, 0,99 |
0,038c | |
|
-Subgrupo IA (n=313)a |
24,1 |
20,8 |
0,86 |
0,67, 1,11 |
0,241c | |
|
Variable |
Tipo de cálculo; |
Faslodex 500 mg |
Faslodex 250 mg |
Comparación entre grupos (Faslodex 500 mg/Faslodex 250 mg) | ||
|
comparación |
(N=362) |
(N=374) |
Diferencia |
IC al 95% | ||
|
de tratamiento |
absoluta en % | |||||
|
ORRd |
% de pacientes con OR; diferencia absoluta en % | |||||
|
Todas las pacientes |
13,8 |
14,6 |
-0,8 |
-5,8, 6,3 | ||
|
-Subgrupo AE (n=296) |
18,1 |
19,1 |
-1,0 |
-8,2, 9,3 | ||
|
-Subgrupo IA (n=205)a |
7,3 |
8,3 |
-1,0 |
-5,5, 9,8 | ||
CBRe % de pacientes
con CB; diferencia absoluta en %
|
Todas las pacientes |
45,6 |
39,6 |
6,0 |
-1,1, 13,3 |
|
-Subgrupo AE (n=423) |
52,4 |
45,1 |
7,3 |
-2,2, 16,6 |
|
-Subgrupo IA (n=313)a |
36,2 |
32,3 |
3,9 |
-6,1, 15,2 |
a Faslodex está indicado en pacientes cuya enfermedad había recurrido o progresado durante una terapia antiestrogénica. Los resultados en el subgrupo IA no son concluyentes. b Se presenta la OS para el análisis final de supervivencia con una madurez del 75%.
c Valor nominal de p sin realizar ajustes de multiplicidad entre el análisis inicial de supervivencia global con
una madurez del 50% y el análisis de supervivencia actualizado con un 75% de madurez. d La ORR se calculó en pacientes que eran evaluables para respuesta al inicio (es decir, aquellas con
enfermedad medible al inicio; 240 pacientes en el grupo de Faslodex 500 mg y 261 pacientes en el grupo de Faslodex 250 mg).
e Pacientes con una mejor respuesta objetiva de respuesta completa, respuesta parcial o enfermedad estable >24 semanas.
PFS: Supervivencia libre de progresión; ORR: Tasa de respuesta objetiva; OR: Respuesta objetiva; CBR: Tasa de beneficio clínico; CB: Beneficio clínico; OS: Supervivencia global; K-M: Kaplan-Meier; IC: Intervalo de confianza; IA: Inhibidor de la aromatasa; AE: Antiestrógeno.
Se completaron dos ensayos clínicos fase-III en un total de 851 mujeres postmenopáusicas con cáncer de mama avanzado que presentaban recurrencia de la enfermedad durante o después de terapia endocrina adyuvante, o progresión tras terapia endocrina para la enfermedad avanzada. El 77% de la población bajo estudio presentaba cáncer de mama receptor estrogénico positivo. Estos ensayos compararon la seguridad y la eficacia de la administración mensual de Faslodex 250 mg frente a la administración diaria de 1 mg de anastrozol (inhibidor de la aromatasa). Globalmente, Faslodex a la dosis mensual de 250 mg fue al menos tan eficaz como anastrozol en términos de supervivencia libre de progresión, respuesta objetiva y tiempo hasta el fallecimiento. No se produjeron diferencias estadísticamente significativas en ninguna de estas variables entre los dos grupos de tratamiento. La supervivencia libre de progresión fue la variable principal. El análisis combinado de ambos ensayos mostró que el 83% de las pacientes que recibieron Faslodex progresó, en comparación con el 85% de las tratadas con anastrozol. El análisis combinado de ambos ensayos mostró una “hazard ratio” entre Faslodex 250 mg y anastrozol para la supervivencia libre de progresión de 0,95 (IC al 95% 0,82 a 1,10). La tasa de respuesta objetiva para Faslodex 250 mg fue del 19,2%, en comparación con el 16,5% para anastrozol. La mediana del tiempo hasta el fallecimiento fue de 27,4 meses en las pacientes tratadas con Faslodex y de 27,6 meses en las tratadas con anastrozol. La “hazard ratio” entre Faslodex 250 mg y anastrozol para el tiempo hasta el fallecimiento fue de 1,01 (IC al 95% 0,86 a 1,19).
Efectos sobre el endometrio después de la menopausia
Los datos preclínicos no sugieren un efecto estimulante de fulvestrant sobre el endometrio postmenopáusico (ver sección 5.3). Un estudio durante 2 semanas en voluntarias postmenopáusicas sanas tratadas con 20 pg de etinilestradiol al día mostró que el tratamiento previo con Faslodex 250 mg tuvo por resultado una disminución significativa de la estimulación del endometrio postmenopáusico en comparación con el tratamiento previo con placebo, como se valoró mediante la determinación ecográfica del grosor del endometrio.
El tratamiento neoadyuvante de hasta 16 semanas en pacientes con cáncer de mama tratadas tanto con Faslodex 500 mg como con Faslodex 250 mg no dio lugar a cambios clínicamente significativos del grosor endometrial, indicando una ausencia de efecto agonista. No hay evidencia de efectos adversos endometriales en las pacientes estudiadas con cáncer de mama. No hay datos disponibles respecto a la morfología del endometrio.
En dos estudios a corto plazo (1 y 12 semanas) en pacientes premenopáusicas con enfermedad ginecológica benigna, no se observaron diferencias significativas en el grosor endometrial determinado por ecografía entre los grupos de fulvestrant y placebo.
Efectos sobre el hueso
No existen datos a largo plazo sobre el efecto de fulvestrant sobre el hueso. El tratamiento neoadyuvante de hasta 16 semanas en pacientes con cáncer de mama tratadas tanto con Faslodex 500 mg como con Faslodex 250 mg no dio lugar a cambios clínicamente significativos en los marcadores séricos de recambio óseo.
Población pediátrica
Faslodex no está indicado para uso en niños. La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Faslodex en los diferentes grupos de la población pediátrica en cáncer de mama (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
Un estudio abierto fase II investigó la seguridad, eficacia y farmacocinética de fulvestrant en 30 niñas de 1a 8 años con Pubertad Precoz Progresiva asociada con Síndrome de McCune Albright (MAS). Las pacientes pediátricas recibieron una dosis intramuscular mensual de fulvestrant de 4 mg/kg. Este estudio de 12 meses investigó una serie de variables de MAS y mostró una reducción en la frecuencia de hemorragia vaginal y en la velocidad de avance de edad ósea. Las concentraciones mínimas de fulvestrant en el estado estacionario en niñas en este estudio fueron coherentes con las de los adultos (ver sección 5.2). No surgieron nuevas cuestiones de seguridad de este pequeño estudio, pero los datos a 5 años no están disponibles todavía.
5.2 Propiedades farmacocinéticas
Absorción
Después de la administración de la inyección intramuscular de acción prolongada de Faslodex, fulvestrant se absorbe lentamente, y las concentraciones plasmáticas máximas (Cmax) se alcanzan después de unos 5 días. La administración del régimen de Faslodex 500 mg alcanza niveles de exposición en, o cerca del, estado estacionario durante el primer mes de tratamiento (media [CV]: AUC 475 [33,4%] ng.días/ml,
Cmax 25,1 [35,3%] ng/ml, Cmin 16,3 [25,9%] ng/ml, respectivamente). En estado estacionario, las concentraciones plasmáticas de fulvestrant se mantienen en un intervalo relativamente estrecho, con una diferencia aproximadamente de hasta 3 veces entre las concentraciones máxima y mínima. Tras la administración intramuscular, la exposición es aproximadamente proporcional a la dosis en el intervalo posológico de 50 a 500 mg.
Distribución
Fulvestrant está sometido a una distribución rápida y extensa. El gran volumen de distribución aparente en estado estacionario (Vdss) de aproximadamente 3 a 5 l/kg indica que la distribución es en gran medida extravascular. Fulvestrant está altamente unido (99%) a las proteínas plasmáticas. Las fracciones de lipoproteína de muy baja densidad (VLDL), lipoproteína de baja densidad (LDL) y lipoproteína de alta densidad (HDL) son los componentes de unión principales. No se han realizado estudios de interacción sobre la unión competitiva a proteínas. No se ha determinado el papel de la globulina de unión a hormonas sexuales (SHBG).
Biotransformación
El metabolismo de fulvestrant no se ha evaluado completamente, pero implica combinaciones de un número de posibles vías de biotransformación análogas a las de los esteroides endógenos. Los metabolitos identificados (incluye los metabolitos 17-cetona, sulfona, 3-sulfato, 3- y 17-glucurónido) son menos activos, o bien muestran una actividad similar a la de fulvestrant en modelos antiestrogénicos. Los estudios utilizando preparaciones hepáticas humanas y enzimas recombinantes humanos indican que
CYP3A4 es el único isoenzima del P450 involucrado en la oxidación de fulvestrant; sin embargo, las vías que no son P450 parecen predominar in vivo. Los datos in vitro indican que fulvestrant no inhibe los isoenzimas del CYP450.
Eliminación
Fulvestrant se elimina principalmente en forma metabolizada. La vía de excreción principal es la fecal, con menos del 1% excretado en la orina. Fulvestrant presenta una eliminación elevada, 11±1,7 ml/min/kg, sugiriendo un cociente de extracción hepática elevado. La vida media (tJ/2) terminal después de la administración intramuscular se rige por la velocidad de absorción y se ha estimado que es de 50 días.
Poblaciones especiales
En un análisis farmacocinético de población de los datos recabados en los estudios fase III no se detectó ninguna diferencia en el perfil farmacocinético de fulvestrant por lo que se refiere a la edad (intervalo de 33 a 89 años), el peso (40-127 kg) o la raza.
Insuficiencia renal
La insuficiencia de la función renal leve a moderada no influenció en la farmacocinética de fulvestrant de ninguna forma clínicamente importante.
Insuficiencia hepática
La farmacocinética de fulvestrant se ha evaluado en un ensayo clínico a dosis única realizado en sujetos con insuficiencia hepática de leve a moderada (grado A y B de Child-Pugh). Se utilizó una dosis elevada en formulación inyectable por vía intramuscular de acción corta. En estos sujetos con insuficiencia hepática se produjo un incremento de hasta aproximadamente 2,5 veces en el AUC en comparación con los individuos sanos. En las pacientes en tratamiento con Faslodex se espera que un aumento de esta magnitud en la exposición sea bien tolerado. No se han evaluado pacientes con insuficiencia hepática grave (grado C de Child-Pugh).
Población pediátrica
La farmacocinética de fulvestrant se ha evaluado en un ensayo clínico llevado a cabo en 30 niñas con Pubertad Precoz Progresiva asociada con Síndrome de McCune Albright (ver sección 5.1). Las pacientes pediátricas tenían de 1a 8 años y recibieron una dosis intramuscular mensual de fulvestrant de 4 mg/kg. La media geométrica (desviación estándar) de la concentración mínima (Cmin,ss) y AUCss en el estado estacionario fue 4,2 (0,9) ng/ml y 3.680 (1.020) ng*h/ml, respectivamente. Aunque los datos recogidos fueron limitados, las concentraciones mínimas de fulvestrant en el estado estacionario en niñas parecieron ser coherentes con las de los adultos.
5.3 Datos preclínicos sobre seguridad
La toxicidad aguda de fulvestrant es baja.
Faslodex y otras formulaciones de fulvestrant fueron bien toleradas en las especies animales empleadas en estudios de dosis múltiples. Las reacciones locales, incluyendo miositis y granulomas en el lugar de la inyección se atribuyeron al vehículo, pero la gravedad de la miositis en conejos aumentó con fulvestrant, en comparación con la solución salina de control. En estudios de toxicidad con dosis múltiples intramusculares de fulvestrant en ratas y perros, la actividad antiestrogénica de este fármaco fue responsable de la mayoría de los efectos observados, en concreto, sobre el sistema reproductor femenino, pero también en otros órganos sensibles a las hormonas en ambos sexos. Tras un tratamiento crónico (12 meses), en algunos perros se ha observado arteritis que afecta a diferentes tejidos.
En estudios en perros tras la administración oral e intravenosa se observaron efectos sobre el sistema cardiovascular (ligeras elevaciones del segmento S-T del ECG [oral] y parada sinusal en un perro [intravenosa]). Estos tuvieron lugar a niveles de exposición más elevados que en pacientes (Cmax >15 veces), y es probable que sean de importancia limitada para la seguridad a la dosis clínica en humanos.
Fulvestrant no mostró potencial genotóxico.
Fulvestrant mostró efectos sobre la reproducción y el desarrollo embrionario/fetal consecuentes con su actividad antiestrogénica, a dosis similares a la dosis clínica. En ratas, se observó una reducción reversible de la fertilidad de las hembras y de la supervivencia embrionaria, distocia y una mayor incidencia de anomalías fetales, incluyendo flexión tarsal. Conejos tratados con fulvestrant fracasaron en mantener la gestación. Se apreciaron aumentos en el peso placentario y pérdida fetal tras la implantación. Existió una mayor incidencia de variaciones fetales en conejos (desplazamiento de la cintura pélvica hacia atrás y la vértebra presacra 27).
Un estudio de oncogenicidad a dos años en ratas (administración intramuscular de Faslodex) reveló una mayor incidencia de tumores ováricos benignos de las células de la granulosa en ratas hembra a la dosis alta de 10 mg/rata/15 días, así como una mayor incidencia de tumores testiculares de las células de Leydig en los machos. En un estudio de oncogenicidad a dos años en ratones (administración oral diaria) existió un aumento de la incidencia de tumores ováricos estromales de los cordones sexuales (tanto benignos como malignos) a dosis de 150 y 500 mg/kg/día. En el nivel de no efecto para estos hallazgos, los niveles de exposición sistémica (AUC) fueron, en ratas, aproximadamente 1,5 veces los niveles de exposición humana esperados en hembras y 0,8 veces en machos, y en ratones, aproximadamente 0,8 veces los niveles de exposición humana esperados tanto en machos como en hembras. La inducción de tales tumores es consecuente con las alteraciones de la retroalimentación endocrina relacionadas con la farmacología en niveles de gonadotropina causados por antiestrógenos en animales en ciclo estrogénico. Por lo tanto, no se considera que estos resultados sean relevantes para el uso de fulvestrant en mujeres postmenopáusicas con cáncer de mama avanzado.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Etanol (96 por ciento)
Alcohol bencílico Benzoato de bencilo Aceite de ricino
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 4 años
6.4 Precauciones especiales de conservación
Conservar y transportar en nevera (entre 2°C y 8°C).
Las desviaciones de temperatura fuera del rango de entre 2°C y 8°C deben ser controladas. Esto incluye evitar la conservación a temperaturas superiores a 30°C, y que no exceda un periodo de 28 días, durante el cual la temperatura media de conservación del medicamento sea inferior a 25°C (pero por encima de entre 2°C y 8°C). Tras las desviaciones de temperatura, el medicamento debe ser retornado de forma inmediata a las condiciones de conservación recomendadas (conservar y transportar en nevera entre 2°C y 8°C). Las desviaciones de temperatura tienen un efecto acumulativo en la calidad del medicamento, no debiéndose superar el periodo de 28 días por encima de la duración de la caducidad de 4 años de Faslodex (ver sección 6.3). La exposición a temperaturas inferiores a 2°C no dañará el medicamento, siempre y cuando éste no se conserve por debajo de los -20°C.
Conservar la jeringa precargada en el embalaje original para protegerla de la luz.
6.5 Naturaleza y contenido del envase
“BD SafetyGlide” es una marca registrada de “Becton Dickinson and Company” y es marcado CE: CE 0050.
La presentación de la jeringa precargada consta de:
Una jeringa precargada de vidrio transparente tipo 1 con émbolo de poliestireno, equipada con un cierre a prueba de manipulación, que contiene 5 ml de Faslodex solución inyectable.
Se proporciona además una aguja con sistema de seguridad (“BD SafetyGlide™”) para su conexión al cuerpo de la jeringa.
O
Dos jeringas precargadas de vidrio transparente tipo 1 con émbolo de poliestireno, equipadas con un cierre a prueba de manipulación, que contienen cada una 5 ml de Faslodex solución inyectable.
Se proporcionan además las agujas con sistema de seguridad (“BD SafetyGlide™”) para su conexión al cuerpo de cada jeringa.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de administración
Advertencia - No esterilizar en autoclave la aguja con sistema de seguridad (Aguja Hipodérmica Protegida “BD SafetyGlide”) antes de su uso. Las manos deben permanecer por detrás de la aguja en todo momento durante su uso y eliminación.
Para cada una de las dos jeringas:
Figura 1
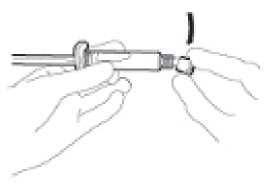
• Retire el cuerpo de vidrio de la jeringa de la bandeja y compruebe que no está dañado.
• Rompa el precinto del protector de plástico blanco del conector Luer (“Luer-Lok”) de la jeringa para retirar este protector junto con la tapa de goma de la punta (ver Figura 1). 1
• Lleve la jeringa cargada al punto de administración.
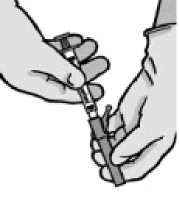
Figura 3
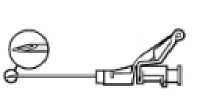
Figura 4
• Retire el capuchón de la aguja.
• Antes de su administración, se deben inspeccionar visualmente las soluciones parenterales en cuanto al contenido en partículas y a la decoloración.
• Retire el exceso de gas de la jeringa.
Administre lentamente vía intramuscular en el glúteo (1-2 minutos/inyección). Para una mayor comodidad, la posición de la aguja con el bisel hacia arriba tiene la misma orientación que el brazo de la palanca levantado (ver Figura 3).
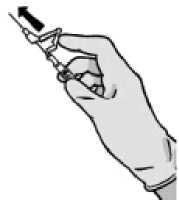
Tras la inyección, dé inmediatamente un solo toque con el dedo en el brazo de la palanca para activar el mecanismo de protección (ver Figura 4).
NOTA: Active alejado de su cuerpo y de los demás. Escuche el clic y confirme visualmente que la punta de la aguja está totalmente protegida.
Eliminación
Las jeringas precargadas son sólo para un único uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca UK Limited Charter Way,
Macclesfield,
Cheshire SK10 2NA Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/03/269/001
EU/1/03/269/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 10 Marzo 2004 Fecha de la última renovación: 10 Marzo 2009
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes AstraZeneca UK Limited Silk Road Business Park,
Macclesfield, SK10 2NA Reino Unido
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quarter, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/resgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
CARTONAJE
1. NOMBRE DEL MEDICAMENTO
Faslodex 250 mg solución inyectable. fulvestrant
2. PRINCIPIO(S) ACTIVO(S)
Una jeringa precargada contiene 250 mg de fulvestrant en 5 ml de solución.
3. LISTA DE EXCIPIENTES
Etanol (96 por ciento), alcohol bencílico, benzoato de bencilo y aceite de ricino. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en una jeringa precargada.
1 jeringa precargada (5 ml)
1 aguja con sistema de seguridad
2 jeringas precargadas (5 ml cada una)
2 agujas con sistema de seguridad
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía intramuscular.
Sólo para un único uso.
Para las instrucciones completas sobre la administración de Faslodex y el empleo de la aguja con sistema de seguridad, ver las “Instrucciones de administración” que se incluyen en el envase.
Deben administrarse dos jeringas para recibir la dosis mensual recomendada de 500 mg.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD.:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar en nevera.
Conservar la jeringa precargada en el embalaje original para protegerla de la luz. Consultar el prospecto para información sobre las desviaciones de temperatura.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca UK Limited Charter Way, Macclesfield,
Cheshire SK10 2NA Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/03/269/001
EU/1/03/269/002
13. NÚMERO DE LOTEDEL PRODUCTO
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
ETIQUETA DE LA JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Faslodex 250 mg solución inyectable
fulvestrant
Uso IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD.:
4. NÚMERO DE LOTE
Lote:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Faslodex 250 mg solución inyectable
Fulvestrant
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver Sección 4.
Contenido del prospecto
1. Qué es Faslodex y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Faslodex
3. Cómo usar Faslodex
4. Posibles efectos adversos
5. Conservación de Faslodex
6. Contenido del envase e información adicional
1. Qué es Faslodex y para qué se utiliza
Faslodex contiene el principio activo fulvestrant, que pertenece al grupo de bloqueantes de estrógeno. Los estrógenos, un tipo de hormonas sexuales femeninas, pueden estar en algunos casos implicados en el desarrollo del cáncer de mama.
Faslodex se utiliza para tratar el cáncer de mama avanzado o metastásico en mujeres postmenopáusicas.
2. Qué necesita saber antes de empezar a usar Faslodex No use Faslodex:
- si es alérgica a fulvestrant o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6 )
- si está embarazada o en periodo de lactancia
- si presenta problemas hepáticos graves
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Faslodex si algo de esto le aplica:
- problemas de riñón o hígado
- recuento bajo de plaquetas (que ayudan a la coagulación de la sangre) o alteraciones hemorrágicas
- problemas previos de coágulos sanguíneos
- osteoporosis (pérdida de densidad ósea)
- alcoholismo
Niños y adolescentes
Faslodex no está indicado en niños y adolescentes menores de 18 años.
Uso de Faslodex con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
En particular, debe decir a su médico si está utilizando anticoagulantes (medicamentos para prevenir los coágulos sanguíneos).
Embarazo y lactancia
No debe utilizar Faslodex si está usted embarazada. Si puede quedarse embarazada, debe utilizar un método anticonceptivo eficaz mientras esté en tratamiento con Faslodex.
No debe dar el pecho mientras esté en tratamiento con Faslodex.
Conducción y uso de máquinas
No se espera que Faslodex afecte a su capacidad para conducir o utilizar máquinas. Sin embargo, si se siente cansada después del tratamiento no conduzca ni utilice máquinas.
Faslodex contiene 10% p/v de etanol (alcohol), es decir, hasta 1000 mg por dosis, lo que equivale a 20 ml de cerveza u 8 ml de vino por dosis.
Este medicamento es perjudicial para personas que padecen alcoholismo.
El contenido en alcohol debe tenerse en cuenta en el caso de mujeres embarazadas o en periodo de lactancia, niños y grupos de alto riesgo, como pacientes con enfermedades del hígado, o epilepsia.
3. Cómo usar Faslodex
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es 500 mg de fulvestrant (dos inyecciones de 250 mg/5 ml) administrada una vez al mes con una dosis adicional de 500 mg administrada 2 semanas después de la dosis inicial.
Su médico o enfermero le administrará Faslodex mediante una inyección intramuscular lenta en cada uno de sus glúteos.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Faslodex puede producir efectos adversos, aunque no todas las personas los sufran.
Puede necesitar tratamiento médico urgente si experimenta alguno de los siguientes efectos adversos:
Informe inmediatamente a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos:
Efectos adversos muy frecuentes (puede afectar a más de 1 de cada 10 personas)
• Reacciones en el lugar de la inyección, como dolor y/o inflamación
• Niveles anormales de enzimas hepáticos (en análisis de sangre)*
• Náuseas (sensación de malestar)
• Debilidad, cansancio*
Todos los efectos adversos restantes:
Efectos adversos frecuentes (puede afectar hasta a 1 de cada 10 personas)
• Dolor de cabeza
• Sofocos
• Vómitos, diarrea o pérdida del apetito*
• Erupción
• Infecciones del tracto urinario
• Dolor de espalda*
• Aumento de bilirrubina (un pigmento de la bilis producido por el hígado)
• Tromboembolismo (aumento del riesgo de coágulos sanguíneos)*
• Reacciones alérgicas (hipersensibilidad), incluyendo hinchazón de la cara, labios, lengua y/o garganta
Efectos adversos poco frecuentes (puede afectar hasta a 1 de cada 100 personas)
• Disminución de los niveles de plaquetas (trombocitopenia)
• Hemorragia vaginal, flujo vaginal espeso, blanquecino y candidiasis (infección)
• Hematoma y hemorragia en el lugar de la inyección
• Aumento de gamma-GT, un enzima hepático que se identifica en un análisis de sangre
• Inflamación del hígado (hepatitis)
• Fallo hepático
• Incluye efectos adversos para los cuales no se puede evaluar el papel exacto de Faslodex debido a la enfermedad subyacente.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V*. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Faslodex
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase o en las etiquetas de las jeringas después de la abreviatura CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar en nevera (entre 2°C y 8°C).
Las desviaciones de temperatura fuera del rango de entre 2°C y 8°C deben ser controladas. Esto incluye evitar la conservación a temperaturas superiores a 30°C, y que no exceda un periodo de 28 días, durante el cual la temperatura media de conservación del medicamento sea inferior a 25°C (pero por encima de entre 2°C y 8°C). Tras las desviaciones de temperatura, el medicamento debe ser retornado de forma inmediata a las condiciones de conservación recomendadas (conservar y transportar en nevera entre 2°C y 8°C). Las desviaciones de temperatura tienen un efecto acumulativo en la calidad del medicamento, no debiéndose superar el periodo de 28 días por encima de la duración de la caducidad de 4 años de Faslodex. La exposición a temperaturas inferiores a 2°C no dañará el medicamento, siempre y cuando éste no se conserve por debajo de los -20°C.
Conservar la jeringa precargada en el embalaje original para protegerla de la luz.
Su profesional sanitario será el responsable de la conservación, uso y eliminación correctos de Faslodex.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Faslodex
- El principio activo es fulvestrant. Cada jeringa precargada (5 ml) contiene 250 mg de fulvestrant.
- Los demás componentes (excipientes) son etanol (96 por ciento), alcohol bencílico, benzoato de bencilo y aceite de ricino.
Aspecto del producto y contenido del envase
Faslodex es una solución viscosa, transparente, de incolora a amarilla en una jeringa precargada equipada con un cierre a prueba de manipulación, que contiene 5 ml de solución inyectable. Deben administrarse dos jeringas para recibir la dosis mensual recomendada de 500 mg.
Faslodex presenta 2 formatos, bien un envase que contiene 1 jeringa de vidrio precargada o bien un envase que contiene 2 jeringas de vidrio precargadas. Se proporcionan además agujas con sistema de seguridad (“BD SafetyGlide™”) para su conexión al cuerpo de cada jeringa.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
AstraZeneca UK Limited Charter Way,
Macclesfield,
Cheshire SK10 2NA Reino Unido
Responsable de la fabricación
AstraZeneca UK Limited
Silk Road Business Park
Macclesfield
Cheshire
SK10 2NA
Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien AstraZeneca S.A./N.V. Tel: +32 2 370 48 11 |
Lietuva UAB AstraZeneca Lietuva Tel: +370 5 2660550 |
|
Etarapna Acrpa3eHeKa Etarapua EOOfl Tea.: +359 2-44-55-000 |
Luxembourg/Luxemburg AstraZeneca S.A./N.V. Tél/Tel: +32 2 370 48 11 |
|
Ceská republika AstraZeneca Czech Republic s.r.o. Tel: +420 222 807 111 |
Magyarország AstraZeneca Kft Tel: +36 1 883 6500 |
|
Danmark AstraZeneca A/S Tlf: +45 43 66 64 62 |
Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
|
Deutschland AstraZeneca GmbH Tel: +49 41 03 7080 |
Nederland AstraZeneca BV Tel: +31 79 363 2222 |
|
Eesti AstraZeneca Tel: +372 6549 600 |
Norge AstraZeneca AS Tlf: +47 21 00 64 00 |
|
EXXáSa AstraZeneca A.E. T^: + 30 2 106871500 |
Osterreich AstraZeneca Osterreich GmbH Tel: +43 1 711 31 0 |
|
España AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00 |
Polska AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 874 35 00 |
|
France AstraZeneca Tél: +33 1 41 29 40 00 |
Portugal AstraZeneca Produtos Farmacéuticos, Lda. Tel: +351 21 434 61 00 |
|
Hrvatska AstraZeneca d.o.o. Tel: +385 1 4628 000 |
Romania AstraZeneca Pharma SRL Tel: +40 21 317 60 41 |
|
Ireland AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100 |
Slovenija AstraZeneca UK Limited Tel: +386 1 51 35 600 |
|
Ísland Vistor hf. |
Slovenská republika AstraZeneca AB o.z. |
Italia
Suomi/Finland
AstraZeneca Oy Puh/Tel: +358 10 23 010
Sverige
AstraZeneca AB Tel: +46 8 553 26 000
United Kingdom
AstraZeneca UK Ltd Tel: +44 1582 836 836
AstraZeneca S.p.A.
Tel: +39 02 9801 1
Kúrcpog
A^skt©p Oap^aKeuxiKq AxS T^: +357 22490305
Latvija
SIA AstraZeneca Latvija Tel: +371 67377100
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Faslodex 500 mg (2 x 250 mg/5 ml solución inyectable) debe administrarse empleando dos jeringas
precargadas, ver sección 3.
“BD SafetyGlide” es una marca registrada de “Becton Dickinson and Company” y es marcado CE:
CE 0050.
Instrucciones de administración
Advertencia - No esterilizar en autoclave la aguja con sistema de seguridad (Aguja Hipodérmica
Protegida “BD SafetyGlide™”) antes de su uso. Las manos deben permanecer por detrás de la aguja en
todo momento durante su uso y eliminación.
Para cada una de las dos jeringas:
Figura 1
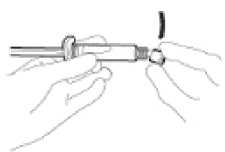
• Retire el cuerpo de vidrio de la jeringa de la bandeja y compruebe que no está dañado.
• Rompa el precinto del protector de plástico blanco del conector Luer (“Luer-Lok”) de la jeringa para retirar este protector junto con la tapa de goma de la punta (ver Figura 1).
Abra retirando el acondicionamiento exterior de la aguja con sistema de seguridad (“BD SafetyGlide”). Acople la aguja con sistema de seguridad al “Luer-Lok” (ver Figura 2).
Figura 2
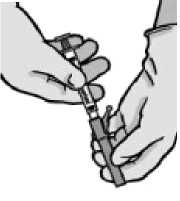
Figura 3
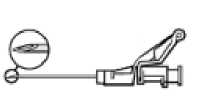
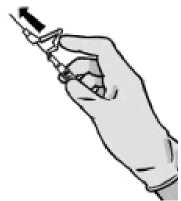
Figura 4
Gire hasta que se acople firmemente.
Gire la aguja para acoplarla al conector Luer.
Tire del capuchón de la aguja en línea recta para no dañar el extremo de la misma.
Lleve la jeringa cargada al punto de administración.
Retire el capuchón de la aguja.
Antes de su administración, se deben inspeccionar visualmente las soluciones parenterales en cuanto al contenido en partículas y a la decoloración.
Retire el exceso de gas de la jeringa.
Administre lentamente vía intramuscular en el glúteo (1-2 minutos/inyección). Para una mayor comodidad, la posición de la aguja con el bisel hacia arriba tiene la misma orientación que el brazo de la palanca levantado (ver Figura 3).
Tras la inyección, dé inmediatamente un solo toque con el dedo en el brazo de la palanca para activar el mecanismo de protección (ver Figura 4).
NOTA: Active alejado de su cuerpo y de los demás. Escuche el clic y confirme visualmente que la punta de la aguja está totalmente protegida.
Eliminación
Las jeringas precargadas son sólo para un único uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
28
Abra retirando el acondicionamiento exterior de la aguja con Figura 2 sistema de seguridad (“BD SafetyGlide”). Acople la aguja
con sistema de seguridad al “Luer-Lok” (ver Figura 2).
• Gire hasta que se acople firmemente.
• Gire la aguja para acoplarla al conector Luer.
• Tire del capuchón de la aguja en línea recta para no dañar el extremo de la misma.