Evarrest Matriz Adhesiva
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
EVARREST matriz adhesiva
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
EVARREST contiene por cm2
Fibrinógeno humano 8,1 mg
Trombina humana 40 UI
Excipiente(s) con efecto conocido:
Contiene hasta 3,0 mmol (68,8 g) de sodio por matriz adhesiva. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Matriz adhesiva.
EVARREST es un producto de combinación bioabsorbible de color blanco amarillento elaborado a partir de una matriz compuesta flexible, recubierta con fibrinógeno humano y trombina humana. La cara activa de la matriz adhesiva es de aspecto polvoriento y la cara no activa tiene un patrón de ondas en relieve.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
EVARREST está indicado en adultos para el tratamiento de apoyo en cirugías en las que las técnicas quirúrgicas convencionales son insuficientes, para mejorar la hemostasia (ver sección 5.1).
4.2 Posología y forma de administración
El uso de EVARREST está restringido a cirujanos experimentados.
Posología
La cantidad de EVARREST a aplicar y la frecuencia de aplicación siempre deben estar dictadas por las necesidades clínicas subyacentes del paciente.
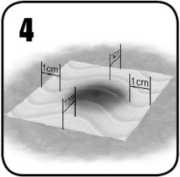
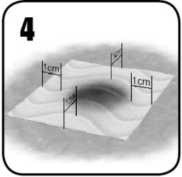
La cantidad de EVARREST a aplicar depende del área y la ubicación de la zona de sangrado a tratar. EVARREST debe aplicarse de forma que se extienda aproximadamente de 1 a 2 cm más allá de los márgenes del área de sangrado objetivo. Puede recortarse con el tamaño y la forma requeridos para adaptarla al tamaño del área de sangrado.
En estudios clínicos no se han investigado áreas de sangrado mayores que las que pueden ser cubiertas por una sola unidad de EVARREST. EVARREST sólo debe utilizarse en una única capa con una superposición de aproximadamente 1 a 2 cm sobre tejido no sangrante o una matriz adhesiva EVARREST adyacente.
Se pueden tratar múltiples puntos de sangrado simultáneamente. En total, no debe permanecer en el cuerpo más del equivalente a dos unidades de 10,2 cm x 10,2 cm o cuatro unidades de 5,1 cm x 10,2 cm ya que hay poca experiencia a largo plazo con mayores cantidades. No se ha estudiado el uso de más de cuatro unidades de 10,2 cm x 10,2 cm, o de cuatro unidades de 5,1 cm x 10,2 cm, ni el uso en pacientes que han estado expuestos previamente a EVARREST.
Si no se alcanza la hemostasia con una sola aplicación de EVARREST, se puede administrar nuevamente el tratamiento. Para consultar las instrucciones, ver más abajo.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de EVARREST en niños desde el nacimiento hasta los 18 años. No se dispone de datos.
Forma de administración
Sólo para uso epilesional. EVARREST debe aplicarse mediante compresión manual firme durante aproximadamente 3 minutos.
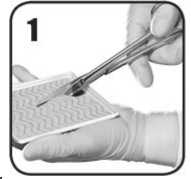
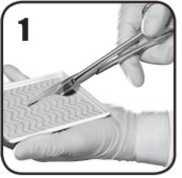
1. Usando tijeras estériles, corte cuidadosamente EVARREST con el tamaño y la forma
necesarios para cubrir y mantener el contacto con el área de sangrado con una superposición de aproximadamente 1 a 2 cm. Mantenga la cara activa de color blanco amarillento de aspecto polvoriento de EVARREST mirando hacia abajo mientras esté en la bandeja
2. Retire el exceso de sangre o líquido del lugar de aplicación si es necesario, para mejorar la visibilidad. Se debe identificar claramente el punto sangrante y asegurar que EVARREST se aplique directamente sobre el mismo cubriéndolo completamente. EVARREST se puede usar en un campo sangrante activo.
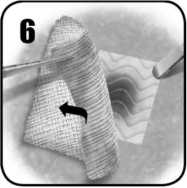
3. Aplique la cara activa de EVARREST sobre el área de sangrado, permitiendo contacto pleno con el tejido. El producto se activa mediante el contacto con el líquido, y se adhiere y ajusta al tejido.

4. Aplique una pieza de EVARREST de tamaño apropiado para cubrir adecuadamente la totalidad del área de sangrado, con una superposición de aproximadamente 1 a 2 cm sobre tejido no sangrante, para ayudar con adherencia al lugar de la lesión.
5a) Sujete sobre EVARREST gasa quirúrgica seca o húmeda o compresas de laparotomía para conseguir contacto pleno con la superficie sangrante.

5b) Para asegurar la hemostasia, aplique inmediatamente compresión manual sobre toda la superficie de EVARREST (incluida el área de superposición) suficiente para detener todo el sangrado. Mantenga la compresión durante aproximadamente 3 minutos, para controlar el sangrado.

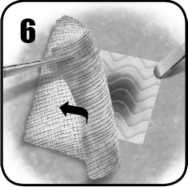
6. Suavemente retire del lugar de aplicación la gasa quirúrgica o las compresas de laparotomía, sin romper o desplazar EVARREST o el coágulo. Inspeccione EVARREST para verificar que se ha alcanzado la hemostasia y para asegurar que no hay encrespamiento sobre el área de sangrado. Si no está satisfecho con la colocación, retire EVARREST y use una nueva matriz adhesiva EVARREST. EVARREST permanecerá en su lugar y se adherirá al tejido, y es absorbible.
7. El lugar de aplicación debe ser controlado durante la intervención para verificar que se mantiene la hemostasia.
Retratamiento
• Puede requerirse retratamiento si hay dobleces, arrugas, o encrespamientos en la matriz adhesiva EVARREST. Si no está satisfecho con la colocación de EVARREST, retire la matriz adhesiva EVARREST usada y repita el procedimiento de aplicación anterior con una nueva matriz adhesiva EVARREST.
• Si el sangrado se debe a una cobertura insuficiente del área de sangrado, pueden aplicarse matrices adhesivas EVARREST adicionales. Aplique en una única capa, asegúrese de que los
bordes se superpongan (aproximadamente de 1 a 2 cm) sobre la matriz adhesiva EVARREST existente.
• Si el sangrado se debe a una adherencia incompleta al tejido (donde el sangrado persiste debajo del vendaje), retire la matriz adhesiva EVARREST y utilice una nueva matriz adhesiva EVARREST.
• Si el sangrado continúa durante o después del tiempo especificado de compresión, retire la matriz adhesiva EVARREST usada e inspeccione el lugar de sangrado. Si no parece que se requieran otras medidas hemostáticas primarias (por ejemplo, técnicas quirúrgicas estándar), repita el procedimiento de aplicación anterior con una nueva matriz adhesiva EVARREST.
4.3 Contraindicaciones
• EVARREST no debe utilizarse para tratar el sangrado grave de defectos extensos en grandes arterias o venas donde la pared vascular lesionada requiere reparación con mantenimiento de la permeabilidad del vaso y se produciría una exposición persistente de EVARREST al flujo de sangre y/o presión durante la cicatrización y la absorción del producto.
• EVARREST no debe aplicarse intravascularmente.
• EVARREST no debe utilizarse en espacios cerrados (por ejemplo, en, alrededor, o en las proximidades de agujeros óseos o áreas de confinamiento óseo), ya que el aumento de volumen puede causar compresión de nervios o vasos sanguíneos.
• EVARREST no debe utilizarse en presencia de infección activa o en áreas contaminadas del organismo porque puede producirse infección.
• Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Sólo para uso epilesional.
Aplicación intravascular
No aplicar intravascularmente. Pueden ocurrir complicaciones tromboembólicas que pongan en riesgo la vida si se administra involuntariamente la preparación intravascularmente.
Sangrado arterial
No se debe utilizar EVARREST en lugar de suturas u otras formas de ligadura mecánica para el tratamiento del sangrado de arterias principales.
Aplicaciones para las que no existen datos adecuados disponibles
No hay disponibles datos adecuados que apoyen el uso de este producto en adhesión de tejidos, neurocirugía o aplicación a través de un endoscopio flexible para el tratamiento de hemorragias, en cirugía vascular o en anastomosis gastrointestinales.
Reacciones de cuerpo extraño
Al igual que con cualquier producto implantable, se pueden producir reacciones de cuerpo extraño. EVARREST sólo debe utilizarse en una única capa con una superposición de aproximadamente 1 a 2 cm sobre tejido no sangrante, para ayudar con la adhesión a la zona de la herida. El tamaño de EVARREST debe limitarse al necesario para la hemostasia.
Reacciones de hipersensibilidad
Al igual que con cualquier producto proteínico, pueden presentarse reacciones de hipersensibilidad de tipo alérgico. Entre los signos de reacciones de hipersensibilidad se incluyen habones, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia. Si se presentan estos síntomas, la administración debe interrumpirse inmediatamente. En caso de shock, se debe implementar el tratamiento médico estándar para el mismo.
Contenido de sodio
EVARREST contiene hasta 3,0 mmol (68,8 g) de sodio por matriz adhesiva, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
Agentes infecciosos transmisibles
Las medidas estándar para prevenir infecciones resultantes del uso de medicamentos derivados de sangre o plasma humanos incluyen la selección de donantes, el cribado de las donaciones individuales y los bancos de plasma para marcadores específicos de infección, y la inclusión de etapas de fabricación eficaces para la inactivación/eliminación de virus. A pesar de esto, cuando se administran medicamentos derivados de sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto es aplicable también a virus desconocidos o emergentes y a otros patógenos.
Las medidas adoptadas se consideran eficaces para los virus encapsulados como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC) y para el virus no encapsulado de la hepatitis A (VHA). Las medidas adoptadas pueden ser de valor limitado frente a virus no encapsulados tales como el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección fetal) y en personas con inmunodeficiencia o eritropoyesis anormal (por ejemplo, anemia hemolítica).
Se recomienda encarecidamente que cada vez que se administre EVARREST a un paciente, se registre el nombre y el número de lote del producto, a fin de mantener un vínculo entre el paciente y el lote del producto.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones.
De manera similar a los productos comparables o a soluciones de trombina, el producto puede desnaturalizarse después de su exposición a soluciones que contengan alcohol, yodo o metales pesados (por ejemplo, soluciones antisépticas). Estas sustancias deben eliminarse en la mayor medida posible antes de aplicar el producto.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad de los selladores/hemostáticos de fibrina para su uso durante el embarazo o la lactancia en ensayos clínicos controlados. Los estudios experimentales en animales son insuficientes para evaluar la seguridad con respecto a la fertilidad, la reproducción, el desarrollo del embrión o feto, el curso de la gestación y el desarrollo peri y posnatal.
Por lo tanto, EVARREST debe administrarse a mujeres embarazadas y en periodo de lactancia sólo si está clínicamente indicado.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
En pacientes tratados con selladores/hemostáticos de fibrina, pueden ocurrir en raros casos, hipersensibilidad o reacciones alérgicas (que pueden incluir angioedema, ardor y escozor en el lugar de aplicación, broncoespasmo, escalofríos, rubefacción, urticaria generalizada, cefalea, habones, hipotensión, letargia, náuseas, agitación, taquicardia, opresión en el pecho, hormigueo, vómitos, sibilancias). En casos aislados, estas reacciones han progresado hasta anafilaxia grave. Tales reacciones pueden producirse particularmente si la preparación se aplica repetidamente, o si se administra a pacientes con hipersensibilidad conocida a los componentes del producto.
Rara vez puede ocurrir la producción de anticuerpos contra componentes de los productos selladores/hemostáticos de fibrina; también hay riesgo de reacción anafiláctica (ver sección 4.4).
Pueden ocurrir complicaciones tromboembólicas si se administra involuntariamente la preparación intravascularmente (ver sección 4.4).
Para obtener información de seguridad con respecto a agentes transmisibles, ver sección 4.4.
Resumen del perfil de seguridad
La información de seguridad para EVARREST refleja los tipos de complicación postoperatoria generalmente relacionados con los entornos quirúrgicos en los que se realizaron los ensayos y la enfermedad subyacente de los pacientes. En los ensayos clínicos, las reacciones adversas notificadas con mayor frecuencia fueron hemorragia y aumento de fibrinógeno, y las reacciones adversas más graves fueron aspiración, embolia pulmonar y hemorragia.
Tabla de reacciones adversas
Se han agrupado los datos de los cuatro ensayos clínicos controlados y un ensayo clínico no controlado con EVARREST en un conjunto integrado de datos y las frecuencias de ocurrencia descritas en la tabla que figura a continuación se originan a partir de este conjunto integrado de datos. En los análisis integrados, 243 pacientes fueron tratados con EVARREST y 110 pacientes fueron tratados con el tratamiento de control.
Se utilizan las siguientes categorías para clasificar las reacciones adversas por frecuencia de aparición: muy frecuentes (^1/10), frecuentes (^ 1/100 a <1/10), poco frecuentes (^ 1/1000 a <1/100); raras ( ^ 1/10.000 a <1/1000) y muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1 Resumen de reacciones adversas a EVARREST
|
Sistema de Clasificación de Órganos MedDRA |
Término preferido |
Frecuencia |
|
Trastornos vasculares |
Trombosis venosa profunda |
Poco frecuente |
|
Trastornos respiratorios, torácicos y mediastínicos |
Aspiración Derrame pleural Embolia pulmonar |
Poco frecuente Poco frecuente Poco frecuente |
|
Trastornos gastrointestinales |
Distensión abdominal |
Poco frecuente |
|
Ascitis |
Poco frecuente | |
|
Hemorragia |
Poco frecuente | |
|
• Hemorragia gastrointestinal | ||
|
• Hemorragia intraabdominal | ||
|
Acumulación localizada de líquido intraabdominal |
Poco frecuente | |
|
Acumulación de líquido peripancreática |
Poco frecuente |
|
Exploraciones complementarias |
Aumento del fibrinógeno sanguíneo |
Frecuente |
|
Lesión, intoxicación y complicaciones procedimentales |
Hemorragia posprocedimiento |
Frecuente |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antihemorrágicos, hemostáticos locales, código ATC: B02BC30
EVARREST contiene fibrinógeno humano y trombina humana como un recubrimiento seco sobre la superficie de una matriz compuesta absorbible. Los componentes del revestimiento se activan en contacto con los líquidos fisiológicos, por ejemplo sangre, linfa o solución salina fisiológica, y la reacción del fibrinógeno y la trombina inicia la última fase de la coagulación sanguínea fisiológica. El fibrinógeno se convierte en monómeros de fibrina que polimerizan espontáneamente para formar un coágulo de fibrina que sujeta la matriz firmemente a la superficie de la herida. A continuación la fibrina es reticulada por el factor XIII endógeno, lo que crea una red de fibrina mecánicamente estable y firme con buenas propiedades adhesivas.
La matriz compuesta se compone de poliglactina 910 y celulosa regenerada oxidada, un hemostático comúnmente utilizado. La matriz proporciona soporte físico y un área de superficie extensa para los componentes biológicos, imparte integridad mecánica inherente al producto y da soporte a la formación de coágulos. La formación de coágulos de EVARREST se integra a la matriz; ésta forma una barrera mecánica a la hemorragia y refuerza el lugar de la lesión. La curación natural se produce mientras la fibrina se degrada y el producto se absorbe por el cuerpo; se considera que la absorción dura aproximadamente 8 semanas, como se ha demostrado en modelos animales porcinos y murinos.
Los estudios clínicos que demuestran la hemostasia en sangrados de tejidos blandos leves o moderados se llevaron a cabo en un total de 141 sujetos (111 tratados con EVARREST y 30 con el control) sometidos a cirugía abdominal, retroperitoneal, pélvica, y torácica (no cardíaca). Un ensayo adicional en 91 pacientes sometidos a cirugía abdominal, retroperitoneal, pélvica, y torácica (no cardíaca), (59 tratados con EVARREST y 32 con el control) demostró hemostasia de hemorragias graves de tejidos blandos. Un estudio clínico en 104 pacientes sometidos a cirugía hepática (59 tratados con EVARREST y 45 con el control) demostró eficacia hemostática en el sangrado parenquimatoso persistente.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con EVARREST en uno o más grupos de la población pediátrica para el tratamiento de la hemorragia resultante de una intervención quirúrgica (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
EVARREST está diseñado solamente para uso epilesional. La administración intravascular está contraindicada y puede causar tromboembolismo. Como consecuencia de ello, no se realizaron estudios farmacocinéticos intravasculares en seres humanos.
Se han realizado estudios en conejos para evaluar la absorción y la eliminación de la trombina cuando se aplica a la superficie de corte del hígado resultante de una hepatectomía parcial. Mediante el uso de 125I-trombina se demostró que se produjo una lenta absorción de péptidos biológicamente inactivos resultantes de la ruptura de la trombina, alcanzando una Cmáx en plasma después de 6 a 8 horas. En la Cmáx, la concentración plasmática representó sólo entre 1% y 2% de la dosis aplicada.
Los selladores/hemostáticos de fibrina son metabolizados de la misma manera que la fibrina endógena, por fibrinólisis y fagocitosis.
Después de que los componentes biológicos han sido absorbidos, los componentes de la matriz (poliglactina 910 y celulosa regenerada oxidada) se absorben completamente. En estudios con animales EVARREST fue absorbida aproximadamente a los 56 días cuando se utilizó a la dosis clínica prevista.
5.3 Datos preclínicos sobre seguridad
La eficacia hemostática de EVARREST se demostró en una serie de modelos animales que evaluaron el tiempo hasta lograr la hemostasia, y la pérdida de sangre posterior al tratamiento, entre otros parámetros.
Los datos no clínicos sobre el componente de la matriz no muestran riesgos especiales para los seres humanos según los estudios de citotoxicidad, sensibilización, reactividad intracutánea, toxicidad sistémica aguda, pirogenicidad mediada por los materiales, toxicidad subcrónica, genotoxicidad, implantación y hemocompatibilidad.
Un estudio de 90 días en ratas para evaluar la toxicidad sistémica subcrónica y la inmunogenicidad de EVARREST tras implantación subcutánea, no encontró indicios de efectos tóxicos ni evidencia alguna de una mayor inmunogenicidad relativa a productos selladores de fibrina.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Matriz compuesta (poliglactina 910 y celulosa regenerada oxidada) 20 mg/cm2
Clorhidrato de arginina
Glicina
Cloruro de sodio Citrato de sodio Cloruro cálcico Albúmina humana Manitol Acetato sódico
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
Una vez abierto el sobre de aluminio, EVARREST puede permanecer en el campo estéril para estar disponible para su uso durante todo el procedimiento.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25 °C. No congelar.
6.5 Naturaleza y contenido del envase
Matriz adhesiva de 10,2 cm x 10,2 cm en una bandeja (poliéster). La bandeja se encuentra en un sobre (lámina de aluminio laminado en poliéster) con un sello. Envase de 1 unidad: matriz adhesiva de 10,2 cm x 10,2 cm.
Matriz adhesiva de 5,1 cm x 10,2 cm en una bandeja (poliéster). La bandeja se encuentra en un sobre (lámina de aluminio laminado en poliéster) con un sello. Envase de 2 unidades: matrices adhesivas de 5,1 cm x 10,2 cm.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las instrucciones de uso también se describen en el prospecto.
Manipulación de EVARREST
• EVARREST viene listo para usarse en envases estériles y debe manipularse usando una técnica estéril en condiciones asépticas. Descartar los envases dañados.
• Para abrir el producto, extraiga el sobre de aluminio de la caja, abra cuidadosamente el sobre de aluminio evitando el contacto con el interior del aluminio o la bandeja estéril blanca que contiene EVARREST.
• Extraiga la bandeja blanca estéril de la bolsa y colóquela sobre el campo estéril.
• Sujete la bandeja de forma segura en la palma de la mano, asegurándose de que la cara de los agujeros mira hacia arriba, y use las lengüetas del lateral de la bandeja para retirar la parte superior de la bandeja con la otra mano.
• La parte inferior de la bandeja contiene EVARREST con la cara activa mirando hacia abajo. La cara activa tiene aspecto polvoriento. La cara no activa tiene un patrón de ondas en relieve.
• Mantenga EVARREST seco tras su apertura. El producto puede permanecer en el campo estéril para estar disponible para su uso durante todo el procedimiento. EVARREST no se pega a los guantes, pinzas ni instrumental quirúrgico.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa legal.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Omrix Biopharmaceuticals NV Leonardo Da Vincilaan 15 1831 Diegem Bélgica
Teléfono: +32 2 746 30 00 Telefax: + 32 2 746 30 01
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/868/001
EU/1/13/868/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 29 de septiembre de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y
FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y
EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (los) fabricante(s) del (los) principio(s) activo(s) biológico(s)
Omrix Biopharmaceuticals Ltd.
Plasma Fractionation Institute (PFI), MDA Blood Bank
Sheba Hospital
Ramat Gan 52621
POB 888
KiryatOno 55000
Israel
Nombre y dirección del (los) fabricante(s) responsable(s) de la liberación de los lotes
Omrix Biopharmaceuticals N.V.
Leonardo Da Vinci Laan 15 B-1831 Diegem Belgium
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida, reservado para su uso en ciertas áreas especializadas (ver Anexo I: Ficha Técnica o Resumen de las características del producto, sección 4.2).
• Liberación oficial de lotes
De conformidad con el artículo 114 de la Directiva 2001/83/CEE, modificada, la liberación oficial de los lotes será realizara por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de seis meses después de la autorización.
Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR coinciden, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Y EL ACONDICIONAMIENTO PRIMARIO
Caja y sobre de aluminio_
1. NOMBRE DEL MEDICAMENTO
EVARREST matriz adhesiva
2. PRINCIPIO(S) ACTIVO(S)
EVARREST contiene por cm2 Fibrinógeno humano 8,1 mg
Trombina humana 40 UI
3. LISTA DE EXCIPIENTES
Excipientes:
Matriz compuesta (poliglactina 910 y celulosa regenerada oxidada)
Clorhidrato de arginina
Glicina
Cloruro de sodio Citrato de sodio Cloruro cálcico Albúmina humana Manitol Acetato sódico
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Contiene una matriz adhesiva (10,2 cm x 10,2 cm)
Contiene dos matrices adhesivas (5,1 cm x 10,2 cm) 2 unidades
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para uso epilesional.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
EXP
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25 °C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Omrix Biopharmaceuticals NV Leonardo Da Vincilaan 15 1831 Diegem Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/868/001
EU/1/13/868/002
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
B. PROSPECTO
Prospecto: información para el paciente EVARREST
matriz adhesiva Fibrinógeno humano/Trombina humana
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de ser tratado con este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es EVARREST y para qué se utiliza
2. Qué necesita saber antes de ser tratado con EVARREST
3. Cómo se usa EVARREST
4. Posibles efectos adversos
5. Conservación de EVARREST
6. Contenido del envase e información adicional
1. Qué es EVARREST y para qué se utiliza
EVARREST es un producto de combinación compuesto de un material absorbible (matriz) recubierto de fibrinógeno humano y trombina humana.
El fibrinógeno es una proteína extraída de la sangre que al interactuar con la enzima trombina, forma un coágulo de fibrina. Cuando el recubrimiento de polvo seco de EVARREST se humedece, la trombina actúa sobre el fibrinógeno para formar rápidamente un coágulo. Este coágulo de fibrina se integra en la matriz lo que permite que EVARREST se adhiera firmemente al tejido circundante.
EVARREST se aplica durante las intervenciones quirúrgicas en sujetos adultos, para detener el sangrado y la supuración durante la cirugía. Se aplica directamente sobre el tejido, donde se adhiere firmemente y detiene el sangrado. Se deja en su lugar después de la operación y es absorbida por el organismo.
2. Qué necesita saber antes de ser tratado con EVARREST
Su cirujano no debe tratarle con EVARREST bajo las siguientes circunstancias:
EVARREST no debe usarse para reparar lesiones de la pared de grandes arterias o venas donde se exponga el producto a flujo y presión sanguínea constantes.
EVARREST no debe aplicarse en el interior de vasos sanguíneos.
No debe utilizarse EVARREST en espacios cerrados (por ejemplo, en, alrededor, o al lado de orificios o conductos en el hueso u otras áreas restringidas alrededor de hueso), donde pudiera hincharse y comprimir nervios o vasos sanguíneos.
No debe utilizarse EVARREST en presencia de infección activa o en áreas contaminadas del organismo porque puede producirse infección.
Usted no debe ser tratado con EVARREST si es alérgico al fibrinógeno humano o a la trombina humana o a cualquiera de los otros componentes de este medicamento (incluidos en la sección 6)
Advertencias y precauciones
Aplicaciones _para las que no hay información adecuada disponible
No se ha estudiado el uso de EVARREST en los siguientes procedimientos, y por tanto no hay información que muestre que pueda ser efectivo:
- adhesion de tejidos
- cirugía cerebral o de médula espinal
- control de sangrados gástricos o intestinales aplicando el producto mediante endoscopia (tubo)
- sellado de reparaciones quirúrgicas intestinales.
Reacciones de cuerpo extraño
Al igual que con cualquier producto implantado, el organismo puede desarrollar una reacción al material extraño. Esto podría provocar problemas en la cicatrización. EVARREST sólo debe utilizarse en una única capa con una superposición de aproximadamente 1 a 2 cm sobre tejido no sangrante, para ayudarlo a adherirse al área de sangrado. El tamaño de EVARREST debe limitarse al necesario para detener el sangrado.
Reacciones de hipersensibilidad
Pueden producirse reacciones de hipersensibilidad de tipo alérgico. Pueden ser signos de dichas reacciones urticaria, erupciones cutáneas, opresión en el pecho, sonido silbante que se produce al respirar (sibilancias), descenso de la presión arterial y anafilaxia (una reacción grave de inicio rápido). Si estos síntomas ocurren durante la cirugía, debe suspenderse inmediatamente el uso del producto.
Transmisión de asentes infecciosos
Cuando los medicamentos se componen de sangre o plasma humanos, se ponen en práctica una serie de medidas para prevenir la transmisión de infecciones a los pacientes. Estas incluyen:
- selección cuidadosa de los donantes de sangre y plasma asegurándose la exclusión de aquellos en riesgo de padecer infecciones.
- pruebas de virus/infecciones en cada donación y mezcla de plasma
- inclusión de pasos en el procesamiento de la sangre y el plasma que puedan inactivar o eliminar los virus.
A pesar de estas medidas, cuando se dan medicamentos procedentes de sangre o plasma humanos, no se puede excluir totalmente la posibilidad de transmisión de infecciones. Esto es aplicable también a cualquier virus desconocido o nuevo, u otros tipos de infección.
Las medidas tomadas en la fabricación del fibrinógeno y la trombina se consideran efectivas para virus encapsulados como el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B y virus de la hepatitis C, y para el virus no encapsulado de la hepatitis A. Las medidas tomadas pueden ser de valor limitado contra virus no encapsulado como el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección fetal) y en individuos cuyo sistema inmunológico esté deprimido o que tengan algunos tipos de anemia (por ejemplo, anemia falciforme o anemia hemolítica).
Es altamente recomendable que cada vez que sea usted tratado con EVARREST, se registre el nombre y el número de lote del medicamento para mantener un registro de los lotes usados.
Niños y adolescentes
No se recomienda el uso de EVARREST en niños y adolescentes menores de 18 años.
Uso de EVARREST con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
No hay suficiente información disponible para saber si se asocia algún riesgo en particular con el uso de EVARREST durante el embarazo o el periodo de lactancia, o si puede afectar a la fertilidad. Si está embarazada o en período de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
EVARREST contiene sodio
Este medicamento contiene hasta 3,0 mmol (68,8 mg) de sodio por matriz adhesiva EVARREST, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
3. Cómo se usa
EVARRESTEl cirujano aplicará EVARREST durante su operación. Se aplica presionando firmemente sobre el tejido sangrante unos 3 minutos. EVARREST se activa al contacto con la sangre u otro fluido y se pegará firmemente al tejido. Se deja en su lugar y es absorbido por el organismo en 8 semanas, aproximadamente.
EVARREST puede cortarse con el tamaño y la forma requeridos para adaptarse al tamaño del área de sangrado. La cantidad de EVARREST que hay que aplicar depende del área de la superficie y de la localización del lugar de sangrado a tratar durante la operación. EVARREST sólo debe utilizarse en una única capa. Si es necesario debe utilizarse hasta el equivalente de dos unidades de 10,2 cm x
10,2 cm o cuatro unidades de 5,1 cm x 10,2 cm para cubrir toda el área de sangrado, con una superposición de aproximadamente 1 a 2 cm. Si continúa el sangrado, se puede retirar la matriz adhesiva EVARREST y aplicar una nueva.
La cantidad total de EVARREST dejada en el cuerpo tras la operación no debe exceder el tamaño de dos matrices adhesivas de 10,2 cm x 10,2 cm o cuatro matrices adhesivas de 5,1 cm x 10,2 cm.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Los siguientes efectos adversos que ocurrieron durante los estudios clínicos se consideraron relacionados con el uso de EVARREST:
Efectos adversos más graves Sangrado (hemorragia)
- Del intestino (hemorragia gastrointestinal); poco frecuente (puede afectar hasta 1 de cada 100 personas).
- Del abdomen (hemorragia intraabdominal); poco frecuente (puede afectar hasta 1 de cada 100 personas).
- Después de la cirugía (hemorragia posterior al procedimiento); frecuente (puede afectar hasta 1 de cada 10 personas).
Coágulo de sangre (tromboembolia)
- En las venas, particularmente de las piernas (trombosis venosa profunda)
- En las arterias que irrigan los pulmones (embolia pulmonar)
Ambos efectos adversos fueron poco frecuentes (pueden afectar hasta 1 de cada 100 personas).
Ingesta no intencional de líquidos a las vías respiratorias (broncoaspiración); poco frecuente (puede afectar hasta 1 de cada 100 personas).
Si experimenta síntomas tales como vómitos con sangre, sangre en las heces, sangre en el tubo de drenaje de su abdomen, hinchazón o decoloración de la piel en las extremidades, dolor en el pecho y dificultad para respirar, y/o cualquier otro síntoma relacionado con la cirugía, póngase en contacto inmediatamente con su médico o cirujano.
Otros efectos adversos
Otros efectos adversos que fueron comunicados durante los ensayos clínicos con EVARREST incluyeron:
Frecuentes (afectando hasta 1 de cada 10 personas).
- complicaciones postoperatorias de la herida (incluyendo hemorragia e infección durante o después de la cirugía)
- aumento del nivel de proteínas de la coagulación (fibrinógeno).
Poco frecuentes (afectando desde 1 de cada 100 hasta menos de 1 de cada 10 personas)
- acumulación de aire y líquido en el estómago (abdomen) o el pulmón después de la cirugía (derrame pleural, distensión abdominal, ascitis, acumulación de líquido pancreática).
EVARREST contiene los componentes del sellador de fibrina. Los selladores de fibrina pueden, en raras ocasiones (hasta 1 de cada 1000 pacientes), causar una reacción alérgica. Si usted experimenta una reacción alérgica podría tener uno o más de los siguientes síntomas: inflamación debajo de la piel (angioedema), erupción cutánea, urticaria o ronchas, opresión en el pecho, escalofríos, rubor, dolor de cabeza, hipotensión arterial, letargia, náuseas, intranquilidad, aumento de la frecuencia cardiaca, hormigueo, vómitos o sonido silbante que se produce al respirar (sibilancias). Si experimenta alguno de estos síntomas tras la cirugía, debe consultar a su médico o cirujano.
Existe también la posibilidad teórica de que pudiera usted desarrollar anticuerpos contra las proteínas de EVARREST que podrían interferir con la coagulación de la sangre. No se conoce la frecuencia de este tipo de evento (no puede estimarse a partir de los datos disponibles).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o cirujano, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de EVARREST
EVARREST debe mantenerse fuera de la vista y del alcance de los niños.
EVARREST no debe utilizarse después de la fecha de caducidad que aparece en el sobre de aluminio y en la caja de cartón después de EXP. La fecha de caducidad es el último día del mes que se indica.
EVARREST no se debe conservar a temperatura superior a 25 °C y no se debe congelar.
EVARREST debe mantenerse seco en todo momento hasta su aplicación para evitar la preactivación.
El sobre de aluminio protege a EVARREST de la humedad y de la contaminación microbiológica.
6. Contenido del envase e información adicional
Composición de EVARREST
Los principios activos son las siguientes:
- Fibrinógeno humano (8,1 mg/cm2)
- Trombina humana (40 UI/cm2)
- Los demás componentes son:
- Compuesto de matriz (poliglactina 910 y celulosa regenerada oxidada)
- Clorhidrato de arginina
- Glicina
- Cloruro sódico
- Citrato sódico
- Cloruro cálcico
- Albúmina humana
- Manitol
- Acetato sódico
Aspecto de EVARREST y contenido del envase
EVARREST se presenta como una matriz adhesiva de 10,2 cm x 10,2 cm de tamaño. Envase de una unidad. También como matrices adhesivas de 5,1 cm x 10,2 cm de tamaño. Envase de dos unidades.
Titular de la autorización de comercialización y responsable de la fabricación
Omrix Biopharmaceuticals NV Leonardo Da Vincilaan 15B-1831 Diegem Bélgica
Teléfono: + 32 2 746 30 00 Telefax: + 32 2 746 30 01
Para cualquier información sobre este medicamento, por favor contacte con el representante de la fabricación:
Pharmacovigilance Department Omrix Biopharmaceuticals Ltd Plasma Fractionation Institute Sheba Hospital, Tel Hashomer RamatGan 52621, Israel Teléfono: +972-3-5316512 Telefax: +972-3-5316590
Fecha de la última revisión de este prospecto: 09/2013 Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Instrucciones de uso
Lea esto antes de abrir el envase Manipulaciónde EVARREST
EVARREST viene listo para usarse en envases estériles y debe manipularse usando una técnica estéril en condiciones asépticas. Deseche los envases dañados, ya que no es posible la reesterilización.
Para abrir el producto, extraiga el sobre de aluminio de la caja, abra cuidadosamente el sobre de aluminio evitando el contacto con el interior del aluminio o la bandeja estéril blanca que contiene EVARREST.
Extraiga la bandeja blanca estéril de la bolsa y colóquela sobre el campo estéril.
Sujete la bandeja de forma segura en la palma de la mano, asegurándose de que la cara de los agujeros mira hacia arriba, y use las lengüetas del lateral de la bandeja para retirar la parte superior de la bandeja con la otra mano.
La parte inferior de la bandeja contiene EVARREST con la cara activa mirando hacia abajo. La cara activa tiene apariencia de polvo. La cara no activa tiene un patrón ondulado en relieve.
Mantenga EVARREST seco tras su apertura. La matriz adhesiva EVARREST puede permanecer en el campo estéril para estar disponible para su uso durante todo el procedimiento. EVARREST no se pega a los guantes, pinzas ni instrumental quirúrgico.
Conservación de EVARREST
No utilizar después de la fecha de caducidad indicada en la caja y etiqueta.
Mantener fuera de la vista y el alcance de los niños.
No conservar a temperatura superior a 25 °C. No congelar.
Aplicación de EVARREST
Sólo para uso epilesional. EVARREST debe aplicarse mediante compresión manual firme durante
aproximadamente 3 minutos.
1. Usando tijeras estériles, corte cuidadosamente EVARREST con el tamaño y la forma necesarios para cubrir y mantener contacto con el área sangrante con una superposición de aproximadamente 1 a 2 cm. Mantenga la cara activa de color blanco amarillento de aspecto polvoriento de EVARREST mirando hacia abajo mientras esté en la bandeja.
2. Retire el exceso de sangre o fluido del lugar de aplicación si es necesario para mejorar la visibilidad. Se debe identificar claramente el punto sangrante y asegurar que EVARREST se aplica directamente sobre el mismo cubriéndolo completamente. EVARREST se puede usar en un campo sangrante activo.
3. Aplique la cara activa de EVARREST sobre el área de sangrado, permitiendo contacto pleno con el tejido. El producto se activa mediante el contacto con el líquido, y se adhiere y ajusta al tejido.

4. Aplique una pieza de EVARREST de tamaño apropiado para cubrir adecuadamente la totalidad del área sangrante, con una superposición de aproximadamente 1 a 2 cm sobre tejido no sangrante, para ayudar con adherencia al lugar de la lesión.
5a) Sujete sobre EVARREST gasa quirúrgica seca o húmeda o compresas de laparotomía para conseguir contacto pleno con la superficie sangrante.

5b) Para asegurar la hemostasia, aplique inmediatamente compresión manual sobre toda la superficie de EVARREST (incluida el área de superposición) suficiente para detener todo el sangrado. Mantenga la compresión durante aproximadamente 3 minutos, para controlar el sangrado.

6. Suavemente retire del lugar de aplicación la gasa quirúrgica o las compresas de laparotomía, sin romper o desplazar EVARREST o el coágulo. Inspeccione EVARREST para verificar que se ha alcanzado la hemostasia y para asegurar que no hay encrespamiento sobre el área de sangrado. Si no está satisfecho con la colocación, retire EVARREST y use una nueva matriz adhesiva. EVARREST permanecerá en su lugar y se adherirá al tejido, y es absorbible.
7. El lugar de aplicación debe ser controlado durante la intervención para verificar que se mantiene la hemostasia.
Retratamiento
• Puede requerirse retratamiento si hay dobleces, arrugas, o encrespamientos en la matriz adhesiva EVARREST. Si no está satisfecho con la colocación de EVARREST, retire la matriz adhesiva EVARREST usada y repita el procedimiento de aplicación anterior con una nueva matriz adhesiva EVARREST.
• Si el sangrado se debe a una cobertura insuficiente del área de sangrado, pueden aplicarse matrices adhesivas EVARREST adicionales. Aplique en una única capa, asegúrese de que los bordes se superpongan (aproximadamente de 1 a 2 cm) sobre la matriz adhesiva EVARREST existente.
• Si el sangrado se debe a una adherencia incompleta al tejido (donde el sangrado persiste debajo del vendaje), retire la matriz adhesiva EVARREST y utilice una nueva.
• Si el sangrado continúa durante o después del tiempo especificado de compresión, retire la matriz adhesiva EVARREST usada e inspeccione el lugar de sangrado. Si no parece que se requieran otras medidas hemostásicas primarias (por ejemplo, técnicas quirúrgicas estándar), repita el procedimiento de aplicación anterior con una nueva matriz adhesiva EVARREST.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
28