Eperzan 50Mg Polvo Y Disolvente Para Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Eperzan 30 mg polvo y disolvente para solución inyectable Eperzan 50 mg polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Eperzan 30 mg polvo y disolvente para solución inyectable
Tras la reconstitución, cada pluma contiene 30 mg de albiglutida por cada dosis de 0,5 ml.
Eperzan 50 mg polvo y disolvente para solución inyectable
Tras la reconstitución, cada pluma contiene 50 mg de albiglutida por cada dosis de 0,5 ml.
Albiglutida es una proteína de fusión recombinante que consiste en dos copias de una secuencia de 30 aminoácidos de péptido similar a glucagón humano tipo 1 modificado genéticamente unido en serie a albúmina humana.
Albiglutida se produce por tecnología del ADN recombinante en células de Saccharomyces cerevisiae. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable. Polvo: polvo liofilizado de blanco a amarillento.
Disolvente: solución transparente, incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Eperzan está indicado para el tratamiento de diabetes mellitus tipo 2 en adultos para mejorar el control glucémico como:
Monoterapia
Cuando la dieta y el ejercicio por sí solos no proporcionan un control glucémico adecuado, en pacientes para los cuales el uso de metformina no se considera apropiado debido a contraindicaciones o intolerancia.
Tratamiento adicional en combinación
En combinación con otros medicamentos antihiperglucemiantes incluyendo insulina basal, cuando éstos, junto con la dieta y el ejercicio, no proporcionan un control glucémico adecuado (ver secciones 4.4 y 5.1 para datos disponibles acerca de las diferentes combinaciones).
4.2 Posología y forma de administración
Posología
La dosis recomendada de Eperzan es de 30 mg una vez a la semana, administrada por vía subcutánea.
La dosis se puede aumentar a 50 mg una vez a la semana según la respuesta glucémica individual.
Cuando se añade Eperzan a un tratamiento ya existente con metformina, se puede continuar con la misma dosis de metformina. Cuando se comience el tratamiento con Eperzan de forma concomitante con secretagogos de insulina (tales como sulfonilureas) o insulina, puede ser necesaria una reducción de la dosis de éstos para reducir el riesgo de hipoglucemia (ver secciones 4.4 y 4.8).
El uso de Eperzan no requiere un autocontrol de los niveles de glucosa en sangre. Sin embargo, cuando se usa en combinación con sulfonilurea o insulina basal, este autocontrol de glucosa en sangre puede llegar a ser necesario para ajustar la dosis de sulfonilurea o de insulina basal.
Eperzan puede ser administrado a cualquier hora del día, independientemente de las comidas.
Eperzan se debe administrar una vez a la semana, el mismo día cada semana. El día de administración semanal se puede cambiar si es necesario, siempre que la última dosis fuera administrada 4 días antes o más.
Si se olvida una dosis, ésta se debe administrar tan pronto como sea posible, dentro de los 3 días siguientes a la dosis olvidada. A partir de entonces, los pacientes pueden retomar la dosis en su día habitual de administración. Si han transcurrido más de 3 días después de la dosis olvidada, los pacientes deben esperar y administrar la siguiente en el día programado de su dosis semanal.
Pacientes de edad avanzada (>65 años)
No se requiere ajuste de dosis en función de la edad. La experiencia clínica en pacientes >75 años es muy limitada (ver sección 5.2).
Pacientes con insuficiencia renal
No es necesario ajuste de dosis para pacientes con insuficiencia renal leve o moderada (Filtrado glomerular eGFR 60 a 89 y 30 a 59 ml/min/1,73 m2 respectivamente) (ver secciones 4.4, 4.8, 5.1, 5.2). La experiencia en pacientes con insuficiencia renal grave (<30 ml/min/1,73 m2) o en diálisis es muy limitada y por lo tanto Eperzan no está recomendado en esta población (ver secciones 4.4, 4.8, 5.1, 5.2).
Pacientes con insuficiencia hepática
No se recomienda ajuste de dosis para pacientes con insuficiencia hepática. No se han realizado estudios en pacientes con insuficiencia hepática (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Eperzan en niños y adolescentes de menos de 18 años (ver sección 5.2). No se dispone de datos.
Forma de administración
Eperzan está diseñado para su administración por el propio paciente como inyección subcutánea en el abdomen, el muslo o la parte superior del brazo.
No se debe administrar por vía intravenosa o intramuscular.
Cada pluma sólo puede ser utilizada por una persona y es de un solo uso.
El polvo liofilizado que contiene la pluma se debe reconstituir antes de la administración.
Para consultar las instrucciones completas de reconstitución y administración de Eperzan, ver sección 6.6 y las instrucciones de uso incluidas en el prospecto.
Cuando Eperzan se utilice con insulina, cada medicamento se debe administrar en inyecciones separadas. Nunca se deben mezclar los dos medicamentos. Es aceptable inyectar Eperzan e insulina en la misma zona del cuerpo pero las inyecciones no deben ser adyacentes.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
No hay experiencia terapéutica en pacientes con diabetes mellitus tipo 1 y no se debe emplear en estos pacientes. Eperzan no se debe utilizar para el tratamiento de la cetoacidosis diabética.
Pancreatitis aguda
El uso de agonistas del receptor de GLP-1 se ha asociado con riesgo de desarrollar pancreatitis aguda. En ensayos clínicos, se ha notificado pancreatitis aguda en asociación con Eperzan (ver sección 4.8).
Se debe informar a los pacientes acerca de los síntomas característicos de pancreatitis aguda. Si se sospecha pancreatitis, se debe interrumpir el tratamiento con Eperzan; si se confirma la pancreatitis, Eperzan no se debe volver a utilizar. Se debe tener precaución en pacientes con antecedentes de pancreatitis.
Hipoglucemia
El riesgo de hipoglucemia aumenta cuando Eperzan se utiliza en combinación con secretagogos de insulina (como sulfonilurea) o con insulina. Por lo tanto, es posible que los pacientes requieran una dosis más baja de sulfonilurea o insulina para reducir el riesgo de hipoglucemia (ver secciones 4.2, 4.8).
Enfermedad gastrointestinal grave
El uso de agonistas del receptor de GLP-1 se puede asociar con reacciones adversas gastrointestinales. Eperzan no se ha estudiado en pacientes con enfermedad gastrointestinal grave, incluyendo gastroparesia grave y por tanto no se recomienda en estos pacientes.
Insuficiencia renal
Los pacientes con insuficiencia renal grave que recibían Eperzan experimentaron con mayor frecuencia diarrea, náuseas y vómitos en comparación con pacientes con insuficiencia renal leve o moderada. Este tipo de acontecimientos gastrointestinales pueden producir deshidratación y empeorar la función renal.
Interrupción del tratamiento
Tras la interrupción, el efecto de Eperzan puede continuar ya que los niveles plasmáticos de albiglutida decrecen lentamente durante unas 3 a 4 semanas. La elección de otros medicamentos y sus dosis se deben considerar en concordancia, ya que hasta que los niveles de albiglutida desciendan pueden continuar las reacciones adversas y la eficacia puede, al menos en parte, persistir.
Poblaciones no estudiadas
No hay experiencia en pacientes con insuficiencia cardiaca clase III-IV de la NYHA.
Eperzan no se ha estudiado en combinación con insulina prandial, inhibidores de la dipeptidil peptidasa-4 (DPP-4) o inhibidores del cotransportador sodio-glucosa (SGLT2).
La experiencia de albiglutida es limitada cuando se combina con tiazolidindionas sólo, sulfonilureas + tiazolidindionas y metformina + sulfonilureas + tiazolidindionas.
Contenido en sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por cada dosis de 0,5 ml, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
Albiglutida retarda el vaciado gástrico, y puede afectar a la absorción de medicamentos administrados por vía oral de forma concomitante. Albiglutida enlenteció el vaciado gástrico en comparación con placebo para sólidos y líquidos cuando se administraron 100 mg como dosis única en sujetos sanos (ver sección 5.1). Se debe tener precaución en pacientes que reciben medicamentos con estrecho margen terapéutico o medicamentos que requieren una cuidadosa monitorización clínica.
Acarbosa
Acarbosa está contraindicado en pacientes con obstrucción intestinal. Se recomienda precaución si se utiliza de forma concomitante con albiglutida (ver sección 4.8).
Simvastatina
Se administró una dosis única de simvastatina (80 mg) con albiglutida en estado estacionario (50 mg semanal). El AUC de simvastatina decreció en un 40% y la Cmax de simvastatina aumentó un 18%. El AUC de simvastatina ácida aumentó un 36% y la Cmax aumentó aproximadamente un 100%. Se observó una disminución de la semivida de simvastatina y simvastatina ácida de ~7 horas a 3,5 horas. Albiglutida no mostró un impacto sobre la seguridad de simvastatina en los ensayos clínicos.
Digoxina
Albiglutida no alteró de forma significativa la farmacocinética de una dosis única de digoxina (0,5 mg) administrada con albiglutida en estado estacionario (50 mg semanal).
Warfarina
No se observaron efectos clínicamente relevantes en la farmacocinética de los enantiómeros R-y S- de warfarina cuando se administró una dosis única del racémico de warfarina (25 mg) con albiglutida en estado estacionario (50 mg semanal). Además, albiglutida no alteró de forma significativa los efectos farmacodinámicos de warfarina cuantificados mediante INR (Razón Normalizada Internacional).
Anticonceptivos orales
Albiglutida (50 mg semanal en estado estacionario) no tuvo efectos clínicamente relevantes en la farmacocinética del estado estacionario de una combinación de anticonceptivos orales que contenía 0,5 mg de noretindrona y 0,035 mg de etinilestradiol. Además, no se observaron efectos clínicamente relevantes en la hormona luteinizante, la hormona folículo-estimulante o la progesterona, cuando se administró albiglutida junto con una combinación de anticonceptivos orales.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de Eperzan en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3). Se desconoce el riesgo potencial en humanos. Eperzan no debe utilizarse durante el embarazo y no está recomendado en mujeres en edad fértil que no estén utilizando métodos anticonceptivos adecuados.
Eperzan se debe interrumpir al menos 1 mes antes de un embarazo programado debido al largo periodo de lavado de albiglutida.
Lactancia
No hay datos adecuados que apoyen el uso de Eperzan durante la lactancia en humanos.
Se desconoce si albiglutida se excreta en la leche materna. Dado que albiglutida es un agente terapéutico proteico basado en la albúmina, es probable que esté presente en la leche materna. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre. Se observó una disminución del peso corporal de las crías en ratones tratados con albiglutida durante el embarazo y la lactancia (ver sección 5.3).
Fertilidad
No hay datos sobre los efectos de Eperzan en la fertilidad en humanos. Los estudios en ratones mostraron ciclos estrogénicos reducidos a dosis de toxicidad materna, pero no indicaron efectos perjudiciales en términos de fertilidad (ver sección 5.3). Se desconoce el riesgo potencial para los humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Eperzan sobre la capacidad para conducir o utilizar máquinas es nula o insignificante. Cuando se usa Eperzan en combinación con secretagogos de insulina (como las sulfonilureas) o insulina, se debe advertir a los pacientes que tomen precauciones para evitar la hipoglucemia mientras conduzcan o utilicen máquinas (ver sección 4.4).
4.8 Reacciones adversas
Resumen del perfil de seguridad
Más de 2.300 pacientes han recibido Eperzan en 8 ensayos fase III controlados con placebo o con control activo.
El tratamiento de base en estos estudios incluía dieta y ejercicio, metformina, sulfonilurea, tiazolidindiona, insulina glargina o una combinación de medicamentos antidiabéticos.
La duración de los estudios abarcó desde 32 semanas hasta 3 años. Las categorías de frecuencia a continuación reflejan los datos combinados para las 2 dosis de Eperzan, 30 mg o 50 mg a la semana por vía subcutánea.
La reacción adversa más grave en los ensayos clínicos fue pancreatitis aguda (ver sección 4.4).
Las reacciones adversas más frecuentes durante los ensayos clínicos, que aparecieron en >5% de pacientes que recibieron Eperzan fueron diarrea, náuseas y reacciones en el lugar de la inyección incluyendo erupción, eritema o picor en el lugar de la inyección.
Tabla de reacciones adversas
La tabla recoge las reacciones adversas que tuvieron lugar con más frecuencia en pacientes tratados con Eperzan que en pacientes tratados con todos los comparadores. En la Tabla 1 se presentan las reacciones adversas notificadas en un análisis conjunto de siete ensayos fase III controlados con placebo o con control activo durante el periodo completo de tratamiento.
Las frecuencias se definen como: muy frecuentes >1/10; frecuentes >1/100 a <1/10; poco frecuentes >1/1.000 a <1/100; raras: >1/10.000 a <1/1.000; muy raras: <1/10.000 y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Dentro de cada grupo de frecuencias, las reacciones se presentan en orden decreciente de gravedad.
Tabla 1. Reacciones adversas de ensayos fase III durante los periodos de tratamiento completos
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema inmunológico |
Reacción de hipersensibilidad | |||
|
Infecciones e infestaciones |
Neumonía | |||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia (cuando Eperzan se utiliza en combinación con insulina o sulfonilurea) |
Hipoglucemia (cuando Eperzan se utiliza en monoterapia o en combinación con metformina o pioglitazona) | ||
|
Trastornos cardiacos |
Fibrilación auricular/flutter | |||
|
Trastornos gastrointestinales |
Diarrea, náuseas |
Vómitos, estreñimiento, dispepsia, reflujo gastroesofágico |
Pancreatitis, obstrucción intestinal | |
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de la inyección |
Descripción de las reacciones adversas seleccionadas:
Reacciones alérgicas
En los ensayos clínicos con albiglutida se han notificado posibles reacciones de hipersensibilidad (por ejemplo prurito, eritema), incluyendo un caso con prurito generalizado y erupción con disnea.
Pancreatitis
En los ensayos clínicos, la incidencia de pancreatitis (adjudicada como probablemente relacionada con el tratamiento) fue de 0,3% para Eperzan en comparación a un 0% con placebo y un 0,1% para los comparadores (ej. liraglutida, pioglitazona, glimepirida, sitagliptina e insulina glargina) con o sin tratamiento antidiabético adicional de base (ej. metformina).
Trastornos gastrointestinales
Los trastornos gastrointestinales tuvieron lugar con más frecuencia con Eperzan que con todos los comparadores (38% versus 32%). Los notificados con mayor frecuencia fueron diarrea (13% versus 9%), náuseas (12% versus 11%), vómitos (5% versus 4%) y estreñimiento (5% versus 4%), y la mayoría de los acontecimientos tuvieron lugar en los primeros 6 meses.
Los trastornos gastrointestinales con Eperzan tuvieron lugar con más frecuencia en pacientes con insuficiencia renal de moderada a grave (filtrado glomerular: eGFR 15 a 59 ml/min/1,73 m2) que en aquellos con insuficiencia renal leve o función renal normal.
Reacciones en el lugar de la inyección
Las reacciones en el lugar de la inyección (normalmente incluyen erupción, eritema o picor en el lugar de la inyección) ocurrieron en el 15% de pacientes tratados con Eperzan en comparación con el 7% con todos los comparadores y llevaron a la interrupción del tratamiento en el 2% de todos los pacientes tratados con Eperzan. Generalmente, las reacciones en el lugar de la inyección fueron de intensidad leve y no requirieron tratamiento.
Inmunogenicidad
El porcentaje de pacientes que desarrollaron anticuerpos frente a albiglutida durante el tratamiento fue de un 4% (128/2.934). Ninguno de estos anticuerpos neutralizó la actividad de albiglutida en un ensayo in vitro y la formación de anticuerpos fue generalmente transitoria y no estaba asociada a una reducción de la eficacia [(medida como HbA1c y glucosa plasmática en ayunas (GPA)].
Aunque en la mayoría de los pacientes con reacciones en el lugar de la inyección la prueba de anticuerpos fue negativa (~85%), se notificaron con más frecuencia reacciones en el lugar de la inyección en los pacientes con pruebas de anticuerpos positivas (41%, N = 116) que en pacientes con pruebas de anticuerpo negativas (14%, N = 1.927). Estos acontecimientos fueron predominantemente leves y no llevaron a la interrupción del tratamiento. Sin embargo, el patrón de acontecimientos adversos fue similar en general para los pacientes con pruebas de anticuerpos positivas y negativas.
Hipoglucemia
La hipoglucemia grave que requirió la asistencia de otra persona para su tratamiento fue poco frecuente: 0,3% entre los pacientes que recibieron Eperzan y 0,4% entre los pacientes que recibieron comparador. La mayoría de los pacientes con acontecimientos de hipoglucemia grave en los ensayos clínicos estaban recibiendo de forma concomitante sulfonilurea o insulina y en ningún caso requirió hospitalización o interrupción del tratamiento.
Cuando se utilizó Eperzan en monoterapia, la incidencia de hipoglucemia sintomática (<3,9 mmol/l) fue similar para Eperzan 30 mg (2%), Eperzan 50 mg (1%) y placebo (3%).
La tasa de hipoglucemia sintomática fue más alta para Eperzan cuando se utilizó en combinación con una sulfonilurea (15% a 22%) o con insulina (18%) en comparación con combinaciones que no incluían una sulfonilurea o insulina (1% a 4%). Entre los pacientes aleatorizados a otros comparadores, la incidencia de hipoglucemia sintomática fue del 7% al 33% cuando se utilizaron con una sulfonilurea o insulina y del 2% al 4% en combinaciones que no incluían estos medicamentos.
Neumonía
Se observó neumonía en un 2% de pacientes que recibieron Eperzan en comparación con un 0,8% de pacientes en el grupo de todos los comparadores. En el caso de Eperzan, se trató de episodios aislados de neumonía en pacientes que participaron en los estudios desde 32 semanas hasta 3 años de observación.
Fibrilación auricular/flutter
Apareció fibrilación auricular/flutter en un 1% de pacientes que recibieron Eperzan y un 0,5% de pacientes en el grupo de todos los comparadores. En ambos grupos, los pacientes con estos acontecimientos generalmente eran hombres, de edad avanzada o tenían insuficiencia renal.
Frecuencia cardiaca
En los ensayos fase III en pacientes con diabetes tipo 2, se observaron con albiglutida pequeños aumentos en la frecuencia cardiaca (1 a 2 lpm). En un estudio exhaustivo del QT en sujetos sanos, se observó un aumento en la frecuencia cardiaca (de 6 a 8 lpm) tras dosis repetidas con albiglutida 50 mg en comparación con los valores basales.
Abandonos
En ensayos clínicos de al menos 2 años de duración, el 8% de sujetos en el grupo de Eperzan interrumpió el tratamiento por un acontecimiento adverso en comparación con un 6% en el grupo de todos los comparadores. Los acontecimientos adversos que más frecuentemente llevaron a una interrupción de Eperzan fueron las reacciones en el lugar de la inyección y las reacciones gastrointestinales, cada una < 2%.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V
4.9 Sobredosis
Durante los ensayos clínicos de pacientes con diabetes tipo 2, la dosis de Eperzan más alta administrada fue de 100 mg por vía subcutánea cada cuatro semanas durante 12 semanas. Esta dosis se asoció con un aumento en la frecuencia de náuseas, vómitos y cefalea.
No hay antídoto específico para la sobredosis con Eperzan. En caso de sospecha de sobredosis, se debe instaurar el tratamiento clínico de apoyo adecuado, según el estado clínico del paciente. Los síntomas que se anticipan en caso de sobredosis pueden ser náuseas graves, vómitos o cefalea. Teniendo en cuenta la semivida de albiglutida (5 días) puede ser necesario un periodo prolongado de observación y tratamiento de estos síntomas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medicamentos utilizados en diabetes. Otros fármacos hipoglucemiantes, excluyendo insulinas. Código ATC: A10BX13
Mecanismo de acción
Albiglutida es un agonista del receptor de GLP-1 y aumenta la secreción de insulina glucosa-dependiente. Albiglutida también enlentece el vaciado gástrico.
Efectos farmacodinámicos
Control de la glucemia
Eperzan disminuye la glucosa en ayunas y reduce las variaciones de glucosa postprandial. La mayoría de la reducción observada en la glucosa plasmática en ayunas tiene lugar tras una dosis única, de forma consistente con el perfil farmacocinético de albiglutida.
En pacientes con diabetes tipo 2 que recibieron 2 dosis de 32 mg de albiglutida (días 1 y 8), se observó una reducción estadísticamente significativa (24%) en el AUC(0,5-4,5 h) de la glucemia postprandial en comparación con placebo tras un desayuno estándar el día 9.
Una dosis única de albiglutida 50 mg no afectó a la respuesta hormonal contrarreguladora a la hipoglucemia de glucagón, epinefrina, norepinefrina, cortisol u hormona del crecimiento.
Motilidad gástrica
Albiglutida mostró un enlentecimiento del vaciado gástrico en comparación con placebo para sólidos y líquidos cuando se administraron 100 mg como dosis única en sujetos sanos. Para sólidos, el t/2 de vaciado gástrico aumentó de 1,14 h a 2,23 h (p=0,0112). Para líquidos, el tJ/2 de vaciado gástrico aumentó de 0,28 h a 0,69 h (p=0,0018).
Eficacia clínica y seguridad
Un total de 2.365 pacientes con diabetes tipo 2 fueron tratados con Eperzan y 2.530 recibieron otros medicamentos comparadores en 8 ensayos clínicos fase III controlados con tratamiento activo y placebo. Los estudios evaluaron el uso de Eperzan 30 mg y 50 mg una vez a la semana, permitiendo un ajuste de dosis opcional de Eperzan de 30 mg a 50 mg una vez a la semana en 5 de los 8 estudios. En los 8 ensayos clínicos, incluyendo los sujetos de todos los grupos de tratamiento, un total de 19% de los pacientes (N = 937) fueron de 65 años de edad o más, y un 2% (N = 112) eran de 75 años de edad o más, un 52% eran hombres, con una media de Índice de Masa Corporal (IMC) de 33 kg/m2. Un 67% de los pacientes eran caucásicos, un 15% afroamericanos/de ascendencia africana, un 11% asiáticos; y un 26% de los pacientes eran hispanos/latinos.
No se observaron diferencias generales en la efectividad sobre la glucemia o peso corporal entre los subgrupos demográficos (edad, sexo, raza/etnia, duración de la diabetes).
Monoterapia
La eficacia de Eperzan fue evaluada en un estudio multicéntrico de 3 años, aleatorizado, doble ciego, controlado con placebo (n = 296) en pacientes inadecuadamente controlados con dieta y ejercicio. Se aleatorizó a los pacientes (1:1:1) a Eperzan 30 mg una vez a la semana, Eperzan 30 mg una vez a la semana con ajuste de dosis a 50 mg una vez a la semana en la semana 12, o placebo. La variable principal fue el cambio en HbAjc con respecto al valor basal a las 52 semanas. En comparación con placebo, el tratamiento semanal con Eperzan 30 mg y 50 mg subcutáneo (SC) produjo reducciones en HbAjc estadísticamente significativas con respecto al valor basal en la semana 52. El cambio en HbAic con respecto al valor basal a los 6 meses fue también estadísticamente significativo para las dosis semanales de Eperzan de 30 mg (0,9%) y 50 mg (1,1%) (ver Tabla 2).
Tabla 2. Resultados a 52 semanas en un estudio controlado con placebo con dos dosis de Eperzan (30 vs.
50 mg SC semanalmente) en monoterapia
|
Eperzan 30 mg semanales |
Eperzan 50 mg semanales |
Placebo | |
|
ITTa (N) |
N = 100 |
N = 97 |
N = 99 |
|
HbAjC (%) | |||
|
Valor basal (media) Cambio en la semana 52b Diferencia con respecto a placebob (IC del 95%) |
8,05 -0,70 -0,8 (-1,1; -0,6) c |
8,21 -0,9 -1,0 (-1,3; -0,8)c |
8,02 +0,2 |
|
Proporción de Pacientes (%) que alcanzó HbA1c <7% |
49 |
40 |
21 |
|
Peso corporal (kg) | |||
|
Valor basal (media) Cambio en la semana 52b Diferencia con respecto a placebob (IC del 95%) |
96 -0,4 0,3 (-0,9; 1,5) |
97 -0,9 -0,2 (-1,4; 1,0) |
96 -0,7 |
a Población por intención de tratar - última observación extrapolada b Media ajustada
c P<0,05 para diferencia de tratamiento
Tratamiento en combinación Adicional a metformina
La eficacia de Eperzan fue evaluada en un estudio multicéntrico, de 3 años, aleatorizado, doble ciego (n = 999). Con un tratamiento de base con metformina >1.500 mg al día, Eperzan 30 mg SC semanales (con ajuste de dosis opcional a 50 mg semanales tras un mínimo de 4 semanas) se comparó con 100 mg de sitagliptina al día, 2 mg de glimepirida al día (con ajuste de dosis opcional a 4 mg al día), o placebo. La variable principal fue el cambio de HbA1c con respecto al valor basal a 2 años en comparación con placebo. Los resultados a 104 semanas se presentan en la Tabla 3. Eperzan demostró disminuir la glucemia y fue estadísticamente superior en la reducción de HbAic con respecto al valor basal en comparación con placebo, sitagliptina o glimepirida (ver Tabla 3).
Tabla 3. Resultados a 104 semanas en un estudio controlado con placebo que comparaba el uso de Eperzan 30 mg SC semanales (con ajuste de dosis opcional a 50 mg semanales) con sitagliptina 100 mg día y glimepirida 2 a 4 mg día como terapia adicional en pacientes no controlados adecuadamente con metformina >1.500 mg al día
|
Sitagliptina |
Glimepirida | |||
|
Eperzan |
Placebo |
100 mg día |
2 a 4 mg día | |
|
30 mg/50 mg |
+ |
+ |
+ | |
|
semanales + |
Metformina |
Metformina |
Metformina | |
|
Metformina |
>1.500 mg |
>1.500 mg |
>1.500 mg | |
|
>1.500 mg día |
día |
día |
día | |
|
ITT a (N) |
297 |
100 |
300 |
302 |
|
HbAiC (%) | ||||
|
Valor basal (media) |
8,1 |
8,1 |
8,1 |
8,1 |
|
Cambio en la semana 104b |
-0,6 |
+0,3 |
-0,3 |
-0,4 |
|
Diferencia con placebo + metforminab, |
-0,9 (-1,2; -0,7)c | |||
|
(IC del 95%) Diferencia con sitagliptina + |
-0,4 (-0,5; -0,2)c | |||
|
metforminab, (IC del 95%) Diferencia con glimepirida + metforminab, (IC del 95%) |
-0,3 (-0,5; -0,1)c | |||
|
Proporción que alcanzó HbA1c <7% |
39 |
16 |
32 |
31 |
|
Peso corporal (kg) | ||||
|
Valor basal (media) |
90 |
92 |
90 |
92 |
|
Cambio en la semana 104 b |
-1,2 |
-1,0 |
-0,9 |
+1,2 |
|
Diferencia con placebo + metforminab, |
-0,2 (-1,1; 0,7) | |||
|
(IC del 95%) Diferencia con sitagliptina + |
-0,4 (-1,0; 0,3) | |||
|
metforminab (IC del 95%) Diferencia con glimepirida + metforminab (IC del 95%) |
-2,4 (-3,0; -1,7)c |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
Adicional a pioglitazona
La eficacia de Eperzan fue evaluada en un estudio de 3 años, aleatorizado, doble ciego, multicéntrico (n = 299). Eperzan 30 mg SC semanal se comparó con placebo en pacientes inadecuadamente controlados con pioglitazona >30 mg diarios (con o sin metformina >1.500 mg al día).
En comparación con placebo, el tratamiento con Eperzan dio lugar a reducciones estadísticamente significativas en HbA1c con respecto al valor basal (-0,8% para Eperzan versus -0,1% para placebo, p<0,05) y GPA (-1,3 mmol/l para Eperzan versus +0,4 mmol/l para placebo, p<0,05) a 52 semanas. El cambio en el peso con respecto al valor inicial no difirió significativamente entre ambos grupos de tratamiento (ver Tabla
Tabla 4. Resultados a 52 semanas en un estudio controlado con placebo que compara Eperzan 30 mg SC semanal como tratamiento adicional en pacientes controlados inadecuadamente con pioglitazona >30 mg diarios ± metformina >1.500 mg diarios.
|
Eperzan 30 mg semanal + Pioglitazona >30 mg día (+/- Metformina >1.500 mg día) |
Placebo + Pioglitazona >30 mg día (+/- Metformina >1.500 mg día) | |
|
ITTa (N) |
N = 150 |
N = 149 |
|
HbAjC (%) | ||
|
Valor basal (media) |
8,1 |
8,1 |
|
Cambio en la semana 52b |
-0,8 | |
|
Diferencia con placebo + pioglitazonab (IC |
-0,8 (-1,0; -0,6) c |
-0,05 |
|
del 95%) | ||
|
Proporción que alcanzó HbA1c <7% |
44 |
15 |
|
Peso corporal (kg) | ||
|
Valor basal (media) |
98 |
100 |
|
Cambio en la semana 52b |
0,3 |
+0,5 |
|
Diferencia con placebo + pioglitazonab (IC |
-0,2 (-1,2; 0,8) | |
|
del 95%) |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
Adicional a metformina y sulfonilurea
La eficacia de Eperzan fue evaluada en un estudio de 3 años, aleatorizado, doble ciego, multicéntrico (n = 657). Con un tratamiento de base con >1.500 mg de metformina al día más 4 mg de glimepirida diarios, se comparó Eperzan 30 mg SC semanales (con ajuste de dosis opcional a 50 mg semanales tras un mínimo de 4 semanas) con placebo o pioglitazona 30 mg diarios (con ajuste de dosis opcional a 45 mg/día). La variable principal fue el cambio de HbAJc con respecto al valor basal a las 52 semanas en comparación con placebo. A las 52 semanas, el tratamiento con Eperzan dio lugar a reducciones estadísticamente significativas en HbAJc con respecto al valor basal en comparación a placebo. El tratamiento con Eperzan no cumplió el margen de no inferioridad pre-especificado (0,3%) para HbAJc frente a pioglitazona. El cambio de peso con respecto al valor basal con Eperzan no fue significativamente distinto en comparación con placebo pero fue significativamente menor comparado con pioglitazona (ver Tabla 5).
Tabla 5. Resultados a 52 semanas en un estudio controlado con placebo que compara Eperzan 30 mg SC semanal (con ajuste de dosis opcional a 50 mg semanales) con pioglitazona 30 mg diarios (con ajuste de dosis opcional a 45 mg/día) como tratamiento adicional en pacientes controlados inadecuadamente con metformina + sulfonilurea (glimepirida 4 mg al día)
|
Eperzan 30 mg/50 mg semanal+ Metformina >1.500 mg diarios + Glimepirida 4 mg día |
Placebo + Metformina >1.500 mg diarios + Glimepirida 4 mg día |
Pioglitazona + Metformina >1.500 mg diarios + Glimepirida 4 mg día | |
|
ITTa (N) |
269 |
115 |
273 |
|
HbAjC (%) | |||
|
Valor basal (media) |
8,2 |
8,3 |
8,3 |
|
Cambio en la semana 52b |
-0,6 |
+0,33 |
-0,80 |
|
Diferencia con placebo + met + glimb |
-0,9 (-1,1; -0,7)c | ||
|
(IC del 95%) | |||
|
Diferencia con pioglitazona + met + |
0,3 (0,1; 0,4) | ||
|
glimb (IC del 95%) | |||
|
Proporción que alcanzó HbA1c <7% |
30 |
9 |
35 |
|
Peso corporal (kg) | |||
|
Valor basal(media) |
91 |
90 |
91 |
|
Cambio en la semana 52b |
-0,4 |
-0,4 |
+4,4 |
|
Diferencia de placebo + met + glimb |
-0,03 (-0,9; 0,8) | ||
|
(IC del 95%) | |||
|
Diferencia de pioglitazona + met + |
-4,9 (-5,5; -4,2)c | ||
|
glimb (IC del 95%) |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
Adicional a insulina glargina
La eficacia de Eperzan fue evaluada en un estudio de no inferioridad, abierto, multicéntrico, de 52 semanas, aleatorizado (n = 563). Con un tratamiento de base con insulina glargina (iniciado con 10 unidades y ajustando la dosis a > 20 unidades al día), se comparó Eperzan 30 mg SC una vez a la semana (con ajuste de dosis a 50 mg en caso de control inadecuado tras la semana 8) con insulina lispro prandial (administrada diariamente a la hora de las comidas, comenzando de acuerdo al estándar de tratamiento y ajustada según el efecto). La variable principal fue el cambio en HbAJc con respecto al valor basal a las 26 semanas. A la semana 26, la dosis diaria media de insulina glargina fue 53 UI para Eperzan y 51 UI para lispro. La dosis diaria media de insulina lispro a la semana 26 fue 31 UI, y a la semana 52, el 69% de pacientes tratados con Eperzan recibían 50 mg semanales. En la semana 26, la diferencia entre tratamientos en HbAJc fue de 0,2% y cumplió el margen de no inferioridad pre-especificado (0,4%) para Eperzan e insulina lispro. El tratamiento con Eperzan resultó en una pérdida media de peso (-0,7 kg) comparado con un aumento medio del peso con insulina lispro (+0,8 kg) y la diferencia entre ambos grupos de tratamiento fue estadísticamente significativa (ver Tabla 6).
Tabla 6. Resultados a 26 semanas en un estudio que compara Eperzan 30 mg SC semanal (con ajuste de dosis opcional a 50 mg semanales) con insulina lispro prandial como tratamiento adicional en pacientes controlados inadecuadamente con insulina glargina solo
|
Eperzan |
Insulina lispro | |
|
+ |
+ | |
|
Insulina glargina |
Insulina glargina | |
|
(> 20 unidades día) |
(> 20 unidades día) | |
|
ITT a (N) |
N = 282 |
N = 281 |
|
HbAiC (%) | ||
|
Valor basal (media) |
8,47 |
8,43 |
|
Cambio en la semana 26b |
-0,8 |
-0,6 |
|
Diferencia con insulina lisprob (IC del |
-0,2 (-0,3; 0,0) | |
|
95%) | ||
|
Valor P (no inferioridad) |
<0,0001 | |
|
Proporción que alcanzó HbA1c <7% |
30% |
25% |
|
Peso corporal (kg) | ||
|
Valor basal (media) |
93 |
92 |
|
Cambio en la semana 26b |
-0,7 |
+0,8 |
|
Diferencia con insulina lisprob (IC del |
-1,5 (-2,1; -1,0)c | |
|
95%) |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
En pacientes que completaron el estudio (52 semanas), el cambio medio ajustado en el valor basal de HbA1c fue -1,0% para Eperzan (N = 121) y -0,9% para insulina lispro (N = 141). El cambio medio ajustado en peso corporal con respecto al valor basal a las 52 semanas fue de -1,0 kg para Eperzan (N = 122) y +1,7 kg para insulina lispro (N = 141). Estos datos excluyen el uso de tratamientos antidiabéticos permitidos tras la evaluación de eficacia si se sobrepasaban los umbrales glucémicos.
Estudio con control activo versus insulina glargina como tratamiento adicional a metformina ±sulfonilurea La eficacia de Eperzan fue evaluada en un estudio de no inferioridad de 3 años, aleatorizado (2:1), abierto, controlado con insulina glargina (n = 735). Con un tratamiento de base con metformina >1.500 mg diarios (con o sin sulfonilurea), se comparó Eperzan 30 mg SC semanal (con ajuste de dosis opcional a 50 mg semanales) con insulina glargina (empezando con 10 unidades y titulando semanalmente según indicaciones de prescripción). La variable principal era el cambio en HbAJc desde el valor basal a las 52 semanas. La dosis total diaria de inicio de insulina glargina osciló entre 2 y 40 unidades (dosis diaria media de 10 unidades) y varió entre 3 y 230 unidades (dosis diaria media de 30 unidades) a la semana 52. La dosis diaria media de insulina glargina usada antes del rescate hiperglucémico fue de 10 unidades (de 2 a 40 unidades) al comienzo del estudio y 30 unidades (de 3 a 230 unidades) a la semana 52. En la semana 156, al 77% de los pacientes tratados con Eperzan se le ajustó la dosis a 50 mg SC semanales. La diferencia entre tratamientos en HbA1c desde la situación basal a las 52 semanas fue de 0,1% (-0,04; 0,27) y cumplió el margen de no inferioridad pre-especificado para Eperzan e insulina glargina (0,3%). Se observó una disminución estadísticamente significativa en el peso corporal con Eperzan en comparación con un aumento de peso corporal con insulina glargina y la diferencia en el cambio de peso fue estadísticamente significativa (ver Tabla 7).
Tabla 7. Resultados a 52 semanas en un estudio con control activo que compara Eperzan 30 mg SC semanales (con ajuste de dosis opcional a 50 mg semanales) con insulina glargina (ajustado semanalmente según indicaciones de prescripción) como terapia adicional en pacientes controlados inadecuadamente con metformina ± sulfonilurea
|
Eperzan 30 mg/50 mg semanal ± Metformina (con o sin sulfonilurea) |
Insulina glargina ± Metformina (con o sin sulfonilurea) | |
|
ITTa (N) |
496 |
239 |
|
HbAiC (%) | ||
|
Valor basal (media) |
8,28 |
8,36 |
|
Cambio en la semana 52b |
-0,7 |
-0,8 |
|
Diferencia con insulina glarginab (IC del 95%) |
0,1 (-0,04; 0,3) | |
|
Valor P (no inferioridad) |
<0,0086 | |
|
Proporción que alcanzó HbA1c <7% |
32 |
33 |
|
Peso corporal (kg) | ||
|
Valor basal (media) |
95 |
92 |
|
Cambio en la semana 52b |
-1,1 |
1,6 |
|
Diferencia con insulina glarginab (IC del 95%) |
-2,6 (-3,2; -2,0) c |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
En pacientes que recibieron tratamiento durante al menos 104 semanas, el cambio medio ajustado sobre el valor basal en HbA1c fue de -0,97% para Eperzan (N = 182) y -1,04% para insulina glargina (N = 102). El cambio medio ajustado en peso corporal desde el valor basal a las 104 semanas fue de -2,6 kg para Eperzan (N = 184) y de +1,4 kg para insulina glargina (N = 104). Estos datos excluyen el uso de tratamientos antidiabéticos permitidos tras evaluar la eficacia si se sobrepasaban los umbrales de glucemia.
Estudio con control activo versus liraglutida en combinación con metformina, tiazolidindiona o sulfonilurea (en monoterapia o tratamiento dual)
La eficacia de Eperzan fue evaluada en un estudio de no inferioridad de 32 semanas, aleatorizado, abierto, controlado con liraglutida (N = 805). Se comparó Eperzan 30 mg SC semanal (con ajuste de dosis a 50 mg semanales en la semana 6) con 1,8 mg de liraglutida al día (ajustado desde 0,6 mg en la semana 1 y 1,2 mg de la semana 1 a la semana 2) en pacientes inadecuadamente controlados con monoterapia o combinación de tratamiento antidiabético oral (metformina, tiazolidindiona o sulfonilureas). La variable principal fue el cambio en HbA1c con respecto al valor basal a las 32 semanas.
El tratamiento con Eperzan no cumplió el margen de no inferioridad pre-especificado (0,3%) frente a liraglutida para HbAJc (ver Tabla 8).
Tabla 8. Resultados de un ensayo con control activo de Eperzan 30 mg SC semanal (con ajuste de dosis a 50 mg semanales) versus liraglutida 1,8 mg diarios a las 32 semanas3
|
Eperzan 30 mg/50 mg semanal |
Liraglutida 1,8 mg día | |
|
Población por Intención de Tratar (N) |
402 |
403 |
|
HbAje (%) | ||
|
Valor basal (media) |
8,2 |
8,2 |
|
Cambio en la Semana 32b |
-0,8 |
-1,0 |
|
Diferencia con liraglutidab (IC del 95%) |
0,2 (0,1; 0,3) | |
|
Valor P (no inferioridad) |
p = 0,0846 | |
|
Proporción que alcanzó HbA1c <7% |
42% |
52% |
|
Peso corporal (kg) | ||
|
Valor basal (media) |
92 |
93 |
|
Cambio en la Semana 32b |
-0,6 |
-2,2 |
|
Diferencia con liraglutidab (IC del 95%) |
1,55 (1,05; 2,06) c |
a
b
c
Población por intención de tratar - última observación extrapolada Media ajustada
P<0,05 para diferencia de tratamiento
Estudio con control activo versus sitagliptina en _pacientes con diabetes tipo 2 y diferentes grados de insuficiencia renal
La eficacia de Eperzan fue evaluada en un ensayo aleatorizado, doble ciego, con control activo, de 52 semanas, en 486 pacientes con insuficiencia renal leve, moderada y grave, inadecuadamente controlados con dieta y ejercicio o tratamiento con otros antidiabéticos. Se comparó Eperzan 30 mg SC semanales (con ajuste de dosis a 50 mg semanales en caso necesario) con sitagliptina. Sitagliptina se dosificó de acuerdo al aclaramiento de creatinina estimado con la fórmula de Cockcroft-Gault (100 mg diarios en insuficiencia renal leve, 50 mg diarios en insuficiencia renal moderada y 25 mg diarios en insuficiencia renal grave). La variable principal fue el cambio en HbAic desde el valor basal a las 26 semanas.
El tratamiento con Eperzan dio lugar a reducciones estadísticamente significativas en HbA1c con respecto al valor basal a la Semana 26 en comparación con sitagliptina. La disminución media de HbAlc ajustada a modelo desde el valor basal con Eperzan fue de -0,80 (n = 125), -0,83 (n = 98), y -1,08 (n = 19) en pacientes con insuficiencia renal leve (filtrado glomerular (eGFR) 60 a 89 ml/min/1,73 m2), moderada (eGFR 30 a 59 ml/min/1,73 m2) y grave (eGFR <30 ml/min/1,73 m2), respectivamente (ver Tabla 9).
Tabla 9. Resultados a 26 semanas de un estudio de Eperzan 30 mg SC semanales (con ajuste de dosis a 50 mg a la semana en caso necesario) versus sitagliptina (dosificada de acuerdo a la función renal) en pacientes con diferentes grados de insuficiencia renal
|
Eperzan 30 mg/50 mg semanal |
Sitagliptina | |
|
Población por Intención de Tratar |
246 |
240 |
|
(N)a |
(125 leve, 98 moderada, |
(122 leve, 99 moderada, 15 |
|
19 grave)3 |
grave)a | |
|
HbAlc (%) | ||
|
Valor basal (media) |
8,1 |
8,2 |
|
Cambio en la semana 26b |
-0,8 |
-0,5 |
|
Diferencia con sitagliptinab (IC del |
-0,3 (-0,5; -0,2)c | |
|
95%) | ||
|
Pacientes que alcanzó HbA1c <7% |
43% |
31% |
|
Peso corporal (kg) | ||
|
Valor basal (media) |
84 |
83 |
|
Cambio en la Semana 26b |
-0,8 |
-0,19 |
|
Diferencia con sitagliptinab (IC del |
-0,6 (-1,1; -0,1)c | |
|
95%) |
a
b
c
Población por intención de tratar - última observación extrapolada (ITT-LOCF) Media ajustada
P<0,05 para diferencia de tratamiento
Durabilidad del control glucémico
La durabilidad del control glucémico para Eperzan como tratamiento adicional a metformina a lo largo del tiempo en relación a otras clases de medicamentos para el tratamiento de la diabetes tipo 2 y placebo se muestra en la Figura 1.
Figura 1: Curva Kaplan-Meier que muestra la durabilidad del control glucémico (medido como tiempo hasta el rescate) para Eperzan, en relación a dos controles activos (sitagliptina y glimepirida) y placebo
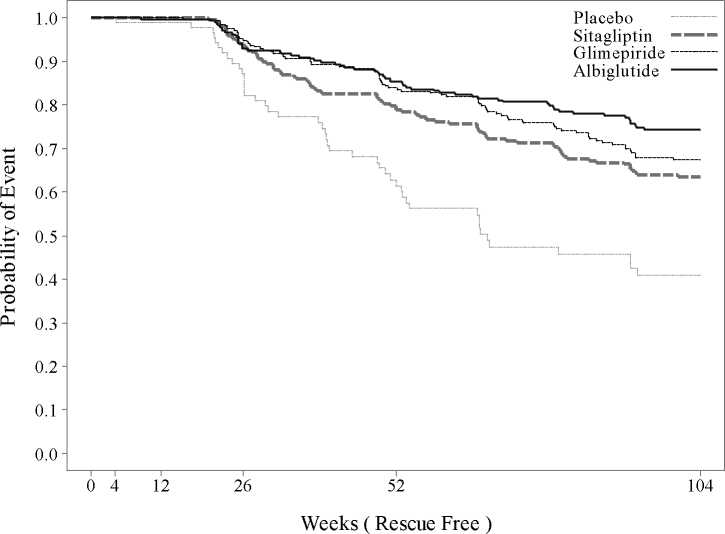
Eje x: Semanas (Libres de rescate); Eje y: Probabilidad del acontecimiento
Glucosa en plasma en ayunas
El tratamiento con Eperzan solo o en combinación con uno o dos medicamentos antidiabéticos orales dio lugar a una reducción de la glucosa plasmática en ayunas con respecto al valor basal en comparación con placebo de 1,3 a 2,4 mmol/l. La mayor reducción se observó durante las primeras dos semanas de tratamiento.
Evaluación Cardiovascular: se realizó un metaanálisis de 9 ensayos clínicos (los 8 estudios principales de eficacia y un estudio fase II de determinación de dosis) de hasta 3 años de duración para evaluar la seguridad cardiovascular de Eperzan (N=2.524) frente a todos los comparadores (N=2.583) dentro de estos ensayos. Una variable llamada MACE+ (acontecimientos cardiovasculares adversos serios plus: “major adverse cardiac events plus”) incluía hospitalización por angina inestable además de las variables de MACE (infarto agudo de miocardio, accidente cerebrovascular, y muerte CV). La razón de riesgo (hazard ratio) para Eperzan versus comparadores para MACE+ fue 1,0 (IC 95% 0,68; 1,49). Las tasas de incidencia observadas para el primer MACE+ fueron 1,2 y 1,1 acontecimientos por cada 100 personas año para Eperzan versus todos los comparadores, respectivamente.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Eperzan en uno o más grupos de la población pediátrica en el tratamiento de la diabetes mellitus tipo 2 (ver sección 4.2 para consultar información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración SC de una dosis única de 30 mg a pacientes con diabetes tipo 2, las concentraciones máximas se alcanzaron entre 3 y 5 días tras la dosis con un pico de concentración medio de albiglutida (Cmax) de 1,74 mcg/ml y un área bajo la curva tiempo-concentración media (AUC) de 465 mcg.h/ml. Las concentraciones medias semanales en estado estacionario tras la administración SC de 30 mg o 50 mg de albiglutida estimadas en los análisis farmacocinéticos poblacionales en los ensayos fase III en pacientes fueron aproximadamente 2,6 mcg/ml y 4,4 mcg/ml, respectivamente. Las exposiciones en estado estacionario se alcanzan tras 3-5 semanas de administración una vez a la semana. Las exposiciones a niveles de dosis de 30 mg y 50 mg fueron consistentes con un aumento proporcional a la dosis. Sin embargo, en voluntarios sanos tras administrar 50 mg la concentración en estado estacionario fue de 7,39 pg/ml en el día 36, por tanto mayor que lo que se predecía en los análisis farmacocinéticos poblacionales de los estudios fase III en pacientes. Se consigue una exposición similar con la administración SC de albiglutida en el abdomen, el muslo o la parte superior del brazo.
Distribución
La media estimada de volumen aparente de distribución de albiglutida tras la administración SC es de 11 litros. Como albiglutida es una molécula de fusión con albúmina, no se ha evaluado la unión a proteínas plasmáticas.
Biotransformación
Albiglutida es una proteína para la cual la vía metabólica esperada es la degradación a pequeños péptidos y aminoácidos por enzimas proteolíticos ubicuos.
Eliminación
El aclaramiento aparente medio de albiglutida es de 67 ml/h, con una semivida de eliminación de aproximadamente 5 días en base a estimaciones de los análisis farmacocinéticos poblacionales de los estudios fase III en pacientes y a valores medidos.
Poblaciones especiales
Pacientes con insuficiencia renal
En un análisis farmacocinético poblacional incluyendo un ensayo fase III en pacientes con insuficiencia renal leve, moderada y grave se incrementó la exposición aproximadamente de un 30 a un 40% en insuficiencia renal grave en comparación con la observada en pacientes diabéticos tipo 2 con función renal normal. Además, un estudio de farmacología clínica mostró un aumento en la exposición similar en pacientes con insuficiencia renal moderada o grave o aquellos en hemodiálisis en relación a los pacientes sin insuficiencia renal. Estas diferencias no se consideraron clínicamente relevantes (ver sección 4.2).
Pacientes con insuficiencia hepática
No se realizaron ensayos clínicos para examinar los efectos de la insuficiencia hepática en la farmacocinética de Eperzan. Las proteínas terapéuticas como albiglutida son catabolizadas por enzimas proteolíticas ampliamente distribuidas, que no están restringidas a tejido hepático; por tanto, es improbable que cambios en la función hepática tengan algún efecto en la eliminación de Eperzan (ver sección 4.2).
Sexo
Según los resultados de los análisis farmacocinéticos poblacionales, no hay efecto clínicamente relevante del sexo en el aclaramiento.
Raza y etnia
Según los resultados de los análisis farmacocinéticos poblacionales que incluían pacientes caucásicos, afroamericanos/africanos, asiáticos e hispanos/no hispanos, la raza y etnia no tuvo efecto clínicamente relevante en la farmacocinética del aclaramiento de Eperzan.
Los pacientes japoneses mostraron una exposición de aproximadamente un 30 a un 40% más alta que los caucásicos, probablemente atribuible a un menor peso corporal. Este efecto no se consideró clínicamente relevante.
Pacientes de edad avanzada (>65 años)
La edad no tuvo un efecto clínicamente relevante en la farmacocinética de albiglutida según un análisis farmacocinético poblacional de sujetos de 24 a 83 años (ver sección 4.2).
Peso corporal
Un peso corporal entre 44 y 158 kg no tiene un efecto clínicamente relevante en el AUC. Un aumento del 20% en el peso corporal resultó aproximadamente en un 18,5% de aumento en el aclaramiento.
Población pediátrica:
No hay datos farmacocinéticos disponibles en pacientes pediátricos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad o toxicidad a dosis repetidas. Dado que albiglutida es una proteína recombinante, no se han realizado estudios de genotoxicidad.
En un estudio de 52 semanas en monos, hubo un pequeño aumento en el peso de tejido pancreático a 50 mg/kg/semana (75 veces la exposición clínica basada en el AUC) asociada a hipertrofia de células acinares. También se observó un pequeño aumento en el número de células de los islotes. Los cambios en el páncreas no estaban asociados a anomalías histomorfológicas o evidencia de aumento de proliferación.
No se han realizado estudios de carcinogenicidad con albiglutida debido a la inmunogenicidad en roedores. Se observaron tumores tiroideos de células C en estudios de 2 años de carcinogenicidad en roedores con otros agonistas del receptor de GLP-1. Se han asociado niveles aumentados de calcitonina sérica con hiperplasia tiroidea de células C y tumores observados en estudios en roedores con estos otros agentes. Albiglutida también produjo aumentos dosis-dependientes en los niveles de calcitonina sérica en un estudio de 21 días en ratones, sugiriendo que los tumores tiroideos en ratones son teóricamente posibles con albiglutida también. No hubo hallazgos relacionados con albiglutida en el tiroides de monos a los que se administraron hasta 50 mg/kg/semana durante hasta 52 semanas (75 veces la exposición clínica basada en el AUC). Se desconoce la relevancia clínica de los tumores tiroideos de células C observados en roedores.
En los estudios de toxicidad para la reproducción con albiglutida en ratones, no hubo efectos sobre el apareamiento o fertilidad a dosis de hasta 50 mg/kg/día (a múltiplos bajos de la exposición clínica). Se observaron reducciones en los ciclos estrogénicos a 50 mg/kg/día, una dosis asociada con toxicidad materna (pérdida de peso corporal y disminución en el consumo de comida). Se observaron efectos en el desarrollo embriofetal (letalidad embriofetal y malformaciones esqueléticas) a 50 mg/kg/día (a múltiplos bajos de la exposición clínica). La descendencia de los ratones dosificados con 50 mg/kg/día durante la organogénesis presentó un peso reducido durante el periodo previo al destete (que se recuperó tras el destete), deshidratación y frío, y un retraso en la separación balanoprepucial. No se observaron efectos a 5 mg/kg/día (a exposiciones similares a la exposición clínica).
En los estudios de desarrollo pre- y postnatal en ratones a los que se administró albiglutida durante el embarazo o durante la crianza, se observó un peso corporal reducido previo al destete de la descendencia F1 a >1 mg/kg/día (a exposiciones similares a la exposición clínica). El peso corporal reducido en F1 revirtió tras el destete a excepción de las hembras F1 de las madres tratadas perinatalmente (fin de gestación a 10 días postparto) a >5 mg/kg/día sin otros efectos sobre el desarrollo. Se detectaron trazas de albiglutida en el plasma de las crías. Se desconoce si el peso corporal reducido de las crías estaba causado por un efecto directo de albiglutida en las crías o era secundario a los efectos en la madre.
Se observó un aumento en la mortalidad y morbilidad a todas las dosis (>1 mg/kg/día) en hembras lactantes en estudios de desarrollo pre- y postnatal en ratón. No se ha observado mortalidad en estudios de toxicidad previos en ratones hembra que no estuvieran en periodo de lactancia o embarazadas, ni tampoco en ratones hembra embarazadas. Estos hallazgos son consistentes con el síndrome de íleo en lactantes que se ha notificado anteriormente en ratones. Dado que el estrés relativo de la energía necesaria para la lactancia es menor en los humanos que en ratones, porque los humanos tienen amplias reservas de energía, la mortalidad observada en ratones lactantes no se considera relevante para los humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo para solución inyectable:
Dihidrógeno fosfato de sodio monohidrato Fosfato disódico anhidro Trehalosa dihidrato Manitol (E421)
Polisorbato 80 Disolvente:
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
Tras la reconstitución, la pluma debe utilizarse antes de las siguientes 8 horas. Usar la pluma inmediatamente después de insertar la aguja, de lo contrario el medicamento puede secarse dentro de la aguja y bloquearla.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar.
Los pacientes pueden conservar las plumas a temperatura ambiente, sin sobrepasar 30°C, no más de 4 semanas antes de su uso. Al final de este periodo las plumas deben ser utilizadas o desechadas.
Para el periodo de validez del producto reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
El cartucho de doble cámara está compuesto por un recipiente de vidrio Tipo 1 sellado con tapón de bromobutilo y un disco de cierre de goma de bromobutilo encajado en una tapa protectora de polipropileno. Cada cartucho se introduce en un inyector de plástico desechable de un solo uso (pluma).
Cada pluma contiene una dosis única de 30 mg o 50 mg de Eperzan en un volumen de 0,5 ml.
Tamaños de envases:
Estuche con 4 plumas de un solo uso y 4 agujas para las plumas.
Envase múltiple que contiene 12 plumas de un solo uso y 12 agujas para las plumas (3 estuches de 4 plumas y 4 agujas).
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Instrucciones de uso
No se debe utilizar Eperzan que haya sido congelado.
Comprobar que en la pluma el número ‘ 1’ está visible en el visor. No utilizar la pluma si no se muestra el número ‘1’.
Reconstitución y administración por parte del paciente
Las instrucciones completas para la reconstitución y administración para el paciente se proporcionan en la sección de Instrucciones de Uso del prospecto.
Advierta al paciente de que debe leer las Instrucciones de Uso completas, incluyendo las preguntas y respuestas, antes de empezar el tratamiento y consultarlas cada vez que vaya a inyectarse la dosis.
Método alternativo de reconstitución (sólo uso por profesionales sanitarios):
Las Instrucciones de Uso incluidas en el prospecto proporcionan información para el paciente acerca de que ha de esperar 15 minutos para la pluma de 30 mg y 30 minutos para la pluma de 50 mg tras haber mezclado el polvo liofilizado y el disolvente para asegurar la reconstitución. Los profesionales sanitarios pueden utilizar el siguiente método de reconstitución alternativo que permite una disolución más rápida. Dado que este método requiere de un mezclado adecuado e inspección visual de la disolución, está destinado únicamente a profesionales sanitarios.
Comprobar la fecha de caducidad que aparece en la pluma y que en el visor del número aparece un “1”. Seguir las instrucciones para girar el cartucho hasta que aparezca un ‘2’ en el visor del número y se oiga un “clic”. Esto mezcla el diluyente en la cámara trasera del cartucho con el polvo liofilizado en la cámara frontal. Con el cartucho transparente hacia arriba, agitar suavemente la pluma durante un minuto. Evitar agitar fuertemente ya que podría producir espuma. Inspeccionar y continuar agitando la pluma hasta que se disuelva el polvo. La disolución completa para la pluma de 30 mg normalmente tiene lugar al cabo de 2 minutos pero puede tardar hasta 5 minutos, confirmar mediante inspección visual para asegurar que es una solución transparente libre de partículas. La disolución completa para la pluma de 50 mg normalmente tiene lugar al cabo de 7 minutos pero puede tardar hasta 10 minutos. Es normal que tras la reconstitución haya una pequeña cantidad de espuma en la parte superior de la disolución. Tras la reconstitución, continuar siguiendo los pasos de las Instrucciones de Uso para insertar la aguja, cebar el inyector de la pluma y administrar la inyección.
Eperzan sólo se debe usar si es una solución transparente amarilla y no contiene partículas.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited,
Currabinny,
Carrigaline,
County Cork,
Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/001
EU/1/13/908/002
EU/1/13/908/003
EU/1/13/908/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 marzo 2014.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
GlaxoSmithKline LLC Building 40 893 River Road Conshohocken, PA 19428 EEUU.
Nombre y dirección del fabricante responsable de la liberación de los lotes
Glaxo Operations UK Limited (operando como Glaxo Wellcome Operations)
Harmire Road Barnard Castle Durham, DL12 8DT Reino Unido
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
ESTUCHE - 4 plumas_
1. NOMBRE DEL MEDICAMENTO
Eperzan 30 mg polvo y disolvente para solución inyectable. albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 30 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
4 plumas
4 agujas para las plumas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto.
Tras la mezcla, esperar 15 minutos antes de la inyección
8. FECHA DE CADUCIDAD
Conservar en nevera (2°C a 8°C).
No congelar.
Las plumas se pueden almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 30
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ESTUCHE - Envase múltiple que contiene 12 plumas de un solo uso y 12 agujas para las plumas (3 estuches de 4 plumas y 4 agujas) - sin blue box
1. NOMBRE DEL MEDICAMENTO
Eperzan 30 mg polvo y disolvente para solución inyectable. albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 30 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
Componente de un envase múltiple que contiene 3 envases, cada uno con 4 plumas y 4 agujas para las plumas.
No vender por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto
Tras la mezcla, esperar 15 minutos antes de la inyección
8. FECHA DE CADUCIDAD
Conservar en nevera (2°C a 8°C).
No congelar.
Un estuche individual de 4 plumas y 4 agujas se puede almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso. El resto de estuches se deben conservar entre 2°C y 8°C hasta su utilización.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 30
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
PC:
SN:
NN:
ETIQUETA VAGÓN - Envase múltiple que contiene 12 plumas de un solo uso y 12 agujas para las plumas (3 estuches de 4 plumas y 4 agujas) - con blue box
1. NOMBRE DEL MEDICAMENTO
Eperzan 30 mg polvo y disolvente para solución inyectable. albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 30 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
Envase múltiple: 12 plumas (3 envases de 4 plumas y 4 agujas) No vender por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto.
Tras la mezcla, esperar 15 minutos antes de la inyección
8. FECHA DE CADUCIDAD
Conservar en nevera (2°C a 8°C).
No congelar.
Un estuche individual de 4 plumas y 4 agujas se puede almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso. El resto de estuches se deben conservar entre 2°C y 8°C hasta su utilización.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 30
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR ESTUCHE - 4 plumas_
1. NOMBRE DEL MEDICAMENTO
Eperzan 50 mg polvo y disolvente para solución inyectable albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 50 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
4 plumas
4 agujas para las plumas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto.
Tiempo de reconstitución
Tras la mezcla, esperar 30 minutos antes de la inyección
8. FECHA DE CADUCIDAD
Conservar en nevera (2°C a 8°C).
No congelar.
Las plumas se pueden almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 50
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ESTUCHE - Envase múltiple que contiene 12 plumas de un solo uso y 12 agujas para las plumas (3 estuches de 4 plumas y 4 agujas) - sin blue box
1. NOMBRE DEL MEDICAMENTO
Eperzan 50 mg polvo y disolvente para solución inyectable albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 50 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
Componente de un envase múltiple que contiene 3 envases, cada uno con 4 plumas y 4 agujas para las plumas.
No vender por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto.
Tiempo de reconstitución
Tras la mezcla, esperar 30 minutos antes de la inyección
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera (2°C a 8°C).
No congelar.
Un estuche individual de 4 plumas y 4 agujas se puede almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso. El resto de estuches se deben conservar entre 2°C y 8°C hasta su utilización.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 50
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA VAGÓN - Envase múltiple que contiene 12 plumas y 12 agujas (3 estuches de 4 plumas y 4 agujas) - con blue box
1. NOMBRE DEL MEDICAMENTO
Eperzan 50 mg polvo y disolvente para solución inyectable albiglutida
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada dosis contiene 50 mg por cada 0,5 ml.
3. LISTA DE EXCIPIENTES
También contiene: dihidrógeno fosfato de sodio monohidrato, fosfato disódico anhidro, trehalosa dihidrato, manitol (E421), polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
Envase múltiple: 12 plumas (3 envases de 4 plumas y 4 agujas) No vender por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto. Vía subcutánea Una vez a la semana.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
Eliminar la pluma tras el uso.
Leer el prospecto.
Tiempo de reconstitución
Tras la mezcla, esperar 30 minutos antes de la inyección
8. FECHA DE CADUCIDAD
Conservar en nevera (2°C a 8°C).
No congelar.
Un estuche individual de 4 plumas y 4 agujas se puede almacenar a temperatura ambiente, sin sobrepasar 30°C, durante no más de un total de 4 semanas antes del uso. El resto de estuches se deben conservar entre 2°C y 8°C hasta su utilización.
Utilizar dentro de las 8 horas tras la reconstitución.
Utilizar inmediatamente después de insertar la aguja.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Trading Services Limited
Currabinny
Carrigaline
County Cork
Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/908/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
eperzan 50
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA DE LA PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Eperzan 30 mg polvo y disolvente para solución inyectable.
albiglutida
Vía subcutánea
Una vez a la semana
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 mg
6. OTROS
ETIQUETA DE LA PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Eperzan 50 mg polvo y disolvente para solución inyectable.
albiglutida
Vía subcutánea
Una vez a la semana
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
50 mg
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente Eperzan 30 mg polvo y disolvente para solución inyectable
Albiglutida
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Eperzan y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Eperzan
3. Cómo usar Eperzan
4. Posibles efectos adversos
5. Conservación de Eperzan
6. Contenido del envase e información adicional Instrucciones de uso de la pluma precargada (al dorso)
Preguntas y respuestas sobre las instrucciones de uso de la pluma precargada
Leer ambas caras de este prospecto
1. Qué es Eperzan y para qué se utiliza
Eperzan contiene el principio activo albiglutida que pertenece a un grupo de medicamentos llamados agonistas de los receptores de GLP-1 que se utilizan para disminuir los niveles de azúcar en sangre (glucosa) en adultos con diabetes tipo 2.
Usted tiene diabetes tipo 2:
• porque su cuerpo no produce suficiente insulina para controlar el nivel de azúcar en su sangre o
• porque su cuerpo no puede usar la insulina adecuadamente.
Eperzan ayuda a su cuerpo a aumentar la producción de insulina cuando su azúcar en sangre está elevado. Eperzan se utiliza para ayudar a controlar su azúcar en sangre, o bien:
- por sí solo, si su azúcar en sangre no se controla de forma adecuada solamente con la dieta y el ejercicio, y no puede tomar metformina (otro medicamento para la diabetes) o
- en combinación con otros medicamentos para la diabetes que se toman por vía oral (como metformina o medicamentos conocidos como sulfonilureas o tiazolidindionas) o con insulina.
Es muy importante que continúe siguiendo los consejos de su médico con respecto a dieta y estilo de vida mientras use Eperzan.
2. Qué necesita saber antes de empezar a usar Eperzan No use Eperzan:
• si es alérgico a albiglutida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Si piensa que esto le aplica a usted, no use Eperzan hasta que lo haya comprobado con su médico, enfermero o farmacéutico.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Eperzan:
• si tiene diabetes tipo 1 (insulino-dependiente) o cetoacidosis (una complicación muy grave de la diabetes que ocurre cuando su cuerpo no es capaz de degradar la glucosa porque no hay suficiente insulina), este medicamento no será adecuado para usted. Hable con su médico acerca de cómo reconocer los síntomas de cetoacidosis y busque ayuda médica urgentemente si esto ocurre
• si alguna vez ha tenido pancreatitis (inflamación del páncreas). Su médico decidirá si puede usar Eperzan y le explicará los síntomas de pancreatitis (ver sección 4)
• si está tomando una sulfonilurea o insulina para la diabetes, ya que puede aparecer una bajada de azúcar en sangre (hipoglucemia). Su médico puede tener que cambiar la dosis de estos medicamentos para reducir este riesgo. (Ver ‘Efectos adversos muy frecuentes’ en la sección 4 en cuanto a los signos de una bajada de azúcar en sangre)
• si usted tiene un problema grave con el vaciado de su estómago (gastroparesia) o si tiene una enfermedad gastrointestinal grave. Eperzan no está recomendado si presenta estos trastornos.
Compruebe con su médico, enfermero o farmacéutico antes de usar Eperzan si cree que cualquiera de los puntos anteriores le aplica a usted.
Niños y adolescentes
Se desconoce si Eperzan es seguro y eficaz en personas menores de 18 años de edad. Eperzan no está recomendado para niños y adolescentes.
Uso de Eperzan con otros medicamentos
Comente con su médico o farmacéutico si está tomando, ha tomado recientemente o puede tener que tomar otros medicamentos (ver también sección 2 “Advertencias y precauciones”).
No debe tomar acarbosa si sufre de obstrucción del intestino.
Consulte a su médico si está tomando acarbosa y utilizando Eperzan al mismo tiempo.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte con su médico, enfermero o farmacéutico antes de utilizar este medicamento. Si existe la posibilidad de que se pueda quedar embarazada, debe utilizar métodos anticonceptivos eficaces mientras utilice este medicamento.
Embarazo
Comunique a su médico, enfermero o farmacéutico inmediatamente si se queda embarazada durante el tratamiento con Eperzan.
No hay información sobre la seguridad de Eperzan en mujeres embarazadas. Eperzan no se debe usar mientras está embarazada.
Si tiene intención de quedarse embarazada, su médico podrá decidir interrumpir el tratamiento con Eperzan al menos un mes antes de que intente quedarse embarazada. Esto es porque Eperzan tarda un tiempo en eliminarse de su cuerpo.
Lactancia
Si está en periodo de lactancia, debe consultar a su médico antes de usar Eperzan. Se desconoce si Eperzan pasa a la leche materna. Usted y su médico decidirán si usar Eperzan u optar por la lactancia. No puede elegir ambas opciones.
Fertilidad
Tanto para hombres como para mujeres, se desconoce si Eperzan puede afectar a la fertilidad.
Conducción y uso de máquinas
La influencia de Eperzan sobre la capacidad para conducir o utilizar máquinas es nula o insignificante. Sin embargo, si usa Eperzan con sulfonilurea o insulina, puede tener una bajada de azúcar en sangre (hipoglucemia). Esto puede causarle problemas de concentración o bien producirle mareo o somnolencia. Si esto le ocurre, no conduzca ni utilice máquinas.
Contenido en sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por cada dosis de 0,5 ml, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar Eperzan
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, enfermero o farmacéutico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
La dosis recomendada es de 30 mg una vez a la semana, inyectada el mismo día cada semana. Su médico puede aumentar su dosis a 50 mg una vez a la semana si su azúcar en sangre no se controla con la dosis de 30 mg. Si es necesario, puede cambiar el día de la semana en el que usa Eperzan, siempre que sea al menos 4 días después de su última dosis.
Puede usar Eperzan a cualquier hora del día, con o sin alimentos.
Eperzan se presenta en una pluma inyectable que se puede inyectar usted mismo. Hable con su médico, enfermero o farmacéutico sobre cómo inyectarse Eperzan de forma correcta. Se inyectará Eperzan bajo la piel en la zona abdominal, en la parte superior de la pierna (muslo) o en la parte superior trasera del brazo. Puede inyectarse en la misma zona de su cuerpo cada semana, pero no inyecte exactamente en el mismo sitio todas las veces.
Eperzan no se debe inyectar en una vena (vía intravenosa) o en un músculo (vía intramuscular).
El inyector de la pluma contiene polvo y agua, que tendrá que mezclar antes de poder usarlo. Tras la sección 6 de este prospecto se encuentran las Instrucciones de Uso que dan unas pautas paso a paso sobre cómo mezclar el medicamento y cómo inyectarlo. Si tiene dudas o no entiende algo acerca de cómo usar la pluma, consulte a su médico, enfermero o farmacéutico.
Nunca mezcle insulina y Eperzan. Si necesita administrarse ambas al mismo tiempo, use dos inyecciones separadas. Se puede inyectar ambas en la misma zona del cuerpo (por ejemplo, en la zona abdominal) pero no debe ponerse las dos inyecciones muy juntas.
Si usa más Eperzan del que debe
Si usa demasiado Eperzan, consulte a un médico o farmacéutico. Si es posible, muéstrele el envase, o este prospecto. Puede tener náuseas graves, vómitos o dolor de cabeza.
Si olvidó usar Eperzan
Si olvida una dosis, inyecte la siguiente dosis tan pronto como sea posible dentro de los 3 días tras la dosis olvidada. Después de esto, puede volver a inyectar la siguiente dosis el día que lo haga habitualmente. Si han pasado más de 3 días desde que olvidó la dosis, espere hasta el día que tiene estipulado para la siguiente inyección. No inyecte una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Eperzan
Utilice Eperzan durante el tiempo que su médico le recomiende. Si deja de usar Eperzan, su nivel de azúcar en sangre se verá afectado. No interrumpa el tratamiento a no ser que su médico se lo aconseje.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Riesgo de pancreatitis aguda (páncreas inflamado)
Se ha comunicado pancreatitis como un efecto adverso poco frecuente. Puede afectar hasta 1 de cada 100 personas.
La pancreatitis puede ser grave y puede ser potencialmente mortal.
Si tiene:
• dolor de estómago (abdominal) muy intenso, que no se va, esto puede ser un síntoma de pancreatitis. El dolor puede tener lugar con o sin presencia de vómitos. Puede sentir que el dolor va desde la parte delantera (abdomen) hacia la espalda.
Deje de usar Eperzan y consulte a su médico inmediatamente
Otros efectos adversos comunicados con Eperzan
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas:
• bajo nivel de azúcar en sangre (hipoglucemia) cuando se usa Eperzan en combinación con insulina o sulfonilurea. Los signos que alertan de una bajada de azúcar en sangre pueden ser, sudor frío, piel pálida y fría, dolor de cabeza, sentirse somnoliento, debilidad, mareo, sentirse confundido o irritable, sentirse hambriento, latidos rápidos del corazón y nerviosismo. Su médico le dirá qué hacer si tiene una bajada de azúcar
• diarrea
• náuseas
• erupción, enrojecimiento o picor de la piel cuando se ha inyectado Eperzan Frecuentes: pueden afectar hasta 1 de cada 10 personas:
• infección en el pecho (neumonía)
• bajo nivel de azúcar en sangre (hipoglucemia) si usa Eperzan solo o en combinación con metformina o pioglitazona
• latidos irregulares del corazón
• vómitos
• estreñimiento
• indigestión
• ardor de estómago (reflujo gastroesofágico)
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas:
• obstrucción del intestino
Raras: pueden afectar hasta 1 de cada 1.000 personas:
• reacción alérgica (hipersensibilidad)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Eperzan
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la pluma y la caja después de ‘CAD’. La fecha de caducidad es el último día del mes que se indica.
Conservar las plumas y las agujas en el embalaje original hasta su utilización.
Conservar en nevera (entre 2°C y 8°C). No congelar. El medicamento se puede conservar a temperatura ambiente (a menos de 30°C) durante no más de un total de 4 semanas antes de uso. Después de este tiempo, las plumas se deben utilizar o desechar.
• Después de que el polvo y el líquido se mezclen en la pluma, la pluma se debe usar antes de las 8 horas siguientes.
• Usar la pluma inmediatamente después de haber puesto y preparado la aguja o la solución puede secarse en el interior de la aguja y bloquearla.
Utilizar cada pluma solamente una vez.
Tras haber utilizado la pluma, no quite la aguja. Deseche la pluma tal y como le hayan enseñado su médico, farmacéutico o enfermero.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Eperzan
- El principio activo es albiglutida.
Cada pluma de 30 mg contiene 30 mg de albiglutida en un volumen de 0,5 ml.
- El disolvente es agua para preparaciones inyectables.
- Los demás componentes son: dihidrógeno fosfato de sodio monohidrato y fosfato disódico anhidro (ver sección 2 bajo “Contenido en sodio”), trehalosa dihidrato, manitol, polisorbato 80.
Aspecto del producto y contenido del envase
Eperzan se suministra como una pluma para auto-inyección. Cada pluma contiene un polvo de blanco a amarillo y un disolvente incoloro en compartimentos separados. Se proporciona una aguja con cada pluma.
Las plumas se suministran en envases de 4 plumas y 4 agujas y envases múltiples que están compuestos por 3 envases que cada uno contiene 4 plumas y 4 agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
GlaxoSmithKline Trading Services Limited, Currabinny, Carrigaline, County Cork, Irlanda
Nombre y dirección del fabricante responsable de la liberación de lotes:
Glaxo Operations UK Limited (operando como Glaxo Wellcome Operations)
Harmire Road Barnard Castle Durham DL12 8DT Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 (0)10 85 52 00
Etnrapna
rnaKcoCMHTKaaHH EOOfl Ten.: + 359 2 953 10 34
Ceská republika
GlaxoSmithKline s.r.o.
Tel: + 420 222 001 111 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 info@glaxosmithkline.dk
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel.: + 49 (0)89 36044 8701 produkt.info@gsk.com
Eesti
GlaxoSmithKline Eesti OU Tel: + 372 6676 900 estonia@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Belgique/Belgien
Tél/Tel: + 32 (0)10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36 1 225 5300
Malta
GlaxoSmithKline Malta Tel: + 356 21 238131
Nederland
GlaxoSmithKline BV Tel: + 31 (0)30 6938100 nlinfo@gsk.com
Norge
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 at.info@gsk.com
|
ELXába GlaxoSmithKline A.E.B.E. Tpk: + 30 210 68 82 100 |
Polska GSK Services Sp. z.o.o. Tel.: + 48 (0)22 576 9000 |
|
España GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmacéuticos, Lda. Tel: + 351 21 412 95 00 FI.PT@gsk.com |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0)1 39 17 84 44 diam@gsk.com Hrvatska GlaxoSmithKline d.o.o. Tel:+385 1 6051 999 |
Romania GlaxoSmithKline (GSK) S.R.L. Tel: + 4021 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0)1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s. r. o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 9218 111 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kúrcpog GlaxoSmithKline (Cyprus) Ltd Tnk: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)31 67 09 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com Lietuva GlaxoSmithKline Lietuva UAB Tel: + 370 5 264 90 00 info.lt@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: + 44 (0)800 221441 customercontactuk@gsk.com |
|
Fecha de la última revisión de este prospecto: Otras fuentes de información |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
55
INSTRUCCIONES DE USO
Visor
Número 3: Las burbujas grandes de aire se eliminan, el botón de inyección sale y la pluma está lista para la inyección.
Número 2: El polvo del medicamento y el agua se mezclan. Esperar 15 minutos y entonces poner la aguja.
Número 1: La pluma está preparada para empezar. El polvo del medicamento y el agua están en compartimentos separados en el cartucho transparente.
Botón de inyección*
*El botón de inyección está dentro de la pluma hasta que la pluma está lista para su uso.
Cartucho
transparente
Cuerpo de la pluma
Pluma Eperzan 30 mg una vez a la semana
Leer todas las instrucciones incluyendo las Preguntas y Respuestas y seguir los pasos siguientes para mezclar el medicamento y preparar la pluma para la inyección.
Guarde estas instrucciones y úselas cada vez que prepare su medicamento.
Si no se siguen los pasos del A al C en el orden correcto la pluma puede dañarse.
Partes de la pluma
La pluma tiene el polvo del medicamento en un compartimento y el agua en otro compartimento. Necesitará mezclarlos girando la pluma.
¿b PRECAUCIÓN:
No permita que la pluma se congele. Descartarla si se congela.
Si se conserva en nevera, mantenerla a temperatura ambiente durante 15 minutos antes de empezar con el paso A.
No reutilice, vuelva a tapar o quite la aguja de la pluma. Deseche la pluma justo después de la inyección.
Antes de empezar: lávese las manos y después tome e inspeccione los materiales
> Lávese las manos.
> Coja una pluma y una nueva aguja de la caja y compruebe la etiqueta de la pluma para asegurarse de que se trata de la dosis de medicamento que le han recetado.
> Coja un vaso limpio vacío para mantener la pluma mientras se mezcla el medicamento, un reloj/temporizador para medir el tiempo mientras la medicación se mezcla y un contenedor para la eliminación de las plumas (estos objetos no están incluidos con el producto).
Aguja
Pluma desechable Eperzan 30 mg

Tapa externa de la aguja
Tapa interna de la aguja
Aguja
Protector
n

NO ponga la aguja hasta que se le indique en el paso B
Reloj/Temporizador

PASO A: Inspeccionar la pluma y mezclar el medicamento Inspeccionar la pluma
> Asegúrese de que tiene todas las partes enumeradas arriba (pluma, aguja, vaso, temporizados equipo de eliminación).
> Comprobar la fecha de caducidad en la pluma. No usar si ya ha pasado.
COMPROBAR LA FECHA DE CADUCIDAD
> Comprobar que la pluma tiene un [1] en el visor del número. NO usar si no se muestra el [1].
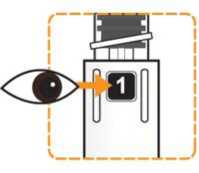
Girar la pluma para mezclar el medicamento
> Sujetar el cuerpo de la pluma con el cartucho transparente hacia arriba para que pueda ver el [1] en el visor del número.
> Con su otra mano, gire el cartucho transparente en la dirección de las flechas (en el sentido de las agujas del reloj) hasta que sienta/oiga que la pluma hace “clic” al llegar a su sitio y verá el [2] en el visor del número. Esto mezclará el polvo del medicamento y el líquido en el cartucho transparente.

> De forma lenta y suave balancee la pluma a un lado y a otro 5 veces para mezclar el medicamento (como un limpiaparabrisas). NO agitar fuerte la pluma para evitar la producción de espuma ya que esto podría afectar a su dosis.
A igitar fuerte la pluma.
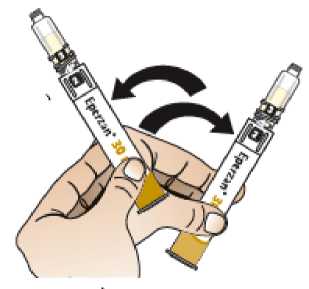
Esperar a que el medicamento se disuelva
> Coloque la pluma en el vaso limpio y vacío para mantener el cartucho transparente hacia arriba.
> Ajustar el reloj/temporizador a 15 minutos.
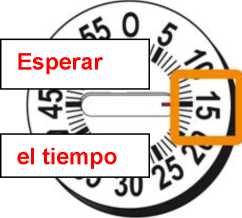

Debe esperar 15 minutos a que el medicamento se disuelva antes de continuar con el Paso B.
La pluma reconstituida se puede conservar un máximo de 8 horas antes de continuar con el Paso B. Una vez que se ajuste la aguja, la pluma se debe usar inmediatamente.
PASO B: Ajustar la aguja y preparar la pluma para la inyección
Tras esperar los 15 minutos, lávese las manos y termine con el resto de pasos inmediatamente.
Inspeccionar el medicamento disuelto
> De nuevo, de forma lenta y suave mueva la pluma a un lado y a otro 5 veces para volver a mezclar el medicamento (como un limpiaparabrisas). NO agitar fuerte la pluma para evitar la producción de espuma ya que esto podría afectar a su dosis.
REPETIR EL BALANCEO
& NO agitar la pluma fuerte.
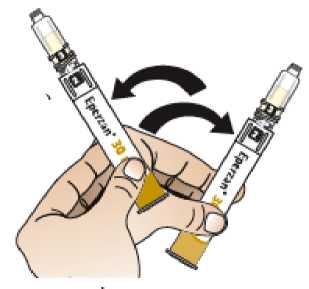
> Mire a través del visor de comprobación para asegurarse de que el líquido del cartucho es transparente y
libre de partículas sólidas.
COMPRUEBE QUE NO HAY PARTÍCULAS
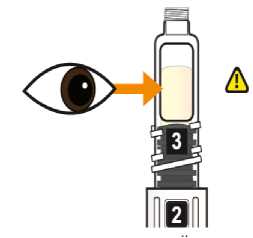
Si aún ve partículas en el líquido,
NO use la pluma.
> El líquido tendrá color amarillo y habrá grandes burbujas de aire encima del líquido. Ajuste la aguja
> Quite el protector de la tapa externa de la aguja.
> Sujete la pluma con el cartucho transparente hacia arriba.
> Empuje la aguja firmemente hacia el fondo en el cartucho transparente hasta que sienta/oiga un “dic”-Esto significa que la aguja se ha insertado.
EMPUJE HACIA ABAJO FIRMEMENTE
A NO doble la aguja o la inserte en ángulo.
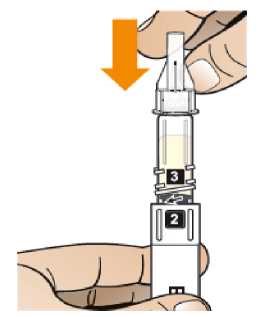
Golpear las burbujas de aire
> Con la aguja hacia arriba, golpee suavemente el cartucho transparente 2-3 veces para llevar las burbujas de aire hasta arriba.

Mantenga la pluma boca hacia arriba.
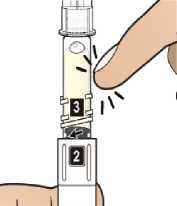
Es aceptable que haya burbujas pequeñas y no es necesario que asciendan.
Gire la pluma para purgar la aguja
> DESPUÉS de ajustar la aguja, mientras aparece el número [2] en el visor del número, de forma lenta gire el cartucho transparente varias veces en la dirección de las flechas (en el sentido de las agujas del reloj) hasta que sienta/oiga la pluma hacer “clic” y verá el [3] en el visor del número. Esto elimina las burbujas de aire grandes del cartucho transparente. El botón de inyección también saldrá de la parte trasera de la pluma.
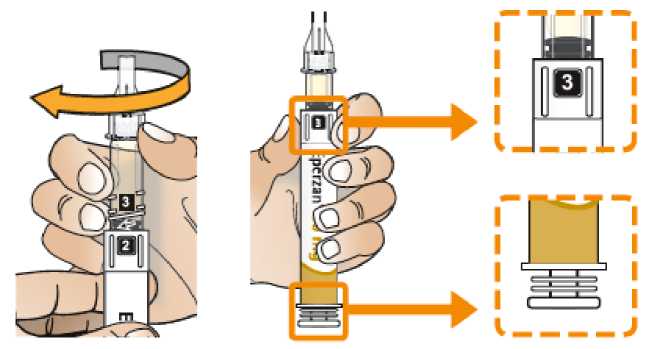
PASO C: Quitar ambas tapas de la aguja e inyectar el medicamento Quitar las tapas de la aguja
> Quitar cuidadosamente la tapa extema de la aguja y después la tapa intema. Pueden salir algunas gotas de líquido de la aguja. Esto es normal.
Paso 1: Quitar la tapa externa de la aguja
Paso 2: Quitar la tapa interna de la aguja
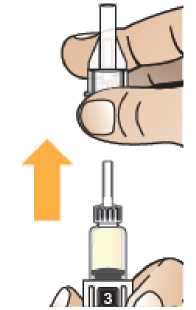
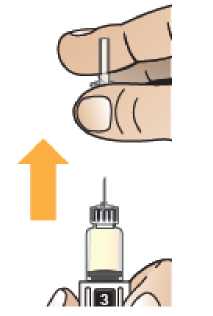
Inyectar el medicamento
>
Insertar la aguja bajo la piel de su abdomen, muslo o parte superior del brazo e inyectar como su
profesional sanitario le haya enseñado.
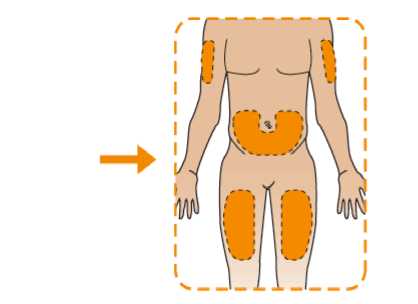
> Apretar el botón de inyección con el pulgar de forma lenta y continua para inyectar el medicamento. Cuanto más despacio apriete, más fácil será la inyección.
> Mantener el botón de inyección apretado hasta oír un “clic”. Siga manteniendo el pulgar en el botón y cuente lentamente hasta 5 para inyectar toda la dosis del medicamento.
Contar hasta 5 lentamente
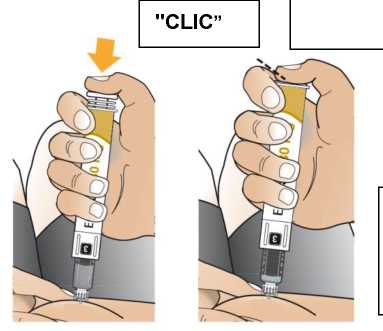
A Inyectar de forma lenta y mantenida. Tras oír el "clic" contar hasta 5 para liberar toda la dosis.
> Después de haber contado hasta 5, saque la aguja de la piel.
Eliminar la pluma
> No vuelva a tapar la aguja, ni la quite de la pluma.
> No tire la pluma usada a la basura. Deséchela como su médico o farmacéutico le hayan indicado.
Preguntas y respuestas
Visor del número
¿Son los números 1, 2 y 3 para seleccionar la dosis de medicamento?
> No, no tiene que seleccionar la dosis. Los números son para ayudar a preparar y administrar el medicamento.
Número 1 - La pluma está preparada para su uso. El polvo del medicamento y el agua están en compartimentos diferentes en el cartucho transparente.
Número 2 - El polvo del medicamento y el agua se mezclan y se balancean con suavidad. Esperar 15 minutos y ajustar la aguja.
Número 3 - Se eliminan las burbujas de aire grandes, el botón de inyección aparece y la pluma está preparada para la inyección.
¿Qué ocurre si no oigo el “CLIC” cuando aparecen el 2 o el 3 en el visor del número?
> Si no oye un “clic” cuando aparecen el número 2 o el número 3 en el visor del número, puede no tener el número completamente centrado en el visor. Gire ligeramente el cartucho en dirección de la flecha hasta completar el “clic” y centre el número en el visor.
Paso A - Inspeccionar la pluma y mezclar el medicamento
¿Qué pasa si no espero 15 minutos antes de pasar la pluma al número 2?
> Si no espera los 15 minutos completos puede que el polvo del medicamento no se haya mezclado adecuadamente con el agua. Esto puede hacer que haya partículas flotando en el cartucho transparente, que la dosis no sea eficaz y/o que se bloquee la aguja. Esperar los 15 minutos completos asegura que el polvo del medicamento y el agua se mezclan adecuadamente, aunque visualmente pueda parecer que están mezclados antes.
¿Qué pasa si dejo la pluma más de 15 minutos antes de pasar la pluma al número 2 en el paso A?
> Mientras no se haya puesto la aguja, la pluma se puede usar hasta 8 horas desde que empezó el paso A. Si han pasado más de 8 horas desde que se mezcló el medicamento en el paso A, descarte la pluma y use otra.
Paso B - Ajustar la aguja y preparar la pluma para la inyección
¿Qué pasa si dejo mi pluma con la aguja puesta en el paso B y dejo para más tarde el paso C?
> Esto puede hacer que la aguja se bloquee, debe pasar del paso B al paso C inmediatamente.
¿Qué pasa si no inserto la aguja en el paso B como se indica?
> No inserte la aguja en el paso A. Si la aguja se inserta en el paso A, se puede perder parte del medicamento durante la mezcla. Si inserta la aguja en el Paso A, descarte la pluma y use otra.
> Insertar la aguja cuando se muestra el número 2 en el visor del número, antes de girar el cartucho a la siguiente posición (número 3). Esto permite que el aire de dentro del cartucho salga a través de la aguja. o Si inserta la aguja después de que el número 3 se muestre en el visor del número puede que la pluma no libere la dosis completa o que se atasque. Descarte la pluma y use otra.
> La aguja debe empujarse hasta sentir u oír un “clic” en vez de girarse. Si la aguja se gira por accidente en lugar de ser insertada empujando y el número 2 está todavía en el visor del número, la pluma todavía puede usarse.
Paso C - Quitar ambas tapas de la aguja e inyectar el medicamento Aún quedan algunas pequeñas burbujas de aire. ¿Puedo usar la pluma?
> Sí, es normal ver burbujas pequeñas y recibirá la dosis correcta del medicamento. Estas burbujas de aire pequeñas no son perjudiciales.
Tras administrar el medicamento, aún se puede ver algo de líquido en el cartucho transparente.
> Esto es normal. Si ha oído/sentido el botón de inyección hacer “clic” y ha contado despacio hasta 5 antes de sacar la aguja de la piel, ha recibido la dosis de medicamento correcta.

30
mg
Por favor compruebe que está utilizando la dosis correcta.
Estas instrucciones son para:
Prospecto: información para el paciente Eperzan 50 mg polvo y disolvente para solución inyectable
Albiglutida
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Eperzan y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Eperzan
3. Cómo usar Eperzan
4. Posibles efectos adversos
5. Conservación de Eperzan
6. Contenido del envase e información adicional Instrucciones de uso de la pluma precargada (al dorso)
Preguntas y respuestas sobre las instrucciones de uso de la pluma precargada
Leer ambas caras de este prospecto
1. Qué es Eperzan y para qué se utiliza
Eperzan contiene el principio activo albiglutida que pertenece a un grupo de medicamentos llamados agonistas de los receptores de GLP-1 que se utilizan para disminuir los niveles de azúcar en sangre (glucosa) en adultos con diabetes tipo 2.
Usted tiene diabetes tipo 2:
• porque su cuerpo no produce suficiente insulina para controlar el nivel de azúcar en su sangre o
• porque su cuerpo no puede usar la insulina adecuadamente.
Eperzan ayuda a su cuerpo a aumentar la producción de insulina cuando su azúcar en sangre está elevado. Eperzan se utiliza para ayudar a controlar su azúcar en sangre, o bien:
- por sí solo, si su azúcar en sangre no se controla de forma adecuada solamente con la dieta y el ejercicio, y no puede tomar metformina (otro medicamento para la diabetes) o
- en combinación con otros medicamentos para la diabetes que se toman por vía oral (como metformina o medicamentos conocidos como sulfonilureas o tiazolidindionas) o con insulina.
Es muy importante que continúe siguiendo los consejos de su médico con respecto a dieta y estilo de vida mientras use Eperzan.
2. Qué necesita saber antes de empezar a usar Eperzan No use Eperzan:
• si es alérgico a albiglutida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Si piensa que esto le aplica a usted, no use Eperzan hasta que lo haya comprobado con su médico, enfermero o farmacéutico.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Eperzan:
• si tiene diabetes tipo 1 (insulino-dependiente) o cetoacidosis (una complicación muy grave de la diabetes que ocurre cuando su cuerpo no es capaz de degradar la glucosa porque no hay suficiente insulina), este medicamento no será adecuado para usted. Hable con su médico acerca de cómo reconocer los síntomas de cetoacidosis y busque ayuda médica urgentemente si esto ocurre
• si alguna vez ha tenido pancreatitis (inflamación del páncreas). Su médico decidirá si puede usar Eperzan y le explicará los síntomas de pancreatitis (ver sección 4)
• si está tomando una sulfonilurea o insulina para la diabetes, ya que puede aparecer una bajada de azúcar en sangre (hipoglucemia). Su médico puede tener que cambiar la dosis de estos medicamentos para reducir este riesgo. (Ver ‘Efectos adversos muy frecuentes’ en la sección 4 en cuanto a los signos de una bajada de azúcar en sangre)
• si usted tiene un problema grave con el vaciado de su estómago (gastroparesia) o si tiene una enfermedad gastrointestinal grave. Eperzan no está recomendado si presenta estos trastornos.
Compruebe con su médico, enfermero o farmacéutico antes de usar Eperzan si cree que cualquiera de los puntos anteriores le aplica a usted.
Niños y adolescentes
Se desconoce si Eperzan es seguro y eficaz en personas menores de 18 años de edad. Eperzan no está recomendado para niños y adolescentes.
Uso de Eperzan con otros medicamentos
Comente con su médico o farmacéutico si está tomando, ha tomado recientemente o puede tener que tomar otros medicamentos (ver también sección 2 “Advertencias y precauciones”).
No debe tomar acarbosa si sufre de obstrucción del intestino.
Consulte a su médico si está tomando acarbosa y utilizando Eperzan al mismo tiempo.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte con su médico, enfermero o farmacéutico antes de utilizar este medicamento. Si existe la posibilidad de que se pueda quedar embarazada, debe utilizar métodos anticonceptivos eficaces mientras utilice este medicamento.
Embarazo
Comunique a su médico, enfermero o farmacéutico inmediatamente si se queda embarazada durante el tratamiento con Eperzan.
No hay información sobre la seguridad de Eperzan en mujeres embarazadas. Eperzan no se debe usar mientras está embarazada.
Si tiene intención de quedarse embarazada, su médico podrá decidir interrumpir el tratamiento con Eperzan al menos un mes antes de que intente quedarse embarazada. Esto es porque Eperzan tarda un tiempo en eliminarse de su cuerpo.
Lactancia
Si está en periodo de lactancia, debe consultar a su médico antes de usar Eperzan. Se desconoce si Eperzan pasa a la leche materna. Usted y su médico decidirán si usar Eperzan u optar por la lactancia. No puede elegir ambas opciones.
Fertilidad
Tanto para hombres como para mujeres, se desconoce si Eperzan puede afectar a la fertilidad.
Conducción y uso de máquinas
La influencia de Eperzan sobre la capacidad para conducir o utilizar máquinas es nula o insignificante. Sin embargo, si usa Eperzan con sulfonilurea o insulina, puede tener una bajada de azúcar en sangre (hipoglucemia). Esto puede causarle problemas de concentración o bien producirle mareo o somnolencia. Si esto le ocurre, no conduzca ni utilice máquinas.
Contenido en sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por cada dosis de 0,5 ml, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar Eperzan
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, enfermero o farmacéutico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
La dosis recomendada es de 30 mg una vez a la semana, inyectada el mismo día cada semana. Su médico puede aumentar su dosis a 50 mg una vez a la semana si su azúcar en sangre no se controla con la dosis de 30 mg. Si es necesario, puede cambiar el día de la semana en el que usa Eperzan, siempre que sea al menos 4 días después de su última dosis.
Puede usar Eperzan a cualquier hora del día, con o sin alimentos.
Eperzan se presenta en una pluma inyectable que se puede inyectar usted mismo. Hable con su médico, enfermero o farmacéutico sobre cómo inyectarse Eperzan de forma correcta. Se inyectará Eperzan bajo la piel en la zona abdominal, en la parte superior de la pierna (muslo) o en la parte superior trasera del brazo. Puede inyectarse en la misma zona de su cuerpo cada semana, pero no inyecte exactamente en el mismo sitio todas las veces.
Eperzan no se debe inyectar en una vena (vía intravenosa) o en un músculo (vía intramuscular).
El inyector de la pluma contiene polvo y agua, que tendrá que mezclar antes de poder usarlo. Tras la sección 6 de este prospecto se encuentran las Instrucciones de Uso que dan unas pautas paso a paso sobre cómo mezclar el medicamento y cómo inyectarlo. Si tiene dudas o no entiende algo acerca de cómo usar la pluma, consulte a su médico, enfermero o farmacéutico.
Nunca mezcle insulina y Eperzan. Si necesita administrarse ambas al mismo tiempo, use dos inyecciones separadas. Se puede inyectar ambas en la misma zona del cuerpo (por ejemplo, en la zona abdominal) pero no debe ponerse las dos inyecciones muy juntas.
Si usa más Eperzan del que debe
Si usa demasiado Eperzan, consulte a un médico o farmacéutico. Si es posible, muéstrele el envase, o este prospecto. Puede tener náuseas graves, vómitos o dolor de cabeza.
Si olvidó usar Eperzan
Si olvida una dosis, inyecte la siguiente dosis tan pronto como sea posible dentro de los 3 días tras la dosis olvidada. Después de esto, puede volver a inyectar la siguiente dosis el día que lo haga habitualmente. Si han pasado más de 3 días desde que olvidó la dosis, espere hasta el día que tiene estipulado para la siguiente inyección. No inyecte una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Eperzan
Utilice Eperzan durante el tiempo que su médico le recomiende. Si deja de usar Eperzan, su nivel de azúcar en sangre se verá afectado. No interrumpa el tratamiento a no ser que su médico se lo aconseje.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Riesgo de pancreatitis aguda (páncreas inflamado)
Se ha comunicado pancreatitis como un efecto adverso poco frecuente. Puede afectar hasta 1 de cada 100 personas.
La pancreatitis puede ser grave y puede ser potencialmente mortal.
Si tiene:
• dolor de estómago (abdominal) muy intenso, que no se va, esto puede ser un síntoma de pancreatitis. El dolor puede tener lugar con o sin presencia de vómitos. Puede sentir que el dolor va desde la parte delantera (abdomen) hacia la espalda.
Deje de usar Eperzan y consulte a su médico inmediatamente
Otros efectos adversos comunicados con Eperzan
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas:
• bajo nivel de azúcar en sangre (hipoglucemia) cuando se usa Eperzan en combinación con insulina o sulfonilurea. Los signos que alertan de una bajada de azúcar en sangre pueden ser, sudor frío, piel pálida y fría, dolor de cabeza, sentirse somnoliento, debilidad, mareo, sentirse confundido o irritable, sentirse hambriento, latidos rápidos del corazón y nerviosismo. Su médico le dirá qué hacer si tiene una bajada de azúcar
• diarrea
• náuseas
• erupción, enrojecimiento o picor de la piel cuando se ha inyectado Eperzan Frecuentes: pueden afectar hasta 1 de cada 10 personas:
• infección en el pecho (neumonía)
• bajo nivel de azúcar en sangre (hipoglucemia) si usa Eperzan solo o en combinación con metformina o pioglitazona
• latidos irregulares del corazón
• vómitos
• estreñimiento
• indigestión
• ardor de estómago (reflujo gastroesofágico)
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas:
• obstrucción del intestino
Raras: pueden afectar hasta 1 de cada 1.000 personas:
• reacción alérgica (hipersensibilidad)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Eperzan
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la pluma y la caja después de ‘CAD’. La fecha de caducidad es el último día del mes que se indica.
Conservar las plumas y las agujas en el embalaje original hasta su utilización.
Conservar en nevera (entre 2°C y 8°C). No congelar. El medicamento se puede conservar a temperatura ambiente (a menos de 30°C) durante no más de un total de 4 semanas antes de uso. Después de este tiempo, las plumas se deben utilizar o desechar.
• Después de que el polvo y el líquido se mezclen en la pluma, la pluma se debe usar antes de las 8 horas siguientes.
• Usar la pluma inmediatamente después de haber puesto y preparado la aguja o la solución puede secarse en el interior de la aguja y bloquearla.
Utilizar cada pluma solamente una vez.
Tras haber utilizado la pluma, no quite la aguja. Deseche la pluma tal y como le hayan enseñado su médico, farmacéutico o enfermero.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Eperzan
- El principio activo es albiglutida.
Cada pluma de 50 mg contiene 50 mg de albiglutida en un volumen de 0,5 ml.
- El disolvente es agua para preparaciones inyectables.
- Los demás componentes son: dihidrógeno fosfato de sodio monohidrato y fosfato disódico anhidro (ver sección 2 bajo “Contenido en sodio”), trehalosa dihidrato, manitol, polisorbato 80.
Aspecto del producto y contenido del envase
Eperzan se suministra como una pluma para auto-inyección. Cada pluma contiene un polvo de blanco a amarillo y un disolvente incoloro en compartimentos separados. Se proporciona una aguja con cada pluma.
Las plumas se suministran en envases de 4 plumas y 4 agujas y envases múltiples que están compuestos por 3 envases que cada uno contiene 4 plumas y 4 agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
GlaxoSmithKline Trading Services Limited, Currabinny, Carrigaline, County Cork, Irlanda
Nombre y dirección del fabricante responsable de la liberación de lotes:
Glaxo Operations UK Limited (operando como Glaxo Wellcome Operations)
Harmire Road Barnard Castle Durham DL12 8DT Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 (0)10 85 52 00
Etarapna
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Ceská republika
GlaxoSmithKline s.r.o.
Tel: + 420 222 001 111 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 info@glaxosmithkline.dk
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v.
Belgique/Belgien
Tél/Tel: + 32 (0)10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36 1 225 5300
Malta
GlaxoSmithKline Malta Tel: + 356 21 238131
Nederland
GlaxoSmithKline BV Tel: + 31 (0)30 6938100 nlinfo@gsk.com
|
Deutschland GlaxoSmithKline GmbH & Co. KG Tel.: + 49 (0)89 36044 8701 produkt.info@gsk.com |
Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
Eesti GlaxoSmithKline Eesti OU Tel: + 372 6676 900 estonia@gsk.com |
Osterreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 at.info@gsk.com |
|
EkXába GlaxoSmithKline A.E.B.E. T@: + 30 210 68 82 100 |
Polska GSK Services Sp. z.o.o. Tel.: + 48 (0)22 576 9000 |
|
España GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmacéuticos, Lda. Tel: + 351 21 412 95 00 FI.PT@gsk.com |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0)1 39 17 84 44 diam@gsk.com Hrvatska GlaxoSmithKline d.o.o. Tel:+385 1 6051 999 |
Romania GlaxoSmithKline (GSK) S.R.L. Tel: + 4021 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0)1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s. r. o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com |
|
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 9218 111 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kúnpoq GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)31 67 09 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Tel: + 44 (0)800 221441 customercontactuk@gsk.com |
Lietuva
GlaxoSmithKline Lietuva UAB Tel: + 370 5 264 90 00 info.lt@gsk.com
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Pluma Eperzan 50 mg una vez a la semana
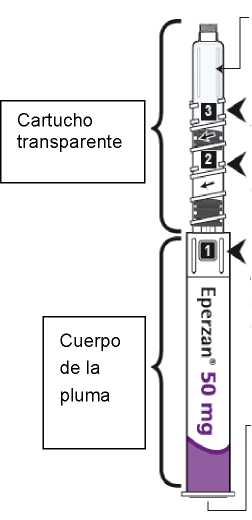
Visor
Número 3: Las burbujas grandes de aire se eliminan y el botón de inyección sale y la pluma está lista para la inyección.
Número 2: El polvo del medicamento y el agua se mezclan. Esperar 30 minutos y poner la aguja.
Número 1: La pluma está preparada para empezar. El polvo del medicamento y el agua están en
compartimentos separados en el cartucho transparente.
Botón de inyección*
*El botón de inyección está dentro de la pluma hasta que la pluma está lista para su uso.
Leer todas las instrucciones incluyendo las Preguntas y Respuestas y seguir los pasos siguientes para mezclar el medicamento y preparar la pluma para la inyección.
Guarde estas instrucciones y úselas cada vez que prepare su medicamento.
Si no se siguen los pasos del A al C en el orden correcto la pluma puede dañarse.
Partes de la pluma
La pluma tiene el polvo del medicamento en un compartimento y el agua en otro compartimento. Necesitará mezclarlos girando la pluma.
A PRECAUCIÓN:
No permita que la pluma se congele. Descartarla si se congela.
Si se conserva en nevera, mantenerla
a temperatura ambiente durante 15 No reutilice, vuelva a tapar o quite la minutos antes de empezar con el aguja de la pluma. Deseche la pluma paso A. justo después de la inyección.
Antes de empezar: lávese las manos y después tome e inspeccione los materiales
> Lávese las manos.
> Coja una pluma y una nueva aguja de la caja y compruebe la etiqueta de la pluma para asegurarse de que se trata de la dosis de medicamento que le han recetado.
> Coja un vaso limpio vacío para mantener la pluma mientras se mezcla el medicamento, un reloj/temporizador para medir el tiempo mientras la medicación se mezcla y un contenedor para la eliminación de las plumas (estos objetos no están incluidos con el producto).
Aguja Pluma desechable Eperzan 50 mg
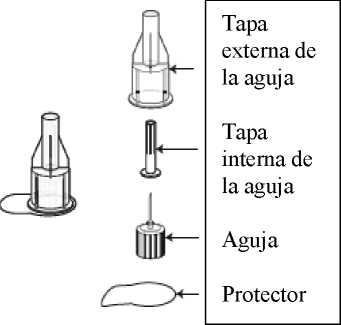
La pluma de EPERZAN 50 mg requiere 30 minutos para que el polvo del medicamento y el agua se mezclen en el Paso A. Esto es diferente de la pluma de EPERZAN 30 mg que puede que haya usado previamente.
PASO A: Inspeccionar la pluma y mezclar el medicamento Inspeccionar la pluma
> Asegúrese de que tiene todas las partes enumeradas arriba (pluma, aguja, vaso, temporizados equipo de eliminación).
> Comprobar la fecha de caducidad en la pluma. No usar si ya ha pasado.
COMPROBAR LA FECHA DE CADUCIDAD
--i
CAD
>
/i\ NO ponga la aguja hasta que se le indique en el Paso B
Vaso limpio, vacío Reloj/Temporizador

Comprobar que la pluma tiene un [1] en el visor del número. NO usar si no se muestra el [1].
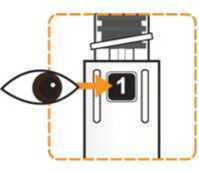
Girar la pluma para mezclar el medicamento
> Sujetar el cuerpo de la pluma con el cartucho transparente hacia arriba para que pueda ver el [1] en el visor del número.
> Con su otra mano, gire el cartucho transparente en la dirección de las flechas (en el sentido de las agujas del reloj) hasta que sienta/oiga que la pluma hace “clic” al llegar a su sitio y verá el [2] en el visor del número. Esto mezclará el polvo del medicamento y el líquido en el cartucho transparente.
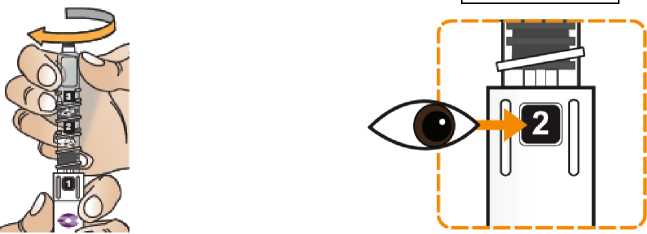
> De forma lenta y suave balancee la pluma a un lado y a otro 5 veces para mezclar el medicamento (como un limpiaparabrisas). NO agitar fuerte la pluma para evitar la producción de espuma ya que esto podría afectar a su dosis.
&
NO agitar fuerte la pluma.
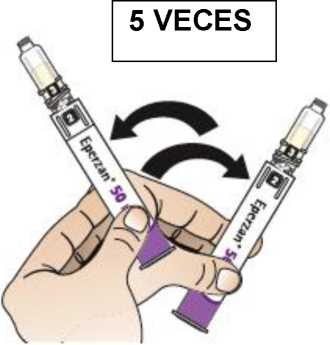
Esperar a que el medicamento se disuelva.
> Coloque la pluma en el vaso limpio y vacío, para mantener el cartucho transparente hacia arriba.
> Ajustar el reloj/temporizador a 30 minutos.
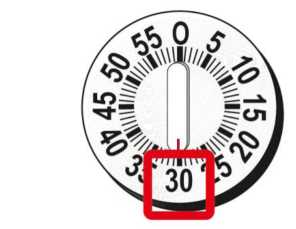

ESPERAR 30 MINUTOS
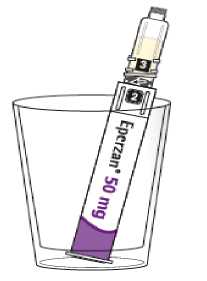
Debe esperar 30 minutos a que el medicamento se disuelva antes de continuar con el Paso B.
La pluma reconstituida se puede conservar un máximo de 8 horas antes de continuar con el Paso B. Una vez que se ajuste la aguja, la pluma se debe usar inmediatamente.
PASO B: Ajustar la aguja y preparar la pluma para la inyección
Tras esperar los 30 minutos, lávese las manos y termine con el resto de pasos inmediatamente.
Inspeccionar el medicamento disuelto
> De nuevo, de forma lenta y suave mueva la pluma a un lado y a otro 5 veces para volver a mezclar el medicamento (como un limpiaparabrisas). NO agitar fuerte la pluma para evitar la producción de espuma ya que esto podría afectar a su dosis.
REPETIR EL BALANCEO

NO agitar fuerte la pluma.
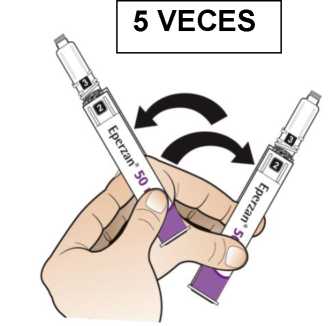
>
Mire a través del visor de comprobación para asegurarse de que el líquido del cartucho es
transparente y libre de partículas sólidas.
COMPRUEBE QUE NO HAY PARTÍCULAS
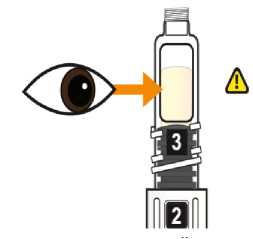
Si aún ve partículas en el líquido,
NO use la pluma.
> El líquido tendrá color amarillo y habrá grandes burbujas de aire encima del líquido. Ajuste la aguja
> Quite el protector de la tapa externa de la aguja.
> Sujete la pluma con el cartucho transparente hacia arriba.
> Empuje la aguja firmemente hacia el fondo en el cartucho transparente hasta que sienta/oiga un “clic”- Esto significa que la aguja se ha insertado.
A
EMPUJE HACIA ABAJO FIRMEMENTE
NO doble la aguja o la inserte en ángulo.
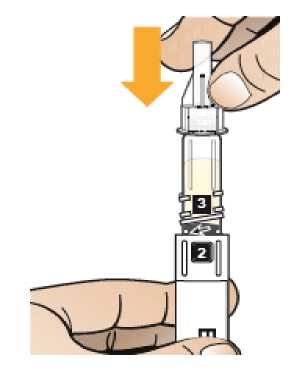
Golpear las burbujas de aire
> Con la aguja hacia arriba, golpee suavemente el cartucho transparente 2-3 veces para llevar las burbujas de aire hasta arriba.

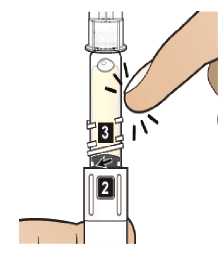
Es aceptable que haya burbujas pequeñas y no es necesario que asciendan.
Gire la pluma para purgar la aguja
> DESPUÉS de ajustar la aguja, mientras aparece el número [2] en el visor del número, de forma lenta gire el cartucho transparente varias veces en la dirección de las flechas (en el sentido de las agujas del reloj) hasta que sienta/oiga la pluma hacer “clic” y verá el [3] en el visor del número. Esto elimina las burbujas de aire grandes del cartucho transparente. El botón de inyección también saldrá de la parte trasera de la pluma.
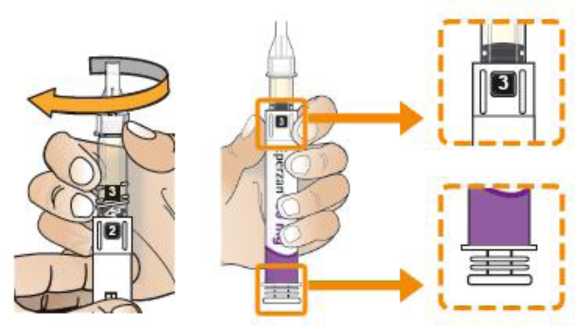
PASO C: Quitar ambas tapas de la aguja e inyectar el medicamento
Quitar las tapas de la aguja
> Quitar cuidadosamente la tapa extema de la aguja y después la tapa intema. Pueden salir algunas gotas de líquido de la aguja. Esto es normal.
Paso 1: Quitar la tapa externa de la aguja
Paso 2: Quitar la tapa interna de la aguja
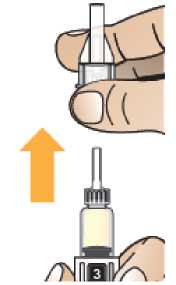
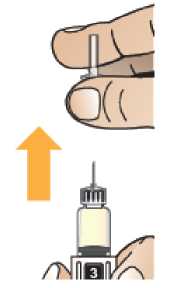
Inyectar el medicamento
>
Insertar la aguja bajo la piel de su abdomen, muslo o parte superior del brazo e inyectar como su profesional sanitario le haya enseñado.
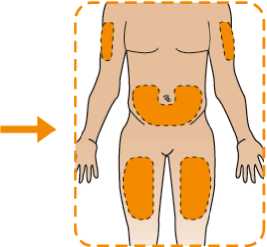
> Apretar el botón de inyección con el pulgar de forma lenta y continua para inyectar el medicamento. Cuanto más despacio apriete, más fácil será la inyección.
> Mantener el botón de inyección apretado hasta oír un “clic”. Siga manteniendo el pulgar en el botón y cuente lentamente hasta 5 para inyectar toda la dosis del medicamento.
Contar hasta 5 lentamente
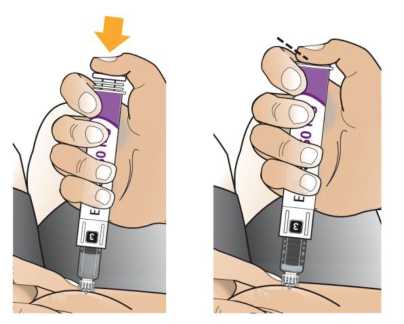
> Después de haber contado hasta 5, saque la aguja de la piel.
Eliminar la pluma
> No vuelva a tapar la aguja, ni la quite de la pluma.
> No tire la pluma usada a la basura. Deséchela como su médico o farmacéutico le hayan indicado.
Preguntas y respuestas Visor del número
¿Son los números 1, 2 y 3 para seleccionar la dosis de medicamento?
> No, no tiene que seleccionar la dosis. Los números son para ayudar a preparar y administrar el medicamento.
Número 1 - La pluma está preparada para su uso. El polvo del medicamento y el agua están en compartimentos diferentes en el cartucho transparente.
Número 2 - El polvo del medicamento y el agua se mezclan y se balancean con suavidad. Esperar 30 minutos y ajustar la aguja.
Número 3 - Se eliminan las burbujas de aire grandes, el botón de inyección aparece y la pluma está preparada para la inyección.
¿Qué ocurre si no oigo el “CLIC” cuando aparecen el 2 o el 3 en el visor del número?
> Si no oye un “clic” cuando aparecen el número 2 y el número 3 en el visor del número, puede no tener el número completamente centrado en el visor. Gire ligeramente el cartucho en dirección de la flecha hasta completar el “clic” y centre el número en el visor.
Paso A - Inspeccionar la pluma y mezclar el medicamento
¿Qué pasa si no espero 30 minutos antes de pasar la pluma al número 2?
> Si no espera los 30 minutos completos puede que el polvo del medicamento no se haya mezclado adecuadamente con el agua. Esto puede hacer que haya partículas flotando en el cartucho transparente, que la dosis no sea eficaz y/o que se bloquee la aguja. Esperar los 30 minutos completos asegura que el polvo del medicamento y el agua se mezclan adecuadamente, aunque visualmente pueda parecer que están mezclados antes.
¿Qué pasa si dejo la pluma más de 30 minutos antes de pasar la pluma al número 2 en el paso A?
> Mientras no se haya puesto la aguja, la pluma se puede usar hasta 8 horas desde que empezó el paso A. Si han pasado más de 8 horas desde que se mezcló el medicamento en el paso A, descarte la pluma y use otra.
Paso B - Ajustar la aguja y preparar la pluma para la inyección
¿Qué pasa si dejo mi pluma con la aguja puesta en el paso B y dejo para más tarde el paso C?
> Esto puede hacer que la aguja se bloquee, debe pasar del paso B al paso C inmediatamente.
¿Qué pasa si no inserto la aguja en el paso B como se indica?
> No inserte la aguja en el paso A. Si la aguja se inserta en el paso A, se puede perder parte del medicamento durante la mezcla. Si inserta la aguja en el Paso A, descarte la pluma y use otra.
> Insertar la aguja cuando se muestra el número 2 en el visor del número, antes de girar el cartucho a la siguiente posición (número 3). Esto permite que el aire de dentro del cartucho salga a través de la aguja.
o Si inserta la aguja después de que el número 3 se muestre en el visor del número puede que la pluma no libere la dosis completa o que se atasque. Descarte la pluma y use otra.
> La aguja debe empujarse hasta sentir u oir un “clic” en vez de girarse. Si la aguja se gira por accidente en lugar de ser insertada empujando y el número 2 está todavía en el visor del número, la pluma todavía puede usarse.
Paso C - Quitar ambas tapas de la aguja e inyectar el medicamento Aún quedan algunas pequeñas burbujas de aire. ¿Puedo usar la pluma?
> Sí, es normal ver burbujas pequeñas y recibirá la dosis correcta del medicamento. Estas burbujas de aire pequeñas no son perjudiciales.
Tras administrar el medicamento, aún se puede ver algo de líquido en el cartucho transparente.
> Esto es normal. Si ha oído/sentido el botón de inyección hacer “clic” y ha contado despacio hasta 5 antes de sacar la aguja de la piel, ha recibido la dosis de medicamento correcta.
Por favor compruebe que está utilizando la dosis correcta.
Estas instrucciones son para:
50 mg
81