Ebixa 10 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Ebixa 10 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Los comprimidos recubiertos con película tienen un color de amarillo pálido a amarillo, forma ovalada, con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
El comprimido se puededividir en dosis iguales.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes adultos con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer.
Posología
. El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina se deben reevaluar de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerabilidad del paciente al tratamiento se deben reevaluar de forma regular de acuerdo a las directrices clinicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapeutico sea favorable y el paciente tolere el tratamiento con memantina. La interrupción del tratamiento con memantina se debe considerar cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Escalado de dosis
La dosis máxima diaria es de 20 mg al día. Para reducir el riesgo de sufrir efectos adversos, la dosis de mantenimiento se alcanza incrementando la dosis 5 mg cada semana durante las primeras 3 semanas de la siguiente manera:
Semana 1 (día 1-7)
El paciente debe tomar la mitad de un comprimido recubierto con película de 10 mg (5mg) al día durante 7 días.
Semana 2 (día 8-14)
El paciente debe tomar un comprimido recubierto con película de 10 mg (10 mg) al día durante 7 días.
Semana 3 (día 15-21)
El paciente debe tomar un comprimido recubierto con película de 10 mg y medio (15 mg) al día durante 7 días.
A partir de la semana 4
El paciente debe tomar dos comprimidos recubiertos con película de 10 mg (20 mg) al día.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada
Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (dos comprimidos recubiertos con película de 10 mg administrados una vez al día), tal como se ha descrito anteriormente.
Insuficiencia renal
En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina 30 - 49 ml/min), la dosis diaria debe ser de 10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática
En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Ebixa a pacientes con insuficiencia hepática grave.
Población pediátrica No se dispone de datos.
Forma de administración
Ebixa se debe administrar por via oral una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película se pueden tomar con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente relacionadas con el sistema nervioso central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presentan estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes principio activo-principio activo entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de memantina en mujeres embarazadas. Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina reacciones adversas en fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Ebixa presenta una influencia de leve a moderada sobre la capacidad de para conducir y de utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen precauciones especiales.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Ebixa y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Ebixa no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general de leves a moderadas en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Ebixa respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4,1% frente a 2,8%).
Tabla de reacciones adversas
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Ebixa y la experiencia postcomercialización.
Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando el siguiente convenio: muy frecuentes (> 1/10), frecuentes (de >1/100 a < 1/10), poco frecuentes (de > 1/1.000 a < 1/100), raras (de >1/10.000 a < 1/1.000), muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
SISTEMA DE CLASIFICACIÓN DE ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes |
Somnolencia |
|
Poco frecuentes |
Confusión | |
|
Poco frecuentes |
Alucinaciones 1 | |
|
Frecuencia no conocida |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes |
Vértigo |
|
Frecuentes |
Alteración del equilibrio | |
|
Poco frecuentes |
Alteración de la marcha | |
|
Muy raras |
Convulsiones | |
|
Trastornos cardíacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes |
Hipertensión |
|
Poco frecuentes |
Trombosis | |
|
venosa/tromboembolismo | ||
|
Trastornos respiratorios, torácicos |
Frecuentes |
Disnea |
|
y mediastínicos | ||
|
Trastornos gastrointestinales |
Frecuentes |
Estreñimiento |
|
Poco frecuentes |
Vómitos | |
|
Frecuencia no conocida |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas |
|
Frecuencia no conocida |
Hepatitis | |
|
Trastornos generales y alteraciones en | ||
|
el lugar de administración |
Frecuentes |
Dolor de cabeza |
|
Poco frecuentes |
Fatiga | |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2 Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstas reacciones en pacientes tratados con Ebixa.
Notificación de sospechas de reacciones adversas:
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas:
Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento:
En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del sistema nervioso central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicoanalépticos. Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico, mas los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de valoración de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísiticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción:
Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución:
Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación:
En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación:
Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad:
Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica:
A una dosis de memantina de 20mg al día los niveles en LCR concuerdan con el valor ki (ki=constante de inhibición) de memantina, que es de 0,5pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Celulosa microcristalina Croscarmelosa sódica Sílice coloidal anhidra Estearato de magnesio
Recubrimiento del comprimido:
Hipromelosa Macrogol 400 Dióxido de titanio Oxido de hierro amarillo
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blisters: PVDC/PE/PVC/Al-blister o PP/Al-blister. Presentaciones de 14, 28, 30, 4250, 56, 70, 84, 98100, 112 comprimidos recubiertos con película.
Envase multiple conteniendo: 980 (10 envases de 98) y 1000 (20 envases de 50) comprimidos recubiertos con película.
Blisters monodosis perforados: PVDC/PE/PVC/Al-blister o PP/Al-blister. Presentaciones de 49 x 1, 56 x 1, 98 x 1 y 100 x 1 comprimidos recubiertos con película.a
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/001-003 EU/1/02/219/007-012 EU/1/02/219/014-021
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 mayo/2002 Fecha de la última renovación: 15 mayo2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/YYYY
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Ebixa 5 mg/pulsación, solución oral.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
Excipiente(s) con efecto conocido: Cada mililitro de solución contiene 100 mg de sorbitol E420 y 0,5 mg de potasio, ver sección 4.4.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución oral.
La solución es transparente y de incolora a ligeramente amarillenta.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes adultos con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer.
Posología
El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina se deben reevaluar de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerabilidad del paciente al tratamiento se deben reevaluar de forma regular de acuerdo a las directrices clinicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapeutico sea favorable y el paciente tolere el tratamiento con memantina. La interrupción del tratamiento con memantina se debe considerar cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos
Ajuste de la dosis
La dosis máxima diaria es de 20 mg una vez al día. Para reducir el riesgo de sufrir efectos indeseados, la dosis de mantenimiento se alcanza incrementando la dosis 5 mg cada semana durante las primeras 3 semanas de la siguiente manera:
Semana 1 (día 1-7)
El paciente debe tomar 0,5 ml de solución (5mg) equivalente a una pulsación al día durante 7 días.
Semana 2 (día 8-14)
El paciente debe tomar 1 ml de solución (10 mg) equivalente a dos pulsaciones al día durante 7 días.
Semana 3 (día 15-21)
El paciente debe tomar 1,5 ml de solución (15 mg) equivalente a tres pulsaciones al día durante 7 días.
A partir de la semana 4
El paciente debe tomar 2 ml de solución (20 mg) equivalente a cuatro pulsaciones al día administradas de una sola vez.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada
Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (2 ml de solución, equivalente a cuatro pulsaciones), tal como se ha descrito anteriormente.
Insuficiencia renal
En pacientes con función renal levemente afectada (aclaramiento de creatinina 50 - 80 ml/min.), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina 30 - 49 ml/min), la dosis diaria debe ser de 10 mg (1 ml de solución, equivalente a dos pulsaciones). Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg (1 ml de solución, equivalente a dos pulsaciones).
Insuficiencia hepática: En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Ebixa a pacientes con insuficiencia hepática grave.
Población pediátrica No se dispone de datos.
Forma de administración
Ebixa se debe administrar por vía oral una vez al día, a la misma hora cada día. La solución se puede tomar con o sin alimentos. La solución no se debe verter o administrar dentro de la boca directamente desde el frasco o el dosificador, se debe colocar en una cuchara o dentro de un vaso de agua usando el dosificador.
Para instrucciones detalladas sobre la preparación y el manejo del producto, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de otros antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente relacionadas con el Sistema Nervioso Central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presentan estas condiciones deben supervisarse cuidadosamente.
Excipientes: La solución oral contiene sorbitol.
Los pacientes con intolerancia hereditaria a la fructosa, no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otros principios activos, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes fármaco-fármaco entre memantina y gliburida/metformina o y donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de memantina en mujeres embarazadas. . Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina reacciones adversas en fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Ebixa presenta una influencia de leve a moderada en la capacidad de conducción y utilización de máquinas de forma que se debe advertir a los pacientes ambulatorios para que tomen precauciones especiales.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave en los que se incluyeron 1784 pacientes tratados con Ebixa y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Ebixa no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron por lo general de leves a moderadas en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Ebixa respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4,1% frente a 2,8%).
Tabla de reacciones adversas
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Ebixa y la experiencia postcomercialización.
Las reacciones adversas se categorizan conforme al sistema de clasificación por órganos, usando el siguiente convenio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
SISTEMA DE CLASIFICACIÓN DE ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes |
Somnolencia |
|
Poco frecuentes |
Confusión | |
|
Poco frecuentes |
Alucinaciones 1 | |
|
Frecuencia no conocida |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes |
Vértigo |
|
Frecuentes |
Alteración del equilibrio | |
|
Poco frecuentes |
Alteración de la marcha | |
|
Muy raras |
Convulsiones | |
|
Trastornos cardíacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes |
Hipertensión |
|
Poco frecuentes |
Trombosis | |
|
venosa/tromboembolismo | ||
|
Trastornos respiratorios, torácicos |
Frecuentes |
Disnea |
|
y mediastínicos | ||
|
Trastornos gastrointestinales |
Frecuentes |
Estreñimiento |
|
Poco frecuentes |
Vómitos | |
|
Frecuencia no conocida |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas |
|
Frecuencia no conocida |
Hepatitis | |
|
Trastornos generales y alteraciones en | ||
|
el lugar de administración |
Frecuentes |
Dolor de cabeza |
|
Poco frecuentes |
Fatiga | |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstas reacciones en pacientes tratados con Ebixa.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas
Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarrea).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento
En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos estándar clínicos para la extracción del principio activo de forma apropiada, por Ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del sistema nervioso central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicoanalépticos. Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico, mas los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de valoración de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísiticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción
Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáftx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución
Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación
En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación
Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad
Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica
A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki=constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina al igual que otros antagonistas del NMDA indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Sorbato potásico Sorbitol E420 Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 4 años.
Una vez abierto, el contenido del frasco debe ser utilizado en 3 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
El frasco con el dosificador montado debe guardarse y transportarse únicamente en posición vertical.
6.5 Naturaleza y contenido del envase
Frascos de vidrio de color ámbar (Hidrolítico de Clase III) que contienen 50 ml, 100 ml ó 10 x 50 ml de solución.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
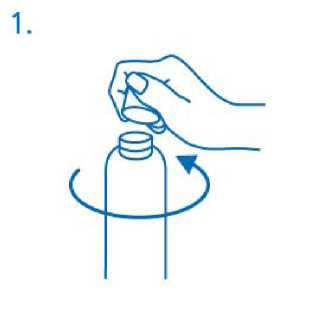
Antes del primer uso, el dosificador debe enroscarse en el frasco. Para sacar el tapón de rosca del frasco debe girarse en el sentido contrario a las agujas del reloj y desenroscarse completamente (fig.1).
Montaje del dosificador en el frasco:
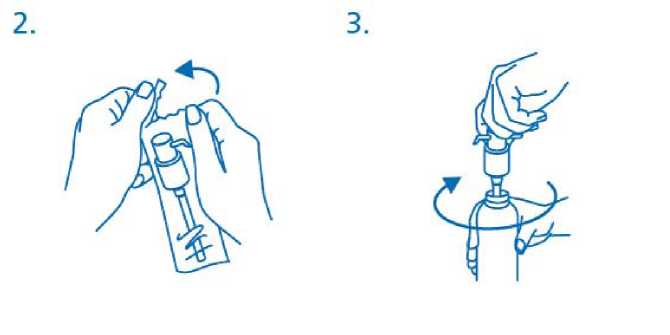
El dosificador debe sacarse de la bolsa de plástico (fig.2) y colocarse encima del frasco, introduciendo hacia abajo el tubo de plástico dentro del frasco con cuidado. El dosificador debe mantenerse en el cuello del frasco y girarse en el sentido de las agujas del reloj hasta que esté unido firmemente (fig.3). Para el uso deseado, el dosisficador sólo debe enroscarse una vez al iniciar el uso y nunca debe desenroscarse.
Uso del dosificador para dispensación:
El cabezal del dosificador tiene dos posiciones y se gira fácilmente - dirección contraria al sentido de las agujas del reloj (posición abierta) y dirección en el sentido de las agujas del reloj (posición cerrada). El cabezal del dosificador no debe pulsarse mientras esté en la posición cerrada. La solución debe dispensarse por tanto en la posición abierta. Para ello, el cabezal del dosisficador debe girarse un octavo de giro en la dirección que indica la flecha, hasta encontrar resistencia (fig.4).
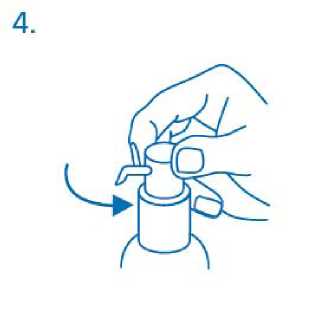
El dosificador está entonces listo para su uso.
Preparación del dosificador:
Cuando se utiliza por primera vez, el dosificador no dispensa la cantidad correcta de solución oral. Por tanto debe prepararse (cebarse) pulsando el cabezal del dosificador hacia abajo completamente durante cinco veces sucesivas (fig.5).
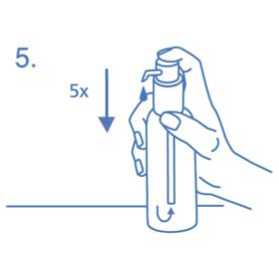
La solución así dispensada debe desecharse. La siguiente vez que el cabezal del dosificador se pulsa hacia abajo completamente (equivalente a una pulsación), ya dispensa la dosis correcta (1 pulsación es equivalente a 0,5 ml de solución oral y contiene 5mg del principio activo clorhidrato de memantina; fig.6).
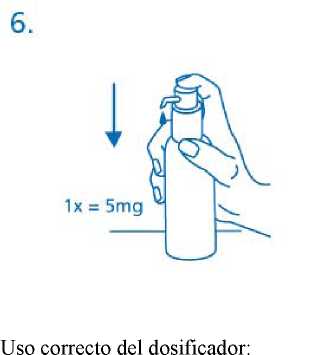
El frasco debe colocarse en una superficie plana, horizontal, por ejemplo encima de una mesa, y sólo debe usarse en posición vertical. Debe colocarse un vaso con un poco de agua o una cuchara debajo de la boquilla y el cabezal del dosificador debe pulsarse hacia abajo firmemente pero tranquilamente y de forma sostenida (no demasiado despacio) hasta el final (fig.7, fig.8).
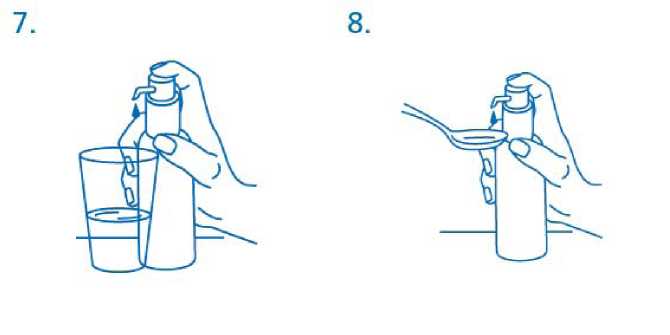
El cabezal puede entonces soltarse y está listo para la siguiente pulsación.
El dosificador debe usarse únicamente con solución de clorhidrato de memantina en el frasco proporcionado, no para otros productos o envases. Si el dosificador no funciona correctamente como se describe durante su uso y de acuerdo a las instrucciones, el paciente debería consultar a su médico o a un farmacéutico. El dosificador debe cerrarse después de su uso.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/005-006
EU/1/02/219/013
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 mayo 2002 Fecha de la última renovación: 15 mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/YYYY
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
NOMBRE DEL MEDICAMENTO
1.
Ebixa 5 mg comprimidos recubiertos con película. Ebixa 10 mg comprimidos recubiertos con película. Ebixa 15 mg comprimidos recubiertos con película. Ebixa 20 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 4,15 mg de memantina.
Cada comprimido recubierto con película contiene a 8,31 mg de memantina.
Cada comprimido recubierto con película contiene a 12,46 mg de memantina.
Cada comprimido recubierto con película contiene a 16,62 mg de memantina 5 mg de clorhidrato de memantina, que equivalen a 10 mg de clorhidrato de memantina, que equivalen 15 mg de clorhidrato de memantina, que equivalen 20 mg de clorhidrato de memantina, que equivalen
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos recubiertos con película.
Los comprimidos recubiertos con película de 5 mg tienen un color de blanco a blanquecino y son alargados y fusiformes con el número “5” impreso en una cara y “MEM” en la otra.
Los comprimidos recubiertos con película de 10 mg tienen un color de amarillo pálido a amarillo, forma ovalada, con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
El comprimido se puede dividir en dosis iguales.
Los comprimidos recubiertos con película de 15 mg tienen un color de naranja pálido a naranja grisáceo, son fusiformes y presentan el número “15” impreso en una cara y “MEM” en la otra.
Los comprimidos recubiertos con película de 20 mg tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes adultos con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer.
Posología
El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina se deben reevaluar de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerabilidad del paciente al tratamiento se deben reevaluar de forma regular de acuerdo a las directrices clinicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapeutico sea favorable y el paciente tolere el tratamiento con memantina. La interrupción del tratamiento con memantina se debe considerar cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos:
Ajuste de la dosis
La dosis recomendada de inicio es de 5 mg al día que se incrementa de forma gradual durante las primeras 4 semanas de tratamiento alcanzando la dosis recomendada de mantenimiento de la siguiente manera:
Semana 1 (día 1-7)
El paciente debe tomar un comprimido recubierto con película de 5 mg al día (de blanco a blanquecino, alargado y fusiforme) durante 7 días.
Semana 2 (día 8-14)
El paciente debe tomar un comprimido recubierto con película de 10 mg al día (de amarillo pálido a amarillo, forma ovalada) durante 7 días.
Semana 3 (día 15-21)
El paciente debe tomar un comprimido recubierto con película de 15 mg al día (de naranja pálido a naranja grisáceo, fusiformes) durante 7 días.
Semana 4 (día 22-28)
El paciente debe tomar un comprimido recubierto con película de 20 mg al día (de rojo pálido a rojo grisaceo, fusiforme) durante 7 días.
La dosis máxima diaria es de 20 mg
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada
Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día (20 mg una vez al día), tal como se ha descrito anteriormente.
Insuficiencia renal
En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30 - 49 ml/min), la dosis diaria debe ser de 10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática
En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Ebixa a pacientes con insuficiencia hepática grave.
Población pediátrica No se dispone de datos.
Forma de administración
Ebixa se debe administrar por vía oral una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película se pueden tomar con o sin alimentos.
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente las relacionadas con el sistema nervioso central [SNC] pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardíaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presenten estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otras susutancias activas, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes sustancia activa-sustancia activa entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de la memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de memantina en mujeres embarazadas..
Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina reacciones adversas en fertilidad ni en hombres ni en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Ebixa presenta una influencia de leve a moderada sobre la capacidad de conducción y de utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios para que tomen las precauciones adecuadas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Ebixa y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Ebixa no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderados en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Ebixa respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Tabla de reacciones adversas
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Ebixa y la experiencia postcomercialización.
Las reacciones adversas se categorizar conforme al sitema de clasificación de órganos usando el siguiente convenio: muy frecuentes (> 1/10), frecuentes (de >1/100 a < 1/10), poco frecuentes (de > 1/1.000 a < 1/100), raras (de >1/10.000 a < 1/1.000), muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
SISTEMA DE CLASIFICACIÓN DE ÓRGANOS |
FRECUENCIA |
REACCIONES ADVERSAS |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes |
Somnolencia |
|
Poco frecuentes |
Confusión | |
|
Poco frecuentes |
Alucinaciones 1 | |
|
Frecuencia no conocida |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes |
Vértigo |
|
Frecuentes |
Alteración del equilibrio | |
|
Poco frecuentes |
Alteración de la marcha | |
|
Muy raras |
Convulsiones | |
|
Trastornos cardíacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes |
Hipertensión |
|
Poco frecuentes |
Trombosis venosa/tromboembolismo | |
|
Trastornos respiratorios, torácicos |
Frecuentes |
Disnea |
|
y mediastínicos | ||
|
Trastornos gastrointestinales |
Frecuentes |
Estreñimiento |
|
Poco frecuentes |
Vómitos | |
|
Frecuencia no conocida |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas |
|
Frecuencia no conocida |
Hepatitis | |
|
Trastornos generales y alteraciones en | ||
|
el lugar de administración |
Frecuentes |
Dolor de cabeza |
|
Poco frecuentes |
Fatiga | |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstas reacciones en pacientes tratados con Ebixa.
Notificación de sospechas de reacciones adversas:
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas
Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea. o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de mamantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento
En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del Sistema Nervioso Central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicoanalépticos. Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico, más los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de valoración de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísiticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción
Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución
Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación
En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación
Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo, de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad:
Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica
A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina, al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo de los comprimidos recubiertos con película de 5/10/15/20 mg:
Celulosa microcristalina
Croscarmelosa sódica
Sílice coloidal anhidra
Estearato de magnesio
Cubierta de los comprimidos recubiertos con película de 5/10/15/20 mg:
Hipromelosa
Macrogol 400
Dióxido de titanio
Adicional en los comprimidos recubiertos con película de 10 mg Oxido de hierro amarillo
Adicional en los comprimidos recubiertos con película de 15/20 mg Óxido de hierro amarillo y rojo
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Cada envase contiene 28 comprimidos recubiertos con película en 4 blisters de PVDC/PE/PVC/Al o blisteres de PP/Al con 7 comprimidos recubiertos con película de 5mg, 7 comprimidos recubiertos con película de 10 mg, 7 comprimidos recubiertos con película de 15 mg y 7 comprimidos recubiertos con película de 20 mg.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/022
EU/1/02/219/036
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 mayo 2002 Fecha de la última renovación: 15 mayo /2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/YYYY
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Ebixa 20 mg comprimidos recubiertos con película.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Los comprimidos recubiertos con película tienen un color gris rojizo, una forma ovalada rectangular y la impresión del número “20” en una cara y “MEM” en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes adultos con enfermedad de Alzheimer de moderada a grave.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el diagnóstico y tratamiento de la demencia de Alzheimer.
Posología
El tratamiento se debe iniciar únicamente si se dispone de un cuidador que monitorice regularmente la toma del fármaco por parte del paciente. Se debe realizar el diagnóstico siguiendo las directrices actuales. La tolerabilidad y la dosis de memantina se deben reevaluar de forma regular, preferiblemente dentro de los 3 meses posteriores al inicio del tratamiento. Por lo tanto el beneficio clínico de memantina y la tolerabilidad del paciente al tratamiento se deben reevaluar de forma regular de acuerdo a las directrices clinicas vigentes. El tratamiento de mantenimiento puede continuarse mientras el beneficio terapeutico sea favorable y el paciente tolere el tratamiento con memantina. La interrupción del tratamiento con memantina se debe considerar cuando ya no se evidencie su efecto terapéutico o si el paciente no tolera el tratamiento.
Adultos
Ajuste de la dosis
La dosis máxima diaria es de 20 mg al día. Para reducir el riesgo de sufrir efectos indeseados, la dosis de mantenimiento se alcanza incrementando la dosis 5 mg cada semana durante las primeras 3 semanas de la siguiente manera. Para realizar este ajuste de dosis existen comprimidos con diferentes dosis
Semana 1 (día 1-7)
El paciente debe tomar un comprimido recubierto con película de 5mg al día durante 7 días.
Semana 2 (día 8-14)
El paciente debe tomar un comprimido recubierto con película de 10 mg al día durante 7 días.
Semana 3 (día 15-21)
El paciente debe tomar un comprimido recubierto con película de 15 mg al día durante 7 días.
A partir de la semana 4
El paciente debe tomar un comprimido recubierto con película de 20 mg al día.
Dosis de mantenimiento
La dosis recomendada de mantenimiento es de 20 mg al día.
Pacientes de edad avanzada
Basándose en estudios clínicos, la dosis recomendada para los pacientes mayores de 65 años es de 20 mg al día, tal como se ha descrito anteriormente.
Insuficiencia renal
En pacientes con función renal levemente afectada (aclaramiento de creatinina de 50 - 80 ml/min), no es necesario ajustar la dosis. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina de 30 - 49 ml/min), la dosis diaria debe ser de10 mg al día. Si se tolera bien después de, al menos 7 días de tratamiento, la dosis podría aumentarse hasta 20 mg/día de acuerdo con el esquema de titulación estándar. En pacientes con insuficiencia renal grave (aclaramiento de creatinina de 5-29 ml/min.) la dosis diaria debe ser de 10 mg al día.
Insuficiencia hepática
En pacientes con insuficiencia hepática leve o moderada (Child-Pugh A y Child-Pugh B) no es necesario ajustar la dosis. No existen datos disponibles sobre el uso de memantina en pacientes con insuficiencia hepática grave. No se recomienda la administración de Ebixa a pacientes con insuficiencia hepática grave.
Población pediátrica No se dispone de datos.
Forma de administración
Ebixa se debe administrar por vía oral una vez al día, siempre a la misma hora. Los comprimidos recubiertos con película se pueden tomar con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda precaución en el tratamiento de pacientes con epilepsia, antecedentes de crisis convulsivas o en pacientes con factores de riesgo para padecer epilepsia.
Se debe evitar la administración concomitante de antagonistas del N-metil-D-aspartato (NMDA) como la amantadina, la ketamina y el dextrometorfano. Estos compuestos actúan sobre el mismo sistema receptor que memantina y, por lo tanto, las reacciones adversas (principalmente las relacionadas con el sistema nervioso central [SNC]) pueden ser más frecuentes o más intensas (ver sección 4.5).
Todos aquellos factores que aumenten el pH urinario (ver sección 5.2 “Eliminación”) pueden requerir una monitorización rigurosa del paciente. Entre estos factores se incluyen cambios drásticos en la dieta, por ejemplo de carnívora a vegetariana, o una ingesta masiva de tampones gástricos alcalinizantes. Asimismo, el pH urinario puede estar elevado en estados de acidosis tubular renal (ATR) o infecciones graves del tracto urinario por bacterias del género Proteus.
En la mayoría de los ensayos clínicos, se excluyeron aquellos pacientes con antecedentes de infarto de miocardio reciente, enfermedad cardiaca congestiva (NYHA III-IV) o hipertensión no controlada. Como consecuencia, los datos en estos pacientes son limitados y los pacientes que presenten estas condiciones deben supervisarse cuidadosamente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Debido a los efectos farmacológicos y al mecanismo de acción de la memantina, pueden producirse las siguientes interacciones:
• El mecanismo de acción sugiere que los efectos de la L-dopa, los agonistas dopaminérgicos y los anticolinérgicos pueden aumentar con el tratamiento concomitante de antagonistas del NMDA como memantina. Se pueden reducir los efectos de los barbitúricos y de los neurolépticos. La administración concomitante de memantina y agentes antiespasmódicos, como el dantroleno o el baclofeno, puede modificar sus efectos y hacer necesario un ajuste de la dosis.
• Se debe evitar el uso concomitante de memantina y amantadina, por el riesgo de psicosis farmacotóxica. Los dos compuestos están químicamente relacionados con los antagonistas del NMDA. Esto mismo podría aplicarse para la ketamina y el dextrometorfano (ver sección 4.4). También hay un caso clínico publicado sobre el posible riesgo de la combinación de memantina y fenitoína.
• Otras sustancias activas, como cimetidina, ranitidina, procainamida, quinidina, quinina y nicotina, que utilizan el mismo sistema de transporte catiónico renal que la amantadina, posiblemente también interaccionen con la memantina lo que conlleva un riesgo potencial de aumento de los niveles plasmáticos.
• Cuando se co-administra memantina junto con hidroclorotiazida (HCT) o con cualquier combinación con HCT existe la posibilidad de que se produzca una disminución en los niveles séricos de la HCT.
• En la experiencia post-comercialización, se ha informado de casos aislados de incremento del cociente internacional normalizado (INR), en pacientes tratados concomitantemente con warfarina. Aunque no se ha establecido relación causal, es aconsejable realizar una monitorización estrecha del tiempo de protrombina o INR, en pacientes tratados concomitantemente con anticoagulantes orales.
En estudios farmacocinéticos (FC) a dosis únicas realizados en sujetos jóvenes sanos, no se han observado interacciones relevantes sustancia activa-sustancia activa entre memantina y gliburida/metformina o donepezilo.
En un ensayo clínico realizado en sujetos jóvenes sanos, no se han observado efectos relevantes de memantina sobre la farmacocinética de la galantamina.
Memantina no inhibió las isoformas CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, la flavina monooxigenasa, la epóxido hidrolasa o la sulfonación in vitro.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de memantina en mujeres embarazadas.
Estudios con animales indican un riesgo potencial de disminución del crecimiento intrauterino con niveles de exposición idénticos o ligeramente más altos que los niveles de exposición en humanos (ver sección 5.3). No se conoce el riesgo potencial para humanos. Memantina no debe utilizarse durante el embarazo excepto que sea considerado claramente necesario.
Lactancia
Se desconoce si memantina se excreta por la leche materna pero, teniendo en cuenta la lipofilia del principio activo, es probable que así sea. Las mujeres que tomen memantina deben suspender la lactancia materna.
Fertilidad
No se notificaron con memantina reacciones adversas en fertilidad ni en hombres ni en mujeres
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La enfermedad de Alzheimer de moderada a grave afecta normalmente la capacidad de conducción y compromete la capacidad para utilizar máquinas. Además, Ebixa presenta una influencia de leve a moderada sobre la capacidad de conducción y de utilizar máquinas, de forma que se debe advertir especialmente a los pacientes ambulatorios.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con demencia de leve a grave, en los que se incluyeron 1784 pacientes tratados con Ebixa y 1595 pacientes tratados con placebo, la incidencia global de reacciones adversas con Ebixa no difirió de la de aquellos tratados con placebo; las reacciones adversas fueron, por lo general, de leves a moderados en gravedad. Las reacciones adversas con mayor frecuencia de aparición que se observaron con una incidencia superior en el grupo de Ebixa respecto al grupo placebo fueron vértigo (6,3% frente a 5,6%, respectivamente), dolor de cabeza (5,2% frente a 3,9%), estreñimiento (4,6% frente a 2,6%), somnolencia (3,4% frente a 2,2%) e hipertensión (4.1% frente a 2.8%).
Tabla de reacciones adversas
Las reacciones adversas enumeradas en la siguiente tabla proceden de los ensayos clínicos realizados con Ebixa y la experiencia postcomercialización
Las reacciones adversas se categorizar conforme al sistema de clasificación por órganos usando el siguiente convenio: muy frecuentes (> 1/10), frecuentes (de >1/100 a < 1/10), poco frecuentes (de > 1/1000 a < 1/100), raras (de >1/10000 a < 1/1000), muy raras (< 1/10000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
SISTEMA DE CLASIFICACIÓN DE ÓRGANOS FRECUENCIA |
REACCIONES ADVERSAS | |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones fúngicas |
|
Trastornos del sistema inmunológico |
Frecuentes |
Hipersensibilidad al medicamento |
|
Trastornos psiquiátricos |
Frecuentes |
Somnolencia |
|
Poco frecuentes |
Confusión | |
|
Poco frecuentes |
Alucinaciones 1 | |
|
Frecuencia no conocida |
Reacciones psicóticas2 | |
|
Trastornos del sistema nervioso |
Frecuentes |
Vértigo |
|
Frecuentes |
Alteración del equilibrio | |
|
Poco frecuentes |
Alteración de la marcha | |
|
Muy raras |
Convulsiones | |
|
Trastornos cardíacos |
Poco frecuentes |
Insuficiencia cardíaca |
|
Trastornos vasculares |
Frecuentes |
Hipertensión |
|
Poco frecuentes |
Trombosis | |
|
.....venosa/tromboembolismo | ||
|
Trastornos respiratorios, torácicos |
Frecuentes |
Disnea |
|
y mediastínicos | ||
|
Trastornos gastrointestinales |
Frecuentes |
Estreñimiento |
|
Poco frecuentes |
Vómitos | |
|
Frecuencia no conocida |
Pancreatitis2 | |
|
Trastornos hepatobiliares |
Frecuentes |
Pruebas de función hepática elevadas |
|
Frecuencia no conocida |
Hepatitis | |
|
Trastornos generales y alteraciones en | ||
|
el lugar de administración |
Frecuentes |
Dolor de cabeza |
|
Poco frecuentes |
Fatiga | |
'Las alucinaciones se han observado principalmente en pacientes con enfermedad de Alzheimer grave. 2
Se han notificado casos aislados en la experiencia post-comercialización.
La enfermedad de Alzheimer ha sido asociada con depresión, ideación suicida y suicidio. En la experiencia post-comercialización, se ha notificado la aparición de éstas reacciones en pacientes tratados con Ebixa.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V
4.9 Sobredosis
Solo se dispone de experiencia limitada en casos de sobredosis de los ensayos clínicos y de la experiencia post-comercialización.
Síntomas
Sobredosis relativamente altas (200 mg y 105 mg/día durante 3 días respectivamente) se han asociado únicamente con síntomas como cansancio, debilidad y/o diarrea. o han sido asintomáticas. En casos de sobredosis por debajo de 140 mg o dosis no conocida aparecieron en los pacientes síntomas a nivel del sistema nervioso central (confusión, adormecimiento, somnolencia, vértigo, agitación, agresividad, alucinaciones y alteraciones de la marcha) y/o de origen gastrointestinal (vómitos y diarreas).
En el caso más extremo de sobredosis, el paciente sobrevivió a la ingesta oral de un total de 2000 mg de memantina con efectos a nivel del sistema nervioso central (coma durante 10 días, y posterior diplopía y agitación). El paciente recibió tratamiento sintomático y plasmaféresis, recuperándose sin secuelas permanentes.
En otro caso de sobredosis grave, el paciente también sobrevivió y se recuperó. Dicho paciente había recibido 400 mg de memantina por vía oral, y experimentó síntomas a nivel del sistema nervioso central tales como inquietud, psicosis, alucinaciones visuales, proconvulsividad, somnolencia, estupor e inconsciencia.
Tratamiento
En caso de sobredosis, el tratamiento debe ser sintomático. No existe antídoto específico para la intoxicación o sobredosis. Se deben utilizar procedimientos clínicos estándar para la eliminación del principio activo de forma apropiada, por ej.: lavado gástrico, carbón activado (interrupción de la recirculación enterohepática potencial), acidificación de la orina, diuresis forzada.
En caso de aparición de signos y síntomas de sobrestimulación general del Sistema Nervioso Central (SNC), se debe considerar llevar a cabo un tratamiento clínico sintomático cuidadoso.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicoanalépticos. Otros fármacos anti-demencia, código ATC: N06DX01.
Existe una evidencia cada vez más clara de que el mal funcionamiento de la neurotransmisión glutamatérgica, en particular en los receptores NMDA, contribuye tanto a la expresión de los síntomas como a la progresión de la enfermedad hacia demencia neurodegenerativa.
Memantina es un antagonista no competitivo de los receptores NMDA, de afinidad moderada y voltaje dependiente. Modula los efectos de los niveles tónicos de glutamato elevados patológicamente que pueden ocasionar disfunción neuronal.
Ensayos clínicos
Un ensayo pivotal de monoterapia en pacientes que padecían enfermedad de Alzheimer de moderada a grave (puntuación total en el miniexamen cognoscitivo (MMSE, mini mental state examination) al inicio del estudio 3 - 14) incluyó un total de 252 pacientes. El estudio mostró los efectos beneficiosos del tratamiento con memantina respecto al tratamiento con placebo después de 6 meses (análisis de casos observados para el estudio CIBIC-plus (siglas en inglés que corresponden a la escala de impresión de cambio basada en la entrevista del médico, más los comentarios del cuidador): p=0,025; ADCS-ADLsev (siglas en inglés que corresponden al estudio cooperativo de la enfermedad de Alzheimer - actividades de la vida diaria): p=0,003; SIB (siglas en inglés que corresponden a la batería de deterioro grave): p=0,002).
Un estudio pivotal de memantina en monoterapia en el tratamiento de la enfermedad de Alzheimer de leve a moderada (puntuación total MMSE al inicio del estudio de 10 a 22) incluyó a 403 pacientes.
Los pacientes tratados con memantina mostraron un efecto superior a placebo estadísticamente significativo, en las variables principales: ADAS-cog (siglas en inglés que corresponden a la escala de valoración de la enfermedad de Alzheimer-subescala cognitiva) (p=0,003) y CIBIC-plus (p=0,004) en la semana 24 LOCF (siglas en inglés que corresponden al método de arrastre de la última observación realizada). En otro ensayo de monoterapia en enfermedad de Alzheimer de leve a moderada se aleatorizaron un total de 470 pacientes (puntuación total MMSE al inicio del estudio de 11 - 23). En el análisis primario definido prospectivamente no se encontró diferencia estadísiticamente significativa en las variables primarias de eficacia en la semana 24.
Un meta-análisis de los pacientes con enfermedad de Alzheimer de moderada a grave (puntuación total MMSE < 20) de seis estudios en fase III, controlados con placebo en estudios a 6 meses (incluyendo estudios de monoterapia y estudios con pacientes con una dosis estable de un inhibidor de la acetilcolinesterasa), mostró que había un efecto estadísticamente significativo a favor del tratamiento con memantina en las áreas cognitiva, global y funcional. Cuando los pacientes fueron identificados con un empeoramiento conjunto en las tres áreas, los resultados mostraron un efecto estadísticamente significativo de memantina en la prevención del empeoramiento, el doble de los pacientes tratados con placebo en comparación con los pacientes tratados con memantina mostraron empeoramiento en las tres áreas (21% frente 11%, p<0,0001).
5.2 Propiedades farmacocinéticas
Absorción
Memantina tiene una biodisponibilidad absoluta de aproximadamente el 100%. La tmáx está entre 3 y 8 horas. No hay indicios de la influencia de alimentos en la absorción de memantina.
Distribución
Las dosis diarias de 20 mg producen concentraciones plasmáticas constantes de memantina que oscilan entre 70 y 150 ng/ml (0,5 - 1 pmol) con importantes variaciones interindividuales. Cuando se administraron dosis diarias de 5 a 30 mg, se obtuvo un índice medio de líquido cefalorraquídeo (LCR)/suero de 0,52. El volumen de distribución es de aproximadamente 10 l/kg. Alrededor del 45% de memantina se une a proteínas plasmáticas.
Biotransformación
En el hombre, aproximadamente el 80% del material circulante relacionado con memantina está presente como compuesto inalterado. Los principales metabolitos en humanos son N-3,5-dimetil-gludantano, la mezcla isomérica de 4- y 6-hidroxi-memantina y 1-nitroso-3,5-dimetil-adamantano. Ninguno de estos metabolitos muestra actividad antagonista NMDA. No se ha detectado in vitro metabolismo catalizado por citocromo P 450.
En un estudio con 14C-memantina administrado vía oral, se recuperó una media del 84% de la dosis dentro de los 20 días, excretándose más del 99% por vía renal.
Eliminación
Memantina se elimina de manera monoexponencial con una t/2 terminal de 60 a 100 horas. En voluntarios con función renal normal, el aclaramiento total (Cltot) asciende a 170 ml/min/1,73 m2 y parte del aclaramiento total renal se logra por secreción tubular.
La función renal también incluye la reabsorción tubular, probablemente mediada por proteínas transportadoras de cationes. La tasa de eliminación renal de la memantina en condiciones de orina alcalina puede reducirse en un factor entre 7 y 9 (ver sección 4.4). La alcalinización de la orina se puede producir por cambios drásticos en la dieta, por ejemplo, de carnívora a vegetariana, o por una ingesta masiva de tampones gástricos alcalinizantes.
Linealidad
Los estudios en voluntarios han demostrado una farmacocinética lineal en el intervalo de dosis de 10 a 40 mg.
Relación farmacocinética/farmacodinámica
A una dosis de memantina de 20 mg al día los niveles en LCR concuerdan con el valor ki (ki = constante de inhibición) de memantina, que es de 0,5 pmol en la corteza frontal humana.
5.3 Datos preclínicos sobre seguridad
En estudios a corto plazo en ratas, memantina, al igual que otros antagonistas del NMDA, indujo vacuolización neuronal y necrosis (lesiones de Olney) únicamente tras dosis que producían picos muy altos de concentraciones séricas. La ataxia y otros signos preclínicos precedieron a la vacuolización y a la necrosis. Como estos efectos no se observaron en roedores ni en no roedores en estudios a largo plazo, se desconoce la importancia clínica de estos hallazgos.
Se observaron cambios oculares en estudios de toxicidad de dosis repetidas en roedores y perros, pero no en monos. Los exámenes específicos oftalmoscópicos realizados en estudios clínicos con memantina no revelaron cambios oculares.
En roedores se observó fosfolipidosis en macrófagos pulmonares producido por la acumulación de memantina en lisosomas. Este efecto se ha observado en otros principios activos con propiedades anfifílicas catiónicas. Existe una posible relación entre esta acumulación y la vacuolización observada en los pulmones. Este efecto se observó solamente en roedores a dosis altas. Se desconoce la importancia clínica de estos hallazgos.
No se observó genotoxicidad en los ensayos estándar realizados con memantina. No hubo evidencias de carcinogenicidad en los estudios en ratones y ratas hasta su muerte. Memantina no resultó teratogénica ni en ratas ni en conejos, incluso a dosis tóxicas para la madre y no se observó ningún efecto adverso de memantina sobre la fertilidad. En ratas, se observó una reducción del crecimiento fetal a niveles de exposición idénticos o ligeramente más altos que los niveles de exposición humana.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Celulosa microcristalina Croscarmelosa sódica Sílice coloidal anhidra Estearato de magnesio
Recubrimiento del comprimido:
Hipromelosa
Macrogol 400
Dióxido de titanio
Óxido de hierro amarillo y rojo
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 4 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blister: PVDC/PE/PVC/Al-blister o PP/Al-blister. Presentaciones de 14, 28, 42, 56, 70, 84, 98,112 recubiertos con película.
Envase múltiple conteniendo 840 (20 x 42) comprimidos recubiertos con película.
Envases monodosis perforados: PVD/PE/PVC/Al-blister o PP/Al-blister.
Presentaciones de 49x1, 56x1, 98x1 y 100x1 comprimidos recubiertos con película .
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/023-035
EU/1/02/219/037-049
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 mayo 2002 Fecha de la última renovación: 15 mayo2007
10. FECHA DE LA REVISIÓN DEL TEXTO
MM/YYYY
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACION DE COMERCIALIZACION
D. CONDICIONES O RESTRICCIONES RELATIVAS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
H. Lundbeck A/S
Ottiliavej 9
2500 Valby
Dinamarca
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACION DE COMERCIALIZACION
Informes Periódicos de Seguridad (IPSs)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Ebixa 10 mg comprimidos recubiertos con película Clorhidrato de memantina
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
|
Comprimidos recubiertos con película. | |
|
14 comprimidos recubiertos con película | |
|
28 comprimidos recubiertos con película. 30 comprimidos recubiertos con película. 42 comprimidos recubiertos con película. | |
|
49 x 1 comprimidos recubiertos con película. | |
|
50 comprimidos recubiertos con película. 56 comprimidos recubiertos con película. | |
|
56 x 1 comprimidos recubiertos con película. | |
|
70 comprimidos recubiertos con película. 84 comprimidos recubiertos con película. 98 comprimidos recubiertos con película. | |
|
98 x 1 comprimidos recubiertos con película. | |
|
100 comprimidos recubiertos con película |
. |
|
100 x 1 comprimidos recubiertos con película. | |
|
112 comprimidos recubiertos con película. | |
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD {MM/AAAA}
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
EU/1/02/219/016 14 comprimidos recubiertos con película.
|
EU/1/02/219/007 28 comprimidos recubiertos con película . | |
|
EU/1/02/219/001 30 comprimidos recubiertos con película. | |
|
EU/1/02/219/017 42 comprimidos recubiertos con película . | |
|
EU/1/02/219/010 49 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/002 50 comprimidos recubiertos con película. EU/1/02/219/008 56 comprimidos recubiertos con película. | |
|
EU/1/02/219/014 56 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/018 70 comprimidos recubiertos con película. EU/1/02/219/019 84 comprimidos recubiertos con película. EU/1/02/219/020 98 comprimidos recubiertos con película. | |
|
EU/1/02/219/015 98 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/003 100 comprimidos recubiertos con película |
. |
|
EU/1/02/219/011 100 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/009 112 comprimidos recubiertos con película |
. |
Lote {número}
Medicamento sujeto a prescripción médica.
Ebixa 10 mg comprimidos
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR EMBALAJE COMO ENVASE INTERMEDIO / COMPONENTE DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)
Ebixa 10 mg comprimidos recubiertos con película Clorhidrato de memantina
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Comprimidos recubiertos con película.
50 Comprimidos recubiertos con película.
98 comprimidos recubiertos con película
Componente de un envase múltiple, no pueden venderse por separado.
Leer el prospecto antes de utilizar este medicamento.
Vía oral._
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD {MM/AAAA}
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/021 980 (10 envases de 98) comprimidos recubiertos con película EU/1/02/219/012 1000 (20 envases de 50) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Ebixa 10 mg comprimidos
1. NOMBRE DEL MEDICAMENTO
Ebixa 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIOS) ACTIVOQ
Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película.
Envase múltiple 980 (10 envases de 98) comprimidos recubiertos con película. Envase múltiple: 1000 (20 envases de 50) comprimidos recubiertos con película.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
EU/1/02/219/021 980 (10 x 98) comprimidos recubiertos con película EU/1/02/219/012 1000 (20 x 50) comprimidos recubiertos con película
Lote {número}
Medicamento sujeto a prescripción médica.
Ebixa 10 mg comprimidos
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS BLISTER PARA COMPRIMIDOS
1. NOMBRE DEL MEDICAMENTO
Ebixa 10 mg comprimidos recubiertos con película Clorhidrato de memantina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S
3. FECHA DE CADUCIDAD
CAD {MM/AAAA} Ver el relieve.
4. NÚMERO DE LOTE
Lote {número} Ver el relieve.
5. OTROS
Ebixa 5 mg/pulsación, solución oral clorhidrato de memantina
Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
La solución también contiene sorbato potásico y sorbitol E420. Para mayor información consultar el prospecto.
Solución oral. 50 ml.
100 ml.
5. FORMA Y VÍA DE ADMINISTRACIÓN_
Una vez al día
Leer el prospecto antes de utilizar este medicamento.
Vía oral._
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/005 50 ml.
EU/1/02/219/006 100 ml.
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Ebixa 5mg/pulsación solución oral
EMBALAJE Y ETIQUETA PARA FRASCOS COMO ENVASE INTERMEDIO / COMPONENTE DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)_
Ebixa 5 mg/pulsación, solución oral clorhidrato de memantina
Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
La solución también contiene sorbato potásico y sorbitol E420. Para mayor información consultar el prospecto.
Solución oral 50 ml.
Componente de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Una vez al día
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vistay del alcance de los niños.
CAD {MM/AAAA}
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/013 500ml (10 frascos de 50ml)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Ebixa 5 mg/pulsación solución oral
Ebixa 5 mg/pulsación, solución oral clorhidrato de memantina
Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
La solución también contiene sorbato potásico y sorbitol E420. Para mayor información consultar el prospecto.
Solución oral.
Envase múltiple ( 500 ml (10 frascos de 50 ml), solución oral.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Una vez al día
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD {MM/AAAA}
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/219/013 500 ml (10 frascos de 50 ml)
13. NÚMERO DE LOTE
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Ebixa 5 mg/pulsación solución oral
Ebixa 5 mg comprimidos recubiertos con película Ebixa 10 mg comprimidos recubiertos con película Ebixa 15 mg comprimidos recubiertos con película Ebixa 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIOQ ACTIVOQ
Cada comprimido recubierto con película contiene 4,15 mg de memantina.
Cada comprimido recubierto con película contiene a 8,31 mg de memantina.
Cada comprimido recubierto con película contiene a 12,46 mg de memantina.
Cada comprimido recubierto con película contiene a 16,62 mg de memantina.
5 mg de clorhidrato de memantina, que equivalen a 10 mg de clorhidrato de memantina, que equivalen 15 mg de clorhidrato de memantina, que equivalen 20 mg de clorhidrato de memantina, que equivalen
Tratamiento pack de inicio
Cada envase de 28 comprimidos recubiertos con película para un programa de 4 semanas de tratamiento contiene:
7 comprimidos recubiertos con película de Ebixa 5 mg 7 comprimidos recubiertos con película de Ebixa 10 mg 7 comprimidos recubiertos con película de Ebixa 15 mg 7 comprimidos recubiertos con película de Ebixa 20 mg
5. FORMA Y VÍA DE ADMINISTRACIÓN_
Una vez al día
Leer el prospecto antes de utilizar este medicamento.
Vía oral.
Para continuar con el tratamiento, consulte con su médico o farmacéutico.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD {MM/AAAA}
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
EU/1/02/219/022 7 x 5 mg + 7 x 10 mg + 7 x 15 mg 7 x 20 mg comprimidos recubiertos con película. EU/1/02/219/036 7 x 5 _5 mg 7 x 20 mg comprimidos recubiertos con película.
Lote {número}
Medicamento sujeto a prescripción médica.
Tomar un solo comprimido al día Ebixa 5 mg
Clorhidrato de memantina Semana 1, Día 1 2 3 4 5 6 7
7comprimidos recubiertos con película de Ebixa 5 mg Ebixa 10 mg
Clorhidrato de memantina
Semana 2, Día 8 9 10,11 12 13 14
7comprimidos recubiertos con película de Ebixa 10 mg
Ebixa 15 mg
Clorhidrato de memantina
Semana 3, Día 15 16 17 18 19 20 21
7comprimidos recubiertos con película de Ebixa 15 mg
Ebixa 20 mg
Clorhidrato de memantina
Semana 4, Día 22 23 24 25 26 27 28
7comprimidos recubiertos con película de Ebixa 20 mg
16. INFORMACIÓN EN BRAILLE
Ebixa 5 mg, 10 mg, 15 mg, 20 mg comprimidos.
Ebixa 20 mg comprimidos recubiertos con película Clorhidrato de memantina
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
Comprimidos recubiertos con película.
14 comprimidos recubiertos con película. 28 comprimidos recubiertos con película. 42 comprimidos recubiertos con película. 49 comprimidos recubiertos con película
|
56 comprimidos recubiertos con película. | |
|
56 x1 comprimidos recubiertos con película | |
|
70 comprimidos recubiertos con película. 84 comprimidos recubiertos con película. 98 comprimidos recubiertos con película. | |
|
98 x 1 comprimidos recubiertos con película. | |
|
100 x 1 comprimidos recubiertos con película. | |
|
112 comprimidos recubiertos con película |
. |
5. FORMA Y VÍA) DE ADMINISTRACIÓN_
Una vez al día
Leer el prospecto antes de utilizar este medicamento.
Vía oral._
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD {MM/AAAA}
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottiliavej 9,
2500 Valby Dinamarca
|
EU/1/02/219/023 14 comprimidos recubiertos con película. | |
|
EU/1/02/219/024 28 comprimidos recubiertos con película. EU/1/02/219/025 42 comprimidos recubiertos con película. | |
|
EU/1/02/219/026 49 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/027 56 comprimidos recubiertos con película. | |
|
EU/1/02/219/028 56 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/029 70 comprimidos recubiertos con película. EU/1/02/219/030 84 comprimidos recubiertos con película. EU/1/02/219/031 98 comprimidos recubiertos con película. | |
|
EU/1/02/219/032 98 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/033 100 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/034 112 comprimidos recubiertos con película |
. |
|
EU/1/02/219/037 14 comprimidos recubiertos con película. EU/1/02/219/038 28 comprimidos recubiertos con película. EU/1/02/219/039 42 comprimidos recubiertos con película. | |
|
EU/1/02/219/040 49 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/041 56 comprimidos recubiertos con película. | |
|
EU/1/02/219/042 56 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/043 70 comprimidos recubiertos con película. EU/1/02/219/044 84 comprimidos recubiertos con película. EU/1/02/219/045 98 comprimidos recubiertos con película. | |
|
EU/1/02/219/046 98 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/047 100 x 1 comprimidos recubiertos con película. | |
|
EU/1/02/219/048 112 comprimidos recubiertos con película |
. |
Lote {número}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Ebixa 20 mg comprimidos
EMBALAJE COMO ENVASE INTERMEDIO / COMPONENTE DE UN ENVASE MÚLTIPLE (SIN “BLUE BOX”)_
1. NOMBRE DEL MEDICAMENTO
Ebixa 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO ACTIVO
Cada comprimido recubiertos con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película.
42 comprimidos recubiertos con película.
Parte de un envase múltiple No pueden venderse por separado.
5. FORMA Y VÍA DE ADMINISTRACIÓN_
Una vez al día
Leer el prospecto antes de utilizar este medicamento.
Vía oral._
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottliavej 9 2500 Valby Dinamarca
EU/1/02/219/035 840 (20 envases de 42) comprimidos recubiertos con película. EU/1/02/219/049 840 (20 envases de 42) comprimidos recubiertos con película.
13. NÚMERO de lote
Lote {número}
Medicamento sujeto a prescripción médica.
Ebixa 20 mg comprimidos
ETIQUETA DE LA ENVOLTURA EXTERIOR DEL ENVASE MÚLTIPLE (ENVUELTO EN UNA LÁMINA (INCLUYENDO LA “BLUE BOX”)
1. NOMBRE DEL MEDICAMENTO
Ebixa 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. PRINCIPIO) ACTIVO(
Cada comprimido recubierto con película contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimidos recubiertos con película.
Envase múltiple : 840 (20 envases de 42) comprimidos recubiertos con película.
5. FORMA Y VÍA DE ADMINISTRACIÓN
Una vez al día
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD {MM/AAAA}
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
EU/1/02/219/035 840 (20 x 42) comprimidos recubiertos con película. EU/1/02/219/049 840 (20 _ertos con película.
Lote {número}
Medicamento sujeto a prescripción médica.
Ebixa 20 mg comprimidos
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLISTER PARA COMPRIMIDOS
1. NOMBRE DEL MEDICAMENTO
Ebixa 20 mg comprimidos recubiertos con película Clorhidrato de memantina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
H. Lundbeck A/S
3. FECHA DE CADUCIDAD
CAD {MM/AAAA} Ver el relieve.
4. NÚMERO DE LOTE
Lote {número} Ver el relieve.
5. OTROS
Lun ^ Mar ^ Mie^ Jue ^ Vie^ Sab ^ Dom
B. PROSPECTO
Ebixa 10 mg comprimidos recubiertos con película
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porquecontiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Ebixa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Ebixa
3. Cómo tomar Ebixa
4. Posibles efectos adversos
5. Conservación de Ebixa
6. Contenido del envase e información adicional
1. Qué es Ebixa y para qué se utiliza
Ebixa contiene el principio activo clorhidrato de memantina. Pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D-aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Ebixa pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Ebixa actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Ebixa se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomar Ebixa No tome Ebixa
- si es alérgico a memantina o a cualquiera de los demás componentes de este medicamento (incluidos en lar sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Ebixa:
- si tiene antecedentes de crisis epilépticas.
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardiaca congestiva o si tiene hipertensión (la presión arterial elevada) no controlada.
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Ebixa regularmente.
Si padece insuficiencia renal (problemas en los riñones), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado como anestesico), dextrometorfano (fármaco para el tratamiento de la tos) y otros antagonistas del NMDA.
Niños y adolescentes
No se recomienda el uso de Ebixa en niños y adolescentes menores de 18 años.
Toma de Ebixa con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Ebixa puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
- amantadina, ketamina, dextrometorfano,
- dantroleno, baclofeno,
- cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina,
- hidroclorotiazida (o cualquier combinación con hidroclorotiazida),
- anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales),
- anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones),
- barbitúricos (sustancias generalmente utilizadas para inducir el sueño),
- agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina),
- neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales),
- anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Ebixa.
Toma de Ebixa con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal (problema de riñón)) o infecciones graves del tracto urinario (conducto de la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Ebixa no deben dar el pecho.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Ebixa puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
Cómo tomar Ebixa
3.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada de Ebixa en pacientes adultos y pacientes de edad avanzada es de 20 mg administrados una vez al día. Para reducir el riesgo de efectos adversos, esta dosis se alcanza gradualmente siguiendo el siguiente esquema diario:
|
semana 1 |
medio comprimido de 10 mg |
|
semana 2 |
un comprimido de 10 mg |
|
semana 3 |
un comprimido y medio de 10 mg |
|
semana 4 y siguientes |
dos comprimidos de 10 mg una vez al día |
La dosis normal de inicio es de medio comprimido una vez al día (1 x 5 mg) la primera semana. Se aumenta un comprimido al día (1 x 10 mg) la segunda semana y a 1 comprimido y medio una vez al día en la tercera semana. De la cuarta semana en adelante, la dosis normal es de 2 comprimidos administrados una vez al día (1 x 20 mg).
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Ebixa debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Ebixa mientras sea beneficioso para usted. El médico debe evaluar los efectos de su tratamiento periódicamente.
Si toma más Ebixa del que debe
- En general, tomar una cantidad excesiva de Ebixa no debería provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Ebixa, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Ebixa
- Si se da cuenta de que ha olvidado tomar su dosis de Ebixa, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico..
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, sueño, estreñimiento, pruebas de función hepática elevadas, vértigo, alteración del equilibrio, respiración difícil, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1.000 pacientes):
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso).
Muy raros (que afecta a menos de 1 de cada 10.000pacientes):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, inflamación del hígado (hepatitis) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Ebixa.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ebixa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
No se precisan condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Ebixa
El principio activo es clorhidrato de memantina. Cada comprimido recubierto con película contiene 10 mg de clorhidrato de memantina, que equivalen a 8,31 mg de memantina.
Los demás componentes son celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhidra y estearato de magnesio, en el núcleo del comprimido, e hipromelosa, dióxido de titanio (E 171), macrogol 400 y oxido de hierro amarillo (E 172), en la cubierta del comprimido.
Aspecto del producto y contenido del envase
Ebixa se presenta en forma de comprimidos recubiertos con película de color de amarillo pálido a amarillo, forma ovalada, con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara. El comprimido se puede partir en dosis iguales.
Ebixa comprimidos se presenta en envases de 14, 28, 30, 42, 49 x 1, 50, 56, 56 x 1, 70, 84, 98, 98 x 1, 100, 100 x 1, 112, 980 (10 x 98) ó 1000 (20 x 50) comprimidos. Los envases de 49 x 1, 56 x 1, 98 x 1 y 100 x 1 comprimidos recubiertos con película se presentan en blisters monodosis.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
H. Lundbeck A/S Ottiliavej, 9 2500 Valby Dinamarca
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
|
Belgique/Belgie/Belgien Lundbeck S.A./N.V. Tél/Tel: +32 2 340 2828 |
Lietuva H. Lundbeck A/S, Danija Tel: + 45 36301311 |
|
Bt^rapna Lundbeck Export A/S Representative Office Tel: +359 2 962 4696 |
Luxembourg/Luxemburg Lundbeck S.A. Tél: +32 2 340 2828 |
|
Ceská republika Lundbeck Ceská republika s.r.o. Tel: +420 225 275 600 |
Magyarország Lundbeck Hungaria Kft. Tel: +36 1 4369980 |
|
Danmark Lundbeck Pharma A/S Tlf: +45 4371 4270 |
Malta H. Lundbeck A/S, Denmark Tel: + 45 36301311 |
|
Deutschland Lundbeck GmbH Tel: +49 40 23649 0 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti H. Lundbeck A/S, Taani Tel: + 45 36301311 |
Norge H. Lundbeck AS Tlf: +47 91 300 800 |
|
ELLáóa Lundbeck Hellas S.A. TqL: +30 210 610 5036 |
Ósterreich Lundbeck Austria GmbH Tel: +43 1 331 070 |
|
España Lundbeck España S.A. Tel: +34 93 494 9620 |
Polska Lundbeck Poland Sp. z o. o Tel.: + 48 22 626 93 00 |
|
France Lundbeck SAS Tél: + 33 1 79 41 29 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: + 385 1 3649 210 |
Romanía Lundbeck Export A/S Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Lundbeck Export A/S, útibú á Íslandi Tel: +354 414 7070 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Lundbeck Italia S.p.A. Tel: +39 02 677 4171 |
Suomi/Finland Oy H. Lundbeck Ab Puh/Tel: +358 2 276 5000 |
|
Kúrcpo^ Lundbeck Hellas A.E TpL: +357 22490305 |
Sverige H. Lundbeck AB Tel: +46 4225 4300 |
|
Latvija H. Lundbeck A/S, Danija Tel: + 45 36301311 |
United Kingdom Lundbeck Limited Tel: +44 1908 64 9966 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Ebixa 5 mg /pulsación, solución oral
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Ebixa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Ebixa
3. Cómo tomar Ebixa
4. Posibles efectos adversos
5. Conservación de Ebixa
6. Contenido del envase e información adicional
1. Qué es Ebixa y para qué se utiliza
Ebixa contiene el principio activo clorhidrato de memantina. Pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D-aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Ebixa pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Ebixa actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Ebixa se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomar Ebixa No tome Ebixa
si es alérgico a memantina o a cualquiera de los demás componentes de de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Ebixa:
- si tiene antecedentes de crisis epilépticas.
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre insuficiencia cardiaca congestiva o si tiene hipertensión (la presión arterial elevada) no controlada.
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Ebixa regularmente.
Si padece insuficiencia renal (problemas de riñón), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado como anestésico), dextrometorfano (fármaco para tratar la tos) y otros antagonistas del NMDA.
Niños y adolescentes
No se recomienda el uso de Ebixa en niños y adolescentes menores de 18 años.
Toma de Ebixa con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente, o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Ebixa puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
- amantadina, ketamina, dextrometorfano,
- dantroleno, baclofeno,
- cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina,
- hidroclorotiazida (o cualquier combinación con hidroclorotiazida),
- anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales),
- anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones),
- barbitúricos (sustancias generalmente utilizadas para inducir el sueño),
- agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina),
- neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales),
- anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Ebixa.
Toma de Ebixa con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal (problema de riñón)) o infecciones graves del tracto urinario (estructura que lleva la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Ebixa no deben dar el pecho.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Ebixa puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
Ebixa contiene sorbitol
Este medicamento contiene sorbitol. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar éste medicamento. Su médico le aconsejará lo más adecuado.
Además éste medicamento contiene potasio, menos de 1 mmol (39 mg) por dosis, es decir, esencialmente libre de potasio.
3. Cómo tomar Ebixa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consultede nuevo a su médico o farmacéutico.
Una pulsación contiene 5 mg de clorhidrato de memantina.
La dosis recomendada de Ebixa en pacientes adultos y pacientes de edad avanzada es de cuatro pulsaciones, equivalentes a 20 mg administrados una vez al día. Para reducir el riesgo de efectos adversos, esta dosis se alcanza gradualmente siguiendo el siguiente esquema diario:
|
semana 1 |
una pulsación |
|
semana 2 |
dos pulsaciones |
|
semana 3 |
tres pulsaciones |
|
semana 4 y siguientes |
cuatro pulsaciones |
La dosis habitual de inicio es de una pulsación una vez al día (1 x 5 mg) la primera semana. Esta dosis se aumenta en la segunda semana a dos pulsaciones una vez al día (1 x 10 mg) y en la tercera semana a tres pulsaciones una vez al día (1 x 15 mg). Desde la cuarta semana, la dosis recomendada es de cuatro pulsaciones una vez al día (1 x 20 mg).
Posología para pacientes con función renal reducida
Si tiene la función renal reducida, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Ebixa debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. La solución se debe tomar con un poco de agua. La solución se puede tomar con o sin alimentos.
Para instrucciones detalladas sobre la preparación y manejo del producto ver el final de este prospecto.
Duración del tratamiento
Continúe tomando Ebixa mientras le beneficie. El médico debe evaluar su tratamiento periódicamente. Si toma más Ebixa del que debe
- En general, tomar una cantidad excesiva de Ebixa no debe provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Ebixa, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Ebixa
- Si se da cuenta de que ha olvidado tomar su dosis de Ebixa, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, sueño, estreñimiento, pruebas de función hepática elevadas, vértigo, alteración del equilibrio, respiración difícil, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1.000 pacientes):
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso).
Muy raros (que afecta a menos de 1 de cada 10.000pacientes):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas inflamación del hígado (hepatitis) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Ebixa.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ebixa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en la etiqueta del frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Una vez abierto, el contenido del frasco debe ser utilizado en 3 meses.
El frasco con el dosificador montado debe guardarse y transportarse únicamente en posición vertical.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Ebixa
-El principio activo es clorhidrato de memantina. Cada pulsación del dosificador libera 0,5 ml de solución conteniendo 5 mg de clorhidrato de memantina, equivalente a 4,16 mg de memantina.
-Los demás componentes son sorbato potásico, sorbitol E420 y agua purificada.
Aspecto del producto y contenido del envase
Ebixa, solución oral, es una solución transparente, de incolora a ligeramente amarillenta.
Ebixa, solución oral se presenta en frascos de 50 ml, 100 ml ó 10 x 50 ml.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
H. Lundbeck A/S Ottiliavej, 9 2500 Valby Dinamarca
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Bt^rapna
Lundbeck Export A/S Representative Office
Tel: +359 2 962 4696
Magyarország Lundbeck Hungaria Kft.
Tel: +36 1 4369980
Norge
H. Lundbeck AS Tlf: +47 91 300 800
Eesti
H. Lundbeck A/S, Taani Tel: + 45 36301311
|
ELLáóa Lundbeck Hellas S.A. TpL: +30 210 610 5036 |
Ósterreich Lundbeck Austria GmbH Tel: +43 1 331 070 |
|
España Lundbeck España S.A. Tel: +34 93 494 9620 |
Polska Lundbeck Poland Sp. z o. o. Tel.: + 48 22 626 93 00 |
|
France Lundbeck SAS Tél: + 33 1 79 41 29 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: + 385 1 3649 210 |
Romanía Lundbeck Export A/S Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Lundbeck Export A/S, útibú á Íslandi Tel: +354 414 7070 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Lundbeck Italia S.p.A. Tel: +39 02 677 4171 |
Suomi/Finland Oy H. Lundbeck Ab Puh/Tel: +358 2 276 5000 |
|
Kúrcpo^ Lundbeck Hellas A.E TpL: +357 22490305 |
Sverige H. Lundbeck AB Tel: +46 4225 4300 |
|
Latvija H. Lundbeck A/S, Danija Tel: + 45 36301311 |
United Kingdom Lundbeck Limited Tel: +44 1908 64 9966 |
Fecha de la última revisión de este prospecto: (MM/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones para el uso correcto del dosificador
La solución no debe verterse o dispensarse dentro de la boca directamente desde el frasco o el dosificador. Medir la dosis en una cuchara o dentro de un vaso de agua usando el dosificador.
Sacar el tapón de rosca del frasco:
El tapón debe girarse en el sentido contrario a las agujas del reloj, desenroscarse completamente y sacarse (fig.1).

Sacar el dosificador de la bolsa de plástico (fig.2) y colocarlo encima del frasco. Introducir hacia abajo el tubo de plástico cuidadosamente dentro del frasco. Mantener el dosificador en el cuello del frasco y girar en el sentido de las agujas del reloj hasta que esté unido firmemente (fig.3). El dosificador sólo debe enroscarse una vez al iniciar el uso y nunca debe desenroscarse.

Cómo funciona el dosificador:
El cabezal del dosificador tiene dos posiciones y se gira fácilmente -dirección contraria al sentido de las agujas del reloj para abrir -dirección en el sentido de las agujas del reloj para cerrar
El cabezal del dosificador no debe pulsarse hacia abajo mientras esté en la posición cerrada. La solución solo puede dispensarse en la posición abierta. Para abrir, girar el cabezal del dosisficador en la dirección que indica la flecha hasta que no se pueda más (alrededor de un octavo de giro, fig.4). El dosificador está entonces listo para su uso.
Preparación del dosificador:
Cuando se utiliza por primera vez, el dosificador no dispensa la cantidad correcta de solución oral. Por tanto debe prepararse (cebarse) pulsando el cabezal del dosificador hacia abajo completamente durante
cinco veces seguidas (fig.5).


La solución así dispensada debe desecharse. La siguiente vez que el cabezal del dosificador se pulsa hacia abajo completamente (equivalente a una pulsación), ya dispensa la dosis correcta (fig.6).

Colocar el frasco en una superficie plana, horizontal, por ejemplo encima de una mesa, y sólo debe usarse en posición vertical. Colocar un vaso con un poco de agua o una cuchara debajo de la boquilla. Pulsar el cabezal del dosificador hacia abajo firmemente pero tranquilamente y de forma sostenida, no demasiado despacio (fig.7, fig.8).

El cabezal puede entonces soltarse y esta listo para la siguiente pulsación.
El dosificador debe sólo usarse con Ebixa solución en frasco proporcionado, no para otros productos o envases. Si el dosificador no funciona correctamente, consulte a su médico o farmacéutico. Cierre el dosificador después de usar Ebixa.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Ebixa 5 mg comprimidos recubiertos con película Ebixa 10 mg comprimidos recubiertos con película Ebixa 15 mg comprimidos recubiertos con película Ebixa 20 mg comprimidos recubiertos con película
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Ebixa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Ebixa
3. Cómo tomar Ebixa
4. Posibles efectos adversos
5. Conservación de Ebixa
6. Contenido del envase e información adicional
1. Qué es Ebixa y para qué se utiliza
Ebixa contiene el principio activo clorhidrato de memantina. Pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D-aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Ebixa pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Ebixa actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Ebixa se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomar Ebixa No tome Ebixa
- si es alérgico a memantina o a cualquiera de los demás componentes de de este medicamento (incluidos en la sección 6).
Advertencias y precauciones Consulte a su médico o farmacéutico antes de empezar a tomar Ebixa:
- si tiene antecedentes de crisis epilépticas.
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardiaca congestiva o si tiene hipertensión (la presión arterial elevada) no controlada.
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Ebixa regularmente.
Si padece insuficiencia renal (problemas de riñón), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado como anestésico), dextrometorfano (fármaco para tratar la tos) y otros antagonistas del NMDA.
Niños y adolescentes
No se recomienda el uso de Ebixa en niños y adolescentes menores de 18 años.
Toma de Ebixa con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Ebixa puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
- amantadina, ketamina, dextrometorfano,
- dantroleno, baclofeno,
- cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina,
- hidroclorotiazida (o cualquier combinación con hidroclorotiazida),
- anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales),
- anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones),
- barbitúricos (sustancias generalmente utilizadas para inducir el sueño),
- agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina),
- neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales),
- anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Ebixa.
Toma de Ebixa con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una insuficiencia renal (problema de riñón)) o infecciones graves del tracto urinario (estructura que lleva la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento
Embarazo:. No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Ebixa no deben dar el pecho.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Ebixa puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
Cómo tomar Ebixa
3.
El envase con el tratamiento de inicio de Ebixa sólo debe usarse al principio del tratamiento con Ebixa.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consultede nuevo a su médico o farmacéutico.
La dosis recomendada es de 20 mg al día, que se alcanza mediante incrementos graduales de la dosis de Ebixa durante las primeras 3 semanas de tratamiento. El esquema de tratamiento también se indica en el envase de tratamiento de inicio. Tome un comprimido una vez al día.
Semana 1 (día 1-7)
Tome un comprimido de 5 mg una vez al día (de blanco a blanquecino, fusiforme) durante 7 días. Semana 2 (día 8-14)
Tome un comprimido de 10 mg una vez al día (de amarillo pálido a amarillo, forma ovalada) durante 7 días.
Semana 3 (día 15-21)
Tome un comprimido de 15 mg una vez al día (de naranja pálido a naranja grisáceo y fusiforme) durante 7 días.
Semana 4 (día 22-28)
Tome un comprimido de 20 mg una vez al día (de rojo pálido a rojo grisáceo y fusiforme) durante 7 días.
|
semana 1 |
comprimido de 5 mg |
|
semana 2 |
comprimido de 10 mg |
|
semana 3 |
comprimido de 15 mg |
|
semana 4 y siguientes |
comprimido de 20 mg una vez al día |
Dosis de mantenimiento
La dosis diaria recomendada es de 20 mg una vez al día.
Para continuar el tratamiento consulte a su médico.
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Ebixa debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Ebixa mientras le beneficie. El médico debe evaluar su tratamiento periódicamente.
Si toma más Ebixa del que debe
- En general, tomar una cantidad excesiva de Ebixa no debe provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Ebixa, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Ebixa
- Si se da cuenta de que ha olvidado tomar su dosis de Ebixa, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, sueño, estreñimiento, pruebas de función hepática elevadas, vértigo, alteración del equilibrio, respiración difícil, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1000 pacientes):
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso).
Muy raros (que afecta a menos de 1 de cada 10.000pacientes):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, inflamación del hígado (hepatitis) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de estos acontecimientos en pacientes tratados con Ebixa.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V.Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ebixa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Ebixa
• El principio activo es clorhidrato de memantina. Cada comprimido contiene 5/10/15/20 mg de
clorhidrato de memantina, que equivalen a 4,15/8,31/12,46/16,62 mg de memantina.
• Los demás componentes de Ebixa comprimidos recubiertos con película de 5/10/15 y 20 mg son
celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhidra, estearato de magnesio en el núcleo del comprimido e hipromelosa, macrogol 400, dióxido de titanio (E171) y además, óxido de hierro amarillo (E 172) para Ebixa 10 mg comprimidos recubiertos con película y para Ebixa 15 mg y Ebixa 20 mg comprimidos recubiertos con película, óxido de hierro amarillo y rojo (E172), en la película de recubrimiento.
Aspecto del producto y contenido del envase
Ebixa 5 mg comprimidos recubiertos con película tienen un color de blanco a blanquecino y son fusiformes con el número “5” impreso en una cara y “MEM” en la otra.
Ebixa 10 mg comprimidos recubiertos con película tienen un color de amarillo pálido a amarillo, forma ovalada, con una línea de rotura con grabado “1 0” en una cara y “M M” en la otra cara.
El comprimido se puede dividir en dosis iguales.
Ebixa 15 mg comprimidos recubiertos con película tienen un color de naranja pálido a naranja grisáceo y son fusiformes con el número “15” impreso en una cara y “MEM” en la otra.
Ebixa 20 mg comprimidos recubiertos con película de 20 mg tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
Cada envase de tratamiento de inicio contiene 28 comprimidos con 4 blisters que contienen 7 comprimidos de Ebixa 5 mg, 7 comprimidos de Ebixa 10 mg, 7 comprimidos de Ebixa 15 mg y 7 comprimidos de Ebixa 20 mg.
Titular de la autorización de comercialización y responsable de la fabricación
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Lietuva
H. Lundbeck A/S, Danija Tel: + 45 36301311
Luxembourg/Luxemburg
Lundbeck S.A.
Tél: +32 2 340 2828
Belgique/Belgie/Belgien
Lundbeck S.A./N.V.
Tél/Tel: +32 2 340 2828
Bt^rapna
Lundbeck Export A/S Representative Office Tel: +359 2 962 4696
|
Ceská republika Lundbeck Ceská republika s.r.o. Tel: +420 225 275 600 |
Magyarország Lundbeck Hungaria Kft. Tel: +36 1 4369980 |
|
Danmark Lundbeck Pharma A/S Tlf: +45 4371 4270 |
Malta H. Lundbeck A/S, Denmark Tel: + 45 36301311 |
|
Deutschland Lundbeck GmbH Tel: +49 40 23649 0 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti H. Lundbeck A/S, Taani Tel: + 45 36301311 |
Norge H. Lundbeck AS Tlf: +47 91 300 800 |
|
ELLáóa Lundbeck Hellas S.A. TpL: +30 210 610 5036 |
Ósterreich Lundbeck Austria GmbH Tel: +43 1 331 070 |
|
España Lundbeck España S.A. Tel: +34 93 494 9620 |
Polska Lundbeck Poland Sp. z o. o. Tel.: + 48 22 626 93 00 |
|
France Lundbeck SAS Tél: + 33 1 79 41 29 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: + 385 1 3649 210 |
Romanía Lundbeck Export A/S Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Lundbeck Export A/S, útibú á Íslandi Tel: +354 414 7070 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Lundbeck Italia S.p.A. Tel: +39 02 677 4171 |
Suomi/Finland Oy H. Lundbeck Ab Puh/Tel: +358 2 276 5000 |
|
Kúrcpo^ Lundbeck Hellas A.E TpL: +357 22490305 |
Sverige H. Lundbeck AB Tel: +46 4225 4300 |
|
Latvija H. Lundbeck A/S, Danija Tel: + 45 36301311 |
United Kingdom Lundbeck Limited Tel: +44 1908 64 9966 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Ebixa 20 mg comprimidos recubiertos con película
Clorhidrato de memantina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Ebixa y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Ebixa
3. Cómo tomar Ebixa
4. Posibles efectos adversos
5. Conservación de Ebixa
6. Contenido del envase e información adicional 1. Qué es Ebixa y para qué se utiliza
Ebixa contiene el principio activo clorhidrato de memantina. Pertenece a un grupo de medicamentos conocidos como medicamentos anti-demencia.
La pérdida de memoria en la enfermedad de Alzheimer se debe a una alteración en las señales del cerebro. El cerebro contiene los llamados receptores N-metil-D-aspartato (NMDA) que participan en la transmisión de señales nerviosas importantes en el aprendizaje y la memoria. Ebixa pertenece al grupo de medicamentos llamados antagonistas de los receptores NMDA. Ebixa actúa sobre estos receptores mejorando la transmisión de las señales nerviosas y la memoria.
Ebixa se utiliza en el tratamiento de pacientes con enfermedad de Alzheimer de moderada a grave.
2. Qué necesita saber antes de empezar a tomar Ebixa No tome Ebixa
si es alérgico a memantina o a cualquiera de los demás componentes de de este medicamento (incluidos en la sección 6) .
Advertencias y precauciones Consulte a su médico o farmacéutico antes de empezar a tomar Ebixa:
- si tiene antecedentes de crisis epilépticas.
- si ha sufrido recientemente un infarto de miocardio (ataque al corazón), si sufre enfermedad cardiaca congestiva o si tiene hipertensión (la presión arterial elevada) no controlada.
En las situaciones anteriores, el tratamiento debe ser supervisado cuidadosamente y el médico debe reevaluar el beneficio clínico de Ebixa regularmente.
Si padece insuficiencia renal (problemas de riñón), su médico debe controlar atentamente la función renal y si es necesario, adaptar las dosis de memantina.
Se debe evitar el uso de memantina junto con otros medicamentos como amantadina (para el tratamiento del Parkinson), ketamina (fármaco generalmente usado como anestésico), dextrometorfano (fármaco para tratar la tos) y otros antagonistas del NMDA.
Niños y adolescentes
No se recomienda el uso de Ebixa en niños y adolescentes menores de 18 años.
Toma de Ebixa con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, la administración de Ebixa puede producir cambios en los efectos de los siguientes medicamentos, por lo que puede que su médico necesite ajustar la dosis:
- amantadina, ketamina, dextrometorfano,
- dantroleno, baclofeno,
- cimetidina, ranitidina, procainamida, quinidina, quinina, nicotina,
- hidroclorotiazida (o cualquier combinación con hidroclorotiazida),
- anticolinérgicos (sustancias generalmente utilizadas para tratar alteraciones del movimiento o espasmos intestinales),
- anticonvulsivantes (sustancias utilizadas para prevenir y eliminar las convulsiones),
- barbitúricos (sustancias generalmente utilizadas para inducir el sueño),
- agonistas dopaminérgicos (sustancias como L-dopa, bromocriptina),
- neurolépticos (sustancias utilizadas en el tratamiento de enfermedades mentales),
- anticoagulantes orales.
Si ingresa en un hospital, informe a su médico que está tomando Ebixa.
Toma de Ebixa con alimentos y bebidas
Debe informar a su médico si ha cambiado recientemente o tiene la intención de cambiar su dieta de manera sustancial (por ejemplo de dieta normal a dieta vegetariana estricta) o si padece acidosis tubular renal (ATR, exceso de sustancias productoras de ácido en la sangre debido a una disfunción renal (problema de riñón)) o infecciones graves del tracto urinario (estructura que lleva la orina), ya que su médico puede tener que ajustar la dosis del medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo: No se recomienda el uso de memantina en mujeres embarazadas.
Lactancia: Las mujeres que toman Ebixa no deben dar el pecho.
Conducción y uso de máquinas
Su médico le informará de si su enfermedad le permite conducir y usar máquinas con seguridad. Asimismo, Ebixa puede alterar su capacidad de reacción, por lo que la conducción o el manejo de máquinas pueden resultar inapropiados.
3. Cómo tomar Ebixa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendadade Ebixa para adultos y pacientes de edad avanzada es de 20 mg administrados una vez al día.
Para reducir el riesgo de aparición de efectos adversos, esta dosis ha de alcanzarse de manera gradual siguiendo un esquema de tratamiento diario. Para ajustar la dosis existen comprimidos con diferentes dosis.
Al inicio del tratamiento empezará a tomar Ebixa 5 mg comprimidos recubiertos con película una vez al día. Esta dosis se incrementará de forma semanal en 5 mg hasta alcanzar la dosis recomendada (de mantenimiento). La dosis recomendada de mantenimiento es de 20 mg una vez al día, que se alcanza al comienzo de la cuarta semana.
Posología para pacientes con insuficiencia renal
Si padece problemas de riñón, su médico decidirá la dosis apropiada para su condición. En este caso, su médico debe controlar periódicamente su función renal.
Administración
Ebixa debe administrarse por vía oral una vez al día. Para sacar el máximo provecho de su medicación, deberá tomarla todos los días y a la misma hora. Los comprimidos se deben tragar con un poco de agua. Los comprimidos se pueden tomar con o sin alimentos.
Duración del tratamiento
Continúe tomando Ebixa mientras le beneficie. El médico debe evaluar su tratamiento periódicamente. Si toma más Ebixa del que debe
- En general, tomar una cantidad excesiva de Ebixa no debe provocarle ningún daño. Puede experimentar un aumento de los síntomas descritos en la sección 4 “Posibles efectos adversos”.
- Si toma una sobredosis de Ebixa, póngase en contacto con su médico o pida consejo médico, ya que podría necesitar atención médica.
Si olvidó tomar Ebixa
- Si se da cuenta de que ha olvidado tomar su dosis de Ebixa, espere y tome la siguiente dosis a la hora habitual.
- No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En general los efectos adversos se clasifican de leves a moderados.
Frecuentes (que afecta a entre 1 y 10 de cada 100pacientes):
• Dolor de cabeza, sueño, estreñimiento, pruebas de función hepática elevadas, vértigo, alteración del equilibrio, respiración difícil, tensión alta e hipersensibilidad al medicamento.
Poco frecuentes (que afecta a entre 1 y 10 de cada 1000 pacientes):
• Cansancio, infecciones por hongos, confusión, alucinaciones, vómitos, alteración de la marcha, insuficiencia cardíaca y formación de coágulos en el sistema venoso (trombosis/tromboembolismo venoso).
Muy raros (que afecta a menos de 1 de cada 10.000pacientes):
• Convulsiones.
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• Inflamación del páncreas, inflamación del hígado (hepatitis) y reacciones psicóticas.
La enfermedad de Alzheimer se ha relacionado con depresión, ideación suicida y suicidio. Se ha informado de la aparición de éstos acontecimientos en pacientes tratados con Ebixa.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ebixa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en el blister después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Ebixa
El principio activo es clorhidrato de memantina. Cada comprimido contiene 20 mg de clorhidrato de memantina, que equivalen a 16,62 mg de memantina.
Los demás componentes son celulosa microcristalina, croscarmelosa sódica, sílice coloidal anhidra, estearato de magnesio en el núcleo; e hipromelosa, macrogol 400, dióxido de titanio (E171) y óxido de hierro amarillo y rojo (E 172) en la película de recubrimiento.
Aspecto del producto y contenido del envase
Ebixa 20 mg comprimidos recubiertos con película tienen un color de rojo pálido a rojo grisáceo y son fusiformes con el número “20” impreso en una cara y “MEM” en la otra.
Ebixa comprimidos recubiertos con película están disponibles en envases de blísters de 14, 28, 42, 49 x 1, 56, 56 x 1, 70, 84, 98, 98 x 1, 100 x 1, 112 o 840 (20 x 42) comprimidos. Los tamaños de envase 49 x1, 56 x1, 98 x 1, y 100 x 1 se presentan en monodosis.
Puede que no todos los envases estén comercializados.
H. Lundbeck A/S Ottiliavej 9 2500 Valby Dinamarca
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización
|
Belgique/Belgie/Belgien Lundbeck S.A./N.V. Tél/Tel: +32 2 340 2828 |
Lietuva H. Lundbeck A/S, Danija Tel: + 45 36301311 |
|
Bt^rapna Lundbeck Export A/S Representative Office Tel: +359 2 962 4696 |
Luxembourg/Luxemburg Lundbeck S.A. Tél: +32 2 340 2828 |
|
Ceská republika Lundbeck Ceská republika s.r.o. Tel: +420 225 275 600 |
Magyarország Lundbeck Hungaria Kft. Tel: +36 1 4369980 |
|
Danmark Lundbeck Pharma A/S Tlf: +45 4371 4270 |
Malta H. Lundbeck A/S, Denmark Tel: + 45 36301311 |
|
Deutschland Lundbeck GmbH Tel: +49 40 23649 0 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti H. Lundbeck A/S, Taani Tel: + 45 36301311 |
Norge H. Lundbeck AS Tlf: +47 91 300 800 |
|
Ekkáóa Lundbeck Hellas S.A. T r(k: +30 210 610 5036 |
Ósterreich Lundbeck Austria GmbH Tel: +43 1 331 070 |
|
España Lundbeck España S.A. Tel: +34 93 494 9620 |
Polska Lundbeck Poland Sp. z o. o. Tel.: + 48 22 626 93 00 |
|
France Lundbeck SAS Tél: + 33 1 79 41 29 00 |
Portugal Lundbeck Portugal Lda Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel.: + 385 1 3649 210 |
Romanía Lundbeck Export A/S Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Limited Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Lundbeck Export A/S, útibú á Íslandi Tel: +354 414 7070 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
96