Dermestril - Septem 75 Microgramos/24 Horas Parche Transdermico
Información obsoleta, busque otroMINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
- Conserve este prospecto. Puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a Vd. personalmente y no debe darlo a otras personas. Puede
perjudicarles, aun cuando sus síntomas sean los mismos que los suyos._
En este prospecto
1. Qué es DERMESTRIL-Septem 75microgramos/24 horas y para qué se utiliza
2. Antes de usar DERMESTRIL-Septem 75 microgramos/24 horas
3. Cómo usar DERMESTRIL-Septem 75 microgramos/24 horas
4. Posibles efectos adversos
5. Conservación de DERMESTRIL-Septem 75 microgramos/24 horas
DERMESTRIL-Septem 75 microgramos/24 horas. Parche transdérmico
Estradiol
El principio activo de DERMESTRIL-Septem 75 es estradiol hemihidrato 7,74 mg (equivalente a 7,5 mg de estradiol) libera alrededor de 75 microgramos de estradiol al día; el área de liberación del parche es de 33,75 cm2.
Los demás componentes son Durotak 387-2353, Durotak 387-2287, polietileno tereftalato.
El titular de la autorización de comercialización es:
Rottapharm, S.L.
Foc, 68 - 82 (Barcelona)
- 08038 - España
El responsable de la fabricación es:
Lohmann Therapie-Systeme AG,
LohmannstraPe 2
D-56626 Andernach, Alemania.
1. QUÉ ES DERMESTRIL-Septem 75 Y PARA QUÉ SE UTILIZA
DERMESTRIL-Septem 75 se presenta en envases de 4 ó 12 parches transdérmicos. Cada parche transdérmico contiene 7,5 mg de estradiol, y se envasa en un sobre individual.
DERMESTRIL-Septem 75 está indicado como terapia hormonal sustitutiva (THS) para:
Tratamiento de los síntomas de la menopausia, natural o inducida quirúrgicamente, p.ej. sofocos, sudoración nocturna, trastornos urogenitales (vulvovaginitis atrófica).
La experiencia en mujeres mayores de 65 años es limitada.
No debe utilizarse DERMESTRIL-Septem 75 para prevenir enfermedades del corazón ni para aumentar la capacidad intelectual.
DERMESTRIL-Septem 75 no es un anticonceptivo, ni restablece la fertilidad.
2. ANTES DE USAR DERMESTRIL-Septem 75
Siga cuidadosamente todas las instrucciones que le dé su médico. Correo electronicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Lea la siguiente información antes de usar DERMESTRIL-Septem No utilice DERMESTRIL-Septem 75 si:
• Padece o ha padecido cáncer de mama o de útero o si se sospecha que pueda tenerlo
• está embarazada o sospecha que puede estarlo
• presenta hemorragias vaginales anormales
• padece hiperplasia de endometrio (crecimiento anormal del endometrio)
• padece o ha padecido una trombosis venosa (coágulos sanguíneos en las venas de las piernas) o embolismo pulmonar (coágulo de sangre en las venas de las piernas que se desprende afectando al pulmón)
• tiene alguna alteración que afecte a la coagulación del a sangre (trombofilia)
• padece o ha padecido recientemente trombosis de una arteria (p.ej. angina de pecho, infarto de miocardio, accidente cerebrovascular, afectación de la arteria de la retina)
• padece o ha padecido algún trastorno grave del hígado, hasta que éste no regrese a la normalidad
• es alérgico a alguno de los componentes de DERMESTRIL-Septem
• padece porfiria (enfermedad de un pigmento de la sangre)
Tenga especial cuidado con DERMESTRIL-Septem 75:
Visite a su médico regularmente y al menos una vez al año. Hable con su médico en cada visita sobre la necesidad de ajustar o continuar el tratamiento.
Para el tratamiento de los síntomas climatéricos, la THS solo debe iniciarse cuando los síntomas afectan a la calidad de vida de la mujer. En todos los casos, debe realizarse, al menos anualmente, una valoración cuidadosa de los riesgos y beneficios y la THS solamente debería de continuarse mientras los beneficios superen los riesgos. Se deberá siempre considerar la administración de la menor dosis y la duración de tratamiento más corta.
Antes de empezar con la terapia hormonal sustitutiva (THS) debe informar a su médico sobre su historia médica personal y familiar. Su médico le realizará una revisión física y ginecológica completa antes de comenzar el tratamiento y periódicamente a lo largo del mismo.
Deberá de acudir inmediatamente a su médico si alguna de estas enfermedades empeora o aparece mientras usa DERMESTRIL-Septem:
- Trastornos ginecológicos de cualquier tipo
- Cambios o alteraciones en las mamas
- Niveles altos de grasa (triglicéridos) en la grasa o historia familiar de ésto
- Tensión arterial elevada, particularmente si empeora o no mejora con el tratamiento antihipertensivo
- Trastornos del hígado
- Diabetes
- Trastornos del funcionamiento de la vesícula biliar
- Jaquecas (migrañas) intensas y repetitivas
- Enfermedad inmune denominada lupus eritematoso sistémico
- Epilepsia
- Asma
- Ictericia (color amarillo del blanco de los ojos y de la piel)
- Embarazo
Tenga especial cuidado en no exceder las dosis recomendadas.
Durante el tratamiento con terapia hormonal de sustitución, pueden aparecer con más frecuencia algunas enfermedades graves como coágulos de sangre (trombosis) y algunos tipos de tumores.
TROMBOSIS (coágulos de sangre)
La terapia hormonal de sustitución aumenta el riesgo de padecer trombosis (coágulos de sangre) siendo este riesgo mayor durante el primer año de uso.
Los coágulos de sangre pueden bloquear los vasos sanguíneos principales. Si el coágulo sanguíneo se forma en las venas profundas de las piernas, podrá desprenderse y bloquear las arterias pulmonares (embolia pulmonar). Asimismo los coágulos sanguíneos se producen, aunque mucho menos frecuentemente, en las arterias del corazón (infarto de miocardio, angina de pecho), en las arterias cerebrales (trombosis cerebral) o en los ojos (pérdida de visión o visión doble).
Si usted identifica la aparición de cualquiera de los posibles signos de un coágulo de sangre, comuníqueselo inmediatamente a su médico. Entre estos síntomas se encuentran:
- Dolor e hinchazón en una pierna
- Tos de aparición brusca
- Dolor fuerte en el pecho y a veces también en el brazo
- Dificultad para respirar
- Dolor de cabeza fuerte e inusual
- Problemas de visión (pérdida de visión, visión doble)
- Dificultad para hablar con claridad
- Mareos
- Convulsiones
- Debilidad o entumecimiento que afecta a una parte del cuerpo
- Dificultad para andar o sujetar cosas
El riesgo de coágulos en la sangre puede aumentar temporalmente si usted tiene que estar inmovilizada durante un tiempo debido a una intervención quirúrgica u otro motivo. Por lo tanto, en estos casos deberá consultar a su médico ya que puede ser conveniente interrumpirle el tratamiento hasta que recupere completamente su movilidad. Si usted va a ser sometida a una intervención y conoce de antemano que va a estar en cama durante un tiempo, indíqueselo a su médico.
TUMORES
La THS aumenta el riesgo de cáncer de mama. El aumento de riesgo de cáncer de mama aparece tras los primeros años de tratamiento y es mayor conforme aumenta la duración de tratamiento, desapareciendo aproximadamente 5 años después de dejar el tratamiento. Su médico le orientará sobre como puede detectar anomalías en su pecho y le realizará controles periódicos a lo largo del tratamiento.
Se ha observado que en tratamientos de larga duración con estrógenos (especialmente a partir de los 10 años de uso), aumentan las posibilidades de padecer un tumor en los ovarios.
Asímismo, cuando se administran estrógenos durante largos periodos de tiempo, aumenta el riesgo de desarrollar tumores y anomalías en el útero. Si usted conserva el útero, su médico le recetará otra hormona, la progesterona, para reducir el riesgo de cáncer de útero. Al final del periodo de tratamiento con
progesterona puede aparecer una hemorragia. Informe a su médico si presenta hemorragias abundantes o irregulares a lo largo del ciclo.
Usted deberá valorar junto con su médico las posibles alternativas de tratamiento existentes para la situación concreta y cuanto tiempo debe prolongarse el tratamiento. Esto deberá revisarse periódicamente a lo largo del tratamiento.
Advierta a su médico que usa DERMESTRIL-Septem ya que puede alterar los resultados de ciertas pruebas o análisis de laboratorio.
DERMESTRIL-Septem no es un anticonceptivo y no debe utilizarse como tal; tampoco restablece la fertilidad.
En relación con los parches que liberan más de 50 pg/día de estradiol, no se ha estudiado la seguridad endometrial de los progestágenos añadidos.
El tratamiento hormonal de sustitución no mejora la memoria ni la capacidad intelectual, e incluso podría empeorarla si Vd. tiene más de 65 años.
Uso en niñas
DERMESTRIL-Septem no debe utilizarse en niñas.
Embarazo
Consulte a su médico o farmacéutico antes de tomar cualquier medicamento No utilice DERMESTRIL-Septem si está embarazada o quiere quedarse embarazada.
Lactancia
Consulte a su médico o farmacéutico antes de tomar cualquier medicamento No utilice DERMESTRIL-Septem si está dando el pecho
Efectos sobre la capacidad de conducir y utilizar maquinaria
No se han notificado efectos adversos de DERMESTRIL-Septem sobre la capacidad de conducir o de manejar maquinaria.
Uso de DERMESTRIL-Septem con otros medicamentos:
Informe a su médico o farmacéutico si está tomando, o ha tomado recientemente cualquier otro medicamento incluso los adquiridos sin receta.
Es especialmente importante que informe a su médico si va a tomar o está tomando alguno de los siguientes medicamentos, ya que pueden interaccionar con DERMESTRIL-Septem y modificar su efecto: medicamentos antiepilépticos (p.ej. fenobarbital, fenitoina o carbamacepina), un antiinflamatorio (fenilbutazona), antibióticos y otros medicamentos antiinfecciosos (p.ej. rifampicina, rifabutina,
eritromicina, ketoconazol, nevirapina, efavirenz, ritonavir, nelfinavir), algunos antiulcerosos (cimeticina) y preparaciones a base de plantas medicinales que contengan hierba de San Juan - Hypericum perforatum). El efecto de estos últimos preparados permanece hasta dos semanas después de haberlos dejado de tomar.
3. CÓMO USAR DERMESTRIL-Septem 75
Siga estas instrucciones a menos que su médico le haya dado otras indicaciones distintas.
Recuerde usar su medicamento.
Su médico le indicará la duración de su tratamiento con Dermestril - Septem 75. No suspenda el tratamiento antes, ya que podría no ejercer el efecto deseado.
Están disponibles tres dosificaciones de DERMESTRIL-Septem - DERMESTRIL-Septem 25, 50 y 75. El tratamiento se inicia normalmente con DERMESTRIL-Septem 25 aplicado sobre la piel una vez por semana, con el fin de asegurar una aportación continua de la hormona al organismo. Vd. deberá reemplazar cada parche utilizado por uno nuevo cada 7 días.
Para el inicio y la continuación del tratamiento de los síntomas postmenopáusicos, se deberá emplear la menor dosis eficaz y la duración del tratamiento más corta.
Si después de un tratamiento de 1-2 meses con DERMESTRIL-Septem 25 aplicado una vez a la semana, los síntomas de deficiencia de estrógenos no parecen neutralizarse, puede administrarse una dosis más elevada.
En caso de reacciones adversas o síntomas de sobredosificación (ej.: tensión mamaria y/o sangrado vaginal) debe reducirse la dosis.
En mujeres con útero intacto, debe administrarse adicionalmente un progestágeno durante al menos 12-14 días cada mes/ciclo de 28 días, para evitar el desarrollo de un crecimiento anormal del endometrio estimulado por estrógenos.
No se recomienda añadir un progestágeno en mujeres histerectomizadas, a no ser que exista un diagnóstico previo de endometriosis.
Se pueden emplear dos regímenes terapéuticos:
Cíclico: DERMESTRIL-Septem se administra de forma cíclica, con un periodo libre de tratamiento, en general, 21 días de tratamiento, seguidos de 7 días libres de tratamiento. El progestágeno se añade normalmente durante 12-14 días del ciclo. Durante este periodo puede cesar el sangrado.
Secuencial continuo: DERMESTRIL-Septem se administra de forma continua. El progestágeno se añade normalmente durante 12-14 días (o más) en cada ciclo de 28 días, de forma secuencial.
Puede recomendarse este tratamiento en casos en los que los síntomas marcados de deficiencia de estrógenos vuelvan a producirse durante el periodo libre de tratamiento.


Puede producirse el cese del sangrado cuando se retire el progestágeno.
Vd. podrá iniciar el tratamiento con DERMESTRIL-Septem en cualquier momento, si no está recibiendo ningún tratamiento con estrógenos. Sí Vd. está actualmente recibiendo tratamiento cíclico o secuencial con estrógeno/progestágeno, deberá completar el tratamiento en curso antes de iniciar el tratamiento con DERMESTRIL-Septem. El momento adecuado para que Vd. inicie el tratamiento con DERMESTRIL-Septem será el primer día del cese del sangrado.
Sí Vd. está actualmente en tratamiento combinado continuo con estrógeno/progestágeno puede cambiar directamente a DERMESTRIL-Septem.
Instrucciones para la correcta administración del preparado
Cada parche transdérmico va en una bolsa protectora.
Abrir la bolsa por la muesca (no utilizar tijeras para evitar dañar el parche) y sacar el parche (Fig. 1-2). Cada parche de DERMESTRIL-Septem consta de 2 partes: el sistema transdérmico, que es transparente, elíptico y vehículo del principio activo, y la lámina protectora que es cuadrada, más grande y más rígida que el parche.
Se sujeta el parche con el pulgar y el índice por el área más pequeña delimitada por una fisura diagonal (Fig. 3). Despegar la parte más grande de la lámina protectora con la otra mano y desecharla (Fig. 4).
Debe evitarse tocar la parte adhesiva del parche.
Aplicar el parche sobre la piel de la cadera, cuadrante superior de los glúteos, región lumbar o el
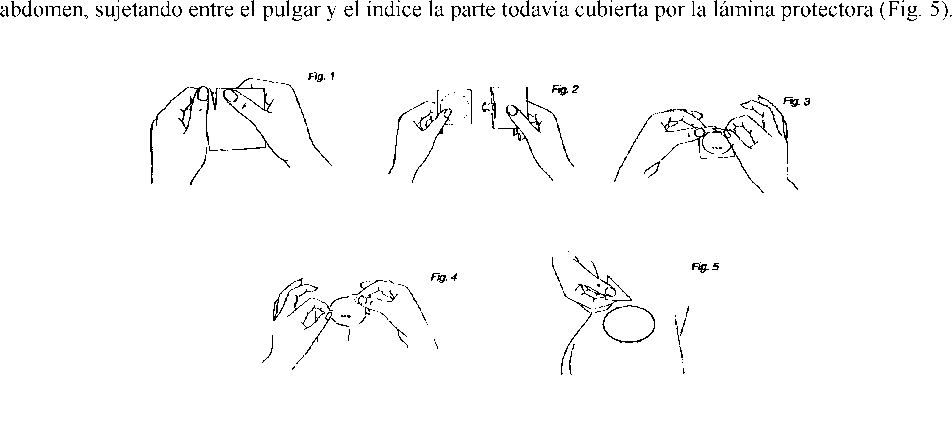
La piel del lugar de aplicación debe estar limpia, seca, no grasa y sin irritaciones o coloración roja de la piel.
Despegar la otra parte de la lámina protectora y presionar firmemente durante unos 10 segundos sobre toda la superficie del parche. Pasar otra vez los dedos por los bordes del parche para asegurar una buena adhesión.
Las áreas del cuerpo que forman muchos pliegues durante el movimiento, así como los lugares de los que el parche podría caerse debido al movimiento o al roce deberían evitarse.
DERMESTRIL-Septem no debe aplicarse en las mamas o cerca de ellas.
Los parches no deben aplicarse dos veces consecutivas en el mismo sitio.
El parche debe cambiarse una vez a la semana con el fin de asegurar un aporte continuo de la hormona al organismo.
E IGUALDAD_
Agencia española de medicamentos y productos sanitarios


Si se siguen las indicaciones arriba reseñadas, el parche se adhiere a la piel sin problemas durante el periodo necesario de una semana. En el caso de que el parche se caiga y no vuelva a pegarse correctamente, se debe reemplazar por uno nuevo, durante el resto del periodo de dosificación de una semana. El cambio regular del parche debería realizarse según el esquema original de tratamiento.
Si el parche no se ha cambiado el día que tocaba, deberá reemplazarse tan pronto como sea posible y volver a cambiarlo siguiendo el esquema antiguo.
Si el parche es aplicado correctamente, es posible ducharse y bañarse. De todas formas, el parche puede desprenderse después de un baño muy caliente o de una sauna. Si esto ocurre y el parche no se vuelve a pegar correctamente, debe ser sustituido por uno nuevo. Lo mejor sería planear la sauna para el día que se debe cambiar el parche.
Después de eliminarlos, los parches deberían doblarse con la parte adhesiva hacia dentro y desecharse.
Si Vd. usa más DERMESTRIL-Septem 75 del que debiera:
En caso de sobredosis con DERMESTRIL-Septem 75, consulte inmediatamente a su médico o farmacéutico, acuda al hospital más cercano o llame al Servicio de Información Toxicológica. Tlfno. 91562.04.20.
Una dosis demasiado elevada puede producir tensión mamaria, hinchazón abdominal o pélvica, ansiedad, irritabilidad, retención de líquidos. Puede producirse también flatulencia.
Puede presentarse sangrado abundante como resultado de una sobredosificación relativa de estradiol durante la administración de progestágeno (es decir, infradosificación del progestágeno).
Los síntomas desaparecen cuando se elimina el parche o cuando se reduce la dosis.
Si usted o alguien aplica varios parches a la vez, elimine los parches con cuidado y lave la zona para reducir la absorción.
Si olvidó usar DERMESTRIL-Septem 75:
Si el parche no se ha cambiado el día que tocaba deberá reemplazarse tan pronto como sea posible y a continuación aplicar el siguiente parche siguiendo el esquema original de tratamiento.
El olvido de una dosis aumenta la probabilidad de sangrado vaginal y manchado.
4. POSIBLES EFECTOS ADVERSOS
Como todos los medicamentos, DERMESTRIL-Septem 75 puede tener efectos adversos.
Los efectos adversos pueden ser muy frecuentes, frecuentes, poco frecuentes o incluso raros y son siempre moderados y transitorios.
Trastornos psiquiátricos
Frecuentemente (> 1% y < 10% de las mujeres tratadas): depresión.
Sistema nervioso central
Frecuentemente (> 1% y < 10% de las mujeres tratadas): irritabilidad, dolor de cabeza.
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): migraña, vértigo.
Raramente (> 0,01% y < 0,1% de las mujeres tratadas): cambios en el apetito sexual, empeoramiento de la epilepsia.
Trastornos vasculares
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): aumento de la presión arterial Raramente (> 0,01% y < 0,1% de las mujeres tratadas): tromboembolismo venoso.
Trastornos gastrointestinales
Frecuentemente (> 1% y < 10% de las mujeres tratadas): náuseas, calambres abdominales, meteorismo.
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): vómitos.
Trastornos del hígado y la vesícula biliar
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): trastornos o resultados anormales de las pruebas de la función hepática.
Trastornos de la piel y del tejido subcutáneo
Muy frecuentemente (> 10 % de las mujeres tratadas): erupción moderada en el lugar de aplicación del parche, con o sin picor.
Raramente (> 0,01% y < 0,1% de las mujeres tratadas): dermatitis alérgica de contacto, pigmentación post-inflamatoria reversible, picor generalizado y erupciones cutáneas.
Trastornos del sistema reproductor y mamas
Muy frecuentemente (> 10 % de las mujeres tratadas): tensión y dolor en las mamas.
Frecuentemente (> 1% y < 10% de las mujeres tratadas): sangrado vaginal comparable al menstrual, cambios en las secreciones vaginales, aumento anormal del tejido del endometrio.
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): cáncer de mama.
Raramente (> 0,01% y < 0,1% de las mujeres tratadas): tumores en el útero.
Trastornos generales
Frecuentemente (> 1% y < 10% de las mujeres tratadas): retención de líquidos con hinchazón, sensación de pesadez en las piernas, aumento o disminución de peso.
Poco frecuentemente (> 0,1% y <1% de las mujeres tratadas): alteraciones de la tolerancia a la glucosa y de la coagulación sanguínea.
Raramente (> 0,01% y < 0,1% de las mujeres tratadas): irritación ocular durante el uso de lentes de contacto, reacciones alérgicas.
Se han descrito las siguientes reacciones adversas, en relación con el tratamiento estrógeno/progestágeno:
- Cáncer maligno o benigno dependiente de estrógenos, como el cáncer de endometrio
- Coágulos en las venas (tromboembolismo venoso)
- Infarto de miocardio y ataque cerebral
- Enfermedad de la vesícula biliar
- Trastornos de la piel y subcutáneos, tales como manchas en la cara que pueden ser persistentes, síndrome de hipersensibilidad, cuadro cutáneo caracterizado por nódulos dolorosos en las piernas, formación de manchas rojas en la piel.


Si se observa cualquier otra reacción no descrita en este prospecto, consulte con su médico o farmacéutico.
5. CONSERVACIÓN DE DERMESTRIL-Septem 75
Mantenga DERMESTRIL-Septem 75 fuera del alcance y de la vista de los niños. No conservar a temperatura superior a 25°C.
DERMESTRIL-Septem debe almacenarse en su sobre intacto.
Caducidad
No utilizar DERMESTRIL-Septem 75 después de la fecha de caducidad indicada en el sobre/ caja. Este prospecto ha sido aprobado en Octubre de 2004
Agencia española de
medicamentos y
productos sanitarios