Decapeptyl Semestral 22,5 Mg Polvo Y Disolvente Para Suspension Inyectable De Liberacion Prolongada
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Decapeptyl semestral 22,5 mg polvo y disolvente para suspensión inyectable de liberación prolongada
Triptorelina
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede peijudicarles.
• Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto
1. Qué es Decapeptyl semestral 22,5 mg y para qué se utiliza
2. Antes de usar Decapeptyl semestral 22,5 mg
3. Cómo usar Decapeptyl semestral 22,5 mg
4. Posibles efectos adversos
5. Conservación de Decapeptyl semestral 22,5 mg
6. Contenido del envase e información adicional.
1. Qué es DECAPEPTYL SEMESTRAL 22,5 MG y para qué se utiliza
Decapeptyl semestral 22,5 mg contiene triptorelina, que es similar a una hormona denominada hormona liberadora de gonadotropina (análogo de la GnRH). Se trata de una formulación de acción prolongada diseñada para liberar lentamente 22,5 mg de triptorelina durante un periodo de 6 meses (24 semanas). Actúa reduciendo las concentraciones de la hormona masculina testosterona en el organismo.
Decapeptyl semestral 22,5 mg se usa para tratar el cáncer de próstata localmente avanzado hormono-dependiente, solo, o durante y después de la radioterapia. También se utiliza para tratar el cáncer de próstata hormono-dependiente que se ha diseminado a otras partes del cuerpo (cáncer metastásico).
2. ANTES DE USAR DECAPEPTYL SEMESTRAL 22,5 MG
No use Decapeptyl semestral 22,5 mg si es alérgico (hipersensible) a triptorelina pamoato, a la hormona liberadora de gonadotropina (GnRH), a otros análogos de la GnRH o a cualquiera de los excipientes de Decapeptyl semestral 22,5 mg.
Tenga especial cuidado con Decapeptyl semestral 22,5 mg
• Se han comunicado casos de depresión en pacientes tratados con Decapeptyl semestral 22,5 mg que puede ser grave. Si usted está en tratamiento con Decapeptyl semestral 22,5 mg y presenta depresión, informe a su médico.
• Con la inyección intramuscular, si usa medicamentos para prevenir la coagulación de la sangre, ya que
pueden aparecer hematomas en el lugar de inyección.
• Al comenzar el tratamiento aumentará la cantidad de testosterona en su organismo, lo que puede hacer que los síntomas de cáncer empeoren. Consulte con su médico si esto sucede. El médico puede darle algún medicamento (un antiandrógeno) para impedir que los síntomas empeoren.
• Como sucede con otros análogos de la GnRH, durante las primeras semanas de tratamiento, Decapeptyl puede provocar compresión de la médula espinal o bloqueo de la uretra (conducto de salida de la orina). Su médico le hará un seguimiento y le dará el tratamiento adecuado para estos problemas, si se presentan.
• Después de la castración quirúrgica, triptorelina no induce ningún descenso adicional de los niveles de testosterona sérica y por tanto, no debe emplearse en orquidectomía.
• Los ensayos de diagnóstico de la función gonadal pituitaria realizados durante el tratamiento o tras la interrupción de la terapia con Decapeptyl semestral 22,5 mg pueden ser erróneos.
• El tratamiento con Decapeptyl semestral 22,5 mg puede, al igual que sucede con otros análogos de la GnRH, provocar pérdida de masa ósea, osteoporosis y un riesgo mayor de fracturas óseas especialmente si usted es muy bebedor, fumador, tiene historial familiar de osteoporosis (una patología que afecta la fuerza de sus huesos), tiene una dieta pobre o toma anticonvulsivos (medicamentos para la epilepsia o ataques epilépticos) o cortocoesteroides (esteroides).
• Si usted padece diabetes o si padece problemas cardíacos o vasculares, informe a su médico.
• Si usted padece un agrandamiento (tumor benigno) de la hipófisis que desconocía, éste puede ser descubierto durante el tratamiento con Decapeptyl semestral 22,5 mg. Los síntomas incluyen dolor de cabeza, vómitos, problemas visuales y parálisis de los ojos.
Consulte con su médico si está preocupado sobre alguno de estos temas.
Uso de otros medicamentos
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente otros medicamentos, incluso los adquiridos sin receta.
Niños
El tratamiento con Decapeptyl semestral 22,5 mg no está indicado en recién nacidos, lactantes, niños y adolescentes.
Embarazo y lactancia
El tratamiento con Decapeptyl semestral 22,5 mg no está indicado en mujeres.
Conducción y uso de máquinas
Aunque se administre siguiendo las indicaciones, Decapeptyl semestral 22,5 mg puede modificar ciertas reacciones hasta tal punto que alteren la capacidad para conducir o utilizar máquinas. Esto es particularmente notorio en combinación con alcohol. Puede sentirse mareado, estar cansado o presentar problemas en la vista, como visión borrosa. Estos son posibles efectos adversos del tratamiento o de la enfermedad subyacente. Si experimenta cualquiera de estos efectos adversos no debe conducir ni manejar máquinas.
Información importante sobre algunos de los componentes de Decapeptyl semestral 22,5 mg
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por vial, por lo que se considera “exento de sodio” y puede tomarse con una dieta baja en sodio.
3. Cómo usar DECAPEPTYL SEMESTRAL 22,5 MG
Decapeptyl semestral 22,5 mg se administrará bajo la supervisión de un médico.
La terapia para el cáncer de próstata con Decapeptyl semestral 22,5mg precisa un tratamiento a largo plazo.
Para el cáncer de próstata localmente avanzado hormono-dependiente durante y después de la radioterapia, la duración recomendada del tratamiento es de 2-3 años.
La dosis habitual es de 1 vial de Decapeptyl semestral 22,5 mg inyectado en el músculo cada seis meses (24 semanas).
Su médico puede realizarle análisis de sangre para medir la eficacia del tratamiento.
Si tiene la impresión de que la acción de Decapeptyl semestral 22,5 mg es demasiado fuerte o demasiado débil, comuníqueselo a su médico o farmacéutico.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Decapeptyl semestral 22,5 mg puede producir efectos adversos, aunque no todas las personas los sufran.
Como puede observarse durante el tratamiento con otros agonistas de la GnRH o después de la castración quirúrgica, los acontecimientos adversos más frecuentes relacionados con el tratamiento con triptorelina se debieron a sus efectos farmacológicos esperados. Estos efectos incluyeron sofocos (50%), impotencia (4%) y descenso de la libido (3%).
Se ha descrito el aumento del número de linfocitos en pacientes que reciben análogos de la GnRH. Con la excepción de las reacciones inmunoalérgicas y las reacciones en el punto de inyección, todos los efectos adversos están relacionados con los cambios en los niveles de testosterona.
Como con otros agonistas de la GnRH, se han comunicado hipersensibilidad y reacciones alérgicas (anafilácticas) con triptorelina.
Efectos adversos muy frecuentes, que afectan a más de 1 de cada 10 pacientes:
• Sofocos
• Debilidad
• Sudoración excesiva
• Dolor de espalda
• Sensación de hormigueo y adormecimiento en las piernas
Efectos adversos frecuentes, que afectan a más de 1 de cada 100 pacientes:
• Náuseas
• Cansancio, enrojecimiento, picor y/o dolor en el lugar de la inyección, dolor muscular y óseo, dolor en brazos y piernas, edema (concentración de líquidos en los tejidos corporales)
• Mareos, dolor de cabeza
• Impotencia, pérdida de libido
• Depresión, cambios de humor
Efectos adversos poco frecuentes, que afectan a más de 1 de cada 1.000 pacientes:
• Zumbidos en los oídos
3E
• Dolor abdominal, estreñimiento, diarrea, vómitos
• Modorra, escalofríos, somnolencia, dolor
• Ciertos parámetros analíticos afectados (incluyendo aumento de los test de función hepática)
• Aumento de peso
• Pérdida de peso, gota (dolor severo e hinchazón de las articulaciones habitualmente en el dedo gordo del pie)
• Aumento del apetito
• Dolor articular, calambres musculares, debilidad muscular, dolor muscular
• Hormigueo o entumecimiento
• Incapacidad para dormir, sensación de irritabilidad,
• Desarrollo de las mamas en los hombres, dolor en el pecho, reducción del tamaño testicular, dolor en los testículos
• Dificultad al respirar
• Acné, pérdida de pelo, picor, erupción
• Aumento de la presión sanguínea
Efectos adversos raros, que afectan a más de 1 de cada 10.000 pacientes
• Decoloración roja o morada de la piel
• Diabetes
• Vértigo
• Sensación anormal en el ojo, alteración de la visión o visión borrosa
• Sensación de abdomen lleno, flatulencia, sequedad de boca, sentido anormal del gusto
• Dolor en el tórax
• Dificultad para estar de pie
• Síntomas similares a la gripe, fiebre
• Reacción alérgica, reacción anafiláctica (reacción alérgica grave que puede causar mareos o dificultad para respirar)
• Inflamación de la nariz/garganta
• Aumento de la temperatura corporal
• Pérdida de peso
• Rigidez articular, hinchazón de las articulaciones, rigidez musculoesquelética, osteoartritis
• Pérdida de memoria
• Sensación de confusión, disminución de la actividad, sensación de euforia o bienestar
• Incapacidad de eyacular
• Dificultad para respirar al estar tumbado
• Ampollas
• Sangrado de la nariz
• Presión sanguínea baja
Durante la experiencia postcomercialización también se han notificado los siguientes efectos adversos: visión borrosa, aumento de la presión sanguínea, malestar general, dolor óseo, ansiedad y formación rápida de pápulas debido a la hinchazón de la piel o membranas mucosas.
Su médico determinará las medidas a tomar a fin de contrarrestarlos.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. Conservación de DECAPEPTYL SEMESTRAL 22,5 MG
Mantener fuera del alcance y de la vista de los niños.
3E
No utilizar Decapeptyl semestral 22,5 mg después de la fecha de caducidad que figura en el envase y en las etiquetas como CAD. La fecha de caducidad es el último día del mes que se indica.
La suspensión reconstituida debe usarse inmediatamente.
No conservar a temperatura superior a 25°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los
medicamentos que no necesita en el Punto SIGRE ^ de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. INFORMACIÓN ADICIONAL
Composición de Decapeptyl semestral 22,5 mg
El principio activo es triptorelina.
Un vial contiene triptorelina pamoato equivalente a 22,5 mg de triptorelina.
Después de la reconstitución en 2 ml de disolvente, 1 ml de suspensión reconstituida contiene 11,25 mg de triptorelina.
Los demás componentes son:
Polvo: polímero D,L-lactido-co-glicolido, manitol, carmelosa de sodio y polisorbato 80.
Disolvente: agua para inyectables.
Aspecto del producto y contenido del envase de Decapeptyl semestral 22,5 mg
Este medicamento es un polvo y disolvente para suspensión inyectable, el polvo es un polvo de color blanco a casi blanco y el disolvente es una solución transparente.
Envase con 1 vial, 1 ampolla y 1 blíster con 1 jeringa para inyección y 2 agujas para inyección.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización Ipsen Pharma, S.A.
Torre Realia - Plaza de Europa 41 - 43 08908 L’Hospitalet de Llobregat - Barcelona España
Responsable de la fabricación
Ipsen Pharma Biotech
Pare d’activité du plateau de signes
Chemin départemental N° 402
83870 Signes
Francia
Este medicamento está autorizado en los Estados miembros del EEE con los siguientes nombres:

AT, DE: Pamorelin LA 22.5 mg
BE,LU: Decapeptyl Sustained Release 22.5 mg
CZ, PL, SK: Diphereline SR 22.5 mg
DK, FI, NL, NO, SE: Pamorelin 22.5 mg
EL: Arvekap 22.5 mg
ES: Decapeptyl Semestral 22,5 mg
FR: Decapeptyl LP 22.5 mg
HU: Diphereline SR 22,5 mg por és oldószer retard szuszpenziós injekcióhoz LV: Diphereline 22.5 mg
SI: Pamorelin 22.5 mg prasek in vehikel za suspenzijo za injiciranje s podaljsanim sproscanjem Este prospecto ha sido aprobado en
<----------------------------------------------------------------------------------------------------------------------------->
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
MINISTER10DE )E SAN IDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y Sfoouctos san-tanos [finos
In,
on
Esta información está destinada únicamente a profesionales del sector sanitario:
INSTRUCCIONES PARA LA RECONSTITUCIÓN
1 - PREPARACIÓN DEL PACIENTE ANTES DE LA RECONSTITUCIÓN
Prepare al paciente desinfectando el lugar de la inyección, en el glúteo. Esta operación debe realizarse primero, ya que una vez reconstituido, el producto debe inyectarse inmediatamente.
2 - PREPARACIÓN DE LA INYECCIÓN En la caja se incluyen dos agujas:
• Aguja 1: una aguja de 20G (38 mm de longitud) sin dispositivo de seguridad para utilizar para la reconstitución
• Aguja 2: una aguja de 20G (38 mm de longitud) con dispositivo de seguridad para utilizar para la inyección
needle 1 - 38 mm

La presencia de burbujas en la parte superior del liofilizado forma parte del aspecto normal del producto.
Extraer la ampolla que contiene el disolvente. Dar unos golpecitos en el extremo de la ampolla para que toda la solución penetre en el cuerpo de la ampolla.
Enroscar la aguja 1 (sin dispositivo de seguridad) en la jeringa. No quitar aún el protector de la aguja.
Romper el cuello de la ampolla, manteniéndola en posición vertical.
Quitar el protector de la aguja 1. Insertar la aguja en la ampolla y aspirar todo el disolvente con la jeringa.
Dejar a un lado la jeringa que contiene el disolvente.
]¡

Extraer el vial que contiene el polvo. Dar unos golpecitos en la parte superior del vial para que el polvo que se haya acumulado baje al fondo.
Quitar la tapa de plástico del vial.
Volver a coger la jeringa que contiene el disolvente e introducir la aguja verticalmente a través del tapón de goma del vial e inyectar lentamente el disolvente para que, si es posible, lave toda la parte superior del vial.
O
Desplazar ligeramente la aguja 1 hacia arriba hasta que quede por encima del nivel de líquido. No quitar la aguja del vial. Reconstituir la suspensión, moviendo suavemente de lado a lado. No invertir el vial.
Asegurarse de que la agitación es suficiente para obtener una suspensión homogénea y lechosa.
Importante: Verificar que no queda polvo sin suspender en el vial (si se observan grumos, seguir moviendo hasta que desaparezcan).
2d
• Cuando la suspensión sea homogénea, deslizar la aguja hacia abajo sin invertir el vial, y aspirar la totalidad de la suspensión. Una pequeña cantidad se quedará en el vial y debe desecharse. Se incluye una cantidad adicional a fin de cubrir esta pérdida.
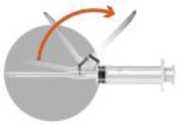
• Para desacoplar la aguja, manipular sólo la parte coloreada. Retirar de la jeringa la aguja 1 empleada para la reconstitución. Acoplar la aguja 2 a la jeringa.
• Desplazar la cubierta de seguridad de la aguja hacia el cilindro de la jeringa. La cubierta de seguridad se mantiene fija en la posición en que se coloque.
• Quitar el protector de la aguja.
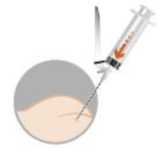
• Purgar la aguja para eliminar el aire de la jeringa e inyectar inmediatamente en el músculo del glúteo previamente desinfectado.
3 - INYECCIÓN INTRAMUSCULAR
• A fin de evitar la precipitación, inyectar inmediatamente en el músculo del glúteo previamente desinfectado.
4 - DESPUÉS DEL USO
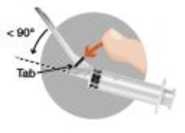
• Activación del sistema de seguridad utilizando la técnica de una sola mano,
• Nota: mantener el dedo detrás de la pestaña del dispositivo en todo momento
Hay dos métodos alternativos para activar el sistema de seguridad.
o Método A: empujar la pestaña del dispositivo hacia delante con el dedo
o o,
o Método B: empujar la cubierta con una superficie plana.
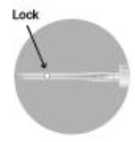
o En ambos casos presionar con un movimiento firme y rápido hasta que se escuche un click distintivo.
o Confirmar visualmente que la aguja está totalmente bloqueada con el cierre.
Las agujas usadas, cualquier resto de suspensión no utilizado u otro material residual deben desecharse en conformidad con las directrices locales.

Método A

Método B
]£
¡y
taños
8 de 8