Cosopt Pf 20 Mg/Ml + 5 Mg/Ml Colirio En Solucion En Envase Unidosis
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
COSOPT PF 20 mg/ml + 5 mg/ml colirio en solución en envase unidosis
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 22,26 mg de dorzolamida hidrocloruro correspondiente a 20 mg de dorzolamida y 6,83 mg de timolol maleato correspondiente a 5 mg de timolol.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Colirio en solución en envase unidosis
Solución transparente, incolora o casi incolora, ligeramente viscosa, con un pH entre 5,5 y 5,8, y una osmolaridad de 242-323 mOsM.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento está indicado en el tratamiento de la presión intraocular elevada (PIO) en pacientes con glaucoma de ángulo abierto, o glaucoma pseudoexfoliativo cuando la monoterapia con un betabloqueante tópico no sea suficiente.
4.2 Posología y forma de administración
La dosis es una gota de COSOPT PF dos veces al día en el saco conjuntival del ojo u ojos afectados.
Si se está utilizando otro medicamento oftálmico tópico, COSOPT PF y este otro medicamento deben administrarse al menos con diez minutos de diferencia.
Este medicamento es una solución estéril que no contiene conservante. La solución de un envase unidosis individual se debe usar inmediatamente después de su apertura para la administración en el ojo u ojos afectados. Dado que no puede mantenerse la esterilidad después de abrir el envase unidosis individual, se debe desechar todo el contenido sobrante inmediatamente después de la administración.
Se debe advertir a los pacientes que se laven las manos antes de su uso y que eviten que el envase entre en contacto con los ojos o con las estructuras que los rodean, ya que esto podría causar lesión en los ojos (ver instrucciones de uso).
Además, se debe informar a los pacientes que las soluciones oftálmicas, si no se manipulan adecuadamente, pueden contaminarse con bacterias comunes causantes de infecciones oculares. La utilización de soluciones contaminadas puede dar lugar a trastornos oculares graves y la subsiguiente pérdida de la visión.
Cuando se hace oclusión nasolacrimal o se cierran los párpados durante 2 minutos, se reduce la absorción sistémica. Esto puede dar lugar a una disminución en las reacciones adversas sistémicas y a un aumento en la actividad local.
Instrucciones de uso
Dado que están disponibles distintas formas de los envases unidosis, se debe informar a los pacientes del correcto manejo del envase unidosis. Por favor, ver sección 6.6 para las instrucciones de uso y dibujos específicos de cada forma de envase.
Población pediátrica
No se ha establecido la eficacia en pacientes pediátricos.
No se ha establecido la seguridad en pacientes pediátricos menores de 2 años (para información relativa a la seguridad en pacientes pediátricos de entre 2 y 6 años, ver sección 5.1).
4.3 Contraindicaciones
COSOPT PF está contraindicado en pacientes con:
• enfermedad reactiva aérea incluyendo asma bronquial o antecedentes de asma bronquial, o enfermedad pulmonar obstructiva crónica grave
• bradicardia sinusal, síndrome del nodo sinusal enfermo, bloqueo sinoauricular, bloqueo auriculoventricular de segundo o tercer grado no controlado con marcapasos, insuficiencia cardiaca
manifiesta, shock cardiogénico
• insuficiencia renal grave (CrCl < 30 ml/min) o acidosis hiperclorémica
• hipersensibilidad a uno o a los dos principios activos o a alguno de los excipientes incluidos en la sección 6.1.
Estas contraindicaciones están basadas en los componentes y no son exclusivas de la combinación.
4.4 Advertencias y precauciones especiales de empleo
Reacciones Cardiovasculares/Respiratorias
Como otros agentes oftálmicos de aplicación tópica, timolol se absorbe sistémicamente. Debido al componente beta-adrenérgico, timolol, pueden ocurrir los mismos tipos de reacciones adversas cardiovasculares, pulmonares y otras, que las que se presentan con los bloqueantes beta-adrenérgicos sistémicos. La incidencia de reacciones adversas sistémicas después de la administración oftálmica tópica es más baja que para la administración sistémica. Para reducir la absorción sistémica, ver sección 4.2.
Trastornos cardiacos:
Se debe valorar críticamente en pacientes con enfermedades cardiovasculares (p. ej. cardiopatía coronaria, angina de Prinzmetal e insuficiencia cardiaca) y terapia hipotensora con betabloqueantes, y se debe considerar la terapia con otros ingredientes activos. Se debe vigilar en pacientes con enfermedades cardiovasculares signos de deterioro de estas enfermedades y de reacciones adversas.
Debido a su efecto negativo en el tiempo de conducción, los betabloqueantes deben ser dados solamente con precaución a pacientes con bloqueo cardiaco de primer grado.
Trastornos vasculares:
Se debe tratar con precaución a los pacientes con alteración/trastornos circulatorios periféricos graves (p. ej. formas graves de la enfermedad de Raynaud o síndrome de Raynaud).
Trastornos respiratorios:
Se han notificado reacciones respiratorias, incluyendo muerte debido a broncoespasmos en pacientes con asma, después de la administración de algunos betabloqueantes oftálmicos.
COSOPT PF debe ser usado con precaución en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) leve/moderada, y solamente si el beneficio potencial supera al riesgo potencial.
Insuficiencia hepática
Este medicamento no ha sido estudiado en pacientes con insuficiencia hepática y, por lo tanto, se debe utilizar con precaución en estos pacientes.
Inmunología e hipersensibilidad
Como otros agentes oftálmicos de aplicación tópica, este medicamento puede absorberse sistémicamente. Dorzolamida contiene un grupo sulfamido, lo cual ocurre también en las sulfamidas. Por lo tanto, con la administración tópica, puede presentarse el mismo tipo de reacciones adversas que se presenta con la administración sistémica de sulfamidas, incluyendo reacciones graves tales como síndrome de Stevens-Johnson y necrólisis epidérmica tóxica. Si se presentasen signos de reacciones graves o de hipersensibilidad, interrumpir el uso de este preparado.
Con este medicamento se han visto efectos adversos oculares locales, similares a los observados con colirios de dorzolamida hidrocloruro. Si se producen dichas reacciones, se deberá considerar la interrupción de COSOPT PF.
Durante la administración de betabloqueantes, los pacientes con historia clínica de atopia o antecedentes de reacciones anafilácticas graves a diversos alérgenos pueden ser más reactivos a la exposición repetida a estos alérgenos y pueden no responder a las dosis habituales de adrenalina utilizadas para tratar las reacciones anafilácticas.
Tratamiento concomitante
El efecto en la presión intraocular o los efectos conocidos del bloqueo beta sistémico pueden ser potenciados cuando se administra timolol a pacientes que están recibiendo un agente betabloqueante sistémico. La respuesta de estos pacientes debe ser estrechamente observada. No se recomienda el uso de dos agentes bloqueantes beta-adrenérgicos tópicos (ver sección 4.5).
No se recomienda el uso de dorzolamida e inhibidores orales de la anhidrasa carbónica.
Retirada de la terapia
Al igual que con betabloqueantes sistémicos, cuando sea necesario suspender el timolol oftálmico en pacientes con enfermedad cardiaca coronaria, la terapia debe ser retirada de forma gradual.
Efectos adicionales del bloqueo beta
Hipoglucemia/diabetes:
Los betabloqueantes se deben administrar con precaución en pacientes bajo hipoglucemia espontánea o en pacientes con diabetes lábil, ya que los betabloqueantes pueden enmascarar los signos y síntomas de la hipoglucemia aguda.
Los betabloqueantes pueden también enmascarar signos de hipertiroidismo. Una retirada brusca de la terapia betabloqueante puede precipitar un empeoramiento de los síntomas.
Enfermedades corneales
Los betabloqueantes oftálmicos pueden inducir sequedad de los ojos. Se deben tratar con precaución a los pacientes con enfermedades corneales.
Anestesia quirúrgica
Las preparaciones oftalmológicas betabloqueantes pueden bloquear los efectos betaagonistas sistémicos, como por ejemplo de la adrenalina. Se debe informar al anestesista si el paciente está utilizando timolol.
La terapia con betabloqueantes puede agravar los síntomas de miastenia gravis.
Efectos adicionales de la inhibición de la anhidrasa carbónica
La terapia con inhibidores orales de la anhidrasa carbónica ha sido asociada con urolitiasis como consecuencia de alteraciones ácido-básicas, especialmente en pacientes con antecedentes de cálculo renal. Aunque no se han observado alteraciones del equilibrio ácido-base con COSOPT (formulación con conservante), se ha notificado urolitiasis con baja frecuencia. Dado que COSOPT PF contiene un inhibidor tópico de la anhidrasa carbónica que se absorbe sistémicamente, los pacientes con antecedentes de cálculo renal pueden tener un riesgo mayor de padecer urolitiasis mientras usan este medicamento.
Otros
El tratamiento de pacientes con glaucoma agudo de ángulo cerrado requiere intervenciones terapéuticas además de los agentes hipotensores oculares. Este medicamento no ha sido estudiado en pacientes con glaucoma agudo de ángulo cerrado.
Se han notificado casos de edema corneal y descompensación corneal irreversible en pacientes con defectos corneales crónicos pre-existentes y/o historia de cirugía intraocular mientras usaban dorzolamida. Hay un incremento potencial de desarrollar edema corneal en pacientes con recuento de células del endotelio bajo. Se debe usar con precauciones cuando se prescribe COSOPT PF a estos grupos de pacientes.
Se ha notificado desprendimiento coroideo con la administración de tratamientos supresores acuosos (p. ej. timolol, acetazolamida) después de los procedimientos de filtración.
Al igual que con el uso de otros medicamentos antiglaucoma, se ha notificado una disminución en la respuesta a timolol maleato oftálmico después de su uso prolongado en algunos pacientes. No obstante, en ensayos clínicos en los cuales se hizo un seguimiento a 164 pacientes durante al menos tres años, no se observó ninguna diferencia significativa en la presión intraocular media después de la estabilización inicial.
Utilización de lentes de contacto
Este medicamento no se ha estudiado en pacientes que utilizan lentes de contacto.
Población pediátrica Ver sección 5.1.
Uso en deportistas: Este medicamento contiene timolol que puede producir un resultado positivo en las pruebas de control de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
Con COSOPT PF no se han realizado estudios específicos de interacción medicamentosa.
En un ensayo clínico, este medicamento ha sido utilizado concomitantemente con los siguientes medicamentos sistémicos sin evidencia de interacciones adversas: inhibidores de la ECA, bloqueantes de los canales de calcio, diuréticos, antiinflamatorios no esteroideos, incluyendo aspirina, y hormonas (p. ej. estrógenos, insulina, tiroxina).
Cuando se administra la solución betabloqueante oftálmica de forma concomitante con bloqueantes de los canales de calcio, medicamentos causantes de depleción de las catecolaminas o agentes bloqueantes beta-adrenérgicos, antiarrítmicos (como amiodarona), glucósidos digitálicos, parasimpaticomiméticos, guanetidina, narcóticos, e inhibidores de la monoamina oxidasa (MAO), hay una posibilidad de efectos aditivos que resultan en hipotensión y/o marcada bradicardia.
Durante el tratamiento combinado con inhibidores del CYP2D6 (p. ej. quinidina, fluoxetina, paroxetina) y timolol, se ha notificado un betabloqueo sistémico potenciado (p. ej. disminución de la frecuencia cardiaca, depresión).
Aunque COSOPT (formulación con conservante) sólo tiene un efecto escaso o nulo sobre el tamaño de la pupila, se ha notificado midriasis ocasionalmente como resultado del uso concomitante de betabloqueantes oftálmicos con adrenalina (epinefrina).
Los betabloqueantes pueden aumentar el efecto hipoglucémico de los fármacos antidiabéticos.
Los agentes bloqueantes beta-adrenérgicos orales pueden exacerbar la hipertensión rebote que puede acompañar a la retirada de la clonidina.
4.6 Fertilidad, embarazo y lactancia
Embarazo
COSOPT PF no se debe utilizar durante el embarazo.
Dorzolamida
No hay disponibles datos clínicos adecuados en embarazos expuestos. En conejos, dorzolamida produjo efectos teratogénicos a dosis maternotóxicas (ver sección 5.3).
Timolol
No hay datos adecuados para el uso de timolol en mujeres embarazadas. El timolol no debe ser usado durante el embarazo a menos de que sea claramente necesario. Para reducir la absorción sistémica, ver sección 4.2.
Los estudios epidemiológicos no han revelado efectos de malformación pero muestran un riesgo de retraso en el crecimiento intrauterino cuando se administran betabloqueantes por vía oral. Además, cuando los betabloqueantes han sido administrados hasta el parto se han observado en los neonatos los signos y síntomas de los betabloqueantes (p. ej. bradicardia, hipotensión, dificultad respiratoria e hipoglucemia). Si se administra este medicamento hasta el parto, el neonato debe ser cuidadosamente monitorizado durante los primeros días de vida.
Lactancia
Se desconoce si dorzolamida se excreta en la leche materna. En ratas lactantes a las que se les administraba dorzolamida, se apreció un descenso en la ganancia del peso vivo de la progenie. Los betabloqueantes se excretan en la leche materna. Sin embargo, a las dosis terapéuticas de timolol en colirio en solución no es probable que estuvieran presentes, en la leche materna, suficientes cantidades como para producir síntomas clínicos de betabloqueantes en lactantes. Para reducir la absorción sistémica, ver sección 4.2. No se recomienda la lactancia si se requiere el tratamiento con COSOPT PF.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Posibles efectos secundarios como visión borrosa pueden afectar a la capacidad de algunos pacientes para conducir y/o utilizar máquinas.
4.8 Reacciones adversas
En un ensayo clínico para COSOPT PF, las reacciones adversas observadas han sido consistentes con las notificadas previamente con COSOPT (formulación con conservante), dorzolamida hidrocloruro y/o timolol maleato.
pacientes fueron tratados con COSOPT (formulación con los pacientes interrumpieron el tratamiento con COSOPT
En el curso de los ensayos clínicos, 1.035 conservante). Alrededor del 2,4% de todos
ruu i
SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
(formulación con conservante) debido a reacciones adversas oculares locales y aproximadamente el 1,2% de todos los pacientes lo interrumpieron por reacciones adversas locales que sugerían la presencia de alergia o hipersensibilidad (como inflamación del párpado y conjuntivitis).
Se ha comprobado que COSOPT PF tiene un perfil de seguridad similar al de COSOPT (formulación con conservante) en un estudio comparativo con doble enmascaramiento y dosis repetidas.
Como otros medicamentos oftálmicos de aplicación tópica, timolol se absorbe en la circulación sistémica. Esto puede causar reacciones adversas similares a las que aparecen con agentes betabloqueantes sistémicos La incidencia de reacciones adversas sistémicas después de la administración oftálmica tópica es más baja que para la administración sistémica.
Las reacciones adversas siguientes han sido notificadas con COSOPT PF o uno de sus componentes, bien durante ensayos clínicos o durante la experiencia tras la comercialización:
[Muy frecuentes: (>1/10), Frecuentes: (>1/100, <1/10), Poco frecuentes: (>1/1.000, <1/100), Raras: (>1/10.000, <1/1.000) y Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)]
|
Clasificación de órganos del sistema (MedDRA) |
Formulación |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida* |
|
Trastornos del sistema inmunológico |
COSOPT PF |
signos y síntomas de reacciones alérgicas sistémicas, incluyendo angioedema, urticaria, prurito, erupción, anafilaxia | ||||
|
Colirio en solución de timolol maleato |
signos y síntomas de reacciones alérgicas, incluyendo angioedema, urticaria, erupción generalizada y localizada, anafilaxia |
prurito | ||||
|
Trastornos del metabolismo y de la nutrición |
Colirio en solución de timolol maleato |
hipoglucem ia | ||||
|
Trastornos |
Colirio en |
depresión* |
insomnio*, |
|
Clasificación de órganos del sistema (MedDRA) |
Formulación |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida* |
|
psiquiátricos |
solución de timolol maleato |
pesadillas*, pérdida de memoria | ||||
|
Trastornos del sistema nervioso |
Colirio en solución de dorzolamida hidrocloruro |
cefalea* |
mareos*, parestesia* | |||
|
Colirio en solución de timolol maleato |
cefalea* |
mareos*, síncope* |
parestesia*, aumento en los signos y síntomas de miastenia gravis, disminución de la libido*, accidente cerebrovascular *, isquemia cerebral | |||
|
Trastornos oculares |
COSOPT PF |
ardor y pinchazos |
inyección conjuntival, visión borrosa, erosión corneal, prurito ocular, lagrimeo | |||
|
Colirio en solución de dorzolamida hidrocloruro |
inflamación del párpado*, irritación del párpado* |
iridociclitis* |
irritación incluyendo enrojecimiento* , dolor*, costras en el párpado*, miopía transitoria (que se resuelve al suspender la terapia), edema corneal*, hipotonía ocular*, desprendimient o coroideo |
LITTCA ALDAD ota efe
|
Clasificación de órganos del sistema (MedDRA) |
Formulación |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida* |
|
(después de la cirugía de filtración)* | ||||||
|
Colirio en solución de timolol maleato |
signos y síntomas de irritación ocular incluyendo blefaritis*, queratitis*, disminución de la sensibilidad corneal, y ojos secos* |
trastornos visuales incluyendo cambios refractivos (debido al abandono de la terapia miótica en algunos casos)* |
ptosis, diplopía, desprendimient o coroideo después de la cirugía de filtración* (ver Advertencias y precauciones especiales de empleo 4.4) |
prurito, lagrimeo, enrojecimie nto, visión borrosa, erosión corneal | ||
|
Trastornos del oído y del laberinto |
Colirio en solución de timolol maleato |
tinnitus* | ||||
|
Trastornos cardiacos |
Colirio en solución de timolol maleato |
bradicardia* |
dolor torácico*, palpitación*, edema*, arritmia*, insuficiencia cardíaca congestiva*, parada cardiaca*, bloqueo cardiaco |
bloqueo auriculoven tricular, insuficienci a cardiaca | ||
|
Trastornos vasculares |
Colirio en solución de timolol maleato |
hipotensión*, claudicación, fenómeno de Raynaud*, manos y pies fríos* | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
COSOPTPF |
sinusitis |
respiración entrecortada, insuficiencia respiratoria, rinitis, raramente broncoespasmo | |||
|
Colirio en |
epistaxis* |
LITTCA ALDAD ota efe
|
Clasificación de órganos del sistema (MedDRA) |
Formulación |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida* |
|
solución de dorzolamida hidrocloruro | ||||||
|
Colirio en solución de timolol maleato |
disnea* |
broncoespasmo (predominante en pacientes con enfermedad broncoespástica pre-existente)*, insuficiencia respiratoria, tos* | ||||
|
Trastornos gastrointestin ales |
COSOPT PF |
disgeusia | ||||
|
Colirio en solución de dorzolamida hidrocloruro |
náuseas* |
irritación de garganta, boca seca* | ||||
|
Colirio en solución de timolol maleato |
náuseas*, dispepsia* |
diarrea, boca seca* |
disgeusia, dolor abdominal, vómitos | |||
|
Trastornos de la piel y del tejido subcutáneo |
COSOPT PF |
dermatitis de contacto, síndrome de Stevens-Johnso n, necrólisis epidérmica tóxica | ||||
|
Colirio en solución de dorzolamida hidrocloruro |
erupción* | |||||
|
Colirio en solución de timolol maleato |
alopecia*, erupción psoriasiforme o exacerbación de psoriasis* |
erupción cutánea | ||||
|
Trastornos musculoesque léticos y del tejido conjuntivo |
Colirio en solución de timolol maleato |
lupus eritematoso sistémico |
mialgia |
LITTCA ALDAD ota efe
|
Clasificación de órganos del sistema (MedDRA) |
Formulación |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida* |
|
Trastornos renales y urinarios |
COSOPT PF |
urolitiasis | ||||
|
Trastornos del aparato reproductor y de la mama |
Colirio en solución de timolol maleato |
enfermedad de Peyronie*, disminución de la líbido |
disfunción sexual | |||
|
Trastornos generales y alteraciones en el lugar de administració n |
Colirio en solución de dorzolamida hidrocloruro |
astenia/fatiga * | ||||
|
Colirio en solución de timolol maleato |
astenia/fatiga * |
*Estas reacciones adversas también se observaron con COSOPT (formulación con conservante) durante la experiencia tras la comercialización.
**Se han apreciado reacciones adversas adicionales con betabloqueantes oftálmicos y puede ocurrir posiblemente con COSOPT PF.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
No existen datos disponibles en el hombre acerca de la sobredosis por ingestión accidental o deliberada de COSOPT (formulación con conservante) o COSOPT PF.
Síntomas
Existen informes de sobredosis inadvertida con la solución oftálmica de timolol maleato que causaron efectos sistémicos semejantes a los observados con los agentes bloqueantes beta-adrenérgicos sistémicos, tales como mareo, cefalea, respiración entrecortada, bradicardia, broncoespasmo y parada cardiaca. Los signos y síntomas más comunes que se pueden esperar por sobredosis con dorzolamida son desequilibrio electrolítico, desarrollo de un estado acidótico y, posiblemente, efectos sobre el sistema nervioso central.
Solo se dispone de información limitada acerca de la sobredosis por ingestión accidental o deliberada de dorzolamida hidrocloruro en humanos. Se ha notificado somnolencia con la administración oral. Con la administración tópica se han notificado: náuseas, mareos, cefalea, fatiga, sueños anómalos y disfagia.
Tratamiento
El tratamiento debe ser sintomático y de soporte. Se deben monitorizar los niveles séricos de electrolitos (particularmente el potasio) y los niveles de pH sanguíneo. Los estudios han demostrado que timolol no se dializa fácilmente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados contra el glaucoma y mióticos, agentes betabloqueantes, timolol, combinaciones, código ATC: S01ED51
5.1.1 Mecanismo de acción
COSOPT PF consta de dos componentes: dorzolamida hidrocloruro y timolol maleato. Cada uno de estos dos componentes disminuye la presión intraocular elevada reduciendo la secreción de humor acuoso, aunque utilizando cada uno diferentes mecanismos de acción.
Dorzolamida hidrocloruro es un potente inhibidor de la anhidrasa carbónica II humana. La inhibición de la anhidrasa carbónica en los procesos ciliares de los ojos disminuye la secreción de humor acuoso, probablemente enlenteciendo la formación de iones bicarbonato con la subsiguiente reducción del transporte de sodio y fluido. Timolol maleato es un agente bloqueante no selectivo de los receptores beta-adrenérgicos. Por ahora, no está claramente establecido el mecanismo exacto de acción a través del cual timolol maleato reduce la presión intraocular, aunque un estudio con fluoresceína y estudios de tonografía indican que la acción predominante puede estar relacionada con una formación acuosa reducida. Sin embargo, también se ha observado en algunos estudios, un ligero incremento de la facilidad de flujo. El efecto combinado de estos dos agentes ocasiona una reducción adicional de la presión intraocular (PIO) en comparación con la administración de cualquiera de los componentes por separado.
Tras la administración tópica, COSOPT PF reduce la presión intraocular elevada, relacionada o no con glaucoma. El aumento de la presión intraocular es un factor de riesgo principal en la patogenia de las lesiones del nervio óptico y de la pérdida glaucomatosa del campo visual. Este medicamento reduce la presión intraocular sin los efectos secundarios más frecuentes de los mióticos, tales como ceguera nocturna, espasmos acomodativos y constricción pupilar.
5.1.2 Efectos farmacodinámicos
Efectos clínicos
Se llevaron a cabo ensayos clínicos de hasta 15 meses de duración para comparar el efecto sobre el descenso de la PIO de COSOPT (formulación con conservante) administrado 2 veces al día (por la mañana y al acostarse) con dosis de timolol al 0,5% y dorzolamida al 2,0% administrados individualmente y concomitantemente a pacientes con glaucoma o hipertensión ocular, para los que el tratamiento concomitante fue considerado adecuado en los ensayos. En los estudios fueron incluidos tanto pacientes no tratados como pacientes no controlados adecuadamente con monoterapia de timolol. Antes de su inclusión en el estudio, la mayoría de los pacientes habían sido tratados con monoterapia de betabloqueantes tópicos. En un análisis de los estudios combinados, el efecto de reducción de la PIO de COSOPT (formulación con conservante) administrado 2 veces al día fue superior que la monoterapia con dorzolamida al 2% administrado 3 veces al día o que la de timolol al 0,5% administrado 2 veces al día. El efecto de la reducción de la PIO de COSOPT (formulación con conservante) administrado 2 veces al día fue equivalente al del tratamiento concomitante con dorzolamida administrado 2 veces al día y timolol administrado 2 veces al día. El efecto de reducción de la PIO de COSOPT (formulación con conservante) administrado 2 veces al día fue demostrado cuando se determinó ésta a distintas horas a lo largo del día y este efecto se mantuvo durante la administración a largo plazo.
En un estudio doble enmascarado, paralelo y controlado con tratamiento activo en 261 pacientes con una presión intraocular elevada >22 mmHg en uno o en ambos ojos, COSOPT PF ejerció un efecto de
reducción de la PIO equivalente al de COSOPT (formulación con conservante). El perfil de seguridad de COSOPT PF fue similar al de COSOPT (formulación con conservante).
5.1.4 Población pediátrica
Se ha realizado un ensayo controlado de 3 meses de duración, con el objetivo primario de documentar la seguridad de la solución oftálmica de dorzolamida hidrocloruro 2% en niños menores de 6 años de edad.
En este estudio, 30 pacientes de entre 2 y 6 años, cuya presión intraocular no estaba adecuadamente controlada con la monoterapia con dorzolamida o timolol, recibieron COSOPT (formulación con conservante) en una fase abierta. No se ha establecido la eficacia en estos pacientes. En este pequeño grupo de pacientes, la administración de COSOPT (formulación con conservante) dos veces al día fue por lo general bien tolerada, 19 pacientes completaron el tratamiento y 11 lo interrumpieron por cirugía, un cambio de medicación u otras razones.
5.2 Propiedades farmacocinéticas
Dorzolamida hidrocloruro
A diferencia de los inhibidores de la anhidrasa carbónica orales, la administración tópica de dorzolamida hidrocloruro permite al principio activo ejercer su efecto directamente sobre los ojos a una dosis sustancialmente menor y, por lo tanto, con una menor exposición sistémica. En ensayos clínicos, esto se tradujo en una reducción de la PIO sin los trastornos acidobásicos ni las alteraciones electrolíticas características de los inhibidores de la anhidrasa carbónica orales.
Cuando se aplica tópicamente, la dorzolamida alcanza la circulación sistémica. Para evaluar la potencial inhibición sistémica de la anhidrasa carbónica (AC) tras la administración tópica, se determinaron la concentración del principio activo y de los metabolitos en el plasma y en los hematíes, y la inhibición de la anhidrasa carbónica en los hematíes. Durante la administración crónica, dorzolamida se acumula en los hematíes como resultado de la unión selectiva a la AC-II, mientras en el plasma se mantienen concentraciones extraordinariamente bajas del principio activo libre. El principio activo original forma un único metabolito N-desetilado, que inhibe la AC-II con menos potencia que el principio activo original, aunque también inhibe un isoenzima menos activo (AC-I). El metabolito se acumula también en los hematíes, donde se une principalmente a la AC-I. Dorzolamida se une moderadamente a las proteínas plasmáticas (aproximadamente el 33%). Dorzolamida se excreta inalterada principalmente por la orina; el metabolito también se excreta por la orina. Al finalizar la dosificación, dorzolamida se elimina de los hematíes de manera no lineal, dando lugar inicialmente a un rápido descenso de la concentración del principio activo, seguido de una fase de eliminación más lenta con una semivida de alrededor de cuatro meses.
Cuando dorzolamida se administró por vía oral para simular la máxima exposición sistémica tras una administración ocular tópica a largo plazo, el estado de equilibrio se alcanzó a las 13 semanas. En el estado de equilibrio, no existía virtualmente nada de principio activo libre o de metabolito en plasma; la inhibición de la AC en los hematíes fue menor que la que se suponía que era necesaria para conseguir un efecto farmacológico sobre la función renal o sobre la respiración. Tras la administración crónica de dorzolamida hidrocloruro tópica se observaron resultados farmacocinéticos semejantes. Sin embargo, algunos pacientes de edad avanzada con insuficiencia renal (CrCl estimado de 30-60 ml/min) presentaban concentraciones superiores de metabolito en los hematíes, aunque no se apreciaron diferencias importantes en la inhibición de la anhidrasa carbónica, ni los efectos secundarios sistémicos directamente atribuibles a este hallazgo fueron clínicamente significativos.
Timolol maleato
En un estudio de concentración plasmática del principio activo en seis sujetos, se determinó la exposición sistémica a timolol tras la administración tópica dos veces al día de solución oftálmica de timolol maleato al 0,5%. La concentración media del pico plasmático después de la aplicación de la mañana fue de 0,46 ng/ml y tras la dosificación de la tarde fue de 0,35 ng/ml.
3E
5.3 Datos preclínicos sobre seguridad
El perfil de seguridad ocular y sistémico de los distintos componentes está bien establecido.
Dorzolamida
Se observaron malformaciones de los cuerpos vertebrales, en conejos que recibieron dosis maternotóxicas de dorzolamida asociado con acidosis metabólica.
Timolol
Los estudios en animales no han mostrado efecto teratogénico.
Además, en animales tratados tópicamente con soluciones oftálmicas de dorzolamida hidrocloruro y de timolol maleato, no se apreciaron efectos secundarios oculares, ni tampoco en aquéllos a los que se administró concomitantemente dorzolamida hidrocloruro y timolol maleato. Los estudios in vivo e in vitro con cada uno de los componentes no revelaron un potencial mutagénico. Por lo tanto, a dosis terapéuticas de COSOPT PF, no cabe esperar riesgos significativos para la seguridad en el hombre.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidroxietil celulosa Manitol (E421)
Citrato de sodio (E331)
Hidróxido de sodio (E524) para ajustar pH Agua para preparaciones inyectables.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
No se debe usar COSOPT PF 15 días después de la primera apertura del sobre. Después de ese tiempo desechar los envases unidosis no utilizados.
Tras su uso desechar inmediatamente el envase unidosis abierto.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Se dispone de COSOPT PF en envases unidosis de polietileno de baja densidad de 0,2 ml acondicionados en un sobre de aluminio que contiene 15 envases unidosis.
Tamaños de envases:
30 envases unidosis de 0,2 ml (2 sobres con 15 envases)
60 envases unidosis de 0,2 ml (4 sobres con 15 envases)
120 envases unidosis de 0,2 ml (8 sobres con 15 envases)
]£
Nota: están disponibles distintas formas de los envases unidosis. Por favor, ver sección 6.6 para las instrucciones de uso y dibujos específicos de cada forma de envase.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones Ninguna especial.
Instrucciones de uso
Presentación 1
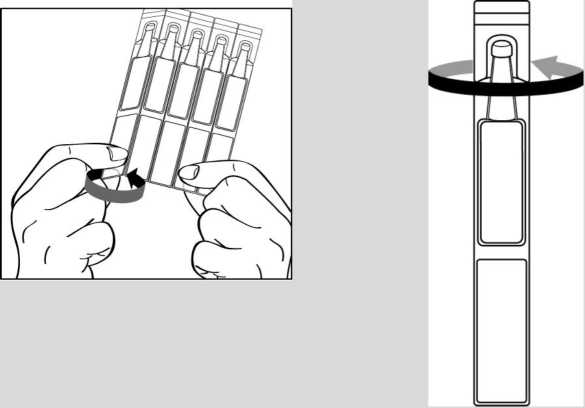
1. Abrir el sobre de aluminio que contiene 15 envases unidosis individuales. En cada sobre hay tres tiras de 5 envases unidosis. Escribir la fecha de la primera apertura en el sobre.
2. En primer lugar lávese las manos y luego separe un envase unidosis de la tira y abra la parte superior del envase unidosis girándola.
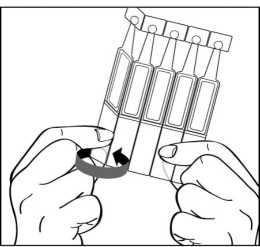
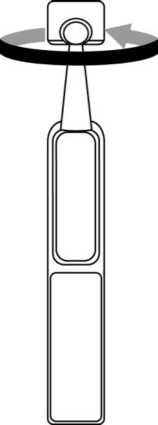
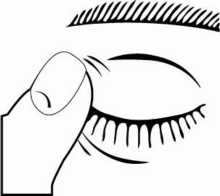
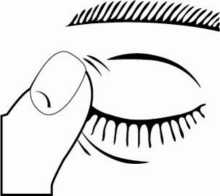
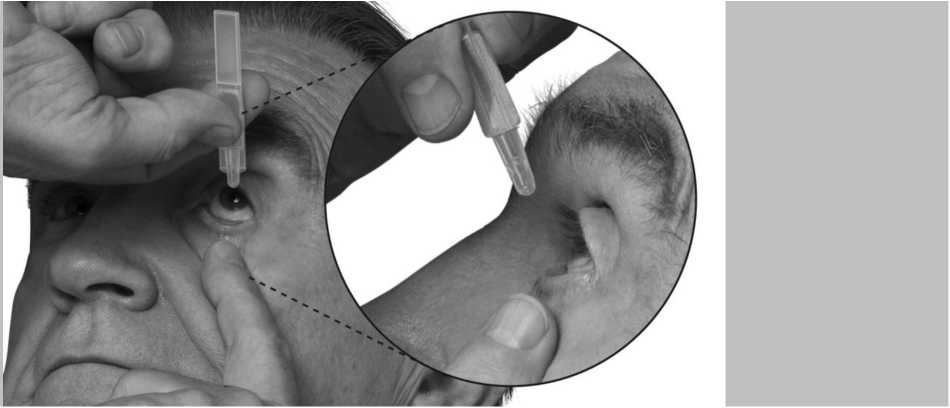
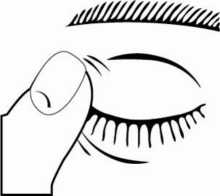
3. Incline la cabeza hacia atrás y separe el párpado inferior ligeramente, formando una pequeña
separación entre el párpado y el ojo, como muestra el siguiente dibujo. No permita que ninguna

Si no está seguro de cómo administrar su medicamento, consulte a su médico, farmacéutico o enfermero.
4. Deposite una gota en el ojo u ojos afectados de acuerdo con las instrucciones de su médico. No parpadee mientras deposita la gota en el ojo.
Cada envase unidosis contiene solución suficiente para los dos ojos.

5. Cuando se hace oclusión nasolacrimal o se cierran los párpados durante dos minutos, se reduce la absorción sistémica. Esto puede dar lugar a una disminución en las reacciones adversas sistémicas y a un aumento en la actividad local.
6. Después de haber depositado la gota en el ojo, tire el envase unidosis usado, incluso si todavía queda algo de medicamento, para evitar la contaminación de la solución sin conservante.
7. Guarde en el sobre de aluminio los envases restantes; debe utilizarlos en los 15 días siguientes a la apertura del sobre. Si después de 15 días todavía quedan envases en el sobre abierto, debe tirarlos de forma segura y abrir un sobre nuevo. Es importante continuar utilizando el colirio siguiendo las instrucciones de su médico.
Presentación 2
|
1. Abrir el sobre de aluminio que contiene 15 envases unidosis individuales. En cada sobre hay tres tiras | ||
|
de 5 envases unidosis. Escribir la fecha de la primera apertura en el sobre. | ||
|
2. |
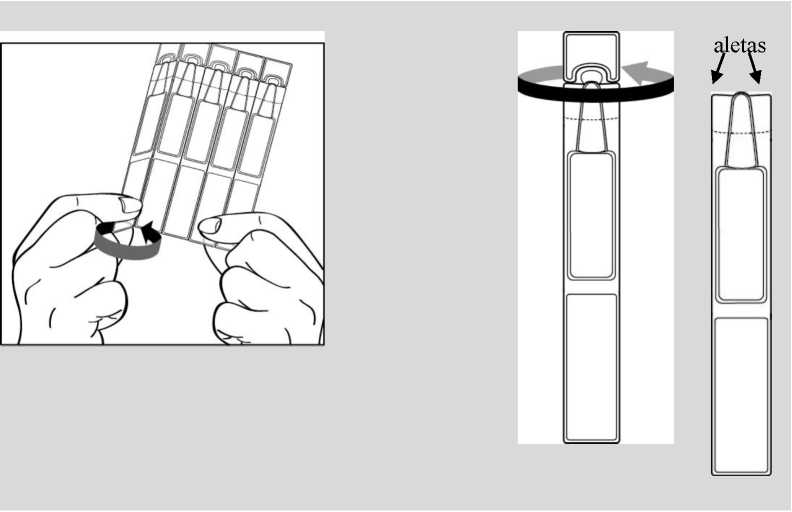
En primer lugar lávese las manos y luego separe un envase unidosis de la tira y abra la parte superior | |
|
del envase unidosis girándola. | ||
|
Por favor, tenga en cuenta que el envase unidosis abierto contiene unas “aletas” a ambos lados de la | ||
|
punta del envase, tal como se muestra en el dibujo de abajo: | ||
3. Sostener el envase unidosis de tal forma que las aletas que están a ambos lados del envase estén alineadas horizontalmente con los extremos de su ojo, tal como muestran los dibujos de abajo. Incline la cabeza hacia atrás y separe el párpado inferior ligeramente, formando una pequeña
separación entre el párpado y el ojo, tal como indican los dibujos. No permita que ninguna parte del envase toque los ojos o las zonas que los rodean.
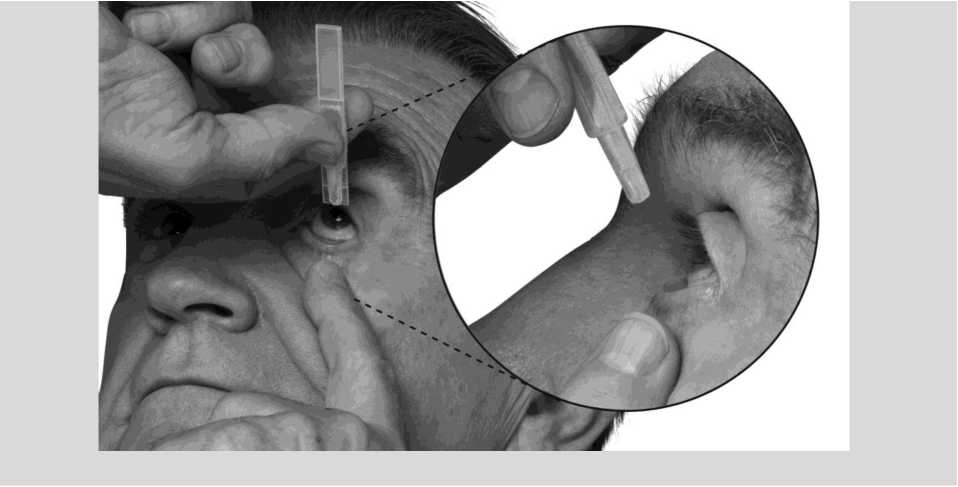
Si no está seguro de cómo administrar su medicamento, consulte a su médico, farmacéutico o fermero
|
4. Deposite una gota en el ojo u ojos afectados de acuerdo con las instrucciones de su médico. No | ||
|
parpadee mientras deposita la gota en el ojo. | ||
|
Cada envase unidosis contiene solución suficiente para los dos ojos. | ||
Cuando se hace oclusión nasolacrimal o se cierran los párpados durante dos minutos, se reduce la
5
absorción sistémica. Esto puede dar lugar a una disminución en las reacciones adversas sistémicas y a un aumento en la actividad local
6
Des
alg
spués de haber depositado la gota en el ojo, tire el envase unidosis usado, incluso si todavía queda o de medicamento, para evitar la contaminación de la solución sin conservante
Guarde en el sobre de aluminio los envases restantes; debe utilizarlos en los 15 días siguientes a la apertura del sobre. Si después de 15 días todavía quedan envases en el sobre abierto, debe tirarlos de forma segura y abrir un sobre nuevo. Es importante continuar utilizando el colirio siguiendo las instrucciones de su médico
Presentación 3
.HP.
1. Abrir el sobre de aluminio que contiene 15 envases unidosis individuales. En cada sobre hay tres tiras de 5 envases unidosis. Escribir la fecha de la primera apertura en el sobre.
ajcta^
|
2. En primer lugar lávese las manos y luego separe un envase unidosis de la tira y abra la parte superior | ||
|
del envase unidosis girándola. | ||
|
Por favor, tenga en cuenta que el envase unidosis abierto contiene unas “aletas” a ambos lados de la | ||
|
punta del envase, tal como se muestra en el dibujo de abajo: | ||
3. Sostener el envase unidosis de tal forma que las aletas que están a ambos lados del envase estén alineadas horizontalmente con los extremos de su ojo, tal como muestran los dibujos de abajo. Incline la cabeza hacia atrás y separe el párpado inferior ligeramente, formando una pequeña separación entre el párpado y el ojo, tal como indican los dibujos. No permita que ninguna parte del envase toque los ojos o las zonas que los rodean.
eSni
no está seguro de cómo administrar su medicamento, consulte a su médico, farmacéutico o fermero.
6. Después de haber depositado la gota en el ojo, tire el envase unidosis usado, incluso si todavía queda algo de medicamento, para evitar la contaminación de la solución sin conservante.
7. Guarde en el sobre de aluminio los envases restantes; debe utilizarlos en los 15 días siguientes a la apertura del sobre. Si después de 15 días todavía quedan envases en el sobre abierto, debe tirarlos de forma segura y abrir un sobre nuevo. Es importante continuar utilizando el colirio siguiendo las instrucciones de su médico.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
SANTEN OY Niittyhaankatu 20 FIN-33720- Tampere Finlandia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
73.508
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Julio 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
11/2014

¡y
taños
18 de 18