Cometriq 20mg+80mg Capsulas Duras
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
COMETRIQ 20 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg de cabozantinib. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura.
Las cápsulas duras son de color gris, con "XL 184 20mg" impreso en color negro en el cuerpo de la cápsula. Las cápsulas contienen un polvo de color blanco a blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
COMETRIQ está indicado para el tratamiento de pacientes adultos con carcinoma medular de tiroides progresivo, irresecable, localmente avanzado o metastásico.
Antes de adoptar una decisión de tratamiento individual, debe tenerse en cuenta la posibilidad de que los beneficios sean menores para los pacientes cuyo estado de mutación de RET (oncogén reorganizado durante la transfección) sea desconocido o negativo (ver información importante en las secciones 4.4 y 5.1).
4.2 Posología y forma de administración
El tratamiento con COMETRIQ debe iniciarse por un facultativo con experiencia en la administración de medicamentos antineoplásicos.
Posología
La dosis recomendada de COMETRIQ es 140 mg una vez al día, administrados en forma de una cápsula de color naranja de 80 mg y tres cápsulas grises de 20 mg. El tratamiento se mantendrá hasta que el paciente deje de beneficiarse clínicamente de la terapia o hasta que se produzcan niveles de toxicidad inaceptables.
Es de esperar que la mayoría de los pacientes tratados con COMETRIQ requiera uno o más ajustes de la dosis (reducción y/o interrupción) por motivos de toxicidad. Por lo tanto, los pacientes deben ser estrechamente monitorizados durante las primeras ocho semanas de terapia (ver la sección 4.4).
El tratamiento de las reacciones adversas sospechadas podría exigir la interrupción temporal o la reducción de la dosis de terapia de COMETRIQ, o ambas. Cuando sea necesario reducir la dosis, se recomienda hacerlo a 100 mg diarios, administrados en forma de una cápsula de color naranja de 80 mg y una cápsula gris de 20 mg, y posteriormente a 60 mg diarios, en forma de tres cápsulas grises de 20 mg.
Se recomienda la interrupción de la administración para tratar toxicidades de grado 3 según la clasificación CTCAE o superior, o toxicidades intolerables de grado 2.
Se recomienda reducir la dosis en casos de acontecimientos que, de persistir, podrían hacerse graves o intolerables.
Dado que la mayoría de los acontecimientos pueden manifestarse en fases tempranas del tratamiento, el facultativo debe evaluar al paciente cuidadosamente durante las primeras ocho semanas de tratamiento para determinar si está justificado modificar la dosis. Entre los acontecimientos que se manifiestan generalmente de forma precoz se incluyen: hipocalcemia, hipopotasemia, trombocitopenia, hipertensión, síndrome de eritrodisestesia palmo-plantar (EPP) y acontecimientos gastrointestinales (dolor abdominal o bucal, inflamación de mucosas, estreñimiento, diarrea, vómitos).
La aparición de algunas reacciones adversas graves (como fístula gastrointestinal) podría depender de la dosis acumulada y presentarse en una fase posterior del tratamiento.
Si un paciente olvida tomar una dosis, no debe tomar esa dosis si faltan menos de 12 horas antes de la siguiente dosis.
Medicamentos concomitantes
Se deben usar con precaución los medicamentos concomitantes que sean inhibidores potentes de CYP3A4. Se debe evitar el uso crónico concomitante de inductores potentes de CYP3A4 (ver secciones 4.4 y 4.5).
Se debe sopesar la selección de un medicamento concomitante cuyo potencial de inducción o inhibición de CYP3A4 sea bajo o nulo.
Pacientes de edad avanzada
No se recomienda un ajuste específico de la dosis de cabozantinib en pacientes de edad avanzada (> 65 años). Sin embargo, se ha observado una tendencia al incremento de acontecimientos adversos graves en pacientes mayores de 75 años.
Raza
Hay poca experiencia de uso de cabozantinib en pacientes no caucásicos.
Pacientes con insuficiencia renal
Cabozantinib se debe utilizar con precaución en pacientes con insuficiencia renal. Cabozantinib no está recomendado en pacientes con insuficiencia renal grave, ya que los datos disponibles sobre su utilización en este tipo de pacientes son limitados y no se ha establecido su seguridad y eficacia.
Pacientes con insuficiencia hepática
Cabozantinib no está recomendado en pacientes con insuficiencia hepática grave, ya que los datos disponibles sobre su utilización en este tipo de pacientes son limitados y no se ha establecido su seguridad y eficacia.
Pacientes con insuficiencia cardiaca
Los datos disponibles en pacientes con insuficiencia cardiaca son limitados. No es posible hacer recomendaciones de dosificación específicas.
Población pediátrica
La seguridad y la eficacia de cabozantinib en pacientes menores de 18 años no se han establecido aún. No hay datos disponibles al respecto.
Forma de administración
Las cápsulas se deben tragar enteras y sin abrir. Se deben dar instrucciones a los pacientes para que no ingieran ningún alimento durante al menos dos horas antes de tomar COMETRIQ y una hora después de hacerlo.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En el ensayo clínico pivotal, se produjeron reducciones de dosis e interrupciones de dosis en el 79 % y el 72 % de los pacientes tratados con cabozantinib respectivamente. El 41 % de los pacientes requirió dos reducciones de dosis. La mediana de tiempo hasta la primera reducción de dosis fue de 43 días y hasta la primera interrupción de dosis fue de 33 días. Por consiguiente, se recomienda monitorizar estrechamente a los pacientes durante las primeras ocho semanas de tratamiento (ver la sección 4.2).
Perforaciones, fístulas y abscesos intraabdominales
Se han observado perforaciones y fístulas gastrointestinales graves, en ocasiones mortales, así como de abscesos intraabdominales, con cabozantinib. Los pacientes sometidos recientemente a radioterapia, con enfermedad inflamatoria del intestino (p. ej., enfermedad de Crohn, colitis ulcerosa, peritonitis o diverticulitis), infiltración tumoral de tráquea, bronquios o esófago, complicaciones de intervenciones gastrointestinales anteriores (especialmente si están asociadas con el retraso de la cicatrización o una cicatrización incompleta), o complicaciones de la cavidad torácica (incluido el mediastino) por radioterapia anterior deben evaluarse cuidadosamente antes de iniciar la terapia con cabozantinib y ser monitorizados atentamente con posterioridad para detectar la aparición de síntomas de perforaciones y fístulas. Debe descartarse como corresponda la existencia de una fístula no gastrointestinal en caso de aparición de mucositis después del inicio del tratamiento. La administración de cabozantinib debe interrumpirse en pacientes que sufran una perforación gastrointestinal o una fístula gastrointestinal o no gastrointestinal.
Acontecimientos tromboembólicos
Se han observado eventos de tromboembolismo venoso y tromboembolismo arterial con cabozantinib. Cabozantinib se debe utilizar con precaución en pacientes con riesgo de este tipo de acontecimientos, o con una historia de ellos. Cabozantinib debe interrumpirse en pacientes que desarrollen infartos de miocardio agudos o cualquier otra complicación tromboembólica arterial clínicamente significativa.
Hemorragia
Se han observado casos de hemorragia con la utilización de cabozantinib. Los pacientes con indicios de afectación tumoral de la tráquea o los bronquios o con historia de hemoptisis previa al inicio del tratamiento deben evaluarse cuidadosamente antes de iniciar la terapia con cabozantinib. Cabozantinib no se debe administrar a pacientes con hemorragia grave o hemoptisis reciente.
Complicaciones de cicatrización
Se han observado complicaciones de cicatrización con cabozantinib. Si es posible, el tratamiento con cabozantinib se debe interrumpir como mínimo 28 días antes de la fecha de intervenciones quirúrgicas programadas. La decisión de reiniciar el tratamiento con cabozantinib después de la intervención debe basarse en la evaluación clínica de una cicatrización adecuada de la herida. La administración de cabozantinib se debe interrumpir en pacientes con complicaciones de cicatrización de las heridas que requieran intervención médica.
Hipertensión
Se han observado casos de hipertensión con cabozantinib. Todos los pacientes deben monitorizarse para detectar la aparición de hipertensión, que se tratará si es necesario con tratamiento antihipertensivo estándar. La dosis de cabozantinib debe reducirse en caso de hipertensión persistente pese al uso de antihipertensivos. La administración de cabozantinib se debe interrumpir en caso de hipertensión grave y persistente pese al uso de tratamiento antihipertensivo y reducción de la dosis de cabozantinib. La administración de cabozantinib se debe interrumpir en caso de crisis hipertensiva.
Osteonecrosis
Se han observado casos de osteonecrosis del maxilar (ONM) con cabozantinib. Antes de iniciar el tratamiento con cabozantinib, se debe realizar un examen oral, que debe repetirse periódicamente durante el tratamiento. Se deben proporcionar instrucciones sobre higiene oral a los pacientes. Si es posible, el tratamiento con cabozantinib debe suspenderse como mínimo 28 días antes de la fecha programada para procedimientos odontológicos invasivos. Se debe proceder con precaución en el caso de pacientes que reciban agentes asociados con la osteonecrosis del maxilar, como los bisfosfonatos. La administración de cabozantinib se debe interrumpir en pacientes que experimenten ONM.
Síndrome de eritrodisestesia palmo-plantar (SEPP)
Se han observado casos de síndrome de eritrodisestesia palmo-plantar con la utilización de cabozantinib. Si el SEPP es grave, debe considerarse la interrupción del tratamiento con cabozantinib. El tratamiento con cabozantinib debe reanudarse en la dosis más baja una vez que el SEPP se ha resuelto hasta grado 1.
Proteinuria
Se han observado casos de proteinuria con la utilización de cabozantinib. Los niveles de proteína en la orina se deben monitorizar con regularidad durante el tratamiento con cabozantinib. La administración de cabozantinib se debe interrumpir en pacientes que desarrollen síndrome nefrótico.
Síndrome de leucoencefalopatía posterior reversible
Se han observado casos de síndrome de leucoencefalopatía posterior reversible (SLPR), también conocido como síndrome de encefalopatía posterior reversible (SEPR), con la utilización de cabozantinib. El tratamiento con cabozantinib se debe interrumpir en pacientes con SLPR.
Prolongación del intervalo QT
Cabozantinib debe utilizarse con precaución en pacientes con antecedentes de prolongación del intervalo QT, pacientes que estén recibiendo antiarrítmicos y pacientes con cardiopatía relevante preexistente, bradicardia o trastornos electrolíticos. Cuando se utilice cabozantinib se debe sopesar la monitorización periódica de ECG en tratamiento y electrolitos (calcio, potasio y magnesio séricos). El tratamiento concomitante con inhibidores potentes de CYP3A4, que pueden incrementar las concentraciones plasmáticas de cabozantinib, debe hacerse con precaución.
Inductores e inhibidores de CYP3A4
Cabozantinib es un sustrato de CYP3A4. La coadministración de cabozantinib con ketoconazol, un potente inhibidor de CYP3A4, dio como resultado un incremento en la exposición plasmática de cabozantinib. Se debe proceder con precaución cuando cabozantinib se coadministre con agentes que sean inhibidores potentes de CYP3A4. La coadministración de cabozantinib con rifampicina, un potente inductor de CYP3A4, dio como resultado una reducción de la exposición plasmática de cabozantinib. Por consiguiente, debe evitarse la administración crónica de agentes que sean inductores potentes de CYP3A4 con cabozantinib (ver secciones 4.2 y 4.5).
Sustratos de la glicoproteína P
Cabozantinib fue inhibidor (IC50 = 7,0 pM), pero no sustrato, de las actividades de transporte de la glicoproteína P (Pgp) en un sistema de ensayo bidireccional con células MDCK-MDR1. Por consiguiente, cabozantinib puede tener el potencial de incrementar las concentraciones plasmáticas de sustratos de Pgp administrados de forma conjunta. Se debe prevenir a los pacientes acerca del uso de sustratos de Pgp (p. ej., fexofenadine, aliskiren, ambrisentán, dabigatrán etexilato, digoxina, colchicina, maraviroc, posaconazol, ranolazina, saxagliptina, sitagliptina, talinolol, tolvaptán) mientras reciban cabozantinib.
Inhibidores de MRP2
La administración de inhibidores de MRP2 puede provocar elevaciones de las concentraciones plasmáticas de cabozantinib. Por lo tanto, se debe tener precaución en la administración concomitante de inhibidores de MRP2 (como ciclosporina, efavirenz o emtricitabina).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efecto de otros medicamentos sobre cabozantinib
Inhibidores e inductores de CYP3A4
La administración de ketoconazol, inhibidor potente de CYP3A4, a voluntarios sanos (400 mg diarios durante 27 días) redujo el aclaramiento de cabozantinib (un 29%) e incrementó la exposición plasmática (AUC) de dosis únicas de cabozantinib un 38%. Por consiguiente, la administración conjunta de inhibidores potentes de CYP3A4 (p. ej., ritonavir, itraconazol, eritromicina, claritromicina, zumo de pomelo) y cabozantinib debe hacerse con precaución.
La administración de rifampicina, inductor potente de CYP3A4, a voluntarios sanos (600 mg diarios durante 31 días) incrementó el aclaramiento de cabozantinib (4,3 veces) y redujo la exposición plasmática (AUC) de dosis únicas de cabozantinib un 77%. Por consiguiente, se debe evitar la administración conjunta crónica de inductores potentes de CYP3A4 (p. ej., fenitoína, carbamazepina, rifampicina, fenobarbital o remedios naturales con hierba de San Juan [Hypericum perforatum]) con cabozantinib.
Agentes modificadores del pH gástrico
La administración conjunta del inhibidor de la bomba de protones (IBP) esomeprazol (40 mg diarios durante 6 días) con una dosis única de 100 mg de cabozantinib a voluntarios sanos no provocó ningún efecto clínicamente significativo sobre la exposición plasmática (AUC) de cabozantinib. No se indica ajuste de la dosis al administrar de forma conjunta agentes modificadores del pH gástrico (como IBPs, antagonistas de los receptores H2 y antiácidos) con cabozantinib.
Inhibidores de MRP2
Los datos de estudios in vitro demuestran que cabozantinib es un sustrato de MRP2. Por lo tanto, la administración de inhibidores de MRP2 puede provocar elevaciones de las concentraciones plasmáticas de cabozantinib.
Efecto de cabozantinib sobre otros medicamentos
No se ha investigado el efecto de cabozantinib sobre la farmacocinética de esteroides anticonceptivos. Dado que no puede garantizarse la invariabilidad del efecto anticonceptivo, se recomienda utilizar un método anticonceptivo adicional, como un método de barrera.
Sustratos de la glicoproteína P
Cabozantinib fue inhibidor (IC50 = 7,0 pM), pero no sustrato, de las actividades de transporte de Pgp en un sistema de ensayo bidireccional con células MDCK-MDR1. Por consiguiente, cabozantinib puede tener el potencial de incrementar las concentraciones plasmáticas de sustratos de Pgp administrados de forma conjunta. Se debe advertir a los pacientes acerca del uso de sustratos de Pgp (p. ej., fexofenadine, aliskiren, ambrisentán, dabigatrán etexilato, digoxina, colchicina, maraviroc, posaconazol, ranolazina, saxagliptina, sitagliptina, talinolol, tolvaptán) mientras reciban cabozantinib.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en hombres y mujeres
Se debe aconsejar a las mujeres en edad fértil que eviten quedarse embarazadas durante el tratamiento con cabozantinib. Igualmente, las parejas de sexo femenino de pacientes varones que reciban cabozantinib también deben evitar quedarse embarazadas. Tanto los pacientes de ambos sexos como sus parejas deben usar métodos anticonceptivos eficaces durante el tratamiento y, como mínimo, hasta cuatro meses después de completar el tratamiento. Dado que los anticonceptivos orales posiblemente no pueden considerarse “métodos anticonceptivos eficaces”, deben utilizarse junto con otro método, como un método de barrera (ver la sección 4.5).
Embarazo
No existen estudios de administración de cabozantinib a mujeres embarazadas. Los estudios en animales han demostrado la existencia de efectos embriofetales y teratogénicos (ver sección 5.3). Se desconoce el riesgo potencial para el ser humano. Cabozantinib no debe utilizarse durante el embarazo, a menos que la situación clínica de la paciente requiera su tratamiento con cabozantinib.
Lactancia
Se desconoce si cabozantinib y/o cualquiera de sus metabolitos se excretan en la leche materna. Debido al riesgo potencial para el lactante, las madres deben interrumpir la lactancia durante el tratamiento con cabozantinib y, como mínimo, hasta cuatro meses después de completar el tratamiento.
Fertilidad
No se dispone de datos sobre la fertilidad humana. Basándose en datos de seguridad no clínicos, el tratamiento con cabozantinib puede afectar a la fertilidad de ambos sexos (ver sección 5.3). Se debe aconsejar a los pacientes de ambos sexos que se asesoren y consideren la adopción de medidas de preservación de la fertilidad antes de iniciar el tratamiento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de cabozantinib sobre la capacidad para conducir y utilizar máquinas es pequeña. Se han asociado reacciones adversas como fatiga y debilidad con el tratamiento con cabozantinib. Por consiguiente, se debe recomendar precaución al conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas graves asociadas con cabozantinib más frecuentes son neumonía, inflamación de las mucosas, hipocalcemia, disfagia, deshidratación, embolismo pulmonar e hipertensión. Las reacciones adversas más frecuentes de cualquier grado (experimentadas al menos por el 20% de pacientes) fueron: diarrea, EPP, disminución de peso, disminución de apetito, náusea, fatiga, disgeusia, cambios en el color del pelo, hipertensión, estomatitis, estreñimiento, vómitos, inflamación de mucosas, astenia y disfonía.
Las anomalías de laboratorio más frecuentes fueron aumento de aspartato aminotransferasa (AST), aumento de alanina aminotransferasa (ALT), aumento de fosfatasa alcalina (ALP), linfocitopenia, hipocalcemia, neutrocitopenia, trombocitopenia, hipofosfatemia, hipoalbuminemia e hiperbilirrubinemia.
Tabla de reacciones adversas
Las reacciones adversas se recogen en la Tabla 1 según la clasificación de órganos del sistema MedDRA y su frecuencia. Las frecuencias se basan en todos los grados y su definición es la siguiente: muy frecuente (>1/10); frecuente (>1/100 a <1/10); poco frecuente (>1/1000 a <1/100). Las reacciones adversas se presentan por orden decreciente de gravedad dentro de cada grupo de frecuencia.
Tabla 1: reacciones adversas notificadas con cabozantinib
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Infecciones e infestaciones |
abscesos (viscerales, cutáneos, dentales), neumonía, foliculitis, infección fúngica (cutánea, oral, genital) |
aspergiloma | |
|
Trastornos endocrinos |
hipotiroidismo | ||
|
Trastornos del metabolismo y de la nutrición |
disminución del apetito, hipocalcemia, hipofosfatemia, hiperbilirrubinemia, hipoalbuminemia |
deshidratación | |
|
Trastornos psiquiátricos |
ansiedad, depresión, estado confusional |
sueños anormales, delirio | |
|
Trastornos del sistema nervioso |
disgeusia, cefalea, mareos |
neuropatía periférica, parestesia, ageusia, temblor |
ataxia, alteraciones de la atención, encefalopatía hepática, pérdida de conocimiento, alteración del habla, ataque isquémico transitorio, síndrome de encefalopatía posterior reversible |
|
Trastornos oculares |
visión borrosa |
catarata, conjuntivitis | |
|
Trastornos del oído y del laberinto |
dolor de oído, acúfenos |
hipoacusia | |
|
Trastornos cardiacos |
fibrilación auricular |
angina pectoris, taquicardia supraventricular | |
|
Trastornos vasculares |
hipertensión |
hipotensión, trombosis venosa, palidez, frío periférico |
trombosis arterial |
|
Trastornos respiratorios, torácicos y mediastínicos |
disfonía, dolor orofaríngeo |
fístula no gastrointestinal (tráquea, neumomediastino, traqueoesofágica), embolismo pulmonar, hemorragia del tracto respiratorio (pulmonar, bronquial, traqueal), neumonía por aspiración |
atelectasia, edema faríngeo, neumonitis |
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos gastrointestinales |
diarrea, náusea, estomatitis, estreñimiento, vómitos, dolor abdominal, disfagia, dispepsia, glosodinia |
perforación gastrointestinal, hemorragia gastrointestinal, pancreatitis, hemorroides, fisura anal, inflamación anal, queilitis |
fístula gastrointestinal, esofagitis |
|
Trastornos hepatobiliares |
colelitiasis | ||
|
Trastornos de la piel y del tejido subcutáneo |
síndrome de eritrodisestesia palmo-plantar, cambios de color del pelo, erupción cutánea, piel seca, alopecia, eritema |
hiperqueratosis, acné, ampolla, crecimiento del pelo anormal, exfoliación cutánea, hipopigmentación cutánea |
úlcera cutánea, telangiectasia |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
artralgia, espasmos musculares |
dolor torácico musculoesquelético, osteonecrosis del maxilar |
rabdomiolisis |
|
Trastornos renales y urinarios |
proteinuria, disuria, hematuria |
insuficiencia renal aguda | |
|
Trastornos del aparato reproductor y de la mama |
amenorrea, hemorragia vaginal | ||
|
Trastornos generales y alteraciones en el lugar de administración |
fatiga, inflamación de las mucosas, astenia |
alteración de la cicatrización de heridas, escalofríos, edema facial |
quiste, dolor facial, edema localizado |
|
Exploraciones complementarias |
disminución de peso, aumento de ALT, AST y ALP séricas, aumento de LDH sanguínea, aumento de TSH sanguínea, linfocitopenia, neutrocipenia, trombocitopenia |
aumento de creatinina fosfoquinasa en sangre, disminución del recuento de neutrófilos |
reducción del tiempo de tromboplastina parcial activada, aumento del recuento de eosinófilos, aumento del recuento de plaquetas |
Descripción de reacciones adversas seleccionadas
Se observó un valor de la hormona estimulante del tiroides (TSH) superior al normal después de la administración de la primera dosis en el 57% de pacientes receptores de cabozantinib, comparado al 19% en los pacientes receptores de placebo (independientemente de los valores basales). El 92% de pacientes del brazo de cabozantinib tenían una tiroidectomía previa y el 89% tomaban hormonas tiroideas antes de recibir la primera dosis.
En un ensayo clínico controlado en pacientes de cáncer se observó un incremento del intervalo QT (usando la corrección de Fridericia, QTcF) de 10-15 ms en el Día 29 (pero no en el Día 1) después del inicio del tratamiento con cabozantinib (a una dosis de 140 mg diarios). Este efecto no se asoció con cambios en la morfología de las ondas cardiacas ni con nuevos ritmos. Ningún paciente tratado con cabozantinib presentó un QTcF >500 ms.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V .
4.9 Sobredosis
No existe un tratamiento específico para la sobredosis de cabozantinib. No se han establecido los posibles síntomas de sobredosis.
En caso de sospecha de sobredosis, se suspenderá la administración de cabozantinib y se instaurará tratamiento de soporte. Los parámetros metabólicos de las pruebas clínicas de laboratorio deben supervisarse con una periodicidad semanal como mínimo, o la que se considere apropiada para evaluar cualquier posible tendencia de cambio. Las reacciones adversas asociadas con la sobredosis deben tratarse sintomáticamente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacéutico: agente antineoplásico, inhibidor de la proteinquinasa, código ATC: L01XE26 Mecanismo de acción
Cabozantinib es una pequeña molécula que inhibe varios receptores tirosina quinasa (RTK) implicados en el crecimiento tumoral y la angiogénesis, la remodelación ósea patológica y la progresión metastásica del cáncer. Se evaluó la actividad inhibitoria de cabozantinib con una serie de quinasas y se identificó como inhibidor de receptores de MET (proteína receptora del factor de crecimiento de hepatocitos) y VEGF (factor de crecimiento endotelial vascular). Asimismo, cabozantinib inhibe otras tirosina quinasas, como RET, el receptor específico de detención del crecimiento GAS6 (AXL), el receptor del factor de células madre (KIT) y la tirosina quinasa 3 tipo Fms (FLT3).
Efectos farmacodinámicos
Cabozantinib presentó inhibición del crecimiento tumoral relacionada con la dosis, regresión tumoral y/o inhibición de metástasis en una gran variedad de modelos de tumores preclínicos.
Se observó eficacia de cabozantinib en pacientes con cáncer medular de tiroides con RET de tipo salvaje o mutante.
Datos clínicos en cáncer medular de tiroides
Se realizó un ensayo multicéntrico, aleatorizado, doble ciego, de comparación de cabozantinib (N = 219) con placebo (N = 111) en pacientes con cáncer medular de tiroides (CMT) irresecable, localmente avanzado o metastásico y progresión de la enfermedad documentada radiográficamente en los 14 meses anteriores a la entrada en el ensayo. El objetivo principal del ensayo fue comparar la supervivencia libre de progresión (SLP) de los pacientes receptores de cabozantinib con la de los pacientes receptores de placebo. Los objetivos secundarios fueron comparar la tasa de respuesta global (TRG) y la supervivencia general (SG). Para la evaluación de la SLP y la TRG se utilizaron revisiones ciegas, centralizadas e independientes de los datos de imagen. Los pacientes recibieron tratamiento hasta la progresión de la enfermedad o hasta que se alcanzaron niveles de toxicidad inaceptables.
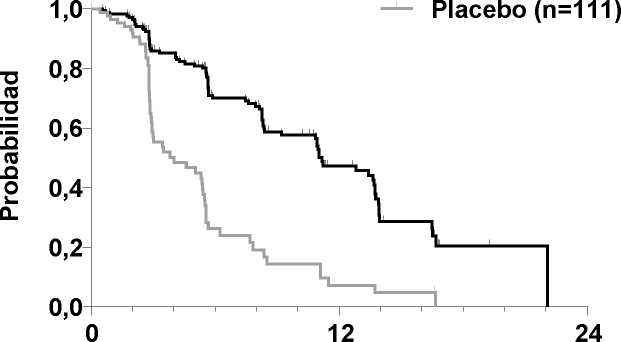
El resultado del análisis de la SLP, basado en la evaluación RECIST de la revisión centralizada, demostró la existencia de una diferencia estadísticamente significativa entre cabozantinib y placebo en la SLP, cuya mediana de duración fue de 11,2 meses en los sujetos del brazo de cabozantinib, frente a 4,0 meses en los sujetos del brazo de placebo ("hazard ratio" [HR] estratificado = 0,28;
IC 95%: 0,19, 0,40; p<0,0001; Figura 1). Los resultados de SLP fueron coherentes entre todos los subgrupos de línea basal y demográficos evaluados, incluidos los del tratamiento previo con
inhibidores de la tirosina quinasa (que podría haber consistido en agentes orientados a las vías asociadas con la antiangiogénesis), estado mutacional del RET (incluyendo a los sujetos con ausencia documentada de mutación del RET), estado previo en relación con tratamiento antineoplásico o radioterapia, o la existencia de metástasis óseas.
La TRG fue del 27,9% y el 0% en los pacientes de los brazos de cabozantinib y placebo, respectivamente (p<0,0001; Tabla 2). La mediana de la duración de las respuestas objetivas fue de 14,6 meses (IC 95%: 11,1, 17,5) para los pacientes del brazo de cabozantinib.
Un análisis administrativo parcial de la SG que incluyó el 75% del total de defunciones necesarias para el análisis final demostró una tendencia a la prolongación de la SG en el brazo de cabozantinib en comparación con el brazo de placebo: HR estratificado (IC 95%) 0,83 (0,60, 1,14); mediana (meses) 26,0 cabozantinib frente a 20,3 placebo.
Figura 1: Curva Kaplan Meier de supervivencia libre de progresión
Cometriq
Placebo
Cometriq (n=219)
Meses
|
Número de sujetos en riesgo | ||||||||
|
Meses |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
|
Cometriq |
219 |
121 |
78 |
55 |
31 |
12 |
2 |
1 |
|
Placebo |
111 |
35 |
11 |
6 |
3 |
2 |
0 |
0 |
Tabla 2: Resumen de principales resultados de eficacia
|
Cabozantinib |
Placebo | |
|
Mediana de la supervivencia libre de progresión |
11,2 meses |
4,0 meses |
|
HR: 0,28 (0,19, 0,40) p<0,0001 | ||
|
Mediana de supervivencia global |
26,0 meses |
20,3 meses |
|
HR: 0,83 (0,60, 1,14) | ||
|
Tasa de respuesta global3 (IC 95%) |
27,9% (21,9%, 34,5%) |
0% |
|
p<0,0001 | ||
|
Duración de la respuesta, mediana (IC 95%) |
14,6 meses (11,1, 17,5) |
No corresponde |
|
Tasa de control de la enfermedad b (IC 95%) |
55,3% (48,3%, 62,2%) |
13,5% (7,6%, 21,6%) |
|
Respuesta calcitoninaa |
47% (49/104)c |
3% (1/40)c |
|
Respuesta CEAa |
33% (47/143)c |
2% (1/55)c |
a Respuesta = RC + RP
b Tasa de control de la enfermedad = EE + TRG c Incluye a los pacientes evaluables en cuanto a la respuesta
Estado mutacional del RET
De los 215 sujetos de los que se disponía de datos suficientes para determinar el estado mutacional, el 78,6% (n=169) fueron clasificados como con mutación del RET positiva y el 21,4% (n=46) fueron clasificados como con mutación del RET negativa. En el caso de 115 sujetos adicionales, el estado mutacional del RET no se pudo determinar o no estaba claro. Los tres subgrupos demostraron un incremento de SLP en el brazo de cabozantinib, en comparación con el brazo de placebo (HR de 0,23, 0,53 y 0,30, para los grupos de mutación del RET positiva, negativa y desconocida, respectivamente). Las tasas de respuesta objetivas medidas en estos subgrupos fueron en general coherentes con los resultados de SLP. Los subgrupos de mutación del RET positiva, negativa y desconocida presentaron tasas de respuesta tumoral del 32%, 22% y 25%, respectivamente.
Análisis genéticos ulteriores mostraron que una pequeña proporción de pacientes albergaban mutaciones somáticas tumorales en HRAS, KRAS o NRAS. Estos pacientes (n=16) mostraron una prolongación significativa de la SLP (HR de 0,15) y una tasa de respuesta objetiva del 31%. Los pacientes con mutación del RET negativa sin evidencia de mutación RAS (n=33) mostraron una reducción del beneficio en la SLP con cabozantinib (HR de 0,87) y una tasa de respuesta más baja, del 18%, en comparación con otros subgrupos mutacionales.
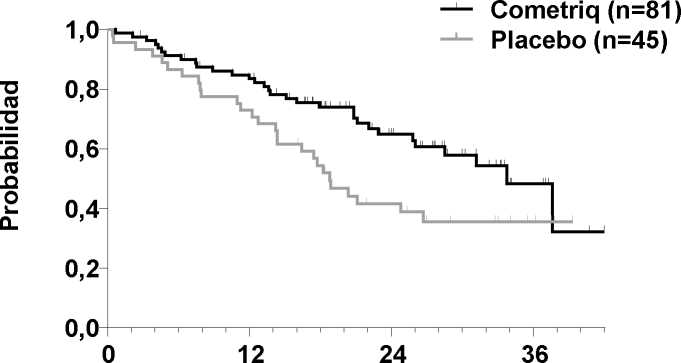
Solo se ha demostrado una relación entre la SLP y una mejora importante de la SG (HR de 0,53, p=0,0179) en el subgrupo de mutación del RET M918T positiva (n=81/219 grupo de cabozantinib). Aún no se ha analizado la SG en otros subgrupos con mutación del RET y/o RAS.
Figura 2. Análisis de la SG de Kaplan-Meier entre sujetos con una mutación del RET M918T
Meses
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con cabozantinib en uno o más subgrupos de la población pediátrica en el tratamiento de tumores malignos sólidos (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
Este medicamento se ha autorizado con una «aprobación condicional».
Esta modalidad de aprobación significa que se espera obtener más información sobre este medicamento.
La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año y esta Ficha Técnica o Resumen de las Características del Producto (RCP) se actualizará cuando sea necesario.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de cabozantinib, las concentraciones plasmáticas máximas de cabozantinib se alcanzan entre 2 y 5 horas después de dicha administración.
La dosificación diaria repetida con 140 mg de cabozantinib durante 19 días dio como resultado una acumulación media de cabozantinib (basada en el AUC) aproximadamente 4 a 5 veces superior a la administración de una dosis única. El estado estacionario se alcanza aproximadamente el Día 15.
Una comida con alto contenido graso incrementó moderadamente los valores de Cmáx y AUC (41% y 57%, respectivamente) con respecto a las condiciones de ayuno en voluntarios sanos a los que se administró una dosis única de 140 mg de cabozantinib oral. No se dispone de información sobre el efecto exacto de los alimentos cuando se ingieren una hora después de la administración de cabozantinib.
Distribución
Cabozantinib presenta una elevada unión a proteínas en el plasma humano in vitro (> 99,7%). Basándose en el modelo farmacocinético (PK) poblacional, el volumen de distribución (V/F) es de aproximadamente 349 l (SE: ± 2,73%).
Biotransformación
Cabozantinib se metabolizó in vivo. Hubo cuatro metabolitos presentes en el plasma a exposiciones (AUC) superiores al 10% de la molécula original: N-óxido de XL184, producto de degradación
XL184 amida, monohidroxi sulfato de XL184, y sulfato de producto de degradación 6-desmetil amida. Dos metabolitos no conjugados (N-óxido de XL184 y producto de degradación XL184 amida), que poseen <1% de la potencia de inhibición de la quinasa objetivo del cabozantinib original, representan cada uno de ellos <10% de la exposición plasmática total relacionada con el fármaco.
Cabozantinib es un sustrato para el metabolismo de CYP3A4 in vitro, puesto que un anticuerpo neutralizador de CYP3A4 inhibió la formación del metabolito N-óxido de XL184 en >80% en una incubación con microsomas de hígado humano (HLM) catalizada por NADPH. Como contraste, los anticuerpos neutralizadores de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 y CYP2E1 no tuvieron efecto alguno en la formación de metabolitos de cabozantinib. Un anticuerpo neutralizador de CYP2C9 demostró un efecto mínimo sobre la formación de metabolitos de cabozantinib (es decir, una reducción <20%).
Eliminación
La semivida plasmática terminal de cabozantinib en estudios de dosis única en voluntarios sanos es de aproximadamente 120 horas. En un análisis farmacocinético poblacional, se calculó que el aclaramiento medio (CL/F) en estado estacionario en pacientes de cáncer era de 4,4 l/h. En un periodo de recogida de 48 días tras una sola dosis de cabozantinib-14C en voluntarios sanos, se recuperó aproximadamente el 81% del total de radiactividad administrado, siendo el 54% en heces y el 27% en orina.
Farmacocinética en poblaciones de pacientes especiales
Insuficiencia renal
No es posible excluir diferencias en la farmacocinética en pacientes con insuficiencia renal, puesto que aún no se dispone de datos sobre esta población.
Insuficiencia hepática
No es posible excluir diferencias en la farmacocinética en pacientes con insuficiencia hepática, puesto que aún no se dispone de datos sobre esta población.
Raza
No se dispone de datos que permitan determinar diferencias farmacocinéticas basadas en la raza.
5.3 Datos preclínicos sobre seguridad
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales con niveles de exposición similares a los clínicos y con posible repercusión en el uso clínico fueron las siguientes:
En estudios de toxicidad de hasta seis meses de duración con dosis repetidas en la rata y en el perro, los órganos diana de la toxicidad fueron: el tracto gastrointestinal, la médula ósea, los tejidos linfoides, el riñón y los tejidos adrenales y del aparato reproductor. El nivel sin efecto adverso observable (NOAEL) de estos hallazgos se situó por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
En una serie de pruebas de genotoxicidad, cabozantinib no mostró potencial mutagénico ni clastogénico. Aún no se han realizado estudios de carcinogénesis.
Los estudios de fertilidad en ratas han mostrado una reducción de la fertilidad en machos y hembras. Asimismo, se ha observado hipoespermatogénesis en el perro por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
Se han realizado estudios de desarrollo embriofetal en ratas y conejos. En la rata, cabozantinib provocó pérdidas postimplantación, edema fetal, paladar hendido/labio leporino, aplasia cutánea y cola deforme o rudimentaria. En el conejo, cabozantinib provocó cambios en los tejidos blandos del feto (reducción del tamaño del bazo, lóbulo medio del pulmón de tamaño reducido o ausente) y un incremento de la incidencia fetal de malformaciones totales. Los NOAEL de los resultados de
toxicidad embriofetal y teratogénica se situaron por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
Las ratas jóvenes (comparables a una población pediátrica >2 años) que recibieron cabozantinib presentaron un aumento de los valores de leucocitos, una disminución de la hematopoyesis, sistema reproductor femenino puberal/inmaduro (sin retraso de la abertura vaginal), anomalías dentales, disminución de la densidad ósea y del contenido mineral óseo, pigmentación hepática e hiperplasia de los conductos biliares. Las manifestaciones en el útero/los ovarios y la disminución de la hematopoyesis fueron aparentemente pasajeras, mientras que los efectos sobre los parámetros óseos y la pigmentación hepática se mantuvieron. No se han realizado evaluaciones en ratas jóvenes (comparables a una población pediátrica <2 años).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula Celulosa microcristalina Croscarmelosa sódica Almidón glicolato sódico Sílice coloidal anhidro Ácido esteárico
Cubierta de la cápsula:
Gelatina
Óxido de hierro negro (E172)
Dióxido de titanio (E171)
Tinta de impresión:
Laca Shellac
Óxido de hierro negro (E172)
Propilenglicol
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperaturas superiores a 25 °C.
Conservar en el embalaje original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Blísters de PVC/PE/PCTFE-Al con una lámina de aluminio en la parte posterior, sellados en un acondicionamiento exterior de cartón termosellado.
Las tiras de blísters contienen:
21 cápsulas de 20 mg (dosis de 60 mg/día para 7 días)
Envase para 28 días que contiene:
84 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg) (dosis de 60 mg/día para 28 días)
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
TMC Pharma Services Ltd.
Lodge Farm Barn Elvetham Park Estate Fleet Road Hartley Wintney Hampshire RG27 8AS Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/890/001 21 cápsulas de 20 mg (dosis de 60 mg/día para 7 días)
EU/1/13/890/004 84 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg) (dosis de 60 mg/día
para 28 días)
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 de marzo de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene (ó)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib. Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura.
Las cápsulas duras son de color gris, con "XL 184 20mg" impreso en color negro en el cuerpo de la cápsula. Las cápsulas contienen un polvo de color blanco a blanquecino.
Las cápsulas duras son de color naranja, con "XL 184 80mg" impreso en color negro en el cuerpo de la cápsula. Las cápsulas contienen un polvo de color blanco a blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
COMETRIQ está indicado para el tratamiento de pacientes adultos con carcinoma medular de tiroides progresivo, irresecable, localmente avanzado o metastásico.
Antes de adoptar una decisión de tratamiento individual, debe tenerse en cuenta la posibilidad de que los beneficios sean menores para los pacientes cuyo estado de mutación de RET (oncogén reorganizado durante la transfección) sea desconocido o negativo (ver información importante en las secciones 4.4 y 5.1).
4.2 Posología y forma de administración
El tratamiento con COMETRIQ debe iniciarse por un facultativo con experiencia en la administración de medicamentos antineoplásicos.
Posología
La dosis recomendada de COMETRIQ es 140 mg una vez al día, administrados en forma de una cápsula de color naranja de 80 mg y tres cápsulas grises de 20 mg. El tratamiento se mantendrá hasta que el paciente deje de beneficiarse clínicamente de la terapia o hasta que se produzcan niveles de toxicidad inaceptables.
Es de esperar que la mayoría de los pacientes tratados con COMETRIQ requiera uno o más ajustes de la dosis (reducción y/o interrupción) por motivos de toxicidad. Por lo tanto, los pacientes deben ser estrechamente monitorizados durante las primeras ocho semanas de terapia (ver la sección 4.4).
El tratamiento de las reacciones adversas sospechadas podría exigir la interrupción temporal o la reducción de la dosis de terapia de COMETRIQ, o ambas. Cuando sea necesario reducir la dosis, se recomienda hacerlo a 100 mg diarios, administrados en forma de una cápsula de color naranja de 80 mg y una cápsula gris de 20 mg, y posteriormente a 60 mg diarios, en forma de tres cápsulas grises de 20 mg.
Se recomienda la interrupción de la administración para tratar toxicidades de grado 3 según la clasificación CTCAE o superior, o toxicidades intolerables de grado 2.
Se recomienda reducir la dosis en casos de acontecimientos que, de persistir, podrían hacerse graves o intolerables.
Dado que la mayoría de los acontecimientos pueden manifestarse en fases tempranas del tratamiento, el facultativo debe evaluar al paciente cuidadosamente durante las primeras ocho semanas de tratamiento para determinar si está justificado modificar la dosis. Entre los acontecimientos que se manifiestan generalmente de forma precoz se incluyen: hipocalcemia, hipopotasemia, trombocitopenia, hipertensión, síndrome de eritrodisestesia palmo-plantar (EPP) y acontecimientos gastrointestinales (dolor abdominal o bucal, inflamación de mucosas, estreñimiento, diarrea, vómitos).
La aparición de algunas reacciones adversas graves (como fístula gastrointestinal) podría depender de la dosis acumulada y presentarse en una fase posterior del tratamiento.
Si un paciente olvida tomar una dosis, no debe tomar esa dosis si faltan menos de 12 horas antes de la siguiente dosis.
Medicamentos concomitantes
Se deben usar con precaución los medicamentos concomitantes que sean inhibidores potentes de CYP3A4. Se debe evitar el uso crónico concomitante de inductores potentes de CYP3A4 (ver secciones 4.4 y 4.5).
Se debe sopesar la selección de un medicamento concomitante cuyo potencial de inducción o inhibición de CYP3A4 sea bajo o nulo.
Pacientes de edad avanzada
No se recomienda un ajuste específico de la dosis de cabozantinib en pacientes de edad avanzada (> 65 años). Sin embargo, se ha observado una tendencia al incremento de acontecimientos adversos graves en pacientes mayores de 75 años.
Raza
Hay poca experiencia de uso de cabozantinib en pacientes no caucásicos.
Pacientes con insuficiencia renal
Cabozantinib se debe utilizar con precaución en pacientes con insuficiencia renal. Cabozantinib no está recomendado en pacientes con insuficiencia renal grave, ya que los datos disponibles sobre su utilización en este tipo de pacientes son limitados y no se ha establecido su seguridad y eficacia.
Pacientes con insuficiencia hepática
Cabozantinib no está recomendado en pacientes con insuficiencia hepática grave, ya que los datos disponibles sobre su utilización en este tipo de pacientes son limitados y no se ha establecido su seguridad y eficacia.
Pacientes con insuficiencia cardiaca
Los datos disponibles en pacientes con insuficiencia cardiaca son limitados. No es posible hacer recomendaciones de dosificación específicas.
Población _ pediátrica
La seguridad y la eficacia de cabozantinib en pacientes menores de 18 años no se han establecido aún. No hay datos disponibles al respecto.
Forma de administración
Las cápsulas se deben tragar enteras y sin abrir. Se deben dar instrucciones a los pacientes para que no ingieran ningún alimento durante al menos dos horas antes de tomar COMETRIQ y una hora después de hacerlo.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En el ensayo clínico pivotal, se produjeron reducciones de dosis e interrupciones de dosis en el 79 % y el 72 % de los pacientes tratados con cabozantinib respectivamente. El 41 % de los pacientes requirió dos reducciones de dosis. La mediana de tiempo hasta la primera reducción de dosis fue de 43 días y hasta la primera interrupción de dosis fue de 33 días. Por consiguiente, se recomienda monitorizar estrechamente a los pacientes durante las primeras ocho semanas de tratamiento (ver la sección 4.2)
Perforaciones, fístulas y abscesos intraabdominales
Se han observado perforaciones y fístulas gastrointestinales graves, en ocasiones mortales, así como de abscesos intraabdominales, con cabozantinib. Los pacientes sometidos recientemente a radioterapia, con enfermedad inflamatoria del intestino (p. ej., enfermedad de Crohn, colitis ulcerosa, peritonitis o diverticulitis), infiltración tumoral de tráquea, bronquios o esófago, complicaciones de intervenciones gastrointestinales anteriores (especialmente si están asociadas con el retraso de la cicatrización o una cicatrización incompleta), o complicaciones de la cavidad torácica (incluido el mediastino) por radioterapia anterior deben evaluarse cuidadosamente antes de iniciar la terapia con cabozantinib y ser monitorizados atentamente con posterioridad para detectar la aparición de síntomas de perforaciones y fístulas. Debe descartarse como corresponda la existencia de una fístula no gastrointestinal en caso de aparición de mucositis después del inicio del tratamiento. La administración de cabozantinib debe interrumpirse en pacientes que sufran una perforación gastrointestinal o una fístula gastrointestinal o no gastrointestinal.
Acontecimientos tromboembólicos
Se han observado eventos de tromboembolismo venoso y tromboembolismo arterial con cabozantinib. Cabozantinib se debe utilizar con precaución en pacientes con riesgo de este tipo de acontecimientos, o con una historia de ellos. Cabozantinib debe interrumpirse en pacientes que desarrollen infartos de miocardio agudos o cualquier otra complicación tromboembólica arterial clínicamente significativa.
Hemorragia
Se han observado casos de hemorragia con la utilización de cabozantinib. Los pacientes con indicios de afectación tumoral de la tráquea o los bronquios o con historia de hemoptisis previa al inicio del tratamiento deben evaluarse cuidadosamente antes de iniciar la terapia con cabozantinib. Cabozantinib no se debe administrar a pacientes con hemorragia grave o hemoptisis reciente.
Complicaciones de cicatrización
Se han observado complicaciones de cicatrización con cabozantinib. Si es posible, el tratamiento con cabozantinib se debe interrumpir como mínimo 28 días antes de la fecha de intervenciones quirúrgicas programadas. La decisión de reiniciar el tratamiento con cabozantinib después de la intervención debe basarse en la evaluación clínica de una cicatrización adecuada de la herida. La administración de cabozantinib se debe interrumpir en pacientes con complicaciones de cicatrización de las heridas que requieran intervención médica.
Hipertensión
Se han observado casos de hipertensión con cabozantinib. Todos los pacientes deben monitorizarse para detectar la aparición de hipertensión, que se tratará si es necesario con tratamiento antihipertensivo estándar. La dosis de cabozantinib debe reducirse en caso de hipertensión persistente pese al uso de antihipertensivos. La administración de cabozantinib se debe interrumpir en caso de hipertensión grave y persistente pese al uso de tratamiento antihipertensivo y reducción de la dosis de cabozantinib. La administración de cabozantinib se debe interrumpir en caso de crisis hipertensiva.
Osteonecrosis
Se han observado casos de osteonecrosis del maxilar (ONM) con cabozantinib. Antes de iniciar el tratamiento con cabozantinib, se debe realizar un examen oral, que debe repetirse periódicamente durante el tratamiento. Se deben proporcionar instrucciones sobre higiene oral a los pacientes. Si es posible, el tratamiento con cabozantinib debe suspenderse como mínimo 28 días antes de la fecha programada para procedimientos odontológicos invasivos. Se debe proceder con precaución en el caso de pacientes que reciban agentes asociados con la osteonecrosis del maxilar, como los bisfosfonatos. La administración de cabozantinib se debe interrumpir en pacientes que experimenten ONM.
Síndrome de eritrodisestesia palmo-plantar (SEPP)
Se han observado casos de síndrome de eritrodisestesia palmo-plantar con la utilización de cabozantinib. Si el SEPP es grave, debe considerarse la interrupción del tratamiento con cabozantinib. El tratamiento con cabozantinib debe reanudarse en la dosis más baja una vez que el SEPP se ha resuelto hasta grado 1.
Proteinuria
Se han observado casos de proteinuria con la utilización de cabozantinib. Los niveles de proteína en la orina se deben monitorizar con regularidad durante el tratamiento con cabozantinib. La administración de cabozantinib se debe interrumpir en pacientes que desarrollen síndrome nefrótico.
Síndrome de leucoencefalopatía posterior reversible
Se han observado casos de síndrome de leucoencefalopatía posterior reversible (SLPR), también conocido como síndrome de encefalopatía posterior reversible (SEPR), con la utilización de cabozantinib. El tratamiento con cabozantinib se debe interrumpir en pacientes con SLPR.
Prolongación del intervalo QT
Cabozantinib debe utilizarse con precaución en pacientes con antecedentes de prolongación del intervalo QT, pacientes que estén recibiendo antiarrítmicos y pacientes con cardiopatía relevante preexistente, bradicardia o trastornos electrolíticos. Cuando se utilice cabozantinib se debe sopesar la monitorización periódica de ECG en tratamiento y electrolitos (calcio, potasio y magnesio séricos). El tratamiento concomitante con inhibidores potentes de CYP3A4, que pueden incrementar las concentraciones plasmáticas de cabozantinib, debe hacerse con precaución.
Inductores e inhibidores de CYP3A4
Cabozantinib es un sustrato de CYP3A4. La coadministración de cabozantinib con ketoconazol, un potente inhibidor de CYP3A4, dio como resultado un incremento en la exposición plasmática de cabozantinib. Se debe proceder con precaución cuando cabozantinib se coadministre con agentes que sean inhibidores potentes de CYP3A4. La coadministración de cabozantinib con rifampicina, un potente inductor de CYP3A4, dio como resultado una reducción de la exposición plasmática de cabozantinib. Por consiguiente, debe evitarse la administración crónica de agentes que sean inductores potentes de CYP3A4 con cabozantinib (ver secciones 4.2 y 4.5).
Sustratos de la glicoproteína P
Cabozantinib fue inhibidor (IC50 = 7,0 p,M), pero no sustrato, de las actividades de transporte de la glicoproteína P (Pgp) en un sistema de ensayo bidireccional con células MDCK-MDR1. Por consiguiente, cabozantinib puede tener el potencial de incrementar las concentraciones plasmáticas de sustratos de Pgp administrados de forma conjunta. Se debe prevenir a los pacientes acerca del uso de sustratos de Pgp (p. ej., fexofenadine, aliskiren, ambrisentán, dabigatrán etexilato, digoxina,
colchicina, maraviroc, posaconazol, ranolazina, saxagliptina, sitagliptina, talinolol, tolvaptán) mientras reciban cabozantinib.
Inhibidores de MRP2
La administración de inhibidores de MRP2 puede provocar elevaciones de las concentraciones plasmáticas de cabozantinib. Por lo tanto, se debe tener precaución en la administración concomitante de inhibidores de MRP2 (como ciclosporina, efavirenz o emtricitabina).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efecto de otros medicamentos sobre cabozantinib
Inhibidores e inductores de CYP3A4
La administración de ketoconazol, inhibidor potente de CYP3A4, a voluntarios sanos (400 mg diarios durante 27 días) redujo el aclaramiento de cabozantinib (un 29%) e incrementó la exposición plasmática (AUC) de dosis únicas de cabozantinib un 38%. Por consiguiente, la administración conjunta de inhibidores potentes de CYP3A4 (p. ej., ritonavir, itraconazol, eritromicina, claritromicina, zumo de pomelo) y cabozantinib debe hacerse con precaución.
La administración de rifampicina, inductor potente de CYP3A4, a voluntarios sanos (600 mg diarios durante 31 días) incrementó el aclaramiento de cabozantinib (4,3 veces) y redujo la exposición plasmática (AUC) de dosis únicas de cabozantinib un 77%. Por consiguiente, se debe evitar la administración conjunta crónica de inductores potentes de CYP3A4 (p. ej., fenitoína, carbamazepina, rifampicina, fenobarbital o remedios naturales con hierba de San Juan [Hypericum perforatum]) con cabozantinib.
Agentes modificadores del pH gástrico
La administración conjunta del inhibidor de la bomba de protones (IBP) esomeprazol (40 mg diarios durante 6 días) con una dosis única de 100 mg de cabozantinib a voluntarios sanos no provocó ningún efecto clínicamente significativo sobre la exposición plasmática (AUC) de cabozantinib. No se indica ajuste de la dosis al administrar de forma conjunta agentes modificadores del pH gástrico (como IBPs, antagonistas de los receptores H2 y antiácidos) con cabozantinib.
Inhibidores de MRP2
Los datos de estudios in vitro demuestran que cabozantinib es un sustrato de MRP2. Por lo tanto, la administración de inhibidores de MRP2 puede provocar elevaciones de las concentraciones plasmáticas de cabozantinib.
Efecto de cabozantinib sobre otros medicamentos
No se ha investigado el efecto de cabozantinib sobre la farmacocinética de esteroides anticonceptivos. Dado que no puede garantizarse la invariabilidad del efecto anticonceptivo, se recomienda utilizar un método anticonceptivo adicional, como un método de barrera
Sustratos de la glicoproteína P
Cabozantinib fue inhibidor (IC50 = 7,0 pM), pero no sustrato, de las actividades de transporte de Pgp en un sistema de ensayo bidireccional con células MDCK-MDR1. Por consiguiente, cabozantinib puede tener el potencial de incrementar las concentraciones plasmáticas de sustratos de Pgp administrados de forma conjunta. Se debe advertir a los pacientes acerca del uso de sustratos de Pgp (p. ej., fexofenadine, aliskiren, ambrisentán, dabigatrán etexilato, digoxina, colchicina, maraviroc, posaconazol, ranolazina, saxagliptina, sitagliptina, talinolol, tolvaptán) mientras reciban cabozantinib.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción en hombres y mujeres
Se debe aconsejar a las mujeres en edad fértil que eviten quedarse embarazadas durante el tratamiento con cabozantinib. Igualmente, las parejas de sexo femenino de pacientes varones que reciban cabozantinib también deben evitar quedarse embarazadas. Tanto los pacientes de ambos sexos como sus parejas deben usar métodos anticonceptivos eficaces durante el tratamiento y, como mínimo, hasta cuatro meses después de completar el tratamiento. Dado que los anticonceptivos orales posiblemente no pueden considerarse “métodos anticonceptivos eficaces”, deben utilizarse junto con otro método, como un método de barrera (ver la sección 4.5).
Embarazo
No existen estudios de administración de cabozantinib a mujeres embarazadas. Los estudios en animales han demostrado la existencia de efectos embriofetales y teratogénicos (ver sección 5.3). Se desconoce el riesgo potencial para el ser humano. Cabozantinib no debe utilizarse durante el embarazo, a menos que la situación clínica de la paciente requiera su tratamiento con cabozantinib.
Lactancia
Se desconoce si cabozantinib y/o cualquiera de sus metabolitos se excretan en la leche materna.
Debido al riesgo potencial para el lactante, las madres deben interrumpir la lactancia durante el tratamiento con cabozantinib y, como mínimo, hasta cuatro meses después de completar el tratamiento.
Fertilidad
No se dispone de datos sobre la fertilidad humana. Basándose en datos de seguridad no clínicos, el tratamiento con cabozantinib puede afectar a la fertilidad de ambos sexos (ver sección 5.3). Se debe aconsejar a los pacientes de ambos sexos que se asesoren y consideren la adopción de medidas de preservación de la fertilidad antes de iniciar el tratamiento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de cabozantinib sobre la capacidad para conducir y utilizar máquinas es pequeña. Se han asociado reacciones adversas como fatiga y debilidad con el tratamiento con cabozantinib. Por consiguiente, se debe recomendar precaución al conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas graves asociadas con cabozantinib más frecuentes son neumonía, inflamación de las mucosas, hipocalcemia, disfagia, deshidratación, embolismo pulmonar e hipertensión. Las reacciones adversas más frecuentes de cualquier grado (experimentadas al menos por el 20% de pacientes) fueron: diarrea, EPP, disminución de peso, disminución de apetito, náusea, fatiga, disgeusia, cambios en el color del pelo, hipertensión, estomatitis, estreñimiento, vómitos, inflamación de mucosas, astenia y disfonía.
Las anomalías de laboratorio más frecuentes fueron aumento de aspartato aminotransferasa (AST), aumento de alanina aminotransferasa (ALT), aumento de fosfatasa alcalina (ALP), linfocitopenia, hipocalcemia, neutrocitopenia, trombocitopenia, hipofosfatemia, hipoalbuminemia e hiperbilirrubinemia.
Tabla de reacciones adversas
Las reacciones adversas se recogen en la Tabla 1 según la clasificación de órganos del sistema MedDRA y su frecuencia. Las frecuencias se basan en todos los grados y su definición es la siguiente: muy frecuente (>1/10); frecuente (>1/100 a <1/10); poco frecuente (>1/1000 a <1/100). Las reacciones adversas se presentan por orden decreciente de gravedad dentro de cada grupo de frecuencia.
Tabla 1: reacciones adversas notificadas con cabozantinib
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Infecciones e infestaciones |
abscesos (viscerales, cutáneos, dentales), neumonía, foliculitis, infección fúngica (cutánea, oral, genital) |
aspergiloma | |
|
Trastornos endocrinos |
hipotiroidismo | ||
|
Trastornos del metabolismo y de la nutrición |
disminución del apetito, hipocalcemia, hipofosfatemia, hiperbilirrubinemia, hipoalbuminemia |
deshidratación | |
|
Trastornos psiquiátricos |
ansiedad, depresión, estado confusional |
sueños anormales, delirio | |
|
Trastornos del sistema nervioso |
disgeusia, cefalea, mareos |
neuropatía periférica, parestesia, ageusia, temblor |
ataxia, alteraciones de la atención, encefalopatía hepática, pérdida de conocimiento, alteración del habla, ataque isquémico transitorio, síndrome de encefalopatía posterior reversible |
|
Trastornos oculares |
visión borrosa |
catarata, conjuntivitis | |
|
Trastornos del oído y del laberinto |
dolor de oído, acúfenos |
hipoacusia | |
|
Trastornos cardiacos |
fibrilación auricular |
angina pectoris, taquicardia supraventricular | |
|
Trastornos vasculares |
hipertensión |
hipotensión, trombosis venosa, palidez, frío periférico |
trombosis arterial |
|
Trastornos respiratorios, torácicos y mediastínicos |
disfonía, dolor orofaríngeo |
fístula no gastrointestinal (tráquea, neumomediastino, traqueoesofágica), embolismo pulmonar, hemorragia del tracto respiratorio (pulmonar, bronquial, traqueal), neumonía por aspiración |
atelectasia, edema faríngeo, neumonitis |
|
Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Trastornos gastrointestinales |
diarrea, náusea, estomatitis, estreñimiento, vómitos, dolor abdominal, disfagia, dispepsia, glosodinia |
perforación gastrointestinal, hemorragia gastrointestinal, pancreatitis, hemorroides, fisura anal, inflamación anal, queilitis |
fístula gastrointestinal, esofagitis |
|
Trastornos hepatobiliares |
colelitiasis | ||
|
Trastornos de la piel y del tejido subcutáneo |
síndrome de eritrodisestesia palmo-plantar, cambios de color del pelo, erupción cutánea, piel seca, alopecia, eritema |
hiperqueratosis, acné, ampolla, crecimiento del pelo anormal, exfoliación cutánea, hipopigmentación cutánea |
úlcera cutánea, telangiectasia |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
artralgia, espasmos musculares |
dolor torácico musculoesquelético, osteonecrosis del maxilar |
rabdomiolisis |
|
Trastornos renales y urinarios |
proteinuria, disuria, hematuria |
insuficiencia renal aguda | |
|
Trastornos del aparato reproductor y de la mama |
amenorrea, hemorragia vaginal | ||
|
Trastornos generales y alteraciones en el lugar de administración |
fatiga, inflamación de las mucosas, astenia |
alteración de la cicatrización de heridas, escalofríos, edema facial |
quiste, dolor facial, edema localizado |
|
Exploraciones complementarias |
disminución de peso, aumento de ALT, AST y ALP séricas, aumento de LDH sanguínea, aumento de TSH sanguínea, linfocitopenia, neutrocitopenia, trombocitopenia |
aumento de creatinina fosfoquinasa en sangre, disminución del recuento de neutrófilos |
reducción del tiempo de tromboplastina parcial activada, aumento del recuento de eosinófilos, aumento del recuento de plaquetas |
Descripción de reacciones adversas seleccionadas
Se observó un valor de la hormona estimulante del tiroides (TSH) superior al normal después de la administración de la primera dosis en el 57% de pacientes receptores de cabozantinib, comparado al 19% en los pacientes receptores de placebo (independientemente de los valores basales). El 92% de pacientes del brazo de cabozantinib tenían una tiroidectomía previa y el 89% tomaban hormonas tiroideas antes de recibir la primera dosis.
En un ensayo clínico controlado en pacientes de cáncer se observó un incremento del intervalo QT (usando la corrección de Fridericia, QTcF) de 10-15 ms en el Día 29 (pero no en el Día 1) después del inicio del tratamiento con cabozantinib (a una dosis de 140 mg diarios). Este efecto no se asoció con cambios en la morfología de las ondas cardiacas ni con nuevos ritmos. Ningún paciente tratado con cabozantinib presentó un QTcF >500 ms.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V .
4.9 Sobredosis
No existe un tratamiento específico para la sobredosis de cabozantinib. No se han establecido los posibles síntomas de sobredosis.
En caso de sospecha de sobredosis, se suspenderá la administración de cabozantinib y se instaurará tratamiento de soporte. Los parámetros metabólicos de las pruebas clínicas de laboratorio deben supervisarse con una periodicidad semenal como mínimo, o la que se considere apropiada para evaluar cualquier posible tendencia de cambio. Las reacciones adversas asociadas con la sobredosis deben tratarse sintomáticamente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacéutico: agente antineoplásico, inhibidor de la proteinquinasa, código ATC: L01XE26 Mecanismo de acción
Cabozantinib es una pequeña molécula que inhibe varios receptores tirosina quinasa (RTK) implicados en el crecimiento tumoral y la angiogénesis, la remodelación ósea patológica y la progresión metastásica del cáncer. Se evaluó la actividad inhibitoria de cabozantinib con una serie de quinasas y se identificó como inhibidor de receptores de MET (proteína receptora del factor de crecimiento de hepatocitos) y VEGF (factor de crecimiento endotelial vascular). Asimismo, cabozantinib inhibe otras tirosina quinasas, como RET, el receptor específico de detención del crecimiento GAS6 (AXL), el receptor del factor de células madre (KIT) y la tirosina quinasa 3 tipo Fms (FLT3).
Efectos farmacodinámicos
Cabozantinib presentó inhibición del crecimiento tumoral relacionada con la dosis, regresión tumoral y/o inhibición de metástasis en una gran variedad de modelos de tumores preclínicos.
Se observó eficacia de cabozantinib en pacientes con cáncer medular de tiroides con RET de tipo salvaje o mutante.
Datos clínicos en cáncer medular de tiroides
Se realizó un ensayo multicéntrico, aleatorizado, doble ciego, de comparación de cabozantinib (N = 219) con placebo (N = 111) en pacientes con cáncer medular de tiroides (CMT) irresecable, localmente avanzado o metastásico y progresión de la enfermedad documentada radiográficamente en los 14 meses anteriores a la entrada en el ensayo. El objetivo principal del ensayo fue comparar la supervivencia libre de progresión (SLP) de los pacientes receptores de cabozantinib con la de los pacientes receptores de placebo. Los objetivos secundarios fueron comparar la tasa de respuesta global (TRG) y la supervivencia general (SG). Para la evaluación de la SLP y la TRG se utilizaron revisiones ciegas, centralizadas e independientes de los datos de imagen. Los pacientes recibieron tratamiento hasta la progresión de la enfermedad o hasta que se alcanzaron niveles de toxicidad inaceptables.
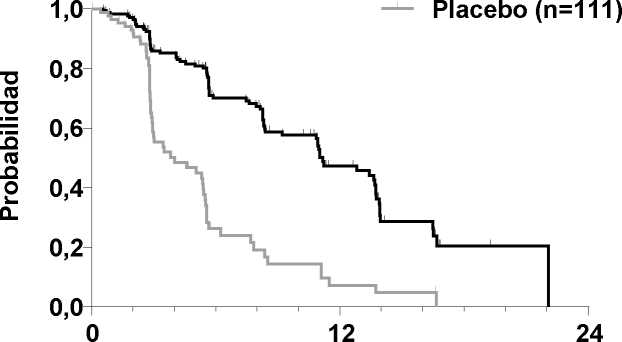
El resultado del análisis de la SLP, basado en la evaluación RECIST de la revisión centralizada, demostró la existencia de una diferencia estadísticamente significativa entre cabozantinib y placebo en la SLP, cuya mediana de duración fue de 11,2 meses en los sujetos del brazo de cabozantinib, frente a 4,0 meses en los sujetos del brazo de placebo ("hazard ratio" [HR] estratificado = 0,28;
IC 95%: 0,19, 0,40; p<0,0001; Figura 1). Los resultados de SLP fueron coherentes entre todos los subgrupos de línea basal y demográficos evaluados, incluidos los del tratamiento previo con
inhibidores de la tirosina quinasa (que podría haber consistido en agentes orientados a las vías asociadas con la antiangiogénesis), estado mutacional del RET (incluyendo a los sujetos con ausencia documentada de mutación del RET), estado previo en relación con tratamiento antineoplásico o radioterapia, o la existencia de metástasis óseas.
La TRG fue del 27,9% y el 0% en los pacientes de los brazos de cabozantinib y placebo, respectivamente (p<0,0001; Tabla 2). La mediana de la duración de las respuestas objetivas fue de 14,6 meses (IC 95%: 11,1, 17,5) para los pacientes del brazo de cabozantinib.
Un análisis administrativo parcial de la SG que incluyó el 75% del total de defunciones necesarias para el análisis final demostró una tendencia a la prolongación de la SG en el brazo de cabozantinib en comparación con el brazo de placebo: HR estratificado (IC 95%) 0,83 (0,60, 1,14); mediana (meses) 26,0 cabozantinib frente a 20,3 placebo.
Figura 1: Curva Kaplan Meier de supervivencia libre de progresión
Cometriq (n=219)
Meses
|
Número de sujetos en riesgo | ||||||||
|
Meses |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
21 |
|
Cometriq |
219 |
121 |
78 |
55 |
31 |
12 |
2 |
1 |
|
Placebo |
111 |
35 |
11 |
6 |
3 |
2 |
0 |
0 |
Tabla 2: Resumen de principales resultados de eficacia
|
Cabozantinib |
Placebo | |
|
Mediana de la supervivencia libre de progresión |
11,2 meses |
4,0 meses |
|
HR: 0,28 (0,19, 0,40) p<0,0001 | ||
|
Mediana de supervivencia global |
26,0 meses |
20,3 meses |
|
HR: 0,83 (0,60, 1,14) | ||
|
Tasa de respuesta global3 (IC 95%) |
27,9% (21,9%, 34,5%) |
0% |
|
p<0,0001 | ||
|
Duración de la respuesta, mediana (IC 95%) |
14,6 meses (11,1, 17,5) |
No corresponde |
|
Tasa de control de la enfermedad b (IC 95%) |
55,3% (48,3%, 62,2%) |
13,5% (7,6%, 21,6%) |
|
Respuesta calcitoninaa |
47% (49/104)c |
3% (1/40)c |
|
Respuesta CEAa |
33% (47/143)c |
2% (1/55)c |
a Respuesta = RC + RP
b Tasa de control de la enfermedad = EE + TRG c Incluye a los pacientes evaluables en cuanto a la respuesta
Estado mutacional del RET
De los 215 sujetos de los que se disponía de datos suficientes para determinar el estado mutacional, el 78,6% (n=169) fueron clasificados como con mutación del RET positiva y el 21,4% (n=46) fueron clasificados como con mutación del RET negativa. En el caso de 115 sujetos adicionales, el estado mutacional del RET no se pudo determinar o no estaba claro. Los tres subgrupos demostraron un incremento de SLP en el brazo de cabozantinib, en comparación con el brazo de placebo (HR de 0,23, 0,53 y 0,30, para los grupos de mutación del RET positiva, negativa y desconocida, respectivamente). Las tasas de respuesta objetivas medidas en estos subgrupos fueron en general coherentes con los resultados de SLP. Los subgrupos de mutación del RET positiva, negativa y desconocida presentaron tasas de respuesta tumoral del 32%, 22% y 25%, respectivamente.
Análisis genéticos ulteriores mostraron que una pequeña proporción de pacientes albergaban mutaciones somáticas tumorales en HRAS, KRAS o NRAS. Estos pacientes (n=16) mostraron una prolongación significativa de la SLP (HR de 0,15) y una tasa de respuesta objetiva del 31%. Los pacientes con mutación del RET negativa sin evidencia de mutación RAS (n=33) mostraron una reducción del beneficio en la SLP con cabozantinib (HR de 0,87) y una tasa de respuesta más baja, del 18%, en comparación con otros subgrupos mutacionales.
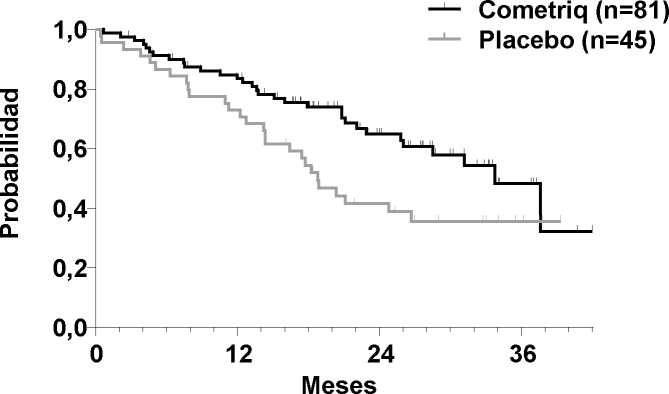
Solo se ha demostrado una relación entre la SLP y una mejora importante de la SG (HR de 0,53, p=0,0179) en el subgrupo de mutación del RET M918T positiva (n=81/219 grupo de cabozantinib). Aún no se ha analizado la SG en otros subgrupos con mutación del RET y/o RAS.
Figura 2. Análisis de la SG de Kaplan-Meier entre sujetos con una mutación del RET M918T
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con cabozantinib en uno o más subgrupos de la población pediátrica en el tratamiento de tumores malignos sólidos (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
Este medicamento se ha autorizado con una «aprobación condicional».
Esta modalidad de aprobación significa que se espera obtener más información sobre este medicamento.
La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año y esta Ficha Técnica o Resumen de las Características del Producto (RCP) se actualizará cuando sea necesario.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de cabozantinib, las concentraciones plasmáticas máximas de cabozantinib se alcanzan entre 2 y 5 horas después de dicha administración.
La dosificación diaria repetida con 140 mg de cabozantinib durante 19 días dio como resultado una acumulación media de cabozantinib (basada en el AUC) aproximadamente 4 a 5 veces superior a la administración de una dosis única. El estado estacionario se alcanza aproximadamente el Día 15.
Una comida con alto contenido graso incrementó moderadamente los valores de Cmáx y AUC (41% y 57%, respectivamente) con respecto a las condiciones de ayuno en voluntarios sanos a los que se administró una dosis única de 140 mg de cabozantinib oral. No se dispone de información sobre el efecto exacto de los alimentos cuando se ingieren una hora después de la administración de cabozantinib.
Distribución
Cabozantinib presenta una elevada unión a proteínas en el plasma humano in vitro (> 99,7%). Basándose en el modelo farmacocinético (PK) poblacional, el volumen de distribución (V/F) es de aproximadamente 349 l (SE: ± 2,73%).
Biotransformación
Cabozantinib se metabolizó in vivo. Hubo cuatro metabolitos presentes en el plasma a exposiciones (AUC) superiores al 10% de la molécula original: N-óxido de XL184, producto de degradación
XL184 amida, monohidroxi sulfato de XL184, y sulfato de producto de degradación 6-desmetil amida. Dos metabolitos no conjugados (N-óxido de XL184 y producto de degradación XL184 amida), que poseen <1% de la potencia de inhibición de la quinasa objetivo del cabozantinib original, representan cada uno de ellos <10% de la exposición plasmática total relacionada con el fármaco.
Cabozantinib es un sustrato para el metabolismo de CYP3A4 in vitro, puesto que un anticuerpo neutralizador de CYP3A4 inhibió la formación del metabolito N-óxido de XL184 en >80% en una incubación con microsomas de hígado humano (HLM) catalizada por NADPH. Como contraste, los anticuerpos neutralizadores de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 y CYP2E1 no tuvieron efecto alguno en la formación de metabolitos de cabozantinib. Un anticuerpo neutralizador de CYP2C9 demostró un efecto mínimo sobre la formación de metabolitos de cabozantinib (es decir, una reducción <20%).
Eliminación
La semivida plasmática terminal de cabozantinib en estudios de dosis única en voluntarios sanos es de aproximadamente 120 horas. En un análisis farmacocinético poblacional, se calculó que el aclaramiento medio (CL/F) en estado estacionario en pacientes de cáncer era de 4,4 l/h. En un periodo de recogida de 48 días tras una sola dosis de cabozantinib-14C en voluntarios sanos, se recuperó aproximadamente el 81% del total de radiactividad administrado, siendo el 54% en heces y el 27% en orina.
Farmacocinética en poblaciones de pacientes especiales
Insuficiencia renal
No es posible excluir diferencias en la farmacocinética en pacientes con insuficiencia renal, puesto que aún no se dispone de datos sobre esta población.
Insuficiencia hepática
No es posible excluir diferencias en la farmacocinética en pacientes con insuficiencia hepática, puesto que aún no se dispone de datos sobre esta población.
Raza
No se dispone de datos que permitan determinar diferencias farmacocinéticas basadas en la raza.
5.3 Datos preclínicos sobre seguridad
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales con niveles de exposición similares a los clínicos y con posible repercusión en el uso clínico fueron las siguientes:
En estudios de toxicidad de hasta seis meses de duración con dosis repetidas en la rata y en el perro, los órganos diana de la toxicidad fueron: el tracto gastrointestinal, la médula ósea, los tejidos linfoides, el riñón y los tejidos adrenales y del aparato reproductor. El nivel sin efecto adverso observable (NOAEL) de estos hallazgos se situó por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
En una serie de pruebas de genotoxicidad, cabozantinib no mostró potencial mutagénico ni clastogénico. Aún no se han realizado estudios de carcinogénesis.
Los estudios de fertilidad en ratas han mostrado una reducción de la fertilidad en machos y hembras. Asimismo, se ha observado hipoespermatogénesis en el perro por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
Se han realizado estudios de desarrollo embriofetal en ratas y conejos. En la rata, cabozantinib provocó pérdidas postimplantación, edema fetal, paladar hendido/labio leporino, aplasia cutánea y cola deforme o rudimentaria. En el conejo, cabozantinib provocó cambios en los tejidos blandos del feto (reducción del tamaño del bazo, lóbulo medio del pulmón de tamaño reducido o ausente) y un incremento de la incidencia fetal de malformaciones totales. Los NOAEL de los resultados de toxicidad embriofetal y teratogénica se situaron por debajo de los niveles de exposición clínica en el ser humano a la dosis terapéutica prevista.
Las ratas jóvenes (comparables a una población pediátrica >2 años) que recibieron cabozantinib presentaron un aumento de los valores de leucocitos, una disminución de la hematopoyesis, sistema reproductor femenino puberal/inmaduro (sin retraso de la abertura vaginal), anomalías dentales, disminución de la densidad ósea y del contenido mineral óseo, pigmentación hepática e hiperplasia de los conductos biliares. Las manifestaciones en el útero/los ovarios y la disminución de la hematopoyesis fueron aparentemente pasajeras, mientras que los efectos sobre los parámetros óseos y la pigmentación hepática se mantuvieron. No se han realizado evaluaciones en ratas jóvenes (comparables a una población pediátrica <2 años).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula Celulosa microcristalina Croscarmelosa sódica Almidón glicolato sódico Sílice coloidal anhidro Ácido esteárico
Cubierta de la cápsula:
Gelatina
Óxido de hierro negro (E172) (solo cápsulas de 20 mg)
Óxido de hierro rojo (E172) (solo cápsulas de 80 mg)
Dióxido de titanio (E171)
Tinta de impresión:
Laca Shellac
Óxido de hierro negro (E172)
Propilenglicol
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperaturas superiores a 25°C.
Conservar en el embalaje original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Blísters de PVC/PE/PCTFE-Al con una lámina de aluminio en la parte posterior, sellados en un acondicionamiento exterior de cartón termosellado.
Las tiras de blísters contienen una de las dos opciones siguientes:
7 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 100 mg/día para 7 días)
21 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 140 mg/día para 7 días)
Envase para 28 días que contiene:
56 cápsulas (4 tiras de blísters de 7 cápsulas de 20 mg y 7 cápsulas de 80 mg) (dosis de 100 mg/día para 28 días)
112 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg y 7 cápsulas de 80 mg) (dosis de 140 mg/día para 28 días)
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
TMC Pharma Services Ltd.
Lodge Farm Barn Elvetham Park Estate Fleet Road Hartley Wintney Hampshire RG27 8AS Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/890/002
EU/1/13/890/003
EU/1/13/890/005
EU/1/13/890/006
7 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 100 mg/día para 7 días)
21 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 140 mg/día para 7 días) 56 cápsulas (4 tiras de blísters de 7 cápsulas de 20 mg y 7 cápsulas de 80 mg) (dosis de 100 mg/día para 28 días)
112 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg y 7 cápsulas de 80 mg) (dosis de 140 mg/día para 28 días)
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 de marzo de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POSTAUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN CONDICIONAL
FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
A.
Nombre y dirección del fabricante responsable de la liberación de los lotes
Catalent UK Packaging Limited Lancaster Way, Wingates Industrial Park,
Westhoughton, Bolton,
Lancashire, BL5 3XX,
Reino Unido
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización. Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Medidas adicionales de minimización de riesgos
No procede.
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Un análisis maduro de la SG del estudio XL184-301 que incluye análisis de subgrupos de características tumorales demográficas y basales relevantes y posible efecto de confusión de terapias posteriores al estudio. |
30 de abril de 2015 |
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POSTAUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN CONDICIONAL
Al ser esta una autorización de comercialización condicional y según lo que establece el Artículo 14(7) del Reglamento (CE) 726/2004, el TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Un estudio de comparación de dosis (XL-184-401) (140 mg comparado con 60 mg) en 112 pacientes con carcinoma medular de tiroides esporádico o hereditario. Los pacientes con ambas formas esporádica y hederitaria de CMT podrán participar en el estudio. Deben obtenerse muestras tumorales nuevas del foco metastásico más reciente para realizar un análisis genético del tumor en pacientes reclutados en el estudio de comparación de dosis. Las muestras se someterán a una evaluación exhaustiva para detectar mutaciones de los genes RET y RAS. Las muestras de tejido tumoral se someterán inicialmente a una evaluación histológica, enriquecimiento manual del tumor y aislamiento del ADN. La calidad de las muestras de ADN resultantes se evaluará mediante una prueba de amplificación de ácidos nucleicos (PCR) y mediante secuenciación de Sanger para RET M918T. Se solicitará una muestra de sustitución en caso de que la muestra original fracase durante las pruebas de calidad PCR o la prueba de secuenciación de Sanger. Se realizará secuenciación de próxima generación de axones 10, 11 y 13-16 de genes RET, que cubre la gran mayoría de mutaciones RET conocidas. Además, las muestras se evaluarán para detectar mutaciones en puntos calientes de genes RAS (genes HRAS, KRAS y NRAS). Se exigirán evaluaciones PK de todos los sujetos (ambos grupos de dosis). Los resultados se utilizarán para evaluar la exposición a cabozantinib a los niveles de dosis de 60 y 140 mg y caracterizar con mayor detalle los modelos PK de población y las relaciones de respuesta a la exposición de cabozantinib y posibles metabolitos en esta población. |
31 de marzo de 2019 |
TIRAS DE BLÍSTERS, dosis de 60 mg_
1. NOMBRE DEL MEDICAMENTO_
COMETRIQ 20 mg cápsulas duras Cabozantinib
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg de cabozantinib.
3. LISTA DE EXCIPIENTES
Cápsulas duras 20 mg
Dosis de 60 mg
Envase para la dosis diaria de 60 mg
21 cápsulas de 20 mg (dosis de 60 mg/día para 7 días)
Cada dosis diaria de 60 mg consta de tres cápsulas grises de 20 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
•' - ' •-
3. Empuje la cápsula a través de la lámina de aluminio.
CAD
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn
Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/001
Lote
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
COMETRIQ 20 mg Dosis de 60 mg/día
COMETRIQ 20 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg de cabozantinib.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE_
Dosis de 60 mg
Envase para 28 días: 84 cápsulas (4 tiras de blísters de: 21 cápsulas de 20 mg) para dosis diaria de 60 mg para 28 días.
Cada dosis diaria de 60 mg consta de tres cápsulas grises de 20 mg.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN_
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Consulte las tiras de blísters individuales para conocer las instrucciones de administración.
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn, Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/004 84 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg) (dosis de 60 mg/día
para 28 días)
Lote
Medicamento sujeto a prescripción médica.
COMETRIQ 20 mg
Dosis de 60 mg/día
1. NOMBRE DEL MEDICAMENTO_
COMETRIQ 20 mg cápsulas duras Cabozantinib
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg de cabozantinib.
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Cápsulas duras
20 mg
Dosis de 60 mg
21 cápsulas de 20 mg (dosis de 60 mg/día para 7 días). Forman parte de un envase para 28 días, no pueden venderse por separado.
Envase para la dosis diaria de 60 mg
Cada dosis diaria de 60 mg consta de tres cápsulas grises de 20 mg.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
•' - ' •-
3. Empuje la cápsula a través de la lámina de aluminio.
CAD
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn
Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/004 84 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg) (dosis de 60 mg/día
para 28 días)
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Cápsulas duras 20 mg y 80 mg Dosis de 100 mg
Envase para la dosis diaria de 100 mg
7 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 100 mg/día para 7 días)
Cada dosis diaria de 100 mg consta de una combinación de una cápsula gris de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
•' - ' •-
3. Empuje la cápsula a través de la lámina de aluminio.
CAD
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn
Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/002
Lote
Medicamento sujeto a prescripción médica.
COMETRIQ 20 mg COMETRIQ 80 mg Dosis de 100 mg/día
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Dosis de 100 mg
Envase para 28 días: 56 cápsulas (4 tiras de blísters de: 7 cápsulas de 20 mg y 7 cápsulas de 80 mg) para dosis diaria de 100 mg para 28 días.
Cada dosis diaria de 100 mg consta de una combinación de una cápsula gris de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Consulte las tiras de blísters individuales para conocer las instrucciones de administración.
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn, Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/005 56 cápsulas (4 tiras de blísters de 7 cápsulas de 20 mg y 7 cápsulas de 80 mg)
(dosis de 100 mg/día para 28 días)
Lote
Medicamento sujeto a prescripción médica.
COMETRIQ 20 mg COMETRIQ 80 mg Dosis de 100 mg/día
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Cápsulas duras 20 mg y 80 mg Dosis de 100 mg
7 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 100 mg/día para 7 días). Forman parte de un envase para 28 días, no pueden venderse por separado.
Envase para la dosis diaria de 100 mg
Cada dosis diaria de 100 mg consta de una combinación de una cápsula gris de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
3. Empuje la cápsula a través de la lámina de aluminio.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
TMC Pharma Services Ltd.
Lodge Farm Barn
Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/890/005 56 cápsulas (4 tiras de blísters de 7 cápsulas de 20 mg y 7 cápsulas de 80 mg)
(dosis de 100 mg/día para 28 días)
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Cápsula dura
20 mg y 80 mg Dosis de 140 mg
Envase para la dosis diaria de 140 mg
21 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 140 mg/día para 7 días)
Cada dosis diaria de 140 mg consta de una combinación de tres cápsulas grises de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
•' - ' •-
3. Empuje la cápsula a través de la lámina de aluminio.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
TMC Pharma Services Ltd.
Lodge Farm Barn, Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/890/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
COMETRIQ 20 mg COMETRIQ 80 mg Dosis de 140 mg/día
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Dosis de 140 mg
Envase para 28 días: 112 cápsulas (4 tiras de blísters de: 21 cápsulas de 20 mg y 7 cápsulas de 80 mg) para dosis diaria de 140 mg para 28 días.
Cada dosis diaria de 140 mg consta de una combinación de tres cápsulas grises de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Consulte las tiras de blísters individuales para conocer las instrucciones de administración.
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn, Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/006 112 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg y 7 cápsulas de 80 mg)
(dosis de 140 mg/día para 28 días)
Lote
Medicamento sujeto a prescripción médica.
COMETRIQ 20 mg COMETRIQ 80 mg Dosis de 140 mg/día
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras Cabozantinib
Cada cápsula dura contiene (S)-malato de cabozantinib, equivalente a 20 mg u 80 mg de cabozantinib.
Cápsula dura
20 mg y 80 mg Dosis de 140 mg
21 cápsulas de 20 mg y 7 cápsulas de 80 mg (dosis de 140 mg/día para 7 días). Forman parte de un envase para 28 días, no pueden venderse por separado.
Envase para la dosis diaria de 140 mg
Cada dosis diaria de 140 mg consta de una combinación de tres cápsulas grises de 20 mg y una cápsula naranja de 80 mg.
Vía oral.
Leer el prospecto antes de utilizar este medicamento. Prospecto dentro de la bolsa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Instrucciones de administración
Tomar las cápsulas de una fila cada día, sin alimentos (los pacientes deben permanecer en ayunas como mínimo durante dos horas antes de la toma y una hora después). Registrar la fecha de la primera toma.
1. Apriete la pestaña.
•' - ' •-
3. Empuje la cápsula a través de la lámina de aluminio.
CAD
Conservar en el embalaje original para protegerlo de la humedad. No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
TMC Pharma Services Ltd.
Lodge Farm Barn, Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Reino Unido
Tel.: +44 1252 842255
EU/1/13/890/006 112 cápsulas (4 tiras de blísters de 21 cápsulas de 20 mg y 7 cápsulas de 80 mg)
(dosis de 140 mg/día para 28 días)
Lote
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
B. PROSPECTO
Prospecto: información para el paciente
COMETRIQ 20 mg cápsulas duras COMETRIQ 80 mg cápsulas duras
(iS)-malato de cabozantinib
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es COMETRIQ y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar COMETRIQ
3. Cómo tomar COMETRIQ
4. Posibles efectos adversos
5. Conservación de COMETRIQ
6. Contenido del envase e información adicional
1. Qué es COMETRIQ y para qué se utiliza
COMETRIQ es un medicamento que se emplea para tratar el cáncer medular de tiroides, un tipo raro de cáncer de tiroides que no puede ser eliminado mediante cirugía o que se ha extendido a otras partes del cuerpo.
COMETRIQ puede retardar o detener el crecimiento del cáncer medular de tiroides. Puede ayudar a reducir el tamaño de los tumores asociados a este tipo de cáncer.
2. Qué necesita saber antes de empezar a tomar COMETRIQ No tome COMETRIQ
- si es alérgico a cabozantinib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar COMETRIQ:
- Si tiene tensión arterial alta.
- Si tiene diarrea.
- Si tiene antecedentes recientes de tos con sangre o hemorragia importante.
- Si se ha sometido a una intervención quirúrgica en el último mes (o si tiene alguna
programada), incluidas intervenciones odontológicas.
- Si se ha sometido a radioterapia en los últimos tres meses.
- Si tiene enfermedad inflamatoria del intestino (como enfermedad de Crohn, colitis ulcerosa o diverticulitis).
- Si le han dicho que su cáncer se ha extendido a las vías respiratorias o esófago.
- Si tiene antecedentes recientes de coágulo sanguíneo en la pierna, ictus o ataque al corazón.
- Si está tomando medicamentos para controlar el ritmo cardiaco, tiene un ritmo cardiaco lento, tiene problemas de corazón o tiene problemas con los niveles de calcio, potasio o magnesio en la sangre.
Avise a su médico si se ve afectado por cualquiera de estas circunstancias. Es posible que necesite tratamiento, o que el médico decida cambiar la dosis de COMETRIQ o inter