Cluvot 250 Ui Polvo Y Disolvente Para Solucion Inyectable O Perfusion
Prospecto: información para el usuario
Cluvot250 UI
Polvo y disolvente para solución inyectable o perfusión.
Concentrado de factor XIII de coagulación derivado de plasma humano
"V Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a usted,y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de
_efectos adversos que no aparecen en este prospecto. Ver sección 4._
Contenido del prospecto
1. Qué es Cluvot y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Cluvot
3. Cómo usar Cluvot
4. Posibles efectos adversos
5. Conservación de Cluvot
6. Contenido del envase e información adicional
1. Qué es Cluvot y para qué se utiliza
Qué es Cluvot
Cluvot se presenta como un polvo blanco y un disolvente. La solución obtenida debe administrarse mediante inyección en una vena.
Cluvot es un producto compuesto por factor XIII (FXIII) de coagulación derivado de plasma humano (la parte líquida de la sangre), y tiene funciones importantes en la hemostasia (interrupción de la hemorragia).
Para qué se utiliza Cluvot
Cluvot se utiliza en pacientes adultos y pediátricos
• para el tratamiento preventivo de la deficiencia hereditaria del factor XIII y
• para el tratamiento perioperatorio de la hemorragia quirúrgica con deficiencia congénita de FXIII
2. Qué necesita saber antes de empezar a usar Cluvot
Las secciones siguientes contienen información que su médico debe tener en cuenta antes de administrarle Cluvot.
No use Cluvot:
• si es alérgico al principio activo o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Informe a su médico si es alérgico a cualquier medicamento o alimento.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Cluvot.
• Si ha experimentado reacciones alérgicas al FXIII de coagulación en el pasado. Debe tomar antihistamínicos y corticosteroides con fines profilácticos si así lo aconseja su médico.
• Cuando se produzcan reacciones de tipo alérgico o anafiláctico (una reacción alérgica grave que provoca dificultades respiratorias graves o mareos), la administración de Cluvot debe interrumpirse de inmediato (p. ej., interrumpir la perfusión). En caso de shock, se seguirán las pautas médicas vigentes para su tratamiento.
• Si ha experimentado una trombosis reciente (coágulo sanguíneo), se debe actuar con precaución debido al efecto estabilizador de la fibrina del FXIII.
• La formación de inhibidores (anticuerpos neutralizantes) es una complicación conocida del tratamiento e implica que el tratamiento ha dejado de funcionar. Si sus hemorragias no consiguen controlarse con Cluvot, informe a su médico inmediatamente. Debe ser controlado cuidadosamente por si desarrolla algún inhibidor.
Su médico considerará detenidamente el beneficio del tratamiento con Cluvot en comparación conel riesgo de estas complicaciones.
Seguridad vírica
Cuando los medicamentos se elaboran a partir de sangre o plasma humano, se toman ciertas medidas para prevenir la transmisión de infecciones a los pacientes. Estas medidas incluyen:
• selección cuidadosa de los donantes de sangre y plasma para garantizar que se excluye a los posibles portadores de infecciones;
• análisis de cada donación y mezcla de plasmas para detectar signos de virus/infecciones;
• la inclusión de medidas durante el procesamiento de la sangre o plasma para inactivar o eliminar los virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humano, no puede excluirse totalmente la posibilidad de transmisión de infecciones. Esto también se aplica a cualquier virus desconocido o emergente o a otros tipos de infecciones.
Las medidas adoptadas se consideran eficaces para los virus envueltos como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, y para el virus no envuelto de la hepatitis A y el parvovirus B19.
Se recomienda encarecidamente que, cada vez que se le administre Cluvot, su médico anote el nombre y el número de lote del medicamento (se encuentra en la caja de cartón).
Es posible que su médico le recomiende que considere la posibilidad de vacunarse contra la hepatitis A y B si recibe de forma regular o repetida productos derivados de plasma humano.
Uso de Cluvot con otros medicamentos
• Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
• Hasta el momento, no se conoce ninguna interacción entre el concentrado del FXIII de coagulación derivado de plasma humano y otros medicamentos.
• Cluvot no debe mezclarse con otros medicamentos, diluyentes o disolventes, excepto aquellos indicados en la sección 6 y debe administrarse a través de una línea de perfusión independiente.
Embarazo, lactancia y fertilidad
• Si está embarazada o en período de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de que se le administre este medicamento.
• Los datos limitados sobre el uso clínico de Cluvot en el embarazo no mostraron efectos negativos en la evolución del embarazo y el desarrollo perinatal o posnatal. Por tanto, si es necesario, puede considerarse el uso de Cluvot durante el embarazo.
• No hay datos sobre la excreción de Cluvot en la leche humana. Sin embargo, basándose en su gran tamaño molecular la excreción en la leche es improbable y debido a su carácter proteico, también es improbable la absorción de moléculas intactas por parte del lactante. Por tanto, Cluvot puede utilizarse durante la lactancia.
• No se dispone de datos de fertilidad.
Conducción y uso de máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
Cluvot contiene sodio
Tenga en cuenta que Cluvot contiene sodio. Esto es importante si está siguiendo una dieta con restricción de sodio. Cluvot contiene de 124,4 a 195,4 mg (de 5,41 a 8,50 mmol) de sodio por dosis (40 UI/peso corporal: para una media de 70 kg), si se aplica la dosis recomendada (2.800 UI = 44,8 ml).
3. Cómo usar Clavot
• Normalmente su médico será quien le administre Cluvot.
• Cluvot está pensado únicamente para su inyección venosa.
Dosificación
Su médico calculará la dosis correcta y decidirá la frecuencia con que se le administrará Cluvot, teniendo en cuenta cómo está funcionando el tratamiento.
Para más información, ver sección “Esta información está destinada únicamente a médicos o profesionales sanitario^".
Sobredosis
No se han notificado casos de sobredosis y no se prevén, dado que el medicamento es administrado por profesionales sanitarios.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Se han observado los efectos adversos siguientes en raras ocasiones (afecta a más de 1 usuario de cada 10.000 y a menos de 1 usuario de cada 1.000):
• Reacciones alérgicas, como la urticaria generalizada (hinchazones con picor en la piel), erupción cutánea, descenso de la presión arterial (que puede provocar sensación de desmayo o mareo) y dificultad para respirar.
• Aumento en la temperatura
Se han observado los efectos adversos siguientes en muy raras ocasiones (afecta a menos de1 usuario de cada 10.000):
• Desarrollo de inhibidores del FXIII.
Si se producen reacciones alérgicas, se debe interrumpir de inmediato la administración de Cluvot e iniciar el tratamiento apropiado. Para el tratamiento del shock se debe actuar conforme a los estándares médicos vigentes.
Efectos adversos en niños y adolescentes
Se espera que los efectos adversos en niños sean los mismos que en adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cluvot
• Conservar en nevera (entre + 2 °C y + 8 °C).
• No congelar.
• Conservar el vial en el envase exterior para protegerlo de la luz.
• Cluvot no contiene conservantes. El producto debe usarse de inmediato tras la reconstitución. En caso de no usarse de inmediato, no debe conservarse más de 4 horas a temperatura ambiente. No refrigerar ni congelar la solución reconstituida.
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en el envase de cartón. La fecha de caducidad es el último día del mes que se indica.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Cluvot El principio activo es:
Concentrado de factor XIII de coagulación derivado de plasma humano que contiene 250 UI por vial.
Los demás componentes son:
Albúmina humana, glucosa monohidratada, cloruro de sodio. hidróxido sódico (en pequeñas cantidades para el ajuste del pH)
Disolvente: Agua para preparaciones inyectables Aspecto del producto y contenido del envase
Cluvot se presenta como un polvo blanco y se suministra con un disolvente (agua para preparaciones inyectables).
La solución obtenida debe ser incolora, transparente o ligeramente opalescente. Cuando se expone a la luz no debe ser turbia ni contener residuos (depósitos/partículas).
Presentación
Un envase de 250 UI que contiene:
- 1 vial con polvo
- 1 vial con 4 ml de agua para preparaciones inyectables
- 1 trasvasador con filtro 20/20 (Mix2Vial)
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH Emil-von-Behring-Strasse 76 35041 Marburgo Alemania
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de autorización de comercialización:
CSL Behring SA Avenida Diagonal, 601, 7C 08028 Barcelona - España
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres: Cluvot
Fecha de la última revisión de este prospecto: Julio 2016.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
Esta información está destinada únicamente a profesionales del sector sanitario:
Posología y forma de administración Posología
1 ml equivale aproximadamente a 62,5 UI, y 100 UI equivalen a 1,6 ml, respectivamente.
Importante:
La cantidad que hay que administrar y la frecuencia de administración siempre deben orientarse a la eficacia clínica en cada caso particular.
Dosificación
La pauta de dosificación debe personalizarse según el peso corporal, los valores analíticos y el estado clínico del paciente.
Pauta de dosificación profiláctica habitual Dosis inicial
• 40 unidades internacionales (UI) por kg de peso corporal
• La velocidad de inyección no debe ser superior a los 4 ml por minuto.
Dosificación posterior
• La dosificación debe guiarse por el nivel de actividad mínimo más reciente del FXIII, con una administración cada 28 días (4 semanas) para mantener un nivel de actividad mínimo del FXIII entre el 5 y el 20%, aproximadamente.
• Los ajustes de dosis recomendados de ± 5 UI por kg deben basarse en los niveles de actividad mínimos del FXIII tal como se muestra en la tabla 1 y el estado clínico del paciente.
• Los ajustes de dosis deben realizarse basándose en un análisis específico y sensible para determinar los niveles de FXIII. En la tabla 1 siguiente se describe un ejemplo de ajuste de la dosis mediante la prueba de actividad Berichrom® estándar.
Tabla 1: ajuste de la dosis mediante la prueba de actividad Berichrom®
|
Nivel mínimo de actividad del factor XIII (%) |
Cambio de dosificación |
|
Un nivel mínimo de < 5% |
Aumento en 5 unidades por kg |
|
Nivel mínimo entre el 5% y el 20% |
Sin cambio |
|
Dos niveles mínimos de > 20% |
Disminución en 5 unidades por kg |
|
Un nivel mínimo de > 25% |
Disminución en 5 unidades por kg |
La potencia expresada en unidades se determina mediante la prueba de actividad Berichrom®, referida al estándar internacional vigente para el factor XIII de coagulación sanguínea en plasma.
Por tanto, una unidad en este documento es equivalente a una unidad internacional.
Profilaxis previa a la cirugía
Después de la última dosis profiláctica habitual del paciente, si una cirugía se programa:
• Entre 21 y 28 días después: administre al paciente la dosis profiláctica total inmediatamente antes de la cirugía y la siguiente dosis profiláctica debe administrarse 28 días después.
• Entre 8 y 21 días después: puede administrarse una dosis adicional (total o parcial) antes de la cirugía. La dosis debe guiarse por los niveles de actividad del FXIII y el estado clínico del paciente y debe ajustarse según la semivida de Cluvot.
• En los 7 días posteriores desde la última dosis: puede no ser necesaria una dosis adicional.
Los ajustes de dosis pueden diferir de estas recomendaciones y deben personalizarse en función de los niveles de actividad del FXIII y el estado clínico del paciente. Se debe controlar con precisión a todos los pacientes durante y después de la cirugía.
Por tanto, se recomienda monitorizar el aumento de la actividad del FXIII con una prueba de FXIII. En caso de cirugía mayor y hemorragias graves, el objetivo es obtener valores casi normales (personas sanas: 70% - 140%).
Población pediátrica
La posología y forma de administración en niños y adolescentes se basan en el peso corporal y, por tanto, en general se basan en las mismas directrices que para los adultos. La dosis y la frecuencia de administración para cada persona siempre deben guiarse por la eficacia clínica y los niveles de actividad del factor XIII.
Población de edad avanzada
La posología y forma de administración en personas de edad avanzada (> 65 años) no se ha documentado todavía en estudios clínicos.
Forma de administración
Instrucciones generales
- La solución debe ser transparente o ligeramente opalescente. Después de extraer y filtrar el producto reconstituido (véase más adelante) debe revisarse visualmente para detectar la presencia de partículas extrañas y decoloraciones antes de la administración.
- No se deben utilizar soluciones visiblemente turbias o soluciones que aún contengan flóculos o partículas.
- La reconstitución y la extracción deben llevarse a cabo en condiciones asépticas.
Reconstitución
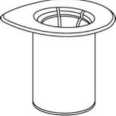
Atemperar el disolvente a temperatura ambiente. Asegúrese de que se hayan retirado las cápsulas de los viales del producto y del disolvente y de que los tapones se tratan con una solución aséptica y se dejan secar antes de abrir el envase del Mix2Vial.
1
1. Abra el envase que contiene el Mix2Vial desprendiendo el precinto. No extraiga el Mix2Vial del envase del blíster

2
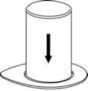
2. Coloque el vial del disolvente sobre una superficie limpia y plana y sujételo con firmeza. Sujete el Mix2Vial junto con el envase del blíster y empuje la punta del extremo del adaptador azul hacia abajo que encaje en el tapón del vial del disolvente.
3
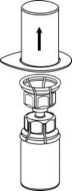
3. Retire con cuidado el envase del blíster del Mix2Vial sujetando el borde y tirando verticalmente hacia arriba. Asegúrese de que solo retira el envase del blíster y no el Mix2Vial.
f_a
5
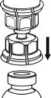
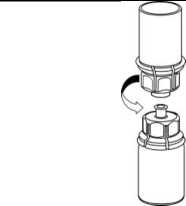
4. Coloque el vial del producto sobre una superficie plana y firme. Invierta el vial del disolvente con el Mix2Vial acoplado y empuje la punta del extremo del adaptador transparente hacia abajo hasta que encaje en el tapón del vial del producto. El disolvente se transferirá automáticamente al vial del producto.
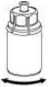
5. Con una mano, sujete el lado del producto del Mix2Vial y, con la otra mano, sujete el lado del vial del disolvente y desenrosque con cuidado el sistema de transferencia y divídalo en dos piezas. Deseche el vial del disolvente con el adaptador del Mix2Vial azul acoplado.
Trasvase y administración
6. Gire suavemente el vial del producto con el adaptador transparente hasta que la sustancia se haya disuelto por completo. No lo agite.
6
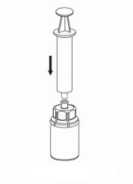
7. Llene de aire una jeringa estéril vacía. Manteniendo el vial del producto en posición vertical, conecte la jeringa al adaptador Luer-Lock del Mix2Vial acoplado. Inyecte el aire en el vial del producto.
7
ÜE
|
s |
^8 |
8. Manteniendo presionado el émbolo de la jeringa, invierta el sistema para colocarlo boca abajo y aspire la solución en la jeringa tirando del émbolo lentamente hacia atrás. | |
|
9 |
,1 |
g, 1 |
9. Una vez que la solución se haya transferido a la jeringa, sujete con firmeza el cuerpo de la jeringa (manteniendo el émbolo mirando hacia abajo) y desconecte el adaptador transparente del Mix2Vial de la jeringa. |
Debe tenerse cuidado de que no entre sangre en la jeringa llena del producto, ya que existe riesgo de que la sangre se coagule en la jeringa y por tanto, se administrarían al paciente coágulos de fibrina.
La solución reconstituida debe administrarse por vía intravenosa a través de una línea de inyección/perfusión independiente mediante una inyección lenta, a una velocidad que no exceda los 4 ml por minuto.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
8 de 8