Cisatracurio Inibsa 2 Mg/Ml Solucion Inyectable Y Para Perfusion Efg
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 1/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 1/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
1. NOMBRE DEL MEDICAMENTO
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG Cisatracurio Inibsa 5 mg/ml solución inyectable y para perfusión EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cisatracurio Inibsa 2 mg/ml
Cada mililitro de solución inyectable y para perfusión contiene 2,68 mg de besilato de cisatracurio que equivalen a 2 mg de cisatracurio.
Una ampolla de 2,5 ml contiene 5 mg de cisatracurio (como besilato).
Una ampolla de 5 ml contiene 10 mg de cisatracurio (como besilato).
Una ampolla de 10 ml contiene 20 mg de cisatracurio (como besilato).
Para consultar la lista completa de excipientes, ver sección 6.1.
Cisatracurio Inibsa 5 mg/ml
Cada mililitro de solución inyectable y para perfusión contiene 6,70 mg de besilato de cisatracurio que equivalen a 5 mg de cisatracurio.
Un vial de 30 ml contiene 150 mg de cisatracurio (como besilato). Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución inyectable y para perfusión.
Solución incolora, libre de partículas visibles.
4. DATOS CLÍNICOS
Cisatracurio Inibsa es un agente bloqueante neuromuscular no despolarizante, de duración intermedia para administración intravenosa.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 2/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
4.1. Indicaciones terapéuticas
Cisatracurio Inibsa está indicado para su empleo durante procedimientos quirúrgicos y otros procedimientos así como en cuidados intensivos en adultos y niños de al menos 1 mes. Cisatracurio Inibsa se puede utilizar como coadyuvante en anestesia general, o sedación en la Unidad de Cuidados Intensivos (UCI) para relajar los músculos esqueléticos y para facilitar la intubación traqueal y la ventilación mecánica.
4.2. Posología y forma de administración
Cisatracurio Inibsa sólo debe administrarse por o bajo la supervisión de anestesistas o de otros médicos que estén familiarizados con el uso y la acción de los bloqueantes neuromusculares. Se debe disponer de instalaciones para la intubación traqueal, el mantenimiento de la ventilación pulmonar y la oxigenación arterial adecuada.
Por favor, téngase en cuenta que Cisatracurio Inibsa no se debe mezclar en la misma jeringa o administrarse al mismo tiempo a través de la misma aguja, que una emulsión inyectable de propofol o con soluciones alcalinas como tiopentona sódica (Ver sección 6.2).
Cisatracurio Inibsa no contiene conservante antimicrobiano y se debe utilizar en un único paciente.
Recomendación de monitorización
Al igual que con otros agentes bloqueantes neuromusculares, se recomienda el control de la función neuromuscular durante el empleo de Cisatracurio Inibsa con el fin de individualizar los requerimientos de la dosis.
Uso por inyección intravenosa en bolus
- Posología en adultos
Intubación traqueal. La dosis recomendada de intubación de Cisatracurio Inibsa para adultos es de 0,15 mg/kg (peso corporal). Esta dosis proporciona condiciones buenas/excelentes para la intubación traqueal 120 segundos después de la administración de Cisatracurio Inibsa, tras la inducción de la anestesia con propofol.
Dosis más elevadas acortarán el tiempo de la aparición del bloqueo neuromuscular.
La siguiente tabla resume los datos farmacodinámicos medios al administrarse cisatracurio a dosis de 0,1 a 0,4 mg/kg (peso corporal) a pacientes adultos sanos durante anestesia con opiáceos (tiopentona/fentanilo/midazolam) o con propofol.
|
Dosis inicial de |
Tipo de |
Tiempo hasta el |
Tiempo hasta |
Tiempo hasta el |
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 3/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
|
cisatracurio mg/kg (peso corporal) |
anestésico |
90% de la supresión T1* (min) |
supresión T1* máxima (min) |
25% de la recuperación espontánea de T1* (min) |
|
0,1 |
Opiáceos |
3,4 |
4,8 |
45 |
|
0,15 |
Propofol |
2,6 |
3,5 |
55 |
|
0,2 |
Opiáceos |
2,4 |
2,9 |
65 |
|
0,4 |
Opiáceos |
1,5 |
1,9 |
91 |
*Ti respuesta de contracción muscular única así como el primer componente de la respuesta Tren-de-cuatro del músculo abductor del pulgar tras estimulación eléctrica supramáxima del nervio cubital.
La anestesia con enflurano o isoflurano puede aumentar la duración clínicamente eficaz de una dosis inicial de cisatracurio hasta en un i5%.
Mantenimiento. Se puede prolongar el bloqueo neuromuscular con dosis de mantenimiento de Cisatracurio Inibsa. Una dosis de 0,03 mg/kg (peso corporal) proporciona aproximadamente 20 minutos de bloqueo neuromuscular adicional clínicamente eficaz durante la anestesia con opiáceos o propofol.
Las dosis consecutivas de mantenimiento no conducen a prolongación progresiva del efecto.
Recuperación espontánea. Una vez comienza la recuperación espontánea del bloqueo neuromuscular, la velocidad es independiente de la dosis administrada de Cisatracurio Inibsa. Durante la anestesia con opiáceos o propofol, las medianas de los tiempos para una recuperación del 25 al 75% y de 5 al 95%, aproximadamente, 13 y 30 minutos, respectivamente.
Reversión. El bloqueo neuromuscular tras la administración de Cisatracurio Inibsa es fácilmente reversible con dosis estandar de agentes anticolinesterásicos. Los tiempos medios para una recuperación del 25 al 75% y para la recuperación clínica completa (ratio T4:T1 > 0,7) son, aproximadamente, de 4 a 9 minutos, respectivamente, tras la administración del agente de reversión a un promedio del 10% de la recuperación T1.
- Posología en pacientes pediátricos
Intubación traqueal (pacientes pediátricos con edades comprendidas entre 1 mes y 12 años):
Al igual que en los adultos, la dosis de intubación recomendada de Cisatracurio Inibsa es de 0,15 mg/kg (peso corporal) administrada rápidamente durante 5 a 10 segundos. Esta dosis produce condiciones de buenas a excelentes para la intubación traqueal 120 segundos después de la inyección de Cisatracurio Inibsa. Los datos farmacodinámicos correspondientes a esta dosis se presentan en las tablas que se incluyen a continuación.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 4/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Cisatracurio no ha sido estudiado para intubación de pacientes pediátricos de Clase ASA III-IV. Se dispone de un número limitado de datos relativos al uso de cisatracurio con niños con menos de 2 años de edad sometidos a cirugía mayor o prolongada.
En pacientes pediátricos con edades comprendidas entre 1 mes y 12 años, cisatracurio presenta una duración clínicamente eficaz más corta, así como un perfil de recuperación espontánea más rápido que en el caso de los adultos sometidos a condiciones anestésicas similares. Se observaron pequeñas diferencias en las características farmacodinámicas entre los intervalos de edades de 1 mes a 11 meses y de 1 a 12 años, diferencias que se resumen en las tablas que se presentan a continuación.
Niños con edades comprendidas entre 1 y 11 meses
|
Dosis de cisatracurio mg/kg (peso corporal) |
Tipo de anestésico |
Tiempo hasta el 90% de supresión (min) |
Tiempo hasta supresión máxima (min) |
Tiempo hasta el 25% de recuperación espontánea de T1 (min |
|
0,15 |
Halotano |
1,4 |
2,0 |
52 |
|
0,15 |
Opiáceos |
1,4 |
1,9 |
47 |
Niños con edades comprendidas entre 1 y 12 años
|
Dosis de Besilato de cis atracurio mg/kg (peso corporal) |
Tipo de anestésico |
Tiempo hasta el 90% de supresión (min) |
Tiempo hasta supresión máxima (min) |
Tiempo hasta el 25% de recuperación espontánea de T1 (min |
|
0,15 |
Halotano |
2,3 |
3,0 |
43 |
|
0,15 |
Opiáceos |
2,6 |
3,6 |
38 |
Cuando Cisatracurio Inibsa no es necesario para la intubación: se puede utilizar una dosis de menos de 0,15 mg/kg. En la tabla que se presenta a continuación se incluyen los datos farmacodinámicos correspondientes a las dosis de 0,08 y 0,1 mg/kg en pacientes pediátricos con edades comprendidas entre 2 y 12 años.
|
Dosis de cisatracurio mg/kg (peso corporal) |
Tipo de anestésico |
Tiempo hasta el 90% de supresión (min) |
Tiempo hasta supresión máxima (min) |
Tiempo hasta el 25% de recuperación espontánea de T1 (min |
|
0,08 |
Halotano |
1,7 |
2,5 |
31 |
|
0,1 |
Opiáceos |
1,7 |
2,8 |
28 |
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 5/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
No se ha estudiado en niños la administración de cisatracurio tras suxametonio (ver sección 4.5).
Cabe esperar que halotano prolongue la duración clínicamente eficaz de una dosis de Cisatracurio Inibsa en hasta un 20%. No se dispone de información sobre el uso de cisatracurio en niños durante la anestesia con otros agentes anestésicos fluorocarbonados halogenados, pero es de esperar que estos fármacos también prolonguen la duración clínicamente eficaz de una dosis de Cisatracurio Inibsa.
Mantenimiento (pacientes pediátricos con edades entre 2 y 12 años). El bloqueo neuromuscular puede prolongarse con dosis de mantenimiento de Cisatracurio Inibsa. En niños con edades comprendidas entre 2 y 12 años, una dosis de 0,02 mg/kg (peso corporal) proporciona aproximadamente 9 minutos de bloqueo neuromuscular clínicamente eficaz adicional durante la anestesia con halotano. Dosis de mantenimiento consecutivas no conducen a una prolongación progresiva del efecto.
No existen datos suficientes que permitan realizar una recomendación específica sobre dosis de mantenimiento en niños con menos de 2 años de edad. Sin embargo, datos muy limitados procedentes de los ensayos clínicos en niños de menos de 2 años de edad sugieren que una dosis de mantenimiento de 0,03 mg/kg pueden prolongar el bloqueo neuromuscular clínicamente eficaz durante un periodo de hasta 25 minutos durante la anestesia con opiáceos.
Recuperación espontánea. Una vez que se inicia la recuperación del bloqueo neuromuscular, la velocidad es independiente de la dosis de Cisatracurio Inibsa administrada. Durante la anestesia llevada a cabo con opiáceos o halotano, las medianas de los tiempos para la recuperación del 25 al 75% y del 5% al 95% son, aproximadamente, 11 y 28 minutos, respectivamente.
Reversión. El bloqueo neuromuscular tras la administración de Cisatracurio Inibsa es fácilmente reversible con dosis estándares de agentes anticolinesterásicos. Los tiempos medios para una recuperación del 25 al 75% y para la recuperación clínica completa (ratio T4:T > 0,7) son, aproximadamente, 2 y 5 minutos, respectivamente, tras la administración del agente de reversión a un promedio del 13% de recuperación Ti.
Uso en perfusión intravenosa
- Posología en adultos y niños de 2 a 12 años
Se puede conseguir el mantenimiento del bloqueo neuromuscular por perfusión de Cisatracurio Inibsa. Se recomienda una velocidad inicial de perfusión de 3 microg/kg (peso corporal)/min (0,18 mg/kg/h) para restablecer el 89-99% de supresión T1 tras la evidencia de recuperación espontánea. Tras un periodo reinicial de estabilización del bloqueo neuromuscular, una velocidad de 1 a 2 microg/kg (peso corporal)/min (0,06 a 0,12 mg/kg/h) debe ser adecuada para mantener el bloqueo en este intervalo en la mayoría de los pacientes.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 6/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Puede precisarse una reducción de la velocidad de perfusión hasta en un 40% cuando cisatracurio se administre durante anestesia con isofluorano o enfluorano (ver sección 4.5.)
La velocidad de perfusión dependerá de la concentración de cisatracurio en la solución de perfusión, del grado deseado de bloqueo neuromuscular y de peso del paciente. La siguiente tabla presenta pautas para la administración de cisatracurio no diluido.
Velocidad de perfusión de Cisatracurio Inibsa 2 mg/ml
|
Paciente (peso corporal) (kg) |
DOSIS (microg/kg/min) |
Velocidad perfusión | |||
|
1,0 |
1,5 |
2,0 |
3,0 | ||
|
20 |
0,6 |
0,9 |
1,2 |
1,8 |
ml/h |
|
70 |
2,1 |
3,2 |
4,2 |
6,3 |
ml/h |
|
100 |
3,0 |
4,5 |
6,0 |
9,0 |
ml/h |
La perfusión continua de cisatracurio a una velocidad en equilibrio no está relacionada con una disminución o aumento progresivos del efecto de bloqueo neuromuscular.
Tras la interrupción de la perfusión de cisatracurio tiene lugar la recuperación espontánea del bloqueo neuromuscular, a una velocidad comparable a la que sigue a la administración de un único bolus.
- Posología en recién nacidos (con menos de 1 mes de edad)
No se recomienda la utilización de cisatracurio en recién nacidos ya que no se ha estudiado en este grupo de pacientes.
- Posología en pacientes de edad avanzada
No se precisan alteraciones en la dosificación en el caso de pacientes de edad avanzada. En estos pacientes, cisatracurio presenta un perfil farmacodinámico similar al observado en pacientes jóvenes adultos, pero, como ocurre con otros agentes bloqueantes neuromusculares, puede que la acción se inicie algo más despacio.
- Posología en pacientes con insuficiencia renal
No se precisan alteraciones de dosificación en pacientes con fallo renal. En estos pacientes, cisatracurio presenta un perfil farmacodinámico similar al observado en pacientes con la función renal normal, pero puede que la aparición de la acción tenga lugar ligeramente más despacio.
- Posología en pacientes con insuficiencia hepática
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 7/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
No se requieren alteraciones posológicas en pacientes con enfermedad hepática en fase terminal. En estos pacientes cisatracurio presenta un perfil farmacodinámico similar al observado en pacientes con la función hepática normal pero la acción puede aparecer ligeramente más deprisa.
- Posología en pacientes con enfermedad cardiovascular
Administrado por inyección rápida en bolus (durante 5 a 10 segundos) a pacientes adultos con enfermedad cardiovascular grave (New Cork Heart Association Clase I-III) sometidos a cirugía de bypass de las arterias coronarias (CABG), cisatracurio no se ha relacionado con efectos cardiovasculares clínicamente significativos a ninguna de las dosis estudiadas (hasta 0,4 mg/kg (8xDE95) inclusive). No obstante se dispone de datos limitados con dosis superiores a 0,3 mg/kg en este grupo de pacientes.
Cisatracurio Inibsa no se ha estudiado en niños sometidos a cirugía cardiaca.
- Posología en pacientes en la Unidad de Cuidados Intensivos (UCI)
Cisatracurio Inibsa puede ser administrado en bolus y/o perfusión a pacientes adultos en la UCI.
Para pacientes adultos en UCI, se recomienda una velocidad de perfusión inicial de cisatracurio de 3 microg/kg (peso corporal)/min (0,18 mg/kg/h). Puede existir una amplia variación entre pacientes en cuando a los requerimientos de dosis pudiendo estos aumentar o disminuir con el tiempo. En los estudios clínicos, la velocidad media de perfusión fue de 3 microg/kg/min [intervalo 0,5 a 10,2 microg/kg (peso corporal)/min (0,03 a 0,6 mg/kg/h)]
La mediana del tiempo necesario para la recuperación espontánea completa tras una perfusión de larga duración (hasta 6 días) de cisatracurio en pacientes en UCI, fue de aproximadamente 50 minutos.
Velocidad de perfusión de Cisatracurio Inibsa 5 mg/ml, solución inyectable
|
Paciente (peso corporal) kg |
DOSIS (microg/kg/min) |
Velocidad perfusión | |||
|
1,0 |
1,5 |
2,0 |
3,0 | ||
|
70 |
0,8 |
1,2 |
1,7 |
2,5 |
ml/h |
|
100 |
1,2 |
1,8 |
2,4 |
3,6 |
ml/h |
El perfil de recuperación tras perfusiones de Cisatracurio Inibsa a pacientes en UCI es independiente de la duración de perfusión.
4.3. Contraindicaciones
Hipersensiblidad al cisatracurio, atracurio, ácido bencenosulfónico o a alguno de los excipientes.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 8/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
4.4. Advertencias y precauciones especiales de empleo
Características específicas del producto.
Cisatracurio paraliza los músculos respiratorios así como otros músculos esqueléticos, pero carece de efecto sobre la consciencia o sobre el umbral del dolor. Cisatracurio Inibsa sólo debe ser administrado por o bajo la supervisión de anestesistas o médicos familiarizados con el empleo de acción de agentes bloqueantes neuromusculares. Es necesario disponer de medios para intubación traqueal, mantenimiento de la ventilación pulmonar y oxigenación arterial adecuada.
Se debe tener precaución cuando se administre Cisatracurio Inibsa a pacientes que hayan mostrado tener una hipersensibilidad a otros agentes bloqueantes neuromusculares, debido a la elevada tasa de sensibilidad cruzada notificada (mayor del 50%) entre agentes bloqueantes neuromusculares (ver sección 4.3).
Cisatracurio no presenta propiedades vagolíticas significativas o bloqueo ganglionar. En consecuencia, Cisatracurio Inibsa carece de efecto clínicamente significativo sobre el ritmo cardiaco y no contrarrestará la bradicardia producida por muchos agentes anestésicos o por estimulación vagal durante la cirugía.
Los pacientes con miastenia gravis y otras formas de enfermedad neuromuscular han mostrado una sensibilidad muy incrementada a agentes bloqueantes no despolarizantes. Se recomienda una dosis inicial no superior a 0,02 mg/kg de Cisatracurio Inibsa en estos pacientes.
Anormalidades graves de tipo ácido-base y/o electrolitos séricos pueden incrementar o disminuir la sensibilidad de los pacientes a los agentes bloqueantes neuromusculares.
No existe información sobre el empleo de cisatracurio en recién nacidos con menos de 1 mes de edad, dado que no ha sido estudiado en este tipo de pacientes.
Cisatracurio no se ha estudiado en pacientes con una historia de hipertermia maligna Estudios en cerdos susceptibles a hipertermia maligna indicaron que cisatracurio no desencadena este síndrome.
No se han realizado estudios con cisatracurio en pacientes sometidos a cirugía con hipotermia inducida (25 a 28°C). Como ocurre con otros agentes bloqueantes neuromusculares, se puede esperar que la velocidad de perfusión necesaria para mantener una relajación quirúrgica adecuada bajo estas condiciones se reduzca significativamente.
No se ha estudiado cisatracurio en pacientes con quemaduras; en cualquier caso, como ocurre con otros agentes bloqueantes neuromusculares no despolarizantes, la posibilidad de tener que necesitar una dosificación mayor y una duración de acción más corta debe tenerse en consideración si Cisatracurio Inibsa va a ser administrado a este tipo de pacientes.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 9/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Cisatracurio Inibsa es hipotónico y no se debe administrar en la línea de perfusión de una transfusión sanguínea.
Pacientes en la Unidad e Cuidados Intensivos (UCI)
Cuando se administra a animales de laboratorio a dosis elevadas, laudanosina, un metabolito de cisatracurio y atracurio, se ha relacionado con hipotensión pasajera y, en algunas especies, con efectos cerebrales excitatorios. En las especies animales más sensibles, estos efectos ocurrieron a concentraciones plasmáticas de laudanosina similares a las observadas en algunos pacientes de UCI tras su perfusión prolongada de atracurio.
En concordancia con la menos velocidad de perfusión requerida con cisatracurio, las concentraciones plasmáticas de laudanosina representan aproximadamente un tercio de las encontradas tras la perfusión de atracurio.
Raramente se han notificado casos de crisis en pacientes en UCI que hayan recibido atracurio y otros agentes. Estos pacientes normalmente presentaban una o más patologías predisponentes a las crisis (por ejemplo, trauma craneal, encefalopatía hipóxica, edema cerebral, encefalitis vírica, uremia). No se ha establecido una relación causal con laudanosina.
4.5. Interacción con otros medicamentos y otras formas de interacción
Muchos fármacos han demostrado influir en la magnitud y/o duración de la acción de agentes bloqueantes neuromusculares no despolarizantes, incluyendo los siguientes:
Incremento del efecto:
Por agentes anestésicos como el enfluorano, isofluorano, halotano (ver sección 4.2) y ketamina, por otros bloqueantes neuromusculares no despolarizantes o por otros fármacos como antibióticos (incluyendo aminoglucósidos, polimixinas, espectinomicina, tetraciclinas, lincomicina y clindamicina), fármacos antiarritmicos (incluyendo propranolol, bloqueantes de los canales del calcio, lignocaína, procainamida y quinidina), diuréticos (incluyendo furosemida y posiblemente tiazidas, manitol y acetazolamida), sales de magnesio y litio y bloqueantes ganglionares (trimetafán, hexametonio).
Se observa un menor efecto después de la administración previa crónica de fenitoína o carbamazepina.
La administración previa de suxametonio carece de efecto sobre la duración del bloqueo neuromuscular tras dosis en bolus de Cisatracurio Inibsa o sobre los requerimientos en la velocidad de perfusión.
La administración previa de suxametonio para prolongar los efectos de bloqueantes neuromusculares no despolarizantes puede conducir a un bloqueo prolongado y complejo cuya
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 10/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
reversión por agentes anticolinesterásicos puede ser difícil.
Raramente, ciertos fármacos pueden agravar o desenmascarar una miastenia gravis latente o inducir realmente un síndrome miasténico; podría producirse una mayor sensibilidad a agentes bloqueantes neuromusculares no despolarizantes. Tales fármacos incluyen varios antibióticos, betabloqueantes (propranolol, oxprenolol), fármacos antiarrítmicos (procainamida, quinidina) fármacos antirreumáticos (cloroquina, D-penicilamina), trimetafán, clorpromazina, esteroides, fenitoína y litio.
El tratamiento con anticolinesterasas, normalmente utilizados en el tratamiento de la enfermedad de Alzheimer, por ejemplo donepezilo, puede acortar la duración y disminuir la magnitud del bloqueo neuromuscular con cisatracurio.
4.6. Fertilidad, embarazo y lactancia
No existen datos suficientes sobre la utilización de cisatracurio en mujeres embarazadas.
Los estudios en animales son insuficientes para determinar los efectos del cisatracurio sobre el embarazo, desarrollo embrional/fetal, parto, desarrollo postnatal (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos.
Cisatracurio Inibsa no debe utilizarse durante el embarazo.
Lactancia
No se sabe si cisatracurio o sus metabolitos se excretan en la leche humana.
No se puede excluir el riesgo en recién nacidos/niños.
Debe interrumpirse la lactancia durante el tratamiento con Cisatracurio Inibsa.
Fertilidad
No se han realizado estudios de fertilidad en animales.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
Esta precaución no es relevante en lo que respecta a la utilización de Cisatracurio Inibsa.
Cisatracurio Inibsa siempre se utilizará en combinación con un anestésico general y, por lo tanto, son aplicables las precauciones normales relativas a la realización de tareas tras la anestesia general.
4.8. Reacciones adversas
Los datos obtenidos de ensayos clínicos internos se han usado para determinar la frecuencia de las reacciones adversas desde muy frecuentes a poco frecuentes.
Se ha utilizado el siguiente convenio para la clasificación de la frecuencia:
Muy frecuentes (>1/10),
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 11/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Frecuentes (>1/100 a <1/10),
Poco frecuentes (>1/1.000 a <1/100),
Raras (>1/10.000 a < 1/1.000),
Muy raras (<1/10.000),
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Datos de ensayos clínicos
Trastornos cardiacos
Frecuentes Bradicardia
Trastornos vasculares
Frecuentes Hipotensión
Poco frecuentes Rubor cutáneo
Trastornos respiratorios, torácicos y mediastínicos
Poco frecuentesBroncoespasmo Trastornos de la piel y del tejido subcutáneo Poco frecuentes Erupción Datos postcomercialización Trastornos del sistema inmunológico
Muy raras Reacción anafiláctica
Se han observado reacciones anafilácticas de gravedad variable tras la administración de agentes bloqueantes neuromusculares. Muy raramente se han comunicado reacciones anafilácticas graves en pacientes a los que se les administró cisatracurio junto con uno o más agentes anestésicos.
Trastornos musculoesqueléticos y del tejido conjuntivo
Muy raras Miopatía, debilidad muscular
Han tenido lugar algunos informes de debilidad muscular y/o miopatía tras el uso prolongado de relajantes musculares en pacientes gravemente enfermos en la UCI. La mayoría de los pacientes estaban recibiendo corticosteroides al mismo tiempo. Estos efectos se han comunicados con poca frecuencia en asociación con cisatracurio, no habiéndose establecido una relación causal.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 12/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
4.9. Sobredosis
Síntomas y signos
Es de esperar que la parálisis muscular prolongada y sus consecuencias sean los signos principales de sobredosis con cisatracurio.
Tratamiento
Es esencial mantener la ventilación pulmonar y la oxigenación arterial hasta que vuelva a tener lugar una respiración espontánea adecuada. Se precisará sedación completa dado que la consciencia no se ve afectada por Cisatracurio Inibsa. Se puede acelerar la recuperación por la administración de agentes anticolinesterásicos una vez se tenga evidencia de recuperación espontánea.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes relajantes musculares de acción periférica, código ATC: M03AC11
Cisatracurio es un relajante benzilisoquinolínico del músculo esquelético, no despolarizante y de duración intermedia.
Estudios clínicos en el hombre indicaron que cisatracurio no está asociado con liberación de histamina dependiente de la dosis, incluso a dosis de hasta 8 x DE95.
Mecanismo de acción
Cisatracurio se une a los receptores colinérgicos de la placa motora terminal para antagonizar la acción de acetilcolina, dando lugar a un bloqueo competitivo de la transmisión neuromuscular. Esta acción puede revertir fácilmente por agentes anticolinesterásico como neostigmina o edrofonio.
La DE95 (dosis requerida para producir una depresión del 95% de la respuesta espasmódica del músculo abductor del pulgar al estimular el nervio cubital) de cisatracurio, se estima en 0,05 mg/kg de peso corporal durante la anestesia con opiáceos (tiopentona/fentanilo/midazolam).
La DE95 de cisatracurio en niños durante la anestesia con halotano es de 0,04 mg/kg.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 13/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
5.2. Propiedades farmacocinéticas
Cisatracurio sufre degradación en el organismo a temperatura y pH fisiológicos vía eliminación de Hofmann (un proceso químico) para formar laudanosina y el metabolito acrilato monocuaternario. El acrilato monocuaternario sufre hidrólisis por estearasas del plasma no específicas para formar el metabolito alcohol cuaternario. La eliminación de cisatracurio es bastante independiente de los órganos pero el hígado y los riñones constituyen las vías principales para el aclaramiento de sus metabolitos.
Estos metabolitos no poseen actividad bloqueante neuromuscular.
Farmacocinética en pacientes adultos
La farmacocinética no compartimental de cisatracurio es independiente de la dosis en el intervalo estudiado (0,1 a 0,2 mg/kg, es decir 2 a 4 veces la DE95).
El modelo farmacocinético de la población confirma y amplía estos hallazgos hasta 0,4 mg/kg (8 x DE95). Los parámetros farmacocinéticos tras dosis de 0,1 y 0,2 mg/kg de cisatracurio, administradas a pacientes quirúrgicos adultos sanos, se resume en la siguiente tabla:
|
Parámetro |
Intervalo de valores medios |
|
Aclaramiento |
4,7 a 5,7 ml/min/kg |
|
Volumen distribución en estado de equilibrio |
121 a 161 ml/kg |
|
Semivida de eliminación |
22 a 29 min |
Farmacocinética en pacientes de edad avanzada
No existen diferencias clínicamente importantes en la farmacocinética de cisatracurio entre pacientes pacientes de edad avanzada y pacientes adultos jóvenes. El perfil de recuperación también permanece inalterado.
Farmacocinética en pacientes con insuficiencia renal/hepática
No existen diferencias clínicamente importantes en la farmacocinética de cisatracurio entre pacientes con fallo renal en fase terminal o con enfermedad hepática en fase terminal y pacientes adultos sanos. Sus perfiles de recuperación tampoco varían.
Farmacocinética durante perfusiones
La farmacocinética de cisatracurio tras perfusiones de soluciones de cisatracurio es similar a la encontrada tras una única inyección en bolus. El perfil de recuperación tras la perfusión de cisatracurio es independiente de la duración de la perfusión y es similar al registrado tras una única inyección en bolus.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 14/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Farmacocinética de pacientes en Unidades de Cuidados Intensivos (UCI)
La farmacocinética de cisatracurio en pacientes de UCI que reciben perfusiones prolongadas es similar a la de pacientes quirúrgicos adultos sanos, que reciben perfusiones o inyecciones en bolus únicas. El perfil de recuperación tras perfusiones de cisatracurio en pacientes en UCI es independiente de la duración de la perfusión.
Las concentraciones de metabolitos son más elevadas en pacientes en UCI con función renal y/o hepática anormal (ver sección 4.4). Estos metabolitos no contribuyen al bloqueo neuromuscular.
5.3. Datos preclínicos sobre seguridad
Toxicidad aguda
No han podido realizarse estudios significativos en toxicidad aguda con cisatracurio. Para síntomas de toxicidad, ver sección 4.9
Toxicidad subaguda
Los estudios realizados con administración repetida durante tres semanas en perros y monos no mostraron signos de toxicidad específicos con este compuesto.
Mutagenicidad
Cisatracurio no fue mutagénico en un estudio microbiano de mutagenicidad in vitro a concentraciones de hasta 5.000 microg/placa.
En un estudio citogénico in vivo en ratas, no se observaron anormalidades cromosómicas significativas a dosis s.c de hasta 4 mg/kg.
Cisatracuriuo fue mutagénico en un ensayo de mutagenicidad in vitro en linfoma de ratón a concentraciones de 40 microg/ml y mayores.
Una respuesta mutagénica positiva única para un fármaco que se utiliza con poca frecuencia y/o en periodos cortos es de relevancia clínica cuestionable.
Carcinogenicidad
No se han realizado estudios de carcinogenicidad.
Toxicología reproductiva
No se han realizado estudios de fertilidad. Los estudios reproductivos en ratas no han mostrado ningún efecto adverso en el desarrollo fetal con cisatracurio.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 15/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Tolerancia local
El resultado de un estudio intra-arterial en conejos mostró que cisatracurio inyectable se tolera bien y no se observaron cambios relacionados con el fármaco.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Solución de ácido bencenosulfónico al 32% p/v, agua para preparaciones inyectables.
6.2. Incompatibilidades
Se ha demostrado que la degradación de cisatracurio tiene lugar más rápidamente tanto cuando se diluye en inyección Ringer Lactato y Dextrosa al 5% como cuando se diluye en Ringer lactato sólo, que en los fluidos de perfusión enumerados en la sección 6.6.
Por tanto, se recomienda no utilizar Ringer lactato sólo ni inyección de Dextrosa al 5% y Ringer lactato como diluyentes en la preparación de soluciones de Cisatracurio Inibsa para perfusión.
Dado que Cisatracurio Inibsa sólo es estable en soluciones ácidas, no debe mezclarse en la misma jeringa o administrarse simultáneamente a través de la misma aguja con soluciones alcalinas, como por ejemplo tiopentona sódica. No es compatible con ketorolaco trometamol ni con emulsión inyectable de propofol.
6.3. Periodo de validez
Periodo de validez antes de dilución: 18 meses.
Periodo de validez después de la dilución:
Se ha demostrado la estabilidad química y física durante el uso durante al menos 24 horas a 5°C y 25°C (ver sección 6.6).
Desde el punto de vista microbiológico, el producto diluido debe utilizarse inmediatamente. Si no se usa de forma inmediata, los tiempos y condiciones de almacenamiento previos a la utilización, son responsabilidad de la persona que lo vaya a usar y normalmente no deben ser superiores a 24 horas a 2-8°C, a menos que la dilución se haya realizado en condiciones asépticas controladas y validadas.
6.4. Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar
Conservar en el embalaje exterior para protegerlo de la luz.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 16/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
Para las condiciones de conservación del medicamento diluido, ver sección 6.3
6.5. Naturaleza y contenido del envase
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión Ampollas (vidrio) de 2,5 ml: caja con 5 ampollas.
Ampollas (vidrio) de 5 ml: caja con 5 ampollas.
Ampollas (vidrio) de 10 ml: caja con 5 ampollas.
Ampollas de vidrio neutro, transparente de Tipo I.
Cisatracurio Inibsa 5 mg/ml solución inyectable y para perfusión Vial (vidrio) de 30 ml: caja con 1 vial.
Vial de vidrio neutro, transparente de Tipo I, con tapón de goma bromobutilo sintética con recubrimiento polimérico, provisto de una cápsula de aluminio y cubierta de plástico de tipo “flip-top”.
Puede que solamente estén comercializados algunos tamaños de envases
6.6. Precauciones especiales de eliminación y otras manipulaciones
Este producto es sólo para un único uso. Utilizar únicamente soluciones límpidas y casi incoloras o de color amarillo claro a amarillento/verdoso. El producto debe ser inspeccionado visualmente antes de su uso, y si la apariencia visual ha cambiado o si el recipiente está dañado, el producto se debe desechar.
Cisatracurio Inibsa diluido permanece física y químicamente estable durante al menos 24 horas a 5°C y 25°C a concentraciones entre 0,1 y 2 mg/ml en los siguientes fluidos de perfusión, bien en envases de cloruro de polivinilo o de polipropileno.
Perfusión intravenosa de cloruro sódico (0,9% p/v)
Perfusión intravenosa de glucosa (5% p/v)
Perfusión intravenosa de cloruro sódico (0,18% p/v) y glucosa (4% p/v)
Perfusión intravenosa de cloruro sódico (0,45% p/v) y glucosa (2,5% p/v)
En cualquier caso, dado que el producto no contiene conservantes antomicrobianos, la dilución debe realizarse inmediatamente antes de su uso o, si esto no es posible, se puede conservar como se indica en la sección 6.3
Cisatracurio ha demostrado ser compatible con los siguientes fármacos normalmente utilizados en operaciones quirúrgicas, cuando se mezclan en condiciones que simulan la administración vía perfusión intravenosa a través de un dispositivo en Y: hidrocloruro de alfentanilo, droperidol, citrato de fentanilo, hidrocloruro de midazolam, y citrato de sufentanilo. Cuando se administran otros fármacos a través de la misma aguja o cánula que Cisatracurio Inibsa, se recomienda que
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 17/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
cada fármaco se arrastre con un volumen adecuado de un fluido intravenoso apropiado como por ejemplo: perfusión intravenosa de cloruro sódico (0,9% p/v).
Como en el caso de otros fármacos de administración intravenosa, cuando se elige una vena pequeña como lugar de inyección, Cisatracurio Inibsa debe arrastrarse con un fluido de perfusión adecuado, como por ejemplo: perfusión intravenosa de cloruro sódico (0,9% p/v)
Instrucciones para abrir la ampolla de Cisatracurio Inibsa:
Las ampollas tienen un sistema de apertura de “Un Punto de Corte” (UPC) y se deben abrir siguiendo las instrucciones siguientes:
- Sujetar con una mano la parte inferior de la ampolla, como se indica en la figura 1.
- Colocar la otra mano en la parte superior de la ampolla, situando el dedo pulgar encima del punto coloreado y presionar, como se indica en la figura 2.
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 18/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
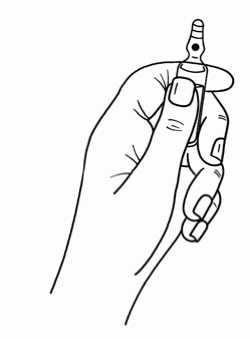
Figura 1
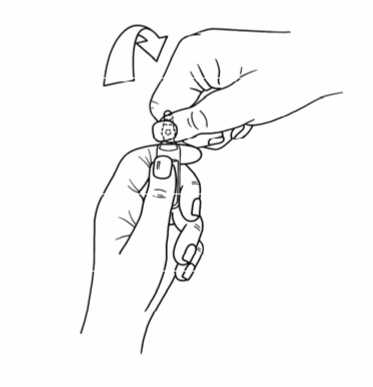
Figura 2
|
Cisatracurio Inibsa 2 mg/ml solución inyectable y para perfusión EFG |
Página 19/19 |
|
MODULO 1.3 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. ETIQUETADO Y PROSPECTO | |
|
INIBSA HOSPITAL S.L.U. | |
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN INIBSA HOSPITAL, S.L.U.
Ctra. Sabadell a Granollers, km 14,5 08185 Lliqá de Vall - Barcelona, España
8. NUMERO(S) DE AUTORIZACION DE COMERCIALIZACION
(Pendiente)
9. FECHA DE LA PRIMERA AUTORIZACION/RENOVACIÓN DE LA AUTORIZACION
Febrero 2012
10. FECHA DE REVISION DEL TEXTO
Resumen de las características del producto - versión 300710 19