Ceplene 0,5 Mg/0,5 Ml Solucion Inyectable
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Ceplene 0,5 mg/0,5 ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial de 0,5 ml de solución contiene 0,5 mg de dihidrocloruro de histamina. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución acuosa clara y transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
El tratamiento de mantenimiento con Ceplene está indicado para pacientes adultos con leucemia mieloide aguda (LMA) en primera remisión tratados de manera concomitante con interleucina 2 (IL-2). No se ha demostrado completamente la eficacia de Ceplene en pacientes mayores de 60 años.
4.2 Posología y forma de administración
El tratamiento de mantenimiento con Ceplene deberá administrarse tras haber finalizado un tratamiento de consolidación en pacientes tratados de manera concomitante con IL-2 bajo la supervisión de un médico con experiencia en el tratamiento de la leucemia mieloide aguda.
Posología
Si desea ver las instrucciones de dosificación de Ceplene en combinación con IL-2, consulte el apartado Posología más adelante.
Interleucina 2 (IL-2)
La IL-2 se administra en dos dosis diarias mediante inyección subcutánea de 1 a 3 minutos antes de la administración de Ceplene; cada dosis de IL-2 son 16.400 Ul/kg (1 pg/kg).
La Interleucina-2 (IL-2) está disponible comercialmente como una IL-2 recombinante; aldesleukina. Las normas abajo indicadas para la dispensación y almacenamiento son específicas para aldesleukina.
IL-2 (aldesleukina) se debe reconstituir de forma aséptica, diluida y dispensada por la farmacia, en jeringuillas de tuberculina de polipropileno con tapa protectora, en base al peso individual de los pacientes (ver más abajo las pautas de administración para aldesleukina) a la dosis recomendada de 16.400 Ul/kg (1 pg/kg). Para la administración en casa, a los pacientes se les puede proporcionar jeringuillas de tuberculina precargadas con tapa protectora para hasta dos semanas de tratamiento, con instrucciones de que las jeringuillas se deben conservar en nevera entre 2°C - 8°C hasta la administración.
Los estudios han demostrado la estabilidad química y esterilidad de la aldesleukina diluida (dispensada en jeringuillas de tuberculina de polipropileno con tapa protectora) de hasta tres semanas, cuando se preparan en un medio aséptico controlado y se conservan en nevera entre 2°C - 8°C.
NOTA: La dispensación de aldesleukina debe llevarse a cabo en condiciones asépticas controladas.
Dispensación para cada paciente de la IL-2 (Aldesleukina) diluida
La IL-2 (aldesleukina) diluida se prepara asépticamente para cada paciente en jeringuillas estériles de tuberculina de polipropileno con tapa protectora a la dosis de 1 pg/kg, con un volumen de dosificación estándar mínimo de 0,25 ml (50 pg) y una dosis máxima de 0,5 ml (100 pg). Los volúmenes de dosificación basados en el peso del paciente se indican en la Tabla 1. Esta tabla también indica el volumen requerido en caso de prescribirse una reducción de dosis del 20% .
Tabla 1: Pauta de administración para IL-2 (aldesleukina)
|
Peso del paciente (kg) |
Dosis estándar (Pg) |
Volumen* de inyección (ml) |
20% de reducción de dosis volumen de inyección (ml)** |
|
<50 |
50 |
0.25 |
0.20 |
|
>50 a <60 |
60 |
0.30 |
0.25 |
|
>60 a <70 |
70 |
0.35 |
0.30 |
|
>70 a <80 |
80 |
0.40 |
0.30 |
|
>80 a <90 |
90 |
0.45 |
0.35 |
|
>90 a <100 |
100 |
0.50 |
0.40 |
|
>100 |
100 |
0.50 |
0.40 |
*Volumen de inyección redondeado al 0,05ml
** Volúmenes de inyección basados en reducciones del 20%, redondeados de forma que la reducción real de dosis varía del 15%-25%
0,5 ml de solución son suficientes para una sola dosis (ver sección 6.6).
Ceplene se administra entre 1 y 3 minutos después de cada inyección de IL-2. Cada dosis de 0,5 ml de Ceplene se administra lentamente, durante un periodo de 5 a 15 minutos.
Ciclos de tratamiento
Ceplene y la IL-2 se administran para 10 ciclos de tratamiento: cada ciclo consta de un periodo de tratamiento de 21 días (3 semanas), seguidos de un periodo sin tratamiento de tres o seis semanas de duración.
En el caso de los ciclos 1-3, cada ciclo consiste en 3 semanas de tratamiento, seguidas de 3 semanas sin tratamiento. En el caso de los ciclos 4-10, cada ciclo consiste en 3 semanas de tratamiento, seguidas de 6 semanas sin tratamiento.
En las tablas 2 y3 se indica el régimen de dosificación recomendado.
Tabla 2: Para los ciclos de tratamiento 1-3 con Ceplene e IL-2
|
Número de semana (S)* |
Tratamiento* | ||
|
Ciclo 1 |
Ciclo 2 |
Ciclo 3 | |
|
S1 a S3 (Días 1-21) |
S7 a S9 (Días 1-21) |
S13 aS15 (Días 1-21) |
16.400 Ul/kg de IL-2, seguido de 0,5 ml de Ceplene. Dos veces al día. |
|
S4 a S6 |
S10a S12 |
S16 aS18 |
Periodo sin tratamiento (3 semanas) |
*Ver apartado «Modificación de la dosis» para obtener información sobre la modificación del programa de dosis y dosificación.
Tabla 3: Para los ciclos de tratamiento 4-10 con Ceplene e IL-2, igual que la tabla 2, a excepción del número de ciclos y de la duración de los periodos sin tratamiento
|
Número de semana (S)* |
Tratamiento* | ||||||
|
Ciclos | |||||||
|
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
|
S19 a S21 |
S28 a S30 |
S37 a S39 |
S46 a S48 |
S55 a S57 |
S64 a S66 |
S73 a S75 |
16.400 UI/kg de IL-2, seguido de 0,5 ml de Ceplene. Dos veces al día. |
|
S22 a S27 |
S31 a S36 |
S40 a S45 |
S49 a S54 |
S58 a S63 |
S67 a S72 |
S76 a S81 |
Periodo sin tratamiento (6 semanas) |
*ver el aparta
o «Modificación de la dosis» para obtener información sobre la modificación del
programa de dosis y dosificación.
Modificación de la dosis
Debería controlarse si los pacientes sufren las reacciones sintomáticas adversas y los cambios clínicos habituales asociados a este tratamiento. Deberán modificarse las dosis de Ceplene e IL-2 cuando sea necesario en función de la tolerancia de cada paciente al tratamiento. Se recomienda emprender las modificaciones de dosis en primeras fases del tratamiento. Las reducciones de la dosis pueden ser temporales o permanentes.
Si se producen toxicidades relacionadas con Ceplene (como hipotensión o cefaleas), el tiempo de inyección puede incrementarse de 5 minutos hasta una duración máxima de 15 minutos.
Para pacientes que experimenten episodios de toxicidad en grado 1
No se recomienda alterar la dosis, excepto si se trata de toxicidad neurológica en grado 1 o de dermatitis tóxica generalizada en grado 1. En las secciones pertinentes que figuran a continuación pueden consultarse las dosis recomendadas para estos episodios de toxicidad en grado 1.
Para pacientes que experimenten toxicidad neurológica en grados 1-4
- En los casos de toxicidad en grados 1-3, deberá interrumpirse el tratamiento hasta llegar al episodio de toxicidad en grado 0. En ese momento, deberá reiniciarse el tratamiento con una reducción de la dosis del 20 % tanto para Ceplene como para IL-2.
- En caso de toxicidad en grado 4, deberá considerarse la posibilidad de interrumpir el tratamiento.
Para pacientes que experimenten dermatitis tóxica generalizada en grados 1-4
- En caso de toxicidad en grado 1, deberá retrasarse el tratamiento 48 horas o hasta que los síntomas hayan remitido. En ese momento, deberá reiniciarse el tratamiento utilizando la dosis habitual de Ceplene, pero reduciendo la dosis de IL-2 en un 20 %.
- En caso de toxicidad de grado 2, se reducirá la dosis de IL-2 en un 50 % y sólo se volverá a la dosis habitual si los síntomas no reaparecen. Deberán transcurrir 60 minutos entre la dosis de Ceplene y la de IL-2, manteniendo esta pauta durante todo el tratamiento. En los casos de toxicidad de grados 3 y 4, deberá interrumpirse el tratamiento y no reanudarlo hasta que los episodios no hayan remitido. Sólo se deberá reanudar el tratamiento tras haber evaluado los riesgos y beneficios para el paciente.
Para pacientes que experimenten toxicidad en grado 2 (que incluye función cardiaca, renal y hepática)
- Deberá interrumpirse el tratamiento hasta que el episodio haya vuelto al grado 1;
- Deberá ampliarse el tiempo de inyección de la dosis de Ceplene hasta un máximo de 15 minutos.
- En caso de toxicidades cardiaca, hepática o renal, deberá reducirse en un 20 % tanto la dosis de Ceplene como la de IL-2.
Para pacientes que experimenten toxicidades en grados 3 y 4 (que incluyen hipotensión y arritmia)
- Deberá interrumpirse el tratamiento hasta que se resuelva el episodio. El plazo máximo para que remitan los episodios en grados 3 y 4 será de un ciclo de tratamiento.
Si persisten la hipotensión, las cefaleas, la arritmia y las toxicidades cardiaca, hepática y renal:
- Deberá ampliarse el tiempo de inyección de la dosis de Ceplene hasta un máximo de 15 minutos.
- Deberá reducirse en un 20 % tanto la dosis de Ceplene como la de IL-2.
Fiebre
- Se puede interrumpir la IL-2 durante 24 horas y retomarla a continuación con una reducción de la dosis del 20 %.
Recuentos leucocitarios anómalos
- Se puede reducir la dosis de IL-2 en un 20 % para el periodo restante del tratamiento, y si se siguen presentando recuentos leucocitarios anómalos durante el siguiente ciclo, se recomienda que la reducción de la IL-2 sea permanente.
Dermatitis tóxica localizada
-Deberá interrumpirse el tratamiento hasta que hayan remitido los síntomas. Se puede reanudar el tratamiento administrando Ceplene en su dosis habitual e IL-2 al 50 %.
Poblaciones especiales
Insuficiencia renal
Los pacientes con insuficiencia renal pueden ser más sensibles a los efectos hipotensores de Ceplene. Aunque no se ha demostrado que el grado de insuficiencia renal afecte a la disposición farmacocinética de Ceplene, es necesario tener cautela al administrar Ceplene a pacientes con insuficiencia renal aguda. Sin embargo, normalmente no es necesario reducir la dosis de Ceplene en pacientes con insuficiencia renal.
Insuficiencia hepática
Ceplene debería usarse con precaución en pacientes con insuficiencia hepática entre moderada y grave (ver sección 5.2). Las concentraciones plasmáticas de Ceplene son superiores en pacientes con trastornos hepáticos moderados y agudos, y estos grupos de pacientes suelen experimentar más taquicardia e hipotensión tras una dosis de Ceplene que los pacientes con una función hepática normal o levemente afectada. Sin embargo, no se pronosticaron efectos adversos como consecuencia de las concentraciones plasmáticas del fármaco y los efectos no estuvieron directamente relacionados con la administración del fármaco. Normalmente, no es necesario reducir la dosis de Ceplene en pacientes con fallos hepáticos, aunque habrá que prestar atención a estos pacientes.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Ceplene en niños menores de 18 años.No se dispone de datos.
Forma de administración
Ceplene es exclusivamente para uso subcutáneo.
Ceplene debe administrarse entre 1 y 3 minutos después de finalizar la administración subcutánea de la IL-2, mediante una inyección subcutánea lenta a un ritmo máximo de 0,1 ml (0,1 mg de dihidrocloruro de histamina) por minuto. Normalmente se tarda 5 minutos en administrar una dosis de 0,5 ml de Ceplene. Para reducir las posibles reacciones adversas, el tiempo de administración puede alargarse hasta un máximo de 15 minutos (ver más abajo). Se puede administrar Ceplene mediante una bomba de jeringuilla de infusión ambulatoria o mediante una inyección subcutánea manual controlada con una jeringuilla con temporizador.
La primera dosis de Ceplene e IL-2 en el día 1 del primer ciclo de tratamiento deberá administrarse en un centro sanitario, bajo la supervisión directa de un médico. El día 1 habrá que controlar las constantes vitales del paciente, incluyendo el ritmo cardiaco, la tensión arterial y la frecuencia respiratoria. Si el paciente experimenta una alteración significativa de las constantes vitales, el médico deberá evaluar el estado del paciente y seguir controlando las constantes. El control de estos pacientes deberá repetirse en los siguientes tratamientos.
Si el paciente demuestra que comprende las precauciones necesarias y que tiene la habilidad adecuada para ponerse una inyección, puede administrarse las siguientes inyecciones de Ceplene en casa.
Lo recomendable es administrar las inyecciones en un entorno supervisado y en presencia de un familiar adulto, un amigo u otro cuidador que sepa cómo reaccionar en caso de señales o síntomas de hipotensión.
Las zonas más adecuadas para aplicar la inyección son los muslos y el abdomen. No deberá inyectarse Ceplene en la misma región anatómica que la IL-2.
Entre las dos dosis diarias de IL-2 y Ceplene deberían transcurrir al menos 6 horas. Tras la inyección de Ceplene, los pacientes deberán descansar durante 20 minutos.
Para consultar las instrucciones de reconstitución y dilución de interleucina-2 (aldesleukina) antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Pacientes con una considerable afectación cardiaca, por ejemplo, clases III y IV de la NYHA. Pacientes que reciben un tratamiento corticoesteroideo sistémico, clonidina y antihistamínicos
H2.
Pacientes que hayan recibido un alotransplante hemocitoblástico. Durante el embarazo.
Durante la lactancia.
4.4 Advertencias y precauciones especiales de empleo
Será preciso esperar entre 1 y 3 minutos para administrar Ceplene tras la IL-2, en lugar de hacerlo de manera concomitante.
Si la inyección subcutánea es rápida o si se inyecta en un espacio vascular, puede dar lugar a hipotensión, taquicardia o síncope agudos.
El tratamiento con Ceplene combinado con IL-2 deberá emplearse con precaución en pacientes cuya actividad cardiaca esté mal compensada. En pacientes con afecciones cardiacas habrá que analizar si padecen fracción de eyección ventricular y actividad parietal mediante un ecocardiograma o mediante una prueba de esfuerzo con medicina nuclear y, posteriormente, deben ser tratados con precaución.
Debe vigilarse a los pacientes durante el tratamiento por si surgen complicaciones clínicas debidas a la hipotensión o a la hipovolemia. Ceplene deberá administrarse en la clínica bajo la supervisión de un médico el día 1 del ciclo inicial de tratamiento. El día 1 habrá que controlar las constantes vitales del paciente, incluidos el ritmo cardiaco, la presión arterial y la frecuencia respiratoria.
El seguimiento del paciente debe continuar durante los siguientes días o ciclos de tratamiento mientras el paciente siga experimentando cambios significativos en sus constantes vitales al administrarle Ceplene. Si se observa una hipotensión relevante o síntomas afines en los siguientes ciclos de tratamiento, habrá que iniciar una reducción de la dosis y, si es preciso, administrarla en el hospital hasta que las respuestas al tratamiento permitan administrarla a domicilio.
Se debe tener precaución con los pacientes que sufren: arteriopatía periférica sintomática, que sufren o han sufrido úlcera gastroduodenal o esofágica con antecedentes de hemorragia, una afección renal clínicamente relevante o una apoplejía en los últimos 12 meses. Cuando corresponda, habrá que considerar la posibilidad de ofrecer un tratamiento simultáneo con un inhibidor de bomba de protones.
Se debe tener precaución con aquellos pacientes que sufran una infección clínicamente relevante que exija el uso de antibióticos, antifúngicos o antivirales o que hayan concluido un tratamiento antiinfeccioso dentro de los 14 días posteriores al inicio del tratamiento, salvo que el uso de los antibióticos o antivirales tenga fines profilácticos.
Se debe tener precaución con aquellos pacientes que tengan antecedentes de enfermedades autoinmunes (como lupus sistémico, enfermedad inflamatoria intestinal, soriasis y artritis reumatoide).
Se recomienda el seguimiento de los resultados de las pruebas de laboratorio, incluidos los análisis bioquímicos y hemáticos habituales.
Habrá que tratar con precaución a los pacientes a los que se administren los siguientes medicamentos (ver sección 4.5):
- Betabloqueantes u otros antihipertensores.
- Antihistamínicos H1 y neurolépticos (antipsicóticos) con propiedades antagonistas de los receptores H1.
- Antidepresivos tricíclicos que puedan tener propiedades antagonistas de los receptores H1 y H2.
- Inhibidores de monoaminoxidasa y fármacos antipalúdicos y antitripanosómicos.
- Inhibidores neuromusculares, analgésicos narcóticos y varios medios de contraste.
4.5 Interacción con otros medicamentos y otras formas de interacción
Aunque la posología varía, cuando se use Ceplene conjuntamente con IL-2, los médicos también deberán consultar el Resumen de Características de Producto o Ficha Técnica (RCP) de la IL-2 y observar las respectivas interacciones del medicamento.
Los antagonistas de los receptores H2 con estructuras imidazoles similares a la histamina -por ejemplo, cimetidina, esteroides sistémicos y clonidina- no deben usarse durante el tratamiento con Ceplene (ver sección 4.3).
Los betabloqueantes u otros antihipertensores deben utilizarse con prudencia durante el tratamiento con Ceplene. La administración simultánea de medicamentos con cardiotoxicidad o con efectos hipotensores puede aumentar la toxicidad de Ceplene.
Deberán evitarse los antihistamínicos o neurolépticos (antipsicóticos) con propiedades antagonistas de los receptores H1 que puedan reducir la eficacia de Ceplene.
Deberán evitarse los antidepresivos tricíclicos que puedan tener propiedades antagonistas de los receptores H1 y H2.
Los inhibidores de monoaminoxidasa y sustancias activas antipalúdicas y antitripanosómicas pueden alterar el metabolismo de Ceplene y deben evitarse (ver sección 4.4).
Se ha señalado que los bloqueantes neuromusculares, los analgésicos narcóticos y varios medios de contraste pueden inducir la secreción de histamina endógena; por ello, habrá que tener en cuenta el efecto adictivo del tratamiento con Ceplene antes de una operación en los pacientes que se vayan a someterse a una intervención diagnóstica o quirúrgica (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Anticonceptivo en mujeres y hombres
Las mujeres en edad fértil y los hombres sexualmente activos deberán usar métodos anticonceptivos eficaces durante el tratamiento con Ceplene e IL-2.
Embarazo
No se dispone de datos clínicos sobre embarazadas expuestas a Ceplene. Estudios en animales muestran toxicidad reproductiva, pero sólo con dosis maternotóxicas, y no indican efectos dañinos directos con respecto al embarazo, al desarrollo embrionario/fetal, al parto o al desarrollo postnatal (ver sección 5.3). No se debe usar Ceplene combinado con IL-2 durante el embarazo.
Lactancia
Se desconoce si se segrega histamina en la leche materna humana. La segregación de histamina en la leche no se ha estudiado en animales, pero con dosis maternotóxicas administradas a ratas, las crías mostraron una ligera toxicidad durante las primeras lactancias (ver sección 5.3). No se debe usar Ceplene combinado con IL-2 durante la lactancia.
Consulte el RCP de la IL-2 para obtener información sobre el embarazo y la lactancia con IL-2. Fertilidad
No se dispone de datos clínicos sobre los efectos de Ceplene en la fertilidad. Estudios con animales no han revelado efectos adversos en la fertilidad, aparte de una ligera reducción en las implantaciones y en los fetos viables (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Ceplene afecta de forma mínima o moderada a la capacidad para conducir y utilizar máquinas. La administración de Ceplene puede provocar hipotensión y puede dar lugar a mareos, ligeros aturdimientos y visión borrosa. Los pacientes no deberían conducir ni manejar máquinas durante al menos 1 hora tras recibir Ceplene.
4.8 Reacciones adversas
Leucemia mieloide aguda
Se han detectado reacciones adversas al menos posiblemente relacionadas con el tratamiento con IL-2 y Ceplene en casi todos los pacientes en estudios sobre LMA.
Las reacciones adversas más habituales, experimentadas por el 30 % o más de los pacientes que recibieron IL-2 y Ceplene (enumeradas en orden descendente según su frecuencia), fueron: rubores, cefaleas, fatiga, granuloma en el lugar de la inyección, fiebre y eritema en el lugar de la inyección.
Las reacciones adversas consideradas al menos posiblemente relacionadas con el tratamiento con dosis bajas de IL-2 con Ceplene en estudios de LMA (n=280 para el grupo de tratamiento con IL-2 y Ceplene) se enumeran a continuación por órganos y sistema, clase y frecuencia. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las frecuencias se definen como muy frecuentes (> 1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000) y muy raras (<1/10.000). Las reacciones adversas identificadas únicamente durante la vigilancia post-comercialización, y para los que la frecuencia no se puede estimar, se han listado como “frecuencia no conocida”.
|
Clasificación de órganos y sistema |
muy frecuentes |
frecuentes |
|
Trastornos de la sangre y del sistema linfático |
eosinofilia, trombocitopenia |
leucopenia, neutropenia |
|
Infecciones e infestaciones |
Infecciones de las vías respiratorias superiores |
pneumonia |
|
Trastornos del metabolismo y de la nutrición |
anorexia | |
|
Trastornos psiquiátricos |
insomnio | |
|
Trastornos del sistema nervioso |
cefalea, mareo, disgeusia | |
|
Trastornos cardíacos |
taquicardia |
palpitaciones |
|
Trastornos vasculares |
rubores, hipotensión | |
|
Trastornos respiratorios, torácicos y mediástinicos |
tos, disnea |
congestión nasal |
|
Trastornos gastrointestinales |
nauseas, dispepsia, diarrea |
vómitos, dolor abdominal alto, sequedad de boca, gastritis, distensión abdominal |
|
Trastornos de la piel y del tejido subcutáneo |
sarpullidos |
eritema, hiperhidrosis, sudores nocturnos, prurito |
|
Trastornos muscuesqueléticos y del tejido conjuntivo |
artralgia, mialgia |
dolor en las extremidades, dorsalgia |
|
Trastornos generales y alteraciones en el lugar de administración |
granuloma en el lugar de la inyección, fatiga, fiebre, eritema en el lugar de la inyección, sofocos, reacción en el lugar de la inyección, prurito en el lugar de la inyección, afección pseudogripal, escalofríos, inflamación del lugar de la inyección, dolor en el lugar de la inyección |
urticaria en el lugar de la inyección, equimosis en el lugar de la inyección, sarpullido en el lugar de la inyección, inflamación en el lugar de la inyección, astenia, dolor torácico |
Otros estudios oncológicos (tumor avanzado)
Ceplene y la IL-2 en dosis bajas se han investigado en otros estudios clínicos con diferentes dosis (1,0 mg de dihidrocloruro de histamina dos veces al día) y con diferentes regímenes de dosis para la IL-2 en dosis bajas y el interferón a. Las siguientes reacciones adversas, no mencionadas anteriormente, fueron relacionadas, al menos posiblemente, con el medicamento en estudio:
|
Clasificación de órganos y sistema |
muy frecuentes (> 1/10) |
frecuentes (> 1/100 to < 1/10) |
|
Trastornos de la sangre y del sistema linfático |
anemia | |
|
Trastornos endocrinos |
Hipotiroidismo | |
|
Trastornos del metabolismo y de la nutrición |
pérdida de apetito |
deshidratación |
|
Trastornos psiquiátricos |
ansiedad |
depresión |
|
Trastornos del sistema nervioso |
paraesthesia | |
|
Trastornos del oído y del laberinto |
vértigo | |
|
Trastornos vasculares |
eritemas | |
|
Trastornos respiratorios, torácicos y mediastínicos |
sibilancias | |
|
Trastornos gastrointestinales |
estreñimiento, distensión abdominal, estomatitis | |
|
Trastornos de la piel y del tejido subcutáneo |
sequedad de la piel | |
|
Trastornos generales y alteraciones en el lugar de administración |
malestar, edema periférico |
fibrosis en el lugar de la inyección, dolor |
|
Exploraciones complementarias |
pérdida de peso |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
La administración de Ceplene o IL-2 mediante infusión rápida en los espacios vasculares, con dosis más altas que las aprobadas, puede exacerbar las reacciones adversas asociadas a Ceplene.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes inmunoestimulantes, otros inmunoestimulantes; Código ATC: L03AX14.
Mecanismo de acción
Ceplene/IL-2 es una inmunoterapia que busca inducir la destrucción inmunitaria de células leucémicas mieloides residuales para, con ello, prevenir una recaída de la leucemia. El papel de Ceplene es proteger los linfocitos, especialmente los linfocitos citolíticos naturales y los linfocitos T, que son los encargados de la destrucción inmunitaria de las células leucémicas residuales. El papel de la IL-2 es favorecer las funciones de los linfocitos citolíticos naturales y linfocitos T mediante la activación de las propiedades antileucémicas de estas células y mediante la expansión de estas poblaciones celulares induciendo la proliferación de los ciclos celulares.
Efectos farmacodinámicos
El mecanismo mediante el cual Ceplene mejora la función antileucémica de los linfocitos en la LMA, no está completamente establecido; se cree que lo hace inhibiendo las especies reactivas del oxígeno (ERO o «radicales libres del oxígeno»), que se sintetizan a través de monocitos/macrófagos y granulocitos. Se sabe que las ERO limitan los efectos antileucémicos de activadores de linfocitos como la IL-2, ya que desencadenan la disfunción y la muerte por apoptosis de los linfocitos citolíticos naturales y de los linfocitos T. Ceplene inhibe la NAPDH oxidasa, que inicia la formación y secreción de ERO desde los fagocitos. Al inhibir la función de oxidasa y reducir la producción de ERO,
Ceplene protege los linfocitos citolíticos naturales y los linfocitos T, activados por la IL-2, de la inhibición inducida por los radicales libres del oxígeno y de la apoptosis. En consecuencia, la administración simultánea de Ceplene y de IL-2 pretende optimizar las funciones antileucémicas de los linfocitos citolíticos naturales y de los linfocitos T.
Eficacia clínica y seguridad
Se han realizado dos ensayos clínicos para evaluar el uso de Ceplene en el mantenimiento de la remisión en pacientes adultos afectados por LMA. El ensayo LMA-1 fue exploratorio y contó con 39 pacientes afectados por LMA en remisión para determinar la dosis y la viabilidad de Ceplene si se administra conjuntamente con IL-2. Los resultados de este estudio piloto se utilizaron para diseñar y poner en marcha un ensayo multinacional de fase III. El ensayo aleatorizado de fase III (0201) comparó el tratamiento con Ceplene e IL-2 con la ausencia de tratamiento en 261 pacientes en primera remisión (RC1) y en otros 59 pacientes en una remisión posterior a una recaída (RC>1). Para los pacientes RC1, la mediana de la duración de la supervivencia sin leucemia aumentó de 291 días (9,7 meses) a 450 días (15 meses) tras la administración de Ceplene/IL-2 frente a la ausencia de tratamiento de mantenimiento (intención de tratar, p=0,01, n=261). El número de pacientes RC1 que seguían sin padecer leucemia 3 años después de administrar Ceplene e IL-2 fue del 40 %, frente al 26 % en los pacientes que no recibieron dicho tratamiento (p=0,01).
Este medicamento se ha autorizado en «Circunstancias excepcionales». Esta modalidad de aprobación significa que, debido a la rareza de la enfermedad, no ha sido posible obtener información completa de este medicamento. La Agencia Europea de Medicamentos revisará anualmente la información nueva del medicamento que pueda estar disponible y esta Ficha Técnica o Resumen de las Características del Producto (RCP) se actualizará cuando sea necesario.
Población perdiátrica
El uso de Ceplene está indicado en adultos. No existen datos disponibles sobre las propiedades farmacodinámicas en niños menores de 18 años.
5.2 Propiedades farmacocinéticas
Absorción
La histamina se absorbe con rapidez tras la inyección subcutánea. La concentración plasmática máxima se alcanza aproximadamente 10 minutos después de terminar la inyección subcutánea. Las concentraciones de histamina y los valores farmacocinéticos fueron muy variables durante los ensayos, al igual que en los grupos de pacientes y voluntarios sanos.
Distribución
Los pacientes mostraron un mayor grado de variabilidad con respecto a la exposición sistémica en comparación con los sujetos sanos. La exposición sistémica global de Ceplene fue mayor en pacientes frente a sujetos sanos. Sin embargo esta diferencia no fue estadísticamente significativa.
Se desconoce si la histamina atraviesa la placenta.
Biotransformación /Elimin ación
La histamina se elimina mediante metabolismo en el riñón, hígado y otros tejidos. Las principales enzimas que participan en el metabolismo de la histamina son las HNMT (histamina-N-metiltransferasa) y DAO (diamina oxidasa). Los metabolitos son excretados principalmente en la orina. La media de la semivida en los pacientes fue de 0,75 a 1,5 horas.
Ni la edad ni el peso tienen efectos relevantes en las propiedades farmacocinéticas de la histamina. El aclaramiento de Ceplene es casi el doble de alto en las mujeres, lo que supone una exposición sistémica considerablemente inferior que en los hombres.
Insuficiencia renal
Los valores farmacocinéticos de la histamina en voluntarios sanos con una función renal normal son similares a los de los voluntarios con insuficiencia renal leve, moderada o aguda. En sujetos con una insuficiencia renal aguda se observaron descensos en la tensión sistólica y diastólica con concentraciones de histamina en plasma que no habían provocado disminución destacable en la tensión arterial de otros sujetos. Así, es posible que los sujetos con insuficiencia renal aguda sean más sensibles a los efectos hipotensores de la histamina administrada por vía exógena que los sujetos con una función renal normal o que los sujetos con insuficiencia renal leve o moderada. Aunque el grado de insuficiencia renal influye poco en la disposición farmacocinética de la histamina, habrá que observar prudencia al administrar histamina a pacientes con insuficiencia renal aguda.
Insuficiencia hepática
Se realizó un ensayo para medir los niveles farmacocinéticos de la histamina en voluntarios sanos comparados con pacientes afectados por insuficiencia hepática leve, moderada o aguda. No se detectaron diferencias clínicamente relevantes ni en cuanto a los parámetros de seguridad ni en cuanto a los valores farmacodinámicos. Las concentraciones de histamina en plasma eran muy variables y mucho más elevadas en los grupos de pacientes con insuficiencia hepática moderada o aguda (medianas 10 y 5 veces superiores a las de los voluntarios sanos, respectivamente). Los pacientes, independientemente de su grado de insuficiencia hepática, pueden sufrir taquicardia o hipotensión durante los 30-60 minutos posteriores a la administración de Ceplene e IL-2.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos muestran que no hay riesgos especiales para los seres humanos basados en estudios convencionales de toxicidad a dosis repetidas, tolerabilidad general y genotoxicidad. Únicamente se observaron reacciones en los estudios no clínicos con exposiciones consideradas superiores a la máxima humana, lo que indica poca relevancia para su uso clínico. No se han realizado estudios sobre carcinogenia con Ceplene.
El dihidrocloruro de histamina no resultó teratógeno ni en ratas ni en conejos en dosis que suponen exposiciones sistémicas varios cientos de veces superiores a la exposición clínica. En ratas hembra a las que se administró el fármaco desde antes del celo hasta el séptimo día de gestación se observó una ligera reducción en el número de implantaciones y de fetos viables, pero sin que hubiera reacciones a la dosis y dentro de los datos de control históricos. En el estudio del desarrollo peri-/postnatal, las dosis altas de dihidrocloruro de histamina provocaron toxicidad materna y las crías mostraron toxicidad durante la lactancia (menos crías vivas en el día 21 en comparación con la lactancia en el día 4), pero no tras el destete.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro sódico
Hidróxido sódico (para ajustar el pH)
Ácido clorhídrico (para ajustar el pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros fármacos, diluyentes ni soluciones para infusión.
6.3 Periodo de validez Viales sin abrir
3 años
6.4 Precauciones especiales de conservación
Ceplene
No congelar.
Interleucina-2 (IL-2; aldesleukina)
La IL-2 (aldesleukina) diluida y dispensada en jeringuillas de tuberculina de polipropileno con tapa protectora se debe conservar en nevera (2°C- 8°C).
6.5 Naturaleza y contenido del envase
Viales de cristal de 2 ml tipo I, con tapón de goma en bromobutilo y cierre flip-off de aluminio, que contienen 0,5 ml de solución (0,70 ml si incluimos el sobrante).
Cada caja contiene 14 viales.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ceplene
Los viales contienen 0,70 ml de solución (incluyendo el sobrante) para facilitar la extracción de una única dosis de 0,5 ml.
Se deberá entregar a los pacientes jeringuillas de polipropileno con tapón y se les enseña a pasar 0,5 ml de disolución a la jeringuilla.
Deberá revisarse visualmente la solución en busca de partículas o decoloración previas a la administración. La solución debe tener una apariencia clara y transparente.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Interleukina-2 (IL-2; aldesleukina)
La IL-2 diluida y dispensada en jeringuillas de tuberculina de polipropileno con tapa protectora se debe preparar en la farmacia en un medio aséptico controlado y conservar en nevera entre 2°C- 8°C.
Reconstitución incial
Cada vial de aldesleukina (1,3 mg / vial) se reconstituye asépticamente con 1,2 ml de agua para preparaciones inyectables (ver RCP la aldesleukina disponible comercialmente). Dirigir el diluyente contra la pared del vial para evitar exceso de espuma. Mover suavemente para facilitar la disolución completa del polvo. NO agitar el vial durante todo el proceso de reconstitución. La solución resultante contiene 22 x 106 UI (1.300 pg) de aldesleukina por 1,2 ml..
Dilución _posterior a 200 ug/ml
Posteriormente, el contenido completo del vial reconstituido (1,2 ml) se diluye asépticamente de nuevo con 5,3 ml de solución para inyección de dextrosa 5% p/v hasta completar un volumen de 6,5 ml que equivale a una concentración final de 200 pg/ml (3,3 x 106 UI/ml) de IL-2 (aldesleukina).
Cuando se reconstituye y diluye, se ha demostrado estabilidad de hasta 21 días para la IL-2 (aldesleukina) diluida en jeringuillas de tuberculina de polipropileno con tapa protectora cuando se conserva a las temperaturas de nevera (2°C-8°C).
Ver sección 4.2 para las instrucciones de dispensación de la IL-2.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Meda AB Box 906 SE 170 09 Solna Suecia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/477/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 07/10/2008
Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POST-AUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN EN CIRCUNSTANCIAS EXCEPCIONALES
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Catalent UK Packaging Ltd Lancaster Way, Wingates Industrial Park Westhoughton, Bolton Lancashire, BL5 3XX Reino Unido
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes Periódicos de Seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
E. OBLIGACIÓN ESPECÍFICA DE LLEVAR A CABO MEDIDAS POSTAUTORIZACIÓN EN RELACIÓN CON UNA AUTORIZACIÓN DE COMERCIALIZACIÓN EN CIRCUNSTANCIAS EXCEPCIONALES
Al ser esta una autorización de comercialización en circunstancias excepcionales y según lo que establece el Artículo 14(8) del Reglamento (CE) 726/2004, el TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Evaluar la Enfermedad Residual Mínima (ERM) al inicio y durante el seguimiento de un estudio clínico o registro, según proceda, para la evaluación de la actividad anti-leucémica de Ceplene con la dosis baja de Interleucina-2, en un número suficiente de pacientes adultos estratificados por edad, mayores o menores de 60 años con Leucemia Mieloide Aguda en primera remisión completa |
Informes anuales dentro de la reevaluación anual |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Caja externa_
1. NOMBRE DEL MEDICAMENTO
Ceplene 0,5 mg/0,5 ml solución inyectable Dihidrocloruro de histamina
2. PRINCIPIO(S) ACTIVO(S)
Un vial de 0,5 ml de solución contienen 0,5 mg de dihidrocloruro de histamina.
3. LISTA DE EXCIPIENTES
Cloruro sódico, agua para inyectables e hidróxido sódico y/o ácido clorhídrico para ajustar el pH.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución para inyección 14 viales
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Exclusivamente vía subcutánea.
Inyectar lentamente durante un periodo de 5-15 minutos.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Meda AB Box 906 SE 170 09 Solna Suecia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/477/001
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
Antes de la administración revisar cada vial visualmente en busca de partículas y decoloración. Usar solo la solución clara e incolora.
16. INFORMACIÓN EN BRAILLE
Ceplene
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Vial
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Ceplene 0,5 mg/0,5 ml solución para inyectable Dihidrocloruro de histamina Exclusivamente vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
Lea el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Ceplene 0,5 mg/0,5 ml solución inyectable
Dihidrocloruro de histamina
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Ceplene y para qué se utiliza.
2. Qué necesita saber antes de empezar a usar Ceplene.
3. Cómo usar Ceplene.
4. Posibles efectos adversos.
5. Conservación de Ceplene.
6. Contenido del envase e información adicional.
1. Qué es Ceplene y para qué se utiliza
Ceplene pertenece a un grupo de medicamentos denominados inmunomoduladores. Estos medicamentos ayudan al sistema inmunitario del cuerpo a luchar contra enfermedades como el cáncer, ya que mejoran la capacidad natural del sistema inmunitario para luchar contra las enfermedades. El principio activo de Ceplene es el dihidrocloruro de histamina, idéntico a una sustancia producida de forma natural por el cuerpo. Se administra junto con dosis bajas de interleucina-2 (IL-2), otro medicamento que ayuda al sistema inmunitario a luchar contra enfermedades como el cáncer.
Ceplene se utiliza junto con la IL-2 para tratar un tipo específico de leucemia denominado leucemia mieloide aguda (LMA), un tipo de cáncer de la sangre que genera células en la médula ósea. Se usa para mantener la remisión (el periodo en el que la enfermedad es menos grave o cuando no se detecta). Ceplene, administrado junto con IL-2, ayudará a su sistema inmunitario a atacar las células cancerígenas que permanecen tras un tratamiento anterior del cáncer.
Durante el tratamiento, utilizará siempre IL-2 Y Ceplene. Consulte a su médico si tiene cualquier pregunta sobre Ceplene o sobre la IL-2.
Qué necesita saber antes de empezar a usar Ceplene
2.
No use Ceplene
• si es alérgico (hipersensible) a la histamina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si tiene problemas cardiacos graves.
• si toma alguno de los siguientes medicamentos:
- esteroides, como prednisona y dexametasona; se usan para inhibir la actividad del sistema inmunitario (inmunodepresor) y reducir la inflamación.
- clonidina, un medicamento utilizado para reducir la presión sanguínea.
- antihistamínicos H2 como la cimetidina, ranitidina, famotidina o nizatidina, que se utilizan para tratar úlceras gastrointestinales, indigestión (dispepsia) o el ardor de estómago.
• si ha recibido un transplante de hemocitoblastos (un tipo de transplante de médula ósea) de un donante.
• si está embarazada.
• durante la lactancia.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Ceplene.
No se deben inyectar al mismo tiempo Ceplene y la IL-2. Debe inyectarse la IL-2 en primer lugar. La dosis de Ceplene deberá inyectarse entre 1 y 3 minutos después.
Ceplene debe inyectarse lentamente en la capa de tejido situada bajo la piel (en la zona subcutánea) durante un periodo aproximado de 5 a 15 minutos. Una inyección rápida puede provocar un descenso de la tensión arterial y causarle una sensación de debilidad, e incluso provocarle un desmayo.
Deberá empezar el tratamiento con Ceplene en el centro clínico, bajo la supervisión de un médico. Se le realizará un seguimiento para comprobar su respuesta al tratamiento. El médico comprobará su tensión arterial, el ritmo cardiaco y la actividad pulmonar. Además, realizará algunos análisis de sangre durante el tratamiento.
Si ha padecido alguna de las siguientes enfermedades se le realizará un seguimiento en el hospital durante los siguientes días o ciclos de tratamiento:
• úlceras sangrantes,
• infarto cerebral,
• estenosis de las arterias (arteriopatía periférica sistémica),
• cardiopatía (para problemas cardiacos agudos ver más arriba el apartado «No use Ceplene»),
• antecedentes de enfermedad autoinmunitaria (una enfermedad en la que el sistema inmunitario ataca las propias células o tejidos del cuerpo, como el lupus sistémico, la artritis reumatoide, enteropatía inflamatoria o soriasis).
Si está tomando algún otro medicamento mencionado en el epígrafe «Uso de otros medicamentos»o si próximamente se le va a practicar alguna operación o alguna exploración con rayos X que requiera la aplicación de una inyección, consulte a su médico.
Si tiene alguna infección, su médico prestará especial atención a su seguimiento. Si ha tenido alguna infección en los 14 días anteriores al comienzo de este tratamiento que le obligue a tomar medicamentos contra infecciones (antibióticos, antifúngicos o antivíricos), su médico prestará especial atención a su seguimiento.
Si tiene afecciones del riñón, consulte a su médico antes de tomar este medicamento. Puede
producirse una bajada de tensión.
Si tiene problemas del hígado, consulte a su médico antes de tomar este medicamento. Es posible que su médico cambie la dosis.
Niños y adolescentes
No se recomienda usar Ceplene en niños y adolescentes, dado que no se dispone de información sobre el uso de este medicamento en este grupo de edad.
Uso de Ceplene con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento,incluso los adquiridos sin receta.
Si está utilizando alguno de los siguientes medicamentos, asegúrese de consultar a su médico o farmacéutico antes de usar Ceplene. Algunos de ellos son incompatibles con el tratamiento con Ceplene, mientras que otros requieren precauciones especiales:
• Esteroides, como prednisona y dexametasona; se usan para inhibir la actividad del sistema inmunitario (inmunodepresor) y reducir la inflamación (ver más arriba el apartado «No use Ceplene»).
• Antihistamínicos H2 como la cimetidina, ranitidina, famotidina o nizatidina. Estos seutilizan para tratar úlceras gastrointestinales, indigestión (dispepsia) o el ardor de estómago (ver más arriba el apartado «No use Ceplene»).
• Antihistaminas empleadas para tratar alergias.
• Determinados antipsicóticos como la clorpromacina, flupentixol, tioridacina, clozapina y risperidona; se usan para tratar afecciones psíquicas.
• Antidepresivos tricíclicos como la amitriptilina, imipramina, o inhibidores de monoaminoxidasas, como fenelcina, isocarboxacida, tranilcipromina o moclobemida. Se usan para tratar la depresión.
• Anti-maláricos o medicamentos usados para tratar infecciones causantes de la narcolepsia.
• Betabloqueantes, como el propranolol, metoprolol, atenolol. Estos son usados para la angina de pecho y alteraciones del ritmo cardiaco.
• Cualquier tratamiento para la hipertensión (por ejemplo, diuréticos tiacídicos [bendrofluacida], IECA [captoprilo], antagonistas cálcicos [nifedipina] y bloqueantes a [prazosina]).
Asimismo, en el caso de que vaya a someterse próximamente a alguna operación o a alguna exploración especial con rayos X que requiera la aplicación de una inyección, asegúrese antes de que su médico es consciente de que está utilizando Ceplene. Algunos medicamentos utilizados en una operación (por ejemplo, antagonistas neuromusculares y analgésicos narcóticos) o tintes utilizados para ciertas pruebas radiológicas pueden interferir con este medicamento.
Uso de Ceplene con alimentos, bebidas y alcohol
No existe información disponible sobre interacciones de Ceplene con comida, bebida y alcohol. Ceplene se inyecta vía subcutánea, por tanto la absorción a través del tracto gastrointestinal no está influenciada por la comida ni la bebida.
Embarazo y lactancia
No hay información sobre el uso de Ceplene en mujeres embarazadas. Por consiguiente, no debe aplicarse el tratamiento con Ceplene e IL-2 durante el embarazo.
Los pacientes sometidos a este tratamiento, ya sean hombres o mujeres, deberán emplear un método anticonceptivo eficaz, ya que es fundamental evitar la concepción de un niño durante el tratamiento con Ceplene e IL-2.
Se desconoce si Ceplene se excreta en la leche materna. Por lo tanto, no deben usarse Ceplene ni IL-2 durante la lactancia.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No conduzca ni use máquinas en la hora siguiente a la administración de una inyección de Ceplene, ya que este medicamento puede bajar la tensión y provocar mareos, ligeros aturdimientos y visión borrosa. Todo ello puede afectar a su capacidad para conducir o manejar máquinas.
3. Cómo usar Ceplene
Siga exactamente las instrucciones de administración de Ceplene indicadas por su médico. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
Este tratamiento deberá ser prescrito y supervisado por un médico con conocimientos especializados sobre la leucemia mieloide aguda.
Dosis
Puesto que va a utilizar IL-2 y Ceplene en un tratamiento combinado, se ofrece información sobre ambas dosis:
Interleucina 2 (IL-2)
La IL-2 se inyecta dos veces al día mediante una inyección subcutánea (en la capa de tejido inmediatamente debajo de la piel) entre 1 y 3 minutos antes de la inyección de Ceplene. La dosis se calcula en función de su peso. Su médico le indicará a cuánto corresponde esta cantidad y cómo debe inyectarse la dosis.
Ceplene
La dosis habitual de Ceplene es de 0,5 ml de solución dos veces al día administrada mediante una inyección subcutánea lenta (en la capa de tejido inmediatamente debajo de la piel).
La dosis de Ceplene debe inyectarse entre 1 a 3 minutos después de la dosis de IL-2.
Deben inyectarse ambos medicamentos, IL-2 y Ceplene, dos veces al día, con un intervalo mínimo de 6 horas entre las inyecciones.
Periodos con y sin tratamiento:
El tratamiento con IL-2 y Ceplene dura 81 semanas y es cíclico.
• Durante las 18 primeras semanas: usará la IL-2 y Ceplene a diario durante 3 semanas y después descansará otras 3 semanas (sin administración de ningún tratamiento).
• Durante las otras 63 semanas: usará la IL-2 y Ceplene a diario durante 3 semanas y después descansará otras 6 semanas (sin administración de ningún tratamiento).
Si se inyecta la dosis de Ceplene usted mismo/a:
Su médico podría decidir que es más conveniente que se inyecte la IL-2 y Ceplene usted mismo/a.
Su médico o enfermero le enseñarán a hacerlo. No intente ponerse las inyecciones si no le ha enseñado cómo hacerlo un profesional cualificado.
Se recomienda que esté siempre acompañado cuando se inyecte este medicamento, por un familiar adulto, un amigo o un cuidador que le puedan ayudar en caso de notar mareos o de desmayo.
Para obtener más instrucciones sobre cómo inyectarse este medicamento usted mismo/a, lea la sección «INSTRUCCIONES PARA INYECTARSE CEPLENE» al final de este prospecto.
Puede que su médico le recomiende usar una bomba de inyección para regular la inyección de Ceplene. Si usa una bomba de inyección, debe consultar las instrucciones del fabricante de la bomba y atender a las indicaciones de su médico o enfermero.
Si usa más Ceplene del que debe
Debe usar la cantidad exacta de medicamento que le hayan recetado. Si por accidente se inyecta más de lo que debiera, póngase en contacto con su médico o farmacéutico inmediatamente.
Si olvidó usarCeplene
No se administre ninguna dosis extra para compensar las dosis olvidadas. Siga el tratamiento tal y como se le recetó. Si se ha olvidado de alguna de las dosis diarias, póngase en contacto con su médico o farmacéutico.
Si interrumpe el tratamiento con Ceplene
Si desea interrumpir su tratamiento con Ceplene debe consultarlo con un médico. Informe a su médico inmediatamente si interrumpe el uso de Ceplene por decisión propia.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos observados cuando se usa Ceplene tal y como se describe en este prospecto:
Muy frecuentemente puede producirse hipotensión (presión sanguínea baja) pudiendo dar lugar a aturdimiento y desmayos. Si advierte un descenso importante de la presión sanguínea después del uso de Ceplene, contacte inmediatamente con su médico o al menos previamente a una nueva inyección de Ceplene.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• Incremento del número de cierto tipo de glóbulos blancos en la sangre (eosinofilia) y descenso del número de plaquetas (trombocitopenia).
• Cefaleas y mareos.
• Alteración del gusto (disgeusia).
• Aceleración del ritmo cardiaco (taquicardia).
• Rubores.
• Tos, dificultad respiratoria (disnea).
• Infecciones del tracto respiratorio superior.
• Náuseas, indigestión (dispepsia) y diarrea.
• Sarpullidos.
• Dolor muscular y de las articulaciones (mialgia y artralgia).
• Piel inflamada y granulada en el lugar de la inyección, fatiga, fiebre (pirexia), enrojecimiento de la zona de la inyección, acaloramiento, reacción en la zona de la inyección, picores en la zona de la inyección, síntomas similares a los de la gripe, escalofríos (estremecimiento), inflamación del lugar de la inyección y dolor.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Reducción en el número de células blancas de la sangre (leucopenia).
• Reducción en el número de cierto tipo de células blancas de la sangre (neutropenia).
• Inflamación del pulmón (neumonía).
• Pérdida de apetito (anorexia).
• Dificultad para conciliar el sueño (insomnio).
• Sensación de los propios latidos (palpitaciones).
• Congestión nasal.
• Vómitos, dolor en la parte superior del abdomen (dolor abdominal) y sequedad de boca.
• Inflamación del estómago (gastritis).
• Hinchazón del abdomen (distensión abdominal).
• Enrojecimiento anormal de la piel (eritema), incremento de los sudores (hiperhidrosis), sudores nocturnos y picores (prurito).
• Dolor lumbar y en las extremidades.
• Ronchas, moratones, sarpullidos e inflamación del lugar de la inyección, debilidad (astenia) y dolor de pecho.
Efectos adversos adicionales observados cuando se usó Ceplene en otro tipo de tratamiento: Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• Sequedad de la piel.
• Ansiedad.
• Sensación general de incomodidad o molestias.
• Retención de líquidos en el cuerpo, especialmente en las piernas (edema).
• Pérdida de peso.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Sensación de mareo (vértigo).
• Su cuerpo no produce suficiente tiroxina, un tipo de sustancia química del cuerpo conocido como hormona (hipotiroidismo).
• Reducción del número de glóbulos rojos (anemia).
• Pérdida de agua corporal (deshidratad ón).
• Depresión.
• Hormigueo, picores o entumecimiento de la piel (parestesia).
• Eritemas.
• Sibilancias.
• Estreñimiento, estómago hinchado, boca inflamada.
• Dolor y formación de tejido adicional en la piel situada en torno al lugar de la inyección.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ceplene
Mantener este medicamento fuera de la vista y del alcance de los niños.
Ceplene
No utilice Ceplene después de la fecha de caducidad que aparece en la caja y la etiqueta del vial. La fecha de caducidad es el último día del mes que se indica.
No congelar.
Antes de la administración, revisar visualmente la solución en busca de partículas y decoloración. La solución debe ser transparente e incolora.
Interleucina-2 (IL-2, aldesleukina)
La jeringuilla con tapa portectora pre-cargada con IL-2 diluida, dispensada por el farmacéutico, se debe conservar en nevera (entre 2°C y 8° C), hasta su utilización.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Ceplene
• El principio activo es dihidrocloruro de histamina. Cada vial contiene 0,5 mg de dihidrocloruro de histamina en una solución de 0,5 ml.
• Los demás ingredientes son agua para inyectables y cloruro sódico. También puede contener hidróxido sódico y/o ácido clorhídrico para ajustar el pH.
Aspecto de Ceplene y contenido del envase
Ceplene es un líquido transparente e incoloro. Se comercializa en un vial de vidrio con un tapón de goma gris y una protección flip-off azul de aluminio que se distingue claramente sobre el precinto.
Ceplene está disponible en paquetes de 14 viales.
Titular de la autorización de comercialización
Meda AB Box 906 SE 170 09 Solna Suecia
Fabricante
Catalent UK Packaging Ltd Lancaster Way
medicamento dirigiéndose al representante local del
Wingates Industrial Park Westhoughton, Bolton, Lancashire BL5 3XX Reino Unido
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Meda Pharma S.A./N.V.
Chaussée de la Hulpe 166 Terhulpsesteenweg 166 B-1170 Brussels Tél/Tel: +32 (0)2 5 04 08 11
Etarapua
Tn Mega OapMacoÜTHKaac Ya. OgpnH 71-75, eT.2, an 7 1303 Co^ua Tea.: +359 2 4177977
Ceská republika MEDA Pharma s.r.o. Kodañská 1441 / 46 CZ-100 10 Praha 10 Tel: +420 234 064 201
Danmark
Meda AS Solvang 8 DK-3450 Allerad Tlf: +45 44 52 88 88
Deutschland
MEDA Pharma GmbH & Co. KG BenzstraBe 1 D-61352 Bad Homburg Tel: +49 (0) 6172 888 01
Eesti
Meda Pharma SIA Narva mnt. 11D EE-10151 Tallinn Tel: +372 62 61 025
EAláda
MEDA Pharmaceuticals A.E. EupuTavíaQ 3
GR-15231 XaAávSpi -Attikh TqA: +30 210 6 77 5690
España
Meda Pharma S.A.U.
Lietuva
Meda Pharma SIA Veiveriii g. 134 LT-46352 Kaunas Tel. + 370 37330509
Luxembourg/Luxemburg
Meda Pharma S.A./N.V.
Chaussée de la Hulpe 166 Terhulpsesteenweg 166 B-1170 Brussels Belgique / Belgien Tél/Tel: +32 (0)2 5 04 08 11
Magyarország
MEDA Pharma Hungary Kereskedelmi Kft.
H-1139 Budapest
Váci ut 91
Tel: +36 1 236 3410
Malta
Alfred Gera & Sons Ltd.
10 Triq Il Masgar Qormi
MT-3217 Qrm Tel: +356 21 446205
Nederland
MEDA Pharma B.V.
Krijgsman 20 NL-1186 DM Amstelveen Tel: +31 (0)20 751 65 00
Norge Meda A/S Askerveien 61 N-1384 Asker Tlf: +47 66 75 33 00
Osterreich
MEDA Pharma GmbH Guglgasse 15 A-1110 Wien Tel: + 43 (0)1 86 390 0
Polska
Meda Pharmaceuticals Sp.z.o.o.
|
Avenida de Castilla, 2 Parque Empresarial San Femando Edificio Berlín E-28830 San Fernando de Henares (Madrid) Tel: +34 91 669 93 00 |
Al. Jana Pawla II 15 PL-00-828 Warszawa Tel: +48 22 697 7100 |
|
France MEDA Pharma SAS 25 Boulevard de lAmiral Bruix F-75016 Paris Tél: +33 (0)1 56 64 10 70 |
Portugal MEDA Pharma - Produtos Farmacéuticos, S.A. Rua do Centro Cultural, 13 P-1749-066 Lisboa Tel: +351 21 842 0300 |
|
Hrvatska Medical Intertrade d.o.o. Dr. Franje Tudmana 3 10431 Sveta Nedelja Tel: +385 1 3374 010 |
Romania Meda Pharmaceuticals Switzerland GmbH, Reprezentatei Calea Floreasca, Primul District 141-143 - RO Bucure§ti Tel.: +40212309030 |
|
Ireland Meda Health Sales Ireland Ltd. 34/35 Blok A Dunboyne Business Park Dunboyne IRL-Co Meath Tel: +353 1 802 66 24 |
Slovenija MEDA Pharmaceuticals Switzerland GmbH, Podruznica Ljubljana Cesta 24. junija 23 SI-1231 Ljubljana Tel: +386 (0)59 096 951 |
|
Ísland Meda AB Box 906 S-170 09 Solna Svífrjóó Sími: +46 8 630 1900 |
Slovenská republika MEDA Pharma spol. s. r.o. Trnavská cesta 50 SK-821 02 Bratislava Tel: +421 2 4914 0172 |
|
Italia Meda Pharma S.p.A. Viale Brenta, 18 I-20139 Milano Tel: +39 02 57 416 1 |
Suomi/Finland Meda Oy Vaisalantie 4/Vaisalavagen 4 FI-02130 Espoo/Esbo Puh/Tel: +358 20 720 9550 |
|
Kúrcpog MEDA Pharmaceuticals A.E. EupuTOvíag 3 GR-15231 XaAávSpi -Attikh Tr|A: +30 210 6 77 5690 EAMSa |
Sverige Meda AB Box 906 S-170 09 Solna Tel: +46 (0)8 630 1900 |
|
Latvija Meda Pharma SIA Ojára Váciesa iela 13 LV-1004 Riga Tálr: +371 7 805 140 |
United Kingdom Meda Pharmaceuticals Ltd. Skyway House Parsonage Road Takeley Bishops Stortford CM22 6PU - UK Tel.: + 44 845 460 0000 |
Fecha de la última revisión de este prospecto:
Este medicamento se ha autorizado en «Circunstancias excepcionales». Esta modalidad de aprobación significa que debido a la rareza de su enfermedad no ha sido posible obtener información completa de este medicamento. La Agencia Europea de Medicamentos revisará anualmente la información nueva de este medicamento que pueda estar disponible y este prospecto se actualizará cuando sea necesario.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces con otras páginas web sobre enfermedades raras y medicamentos huérfanos.
INSTRUCCIONES PARA AUTO-INYECTARSE CEPLENE
Esta sección contiene información sobre cómo inyectarse Ceplene a uno mismo.
Para información sobre dosis y cómo usar Ceplene y la IL-2, consulte la sección 3, «Cómo usar Ceplene».
Lea las siguientes instrucciones con atención. Es importante que no intente ponerse la inyección a no ser que su médico o enfermero le hayan explicado cómo se hace. Si no está seguro de cómo ponerse la inyección o si tiene dudas, pregunte a su médico o enfermero.
Si se siente débil o mareado durante o después de las inyecciones, dígaselo a su médico antes de inyectarse la siguiente dosis. Puede que su médico quiera incrementar el tiempo que dura la inyección o cambiarle la dosis.
Tendrá que inyectar las dosis de Ceplene y de IL-2 dos veces al día mediante una inyección subcutánea (en la capa de tejido inmediatamente debajo de la piel), siguiendo las indicaciones de su médico.
Siempre inyecte primero la IL-2. Debe inyectar la dosis de Ceplene entre 1 y 3 minutos después.
No se debe mezclar Ceplene con ningún otro producto ni diluirlo.
Su médico le explicará cómo preparar e inyectar la IL-2.
Se recomienda que siempre tenga a alguien con usted cuando se inyecte Ceplene, como un familiar adulto, un amigo o un cuidador que le pueda ayudar si siente mareos o se desmaya.
PREPARACIÓN PARA LA INYECCIÓN DE CEPLENE
Para preparar una dosis de Ceplene necesitará lo siguiente:
• 1 vial de solución de Ceplene (0,5 ml).
• 1 jeringuilla estéril graduada con aguja.
• 1 toallita empapada en alcohol.
Método
1. Saque un vial de la caja. Compruebe la fecha de caducidad (CAD) en la etiqueta del vial.
2. No lo use si ya ha pasado el último día del mes que aparece en la etiqueta.
3. Lávese las manos concienzudamente con agua y jabón.
4. Vuelva a comprobar la etiqueta del vial para asegurarse de que está usando el medicamento adecuado. La solución debe tener una apariencia transparente e incolora. Si no lo es, use otro vial e informe a su médico o farmacéutico.
5. Retire la tapa de plástico del vial, dejando a la vista el tapón con el círculo interior de goma.
6. Use una toallita empapada en alcohol para limpiar la parte de goma del tapón. No toque el tapón con las manos.
7. Coja la jeringuilla estéril. Fíjese en las marcas numeradas que hay en ella. Cada marca (0,1, 0,2, 0,3, etc.) representa una décima de mililitro (0,1 ml). Sin quitar la tapa de la aguja, tire del émbolo y coja aire en la jeringuilla hasta el nivel (número de mililitros) que le haya indicado su médico. Ver Figura 1.
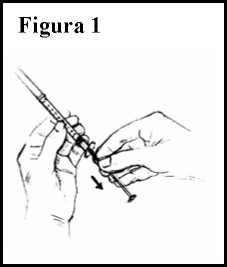
8. Saque la tapa de la aguja. Con el vial sobre una superficie plana, inserte la aguja en el vial a través del tapón de goma.
9. Presione el émbolo de la jeringuilla para inyectar aire en el vial. Ver Figura 2.
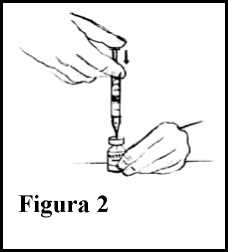
10.Sujetando tanto el vial como la jeringuilla, ponga el vial boca abajo. Ajuste la jeringuilla de tal forma que la punta de la aguja sobresalga ligeramente por encima del tapón de goma, pero siempre dentro de la solución. Ver Figura 3.
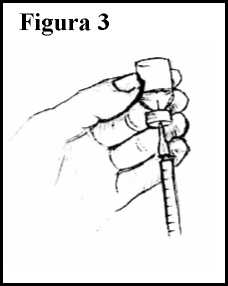
11. Tire lentamente del émbolo para pasar la solución a la jeringuilla, llenándola hasta el nivel (número de mililitros) indicado por su médico. Si aparecen burbujas en la jeringuilla, vuelva a introducir lentamente la solución en el vial y vuelva a extraer la solución.
12. Saque la aguja del vial. No deje la jeringuilla boca abajo ni permita que la aguja entre en contacto con ningún objeto o sustancia.
13. Vuelva a colocar la tapa de la aguja. Coloque la jeringuilla en una superficie limpia y plana.
14. Puede que quede una pequeña cantidad de solución en el vial. Debe devolvérsela al farmacéutico para que la recicle.
NOTA: El vial de Ceplene contiene un sobrenadante para facilitar la extracción de 0.5 ml de dosis individual.
15. Vuelva a comprobar la jeringuilla para asegurarse de haber extraído la cantidad adecuada.
16. Sujete la jeringuilla y siga las «INSTRUCCIONES PARA LA INYECCIÓN» que se ofrecen a continuación.
INSTRUCCIONES PARA LA INYECCIÓN
Normalmente se inyectará dos dosis de 0,5 ml al día, a no ser que su médico le haya recetado una dosis menor.
Para la inyección necesitará lo siguiente:
• 1 jeringuilla preparada para la inyección de IL-2 (consulte el prospecto de IL-2 y las instrucciones sobre la dosis que le haya dado su médico).
• 1 jeringuilla preparada que contenga la dosis de Ceplene.
• Una o varias toallitas empapadas en alcohol.
• Un cronómetro o reloj con segundero.
• Un recipiente a prueba de pinchazos para que pueda desechar las jeringuillas usadas de forma segura.
Método
1. Busque un lugar cómodo y bien iluminado en el que se pueda sentar y reclinarse. Sitúe al alcance de su mano las jeringuillas previamente preparadas con IL-2 y Ceplene, y una toallita empapada en alcohol. Por su propia seguridad, es importante que se siente en un lugar en el que pueda reclinarse o tumbarse cuando se ponga las inyecciones.
2. Inyéctese la IL-2 tal y como le han explicado.
3. Espere entre 1 y 3 minutos.
4. Decida la parte del cuerpo en la que se inyectará Ceplene. Puede elegir entre el interior o el exterior de los muslos, los brazos o el estómago. No debe inyectarse Ceplene y la IL-2 en la misma zona. Por ejemplo, si se inyecta la IL-2 en el brazo izquierdo, podría inyectarse Ceplene en el muslo izquierdo o derecho, en el estómago o en el brazo derecho. Siempre cambie el sitio en el que se inyecta. En la Figura 4 se muestran las zonas en las que puede pincharse.
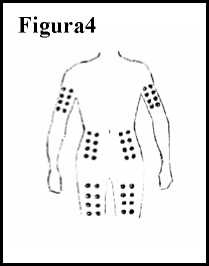
5. Asegúrese de que la zona de piel que escoge está a la vista. Use una toallita empapada en alcohol para limpiarla. Deje que la zona se seque durante 10 segundos.
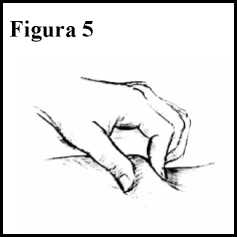
6. Coja una sección de la piel que ha limpiado entre el pulgar y el índice, sin apretarla. Ver Figura 5.
7. Sujete la aguja verticalmente (90°) o en un ángulo de 45° con respecto a la piel y en un
movimiento rápido insértela bajo la piel hasta donde llegue. Debe insertar la aguja bajo la piel, pero no en un vaso sanguíneo. Véase Figura 6.
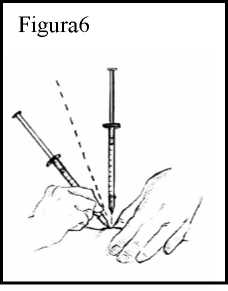
8. Presione lentamente el émbolo. Si aparece sangre, no inyecte Ceplene porque esto significará que la aguja ha entrado en un vaso sanguíneo. Saque la jeringuilla y deshágase de ella como le habrán enseñado. Reúna lo que necesita y empiece el proceso de nuevo, aunque hayan pasado los 3 minutos tras la inyección de IL-2.
9. Fíjese en las marcas numeradas de la jeringuilla. Cada marca (0,1, 0,2, 0,3, etc.) representa una décima de mililitro (0,1 ml).
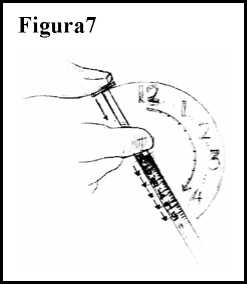
10. Presione el émbolo de la jeringuilla e inyecte un décimo de mililitro (0,1 ml) por minuto, o más lentamente si así se lo ha indicado su médico. Ver Figura 7.
11. Nunca inyecte Ceplene deprisa ni de una vez.
12. Cuando la jeringuilla esté vacía, saque la aguja de la piel.
13. Presione suavemente con una toallita empapada en alcohol en el lugar de la inyección, sin frotar.
14. Permanezca sentado o acostado durante 20 minutos tras inyectarse la dosis de Ceplene.
15. Deseche la jeringuilla en el recipiente a prueba de pinchazos tal y como le habrán explicado.
ANEXO IV
MOTIVOS PARA UNA REVALIDACIÓN ADICIONAL
Motivos para una revalidación adicional
En base a los datos que se están disponibles desde la concesión de la Autorización de Comercialización, el CHMP considera que la relación beneficio-riesgo de Ceplene sigue siendo positiva, pero considera que su perfil de seguridad tiene que ser atentamente monitorizado por las razones siguientes:
La exposición limitada de Ceplene fuera de los ensayos clínicos excluye la adecuada recogida de datos de farmacovigilancia durante su uso clínico real.
Por tanto, en base al perfil de seguridad de Ceplene, el CHMP concluyó que el TAC debería presentar una revalidación adicional a los 5 años.
39