Canadiol 10 Mg/Ml Concentrado Y Disolvente Para Solucion Para Perfusion
¡m
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
CANADIOL 10 mg/ml concentrado y disolvente para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de CANADIOL concentrado contiene 10 mg de itraconazol. Una ampolla con 25 ml contiene 250 mg de itraconazol (sal de trihidrocloruro de itraconazol formada in situ). Cada ml de la solución mezclada contiene 3,33 mg de itraconazol. Una única dosis de 200 mg de itraconazol corresponde a 60 ml de la solución mezclada.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado y disolvente para solución para perfusión.
CANADIOL 10 mg/ml concentrado y disolvente para solución para perfusión (Solución inyectable de cloruro de sodio al 0,9% como disolvente) se presenta en un envase que contiene:
a) 25 ml de Canadiol 10 mg/ml concentrado para solución para perfusión, una solución incolora que se presenta en una ampolla de vidrio.
b) 50 ml de solución inyectable de cloruro de sodio al 0,9% como disolvente para solución para perfusión, una solución incolora que se presenta en una bolsa de plástico de polipropileno.
c) Vía de extensión con una válvula de cierre de 2 vías y un filtro en línea
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
CANADIOL está indicado para el tratamiento de la histoplasmosis.
CANADIOL está indicado en las siguientes infecciones fungicas sistémicas cuando el tratamiento antifungico sistémico de primera elección no resulta adecuado o no ha demostrado ser eficaz. (Esto puede ser debido a la existencia de una patología subyacente, resistencia del patógeno o toxicidad del fármaco).
Tratamiento de la aspergilosis, candidiasis y criptococosis (incluyendo la meningitis criptocócica): en los pacientes inmunodeprimidos con criptococosis y en todos los pacientes con criptococosis del sistema nervioso central.
Se deben tener en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antifúngicos.
4.2 Posología y forma de administración
Este medicamento se suministra con una vía de extensión con una válvula de cierre de 2 vías y un filtro en línea de 0,2 ^m. La vía de extensión específica que incluye el filtro en línea, se debe utilizar para garantizar la correcta administración del producto (ver sección 6.6).
En los dos primeros días se administra una dosis de carga de CANADIOL dos veces al día, seguida de una administración diaria.
Días 1 y 2 del tratamiento: perfusión durante1 hora de 200 mg (60 ml de solución reconstituida) de CANADIOL dos veces al día (ver sección 6.6).
Del día 3 en adelante: perfusión durante 1 hora de 200 mg (60 ml de solución reconstituida) de CANADIOL cada día. No se ha establecido la seguridad para períodos superiores a los 14 días.
Población pediátrica
Los datos clínicos sobre el uso de CANADIOL en pediatría son limitados, por lo que no se recomienda su uso en niños a menos que el posible beneficio supere los posibles riesgos (ver sección 4.4).
Uso en pacientes de edad avanzada
Los datos clínicos sobre el uso de CANADIOL en pacientes de edad avanzada son limitados, por lo que se recomienda su uso en estos pacientes solo si el balance beneficio/riesgo es favorable (ver sección 4.4).
Uso en pacientes con insuficiencia renal
Los datos disponibles sobre el uso intravenoso de itraconazol en pacientes con insuficiencia renal son limitados. La hidroxipropil-B-ciclodextrina, un componente necesario de la formulación de CANADIOL, se elimina a través de filtración glomerular. Por lo tanto, en pacientes con insuficiencia renal grave definida como un aclaramiento de creatinina inferior a 30 ml/min la utilización de CANADIOL está contraindicada (ver sección 4.3).
En los pacientes con insuficiencia renal leve a moderada, CANADIOL debe ser utilizado con precaución. Los niveles de creatinina sérica deben ser estrechamente controlados y, si se sospecha toxicidad renal, se deberá considerar el cambio a la formulación oral en cápsulas (ver secciones 4.4 y 5.2).
Uso en pacientes con insuficiencia hepática
Los datos disponibles sobre el uso intravenoso de itraconazol en pacientes con insuficiencia hepática son limitados. Se deberá tener cuidado cuando este fármaco se administre en estos pacientes (ver sección 5.2).
4.3 Contraindicaciones
CANADIOL está contraindicado en pacientes con hipersensibilidad conocida a itraconazol o a alguno de sus excipientes.
CANADIOL no puede ser utilizado cuando la administración de la solución inyectable de cloruro de sodio esté contraindicada.
El excipiente hidroxipropil-P-ciclodextrina, se elimina por filtración glomerular. Por lo tanto, CANADIOL está contraindicado en los pacientes con insuficiencia renal grave (definida como un aclaramiento de creatinina inferior a 30 ml/min) (ver sección 4.4. y 5.2).
¡m
Está contraindicada la coadministración de CANADIOL con los siguientes fármacos (ver sección 4.5):
- Fármacos metabolizados por el CYP3A4 que pueden prolongar el intervalo QT, por ejemplo: terfenadina, astemizol, bepridilo, mizolastina, cisaprida, dofetilida, levacetilmetadol (levometadil), quinidina, sertindol o pimozida, ya que dicha coadministración puede producir un aumento en los niveles plasmáticos de estos fármacos, lo que puede dar lugar a una prolongación del QTc y en raras ocasiones torsade de pointes.
- Inhibidores de la HMG-CoA reductasa metabolizados por CYP3A4 tales como simvastatina, lovastatina y atorvastatina.
- Triazolam y midazolam oral.
- Los alcaloides del cornezuelo del centeno, como la dihidroergotamina, ergometrina (ergonovina), ergotamina y metilergometrina (metilergonovina).
- Eletriptan.
- Nisoldipino.
Sólo se debe administrar CANADIOL durante el embarazo para indicaciones que pongan en peligro la vida del paciente (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo
Hipersensibilidad cruzada
No hay información referente a la hipersensibilidad cruzada entre el itraconazol y otros agentes antifúngicos azólicos. Se debe tener precaución al prescribir CANADIOL a pacientes con hipersensibilidad a otros azoles.
Efectos cardiacos
En un estudio con voluntarios sanos con CANADIOL se observó disminución transitoria asintomática de la fracción de eyección ventricular izquierda que remitió antes de la siguiente perfusión. No fue realizada una investigación similar en la población diana.
Se ha demostrado que itraconazol tiene un efecto inotrópico negativo y CANADIOL se ha asociado con insuficiencia cardiaca congestiva. Las notificaciones espontáneas de insuficiencia cardiaca fueron más frecuentes con la dosis diaria total de 400 mg que con dosis diarias inferiores, sugiriendo que el riesgo de insuficiencia cardiaca podría aumentar con la dosis diaria total de itraconazol.
CANADIOL no debe utilizarse en pacientes con insuficiencia cardiaca congestiva o con historia de la misma a menos que el beneficio supere claramente el riesgo.
Los médicos deberían valorar cuidadosamente los riesgos y beneficios de la terapia con CANADIOL en pacientes con factores de riesgo para insuficiencia cardiaca congestiva. Estos factores de riesgo incluyen trastornos cardíacos tales como enfermedad isquémica y patología valvular; enfermedad pulmonar significativa, como enfermedad pulmonar obstructiva crónica; e insuficiencia renal y otros procesos edematosos. Estos pacientes deben ser informados acerca de los signos y síntomas de la insuficiencia cardiaca congestiva, ser tratados con precaución y monitorizados durante el tratamiento para detectar los signos y síntomas de la insuficiencia cardiaca congestiva. Debe de interrumpirse la administración de CANADIOL si aparecen estos signos o síntomas durante el tratamiento.
Se debe de tener cuidado cuando se administren conjuntamente itraconazol y bloqueantes de los canales del calcio (ver sección 4.5).
¡m
Efectos hepáticos
Con el uso de CANADIOL han aparecido muy raramente casos de hepatotoxicidad grave, incluyendo algunos casos de insuficiencia hepática aguda muy grave. Algunos de estos casos incluyeron pacientes sin enfermedad hepática previa. Algunos de estos casos se observaron en el primer mes de tratamiento, incluso durante la primera semana. En pacientes que reciben tratamiento con CANADIOL debería considerarse la monitorización de la función hepática. Se deben dar instrucciones a los pacientes para que comuniquen inmediatamente a su médico la aparición de signos y síntomas indicativos de hepatitis tales como anorexia, náuseas, vómitos, fatiga, dolor abdominal u orina oscura. En estos pacientes hay que interrumpir el tratamiento inmediatamente y realizar pruebas de la función hepática. La mayor parte de los casos de hepatotoxicidad grave se produjeron en pacientes con enfermedad hepática previa, que recibieron tratamiento para indicaciones sistémicas, tenían otras enfermedades importantes y/o que estaban tomando otros fármacos hepatotóxicos. En pacientes con aumento de las enzimas hepáticas o enfermedad hepática activa, o en los que hayan experimentado toxicidad hepática con otros fármacos, no se debe iniciar el tratamiento a menos que los beneficios esperados sean superiores al riesgo de lesión hepática. En pacientes con alteración de la función hepática se deberán controlar cuidadosamente las enzimas hepáticas mientras se toma itraconazol.
Uso en población pediátrica
Ya que no se dispone de datos clínicos sobre el uso de CANADIOL en pacientes pediátricos, CANADIOL no debe ser utilizado en niños, a menos que los beneficios potenciales superen a los riesgos.
Uso en pacientes de edad avanzada
Ya que los datos clínicos sobre la utilización de CANADIOL en pacientes de edad avanzada son limitados, se recomienda el uso de CANADIOL en estos pacientes solo si el beneficio potencial supera los posibles riesgos
Insuficiencia hepática
No se han llevado a cabo estudios con itraconazol intravenoso en pacientes con insuficiencia hepática. Los datos disponibles sobre el uso intravenoso de itraconazol en pacientes con insuficiencia hepática son limitados, por lo que se deberá tener cuidado cuando este fármaco se administre en estos pacientes (ver secciones 4.2 y 5.2).
Insuficiencia renal:
La hidroxipropil-P-ciclodextrina administrada intravenosamente se elimina por filtración glomerular. Por lo tanto, en pacientes con insuficiencia renal definida como un aclaramiento de creatinina inferior a 30 ml/min CANADIOL está contraindicado (ver secciones 4.3 y 5.2).
CANADIOL debe ser administrado con precaución en pacientes con menor grado de insuficiencia renal.
En pacientes con insuficiencia renal leve a moderada, los niveles de creatinina sérica deben ser estrechamente controlados y, si hay sospecha de toxicidad renal, se deberá considerar el cambio a la formulación en cápsulas orales (ver sección 4.4).
Pérdida auditiva:
Se ha notificado una pérdida transitoria o permanente de la audición en pacientes que recibieron tratamiento con itraconazol. Varias de estas notificaciones incluían la administración concomitante de quinidina, la cual está contraindicada (ver secciones 4.3 y 4.5). Generalmente, la pérdida auditiva remite cuando se interrumpe el tratamiento, pero puede persistir en algunos pacientes.
Neuropatía:
En caso de neuropatía que pudiera ser imputable a CANADIOL, se deberá interrumpir el tratamiento.
Resistencia cruzada
En casos de candidiasis sistémica, ante la sospecha de la existencia de cepas de especies de Candida resistentes al fluconazol, no se puede asumir que éstas sean sensibles al itraconazol, por lo tanto se debe comprobar su sensibilidad antes de empezar el tratamiento con itraconazol.
Potencial de interacción
CANADIOL tiene el potencial de producir interacciones farmacológicas clínicamente relevantes. (Ver sección 4.5)
No se debe usar itraconazol hasta 2 semanas después de la suspensión del tratamiento con agentes inductores del CYP3A4 (rifampicina, rifabutin, fenobarbital, fenitoína, carbamazepina, Hypericum perforatum (Hierba de San Juan)). El uso de itraconazol con dichos medicamentos puede conducir a niveles plasmáticos subterapéuticos de itraconazol y de este modo al fracaso en el tratamiento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Fármacos que afectan al metabolismo del itraconazol
Itraconazol se metaboliza principalmente a través del citocromo CYP3A4. Se han llevado a cabo estudios de interacción con rifampicina, rifabutina y fenitoína, que son potentes inductores enzimáticos del CYP3A4. No se recomienda la combinación de itraconazol con estos potentes inductores enzimáticos, ya que la biodisponibilidad del itraconazol e hidroxi-itraconazol disminuyó de una manera tan amplia en estos estudios que la eficacia podría reducirse considerablemente. No se dispone de datos de estudios realizados con otros inductores enzimáticos tales como carbamacepina, Hypericum perforatum (Hierba de San Juan), fenobarbital e isoniazida, pero cabe esperar efectos similares.
Los potentes inhibidores de esta enzima tales como ritonavir, indinavir, claritromicina y eritromicina pueden incrementar la biodisponibilidad de itraconazol.
Efecto del itraconazol en el metabolismo de otros fármacos
Itraconazol puede inhibir el metabolismo de los fármacos metabolizados por la familia del citocromo 3A. Esto puede incrementar y/o prolongar sus efectos, incluyendo los secundarios. Cuando se utiliza medicación concomitante, se deberá consultar la Ficha Técnica correspondiente para informarse sobre la vía de metabolización de los mismos. Tras interrumpir el tratamiento, las concentraciones plasmáticas de itraconazol disminuyen gradualmente en función de la dosis y la duración del tratamiento (ver sección 5.2.). Esto se debe tener en cuenta cuando se evalúe el efecto inhibitorio del itraconazol sobre otros fármacos administrados simultáneamente.
Fármacos que están contraindicados con itraconazol:
- Terfenadina, astemizol, bepridilo, mizolastina, levacetilmetadol (levometadil), cisaprida, dofetilida, quinidina, sertindol o pimozida, ya que dicha coadministración puede producir un aumento en los niveles plasmáticos de estos fármacos, lo que puede dar lugar a una prolongación del QTc y en raras ocasiones torsade de pointes (ver sección 4.3).
- Inhibidores de la HMG-CoA reductasa metabolizados por el CYP3A4 tales como simvastatina, lovastatina y atorvastatina.
- Triazolam y midazolam oral.
- Los alcaloides del cornezuelo del centeno, como la dihidroergotamina, la ergometrina (ergonovina), la ergotamina y la metilergometrina (metilergonovina).
- Eletriptan
- Nisoldipino
Se debe de tener precaución cuando se administren itraconazol y bloqueantes de los canales del calcio conjuntamente debido a un aumento del riesgo de insuficiencia cardiaca congestiva. Además de las posibles interacciones farmacocinéticas debidas a la enzima metabolizadora del fármaco CYP3A4, los bloqueantes de los canales del calcio pueden tener efectos inotrópicos negativos que pueden sumarse a los de itraconazol.
Los siguientes fármacos deberán utilizarse con precaución y se deberán controlar sus concentraciones plasmáticas, acción o efectos secundarios. Sus dosis, si se administran simultáneamente con el itraconazol, se deberán reducir si fuera necesario:
- Anticoagulantes orales.
- Anti- VIH inhibidores de la proteasa como ritonavir, indinavir, saquinavir.
- Ciertos agentes antineoplásicos, como los alcaloides de la vinca, el busulfán, el docetaxel o el trimetrexato.
- Bloqueantes de los canales del calcio metabolizados por CPY3A4 como las dihidropiridinas y el verapamilo.
- Ciertos inhibidores de la HMG_CoA reductasa metabolizados por el CYP3A4, como la cerivastatina (ver también los fármacos que están contraindicados con itraconazol).
- Ciertos agentes inmunosupresores: ciclosporina, tacrólimus, rapamicina (también conocido como sirolimus).
- Determinados glucocorticoides, como budesonida, dexametasona, fluticasona y metilprednisolona;
- Digoxina (vía la inhibición de la P-glicoproteína).
- Otros: Carbamazepina, cilostazol, buspirona, alfentanilo, alprazolam, brotizolam, midazolam IV, rifabutin, disopiramida, ebastina, fentanilo, halofantrina, repaglinida y reboxetina. No está todavía establecida la importancia del aumento de la concentración y la relevancia clínica de estos cambios durante la administración concomitante con itraconazol.
No se ha observado interacción del itraconazol con la zidovudina (AZT) y la fluvastatina.
No se han observado efectos inductores del itraconazol en el metabolismo del etinilestradiol y la noretisterona.
Efectos sobre la unión a proteínas:
Los estudios in vitro han demostrado que no existen interacciones con la unión a proteínas plasmáticas entre itraconazol e imipramina, propranolol, diazepam, cimetidina, indometacina, tolbutamida y sulfametazina.
4.6 Fertilidad, embarazo y lactancia
Embarazo
CANADIOL no se debe usar durante el embarazo excepto en casos en los que peligre la vida de la paciente y cuando los posibles beneficios justifiquen los daños potenciales al feto (ver sección 4.3)
En estudios en animales, itraconazol muestra toxicidad para la reproducción (ver sección 5.3).
Los datos epidemiológicos sobre la exposición a CANADIOL durante el primer trimestre del embarazo (fundamentalmente en pacientes que recibieron tratamiento a corto plazo para candidiasis vulvovaginal) no mostraron un aumento de riesgo de malformaciones en comparación con los sujetos control no expuestos a ningún teratógeno conocido.
Mujeres en edad fértil
Las mujeres en edad fértil que utilicen CANADIOL deberán adoptar medidas anticonceptivas. Las medidas anticonceptivas efectivas deberán continuar hasta el siguiente periodo menstrual después del final de la terapia con CANADIOL.
Lactancia
Una pequeña cantidad de itraconazol es excretada en la leche materna por lo que no debe ser administrado en madres que estén dando el pecho. Se deberá interrumpir la lactancia antes de tomar itraconazol.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre los efectos sobre la capacidad de conducir y utilizar máquinas. Se debe tener en cuenta que cuando se conduce vehículos y maneja máquinas, pueden ocurrir en algunos casos, la posibilidad de reacciones adversas como mareos, trastornos visuales y pérdida auditiva (ver sección 4.8).
4.8 Reacciones adversas
Los efectos adversos comunicados con más frecuencia en ensayos clínicos con itraconazol intravenoso fueron de origen gastrointestinal, metabólico y nutricional, y hepatobiliar.
La tabla a continuación muestra las reacciones adversas al fármaco clasificadas por órgano y sistema. En la clasificación por órgano y sistema, las reacciones adversas se agruparon según la frecuencia, utilizando el siguiente criterio:
Muy frecuente (> 1/10); Frecuente (>1/100 a <1/10); Poco frecuente (> 1/1.000 a <1/100); Raro (>1/10.000 a <1/1.000); Muy raro (<1/10.000); No conocida (no puede estimarse a partir de los datos disponibles).
|
Reacciones adversas | |
|
Trastornos de la sangre y de sistema linfático | |
|
No conocida |
Leucopenia, Neutropenia, Trombocitopenia |
|
Trastornos del sistema inmunológico | |
|
No conocida |
Enfermedad del suero, Edema angioneurótico, Reacción anafiláctica, Reacción anafilactoide, Hipersensibilidad*. |
|
Trastornos del metabolismo y de la nutrición | |
|
Frecuentes |
Hipopotasemia |
|
Poco frecuentes |
Hiperglucemia |
|
No conocida |
Hipertrigliceridemia |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
Dolor de cabeza, Mareos |
|
Poco frecuentes |
Hipoestesias |
|
No conocida |
Neuropatía periférica*, Parestesias |
|
Trastornos oculares | |
|
Poco frecuentes |
Trastornos visuales, incluyendo Visión borrosa y Diplopía |
|
Trastornos del oído y del laberinto | |
|
Poco frecuentes |
Pérdida auditiva permanente o transitoria*. |
|
No sconocida |
Acúfenos |
|
Trastornos cardíacos | |
|
No conocida |
Insuficiencia cardiaca congestiva*, Hipertensión |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
Disnea |
|
Poco frecuentes |
Edema pulmonar |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
Náuseas |
|
Frecuentes |
Dolor abdominal, Vómitos, Diarrea, Estreñimiento |
|
Poco frecuentes |
Disgeusia |
|
No conocida |
Pancreatitis, Dispepsia |
|
Trastornos hepato |
-biliares |
|
Frecuentes |
Hepatitis, Ictericia, Hiperbilirrubinemia, Incremento de las enzimas hepáticas |
|
No conocida |
Hepatotoxidad*, Insuficiencia hepática aguda* |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes |
Erupción cutánea, Prurito |
|
No conocida |
Necrólisis epidérmica tóxica, Síndrome de Stevens-Johnson, Pustulosis exantemática aguda generalizada, Eritema multiforme, Dermatitis exfoliativa, Vasculitis leucocitoclástica, Urticaria, Alopecia, Fotosensibilidad. |
|
Trastornos muscu |
oesqueléticos y del tejido conjuntivo |
|
Poco frecuentes |
Mialgia |
|
No conocida |
Artralgia |
No conocida
Polaquiuria, Incontinencia urinaria
No conocida
Trastornos menstruales, Disfunción eréctil
Frecuentes * ver sección 4.4.
Edema, Pirexia
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Síntomas
En general, las reacciones adversas notificadas con sobredosis son consistentes con las reacciones adversas a itraconazol ya enumeradas en esta Ficha Técnica (ver sección 4.8).
Tratamiento
En caso de sobredosis, se deben aplicar medidas de soporte. El itraconazol no se puede eliminar por hemodiálisis. No se conoce ningún antídoto específico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antimicóticos para uso sistémico, derivados del triazol.
Código ATC: J02A C02
Modo de acción
El itraconazol inhibe la 14a-desmetilasa fungica, dando lugar a una reducción drástica del ergosterol y una interrupción de la síntesis de la membrana por los hongos.
Relación PK/PD
La relación PK/PD de itraconazol, y de los triazoles en general, es escasamente conocida y complicada debido al limitado conocimiento de la farmacocinética antifúngica.
Mecanismo de resistencia:
La resistencia de los hongos a los azoles parece desarrollarse lentamente y es frecuentemente el resultado de varias mutaciones genéticas. Los mecanismos que han sido descritos son
• La sobre-expresión de ERG11, gen que codifica 14-alfa-desmetilasa (la enzima objetivo)
• Mutaciones concretas de ERG11 que da lugar a una disminución de la afinidad de la 14-alfa-desmetilasa por el itraconazol.
¡m
La sobre-expresión del transportador resultando en un aumento del flujo de itraconazol desde las células fúngicas (es decir, la eliminación de itraconazol desde su objetivo).
• Resistencia cruzada. Se ha observado en Candida spp una resistencia cruzada entre miembros de la clase de los azoles, aunque la resistencia a un miembro de la clase no confiere necesariamente resistencia a otros azoles.
Puntos de corte
Para itraconazol los puntos de corte no han sido todavía establecidos para los hongos utilizando la metodología EUCAST.
Utilizando los métodos CLSI, los puntos de corte sólo han sido establecidos para las especies de Candida en infecciones micóticas superficiales. Los puntos de corte CLSI son: sensible < 0,125 mg/L y resistente >
1 mg/L.
La prevalencia de la resistencia adquirida puede variar geográficamente y con el tiempo para las especies seleccionadas, y sería interesante disponer de información local sobre resistencias especialmente cuando se están tratando infecciones graves. Si es necesario, se solicitará asesoramiento al experto cuando la prevalencia local de la resistencia sea tal que la utilidad del agente en al menos algunos tipos de infecciones sea cuestionable.
La sensibilidad in vitro del hongo al itraconazol depende del tamaño del inóculo, la temperatura de incubación, la fase de crecimiento del hongo y del medio de cultivo utilizado. Por estas razones, la concentración mínima inhibitoria de itraconazol puede variar ampliamente.
La sensibilidad en la tabla a continuación está basada en MIC90 < 1 mg de itraconazol/L. No hay correlación entre la sensibilidad in vitro y la eficacia clínica.
Especies frecuentemente sensibles
Aspergillus spp.1 Blastomyces dermatitidis1
Candida albicans Candida parapsilosis Cladosporium spp.
Coccidioides immitis1 Cryptococcus neoformans Epidermophyton floccosum Fonsecaea spp. 1 Geotrichum spp.
Histoplasma spp.
Malassezia (anteriormente Pityrosporum) spp. Microsporum spp.
Paracoccidioides brasiliensis1 Penicillium marneffei1 Pseudallescheria boydii Sporothrix schenckii
¡m
Trichophyton spp.
Trichosporon spp.
Especies para los que la resistencia adquirida puede ser un problema
Candida glabrata2 3 1 4 Candida krusei Candida tropicalis4
Organismos intrínsecamente resistentes
Absidia spp.
Fusarium spp.
Mucor spp.
Rhizomucor spp.
Rhizopus spp.
Scedosporium proliferans
Cada 200 mg de la dosis intravenosa de itraconazol contiene 8 g de hidroxipropil-B-ciclodextrina que aumenta la solubilidad del itraconazol. El perfil farmacocinético de este componente está descrito a continuación. (Ver Itraconazol; Propiedades farmacocinéticas Hidroxipropil-B-ciclodextrina.)
Distribución
La mayor parte de itraconazol en el plasma está unido a proteínas (99,8 %) y la albúmina es el principal componente de unión (99,6 % para el hidroxi-metabolito). También tiene una notable afinidad por los lípidos. Sólo el 0,2 % del itraconazol del plasma está presente como fármaco libre. Itraconazol se distribuye en un gran volumen aparente en el cuerpo (> 700 L), lo que sugiere su amplia distribución por los tejidos. Las concentraciones en pulmón, riñón, hígado, hueso, estómago, bazo y músculo fueron dos o tres veces superiores a las correspondientes concentraciones plasmáticas, la captación por tejidos queratínicos, especialmente la piel, es hasta cuatro veces mayor que en el plasma. Las concentraciones en el líquido cefalorraquídeo son mucho más bajas que en plasma, pero se ha demostrado eficacia frente a infecciones presentes en líquido cefalorraquídeo.
Metabolismo o Biotransformación
Itraconazol se metaboliza ampliamente en el hígado en un gran número de metabolitos. En estudios in vitro se ha visto que la CYP3A4 es la principal enzima que interviene en el metabolismo del itraconazol. El principal metabolito es el hidroxi-itraconazol, que tiene una actividad antifúngica in vitro comparable a la de itraconazol; las concentraciones plasmáticas mínimas de este metabolito son alrededor del doble de las de itraconazol.
Eliminación
Itraconazol se excreta principalmente como metabolitos inactivos en la orina (35%) y en heces (54%) en una semana tras una dosis de solución oral. La excreción renal de itraconazol y de su metabolito activo, hidroxi-itraconazol representa menos del 1% de la dosis intravenosa. Basándonos en la dosis oral radiomarcada, la excreción fecal del fármaco inalterado fluctúa del 3 al 18 % de la dosis.
Como la redistribución de itraconazol desde los tejidos queratínicos parece ser despreciable, la eliminación de itraconazol de estos tejidos está relacionada con la regeneración epidérmica. A diferencia de la concentración plasmática, la concentración en la piel persiste durante 2 a 4 semanas después de la suspensión de un tratamiento de 4 semanas y en la queratina de las uñas, donde puede detectarse itraconazol ya 1 semana después del inicio del tratamiento, durante al menos seis meses después del final de un período de tratamiento de 3 meses.
Datos de farmacocinética/ farmacodinamia(s)
Poblaciones especiales
Insuficiencia hepática
No se han llevado a cabo estudios con itraconazol intravenoso en pacientes con insuficiencia hepática. Itraconazol se metaboliza predominantemente en el hígado. Se realizó un estudio farmacocinético en 6 sujetos sanos y 12 con cirrosis a los que se les administró una sola dosis de 100 mg de itraconazol en una cápsula.. En los pacientes cirróticos comparados con los sanos, se observó una reducción estadísticamente significativa en la media de la Cmax (47 %) y un aumento del doble en la semivida de eliminación de itraconazol (37 ± 17 horas frente a 16 ± 5 horas). Sin embargo, la exposición total a itraconazol, basado en
¡m
el AUC fue similar en pacientes cirróticos y en sujetos sanos. No hay datos disponibles en pacientes cirróticos durante el uso prolongado de itraconazol. (Ver secciones 4.2 y 4.4)
Insuficiencia renal
Una fracción pequeña (< 1%) de la dosis intravenosa de itraconazol fue excretada inalterada en orina.
Tras una única dosis intravenosa, la semivida terminal media de itraconazol en pacientes con insuficiencia renal leve (definida en este estudio como CrCl 50-79 ml/min), moderada (definida en este estudio como CrCl 20-49 ml/min), y grave (definida en este estudio como CrCl <20 ml/min) fue similar que en voluntarios sanos, (rangos de medias de 42-49 horas vs 48 horas en pacientes con insuficiencia renal y en voluntarios sanos, respectivamente). La exposición global a itraconazol, basada en el AUC, fue disminuyendo en pacientes con insuficiencia renal de moderada a grave en aproximadamente 30% y 40% respectivamente, comparado con sujetos con función renal normal.
No hay datos disponibles en pacientes con insuficiencia renal durante el uso prolongado de itraconazol. La diálisis no tiene efecto en la vida-media o el aclaramiento de itraconazol o hidroxi-itraconazol. (Ver secciones 4.2, 4.3 y 4.4)
Población pediátrica
Los datos farmacocinéticos disponibles sobre el uso de itraconazol en la población pediátrica son limitados. Los estudios clínicos de farmacocinética en niños y adolescentes de edades comprendidas entre 5 meses y 17 años se realizaron con itraconazol en cápsulas, solución oral o formulación intravenosa. Las dosis individuales con las cápsulas y solución oral variaron de 1,5 a 12,5 mg/kg/día, administradas una o dos veces al día. La formulación intravenosa se administró bien como una perfusión única de 2,5 mg/kg, o una perfusión de 2,5 mg/kg una o dos veces al día. Para la misma dosis diaria, la pauta posológica de dos veces al día en comparación con la dosis única diaria produjo concentraciones máximas y mínimas comparables con la pauta posológica diaria única en adultos. No se observó dependencia significativa en función de la edad en el AUC y en el aclaramiento corporal total de itraconazol, mientras que sí se observaron asociaciones débiles entre la edad y el volumen de distribución de itraconazol, la Cmax y la tasa de eliminación terminal. El volumen de distribución y aclaramiento aparente de itraconazol parece estar relacionada con el peso.
Hidroxipropil-B-ciclodextrina
En pacientes con una función renal normal, el perfil farmacocinético de hidroxipropil-B-ciclodextrina, un componente de la formulación intravenosa de CANADIOL, tiene una vida media corta de 1 a 2 horas, y ha demostrado no acumularse tras dosis diarias sucesivas. En voluntarios sanos y en pacientes con insuficiencia renal leve a grave, la mayoría (>85%) de los 8 gramos de hidroxipropil-B-ciclodextrina es eliminada en orina. Siguiendo una única administración intravenosa de 200 mg de itraconazol, se redujo el aclaramiento de hidroxipropil-B-ciclodextrina en pacientes con insuficiencia renal, resultando en una exposición superior de hidroxipropil-B-ciclodextrina. En sujetos con insuficiencia renal leve, moderada y grave, los valores de vida media fueron aumentando por encima de los valores normales en aproximadamente dos, cuatro, y seis veces respectivamente. En estos pacientes, las perfusiones sucesivas pueden dar lugar a una acumulación de hidroxipropil-B-ciclodextrina hasta que se alcanza el estado de equilibrio. La hidroxipropil-B-ciclodextrina es eliminada mediante hemodiálisis.
5.3 Datos preclínicos sobre seguridad Itraconazol
Datos preclínicos de itraconazol revelaron que no había indicios de toxicidad genética, carcinogénesis primaria o alteración de la fertilidad. A dosis altas, se observaron efectos en la corteza adrenal, hígado y en el sistema mononuclear fagocítico pero que parecen tener poca relevancia en la utilización clínica propuesta. Se ha observado que itraconazol provoca un aumento dosis dependiente de la toxicidad materna, embriotoxicidad y teratogenicidad en ratas y ratones a dosis altas. En cachorros de perro se observó una densidad mineral ósea global menor tras la administración crónica de itraconazol y en ratas se observó una reducción de la actividad de la placa ósea, disminución de la zona compacta de los huesos largos y aumento de la fragilidad ósea.
Hidroxipropil-B-ciclodextrina
Los datos preclínicos no revelaron riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis repetidas, genotoxicidad, y toxicidad para la reproducción y el desarrollo. En un estudio de carcinogenicidad en ratas, hidroxipropil-P-ciclodextrina produjo adenocarcinomas en el intestino grueso y adenocarcinomas de páncreas exocrino. Estos hallazgos no se observaron en un estudio similar de carcinogenicidad en ratones. La relevancia clínica de adenocarcinomas en el intestino grueso es baja y el mecanismo de inducción de adenocarcinomas de páncreas exocrino no se considera relevante en humanos.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidroxipropil -P -ciclodextrina Propilenglicol
Ácido clorhídrico concentrado Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables.
Solución inyectable Cloruro de sodio al 0,9%:
Cloruro de sodio, agua para preparaciones inyectables.
6.2 Incompatibilidades
Cuando CANADIOL se diluye en otra solución que no sea la suministrada de 50 ml de solución para perfusión de cloruro de sodio al 0,9%, existe la posibilidad de que el itraconazol precipite.
6.3 Periodo de validez
CANADIOL:
Período de validez envasado: 2 años
Solución para perfusión de cloruro de sodio al 0,9%:
3 años
¡m
Solución mezclada: 24 horas.
6.4 Precauciones especiales de conservación
CANADIOL:
No conservar a temperatura superior a 25 °C. Conservar en el embalaje original.
Cloruro de sodio al 0,9% inyectable:
No conservar a temperatura superior a 25°C. No congelar.
Solución mezclada:
Proteger de la luz natural directa.
Desde un punto de vista microbiológico, el producto se debe utilizar inmediatamente. Si no se utilizara inmediatamente, los tiempos de conservación y las condiciones previas al uso son responsabilidad del usuario y no deben ser superiores a las 24 horas entre 2 y 8 °C, a menos que la disolución de la mezcla se haya realizado en condiciones asépticas controladas y validadas.
6.5 Naturaleza y contenido del envase CANADIOL
Ampolla de vidrio incoloro, siliconizado de tipo I de 25 ml con 25 ml conteniendo 250 mg de itraconazol. Cloruro de sodio al 0,9%:
Bolsa de 75 ml, para perfusión, fabricada con polipropileno flexible, provista de un puerto flexible de entrada y uno de salida, que alberga un volumen de entre 52 y 56 ml de la solución inyectable de cloruro de sodio al 0,9%.
Vía de extensión:
Tubo de cloruro de polivinilo con una válvula de cierre de dos vías y un filtro en línea.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Itraconazol puede precipitar cuando se diluyen 25 ml de concentrado de CANADIOL en soluciones que no sean los 50 ml de la solución de cloruro de sodio al 0,9 % para inyección. Toda la cantidad de 25 ml de concentrado de CANADIOL contenida en la ampolla debe ser diluida en la bolsa de cloruro de sodio para perfusión, la cual está indicada solamente para uso exclusivo en combinación con el concentrado de CANADIOL. Sólo deben usarse los componentes del envase de envases unitarios (por ejemplo, bolsa salina, una vía de extensión con una válvula de cierre de 2 vías y un filtro en línea de 0,2 pm y ampolla de CANADIOL). CANADIOL no debe ser administrado conjuntamente con otros fármacos o fluidos. (Ver sección 6.2).
Antes de comenzar con el proceso de mezclado, el CANADIOL concentrado y el disolvente (Cloruro de sodio) deben ser inspeccionadas visualmente. Sólo deberán ser utilizadas las soluciones transparentes sin partículas extrañas para la preparación de la mezcla.
¡m
El contenido completo de CANADIOL concentrado debe ser inyectado en la bolsa de Cloruro de Sodio en un único movimiento de forma lenta (hasta 60 segundos). Durante el proceso de mezcla puede aparecer opalescencia, pero desaparecerá tras un ligero mezclado. Una vez realizada la inspección visual de la bolsa tras el mezclado y antes de la administración, se pueden observar agregados intrínsecos del producto. Estos agregados no afectan a la calidad del producto. La vía de extensión específica con una válvula de cierre de 2 vías y un filtro en línea de 0,2 pm, se debe utilizar para evitar que los agregados alcancen el circulación del receptor.
CANADIOL se debe administrar según las instrucciones siguientes: Apertura de la ampolla
Romper la ampolla como se muestra a continuación:

Apertura de la bolsa de cloruro de sodio
Rasgar la envoltura externa por la muesca y sacar la bolsa de perfusión.
Procedimiento de lavado antes de la perfusión
Antes de la perfusión, el catéter debe lavarse para evitar problemas de compatibilidad entre las cantidades
residuales de otros medicamentos e itraconazol.
- Llenar la vía de extensión que se proporciona con el kit que contiene el filtro en línea de 0,2 pm junto con la solución de cloruro de sodio al 0,9% y conectar directamente al catéter intravenoso permanente.
- Lavar la vía de extensión que se proporciona con el kit y el catéter intravenoso permanente con la solución estéril de cloruro de sodio.
Mezcla de CANADIOL concentrado y el cloruro de sodio al 0,9 % para preparaciones inyectables
- Cada componente se debe encontrar a temperatura ambiente.
- Mezclar solamente en la bolsa para perfusión facilitada. Utilizando una técnica aséptica, retirar todo el concentrado de la ampolla con una aguja de longitud adecuada (no incluida en el kit), posteriormente, añadir el concentrado de CANADIOL a la bolsa de perfusión mediante la punción del puerto.
- Añadir el volumen completo (25 ml) del concentrado de CANADIOL a la bolsa en un único acto de forma lenta (hasta 60 segundos). Durante el proceso de mezcla, puede aparecer alguna opalescencia. Este es un fenómeno normal del producto y desaparecerá después de que todo el contenido de los 25 ml de CANADIOL se haya diluido en la bolsa de perfusión de Cloruro de Sodio y tras una suave mezcla. Retirar la aguja después de haber inyectado el concentrado de CANADIOL en la bolsa.
¡m
- Mezclar suavemente el contenido de la bolsa una vez el CANADIOL concentrado se haya introducido completamente. La mezcla se tornará transparente aunque pueden observarse agregados intrínsecos del producto (descritos como partículas con apariencia fibrosa o escamosa, no cristalinas, blancas). Estos agregados no afectan a la calidad del producto.
- La mezcla se debe utilizar inmediatamente y se debe proteger de la luz natural directa. Durante la administración, es admisible la exposición a la luz normal de la habitación (ver secciones 6.3. y 6.4.).
Perfusión
- La solución mezclada es sólo de un único uso. No se debe de administrar si la solución es de un color blanco lechoso que no desaparece tras un mezclado suave, o contiene partículas extrañas, o si la bolsa para perfusión está dañada.
- La bolsa de perfusión debe contener 25 ml de concentrado de CANADIOL y 50 ml de cloruro de sodio al 0,9 % para preparaciones inyectables.
- Nota: No se incluye con el kit una vía de perfusión con una cámara de goteo. Cerrar el dispositivo de control de flujo (llave rotatoria) de la vía de perfusión. Eliminar la parte rompible del puerto externo.
Utilizar una técnica aséptica, presionar el pasador de la vía de perfusión del puerto flexible de la bolsa de perfusión.
- Soltar suavemente el dispositivo de control de flujo y llenar la cámara de goteo hasta la mitad apretándolo (bombeándolo).
- Abrir el dispositivo de control de flujo hasta que se haya expulsado todo el aire de la vía de perfusión.
- Conectar el tubo de perfusión a la válvula de cierre de dos vías del tubo de extensión.
- La perfusión de CANADIOL ya está preparada para su perfusión intravenosa al paciente.
- Ajustar la velocidad de perfusión a 1 ml/min (aproximadamente 25 gotas/min) mediante un dispositivo de control de flujo (p.ej. llave rotatoria o bomba de perfusión).
- Administrar 60 ml de la solución al paciente durante una hora aproximadamente.
- Parar la perfusión cuando se hayan administrado 60 ml.
- Tener en cuenta que se han administrado 200 mg de itraconazol.
- Lavar la vía siguiendo el procedimiento de lavado descrito a continuación.
Procedimiento de lavado tras la perfusión
Tras la perfusión se debe realizar un procedimiento completo de lavado para limpiar el catéter. Esto se realiza para evitar problemas de compatibilidad entre las cantidades residuales de itraconazol y de otros fármacos que pudieran administrarse posteriormente a través del mismo catéter.
- Lavar la vía de extensión y el catéter con 15-20 ml de solución estéril de cloruro de sodio al 0,9% hasta el nivel de la válvula de cierre de dos vías, justo antes del filtro en línea de 0,2 ^m.
- Realizar el lavado en un ciclo continuo de 30 segundos a 15 minutos.
- Después del lavado, desconectar y desechar la bolsa, el tubo de perfusión y la vía de extensión.
- No reesterilizar ni reutilizar el kit de perfusión de CANADIOL.
- Para evitar la precipitación únicamente será administrada otra medicación a través del catéter tras el lavado.
- Si se utilizara un catéter multilumen, no se deberá administrar otra medicación hasta que se haya completado la perfusión de CANADIOL y el catéter haya sido lavado.
ÜE
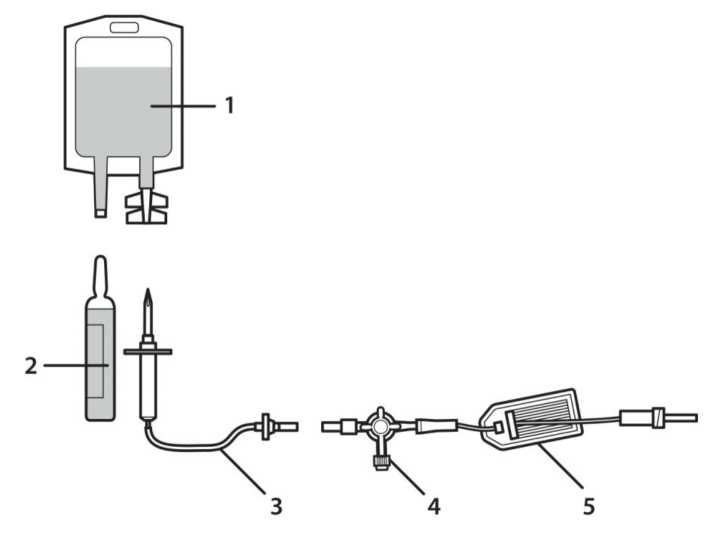
1. Bolsa de perfusión de cloruro de sodio.
2. Ampolla de CANADIOL.
3. Vía de perfusión con cámara de goteo (no se incluye)
4 & 5. Vía de extensión con válvula de cierre de dos vías y filtro en línea.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios Dr. Esteve, S.A.
Av. Mare de Déu de Montserrat, 221 08041 Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65.534
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Julio 2003/ Julio 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
12/2014
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
18 de 18
Se han notificado cepas de Aspergillus fumigatus resistentes al itraconazol.
Scopulariopsis spp.
Estos organismos pueden ser encontrados en pacientes que han vuelto de un viaje fuera de Europa.
Sensibilidad intermediada natural
5.2 Propiedades farmacocinéticas
Itraconazol
Características farmacocinéticas generales
Los picos de concentraciones plasmáticas de itraconazol se alcanzaron al final de la perfusión intravenosa, declinando a continuación. Los picos de concentraciones plasmáticas de hidroxi-itraconazol (ver Metabolismo a continuación) son alcanzados en las tres horas desde el comienzo de la perfusión de una hora, disminuyendo posteriormente.
Como consecuencia de la ausencia de linealidad en la farmacocinética, itraconazol se acumula en el plasma después de la administración de dosis múltiples.
En 4 estudios farmacocinéticos en pacientes a dosis múltiples, se administró itraconazol intravenoso en una perfusión de 1 hora de 200 mg de itraconazol dos veces al día en los días 1 y 2 de tratamiento, seguido de una perfusión de 1 hora de 200 mg, una vez al día, desde el día 3 al día 7 de tratamiento. Las concentraciones en el estado estacionario de itraconazol e hidroxi-itraconazol se alcanzaron generalmente entre las 48 y 96 horas, respectivamente. En la mayoría de los pacientes se alcanzaron concentraciones plasmáticas de itraconazol > 250 ng /ml.
El aclaramiento medio total en plasma de itraconazol tras la administración intravenosa es de 278 ml/min. El aclaramiento de itraconazol disminuye a dosis más altas debido a un metabolismo hepático saturable. La semivida final de itraconazol generalmente oscila de 16 a 28 horas después de dosis única y aumenta de 34 a 42 horas tras dosis repetidas.