Campto 40 Mg/2 Ml Concentrado Para Solucion Para Perfusion

agencia española de medicamentos y productos sanitarios
1. NOMBRE DEL MEDICAMENTO
Campto 40 mg/2 ml concentrado para solución para perfusión Campto 100 mg/5 ml concentrado para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
El concentrado contiene 20 mg/ml de hidrocloruro de irinotecán trihidrato (equivalente a 17,33 mg/ml de irinotecán).
Cada vial de 2 ml contiene 40 mg de hidrocloruro de irinotecán trihidrato (equivalente a 34,6 mg de
irinotecan).
Cada vial de 5 ml contiene 100 mg de hidrocloruro de irinotecán trihidrato (equivalente a 86,5 mg de irinotecan).
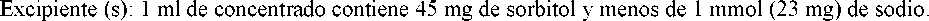
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión.
Solución clara de color amarillo pálido.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Campto está indicado para el tratamiento de pacientes con cáncer colorrectal avanzado:
• en combinación con 5-fluorouracilo y ácido folínico en pacientes sin una quimioterapia anterior para la enfermedad avanzada.
• en monoterapia para pacientes en los que ha fracasado un régimen de tratamiento establecido que contiene 5-fluorouracilo.
Campto en combinación con cetuximab está indicado para el tratamiento de pacientes con cáncer colorrectal metastásico que exprese el receptor del factor de crecimiento epidérmico (EGRF) con KRAS no mutado (wild type) que no han recibido tratamiento previo para el cáncer metastático o después del fracaso con un tratamiento citotóxico que haya incluido irinotecán (ver sección 5.1)
Campto en combinación con 5-fluorouracilo, ácido folínico y bevacizumab está indicado para el tratamiento en primera línea de pacientes con carcinoma metastásico de colon o recto.
Campto en combinación con capecitabina con o sin bevacizumab, está indicado para el tratamiento en primera línea de pacientes con cáncer colorrectal metastático.
4.2. Posología y forma de administración
Sólo para adultos. La perfusión de Campto se debe realizar en una vena periférica o central.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)

Dosis recomendada
En monoterapia (en pacientes previamente tratados):
La dosis recomendada es de 350 mg/m2 de Campto administrados en perfusión intravenosa durante un período de 30 a 90 minutos, cada tres semanas (ver secciones. 4.4 y 6.6).
En terapia combinada (en pacientes no tratados previamente):
La seguridad y eficacia de Campto en combinación con 5-fluorouracilo y ácido folínico ha sido estudiada con la siguiente pauta de administración (ver sección 5.1): Campto y 5-fluorouracilo/ácido folínico cada 2 semanas. La dosis recomendada de Campto es 180 mg/m2, administrada en perfusión intravenosa cada 2 semanas durante un periodo de 30 a 90 minutos, seguido de perfusión con ácido folínico y 5-fluorouracilo.
Irinotecan en combinación con cetuximab: para la posología y forma de administración con cetuximab, consultar la ficha técnica de este medicamento. Normalmente la dosis empleada de irinotecán es la misma que la administrada en ciclos previos. Irinotecán no debe ser administrado hasta una hora después de la finalización de la perfusión de cetuximab.
Irinotecan en combinación con bevacizumab: para la posología y forma de administración de bevacizumab, consultar la ficha técnica de este medicamento.
Irinotecan en combinación con capecitabina: para la posología y forma de administración de capecitabina ver sección 5.1 y consultar la ficha técnica de este medicamento.
Ajustes de dosis
Campto debe ser administrado después de una recuperación adecuada de todos los acontecimientos adversos de grado 0 ó 1 en la clasificación NCI-CTC (National Cancer Institute Common Toxicity Criteria) y cuando la recuperación de la diarrea relacionada con el tratamiento sea completa.
Al comienzo de la siguiente perfusión, la dosis de Campto, y la de 5-fluorouracilo cuando proceda, debe reducirse de acuerdo con el acontecimiento adverso de peor grado observado en la perfusión previa. El tratamiento puede ser aplazado 1 ó 2 semanas para permitir la recuperación de los acontecimientos adversos relacionados con el tratamiento.
Debe aplicarse una reducción del 15 al 20% en la dosis de Campto y/o 5-fluorouracilo cuando proceda, en el caso de los siguientes acontecimientos adversos:
- toxicidad hematológica [neutropenia grado 4, neutropenia febril (neutropenia grado 3-4 y fiebre grado 24), trombocitopenia y leucopenia (grado 4) ]
- toxicidad no hematológica (grado 3-4)
Consultar la ficha técnica de cetuximab para las recomendaciones a seguir en el ajuste de dosis de este medicamento cuando se administra en combinación con Campto
Consultar la ficha técnica de bevacizumab para las recomendaciones a seguir en el ajuste de dosis de este medicamento cuando se administra en combinación con Campto/5-fluorouracilo/ácido folínico.
De acuerdo a la ficha técnica de capecitabina, para pacientes de 65 o más años tratados con irinotecan en combinación con capecitabina, se recomienda una reducción de la dosis inicial de capecitabina a 800 mg/m2 administrada dos veces al día. Consultar la ficha técnica de capecitabina para las recomendaciones a seguir en el ajuste de dosis de este medicamento cuando se administra en combinación.

Duración del tratamiento
El tratamiento con Campto debe continuar hasta que haya una progresión objetiva de la enfermedad o una toxicidad inaceptable.
Poblaciones especiales
Pacientes con insuficiencia hepática En monoterapia:
En los pacientes con un estado general de la OMS < 2, la dosis inicial de Campto depende de los niveles de bilirrubina en sangre (hasta 3 veces el límite superior del rango normal, LSN). En los pacientes con hiperbilirrubinemia y tiempo de protrombina mayor del 50%, se reduce el aclaramiento de irinotecán (ver sección 5.2) y por tanto, aumenta el riesgo de hematotoxicidad. En consecuencia, en este grupo de pacientes deben realizarse recuentos sanguíneos completos semanalmente.
• En los pacientes con un nivel de bilirrubina hasta 1,5 veces el LSN, se recomienda una dosis de 350 mg/m2 de Campto.
• En los pacientes con un nivel de bilirrubina entre 1,5 y 3 veces el límite superior del rango normal (LSN), se recomienda una dosis de 200 mg/m2 de Campto.
• Los pacientes con un nivel de bilirrubina por encima de 3 veces el LSN, no deben ser tratados con Campto (ver secciones 4.3 y 4.4).
En combinación:
No hay datos disponibles de pacientes con insuficiencia hepática tratados con Campto en combinación.
Pacientes con insuficiencia renal
No se recomienda el uso de Campto en pacientes con insuficiencia renal, dado que no se han llevado a cabo estudios en este grupo de población, (ver secciones 4.4 y 5.2).
Población pediátrica
No se ha demostrado la eficacia y seguridad de Campto en este grupo de pacientes, por tanto, no se recomienda su uso en niños.
Ancianos
No se han realizado estudios farmacocinéticos específicos en ancianos. Sin embargo, se debe elegir con precaución la dosis en este grupo de población, debido a una mayor frecuencia de disminución de las funciones biológicas. Este grupo de población necesitará una vigilancia más intensa (ver sección 4.4.).
4.3. Contraindicaciones
- Hipersensibilidad al principio activo, hidrocloruro de irinotecán trihidrato, o a alguno de los excipientes.
- Enfermedad inflamatoria intestinal crónica y/o obstrucción intestinal (ver sección 4.4).
- Durante el embarazo y la lactancia (ver secciones 4.4 y 4.6).
- Nivel de bilirrubina > 3 veces el límite superior del rango normal (ver sección 4.4).

- Pacientes con insuficiencia grave de la médula ósea.
- Pacientes con estado general de la OMS >2.
- Uso concomitante con la Hierba de San Juan (ver sección 4.5).
En el caso de contraindicaciones adicionales de cetuximab o bevacizumab o capecitabina, consultar las fichas técnicas de estos medicamentos.
4.4. Advertencias y precauciones especiales de empleo
El uso de Campto debe restringirse a servicios especializados en la administración de quimioterapia citotóxica y debe administrarse solamente bajo la supervisión de un médico especializado en el empleo de quimioterapia antineoplásica.
Dada la naturaleza e incidencia de los efectos adversos, Campto sólo se prescribirá en los siguientes casos tras haber analizado el beneficio esperado frente a los posibles riesgos terapéuticos:
- en pacientes con un factor de riesgo, en especial aquéllos con un estado general de la OMS = 2
- en los pocos casos en los que se prevea que los pacientes no van a seguir adecuadamente las recomendaciones para el manejo de acontecimientos adversos (necesidad de tratamiento antidiarreico inmediato y prolongado junto con ingestión abundante de líquidos al aparecer la diarrea tardía). Se recomienda un estricto seguimiento hospitalario de dichos pacientes.
Habitualmente, cuando se administra Campto en monoterapia, se prescribe en régimen de administración cada 3 semanas. Sin embargo, puede considerarse la pauta semanal (ver sección 5) en pacientes que pudieran necesitar un seguimiento más estrecho o en aquellos que presenten un riesgo especial de neutropenia grave.
Diarrea tardía
Los pacientes deben ser advertidos del riesgo de diarrea tardía, que puede aparecer después de 24 horas de la administración de Campto y en cualquier momento antes de la administración del ciclo siguiente. En monoterapia, la mediana de tiempo de la primera deposición líquida fue en el día 5 después de la perfusión de Campto. Estos pacientes deben informar rápidamente a su médico y comenzar inmediatamente el tratamiento adecuado.
El riesgo de diarrea aumenta en pacientes con irradiación abdominal/pélvica previa, pacientes con hiperleucocitosis basal, pacientes con estado general de la OMS grado > 2 y mujeres. Si no es tratada de forma adecuada, la diarrea podría llegar a poner en riesgo la vida, especialmente si el paciente tiene neutropenia concomitante.
Tan pronto aparezca la primera deposición líquida, el paciente debe beber importantes volúmenes de líquidos que contengan electrolitos y debe iniciar un adecuado tratamiento antidiarreico inmediatamente.
Este tratamiento antidiarreico será prescrito por el departamento donde le haya sido administrado el ciclo de Campto. Una vez fuera del hospital, los pacientes deben obtener la medicación prescrita para que puedan tratar la diarrea tan pronto como aparezca. Además, deben informar inmediatamente a su médico o al hospital donde se le haya suministrado Campto, de si aparece dicha diarrea y cuándo ocurre.
El tratamiento antidiarreico actualmente recomendado consiste en dosis elevadas de loperamida (una primera toma de 4 mg y luego 2 mg cada 2 horas). Este tratamiento debe continuarse durante 12 horas después de la última deposición líquida y no debe modificarse. La loperamida no deberá administrarse a

estas dosis durante más de 48 horas consecutivas, debido al riesgo de provocar íleo paralítico, ni tampoco durante menos de 12 horas.
Si la diarrea va acompañada de neutropenia grave (recuento de neutrófilos <500 células/mm3), debe administrarse de modo profiláctico un antibiótico de amplio espectro además del tratamiento antidiarreico.
Además del tratamiento antibiótico, se recomienda la hospitalización para el tratamiento de la diarrea en los siguientes casos:
- diarrea acompañada de fiebre.
- diarrea grave (que requiera hidratación por vía intravenosa).
- diarrea que persista más de 48 horas después del comienzo de la terapia con altas dosis de loperamida.
No se debe instaurar ninguna administración profiláctica de loperamida, incluso en pacientes que presentaron diarrea tardía en ciclos previos.
En los pacientes que hayan presentado una diarrea grave se recomienda una reducción de la dosis en los ciclos siguientes (ver sección 4.2).
Hematología
Durante el tratamiento con Campto, se recomienda monitorizar semanalmente los recuentos sanguíneos completos. Se debe advertir a los pacientes del riesgo de neutropenia y de la importancia de la aparición de fiebre. Toda neutropenia febril (temperatura > 38°C y recuento de neutrófilos <1000 células/mm3) debe ser tratada de urgencia en el hospital, con antibióticos intravenosos de amplio espectro.
En pacientes que han experimentado eventos hematológicos graves, se recomienda reducir la dosis en administraciones posteriores (ver sección 4.2).
En pacientes con diarrea grave hay mayor riesgo de infecciones y de toxicidad hematológica. En estos pacientes debe realizarse un recuento completo de células sanguíneas.
Pacientes con insuficiencia hepática
Al inicio del tratamiento y antes de cada ciclo deben realizarse pruebas de la función hepática.
En los pacientes con un nivel de bilirrubina entre 1,5 y 3 veces el LSN, deben realizarse recuentos sanguíneos completos semanalmente, ya que el aclaramiento de irinotecán se reduce (ver sección 5.2) y por tanto, aumenta el riesgo de hematotoxicidad en esta población.
Los pacientes con un nivel de bilirrubina por encima de 3 veces el LSN, no deben ser tratados con Campto (ver sección 4.3).
Náuseas y vómitos
Antes de cada tratamiento con Campto se recomienda el tratamiento profiláctico con antieméticos. Son frecuentes las náuseas y vómitos en los pacientes sometidos a tratamiento con Campto. Aquellos pacientes que presenten vómitos asociados a diarrea tardía deberán ser hospitalizados para ser tratados lo antes posible.
Síndrome colinérgico agudo

En caso de síndrome colinérgico agudo, (definido como diarrea precoz y por un conjunto de síntomas tales como sudoración, calambres abdominales, lagrimeo, miosis y salivación) debe administrarse sulfato de atropina (250 microgramos por vía subcutánea) a menos que esté contraindicado clínicamente (ver sección 4.8).
Se debe tener precaución en pacientes con asma. En pacientes que hayan experimentado un síndrome colinérgico grave y agudo, se recomienda la administración profiláctica de sulfato de atropina en las subsiguientes dosis de Campto.
Trastornos respiratorios
Durante el tratamiento con irinotecán es poco frecuente la enfermedad pulmonar intersticial, en forma de infiltrados pulmonares. La enfermedad pulmonar intersticial puede ser mortal. Los factores de riesgo posiblemente asociados al desarrollo de enfermedad pulmonar intersticial incluyen el uso de fármacos neumotóxicos, radioterapia y factores de estimulación de colonias. Los pacientes con factores de riesgo deben ser controlados estrechamente para detectar síntomas respiratorios antes y durante el tratamiento con irinotecán.
Ancianos
Debido a una mayor frecuencia de la disminución de las funciones biológicas, especialmente las funciones hepáticas, en pacientes de edad avanzada, la dosis de Campto debe ser cuidadosamente seleccionada para pacientes de esta población (ver sección 4.2).
Pacientes con obstrucción intestinal
Estos pacientes no deben ser tratados con Campto hasta que se produzca una recuperación de la obstrucción intestinal (ver sección 4.3).
Pacientes con insuficiencia renal
No se han realizado estudios en pacientes con insuficiencia renal (ver secciones 4.2 y 5.2).
Otros
Se han observado casos poco frecuentes de insuficiencia renal, hipotensión o fallo circulatorio en pacientes que habían sufrido episodios de deshidratación asociados con diarrea y/o vómitos o sepsis Durante el tratamiento y al menos tres meses después de su finalización deben tomarse medidas anticonceptivas (ver sección 4.6).
Debe evitarse la administración concomitante de irinotecán con fármacos que sean inhibidores fuertes (por ejemplo ketoconazol) o inductores (por ejemplo rifampicina, carbamazepina, fenobarbital, fenitoína o la hierba de San Juan) de la vía del citocromo CYP3A4 ya que puede alterarse el metabolismo de irinotecán y, por lo tanto, debe evitarse (ver sección 4.5).
Este medicamento contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben usar este medicamento.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis máxima posológica que es 350 mg/m2, por lo que se considera esencialmente “exento de sodio”

4.5. Interacción con otros medicamentos y otras formas de interacción
No se puede descartar la posibilidad de interacción entre el irinotecán y agentes bloqueantes neuromusculares. Dado que irinotecán tiene actividad anticolinesterasa, los fármacos con actividad anticolinesterasa pueden prolongar los efectos bloqueantes neuromusculares del suxametonio y pueden antagonizar el bloqueo neuromuscular de fármacos no despolarizantes.
Varios estudios han demostrado que la administración concomitante de fármacos anticonvulsivantes inductores del CYP3A (ej: carbamazepina, fenobarbital o fenitoina) conducen a una reducción en la exposición a irinotecán, SN-38 y glucurónido de SN-38 y, a una reducción de los efectos farmacodinámicos. De hecho, la reducción del AUC de los metabolitos SN-38 y SN-38G llegaba hasta un 50% o más en la administración conjunta con estos fármacos anticonvulsivantes. Además de la inducción por las enzimas del citocromo P450 3A, el aumento de la glucuronidación y el aumento de la excreción biliar pueden participar en la reducción de la exposición a irinotecán y sus metabolitos.
Un estudio mostró que la administración concomitante de irinotecán con ketoconazol conducía a una disminución del 87% en el AUC del metabolito APC (derivado del ácido aminopentanoico) y un aumento del 109% en el AUC del metabolito SN-38, en comparación con la administración de irinotecán solo.
Se debe tener precaución en pacientes que estén tomando simultáneamente fármacos que inhiben (ej: ketoconazol) o inducen (ej: carbamazepina, fenobarbital o fenitoina) el metabolismo por el citocromo P450 3A. La administración concomitante de irinotecán con un inhibidor/inductor de esta vía metabólica debe ser evitada ya que el metabolismo de irinotecán puede verse alterado (ver sección 4.4).
En un ensayo farmacocinético reducido (n=5) en el que Campto se administró a una dosis de 350 mg/m2 conjuntamente con 900 mg de Hierba de San Juan (Hypericum perforatum), se observó una disminución del 42 % en las concentraciones plasmáticas del metabolito activo SN-38. Como consecuencia, la Hierba de San Juan no debe ser administrada con Campto (ver sección 4.3)
La coadministración de 5-fluorouracilo y ácido folínico en los regímenes combinados no altera la farmacocinética de irinotecán.
No hay evidencias de que cetuximab influya en el perfil de seguridad de irinotecán o viceversa.
En un estudio se demostró que las concentraciones de irinotecán en pacientes en tratamiento con Campto/5-fluorouracilo/ácido folínico sólo y en combinación con bevacizumab, eran similares. Se analizaron las concentraciones de SN-38, el metabolito activo de irinotecán, en un subgrupo de pacientes (aproximadamente 30 por brazo de tratamiento). En los pacientes que recibieron Campto/5-fluorouracilo/ácido folínico en combinación con bevacizumab, las concentraciones de SN-38 fueron de media un 33% más elevadas que en los pacientes a los que únicamente se les administraba la combinación Campto/5-fluorouracilo/ácido folínico. Debido a la alta variabilidad interindividual y a la muestra limitada, no se puede asegurar que el aumento observado en los niveles de SN-38 sea debido a bevacizumab. Se produjo un pequeño aumento de la diarrea y leucopenia. Se notificaron más reducciones de dosis de irinotecán en los pacientes tratados con Campto/5-fluorouracilo/ácido folínico en combinación con bevacizumab.
En aquellos pacientes que presenten diarrea grave, leucopenia o neutropenia cuando se administre irinotecán en combinación con bevacizumab se deberá modificar la dosis de irinotecán tal y como se especifica en la sección 4.2.
4.6. Embarazo y lactancia
Embarazo
No existen datos sobre la utilización de Campto en mujeres embarazadas.

Campto ha demostrado ser embriotóxico, fetotóxico y teratógeno en la rata y en el conejo. En consecuencia, no se debe administrar Campto durante el embarazo (ver sección 4.3)
Mujeres en edad fértil
A las mujeres en edad fértil que sean tratadas con Campto se les debe aconsejar evitar el embarazo (ver sección 4.4) y deben informar inmediatamente a su médico en caso de que éste tenga lugar (ver sección 4.3).
Las mujeres en edad fértil y también los hombres deben usar métodos anticonceptivos durante y por un mínimo de tres meses después de la finalización del tratamiento.
Lactancia
14C-irinotecán ha sido detectado en la leche de ratas en periodo de lactancia. Se desconoce si irinotecán es excretado a través de la leche materna en el ser humano. En consecuencia, dada la posibilidad de reacciones adversas en niños lactantes, la lactancia debe interrumpirse durante el tratamiento con Campto (ver sección 4.3).
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No obstante, los pacientes deben ser advertidos de la posibilidad de mareos o alteraciones visuales dentro de las 24 horas siguientes a la administración de Campto, siendo aconsejable no conducir vehículos ni manejar maquinaria si aparecen dichos síntomas.
4.8. Reacciones adversas
Las reacciones adversas descritas en esta sección se refieren sólo al tratamiento con irinotecán. No existen datos que indiquen que el perfil de seguridad de irinotecán se vea afectado por cetuximab o viceversa. En combinación con cetuximab las reacciones adversas adicionales notificadas fueron las esperadas con cetuximab (como exantema acneiforme 88%). Consultar las respectivas fichas técnicas de irinotecan y cetuximab para las reacciones adversas del tratamiento combinado.
Consultar la ficha técnica de bevacizumab para las reacciones adversas del tratamiento combinado.
Las reacciones adversas notificadas en pacientes tratados con capecitabina en combinación con irinotecan además de las observadas con capecitabina en monoterapia o las observadas con una mayor frecuencia en comparación con capecitabina en monoterapia incluyen:
-Reacciones adversas muy frecuentes de todos los grados: trombosis/embolismo
-Reacciones adversas frecuentes de todos los grados: reacciones de hipersensibilidad, isquemia cardiaca/infarto.
-Reacciones adversas frecuentes de grados 3/4: neutropenia febril
Para información completa sobre las reacciones adversas, consultar la ficha técnica de capecitabina.
Las reacciones adversas de grados 3/4 notificadas en pacientes tratados con capecitabina en combinación con irinotecan y bevacizumab además de las observadas con capecitabina en monoterapia o las observadas con una mayor frecuencia en comparación con capecitabina en monoterapia incluyen:
-Reacciones adversas frecuentes de grados 3/4: neutropenia, trombosis/embolismo, hipertensión e isquemia cardiaca/infarto.
Para información completa sobre las reacciones adversas, consultar las respectivas fichas técnicas de capecitabina y bevacizumab.
Las siguientes reacciones adversas, consideradas posible o probablemente relacionadas con la administración de Campto, han sido comunicadas en una población de 765 pacientes a la dosis
recomendada de 350 mg/m2 en monoterapia y en 145 pacientes tratados con Campto en terapias combinadas con 5-fluorouracilo/ácido folínico en pauta de administración cada 2 semanas a la dosis recomendada de 180 mg/m2.

Infecciones e infestaciones
Se han observado casos poco frecuentes de insuficiencia renal, hipotensión o fallo cardiocirculatorio en pacientes que presentaron sepsis.
Trastornos de la sangre y del sistema linfático
La neutropenia es un efecto tóxico limitante de la dosis. La neutropenia fue reversible y no acumulativa; la mediana de días hasta el nadir fue de 8 días tanto usado en monoterapia como en tratamiento combinado.
En monoterapia:
Se observó neutropenia en el 78,7 % de los pacientes y fue grave (recuento de neutrófilos
< 500 células/mm3) en el 22,6 % de los pacientes. De los ciclos evaluables, el 18 % tenían un recuento de neutrófilos por debajo de 1.000 células/mm3 incluyendo un 7,6 % con un recuento < 500 células/mm3. Hacia el día 22 generalmente se alcanzaba la recuperación completa.
Se notificó fiebre con neutropenia grave en el 6,2 % de los pacientes y en el 1,7 % de los ciclos.
Se produjeron episodios infecciosos en cerca del 10,3 % de los pacientes (2,5 % de los ciclos) y estuvieron asociados con neutropenia grave en cerca del 5,3 % de los pacientes (1,1 % de los ciclos), con resultado de muerte en dos casos.
Se notificó anemia en cerca del 58,7 % de los pacientes (el 8 % con hemoglobina < 8 g/dl y el 0,9 % con hemoglobina < 6.5 g/dl).
Se observó trombocitopenia (< 100.000 células/mm3) en el 7,4 % de los pacientes y en el 1,8 % de los ciclos, con un 0,9 % con recuento de plaquetas < 50.000 células/mm3 y un 0,2 % de los ciclos.
Casi todos los pacientes mostraron una recuperación hacia el día 22.
En tratamiento combinado:
Se observó neutropenia en el 82,5 % de los pacientes y fue grave (recuento de neutrófilos
< 500 células/mm3) en el 9,8 % de los pacientes.
De los ciclos evaluables, el 67,3 % tenían un recuento de neutrófilos por debajo de 1.000 células/mm3 incluyendo un 2,7 % con un recuento < 500 células/mm3.
En 7-8 días generalmente se alcanzaba la recuperación completa.
Se notificó fiebre con neutropenia grave en el 3,4 % de los pacientes y en el 0,9 % de los ciclos.
Se produjeron episodios infecciosos en cerca del 2 % de los pacientes (0,5 % de los ciclos) y estuvieron asociados con neutropenia grave en cerca del 2,1 % de los pacientes (0,5 % de los ciclos), con resultado de muerte en 1 caso.
Se notificó anemia en el 97,2 % de los pacientes (2,1 % con hemoglobina < 8 g/dl).
Se observó trombocitopenia (< 100.000 células/mm3) en el 32,6 % de los pacientes y en el 21,8 % de los ciclos. No se observó trombocitopenia grave (< 50.000 células/mm3).
En la experiencia post-comercialización se ha notificado un caso de trombocitopenia periférica con anticuerpos antiplaquetarios.
Trastornos del sistema inmunológico
Se han notificado con poca frecuencia reacciones alérgicas leves y casos raros de reacciones anafilácticas/anafilactoides.
Trastornos del sistema nervioso

Durante el periodo post-comercialización, se han notificado casos muy raros de trastornos transitorios del habla asociados con la perfusión de Campto.
En pacientes tratados con irinotecan se han notificado trastornos del habla, generalmente de naturaleza transitoria; en algunos casos, la reacción fue atribuida al síndrome colinérgico observado durante o poco tiempo después de la perfusión de irinotecan
Trastornos cardiacos
Se han notificado casos raros de hipertensión durante o tras la perfusión.
Trastornos respiratorios, torácicos y mediastínicos
La enfermedad pulmonar intersticial, en forma de infiltrados pulmonares es poco frecuente durante el tratamiento con irinotecan. Se han notificado efectos tempranos, tales como disnea (ver sección 4.4).
Trastornos gastrointestinales Diarrea tardía
La diarrea, que aparece después de 24 horas de la administración, es una toxicidad limitante de la dosis de Campto.
En monoterapia: se ha observado diarrea grave en el 20 % de los pacientes que seguían las recomendaciones para el manejo de la diarrea. De los ciclos evaluables, el 14 % tenían una diarrea grave. La mediana del tiempo de comienzo de la primera deposición líquida fue en el día 5 tras la perfusión de Campto.
En tratamiento combinado: se ha observado diarrea grave en el 13,1 % de los pacientes que seguían las recomendaciones para el manejo de la diarrea. De los ciclos evaluables, el 3,9 % tenían una diarrea grave.
Se han notificado casos poco frecuentes de colitis pseudomembranosa, uno de lo cuales ha sido documentado bacteriológicamente (Clostridium difficile).
Nauseas y vómitos
En monoterapia: las nauseas y vómitos fueron graves en aproximadamente el 10 % de los pacientes tratados con fármacos antieméticos.
En tratamiento combinado: se observó una menor incidencia de nauseas y vómitos graves (2,1 % y 2,8 % de los pacientes respectivamente).
Deshidratación
Se han notificado episodios de deshidratación frecuentemente asociados con diarrea y /o vómitos.
Se han observado casos poco frecuentes de insuficiencia renal, hipotensión o fallo cardiocirculatorio en pacientes que presentaron episodios de deshidratación asociados con diarrea y /o vómitos.
Otras alteraciones gastrointestinales
Se ha observado estreñimiento relacionado con Campto y /o loperamida, distribuído:
- en monoterapia: en menos del 10 % de los pacientes
- en tratamiento combinado: 3,4 % de los pacientes.
Se han notificado casos poco frecuentes de obstrucción intestinal, íleo o hemorragia gastrointestinal y casos raros de colitis, incluyendo tiflitis, colitis isquémica y ulcerativa. Se notificaron casos raros de perforación intestinal. Otros efectos leves incluyeron anorexia, dolor abdominal y mucositis.
Casos raros de pancreatitis, sintomáticos o asintomáticos, se han asociado con el tratamiento con irinotecan.

Trastornos de la piel y del tejido subcutáneo
La alopecia fue muy frecuente y reversible. Se han notificado, aunque con poca frecuencia, reacciones cutáneas leves.
Trastornos musculoesqueléticos y del tejido conjuntivo
Se han notificado efectos tempranos, tales como contracciones o calambres musculares y parestesias.
Trastornos generales y alteraciones en el lugar de administración Síndrome colinérgico agudo:
Se observó síndrome colinérgico agudo grave y transitorio en el 9 % de los pacientes tratados en monoterapia y en el 1,4 % de los pacientes en tratamiento combinado. Los principales síntomas fueron definidos como diarrea temprana y un conjunto de síntomas tales como dolor abdominal, conjuntivitis, rinitis, hipotensión, vasodilatación, sudoración, escalofríos, malestar general, mareo, alteraciones visuales, miosis, lagrimeo y aumento de salivación que ocurrieron durante la perfusión de Campto o dentro de las primeras 24 horas tras la perfusión. Estos síntomas desaparecen tras la administración de atropina (ver sección 4.4).
La astenia fue grave en menos del 10 % de los pacientes tratados en monoterapia y en el 6,2 % de los pacientes en tratamiento combinado. No se ha establecido claramente la relación causal con Campto. Se presentó fiebre, en ausencia de infección y sin neutropenia grave concomitante en el 12 % de los pacientes tratados en monoterapia y en el 6,2 % de los pacientes en tratamiento combinado.
Se han notificado reacciones leves en el lugar de la perfusión, aunque con poca frecuencia.
Exploraciones complementarias
En monoterapia, se observaron aumentos transitorios, leves o moderados, de los niveles séricos de las transaminasas, fosfatasa alcalina o bilirrubina en el 9,2 %, 8,1 % y 1,8 % de los pacientes, respectivamente, en ausencia de metástasis hepáticas progresivas.
Se han observado aumentos transitorios, leves o moderados de los niveles séricos de creatinina en el 7,3 % de los pacientes.
En el tratamiento combinado, se observaron aumentos transitorios de los niveles séricos (grados 1 y 2) de GPT, GOT, fosfatasa alcalina o bilirrubina en el 15 %, 11 %, 11 % y 10 % de los pacientes, respectivamente, en ausencia de metástasis hepáticas progresivas. Se observaron alteraciones transitorias de grado 3 en el 0 %, 0%, 0 % y 1 % de los pacientes, respectivamente. No se observaron alteraciones de grado 4.
Se han notificado muy raramente aumentos de la amilasa y /o de la lipasa.
Se han notificado casos raros de hipopotasema e hiponatremia, la mayoría relacionados con la diarrea y los vómitos.
4.9. Sobredosis
Se han notificado casos de sobredosis a dosis de hasta aproximadamente dos veces la dosis terapéutica recomendada, que pueden ser mortales. Las reacciones adversas más significativas fueron la neutropenia y la diarrea graves. No existe ningún antídoto conocido para la sobredosis de Campto. Deberán proporcionarse los máximos cuidados de soporte para prevenir la deshidratación debida a la diarrea y para tratar cualquier complicación infecciosa.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas

Grupo farmacoterapéutico: Citostático inhibidor de la topoisomerasa I. Código ATC: L01XX19 Datos experimentales
El irinotecán es un derivado semisintético de la camptotecina. Es un agente antineoplásico que actúa como inhibidor específico de la ADN topoisomerasa I. El irinotecán es metabolizado en la mayoría de los tejidos por la carboxilesterasa a SN-38, que se ha revelado más activo que el irinotecán sobre la topoisomerasa I purificada y más citotóxico sobre varias líneas de células tumorales murinas y humanas. La inhibición de la ADN topoisomerasa I por el irinotecán o el SN-38 induce lesiones en las cadenas simples del ADN que bloquean la replicación del ADN y son responsables de la citotoxicidad. Esta actividad citotóxica está en función del tiempo y es específica de la fase S.
In vitro, el irinotecán y el SN-38 no son significativamente reconocidos por la glicoproteína-P MDR (multidrug resistance) y ejercen efectos citotóxicos sobre líneas celulares resistentes a la doxorubicina y a la vinblastina.
Por otra parte, el irinotecán posee un amplio espectro de actividad antitumoral experimental in vivo sobre modelos de tumores murinos (adenocarcinoma ductal pancreático PO3, adenocarcinoma mamario MA 16/C, adenocarcinomas de colon C38 y C51) y sobre xenoinjertos humanos (adenocarcinoma de colon Co-4, adenocarcinoma mamario Mx-1, adenocarcinomas gástricos ST-15 y SC-16). El irinotecán también es activo sobre tumores que expresan la glicoproteína-P MDR (leucemias P388 resistentes a vincristina y a doxorubicina).
El principal efecto farmacológico del irinotecán, además de su actividad antitumoral, es la inhibición de la acetilcolinesterasa.
Datos clínicos
Terapia combinada para el tratamiento en primera línea de pacientes con cáncer colorrectal metastásico Terapia combinada con ácido folínico y 5-fluoracilo:
Se realizó un estudio en fase III en 385 pacientes con cáncer colorrectal metastásico sin tratamiento previo, bien con el régimen de tratamiento cada 2 semanas (ver sección 4.2. Posología y forma de administración) o el régimen de tratamiento semanal. En el régimen de tratamiento cada 2 semanas, en el día 1, la administración de 180 mg/m2 de Campto cada 2 semanas viene seguida de una perfusión con ácido folínico (200 mg/m2 durante una perfusión intravenosa de 2 horas) y 5-fluorouracilo (400 mg/m2 en bolus intravenoso, seguido de 600 mg/m2 durante una perfusión intravenosa de 22 horas). En el día 2, el ácido folínico y el 5-fluorouracilo son administrados a las mismas dosis y pautas posológicas. En el régimen de administración semanal, la administración de 80 mg/m2 de Campto viene seguida de perfusión con ácido folínico (500 mg/m2 durante una perfusión intravenosa de 2 horas) y después de 5-fluorouracilo (2300 mg/m2 durante una perfusión intravenosa de 24 horas) durante 6 semanas.
En el ensayo de terapia combinada con las 2 pautas descritas anteriormente, se evaluó la eficacia de Campto en 198 pacientes tratados:
|
Regímenes |
Régimen semanal |
Régimen cada 2 |
|
combinados |
(n=50) |
semanas |
|
(n = 198) |
(n=148) |

|
CAMPTO + 5 FU/ FA |
5FU/FA |
CAMPTO + 5 FU/ FA |
5FU/FA |
CAMPTO + 5 FU/ FA |
5FU/FA | |
|
Tasa de respuesta (%) valores de p |
40,8* |
23,1* |
51,2 * |
28,6* |
37,5* |
21,6* |
|
p < 0,001 |
p = 0,045 |
p = 0,005 | ||||
|
Mediana del tiempo hasta la progresión (meses) valores de p |
6,7 |
4,4 |
7,2 |
6,5 |
6,5 |
3,7 |
|
p < 0,001 |
NS |
p = 0,001 | ||||
|
Mediana de la duración de la respuesta (meses) valores de p |
9,3 |
8,8 |
8,9 |
6,7 |
9,3 |
9,5 |
|
NS |
p = 0,043 |
NS | ||||
|
Mediana de la duración de la respuesta y estabilización (meses)- valores de p |
8,6 |
6 2 |
8,3 |
6,7 |
8,5 |
5,6 |
|
p < 0,001 |
NS |
p =0,003 | ||||
|
Mediana del tiempo hasta el fracaso del tratamiento (meses) Valores de p |
5,3 |
3,8 |
5,4 |
5,0 |
5,1 |
3,0 |
|
p = 0,0014 |
NS |
p < 0,001 | ||||
|
Mediana de la supervivencia Valores de p |
16,8 |
14,0 |
19,2 |
14,1 |
15,6 |
13,0 |
|
p = 0,028 |
NS |
p = 0,041 | ||||
5 FU: 5-fluorouracilo
FA: Ácido folínico
NS: No significativo
*: Análisis de población por protocolo
Con el régimen de administración semanal, la incidencia de diarrea grave, fue del 44,4% en los pacientes tratados con Campto en combinación con 5-fluorouracilo/ácido folínico y del 25,6% en los pacientes tratados con sólo 5-fluorouracilo/ácido folínico. La incidencia de neutropenia grave (recuento de neutrófilos < 500 células/mm3) fue del 5,8% en los pacientes tratados con Campto en combinación con 5-fluorouracilo/ácido folínico y del 2,4% en los pacientes tratados con sólo 5-fluorouracilo/ácido folínico.
Adicionalmente, la mediana del tiempo hasta el estado de deterioro definitivo fue significativamente más larga en el grupo de Campto en combinación que en el grupo con sólo 5-fluorouracilo/ácido folínico (p=0,046).
En este estudio en fase III se evaluó la calidad de vida utilizando el cuestionario EORTC QLQ-C30. En los grupos tratados con Campto el tiempo hasta un deterioro definitivo fue más tardío. La evolución del estado de salud global/calidad de vida fue ligeramente mejor en el grupo de Campto combinado, aunque no significativo, demostrando que la eficacia de Campto en combinación puede alcanzarse sin afectar a la calidad de vida.
Terapia combinada con bevacizumab:
En un ensayo clínico fase III, aleatorizado, doble ciego y con control activo se estudió bevacizumab en combinación con Campto/5-fluorouracilo/ácido folínico como tratamiento de primera línea del carcinoma metastásico de colon o recto. (Estudio AVF2107g). La adición de bevacizumab a la combinación Campto/5-fluorouracilo/ácido folínico dio lugar a un aumento estadísticamente significativo de la supervivencia global. El beneficio clínico, medido como supervivencia global, se observó en todos los

subgrupos preestablecidos de pacientes, incluyendo aquellos definidos según la edad, sexo, estado general, localización del tumor primario, número de órganos afectados y duración de la enfermedad metastásica. Consultar la ficha técnica de bevacizumab. Los resultados de eficacia del estudio AVF2107g se resumen en la siguiente tabla.
|
AVF2107g | ||
|
Brazo 1 Irinotecán/5-FU/Acido folínico + Placebo |
Brazo 2 Irinotecán/5-FU/Acido folínico + Bevacizumab | |
|
Número de Pacientes |
411 |
402 |
|
Supervivencia global | ||
|
Mediana de tiempo (meses) |
15,6 |
20,3 |
|
Intervalo de Confianza del 95% |
14,29 - 16,99 |
18,46 - 24,18 |
|
Razón de riesgob |
0,660 | |
|
Valor de p |
0,00004 | |
|
Supervivencia libre de progresión | ||
|
Mediana de tiempo (meses) |
6,2 |
10,6 |
|
Razón de riesgo |
0,54 | |
|
Valor de p |
< 0,0001 | |
|
Tasa de respuesta global | ||
|
Tasa (%) |
34,8 |
44,8 |
|
Intervalo de confianza del 95% |
30,2-39,6 |
39,9-49,8 |
|
Valor de p |
0,0036 | |
|
Duración de la respuesta | ||
|
Mediana de tiempo (meses) |
7,1 |
10,4 |
|
Percentil 25-75 (meses |
4,7-11,8 |
6,7-15,0 |
a 5 mg/kg cada 2 semanas. b Relativo al brazo control.
Terapia combinada con cetuximab:
EMR 62 202-013: En este ensayo aleatorizado en pacientes con cáncer colorrectal metastásico que no habían recibido tratamiento previo para la enfermedad metastásica, se comparó la combinación de cetuximab e irinotecán más 5-fluorouracilo/ácido folínico (5-FU/AF) en perfusión (599 pacientes) frente

a la misma quimioterapia sola (599 pacientes). La proporción de pacientes con tumores con el gen KRAS no mutado (wild type) de la población de pacientes evaluable en cuanto al estado del gen KRAS fue del 64%.
Los resultados de eficacia de este estudio se resumen en la siguiente tabla:
|
Población general |
Población con gen KRAS nativo o no mutado | |
|
Cetuximab + FOLFIRI |
Cetuximab + FOLFIRI | |
|
FOLFIRI |
FOLFIRI | |
|
(N=599) (N=599) |
(N=172) (N=172) | |
|
ORR | ||
|
(IC 95%) |
46,9 (42,9 , 51,0) 38,7 (34,8 , 42,8) |
59,3 (51,6 , 66,7) 43,2 (35,8 , 50,09) |
|
Valor de p |
0,0038 |
0,0025 |
|
PFS | ||
|
Razón de riesgo |
0,85 (0,726 , 0,998) |
0,68 (0,501 , 0,934) |
|
(IC 95%) | ||
|
Valor de p |
0,0479 |
0,0167 |
IC: intervalo de confianza FOLFIRI: irinotecan mas 5FU/FA
ORR: tasa de respuesta objetiva (pacientes con respuesta completa o parcial)
PFS: tiempo de supervivencia libre de progresión
Terapia combinada con capecitabina:
Los datos de un ensayo fase III (CAIRO) controlado y aleatorizado apoyan el uso de capecitabina a una dosis inicial de 1000 mg/m2 durante 2 semanas en combinación con irinotecan cada 3 semanas para el tratamiento en primera línea de pacientes con cáncer colorrectal metastásico. Se aleatorizaron 820 pacientes para recibir bien tratamiento secuencial (n=410) o bien tratamiento de combinación (n=410).
El tratamiento secuencial consistía en tratamiento en primera línea con capecitabina (1250 mg/m2 dos veces al día durante 14 días), tratamiento en segunda línea con irinotecan (350 mg/m2 en el día 1), y tratamiento combinado en tercera línea de capecitabina (1000 mg/m2 dos veces al día durante 14 días) con oxaliplatino (130 mg/m2 en el día 1). El tratamiento de combinación consistió en tratamiento de primera línea con capecitabina (1000 mg/m2 dos veces al día durante 14 días) combinado con irinotecan (250 mg/m2 en el día 1) (XELIRI) y en segunda línea con capecitabina (1000 mg/m2 dos veces al día durante 14 días) junto con oxaliplatino (130 mg/m2 en el día 1). Todos los ciclos de tratamiento fueron administrados a intervalos de 3 semanas. En el tratamiento en primera línea la mediana de supervivencia libre de progresión en la población por intención de tratar fue de 5,8 meses (IC del 95% 5,1 - 6,2 meses) con capecitabina en monoterapia y de 7,8 meses (IC del 95%, 7,0-8,3 meses; p=0,0002) con XELIRI.
Los datos procedentes de un análisis intermedio en un ensayo fase II (AIO KRK 0604) controlado, multicéntrico y aleatorizado apoyan el uso de capecitabina a la dosis inicial de 800 mg/m2 durante 2 semanas en combinación con irinotecan y bevacizumab cada 3 semanas en el tratamiento en primera línea de pacientes con cáncer colorrectal metastásico. Se aleatorizaron 115 pacientes para recibir tratamiento con capecitabina en combinación con irinotecan (XELIRI) y bevacizumab: capecitabina (800 mg/m2 dos veces al día durante dos semanas seguido de un período de descanso de 7 días), irinotecan (200 mg/m2 en perfusión durante 30 minutos, el día 1 cada 3 semanas), y bevacizumab (7,5 mg/kg en perfusión durante 30 a 90 minutos, el día 1 cada 3 semanas); un total de 118 pacientes fueron aleatorizados para recibir tratamiento con capecitabina en combinación con oxaliplatino más bevacizumab: capecitabina (1000 mg/m2 dos veces al día durante dos semanas seguido de un periodo de descanso de 7 días), oxaliplatino
POLÍTICA SOCIAL
E IGUALDAD
(130 mg/m2 en perfusión durante 2 horas, el día 1 cada 3 semanas), y bevacizumab (7,5 mg/kg en perfusión de 30 a 90 minutos, el día 1 cada 3 semanas). La supervivencia libre de progresión a los 6 meses en la población por intención de tratar fue de un 80% (XELIRI más bevacizumab) frente a un 74% (XELOX más bevacizumab). La tasa de respuesta global (respuesta total más respuesta parcial) fue de un 45% (XELOX más bevacizumab) frente a un 47% (XELIRI más bevacizumab).

Campto en monoterapia para el tratamiento en segunda línea de pacientes con cáncer colorrectal metastásico:
Se han realizado ensayos clínicos en fase II/III con pauta de administración cada 3 semanas en más de 980 pacientes con cáncer colorrectal metastásico en los que había fracasado un régimen previo con 5-fluorouracilo. La eficacia de Campto fue valorada en 765 pacientes con progresión documentada de la enfermedad con 5-fluorouracilo (5-FU) en el momento de entrada en el estudio.
|
Fases III | ||||||
|
Campto frente a cuidados de soporte |
Campto frente a 5-FU | |||||
|
Campto n = 183 |
Cuidados de soporte n = 90 |
Valores de p |
Campto n = 127 |
5-FU n = 129 |
Valores de p | |
|
Supervivencia libre de progresión a los 6 meses (%) |
NA |
NA |
33,5* |
26,7 |
p=0,03 | |
|
Supervivencia a los 12 meses (%) |
36,2* |
13,8 |
p=0,000 1 |
44,8* |
32,4 |
p=0,0351 |
|
Mediana de la supervivencia (meses) |
9,2* |
6,5 |
p=0,000 1 |
10,8* |
8,5 |
p=0,0351 |
NA: No aplicable
* Diferencia estadísticamente significativa
En los estudios en fase II, realizados en 455 pacientes con la pauta de administración cada 3 semanas, la supervivencia libre de progresión a los 6 meses fue del 30% y la mediana de la supervivencia fue de 9 meses. La mediana del tiempo hasta la progresión fue de 18 semanas.
Adicionalmente, se llevaron a cabo estudios no comparativos en fase II en 304 pacientes con pauta de administración semanal, a una dosis de 125 mg/m2 administrado en perfusión intravenosa de 90 minutos durante 4 semanas consecutivas seguidas de 2 semanas de descanso. En estos estudios la mediana del tiempo hasta la progresión fue de 17 semanas y la mediana de la supervivencia fue de 10 meses. Se ha observado un perfil de seguridad similar con el régimen de administración semanal en 193 pacientes con una dosis inicial de 125 mg/m2 comparado con el régimen de administración cada 3 semanas. La mediana del tiempo de aparición de las primeras deposiciones líquidas fue el día 11.
Terapia combinada con cetuximab después del fracaso de un tratamiento que haya incluido irinotecán:
Se investigó la eficacia de la combinación de cetuximab con irinotecán en dos estudios clínicos. Recibieron el tratamiento combinado un total de 356 pacientes con cáncer colorrectal metastásico con expresión del EGFR en los que previamente había fracasado un tratamiento citotóxico que incluía irinotecán. Estos pacientes presentaban un estado funcional de Karnofsky mínimo de 60 pero la mayoría, tenía un estado funcional de Karnofsky > 80.

- EMR 62 202-007: En este estudio aleatorizado se comparó la combinación de cetuximab e irinotecán (218 pacientes) con cetuximab en monoterapia (111 pacientes).
- IMCL CP02-9923: En este estudio abierto de grupo único se analizó el tratamiento combinado en 138 pacientes.
En la tabla siguiente se resumen los datos de eficacia obtenidos en estos estudios:
|
Estudio |
N |
ORR |
DCR |
PFS (meses) |
OS (meses) | ||||
|
n (%) |
IC 95% |
n (%) |
IC 95% |
Mediana |
IC 95% |
Mediana |
IC 95% | ||
|
Cetuximab + irinotecán | |||||||||
|
EMR 62 202-007 |
218 |
50 (22,9) |
17,5; 29,1 |
121 (55,5) |
48,6; 62,2 |
4,1 |
2,8; 4,3 |
8,6 |
7,6; 9,6 |
|
IMCL CP02- 9923 |
138 |
21 (15,2) |
9,7; 22,3 |
84 (60,9) |
52,2; 69,1 |
2,9 |
2,6; 4,1 |
8,4 |
7,2; 10,3 |
|
Cetuximab | |||||||||
|
EMR 62 202-007 |
111 |
12 (10,8) |
5,7; 18,1 |
36 (32,4) |
23,9; 42,0 |
1,5 |
1,4; 2,0 |
6,9 |
5,6; 9,1 |
DCR = disease control rate, tasa de control de la enfermedad (pacientes con respuesta completa, respuesta parcial, o enfermedad estable durante al menos 6 semanas); IC = intervalo de confianza; ORR = objective response rate, tasa de respuesta objetiva (pacientes con respuesta completa o respuesta parcial); OS = overall survival time, tiempo de supervivencia global, PFS = progression-free survival, supervivencia libre de progresión
La eficacia de la combinación de cetuximab con irinotecán fue superior a la de cetuximab en monoterapia, en cuanto a la tasa de respuesta objetiva (ORR), la tasa de control de la enfermedad (DCR) y la supervivencia libre de progresión (PFS). En el ensayo randomizado, no se demostraron efectos en el tiempo de supervivencia global (razón de riesgo 0,91; p = 0,48).
Datos farmacocinéticos/farmacodinámicos
La intensidad de las principales toxicidades obtenidas con Campto (p.ej, leuconeutropenia y diarrea), está relacionada con la exposición (AUC) al fármaco y al metabolito SN-38. En monoterapia, se observaron correlaciones significativas entre la toxicidad hematológica (disminución de glóbulos blancos y neutrófilos en el nadir) o la intensidad de la diarrea y los valores de AUC del irinotecán y del metabolito SN-38.
5.2. Propiedades farmacocinéticas
En un ensayo en fase I, irinotecán mostró un perfil de eliminación bifásico o trifásico en 60 pacientes tratados con la pauta de administración de perfusión intravenosa durante 30 minutos a razón de 100 a 750 mg/m2 cada 3 semanas. El aclaramiento plasmático medio fue de 15 L/h/m2 y el volumen de distribución en el estado estacionario (Vss) fue de 157 L/m2. La semivida plasmática media de la primera fase del modelo trifásico fue de 12 minutos, la de la segunda fase de 2,5 horas y la semivida de la fase terminal de 14,2 horas. SN-38 mostró un perfil de eliminación bifásico, con una semivida media de eliminación terminal de 13,8 horas. Al final de la perfusión, las concentraciones plasmáticas medias del irinotecán y del SN-38, con la dosis recomendada de 350 mg/m2, fueron respectivamente de 7,7 pg/ml y de 56ng/ml, con sus correspondientes áreas bajo la curva (AUC) de 34 pg.h/ml y 451ng.h/ml. En general, se observó una gran variabilidad interindividual, en los parámetros farmacocinéticos del SN-38.
Se ha realizado un análisis farmacocinético de irinotecán sobre 148 pacientes con cáncer colorrectal metastásico, tratados con diversas pautas y distintas dosis en ensayos en fase II. Los parámetros

farmacocinéticos estimados con un modelo tricompartimental fueron similares a los observados en estudios en fase I. Todos los estudios han demostrado que la exposición frente a irinotecán (CPT-11) y SN-38 aumenta de forma proporcional a la dosis administrada de CPT-11; la farmacocinética de ambos es independiente del número de ciclos previos y la pauta de administración.
La unión in vitro a proteínas plasmáticas para el irinotecán y el SN-38 se encontraba en torno al 65% y al 95%, respectivamente.
Estudios sobre el metabolismo y el equilibrio de la masa con el fármaco marcado con 14C, han mostrado que más del 50% de una dosis de irinotecán administrada por vía intravenosa se elimina inalterada, con un 33% en las heces, principalmente a través de la bilis y un 22% en orina.
Se han identificado dos vías metabólicas, cada una representando al menos el 12% de la dosis:
- Hidrólisis por carboxilesterasas para dar el metabolito activo SN-38:
SN-38 se elimina principalmente mediante glucuronidación y posteriormente por excreción biliar y renal (menos del 0,5% de la dosis de irinotecán).
Posteriormente el glucurónido de SN-38 se hidroliza probablemente en el intestino.
- Metabolismo oxidativo por las enzimas del citocromo P450 3A, con apertura del anillo piperidínico terminal y formación de un derivado de ácido aminopentanoico (APC) y un derivado de amina primaria (NPC).
El irinotecán inalterado es la entidad mayoritaria en el plasma, seguido de APC, el glucurónido de SN-38 y el SN-38. Únicamente SN-38 posee actividad citotóxica significativa.
El aclaramiento de irinotecán disminuye aproximadamente el 40% en los pacientes con niveles de bilirrubinemia entre 1,5 y 3 veces el límite superior del rango normal. En estos pacientes, una dosis de 200 mg/m2de irinotecán, da como resultado una exposición plasmática del fármaco comparable a la observada con 350 mg/m2 en pacientes con cáncer con los parámetros hepáticos normales.
5.3. Datos preclínicos sobre seguridad
El irinotecán y el SN-38 se han revelado mutágenos in vitro en el test de aberración cromosómica en las células de ovario de hámster chino, así como en el test in vivo del micronúcleo en ratón.
Sin embargo, en el test de Ames no se ha evidenciado ningún efecto mutágeno.
No se comunicaron tumores relacionados con el tratamiento 91 semanas después del final del tratamiento, en ratas tratadas una vez a la semana durante 13 semanas con una dosis máxima de 150 mg/m2 (que es menos de la mitad de la dosis recomendada en el hombre).
Se han realizado estudios de toxicidad a dosis única y dosis repetida con Campto en ratón, rata y perro. Los principales efectos tóxicos fueron observados en el sistema hematopoyético y linfático. En perros, se informó de diarrea tardía asociada con atrofia y necrosis focal de la mucosa intestinal. También se detectó alopecia en perros.
La gravedad de estos efectos es dependiente de la dosis y reversible.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Sorbitol (E420), ácido láctico (E270) y agua para preparaciones inyectables. Hidróxido de sodio (E524) y ácido clorhídrico (para ajuste del pH).
6.2. Incompatibilidades

Se desconocen.
La solución de Campto no se debe mezclar con otros medicamentos excepto aquellos mencionados en la sección 6.6.
6.3. Periodo de validez
El periodo de validez de los viales sin abrir es de 36 meses.
La solución de Campto es compatible con soluciones para perfusión (solución de cloruro sódico al 0,9% o de glucosa al 5%) durante 28 días cuando se almacena en envases de LDPE o PVC a 5°C o a 30°C y protegido de la luz. Cuando no está protegido de la luz la compatibilidad es de hasta 3 días.
No obstante, ya que no contiene agentes conservantes, para reducir el riesgo de contaminación microbiológica, se recomienda preparar la solución para perfusión inmediatamente antes de su uso y comenzar la perfusión lo antes posible tras su preparación. Si no se usa inmediatamente, los tiempos y condiciones de almacenamiento antes de su uso son responsabilidad del personal sanitario que lo maneje.
Si la dilución se realiza en condiciones asépticas estrictas (p.ej, en una campana de flujo laminar), la solución debe utilizarse (perfusión finalizada) en 12 horas si se almacena hasta 25°C, o en 24 horas conservado en nevera (entre 2°C y 8 °C) tras la apertura del vial.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 25°C. Conservar el vial en el embalaje exterior para protegerlo de la luz.
Para las condiciones de conservación del medicamento reconstituido/diluido, ver sección 6.3.
6.5. Naturaleza y contenido del envase
Campto 40 mg/2 ml, concentrado para solución para perfusión:
Se presenta en un vial de 2 ml de polipropileno ámbar de grado médico (Cytosafe®) con cierre de goma (halobutilo).
Campto 100 mg/5 ml, concentrado para solución para perfusión:
Se presenta en un vial de 5 ml de polipropileno ámbar de grado médico (Cytosafe®) con cierre de goma (halobutilo).
6.6. Precauciones especiales de eliminación y otras manipulaciones
Como otros agentes antineoplásicos, Campto debe ser preparado y manipulado con precaución. Es indispensable utilizar gafas de protección, mascarilla, guantes y bata.
En caso de contacto cutáneo con la solución de Campto a diluir o con la solución a perfundir, lavar inmediatamente y de forma intensiva con agua y jabón.
Si la solución de Campto a diluir, o la solución a perfundir, entraran en contacto con membranas mucosas, se debe lavar inmediatamente con agua.
Preparación de la solución intravenosa a perfundir:
Al igual que cualquier otro medicamento inyectable, la solución de Campto debe ser preparada asépticamente (ver sección 6.3).
Si se observa cualquier precipitado en los viales o después de la reconstitución, debe desecharse el producto de acuerdo con los procedimientos habituales para agentes citotóxicos.
Con ayuda de una jeringa graduada, extraer del vial la cantidad necesaria de solución de Campto, en condiciones de asepsia, e inyectarla en una bolsa o frasco de perfusión de 250 ml conteniendo una

solución de cloruro sódico al 0,9% o de glucosa al 5%. Mezclar cuidadosamente la solución a perfundir mediante rotación manual.
Eliminación:
Todo el material utilizado para la dilución y la administración, así como el medicamento no utilizado debe ser destruido de acuerdo con los procedimientos hospitalarios normalizados aplicables a agentes citotóxicos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
PFIZER S.L.
Avda. de Europa 20-B,
Parque Empresarial La Moraleja.
28108 Alcobendas (Madrid)
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Campto 40 mg/2 ml concentrado para solución para perfusión: 61.329
Campto 100 mg/5 ml concentrado para solución para perfusión: 61.330
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
20-Marzo-1997 / 30-Junio-2007
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2009
Agencia española de
medicamentos y
productos sanitarios