Calsynar 200 U.i. Solucion Para Pulverizacion Nasal En Envase Unidosis

agencia española de medicamentos y productos sanitarios
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Calsynar 200 UI solución para pulverización nasal en envase unidosis
Calcitonina sintética de salmón
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tenga los mismos síntomas, ya que puede peijudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Calsynar 200 UI solución para pulverización nasal en envase unidosis y para qué se utiliza
2. Antes de usar Calsynar 200 UI solución para pulverización nasal en envase unidosis
3. Cómo usar Calsynar 200 UI solución para pulverización nasal en envase unidosis
4. Posibles efectos adversos
5. Conservación de Calsynar 200 UI solución para pulverización nasal en envase unidosis
6. Información adicional
1. QUÉ ES Calsynar 200 UI solución para pulverización nasal en envase unidosis Y PARA QUÉ SE UTILIZA
Calsynar 200 UI se presenta en forma de solución para pulverización nasal.
Cada envase contiene 28 viales pulverizadores unidosis de 200 UI cada uno.
Calsynar 200 UI solución para pulverización nasal en envase unidosis pertenece al grupo de medicamentos denominado hormona antiparatiroidea.
Calsynar se utiliza para:
- El tratamiento de la osteoporosis (desmineralización de los huesos) que aparece en la menopausia, para reducir el riesgo de fracturas de las vértebras.
2. ANTES DE USAR Calsynar 200 UI solución para pulverización nasal en envase unidosis
No utilice Calsynar 200 UI solución para pulverización nasal en envase unidosis
- si es alérgico a la calcitonina o a cualquiera de los excipientes de este medicamento,
- si tiene hipocalcemia (bajo nivel de calcio en la sangre).
Tenga especial cuidado con Calsynar 200 UI solución para pulverización nasal en envase unidosis
Antes de empezar el tratamiento, su médico realizará una exploración nasal, para comprobar que no existe una afectación de la mucosa nasal.
Se interrumpirá el tratamiento si aparecen úlceras graves en la mucosa nasal; si son úlceras no muy importantes, se interrumpirá el tratamiento hasta que se curen.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)

Pueden aparecer reacciones de tipo alérgico al medicamento, incluyendo casos de reacciones graves. En caso de sospecha de alergia a la calcitonina, su médico puede decidir realizar una prueba de sensibilidad antes de iniciar el tratamiento.
Calsynar Solución para pulverización nasal en envase unidosis contiene cloruro de benzalconio como excipiente. Este excipiente puede ser irritante para la mucosa nasal.
Uso de otros medicamentos
No se han descrito interacciones de Calsynar 200 UI solución para pulverización nasal en envase unidosis con otros medicamentos.
Uso en niños
No existe evidencia suficiente que avale el uso de calcitonina de salmón en afecciones asociadas a osteoporosis pediátrica. Por consiguiente, no se recomienda el uso de calcitonina de salmón en niños y adolescentes (menores de 18 años).
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de tomar cualquier medicamento.
No utilice Calsynar 200 UI solución para pulverización nasal en envase unidosis si está embarazada o en periodo de lactancia.
Efectos sobre la capacidad de conducir y utilizar máquinas
Calsynar 200 UI solución para pulverización nasal puede provocar vértigo de forma transitoria. En caso de sufrir esta reacción adversa no deberá conducir ni utilizar máquinas.
Información importante sobre algunos de los componentes de Calsynar 200 UI Solución para pulverización nasal en envase unidosis
Este medicamento puede producir inflamación de la mucosa nasal, especialmente con tratamientos de larga duración, porque contiene cloruro de benzalconio. Si se sospecha tal reacción (congestión nasal persistente), siempre que sea posible, se debería utilizar un medicamento de uso nasal que no contenga este excipiente.
Los pacientes con dietas pobres en sodio deben tener en cuanta que este medicamento contiene sodio.
3. CÓMO USAR Calsynar 200 UI Solución para pulverización nasal en envase unidosis
Siga exactamente las instrucciones de administración de Calsynar indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas. Recuerde utilizar su medicamento.
Su médico le indicará la dosis y la duración del tratamiento con Calsynar 200 UI solución para pulverización nasal en envase unidosis.
La dosis recomendada es de 1 pulverización al día (200 UI/día).
Se recomienda ir alternando las aplicaciones en las dos fosas nasales.

Instrucciones para la correcta administración
Siga estas instrucciones a menos que su médico le haya dado otras indicaciones distintas:
1. Extraer el vial del envase (blister)
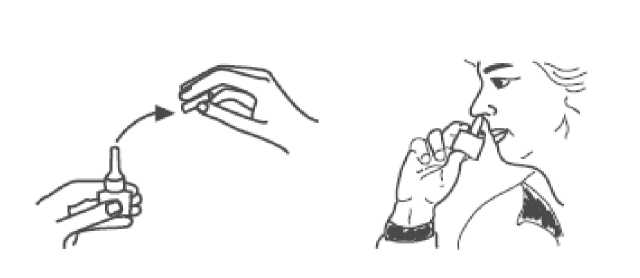
2. Quitar la cubierta de protección del pulverizador
3. Introducir el pulverizador en la nariz apoyando los dedos índice y medio sobre los dos lados de la base del pulverizador y colocando el pulgar debajo del cilindro pequeño de vidrio.
Apretar con fuerza efectuando un movimiento rápido.
El vial unidosis sólo puede ser utilizado una vez.
Una vez abierto, el envase debe conservarse a temperatura ambiente y utilizarse en un máximo de 4 semanas.
Si usa más Calsynar 200 UI solución para pulverización nasal en envase unidosis del que debiera
Contacte inmediatamente con su médico o farmacéutico. Las reacciones que cabe esperar en caso de sobredosis son náuseas, vómitos, enrojecimiento y vértigo.
En caso de sobredosis o ingestión accidental, consulte al Servicio de Información toxicológica. Teléfono 91.562.04.20.
Si olvidó administrarse Calsynar 200 UI solución para pulverización nasal en envase unidosis
Si olvida administrarse una dosis, hágalo cuando se acuerde. Si faltan pocas horas para la siguiente administración, espere y administre la dosis cuando tocaba.
No tome una dosis doble para compensar las dosis olvidadas.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Calsynar 200 UI solución para pulverización nasal en envase unidosis, puede producir efectos adversos, aunque no todas las personas lo sufran.
Informe a su médico si sufre alguno de los siguientes efectos adversos.
Se han comunicado los siguientes efectos adversos según las frecuencias detalladas a continuación:
Muy frecuentes: en más de 1 de cada 10 pacientes
Frecuentes: entre 1 y 10 de cada 100 pacientes

Poco frecuentes: entre 1 y 10 de cada 1.000 pacientes
Raras: entre 1 y 10 de cada 10.000 pacientes
Muy raras: en menos de 1 de cada 10.000 pacientes
Las reacciones adversas observadas muy frecuentemente (en más de uno de cada 10 pacientes) incluyen reacciones locales como rinitis (inflamación de la membrana mucosa del interior de la nariz), incluyendo sequedad nasal, edema nasal, congestión nasal, estornudos, rinitis alérgica, síntomas nasales como irritación del conducto nasal, enrojecimiento, abrasión, alteración del olfato y rash papular (sarpullido).
Reacciones frecuentes (aparecen en 1 a 10 de cada 100 pacientes): náuseas, diarrea, dolor abdominal, rubor, rinitis ulcerativa, sinusitis, epistaxis (sangrado nasal), faringitis, vértigos, dolor de cabeza, dificultad para tragar (disgeusia), dolor musculoesquelético y fatiga.
Reacciones adversas poco frecuentes (aparecen en 1 a 10 de cada 1000 pacientes): vómitos, tensión arterial alta, tos, alteración de la visión, edema (acumulación de líquido debajo la piel) en la cara y extremidades o en todo el cuerpo, dolor en las articulaciones, reacciones alérgicas de la piel, rubor, picor y enfermedad parecida a la gripe.
Reacciones adversas raras o muy raras: desarrollo de anticuerpos contra calcitonina, reacciones alérgicas y de tipo anafilactoide tales como taquicardia (pulso acelerado), hipotensión, colapso circulatorio y shock anafiláctico.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. CONSERVACIÓN DE Calsynar 200 UI solución para pulverización nasal en envase unidosis
Mantener fuera del alcance y de la vista de los niños.
Antes de su uso, Calsynar 200 UI solución para pulverización nasal en envase unidosis puede mantenerse en nevera (2-8°C). No congelar.
Cuando se esté utilizando Calsynar 200 UI solución para pulverización nasal en envase unidosis, puede conservarse a una temperatura no superior a 22°C hasta un máximo de 4 semanas.
Caducidad
No utilizar Calsynar 200 UI solución para pulverización nasal en envase unidosis después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. INFORMACIÓN ADICIONAL
Composición de Calsynar 200 UI solución para pulverización nasal en envase unidosis
- El principio activo es calcitonina sintética de salmón.

Una pulverización equivale a 200 UI de calcitonina sintética de salmón.
- Los excipientes son: citrato de sodio dihidrato, ácido cítrico monohidrato, edetato de disodio, cloruro de benzalconio al 50%, hidróxido de sodio, ácido clorhídrico y agua para inyección.
Titular de la autorización de comercialización y responsable de la fabricación Titular de la autorización de comercialización
sanofi-aventis, S.A.
Josep Pla 2 08019 Barcelona
Responsable de la fabricación
sanofi-aventis S.P.A Viale Europa, 11 21040 Origgio (Italia)
Este prospecto ha sido aprobado en Enero 2011
Agencia española de
medicamentos y
productos sanitarios