Briviact 10Mg/Ml Solucion Oral
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Briviact 10 mg comprimidos recubiertos con película Briviact 25 mg comprimidos recubiertos con película Briviact 50 mg comprimidos recubiertos con película Briviact 75 mg comprimidos recubiertos con película Briviact 100 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Briviact 10 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 10 mg de brivaracetam.
Briviact 25 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 25 mg de brivaracetam.
Briviact 50 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 50 mg de brivaracetam.
Briviact 75 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 75 mg de brivaracetam.
Briviact 100 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 100 mg de brivaracetam.
Excipiente(s) con efecto conocido:
Briviact 10 mg comprimidos recubiertos con película
Cada comprimido recubierto con película de 10 mg contiene 88 mg de lactosa. Briviact 25 mg comprimidos recubiertos con película
Cada comprimido recubierto con película de 25 mg contiene 94 mg de lactosa. Briviact 50 mg comprimidos recubiertos con película
Cada comprimido recubierto con película de 50 mg contiene 189 mg de lactosa. Briviact 75 mg comprimidos recubiertos con película
Cada comprimido recubierto con película de 75 mg contiene 283 mg de lactosa. Briviact 100 mg comprimidos recubiertos con película
Cada comprimido recubierto con película de 100 mg contiene 377 mg de lactosa. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimidos)
Briviact 10 mg comprimidos recubiertos con película
Comprimidos recubiertos con película redondos, blancos o blanquecinos, de 6,5 mm de diámetro y con “u10” grabado en una cara.
Briviact 25 mg comprimidos recubiertos con película
Comprimidos recubiertos con película ovalados, grises, de 8,9 mm x 5,0 mm de dimensiones y con “u25” grabado en una cara.
Briviact 50 mg comprimidos recubiertos con película
Comprimidos recubiertos con película ovalados, amarillos, de 11,7 mm x 6,6 mm de dimensiones y con “u50” grabado en una cara.
Briviact 75 mg comprimidos recubiertos con película
Comprimidos recubiertos con película ovalados, morados, de 13,0 mm x 7,3 mm de dimensiones y con “u75” grabado en una cara.
Briviact 100 mg comprimidos recubiertos con película
Comprimidos recubiertos con película ovalados, de color gris verdoso, de 14,5 mm x 8,1 mm de dimensiones y con “u100” grabado en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Briviact está indicado como terapia concomitante en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en adultos y adolescentes a partir de 16 años de edad con epilepsia.
4.2 Posología y forma de administración
Posología
La dosis de inicio recomendada es 50 mg/día ó 100 mg/día, según la evaluación del médico sobre la reducción de las crisis requerida frente a los posibles efectos secundarios. La dosis se debe administrar en dos dosis iguales, una por la mañana y otra por la noche. La dosis se puede ajustar en función de la respuesta individual y de la tolerabilidad del paciente en un rango de dosis de 50 mg/día a 200 mg/día.
Dosis olvidadas
Si el paciente se olvida de tomar una o más dosis, se recomienda que tome una única dosis tan pronto como se acuerde y que tome la siguiente dosis a su hora normal por la mañana o por la noche. Esto puede evitar que la concentración plasmática de brivaracetam caiga por debajo del nivel de eficacia y que ocurran crisis repentinas.
Suspensión del tratamiento
Si se tiene que suspender el tratamiento con brivaracetam se recomienda hacerlo de forma gradual con reducciones de 50 mg/día semanalmente.Después de 1 semana de tratamiento con 50 mg/día, se recomienda una última semana de tratamiento con una dosis de 20 mg/día.
Poblaciones especiales
Pacientes de edad avanzada (a partir de 65 años)
No se requiere ajuste de dosis en pacientes de edad avanzada (ver sección 5.2).
La experiencia clínica en pacientes > 65 años es escasa.
Insuficiencia renal
No se require ajuste de dosis en pacientes con insuficiencia renal (ver sección 5.2). Brivaracetam no está recomendado en pacientes con enfermedad renal en fase final sometidos a diálisis debido a la falta de datos.
Insuficiencia hepática
En pacientes con enfermedad hepática crónica la exposición a brivaracetam estuvo aumentada. Se debe considerar una dosis de inicio de 50 mg/día. Para todas las fases de insuficiencia hepática se recomienda una dosis máxima diaria de 150 mg dividida en 2 dosis (ver las secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de brivaracetam en niños menores de 16 años de edad.
Los datos actualmente disponibles se describen en las secciones 4.8, 5.1 y 5.2, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
Los comprimidos recubiertos con película de brivaracetam deben administrarse por vía oral, enteros, con algo de líquido y pueden tomarse con o sin alimentos (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a otros derivados de la pirrolidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Pensamientos y comportamientos suicidas
Se han notificado casos de pensamientos y comportamientos suicidas en pacientes tratados con fármacos antiepilépticos, incluyendo brivaracetam, en distintas indicaciones. Un metanálisis de ensayos controlados con placebo, aleatorizados, con fármacos antiepilépticos también ha mostrado un pequeño aumento del riesgo de pensamientos y comportamientos suicidas. Se desconoce el mecanismo de este riesgo y los datos disponibles no excluyen la posibilidad de un aumento del riesgo para brivaracetam.
Por tanto, los pacientes deben ser monitorizados para detectar signos de pensamientos y comportamientos suicidas y se debe considerar el tratamiento adecuado. Se debe aconsejar a los pacientes (y a sus cuidadores) que consulten con su médico si aparecen signos de pensamientos o comportamientos suicidas.
Insuficiencia hepática
Los datos clínicos sobre el uso de brivaracetam en pacientes con insuficiencia hepática preexistente son escasos. Se recomienda el ajuste de dosis en pacientes con insuficiencia hepática (ver sección 4.2).
Intolerancia a la lactosa
Los comprimidos recubiertos con película de brivaracetam contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios formales de interacción se han realizado solo en adultos.
Interacciones farmacodinámicas
Tratamiento concomitante con levetiracetam
En los ensayos clínicos, aunque los datos fueron escasos, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma concomitante. No se observaron problemas de seguridad o tolerabilidad adicionales (ver sección 5.1).
Interacción con alcohol
En un estudio de interacción farmacocinético y farmacodinámico entre una dosis única de brivaracetam de 200 mg y una perfusión continua de etanol de 0,6 g/l en sujetos sanos, no hubo interacción farmacocinética pero brivaracetam aproximadamente dobló el efecto del alcohol sobre la función psicomotora, la atención y la memoria. No se recomienda tomar brivaracetam con alcohol.
Interacciones farmacocinéticas
Efectos de otros agentes sobre la farmacocinética de brivaracetam
Datos in vitro sugieren que brivaracetam tiene un potencial de interacción bajo. La principal ruta de eliminación de brivaracetam es por hidrólisis independiente de CYP.
Una segunda ruta de eliminación incluye hidroxilación mediada por CYP2C19 (ver sección 5.2).
Las concentraciones plasmáticas de brivaracetam pueden aumentar cuando se administra conjuntamente con inhibidores potentes del CYP2C19 (ej. fluconazol, fluvoxamina), pero el riesgo de una interacción mediada por el CYP2C19 clínicamente relevante se considera bajo.
Rifampicina
La administración concomitante con el inductor enzimático potente rifampicina (600 mg/día durante 5 días) en sujetos sanos, disminuye el área bajo la curva de concentraciones plasmáticas (AUC) de brivaracetam en un 45%. Los médicos prescriptores deben considerar un ajuste de la dosis de brivaracetam en pacientes que estén empezando o terminando un tratamiento con rifampicina.
Medicamentos antiepilépticos inductores enzimáticos potentes
Las concentraciones plasmáticas de brivaracetam disminuyen cuando se administra conjuntamente con medicamentos antiepilépticos inductores enzimáticos potentes (carbamazepina, fenobarbital, fenitoína) pero no se requiere ajuste de dosis (ver tabla 1).
Otros inductores enzimáticos
Otros inductores enzimáticos potentes (como la Hierba de San Juan (Hypericum perforatum)) también pueden disminuir la exposición sistémica de brivaracetam. Por tanto, se debe iniciar o finalizar el tratamiento con la hierba de San Juan con precaución.
Efectos de brivaracetam sobre otros medicamentos
Brivaracetam a dosis de 50 o 150 mg/día no afectó el área bajo la curva (AUC) de midazolam (metabolizado por CYP3A4). El riesgo de interacciones CYP3A4 clínicamente relevantes se considera bajo.
Estudios in vitro han mostrado que brivaracetam no inhibe o inhibe muy poco las isoformas de CYP450 excepto la CYP2C19. Brivaracetam puede aumentar las concentraciones plasmáticas de los medicamentos metabolizados por CYP2C19 (ej. lansoprazol, omeprazol, diazepam). Cuando se ensayó in vitro brivaracetam no indujo el CYP1A1/2 pero indujo moderadamente el CYP3A4 y CYP2B6. No se encontró inducción del CYP3A4 in vivo (ver midazolam más arriba). La inducción del CYP2B6 no se ha investigado in vivo y brivaracetam puede reducir las concentraciones plasmáticas de medicamentos metabolizados por CYP2B6 (ej. efavirenz). In vitro, estudios de interacción para determinar los posibles efectos inhibitorios sobre los transportadores concluyeron que no hubo efectos clínicamente relevantes, excepto por OAT3. In vitro, Brivaracetam inhibe OAT3 con la mitad de la concentración máxima inhibitoria 42 veces superior que la Cmax a la dosis clínica más alta. Brivaracetam 200 mg/día puede aumentar las concentraciones plasmáticas de los medicamentos transportados por OAT3.
Medicamentos antiepilépticos
Las posibles interacciones entre brivaracetam (50 mg/día a 200 mg/día) y otros medicamentos antiepilépticos se investigaron en un análisis conjunto de las concentraciones plasmáticas del medicamento de todos los ensayos fase 2-3, en un análisis farmacocinético de la población de los ensayos fase 2-3 controlados con placebo, y en ensayos de interacción farmacológica (para los siguientes medicamentos antiepilépticos: carbamazepina, lamotrigina, fenitoína y topiramato). El efecto de las interacciones sobre las concentraciones plasmáticas se resume en la tabla 1 (aumento se indica como “t” y disminución como “j”, área bajo la curva de concentración plasmática frente al tiempo como “AUC” y concentración máxima observada como Cmax).
Tabla 1: Interacciones ^ farmacocinéticas entre brivaracetam y otros medicamentos antiepilépticos
|
Medicamentos antiepilépticos administrados de forma conjunta |
Influencia de los medicamentos antiepilépticos sobre la concentración plasmática de brivaracetam |
Influencia de brivaracetam sobre la concentración plasmática de los medicamentos antiepilépticos |
|
Carbamazepina |
AUC 29% j Cmax 13%j No se requiere ajuste de dosis |
Carbamazepina - Ninguna Carbamazepina-epóxido t (Ver más abajo) No se requiere ajuste de dosis. |
|
Clobazam |
No hay datos disponibles |
Ninguna |
|
Clonazepam |
No hay datos disponibles |
Ninguna |
|
Lacosamida |
No hay datos disponibles |
Ninguna |
|
Lamotrigina |
Ninguna |
Ninguna |
|
Levetiracetam |
Ninguna |
Ninguna |
|
Oxcarbazepina |
Ninguna |
Ninguna (derivado monohidroxi, MHD) |
|
Fenobarbital |
AUC 19% j No se requiere ajuste de dosis |
Ninguna |
|
Fenitoína |
AUC 21% j No se requiere ajuste de dosis |
Ninguna a AUC 20% t 3 Cmax 20% t |
|
Pregabalina |
No hay datos disponibles |
Ninguna |
|
Topiramato |
Ninguna |
Ninguna |
|
Ácido valproico |
Ninguna |
Ninguna |
|
Zonisamida |
No hay datos disponibles |
Ninguna |
a de acuerdo a un estudio que implica la administración de una dosis supraterapéutica de brivaracetam de 400 mg/día
Carbamazepina
Brivaracetam es un inhibidor moderado reversible de la epóxido hidrolasa lo que conlleva a un aumento de la concentración de carbamazepina epóxido, un metabolito activo de carbamazepina. En ensayos controlados, las concentraciones plasmáticas de carbamazepina epóxido aumentaron una media del 37%, 62% y 98% con una pequeña variabilidad a dosis de brivaracetam de 50 mg/día, 100 mg/día y 200 mg/día respectivamente. No se observaron riesgos de seguridad. No hubo efecto aditivo de brivaracetam y valproato sobre el AUC de carbamazepina epóxido.
Anticonceptivos orales
La administración concomitante de brivaracetam (100 mg/día) con anticonceptivos orales que contienen etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg) no influyó en la farmacocinética de ninguna de las sustancias. Cuando brivaracetam se administró a una dosis de 400 mg/día (dos veces la dosis diaria máxima recomendada) conjuntamente con un anticonceptivo oral conteniendo etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg), se observó una disminución en las áreas bajo la curva (AUCs) de los estrógenos y la progestina del 27% y 23% respectivamente, sin impacto sobre la supresión de la ovulación. No hubo cambio, en general, en los perfiles de concentración-tiempo de los marcadores endógenos estradiol, progesterona, hormona luteinizante (LH), hormona estimulante del folículo (FSH) y globulina transportadora de hormonas sexuales (SHBG).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil en tratamiento con brivaracetam deben discutir con su médico la planificación familiar y las medidas anticonceptivas (ver Embarazo).
Si una mujer decide quedarse embarazada, el uso de brivaracetam debe ser cuidadosamente reevaluado.
Embarazo
Riesgo relacionado con la epilepsia y los medicamentos antiepilépticos en general Para todos los medicamentos antiepilépticos, se ha visto que en la descendencia de las mujeres con epilepsia tratadas, la prevalencia de malformaciones es dos o tres veces mayor que la tasa de, aproximadamente, el 3% en la población general. En la población tratada con politerapia se ha notificado un aumento de malformaciones; sin embargo, no se ha esclarecido el alcance para el cual el tratamiento y/o la enfermedad subyacente es responsable. La suspensión del tratamiento antiepiléptico puede conducir a una exacerbación de la enfermedad que puede ser perjudicial para la madre y el feto.
Riesgo relacionado con brivaracetam
Hay escasos datos sobre el uso de brivaracetam en mujeres embarazadas. No hay datos de la tranferencia placentaria en humanos, pero en ratas, brivaracetam mostró que atraviesa la placenta fácilmente (ver sección 5.3). Se desconoce el posible riesgo en humanos. Los estudios en animales no detectaron ningún potencial efecto teratogénico de brivaracetam (ver sección 5.3).
En ensayos clínicos se utilizó brivaracetam como tratamiento concomitante, y cuando se utilizó con carbamazepina, indujo un aumento relacionado con la dosis en la concentración del metabolito activo carbamazepina-epóxido (ver sección 4.5). No hay datos suficientes para determinar la importancia clínica de este efecto en el embarazo.
Como medida de precaución, no se debe utilizar brivaracetam durante el embarazo a no ser que sea clínicamente necesario (ej. si el beneficio para la madre supera el posible riesgo para el feto).
Lactancia
Se desconoce si brivaracetam se excreta en la leche materna. Estudios en ratas mostraron excreción de brivaracetam en la leche (ver sección 5.3). Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con brivaracetam tras considerar el beneficio del medicamento para la madre. En caso de administración conjunta de brivaracetam y carbamazepina, la cantidad de carbamazepina-epóxido excretada en la leche materna puede aumentar. No hay datos suficientes para determinar la importancia clínica.
Fertilidad
No hay datos disponibles en humanos sobre el efecto de brivaracetam en la fertilidad. En ratas no hubo efecto sobre la fertilidad con brivaracetam (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utlizar máquinas
La influencia de brivaracetam sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada.
Debido a las posibles diferencias de sensibilidad individual, algunos pacientes pueden experimentar somnolencia, mareo y otros síntomas relacionados con el sistema nervioso central (SNC). Se debe advertir a los pacientes que no conduzcan ni manejen máquinas potencialmente peligrosas hasta que se hayan familiarizado con los efectos de brivaracetam sobre su capacidad para realizar dichas actividades.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En todos los ensayos controlados y no controlados en pacientes con epilepsia, 2.388 sujetos recibieron brivaracetam, de los cuales 1.740 fueron tratados durante >6 meses, 1.363 durante >12 meses, 923 durante >24 meses y 569 durante >60 meses (5 años).
Las reacciones adversas notificadas de forma más frecuente (>10%) con el tratamiento de brivaracetam fueron: somnolencia (14,3%) y mareo (11,0%). Fueron normalmente leves a moderadas en intensidad. Somnolencia y fatiga (8,2%) fueron notificadas con una incidencia mayor al aumentar la dosis. Los tipos de reacciones adversas notificados durante los primeros 7 días de tratamientofueron similares a los notificados durante el periodo de tratamiento total.
La tasa de abandono debido a reacciones adversas fue 3,5%, 3,4% y 4,0% para pacientes aleatorizados a brivaracetam a dosis de 50 mg/día, 100 mg/día y 200 mg/día respectivamente, y 1,7% para pacientes aleatorizados a placebo. Las reacciones adversas que de forma más frecuente condujeron al abandono del tratamiento con brivaracetam fueron mareo (0,8%) y convulsiones (0,8%).
Tabla de reacciones adversas
En la siguiente tabla se listan las reacciones adversas que se identificaron en base a la revisión completa de la base de datos de seguridad de ensayos clínicos con brivaracetam, según la frecuencia y la clasificación de órganos del sistema MedDRA.
Las frecuencias se definen de la siguiente manera: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100).Los efectos adversos se presentan en orden decreciente de gravedad dentro de cada grupo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas en ensayos clínicos |
|
Infecciones e infestaciones |
Frecuente |
Gripe |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuente |
Neutropenia |
|
Trastornos del metabolismo y de la nutrición |
Frecuente |
Disminución del apetito |
|
Trastornos psiquiátricos |
Frecuente |
Depresión, ansiedad, insomnio, irritabilidad |
|
Poco frecuente |
Ideas de suicidio, trastorno psicótico, agresividad, agitación | |
|
Trastornos del sistema |
Muy frecuente |
Mareo, somnolencia |
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas en ensayos clínicos |
|
nervioso |
Frecuente |
Convulsión, vértigo |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuente |
Infecciones del tracto respiratorio superior, tos |
|
Trastornos gastrointestinales |
Frecuente |
Náuseas, vómitos, estreñimiento |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Fatiga |
Descripción de algunas reacciones adversas seleccionadas
Neutropenia se ha notificado en el 0,5% (6/1.099) de los pacientes con brivaracetam y en el 0%
(0/459) de los pacientes con placebo. Al inicio cuatro de estos sujetos tuvieron un recuento de neutrófilos más bajo, y experimentaron una disminución adicional en el recuento de neutrófilos tras iniciar el tratamiento con brivaracetam. Ninguno de los 6 casos de neutropenia fue grave, requirió tratamiento específico o condujo a la suspensión de brivaracetam y ninguno tuvo infecciones asociadas.
Las ideas de suicidio se notificaron en el 0,3% (3/1.099) de los pacientes con brivaracetam y en el 0,7% (3/459) de los pacientes con placebo.En los ensayos clínicos a corto plazo de brivaracetam en pacientes con epilepsia, no hubo casos de suicidio completado e intento de suicidio, sin embargo, ambos se notificaron en los ensayos de extensión abierta (ver sección 4.4).
Ensayos de extensión abierta
En los pacientes que fueron seguidos hasta un máximo de 8 años en los ensayos de extensión abierta, el perfil de seguridad fue similar al observado en los ensayos a corto plazo controlados con placebo.
Población pediátrica
Los datos de seguridad de los ensayos abiertos en niños desde 1 mes a<16 años de edad son escasos. Un total de 152 niños (1 mes a <16 años de edad) fueron tratados con brivaracetam en un ensayo farmacocinético y su ensayo de seguimiento relacionado. De los datos limitados disponibles, las reacciones adversas emergentes del tratamiento notificadas de forma más frecuente consideradas por el investigador como relacionadas con el medicamento fueron somnolencia (10%), pérdida del apetito (8%), fatiga (5%) y pérdida de peso (5%). El perfil de seguridad fue consistente con el que se conoce en adultos. No hay datos disponibles sobre neurodesarrollo. Actualmente no hay datos clínicos disponibles en neonatos.
Personas de edad avanzada
De las 130 personas de edad avanzada reclutadas en el programa de desarrollo fase 2/3 de brivaracetam (44 con epilepsia), 100 tenían entre 65-74 años de edad y 30 entre 75-84 años de edad. El perfil de seguridad en pacientes de edad avanzada fue similar al observado en pacientes adultos más jóvenes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reaciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
4.9 Sobredosis
Síntomas
La experiencia clínica con sobredosis de brivaracetam en humanos es escasa. Se han notificado somnolencia y mareo en sujetos sanos que tomaron una única dosis de 1.400 mg de brivaracetam.
Tratamiento de la sobredosis
No hay un antídoto específico para la sobredosis con brivaracetam. El tratamiento de una sobredosis debe incluir medidas generales de soporte. Dado que menos del 10% de brivaracetam se excreta en la orina, no se espera que la hemodiálisis aumente significativamente el aclaramiento de brivaracetam (ver sección 5.2).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX23 Mecanismo de acción
Brivaracetam muestra una alta y selectiva afinidad por la proteína 2A de la vesícula sináptica (SV2A), una glicoproteína transmembrana encontrada a nivel presináptico en las neuronas y en células endocrinas. Aunque el papel exacto de esta proteína todavía tiene que ser dilucidado, se ha visto que modula la exocitosis de los neurotransmisores. Se cree que la unión a SV2A es el mecanismo principal de la actividad anticonvulsivante de brivaracetam.
Eficacia clínica y seguridad
La eficacia de brivaracetam como terapia concomitante en el tratamiento de las crisis de inicio parcial (POS) se estableció en 3 ensayos clínicos aleatorizados, doble-ciego, controlados con placebo, a dosis fijas, multicéntricos, en sujetos a partir de 16 años de edad. La dosis diaria de brivaracetam utilizada en estos ensayos fue de 5 a 200 mg/día. Todos lo ensayos tuvieron un periodo inicial de 8 semanas seguido de un periodo de tratamiento de 12 semanas sin ajuste ascendente de la dosis.
1.558 pacientes recibieron medicamento en estudio, de los cuales 1.099 recibieron brivaracetam. El criterio de reclutamiento en el ensayo requería que los pacientes tuvieran crisis de inicio parcial no controladas a pesar del tratamiento con 1 ó 2 medicamentos antiepilépticos concomitantes. Se requirió que los pacientes tuvieran al menos 8 crisis de inicio parcial durante el periodo inicial. Las variables principales en los ensayos de fase 3 fueron el porcentaje de reducción en la frecuencia de las crisis de inicio parcial frente a placebo y una tasa de respuesta del 50% basada en el 50% de reducción de la frecuencia de las crisis de inicio parcial desde el inicio.
Los medicamentos antiepilépticos tomados más frecuentemente a la entrada en el ensayo fueron carbamazepina (40,6%), lamotrigina (25,2%), valproato (20,5%), oxcarbazepina (16,0%), topiramato (13,5%), fenitoína (10,2%) y levetiracetam (9,8%). La frecuencia media de crisis al inicio en los 3 ensayos fue 9 crisis en 28 días. Los pacientes tenían una duración media de la epilepsia de aproximadamente 23 años.
Los resultadosde eficacia se resumen en la Tabla 2. En general, brivaracetam fue eficaz en el tratamiento concomitante de las crisis de inico parcial en pacientes a partir de 16 años de edad a dosis de entre 50 mg/día y 200 mg/día.
|
Ensayo |
Placebo |
Brivaracetam * Estadísticamente significativo (valor de p) | ||
|
50 mg/día |
100 mg/día |
200 mg/día | ||
|
Ensayo N01253(1) | ||||
|
n= 96 |
n= 101 | |||
|
Tasa de respondedores del 50% |
16,7 |
32,7* (p=0.008) | ||
|
Porcentaje de reducción frente a placebo (%) |
NA |
22,0* (p=0.0040) | ||
|
Ensayo N01252(1) | ||||
|
n = 100 |
n = 99 |
n = 100 | ||
|
Tasa de respondedores del 50% |
20,0 |
27,3 (p=0.372) |
36,0(2) (p=0.023) | |
|
Porcentaje de reducción frente a placebo (%) |
NA |
9,2 (p=0.0274) |
20,5(2) (p=0.0097) | |
|
Ensayo N01358 | ||||
|
n = 259 |
n = 252 |
n = 249 | ||
|
Tasa de respondedores del 50% |
21,6 |
38,9 (p<0.001) |
37,8 (p<0.001) | |
|
Porcentaje de reducción frente a placebo (%) |
NA |
22,8* (p<0.001) |
23,2* (p<0.001) | |
n = pacientes aletorizados que recibieron al menos 1 dosis de la medicación en estudio ~ Dosis no estudiada Estadísticamente significativo
(1) Aproximadamente el 20% de los pacientes estaban tomando levetiracetam
(2) El objetivo primario para N01252 no alcanzó significación estadística basada en el procedimiento de prueba secuencial. La dosis de 100 mg/día fue nominalmente significativa.
En los ensayos clínicos, la reducción en la frecuencia de las crisis frente a placebo fue mayor con la dosis de 100 mg/día que con la de 50 mg/día. A parte de los incrementos dosis-dependientes en la incidencia de somnolencia y fatiga, brivaracetam 50 mg/día y 100 mg/día tuvieron un perfil de seguridad similar incluyendo las reacciones adversas relacionadas con el SNC y con el uso a largo plazo.
La Figura 1 muestra el porcentaje de pacientes (excluyendo los pacientes con levetiracetam concomitante) por categoría de reducción en la frecuencia de las crisis de inicio parcial desde el inicio durante 28 días en los 3 ensayos. Los pacientes con más de un 25% de aumento en las crisis de inicio parcial se muestran a la izquierda como “empeora”. Los pacientes con una mejoría en el porcentaje de reducción en la frecuencia de las crisis de inicio parcial al inicio se muestran en las 4 categorías más a la derecha. El porcentaje de pacientes con al menos una reducción del 50% en la frecuencia de las crisis fue 20,3%, 34,2%, 39,5% y 37,8% para placebo, 50 mg/día, 100 mg/día y 200 mg/día respectivamente.
Figura 1: Proporción de pacientes por categoría de respuesta para brivaracetam y placebo durante 12 semanas a lo largo de los tres ensayos pivotales doble-ciego
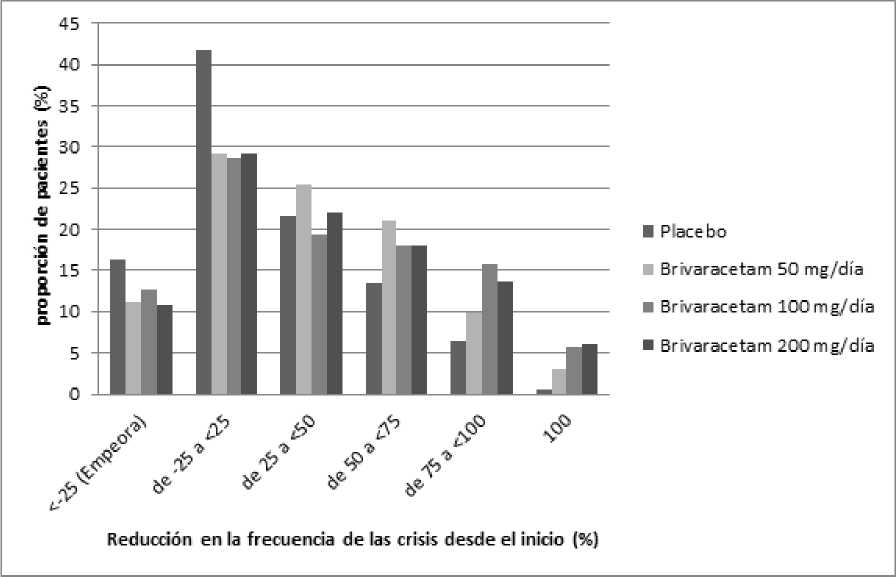
En un análisis conjunto de los tres ensayos pivotales, no se observaron diferencias en eficacia (medida como tasa de respondedores del 50%) dentro del rango de dosis de 50 mg/día a 200 mg/día cuando brivaracetam se combinó con medicamentos antiepilépticos inductores o no inductores enzimáticos. En los ensayos clínicos el 2,5% (4/161), el 5,1% (17/332) y el 4,0% (10/249) de los pacientes con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente estuvieron libres de crisis durante el periodo de tratamiento de 12 semanas, comparado con el 0,5% (2/418) con placebo.
Se observó una mejoría en la media del porcentaje de reducción en la frecuencia de las crisis en 28 días en pacientes con crisis tipo IC (crisis tónico-clónicas secundarias generalizadas) tratados al inicio con brivaracetam 66,6% (n=62), el 61,2% (n=100) y el 82,1% (n=75) de los pacientes tratados con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente comparado con el 33,3% (n=115).
No se ha establecido la eficacia de brivaracetam en monoterapia.
No se recomienda el uso de brivaracetam en monoterapia.
Tratamiento con levetiracetam
En dos ensayos fase 3 aleatorizados controlados con placebo, se administró levetiracetam como medicamento antiepiléptico concomitante en alrededor del 20% de los pacientes. Aunque el número de sujetos es escaso, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma simultánea, lo que puede reflejar la competencia al sitio de unión SV2A . No se observaron problemas adicionales de seguridad o tolerabilidad.
En un tercer ensayo, un análisis pre-especificado demostró eficacia sobre placebo para 100 mg/día y 200 mg/día en pacientes con una exposición previa a levetiracetam. La menor eficacia observada en estos pacientes en comparación con pacientes de inicio con levetiracetam fue probablemente debida al mayor número de fármacos antiepilépticos anteriormente utilizados y una mayor frecuencia de las crisis basales.
Pacientes de edad avanzada (65 años de edad y mayores)
Los tres ensayos pivotales, doble-ciego, controlados con placebo incluyeron 38 pacientes de edad avanzada, con edades entre 65 y 80 años. Aunque los datos son escasos, la eficacia fue comparable a los sujetos más jóvenes.
Ensayos de extensión abierta
A lo largo de todos los ensayos, el 81,7% de los pacientes que completaron los ensayos aleatorizados fueron incluidos en los ensayos de extensión abierta a largo plazo. Desde la entrada en los ensayos aleatorizados, el 5,3% de los sujetos expuestos a brivaracetam durante 6 meses (n=1500) estuvieron libres de crisis comparado con el 4,6% y el 3,7% de los sujetos expuestos durante 12 meses (n=1188) y durante 24 meses (n=847), respectivamente. Sin embargo, como una gran proporción de pacientes (26%) abandonó el estudio abierto por una falta de eficacia, pudo producirse un sesgo de selección, puesto que los sujetos que permanecieron en el estudio respondieron mejor que aquellos que terminaron prematuramente.
Población pediátrica
No se ha establecido la eficacia y tolerabilidad de brivaracetam en pacientes pediátricos (ver sección
4.2) . Brivaracetam se evaluó en estos pacientes en un ensayo farmacocinético, abierto, a corto plazo y en el ensayo de extension abierta en curso, en 152 sujetos de 1 mes a 16 años de edad (ver sección
5.2) .
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos con brivaracetam realizados en uno o más grupos de la población pediátrica en epilepsia con crisis de inicio parcial.
5.2 Propiedades farmacocinéticas
Brivaracetam comprimidos recubiertos con película, solución oral y solución para inyección intravenosa muestran la misma AUC, mientras que la concentración plasmática máxima es ligeramente superior tras la administración intravenosa. Brivaracetam muestra una farmacocinética lineal e independiente del tiempo con baja variabilidad intra- e inter-sujeto, y presenta una absorción completa, muy baja unión a proteínas, excreción renal tras extensa biotransformación, y metabolitos farmacológicamente inactivos.
Absorción
Brivaracetam se absorbe rápida y completamente tras su administración oral y la biodisponibilidad absoluta es aproximadamente el 100%. El tmax medio para comprimidos tomados sin alimentos es 1 hora (rango de Cax es 0,25 a 3 h).
La administración conjunta con una comida rica en grasa disminuyó la velocidad de absorción (tmax medio 3 h) y disminuyó la concentración plasmática máxima (37% inferior) de brivaracetam, mientras que el grado de absorción permaneció inalterado.
Distribución
Brivaracetam se une débilmente (<20%) a las proteínas plasmáticas. El volumen de distribución es 0,5 l/kg, un valor cercano al de todo el agua corporal.
Debido a su lipofilidad (Log P) brivaracetam tiene una alta permeabilidad a través de las membranas celulares.
Biotransformación
Brivaracetam se metaboliza principalmente por hidrólisis del grupo amida para formar el correspondiente ácido carboxílico (aproximadamente el 60% de la eliminación), y secundariamente por hidroxilación en la cadena lateral de propilo (aproximadamente el 30% de la eliminación). La hidrólisis del grupo amida que conduce a un metabolito ácido carboxílico (34% de la dosis en orina) está mediada por la amidasa hepática y extra-hepática. La hidroxilación de brivaracetam, in vitro, está mediada principalmente por el CYP2C19. Ambos metabolitos, son posteriormente metabolizados para formar un ácido hidroxilado común. In vivo, en humanos que poseen mutaciones ineficaces del CYP2C19, la producción del metabolito hidroxilado está disminuida 10 veces mientras que brivaracetam en sí mismo está aumentado un 22% o un 42% en individuos con uno o los dos alelos mutados. Los tres metabolitos no son farmacológicamente activos.
Eliminación
Brivaracetam se elimina principalmente por metabolismo y excreción en la orina. Más del 95% de la dosis, incluyendo los metabolitos, se excreta en la orina dentro de las 72 horas posteriores a la ingesta. Menos del 1% de la dosis se excreta en las heces y menos del 10% de brivaracetam se excreta inalterado en la orina. La semivida plasmática (t1/2) terminal es aproximadamente 9 horas. Se estimó que el aclaramiento plasmático total en pacientes fue de 3,6 L/h.
Linealidad
La farmacocinética es propocional a la dosis desde 10 hasta al menos 600 mg. Interacciones con medicamentos
Brivaracetam se elimina por múltiples vías incluyendo excreción renal, hidrólisis no mediada por CYP y oxidaciones mediadas por CYP. In vitro,brivaracetam no es sustrato de la glicoproteína P (P-gp) humana ni de proteínas resistentes a múltiples fármacos (MRP) 1 y 2, ni probablemente del polipéptido transportador de aniones orgánicos1B1 (OATP1B1) y OATP1B3.
Ensayos in vitro mostraron que la disposición de brivaracetam no debe verse afectada significativamente por ningún inhibidor CYP (ej. CYP1A, 2C8, 2C9, 2D6 y 3A4).
In vitro, brivaracetam no fue un inhibidor de CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 3A4, o de los transportadores P-gp, BCRP, BSEP MRP2, MATE-K, MATE-1, OATP1B1, OATP1B3, OAT1 y OCT1 a concentraciones clínicamente relevantes. In vitro, brivaracetam no indujo CYP1A2.
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada (65 años de edad y mayores)
En un ensayo en sujetos de edad avanzada (65 a 79 años de edad; con aclaramiento de creatinina de 53 a 98 ml/min/1,73 m2) que recibieron 400 mg/día de brivaracetam administrados en dos dosis, la semivida plasmática de brivaracetam fue 7,9 horas y 9,3 horas en los grupos de edad de 65 a 75 años y >75 años, respectivamente. El aclaramiento plasmático en el estado estacionario de brivaracetam fue similar (0,76 ml/min/kg) al de los sujetos varones jóvenes sanos (0,83 ml/min/kg) (ver sección 4.2)
Insuficiencia renal
Un ensayo en sujetos con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min/1,73 m2 que no requerían diálisis) reveló que el área bajo la curva (AUC) plasmático de brivaracetam estuvo moderadamente aumentado (+21%) respecto al grupo control de voluntarios sanos, mientras que el área bajo la curva de los metabolitos ácido, hidroxi e hidroxiácido estuvo aumentado 3, 4 y 21 veces, respectivamente. El aclaramiento renal de estos metabolitos inactivos estuvo disminuido 10 veces. El metabolito hidroxiácido no rebeló ningún problema de seguridad en estudios preclínicos. No se ha estudiado brivaracetam en pacientes sometidos a hemodiálisis (ver sección 4.2).
Insuficiencia hepática
Un ensayo farmacocinético en sujetos con cirrosis hepática (grados A, B y C según Child-Pugh) mostró aumentos similares en la exposición a brivaracetam independientemente de la gravedad de la enfermedad (50%, 57% y 59%), respecto al grupo control de voluntarios sanos (ver sección 4.2).
Población pediátrica
En un ensayo farmacocinético en 99 sujetos de 1 mes a <16 años de edad que recibieron brivaracetam en solución oral, las concentraciones plasmáticas fueron proporcionales a la dosis en todos los grupos de edad. Los modelos farmacocinéticos de población indicaron que la dosis de 2,0 mg/kg dos veces al día proporciona la misma concentración plasmática media del estado estacionario que en adultos que reciben 100 mg dos veces al día.
Peso corporal
Se ha estimado una disminución del 40% en la concentración plasmática del estado estacionario a lo largo del rango de peso corporal de 46 kg a 115 kg. Sin embargo, esto no se considera una diferencia clínicamente significativa en la farmacocinética de brivaracetam.
Sexo
No hay diferencias clínicamente significativas en la farmacocinética de brivaracetam según el sexo. Raza
En un modelo farmacocinético de población en pacientes epilépticos, la farmacocinética de brivaracetam no se vió afectada significativamentes por la raza (caucásica, asiática). El número de pacientes con otros orígenes étnicos fue escaso.
Relación farmacocinética/farmacodinámica
Se estimó que la CE50 (concentración plasmática de brivaracetam correspondiente al 50% del efecto máximo) es 0,57 mg/l. Esta concentración plasmática está ligeramente por encima de la exposición media obtenida tras dosis de brivaracetam de 50 mg/día. Aumentando la dosis a 100 mg/día y alcanzando un meseta a 200 mg/día se obtiene una mayor reducción en la frecuencia de las crisis.
5.3 Datos preclínicos sobre seguridad
En los estudios de farmacología de seguridad los efectos predominantes estuvieron relacionados con el SNC (principalmente depresión del SNC transitoria y disminución de la actividad locomotora espontánea), observados a dosis varias veces (más de 50) la dosis farmacológicamente activa de brivaracetam 2 mg/kg. No afectó al aprendizaje ni a la memoria.
Los hallazgos no observados en los ensayos clínicos, pero observados en los estudios toxicológicos de dosis repetidas en perros a exposiciones similares a la AUC plasmática clínica, fueron efectos hepatotóxicos (principalmente porfiria). Sin embargo, los datos toxicológicos acumulados sobre brivaracetam y sobre un compuesto estructuralmente relacionado indican que los cambios en el hígado de perro se han desarrollado a través de mecanismos no relevantes para humanos. No se observaron cambios adversos en el higado en ratas y monos tras la administración crónica de brivaracetam a 5 y 42 veces el AUC clínica. En monos, signos del SNC (postrado, pérdida de equilibrio, movimientos torpes) sucedieron a 64 veces la Cmax clínica, siendo menos notables con el paso del tiempo.
Los estudios de genotoxicidad no han detectado actividad mutagénica o clastogénica. Los estudios de carcinogenicidad no indicaron ningún potencial oncogénico en ratas, mientras que el aumento de la incidencia de tumores hepatocelulares en ratones macho se consideraron resultado de un modo de acción no genotóxico ligado a la inducción de enzimas hepáticas como fenobarbital, el cual es un fenómeno conocido específico de roedores.
Brivaracetam no afecto a la fertilidad de machos ni hembras y no ha demostrado potencial teratogénico ni en ratas ni en conejos. Se observó embriotoxicidad en conejos a una dosis tóxica materna de brivaracetam con un nivel de exposición de 8 veces la exposición al AUC clínica de la dosis máxima recomendada. En ratas, brivaracetam mostró atravesar la placenta fácilmente y ser excretado en la leche de ratas en período de lactancia con concentraciones similares a los niveles plasmáticos maternos.
Brivaracetam no mostró ningún potencial dependiente en ratas.
Estudios en animales jóvenes
En ratas jóvenes, niveles de exposición a brivaracetam de 6 a 15 veces la exposición del AUC clínica a la dosis máxima recomendada indujeron efectos adversos de desarrollo (ej. mortalidad, signos clínicos, disminución del peso corporal y peso cerebral inferior). No se observaron efectos adversos sobre la función del SNC, en el examen neuropatológico y el examen histopatológico del cerebro. En perros jóvenes los cambios inducidos por brivaracetam a un nivel de exposición de 6 veces el AUC clínica fueron similares a los observados en animales adultos. No hubo efectos adversos sobre ninguna variable estándar de desarrollo o de maduración.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo
Croscarmelosa de sodio,
Lactosa monohidrato Betadex Lactosa anhidra Estearato de magnesio
Cubierta del comprimido
Briviact 10 mg comprimidos recubiertos con película Alcohol polivinilico Dioxido de titanio (E171)
Macrogol 3350 Talco.
Briviact 25 mg comprimidos recubiertos con película Alcohol polivinilico Dioxido de titanio (E171)
Macrogol 3350 Talco
Oxido de hierro amarillo (E172)
Oxido de hierro negro (E172).
Briviact 50 mg comprimidos recubiertos con película Alcohol polivinilico Dioxido de titanio (E171)
Macrogol 3350 Talco
Oxido de hierro amarillo (E172)
Oxido de hierro rojo (E172).
Briviact 75 mg comprimidos recubiertos con película Alcohol polivinilico Dioxido de titanio (E171)
Macrogol 3350 Talco
Oxido de hierro amarillo (E172)
Oxido de hierro rojo (E172)
Oxido de hierro negro (E172).
Briviact 100 mg comprimidos recubiertos con película Alcohol polivinilico Dioxido de titanio (E171)
Macrogol 3350 Talco
Oxido de hierro amarillo (E172)
Oxido de hierro negro (E172)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Briviact 10 mg comprimidos recubiertos con película
• Envases de 14 y 56 comprimidos recubiertos con película y envases múltiples que contienen 168 comprimidos recubiertos con película (3 envases de 56) en blisters de PVC/PCTFE-Aluminio
• Envases de 14 x 1 y 100 x 1 comprimido recubierto con película en blisters de PVC/PCTFE-Aluminio
Briviact 25 mg comprimidos recubiertos con película
• Envases de 14 y 56 comprimidos recubiertos con película y envases múltiples que contienen 168 comprimidos recubiertos con película (3 envases de 56) en blisters de PVC/PCTFE-Aluminio
• Envases de 14 x 1 y 100 x 1 comprimido recubierto con película en blisters de PVC/PCTFE-Aluminio
Briviact 50 mg comprimidos recubiertos con película
• Envases de 14 y 56 comprimidos recubiertos con película y envases múltiples que contienen 168 comprimidos recubiertos con película (3 envases de 56) en blisters de PVC/PCTFE-Aluminio
• Envases de 14 x 1 y 100 x 1 comprimido recubierto con película en blisters de PVC/PCTFE-Aluminio
Briviact 75 mg comprimidos recubiertos con película
• Envases de 14 y 56 comprimidos recubiertos con película y envases múltiples que contienen 168 comprimidos recubiertos con película (3 envases de 56) en blisters de PVC/PCTFE-Aluminio
• Envases de 14 x 1 y 100 x 1 comprimido recubierto con película en blisters de PVC/PCTFE-Aluminio
Briviact 100 mg comprimidos recubiertos con película
• Envases de 14 y 56 comprimidos recubiertos con película y envases múltiples que contienen 168 comprimidos recubiertos con película (3 envases de 56) en blisters de PVC/PCTFE-Aluminio
• Envases de 14 x 1 y 100 x 1 comprimido recubierto con película en blisters de PVC/PCTFE-Aluminio
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/001
EU/1/15/1073/002
EU/1/15/1073/003
EU/1/15/1073/004
EU/1/15/1073/005
EU/1/15/1073/006
EU/1/15/1073/007
EU/1/15/1073/008
EU/1/15/1073/009
EU/1/15/1073/010
EU/1/15/1073/011
EU/1/15/1073/012
EU/1/15/1073/013
EU/1/15/1073/014
EU/1/15/1073/015
EU/1/15/1073/016
EU/1/15/1073/017
EU/1/15/1073/018
EU/1/15/1073/019
EU/1/15/1073/020
EU/1/15/1073/023
EU/1/15/1073/024
EU/1/15/1073/025
EU/1/15/1073/026
EU/1/15/1073/027
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 14/01/2016
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentoshttp://www.ema.europa.eu
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Briviact 10 mg/ml solución oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 10 mg de brivaracetam.
Excipiente(s) con efecto conocido:
Cada ml de solución oral contiene 239,8 mg de sorbitol (E420), 1mg de parahidroxibenzoato de metilo (E218) y 1,16 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución oral
Líquido transparente, de incoloro a amarillento, ligeramente viscoso.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Briviact está indicado como terapia concomitante en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en adultos y adolescentes a partir de 16 años de edad con epilepsia.
4.2 Posología y forma de administración
Posología
La dosis de inicio recomendada es 50 mg/día ó 100 mg/día, según la evaluación del médico sobre la reducción de las crisis requerida frente a los posibles efectos secundarios. La dosis se debe administrar en dos dosis iguales, una por la mañana y otra por la noche. La dosis se puede ajustar en función de la respuesta individual y de la tolerabilidad del paciente en un rango de dosis de 50 mg/día a 200 mg/día.
Dosis olvidadas
Si el paciente se olvida de tomar una o más dosis, se recomienda que tome una única dosis tan pronto como se acuerde y que tome la siguiente dosis a su hora normal por la mañana o por la noche. Esto puede evitar que la concentración plasmática de brivaracetam caiga por debajo del nivel de eficacia y que ocurran crisis repentinas.
Suspensión del tratamiento
Si se tiene que suspender el tratamiento con brivaracetam se recomienda hacerlo de forma gradual con reducciones de 50 mg/día semanalmente.Después de 1 semana de tratamiento con 50 mg/día, se recomienda una última semana de tratamiento con una dosis de 20 mg/día.
Poblaciones especiales
Pacientes de edad avanzada (a partir de 65 años)
No se requiere ajuste de dosis en pacientes de edad avanzada (ver sección 5.2).
La experiencia clínica en pacientes >65 años es escasa.
Insu ficiencia renal
No se require ajuste de dosis en pacientes con insuficiencia renal (ver sección 5.2). Brivaracetam no está recomendado en pacientes con enfermedad renal en fase final sometidos a diálisis debido a la falta de datos.
Insuficiencia hepática
En pacientes con enfermedad hepática crónica la exposición a brivaracetam estuvo aumentada. Se debe considerar una dosis de inicio de 50 mg/día. Para todas las fases de insuficiencia hepática se recomienda una dosis máxima diaria de 150 mg dividida en 2 dosis (ver las secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de brivaracetam en niños menores de 16 años de edad.
Los datos actualmente disponibles se describen en las secciones 4.8, 5.1 y 5.2, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
La solución oral de brivaracetam puede diluirse en agua o zumo poco antes de su administración y se puede tomar con o sin alimentos (ver sección 5.2). Cuando se administre brivaracetam solución oral puede utilizarse una sonda nasogátrica o una sonda de gastrostomía.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a otros derivados de la pirrolidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Pensamientos y comportamientos suicidas
Se han notificado casos de pensamientos y comportamientos suicidas en pacientes tratados con fármacos antiepilépticos, incluyendo brivaracetam, en distintas indicaciones. Un metanálisis de ensayos controlados con placebo, aleatorizados, con fármacos antiepilépticos también ha mostrado un pequeño aumento del riesgo de pensamientos y comportamientos suicidas. Se desconoce el mecanismo de este riesgo y los datos disponibles no excluyen la posibilidad de un aumento del riesgo para brivaracetam.
Por tanto, los pacientes deben ser monitorizados para detectar signos de pensamientos y comportamientos suicidas y se debe considerar el tratamiento adecuado. Se debe aconsejar a los pacientes (y a sus cuidadores) que consulten con su médico si aparecen signos de pensamientos o comportamientos suicidas.
Insuficiencia hepática
Los datos clínicos sobre el uso de brivaracetam en pacientes con insuficiencia hepática preexistente son escasos. Se recomienda el ajuste de dosis en pacientes con insuficiencia hepática (ver sección 4.2).
Excipientes
Contenido en sodio
Brivaracetam solución oral contiene sodio, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
Intolerancia a la fructosa
La solución oral contiene sorbitol (E420). Los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
Excipientes que pueden causar intolerancia
La solución oral contiene parahidroxibenzoato de metilo (E218), lo que puede provocar reacciones alérgicas (posiblemente retardadas).
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios formales de interacción se han realizado sólo en adultos.
Interacciones farmacodinámicas
Tratamiento concomitante con levetiracetam
En los ensayos clínicos, aunquelos datos fueron escasos, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma concomitante. No se observaron problemas de seguridad o tolerabilidad adicionales (ver sección 5.1).
Interacción con alcohol
En un estudio de interacción farmacocinético y farmacodinámico entre una dosis única de brivaracetam de 200 mg y una perfusión continua de etanol de 0,6 g/l en sujetos sanos, no hubo interacción farmacocinética pero brivaracetam aproximadamente dobló el efecto del alcohol sobre la función psicomotora, la atención y la memoria. No se recomienda tomar brivaracetam con alcohol.
Interacciones farmacocinéticas
Efectos de otros agentes sobre la farmacocinética de brivaracetam
Datos in vitro sugieren que brivaracetam tiene un potencial de interacción bajo. La principal ruta de eliminación de brivaracetam es por hidrólisis independiente de CYP.
Una segunda ruta de eliminación incluye hidroxilación, mediada por CYP2C19 (ver sección 5.2).
Las concentraciones plasmáticas de brivaracetam pueden aumentar cuando se administra conjuntamente con inhibidores potentes del CYP2C19 (ej. fluconazol, fluvoxamina), pero el riesgo de una interacción mediada por el CYP2C19 clínicamente relevante se considera bajo.
Rifampicina
La administración concomitante con el inductor enzimático potente rifampicina (600 mg/día durante 5 días) en sujetos sanos disminuye el área bajo la curva de concentraciones plasmáticas (AUC) de brivaracetam en un 45%. Los médicos prescriptores deben considerar un ajuste de la dosis de brivaracetam en pacientes que estén empezando o terminando un tratamiento con rifampicina.
Medicamentos antiepilépticos inductores enzimáticos potentes
Las concentraciones plasmáticas de brivaracetam disminuyen cuando se administra conjuntamente con medicamentos antiepilépticos inductores enzimáticos potentes (carbamazepina, fenobarbital, fenitoína) pero no se requiere ajuste de dosis (ver tabla 1).
Otros inductores enzimáticos
Otros inductores enzimáticos potentes (como la Hierba de San Juan (Hypericum perforatum)) también pueden disminuir la exposición sistémica de brivaracetam. Por tanto, se debe iniciar o finalizar el tratamiento con la hierba de San Juan con precaución.
Efectos de brivaracetam sobre otros medicamentos
Brivaracetam a dosis de 50 o 150 mg/día no afectó el área bajo la curva (AUC) de midazolam (metabolizado por CYP3A4). El riesgo de interacciones CYP3A4 clínicamente relevantes se considera bajo.
Estudios in vitro han mostrado que brivaracetam no inhibe o inhibe muy poco las isoformas de CYP450 excepto la CYP2C19. Brivaracetam puede aumentar las concentraciones plasmáticas de los medicamentos metabolizados por CYP2C19 (ej. lansoprazol, omeprazol, diazepam). Cuando se ensayó in vitro brivaracetam no indujo el CYP1A1/2 pero indujo moderadamente el CYP3A4 y CYP2B6. No se encontró inducción del CYP3A4 in vivo (ver midazolam más arriba). La inducción del CYP2B6 no se ha investigado in vivo y brivaracetam puede reducir las concentraciones plasmáticas de medicamentos metabolizados por CYP2B6 (ej. efavirenz). In vitro, estudios de interacción para determinar los posibles efectos inhibitorios sobre los transportadores concluyeron que no hubo efectos clínicamente relevantes excepto por OAT3.In vitro, Brivaracetam inhibe OAT3 con la mitad de la concentración máxima inhibitoria 42 veces superior que la Cmax a la dosis clínica más alta.Brivaracetam 200 mg/día puede aumentar las concentraciones plasmáticas de los medicamentos transportados por OAT3.
Medicamentos antiepilépticos
Las posibles interacciones entre brivaracetam (50 mg/día a 200 mg/día) y otros medicamentos antiepilépticos se investigaron en un análisis conjunto de las concentraciones plasmáticas del medicamento de todos los ensayos fase 2-3, en un análisis farmacocinético de la población de los ensayos fase 2-3 controlados con placebo, y en ensayos de interacción farmacológica (para los siguientes medicamentos antiepilépticos: carbamazepina, lamotrigina, fenitoína y topiramato). El efecto de las interacciones sobre las concentraciones plasmáticas se resume en la tabla 1 (aumento se indica como “t” y disminución como “j”, área bajo la curva de concentración plasmática frente al tiempo como “AUC” y concentración máxima observada como Cmax).
Tabla 1: Interacciones ^ farmacocinéticas entre brivaracetam y otros medicamentos antiepilépticos
|
Medicamentos antiepilépticos administrados de forma conjunta |
Influencia de los medicamentos antiepilépticos sobre la concentración plasmática de brivaracetam |
Influencia de brivaracetam sobre la concentración plasmática de los medicamentos antiepilépticos |
|
Carbamazepina |
AUC 29% j Cmax 13%j No se requiere ajuste de dosis |
Carbamazepina - Ninguna Carbamazepina-epóxido t (Ver más abajo) No se requiere ajuste de dosis. |
|
Clobazam |
No hay datos disponibles |
Ninguna |
|
Clonazepam |
No hay datos disponibles |
Ninguna |
|
Lacosamida |
No hay datos disponibles |
Ninguna |
|
Lamotrigina |
Ninguna |
Ninguna |
|
Levetiracetam |
Ninguna |
Ninguna |
|
Oxcarbazepina |
Ninguna |
Ninguna (derivado monohidroxi, MHD) |
|
Fenobarbital |
AUC 19% j No se requiere ajuste de dosis |
Ninguna |
|
Fenitoína |
AUC 21% j No se requiere ajuste de dosis |
Ninguna a AUC 20% t 3 Cmax 20% t |
|
Pregabalina |
No hay datos disponibles |
Ninguna |
|
Topiramato |
Ninguna |
Ninguna |
|
Ácido valproico |
Ninguna |
Ninguna |
|
Zonisamida |
No hay datos disponibles |
Ninguna |
a de acuerdo a un estudio que implica la administración de una dosis supraterapéutica de brivaracetam de 400 mg/día
Carbamazepina
Brivaracetam es un inhibidor moderado reversible de la epóxido hidrolasa lo que conlleva a un aumento de la concentración de carbamazepina epóxido, un metabolito activo de carbamazepina. En ensayos controlados, las concentraciones plasmáticas de carbamazepina epóxido aumentaron una media del 37%, 62% y 98% con una pequeña variabilidad a dosis de brivaracetam de 50 mg/día, 100 mg/día y 200 mg/día respectivamente. No se observaron riesgos de seguridad. No hubo efecto aditivo de brivaracetam y valproato sobre el AUC de carbamazepina epóxido.
Anticonceptivos orales
La administración concomitante de brivaracetam (100 mg/día) con anticonceptivos orales que contienen etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg) no influyó en la farmacocinética de ninguna de las sustancias. Cuando brivaracetam se administró a una dosis de 400 mg/día (dos veces la dosis diaria máxima recomendada) conjuntamente con un anticonceptivo oral conteniendo etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg), se observó una disminución en las áreas bajo la curva (AUCs) de los estrógenos y la progestina del 27% y 23% respectivamente, sin impacto sobre la supresión de la ovulación. No hubo cambio, en general, en los perfiles de concentración-tiempo de los marcadores endógenos estradiol, progesterona, hormona luteinizante (LH), hormona estimulante del folículo (FSH) y globulina transportadora de hormonas sexuales (SHBG).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil en tratamiento con brivaracetam deben discutir con su médico la planificación familiar y las medidas anticonceptivas (ver Embarazo).
Si una mujer decide quedarse embarazada, el uso de brivaracetam debe ser cuidadosamente reevaluado.
Embarazo
Riesgo relacionado con la epilepsia y los medicamentos antiepilépticos en general Para todos los medicamentos antiepilépticos, se ha visto que en la descendencia de las mujeres con epilepsia tratadas, la prevalencia de malformaciones es dos o tres veces mayor que la tasa de, aproximadamente, el 3% en la población general. En la población tratada con politerapia se ha notificado un aumento de malformaciones; sin embargo, no se ha esclarecido el alcance para el cual el tratamiento y/o la enfermedad subyacente es responsable. La suspensión del tratamiento antiepiléptico puede conducir a una exacerbación de la enfermedad que puede ser perjudicial para la madre y el feto.
Riesgo relacionado con brivaracetam
Hay escasos datos sobre el uso de brivaracetam en mujeres embarazadas. No hay datos de la tranferencia placentaria en humanos, pero en ratas, brivaracetam mostró que atraviesa la placenta fácilmente (ver sección 5.3). Se desconoce el posible riesgo en humanos. Los estudios en animales no detectaron ningún potencial efecto teratogénico de brivaracetam (ver sección 5.3).
En ensayos clínicos se utilizó brivaracetam como tratamiento concomitante, y cuando se utilizó con carbamazepina, indujo un aumento relacionado con la dosis en la concentración del metabolito activo carbamazepina-epóxido (ver sección 4.5). No hay datos suficientes para determinar la importancia clínica de este efecto en el embarazo.
Como medida de precaución, no se debe utilizar brivaracetam durante el embarazo a no ser que sea clínicamente necesario (ej. si el beneficio para la madre supera el posible riesgo para el feto).
Lactancia
Se desconoce si brivaracetam se excreta en la leche materna. Estudios en ratas mostraron excreción de brivaracetam en la leche (ver sección 5.3). Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con brivaracetam tras considerar el beneficio del medicamento para la madre. En caso de administración conjunta de brivaracetam y carbamazepina, la cantidad de carbamazepina-epóxido excretada en la leche materna puede aumentar. No hay datos suficientes para determinar la importancia clínica.
Fertilidad
No hay datos disponibles en humanos sobre el efecto de brivaracetam en la fertilidad. En ratas no hubo efecto sobre la fertilidad con brivaracetam (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utlizar máquinas
La influencia de brivaracetam sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada.
Debido a las posibles diferencias de sensibilidad individual, algunos pacientes pueden experimentar somnolencia, mareo y otros síntomas relacionados con el sistema nervioso central (SNC). Se debe advertir a los pacientes que no conduzcan ni manejen máquinas potencialmente peligrosas hasta que se hayan familiarizado con los efectos de brivaracetam sobre su capacidad para realizar dichas actividades.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En todos los ensayos controlados y no controlados en pacientes con epilepsia, 2.388 sujetos recibieronbrivaracetam, de los cuales 1.740 fueron tratados durante >6 meses, 1.363 durante >12 meses, 923 durante >24 meses y 569 durante >60 meses (5 años).
Las reacciones adversas notificadas de forma más frecuente (>10%) con el tratamiento de brivaracetam fueron: somnolencia (14,3%) y mareo (11,0%). Fueron normalmente leves a moderadas en intensidad. Somnolencia y fatiga (8,2%) fueron notificadas con una incidencia mayor al aumentar la dosis. Los tipos de reacciones adversas notificados durante los primeros 7 días de tratamiento fueron similares a los notificados durante el período de tratamiento total.
La tasa de abandono debido a reacciones adversas fue 3,5%, 3,4% y 4,0% para pacientes aleatorizados a brivaracetam a dosis de 50 mg/día, 100 mg/día y 200 mg/día respectivamente, y 1,7% para pacientes aleatorizados a placebo. Las reacciones adversas que de forma más frecuente condujeron al abandono del tratamiento con brivaracetam fueron mareo (0,8%) y convulsiones (0,8%).
Tabla de reacciones adversas
En la siguiente tabla se listan las reacciones adversas que se identificaron en base a la revisión completa de la base de datos de seguridad de ensayos clínicos con brivaracetam, según la frecuencia y la clasificación de órganos del sistema MedDRA.
Las frecuencias se definen de la siguiente manera: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100).Los efectos adversos se presentan en orden decreciente de gravedad dentro de cada grupo de frecuencia.
|
Sistema de Clasificación de órganos |
Frecuencia |
Reacciones adversas en ensayos clínicos |
|
Infecciones e infestaciones |
Frecuente |
Gripe |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuente |
Neutropenia |
|
Trastornos del metabolismo y de la nutrición |
Frecuente |
Disminución del apetito |
|
Trastornos psiquiátricos |
Frecuente |
Depresión, ansiedad,insomnio, irritabilidad |
|
Poco frecuente |
Ideas de suicidio, trastorno psicótico, agresividad, agitación | |
|
Trastornos del sistema nervioso |
Muy frecuente |
Mareo, somnolencia |
|
Frecuente |
Convulsión, vértigo | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuente |
Infecciones del tracto respiratorio superior, tos |
|
Trastornos gastrointestinales |
Frecuente |
Náuseas, vómitos, estreñimiento |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Fatiga |
Descripción de algunas reacciones adversas seleccionadas
Neutropenia se ha notificado en el 0,5% (6/1.099) de los pacientes con brivaracetam y en el 0% (0/459) de los pacientes con placebo. Al inicio cuatro de estos sujetos tuvieron un recuento de neutrófilos más bajo, y experimentaron una disminución adicional en el recuento de neutrófilos tras iniciar el tratamiento con brivaracetam. Ninguno de los 6 casos de neutropenia fue grave, requirió tratamiento específico o condujo a la suspensión de brivaracetam y ninguno tuvo infecciones asociadas.
Las ideas de suicidio se notificaron en el 0,3% (3/1.099) de los pacientes con brivaracetam y en el 0,7% (3/459) de los pacientes con placebo.En los ensayos clínicos a corto plazo de brivaracetam en pacientes con epilepsia, no hubo casos de suicidio completado e intento de suicidio, sin embargo, ambos se notificaron en los ensayos de extensión abierta (ver sección 4.4).
Ensayos de extensión abierta
En los pacientes que fueron seguidos hasta un máximo de 8 años en los ensayos de extensión abierta, el perfil de seguridad fue similar al observado en los ensayos a corto plazo controlados con placebo.
Población pediátrica
Los datos de seguridad de los ensayos abiertos en niños desde 1 mes a<16 años de edad son escasos. Un total de 152 niños (1 mes a <16 años de edad) fueron tratados con brivaracetam en un ensayo farmacocinético y su ensayo de seguimiento relacionado. De los datos limitados disponibles, las reacciones adversas emergentes del tratamiento notificadas de forma más frecuenteconsideradas por el investigador como relacionadas con el medicamento fueron somnolencia (10%), pérdida del apetito (8%), fatiga (5%) y pérdida de peso (5%). El perfil de seguridad fue consistente con el que se conoce en adultos. No hay datos disponibles sobre neurodesarrollo. Actualmente no hay datos clínicos disponibles en neonatos.
Personas de edad avanzada
De las 130 personas de edad avanzada reclutadas en el programa de desarrollo fase 2/3 de brivaracetam (44 con epilepsia), 100 tenían entre 65-74 años de edad y 30 entre 75-84 años de edad. El perfil de seguridad en pacientes de edad avanzada fue similar al observado en pacientes adultos más jóvenes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reaciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
4.9 Sobredosis
Síntomas
La experiencia clínica con sobredosis de brivaracetam en humanos es escasa. Se han notificado somnolencia y mareo en sujetos sanos que tomaron una única dosis de 1.400 mg de brivaracetam.
Tratamiento de la sobredosis
No hay un antídoto específico para la sobredosis con brivaracetam. El tratamiento de una sobredosis debe incluir medidas generales de soporte. Dado que menos del 10% de brivaracetam se excreta en la orina, no se espera que la hemodiálisis aumente significativamente el aclaramiento de brivaracetam (ver sección 5.2).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX23 Mecanismo de acción
Brivaracetam muestra una alta y selectiva afinidad por la proteína 2A de la vesícula sináptica (SV2A), una glicoproteína transmembrana encontrada a nivel presináptico en las neuronas y en células endocrinas. Aunque el papel exacto de esta proteína todavía tiene que ser dilucidado, se ha visto que modula la exocitosis de los neurotransmisores. Se cree que la unión a SV2A es el mecanismo principal de la actividad anticonvulsivante de brivaracetam.
Eficacia clínica y seguridad
La eficacia de brivaracetam como terapia concomitante en el tratamiento de las crisis de inicio parcial (POS) se estableció en 3 ensayos clínicos aleatorizados, doble-ciego, controlados con placebo, a dosis fijas, multicéntricos, en sujetos a partir de 16 años de edad. La dosis diaria de brivaracetam utilizada en estos ensayos fue de 5 a 200 mg/día. Todos lo ensayos tuvieron un periodo inicial de 8 semanas seguido de un periodo de tratamiento de 12 semanas sin ajuste ascendente de la dosis.
1.558 pacientes recibieron medicamento en estudio, de los cuales 1.099 recibieron brivaracetam. El criterio de reclutamiento en el ensayo requería que los pacientes tuvieran crisis de inicio parcial no controladas a pesar del tratamiento con 1 ó 2 medicamentos antiepilépticos concomitantes. Se requirió que los pacientes tuvieran al menos 8 crisis de inicio parcial durante el periodo inicial. Las variables principales en los ensayos de fase 3 fueron el porcentaje de reducción en la frecuencia de las crisis de inicio parcial frente a placebo y una tasa de respuesta del 50% basada en el 50% de reducción de la frecuencia de las crisis de inicio parcial desde el inicio.
Los medicamentos antiepilépticos tomados más frecuentemente a la entrada en el ensayo fueron carbamazepina (40,6%), lamotrigina (25,2%), valproato (20,5%), oxcarbazepina (16,0%), topiramato (13,5%), fenitoína (10,2%) y levetiracetam (9,8%). La frecuencia media de crisis al inicio en los 3 ensayos fue 9 crisis en 28 días. Los pacientes tenían una duración media de la epilepsia de aproximadamente 23 años.
Los resultados de eficacia se resumen en la Tabla 2. En general, brivaracetam fue eficaz en el tratamiento concomitante de las crisis de inico parcial en pacientes a partir de 16 años de edad a dosis de entre 50 mg/día y 200 mg/día.
Tabla 2: Resultados Clave de Eficacia en la Frecuencia de Crisis de Inicio Parcial en 28 Días
|
Ensayo |
Placebo |
Brivaracetam * Estadísticamente significativo (valor de p) | ||
|
50 mg/día |
100 mg/día |
200 mg/día | ||
|
Ensayo N01253(1) | ||||
|
n= 96 |
n= 101 | |||
|
Tasa de respondedores del 50% |
16,7 |
32,7* (p=0.008) |
~ |
~ |
|
Porcentaje de reducción frente a placebo (%) |
NA |
22,0* (p=0.0040) |
~ |
~ |
|
Ensayo N01252(1) | ||||
|
n = 100 |
n = 99 |
n = 100 | ||
|
Tasa de respondedores del 50% |
20,0 |
27,3 (p=0.372) |
36,0(2) (p=0.023) |
~ |
|
Porcentaje de reducción frente a placebo (%) |
NA |
9,2 (p=0.0274) |
20,5(2) (p=0.0097) |
~ |
|
Ensayo N01358 | ||||
|
n = 259 |
n = 252 |
n = 249 | ||
|
Tasa de respondedores del 50% |
21,6 |
~ |
38,9 (p<0.001) |
37,8 (p<0.001) |
|
Porcentaje de reducción frente a placebo (%) |
NA |
~ |
22,8* (p<0.001) |
23,2* (p<0.001) |
n = pacientes aletorizados que recibieron al menos 1 dosis de la medicación en estudio ~ Dosis no estudiada * Estadísticamente significativo
(1) Aproximadamente el 20% de los pacientes estaban tomando levetiracetam
(2) El objetivo primario para N01252 no alcanzó significación estadística basada en el procedimiento de prueba secuencial. La dosis de 100 mg/día fue nominalmente significativa.
En los ensayos clínicos, la reducción en la frecuencia de las crisis frente a placebo fue mayor con la dosis de 100 mg/día que con la de 50 mg/día. A parte de los incrementos dosis-dependientes en la incidencia de somnolencia y fatiga, brivaracetam 50 mg/día y 100 mg/día tuvieron un perfil de seguridad similar incluyendo las reacciones adversas relacionadas con el SNC y con el uso a largo plazo.
La Figura 1 muestra el porcentaje de pacientes (excluyendo los pacientes con levetiracetam concomitante) por categoría de reducción en la frecuencia de las crisis de inicio parcial desde el inicio durante 28 días en los 3 ensayos. Los pacientes con más de un 25% de aumento en las crisis de inicio parcial se muestran a la izquierda como “empeora”. Los pacientes con una mejoría en el porcentaje de reducción en la frecuencia de las crisis de inicio parcial al inicio se muestran en las 4 categorías más a la derecha. El porcentaje de pacientes con al menos una reducción del 50% en la frecuencia de las crisis fue 20,3%, 34,2%, 39,5% y 37,8% para placebo, 50 mg/día, 100 mg/día y 200 mg/día respectivamente.
Figura 1: Proporción de pacientes por categoría de respuesta para brivaracetam y placebo durante 12 semanas a lo largo de los tres ensayos pivotales doble-ciego
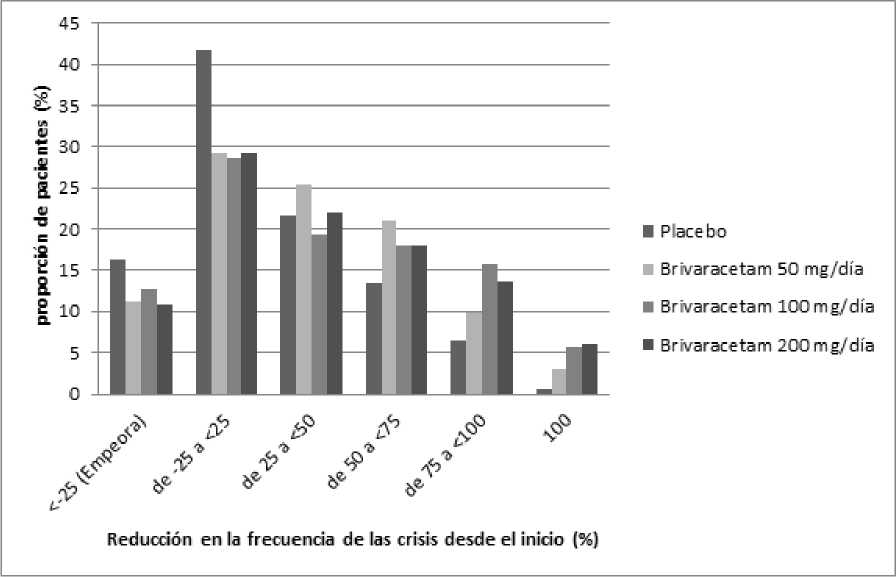
En un análisis conjunto de los tres ensayos pivotales, no se observaron diferencias en eficacia (medida como tasa de respondedores del 50%) dentro del rango de dosis de 50 mg/día a 200 mg/día cuando brivaracetam se combinó con medicamentos antiepilépticos inductores o no inductores enzimáticos. En los ensayos clínicos el 2,5% (4/161), el 5,1% (17/332) y el 4,0% (10/249) de los pacientes con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente estuvieron libres de crisis durante el periodo de tratamiento de 12 semanas, comparado con el 0,5% (2/418) con placebo.
Se observó una mejoría en la media del porcentaje de reducción en la frecuencia de las crisis en 28 días en pacientes con crisis tipo IC (crisis tónico-clónicas secundarias generalizadas) tratados al inicio con brivaracetam66,6% (n=62), el 61,2% (n=100) y el 82,1% (n=75) de los pacientes tratados con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente comparado con el 33,3% (n=115).
No se ha establecido la eficacia de brivaracetam en monoterapia.
No se recomienda el uso de brivaracetam en monoterapia.
Tratamiento con levetiracetam
En dos ensayos fase 3 aleatorizados controlados con placebo, se administró levetiracetam como medicamento antiepiléptico concomitante en alrededor del 20% de los pacientes. Aunque el número de sujetos es escaso, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma simultánea, lo que puede reflejar la competencia al sitio de unión SV2A. No se observaron problemas adicionales de seguridad o tolerabilidad.
En un tercer ensayo, un análisis pre-especificado demostró eficacia sobre placebo para 100 mg/día y 200 mg/día en pacientes con una exposición previa a levetiracetam. La menor eficacia observada en estos pacientes en comparación con pacientes de inicio con levetiracetam fue probablemente debida al mayor número de fármacos antiepilépticos anteriormente utilizados y una mayor frecuencia de las crisis basales.
Pacientes de edad avanzada (65 años de edad y mayores)
Los tres ensayos pivotales, doble-ciego, controlados con placebo incluyeron 38 pacientes de edad avanzada, con edades entre 65 y 80 años. Aunque los datos son escasos, la eficacia fue comparable a los sujetos más jóvenes.
Ensayos de extensión abierta
A lo largo de todos los ensayos, el 81,7% de los pacientes que completaron los ensayos aleatorizados fueron incluidos en los ensayos de extensión abierta a largo plazo. Desde la entrada en los ensayos aleatorizados, el 5,3% de los sujetos expuestos a brivaracetam durante 6 meses (n=1500) estuvieron libres de crisis comparado con el 4,6% y el 3,7% de los sujetos expuestos durante 12 meses (n=1188) y durante 24 meses (n=847), respectivamente. Sin embargo, como una gran proporción de pacientes (26%) abandonó el estudio abierto por una falta de eficacia, pudo producirse un sesgo de selección, puesto que los sujetos que permanecieron en el estudio respondieron mejor que aquellos que terminaron prematuramente.
Población pediátrica
No se ha establecido la eficacia y tolerabilidad de brivaracetam en pacientes pediátricos (ver sección
4.2) . Brivaracetam se evaluó en estos pacientes en un ensayo farmacocinético, abierto, a corto plazo y en el ensayo de extension abierta en curso, en 152 sujetos de 1 mes a 16 años de edad (ver sección
5.2) .
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos con brivaracetam realizados en uno o más grupos de la población pediátrica en epilepsia con crisis de inicio parcial.
5.2 Propiedades farmacocinéticas
Brivaracetam comprimidos recubiertos con película, solución oral y solución para inyección intravenosa muestran la misma AUC, mientras que la concentración plasmática máxima es ligeramente superior tras la administración intravenosa. Brivaracetam muestra una farmacocinética lineal e independiente del tiempo con baja variabilidad intra- e inter-sujeto, y presenta una absorción completa, muy baja unión a proteínas, excreción renal tras extensa biotransformación, y metabolitos farmacológicamente inactivos.
Absorción
Brivaracetam se absorbe rápida y completamente tras su administración oral y la biodisponibilidad absoluta es aproximadamente el 100%. Eltmax medio para comprimidos tomados sin alimentos es 1 hora (rango de tmax es 0,25 a 3 h).
La administración conjunta con una comida rica en grasa disminuyó la velocidad de absorción (tmax medio 3 h) y disminuyó la concentración plasmática máxima (37% inferior) de brivaracetam, mientras que el grado de absorción permaneció inalterado.
Distribución
Brivaracetam se une débilmente (<20%) a las proteínas plasmáticas. El volumen de distribución es 0,5 l/kg, un valor cercano al de todo el agua corporal.
Debido a su lipofilidad (Log P) brivaracetam tiene una alta permeabilidad a través de las membranas celulares.
Biotransformación
Brivaracetam se metaboliza principalmente por hidrólisis del grupo amida para formar el correspondiente ácido carboxílico (aproximadamente el 60% de la eliminación), y secundariamente por hidroxilación en la cadena lateral de propilo (aproximadamente el 30% de la eliminación). La hidrólisis del grupo amida que conduce a un metabolito ácido carboxílico (34% de la dosis en orina) está mediada por la amidasa hepática y extra-hepática. La hidroxilación de brivaracetam, in vitro, está mediada principalmente por el CYP2C19. Ambos metabolitos, son posteriormente metabolizados para formar un ácido hidroxilado común. In vivo, en humanos que poseen mutaciones ineficaces del CYP2C19, la producción del metabolito hidroxilado está disminuida 10 veces mientras que brivaracetam en sí mismo está aumentado un 22% o un 42% en individuos con uno o los dos alelos mutados. Los tres metabolitos no son farmacológicamente activos.
Eliminación
Brivaracetam se elimina principalmente por metabolismo y excreción en la orina. Más del 95% de la dosis, incluyendo los metabolitos, se excreta en la orina dentro de las 72 horas posteriores a la ingesta. Menos del 1% de la dosis se excreta en las heces y menos del 10% de brivaracetam se excreta inalterado en la orina. La semivida plasmática (t1/2) terminal es aproximadamente 9 horas. Se estimó que el aclaramiento plasmático total en pacientes fue de 3,6 L/h.
Linealidad
La farmacocinética es propocional a la dosis desde 10 hasta al menos 600 mg. Interacciones con medicamentos
Brivaracetam se elimina por múltiples vías incluyendo excreción renal, hidrólisis no mediada por CYP y oxidaciones mediadas por CYP. In vitro, brivaracetamno es sustrato de la glicoproteina P (P-gp) humana ni de proteínas resistentes a múltiples fármacos (MRP ) 1 y 2, ni probablemente del polipéptido transportador de aniones orgánicos1B1 (OATP1B1) y OATP1B3.
Ensayos in vitro mostraron que la disposición de brivaracetam no debe verse afectada significativamente por ningún inhibidor CYP (ej. CYP1A, 2C8, 2C9, 2D6 y 3A4) .
In vitro, brivaracetam no fue un inhibidor de CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 3A4, o de los transportadores P-gp, BCRP, BSEP MRP2, MATE-K, MATE-1, OATP1B1, OATP1B3, OAT1 y OCT1 a concentraciones clínicamente relevantes. In vitro, brivaracetam no indujo CYP1A2.
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada (65 años de edad y mayores)
En un ensayo en sujetos de edad avanzada (65 a 79 años de edad; con aclaramiento de creatinina de 53 a 98 ml/min/1,73 m2) que recibieron 400 mg/día de brivaracetam administrados en dos dosis, la semivida plasmática de brivaracetam fue 7,9 horas y 9,3 horas en los grupos de edad de 65 a 75 años y >75 años, respectivamente. El aclaramiento plasmático en el estado estacionario de brivaracetam fue similar (0,76 ml/min/kg) al de los sujetos varones jóvenes sanos (0,83 ml/min/kg) (ver sección 4.2)
Insuficiencia renal
Un ensayo en sujetos con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min/1,73 m2 que no requerían diálisis) reveló que el área bajo la curva (AUC)plasmático de brivaracetam estuvo moderadamente aumentado (+21%) respecto al grupo control de voluntarios sanos, mientras que el área bajo la curva de los metabolitos ácido, hidroxi e hidroxiácido estuvo aumentado 3, 4 y 21 veces, respectivamente. El aclaramiento renal de estos metabolitos inactivos estuvo disminuido 10 veces. El metabolito hidroxiácido no rebeló ningún problema de seguridad en estudios preclínicos. No se ha estudiado brivaracetam en pacientes sometidos a hemodiálisis (ver sección 4.2).
Insuficiencia hepática
Un ensayo farmacocinético en sujetos con cirrosis hepática (grados A, B y C según Child-Pugh) mostró aumentos similares en la exposición a brivaracetam independientemente de la gravedad de la enfermedad (50%, 57% y 59%), respecto al grupo control de voluntarios sanos (ver sección 4.2).
Población pediátrica
En un ensayo farmacocinético en 99 sujetos de 1 mes a <16 años de edad que recibieron brivaracetam en solución oral, las concentraciones plasmáticas fueron proporcionales a la dosis en todos los grupos de edad. Los modelos farmacocinéticos de población indicaron que la dosis de 2,0 mg/kg dos veces al día proporciona la misma concentración plasmática media del estado estacionario que en adultos que reciben 100 mg dos veces al día.
Peso corporal
Se ha estimado una disminución del 40% en la concentración plasmática del estado estacionario a lo largo del rango de peso corporal de 46 kg a 115 kg. Sin embargo, esto no se considera una diferencia clínicamente significativa en la farmacocinética de brivaracetam.
Sexo
No hay diferencias clínicamente significativas en la farmacocinética de brivaracetam según el sexo. Raza
En un modelo farmacocinético de población en pacientes epilépticos, la farmacocinética de brivaracetam no se vió afectada significativamentes por la raza (caucásica, asiática). El número de pacientes con otros orígenes étnicos fue escaso.
Relación farmacocinética/farmacodinámica
Se estimó que la CE50 (concentración plasmática de brivaracetam correspondiente al 50% del efecto máximo) es 0,57 mg/l. Esta concentración plasmática está ligeramente por encima de la exposición media obtenida tras dosis de brivaracetam de 50 mg/día. Aumentando la dosis a 100 mg/día y alcanzando un meseta a 200 mg/día se obtiene una mayor reducción en la frecuencia de las crisis.
5.3 Datos preclínicos sobre seguridad
En los estudios de farmacología de seguridad los efectos predominantes estuvieron relacionados con el SNC (principalmente depresión del SNC transitoria y disminución de la actividad locomotora espontánea), observados a dosis varias veces (más de 50) la dosis farmacológicamente activa de brivaracetam2 mg/kg. No afectó al aprendizaje ni a la memoria.
Los hallazgos no observados en los ensayos clínicos, pero observados en los estudios toxicológicos de dosis repetidas en perros a exposiciones similares a la AUC plasmática clínica, fueron efectos hepatotóxicos (principalmente porfiria). Sin embargo, los datos toxicológicos acumulados sobre brivaracetam y sobre un compuesto estructuralmente relacionado indican que los cambios en el hígado de perro se han desarrollado a través de mecanismos no relevantes para humanos. No se observaron cambios adversos en el higado en ratas y monos tras la administración crónica de brivaracetam a 5 y 42 veces el AUC clínica. En monos, signos del SNC (postrado, pérdida de equilibrio, movimientos torpes) sucedieron a 64 veces la Cmax clínica, siendo menos notables con el paso del tiempo.
Los estudios de genotoxicidad no han detectado actividad mutagénica o clastogénica. Los estudios de carcinogenicidad no indicaron ningún potencial oncogénico en ratas, mientras que el aumento de la incidencia de tumores hepatocelulares en ratones macho se consideraron resultado de un modo de acción no genotóxico ligado a la inducción de enzimas hepáticas como fenobarbital, el cual es un fenómeno conocido específico de roedores.
Brivaracetam no afecto a la fertilidad de machos ni hembras y no ha demostrado potencial teratogénico ni en ratas ni en conejos. Se observó embriotoxicidad en conejos a una dosis tóxica materna de brivaracetam con un nivel de exposición de 8 veces la exposición al AUC clínica de la dosis máxima recomendada. En ratas, brivaracetam mostró atravesar la placenta fácilmente y ser excretado en la leche de ratas en período de lactancia con concentraciones similares a los niveles plasmáticos maternos.
Brivaracetam no mostró ningún potencial dependiente en ratas.
Estudios en animales jóvenes
En ratas jóvenes, niveles de exposición a brivaracetam de 6 a 15 veces la exposición del AUC clínica a la dosis máxima recomendada indujeron efectos adversos de desarrollo (ej. mortalidad, signos clínicos, disminución del peso corporal y peso cerebral inferior). No se observaron efectos adversos sobre la función del SNC, en el examen neuropatológico y el examen histopatológico del cerebro. En perros jóvenes los cambios inducidos por brivaracetam a un nivel de exposición de 6 veces el AUC clínica fueron similares a los observados en animales adultos. No hubo efectos adversos sobre ninguna variable estándar de desarrollo o de maduración.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Citrato de sodio
Ácido cítrico anhidro (para ajuste de pH)
Parahidroxibenzoato de metilo (E218)
Carmelosa sódica Sucralosa Sorbitol líquido Glicerol (E422)
Aroma de frambuesa (propilenglicol 90% - 98%)
Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
Después de la primera apertura: 5 meses.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frasco de vidrio ámbar (tipo III) de 300 ml, con un tapón blanco resistente a niños (polipropileno) en una caja que contiene también una jeringa dosificadora oral graduada de 10 ml (polipropileno, polietileno) y un adaptador para la jeringa (polietileno).
6.6 Precauciones especiales de eliminación
Ninguna especial.
La eliminación del medicamento diluido o sin diluir y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/021
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 14/01/2016
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Briviact 10 mg/ml solución inyectable y para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 10 mg de brivaracetam Cada vial de 5 ml contiene 50 mg de brivaracetam
Excipiente(s) con efecto conocido:
Cada ml de solución inyectable y para perfusión contiene 3,8 mg de sodio. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable y para perfusión (inyectable/ perfusión) Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Briviact está indicado como terapia concomitante en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en adultos y adolescentes a partir de 16 años de edad con epilepsia.
4.2 Posología y forma de administración
Posología
El tratamiento con brivaracetam puede iniciarse tanto por administración intravenosa como por administración oral. Cuando se pasa de la administración oral a la intravenosa o viceversa, se debe mantener la dosis diaria total y la frecuencia de administración. Brivaracetam solución inyectable y para perfusión es una alternativa para pacientes en los que la administración oral no es temporalmente viable.
La dosis de inicio recomendada es 50 mg/día ó 100 mg/día, según la evaluación del médico sobre la reducción de las crisis requerida frente a los posibles efectos secundarios. La dosis se debe administrar en dos dosis iguales, una por la mañana y otra por la noche. La dosis se puede ajustar en función de la respuesta individual y de la tolerabilidad del paciente en un rango de dosis de 50 mg/día a 200 mg/día.
No hay experiencia en la administración intravenosa de brivaracetam dos veces al día por un período mayor de cuatro días.
Dosis olvidadas
Si el paciente se olvida de tomar una o más dosis, se recomienda que tome una única dosis tan pronto como se acuerde y que tome la siguiente dosis a su hora normal por la mañana o por la noche. Esto puede evitar que la concentración plasmática de brivaracetam caiga por debajo del nivel de eficacia y que ocurran crisis repentinas.
Suspensión del tratamiento
Si se tiene que suspender el tratamiento con brivaracetam se recomienda hacerlo de forma gradual con reducciones de 50 mg/día semanalmente.Después de 1 semana de tratamiento con 50 mg/día, se recomienda una última semana de tratamiento con una dosis de 20 mg/día.
Poblaciones especiales
Pacientes de edad avanzada (a partir de 65 años)
No se requiere ajuste de dosis en pacientes de edad avanzada (ver sección 5.2).
La experiencia clínica en pacientes >65 años es escasa.
Insuficiencia renal
No se require ajuste de dosis en pacientes con insuficiencia renal (ver sección 5.2). Brivaracetam no está recomendado en pacientes con enfermedad renal en fase final sometidos a diálisis debido a la falta de datos.
Insuficiencia hepática
En pacientes con enfermedad hepática crónica la exposición a brivaracetam estuvo aumentada. Se debe considerar una dosis de inicio de 50 mg/día. Para todas las fases de insuficiencia hepática se recomienda una dosis máxima diaria de 150 mg dividida en 2 dosis (ver las secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de brivaracetamen niños menores de 16 años de edad.
Los datos actualmente disponibles se describen en las secciones 4.8, 5.1 y 5.2, sin embargo no se puede hacer una recomendación posológica.
Forma de administración
- Bolo intravenoso: brivaracetam se puede administrar como un bolo intravenoso sin dilución.
- Perfusión intravenosa: brivaracetam se puede diluir con un diluyente compatible y ser
administrado como perfusión intravenosa durante 15 minutos (ver sección 6.6). Este medicamento no se debe mezclar con otros medicamentos.
La inyección en bolo o la perfusión intravenosa de brivaracetam no han sido estudiadas en condiciones agudas; ej. estado epiléptico y por lo tanto no se recomienda para dicha condición.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a otros derivados de la pirrolidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Pensamientos y comportamientos suicidas
Se han notificado casos de pensamientos y comportamientos suicidas en pacientes tratados con fármacos antiepilépticos, incluyendo brivaracetam, en distintas indicaciones. Un metanálisis de ensayos controlados con placebo, aleatorizados, con fármacos antiepilépticos también ha mostrado un pequeño aumento del riesgo de pensamientos y comportamientos suicidas. Se desconoce el mecanismo de este riesgo y los datos disponibles no excluyen la posibilidad de un aumento del riesgo para brivaracetam.
Por tanto, los pacientes deben ser monitorizados para detectar signos de pensamientos y comportamientos suicidas y se debe considerar el tratamiento adecuado. Se debe aconsejar a los pacientes (y a sus cuidadores) que consulten con su médico si aparecen signos de pensamientos o comportamientos suicidas.
Insuficiencia hepática
Los datos clínicos sobre el uso de brivaracetam en pacientes con insuficiencia hepática preexistente son escasos. Se recomienda ajuste de dosis en pacientes con insuficiencia hepática (ver sección 4.2).
Contenido en sodio
La solución inyectable y para perfusión contiene 0,83 mmol (ó 19,14 mg) de sodio por vial, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios formales de interacción se han realizado sólo en adultos.
Interacciones farmacodinámicas
Tratamiento concomitante con levetiracetam
En los ensayos clínicos, aunque los datos fueron escasos, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma concomitante. No se observaron problemas de seguridad o tolerabilidad adicionales (ver sección 5.1).
Interacción con alcohol
En un estudio de interacción farmacocinético y farmacodinámico entre una dosis única de brivaracetam de 200 mg y una perfusión continua de etanol 0,6 g/l en sujetos sanos, no hubo interacción farmacocinética pero brivaracetam aproximadamente dobló el efecto del alcohol sobre la función psicomotora, la atención y la memoria. No se recomienda tomar brivaracetam con alcohol.
Interacciones farmacocinéticas
Efectos de otros agentes sobre la farmacocinética de brivaracetam
Datos in vitro sugieren que brivaracetam tiene un potencial de interacción bajo. La principal ruta de eliminación de brivaracetam es por hidrólisis independiente de CYP.
Una segunda ruta de eliminación incluye hidroxilación, mediada por CYP2C19 (ver sección 5.2).
Las concentraciones plasmáticas de brivaracetam pueden aumentar cuando se administra conjuntamente con inhibidores potentes del CYP2C19 (ej. fluconazol, fluvoxamina), pero el riesgo de una interacción mediada por el CYP2C19 clínicamente relevante se considera bajo.
Rifampicina
La administración concomitante con el inductor enzimático potente rifampicina (600 mg/día durante 5 días) en sujetos sanos, disminuye el área bajo la curva de concentraciones plasmáticas (AUC) de brivaracetam en un 45%. Los médicos prescriptores deben considerar un ajuste de la dosis de brivaracetam en pacientes que estén empezando o terminando un tratamiento con rifampicina.
Medicamentos antiepilépticos inductores enzimáticos potentes
Las concentraciones plasmáticas de brivaracetam disminuyen cuando se administra conjuntamente con medicamentos antiepilépticos inductores enzimáticos potentes (carbamazepina, fenobarbital, fenitoína) pero no se requiere ajuste de dosis (ver tabla 1).
Otros inductores enzimáticos
Otros inductores enzimáticos potentes (como la Hierba de San Juan (Hypericum perforatum)) también pueden disminuir la exposición sistémica de brivaracetam. Por tanto se debe iniciar o finalizar el tratamiento con la hierba de San Juan con precaución.
Efectos de brivaracetam sobre otros medicamentos
Brivaracetam a dosis de 50 o 150 mg/día no afectó el área bajo la curva (AUC) de midazolam (metabolizado por CYP3A4). El riesgo de interacciones CYP3A4 clínicamente relevantes se considera bajo.
Estudios in vitro han mostrado que brivaracetamno inhibe o inhibe muy poco las isoformas de CYP450, excepto la CYP2C19. Brivaracetam puede aumentar las concentraciones plasmáticas de los medicamentos metabolizados por CYP2C19 (ej. lansoprazol, omeprazol, diazepam). Cuando se ensayó in vitro brivaracetam no indujo el CYP1A1/2 pero indujo moderadamente el CYP3A4 y CYP2B6. No se encontró inducción del CYP3A4 in vivo (ver midazolam más arriba). La inducción del CYP2B6 no se ha investigado in vivo y brivaracetam puede reducir las concentraciones plasmáticas de medicamentos metabolizados por CYP2B6 (ej. efavirenz). In vitro, estudios de interacción para determinar los posibles efectos inhibitorios sobre los transportadores concluyeron que no hubo efectos clínicamente relevantes, excepto por OAT3. In vitro, Brivaracetam inhibe OAT3 con la mitad de la concentración máxima inhibitoria 42 veces superior que la Cmax a la dosis clínica más alta. Brivaracetam 200 mg/día puede aumentar las concentraciones plasmáticas de los medicamentos transportados por OAT3.
Medicamentos antiepilépticos
Las posibles interacciones entre brivaracetam (50 mg/día a 200 mg/día) y otros medicamentos antiepilépticos se investigaron en un análisis conjunto de las concentraciones plasmáticas del medicamento de todos los ensayos fase 2-3, en un análisis farmacocinético de la población de los ensayos fase 2-3 controlados con placebo, y en ensayos de interacción farmacológica (para los siguientes medicamentos antiepilépticos: carbamazepina, lamotrigina, fenitoína y topiramato). El efecto de las interacciones sobre las concentraciones plasmáticas se resume en la tabla 1 (aumento se indica como “t” y disminución como “j”, área bajo la curva de concentración plasmática frente al tiempo como “AUC” y concentración máxima observada como Cmax).
Tabla 1: Interacciones farmacocinéticas entre brivaracetam y otros medicamentos antiepilépticos
|
Medicamentos antiepilépticos administrados de forma conjunta |
Influencia de los medicamentos antiepilépticos sobre la concentración plasmática de brivaracetam |
Influencia de brivaracetam sobre la concentración plasmática de los medicamentos antiepilépticos |
|
Carbamazepina |
AUC 29% j Cmax 13% j No se requiere ajuste de dosis |
Carbamazepina - Ninguna Carbamazepina-epóxido t (Ver más abajo) No se requiere ajuste de dosis |
|
Clobazam |
No hay datos disponibles |
Ninguna |
|
Clonazepam |
No hay datos disponibles |
Ninguna |
|
Lacosamida |
No hay datos disponibles |
Ninguna |
|
Lamotrigina |
Ninguna |
Ninguna |
|
Levetiracetam |
Ninguna |
Ninguna |
|
Oxcarbazepina |
Ninguna |
Ninguna (derivado monohidroxi, MHD) |
|
Fenobarbital |
AUC 19% j No se requiere ajuste de dosis |
Ninguna |
|
Fenitoína |
AUC 21% j No se requiere ajuste de dosis |
Ninguna a AUC 20% t 3 Cmax 20% t |
|
Pregabalina |
No hay datos disponibles |
Ninguna |
|
Topiramato |
Ninguna |
Ninguna |
|
Ácido valproico |
Ninguna |
Ninguna |
|
Zonisamida |
No hay datos disponibles |
Ninguna |
a de acuerdo a un estudio que implica la administración de una dosis supraterapéutica de brivaracetam de 400 mg/día
Carbamazepina
Brivaracetam es un inhibidor moderado reversible de la epóxido hidrolasa lo que conlleva a un aumento de la concentración de carbamazepina epóxido, un metabolito activo de carbamazepina. En ensayos controlados, las concentraciones plasmáticas de carbamazepina epóxido aumentaron una media del 37%, 62% y 98% con una pequeña variabilidad a dosis de brivaracetam de 50 mg/día, 100 mg/día y 200 mg/día respectivamente. No se observaron riesgos de seguridad. No hubo efecto aditivo de brivaracetam y valproato sobre el AUC de carbamazepina epóxido.
Anticonceptivos orales
La administración concomitante de brivaracetam (100 mg/día) con anticonceptivos orales que contienen etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg) no influyó en la farmacocinética de ninguna de las sustancias. Cuando brivaracetam se administró a una dosis de 400 mg/día (dos veces la dosis diaria máxima recomendada) conjuntamente con un anticonceptivo oral conteniendo etinilestradiol (0,03 mg) y levonorgestrel (0,15 mg), se observó una disminución en las áreas bajo la curva (AUCs) de los estrógenos y la progestina del 27% y 23% respectivamente, sin impacto sobre la supresión de la ovulación. No hubo cambio, en general, en los perfiles de concentración-tiempo de los marcadores endógenos estradiol, progesterona, hormona luteinizante (LH), hormona estimulante del folículo (FSH) y globulina transportadora de hormonas sexuales (SHBG).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
Las mujeres en edad fértil en tratamiento con brivaracetam deben discutir con su médico la planificación familiar y las medidas anticonceptivas (ver Embarazo).
Si una mujer decide quedarse embarazada, el uso de brivaracetam debe ser cuidadosamente reevaluado.
Embarazo
Riesgo relacionado con la epilepsia y los medicamentos antiepilépticos en general Para todos los medicamentos antiepilépticos, se ha visto que en la descendencia de las mujeres con epilepsia tratadas, la prevalencia de malformaciones es dos o tres veces mayor que la tasa de, aproximadamente, el 3% en la población general. En la población tratada con politerapia se ha notificado un aumento de malformaciones; sin embargo, no se ha esclarecido el alcance para el cual el tratamiento y/o la enfermedad subyacente es responsable. La suspensión del tratamiento antiepiléptico puede conducir a una exacerbación de la enfermedad que puede ser perjudicial para la madre y el feto.
Riesgo relacionado con brivaracetam
Hay escasos datos sobre el uso de brivaracetam en mujeres embarazadas. No hay datos de la tranferencia placentaria en humanos, pero en ratas, brivaracetam mostró que atravesiesa la placenta fácilmente (ver sección 5.3). Se desconoce el posible riesgo en humanos. Los estudios en animales no detectaron ningún potencial efecto teratogénico de brivaracetam (ver sección 5.3).
En ensayos clínicos, se utilizó brivaracetam como tratamiento concomitante, y cuando se utilizó con carbamazepina, indujo un aumento relacionado con la dosis en la concentración del metabolito activo carbamazepina-epóxido (ver sección 4.5). Nohay datos suficientes para determinar la importancia clínica de este efecto en el embarazo.
Como medida de precaución, no se debe utilizar brivaracetam durante el embarazo a no ser que sea clínicamente necesario (ej. si el beneficio para la madre supera el posible riesgo para el feto).
Lactancia
Se desconoce si brivaracetam se excreta en la leche materna. Estudios en ratas mostraron excreción de brivaracetam en la leche (ver sección 5.3). Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con brivaracetam tras considerel beneficio del medicamento para la madre. En caso de administración conjunta de brivaracetam y carbamazepina, la cantidad de carbamazepina-epóxido excretada en la leche materna puede aumentar. No hay datos suficientes para determinar la importancia clínica.
Fertilidad
No hay datos disponibles en humanos sobre el efecto de brivaracetam en la fertilidad. En ratas no hubo efecto sobre la fertilidad con brivaracetam (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utlizar máquinas
La influencia de brivaracetam sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada.
Debido a las posibles diferencias de sensibilidad individual, algunos pacientes pueden experimentar somnolencia, mareo y otros síntomas relacionados con el sistema nervioso central (SNC). Se debe advertir a los pacientes que no conduzcan ni manejen máquinas potencialmente peligrosas hasta que se hayan familiarizado con los efectos de brivaracetam sobre su capacidad para realizar dichas actividades.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En todos los ensayos controlados y no controlados en pacientes con epilepsia, 2.388 sujetos recibieronbrivaracetam, de los cuales 1.740 fueron tratados durante >6 meses, 1.363 durante >12 meses, 923 durante >24 meses y 569 durante >60 meses (5 años).
Las reacciones adversas notificadas de forma más frecuente (>10%) con el tratamiento de brivaracetam fueron: somnolencia (14,3%) y mareo (11,0%). Fueronnormalmente leves a moderadas en intensidad. Somnolencia y fatiga (8,2%) fueron notificadas con una incidencia mayor al aumentar la dosis. Los tipos de reacciones adversas notificados durante los primeros 7 días de tratamientofueron similares a los notificados durante el periodo de tratamiento total.
La tasa de abandono debido a reacciones adversas fue 3,5%, 3,4% y 4,0% para pacientes aleatorizados a brivaracetam a dosis de 50 mg/día, 100 mg/día y 200 mg/día respectivamente, y 1,7% para pacientes aleatorizados a placebo. Las reacciones adversas que de forma más frecuente condujeron al abandono del tratamiento con brivaracetam fueron mareo (0,8%) y convulsiones (0,8%).
Tabla de reacciones adversas
En la siguiente tabla se listan las reacciones adversas que se identificaron en base a la revisión completa de la base de datos de seguridad de ensayos clínicos con brivaracetam, según la frecuencia y la clasificación de órganos del sistema MedDRA.
Las frecuencias se definen de la siguiente manera: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100).Los efectos adversos se presentan en orden decreciente de gravedad dentro de cada grupo de frecuencia.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas en ensayos clínicos |
|
Infecciones e infestaciones |
Frecuente |
Gripe |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuente |
Neutropenia |
|
Trastornos del metabolismo y de la nutrición |
Frecuente |
Disminución del apetito |
|
Trastornos psiquiátricos |
Frecuente |
Depresión, ansiedad, insomnio,irritabilidad |
|
Poco frecuente |
Ideas de suicidio, trastorno psicótico, agresividad, agitación | |
|
Trastornos del sistema nervioso |
Muy frecuente |
Mareo, somnolencia |
|
Frecuente |
Convulsión, vértigo | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuente |
Infecciones del tracto respiratorio superior, tos |
|
Trastornos gastrointestinales |
Frecuente |
Náuseas, vómitos, estreñimiento |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Fatiga |
Descripción de algunas reacciones adversas seleccionadas
Neutropenia se ha notificado en el 0,5% (6/1.099) de los pacientes con brivaracetam y en el 0% (0/459) de los pacientes con placebo.Al inicio cuatro de estos sujetos tuvieron un recuento de neutrófilos más bajo, y experimentaron una disminución adicional en el recuento de neutrófilos tras iniciar el tratamiento con brivaracetam. Ninguno de los 6 casos de neutropenia fue grave, requirió tratamiento específico o condujo a la suspensión de brivaracetam y ninguno tuvo infecciones asociadas.
Las ideas de suicidio se notificaron en el 0,3% (3/1.099) de los pacientes con brivaracetam y en el 0,7% (3/459) de los pacientes con placebo.En los ensayos clínicos a corto plazo de brivaracetam en pacientes con epilepsia, no hubo casos de suicidio completado e intento de suicidio, sin embargo, ambos se notificaron en los ensayos de extensión abierta (ver sección 4.4).
Las reacciones adversas con la administración intravenosa fueron generalmente similares a las observadas con la administración oral. La administración intravenosa estuvo asociada con dolor en el lugar de la perfusión en el 2,8% de los pacientes.
Ensayos de extensión abierta
En los pacientes que fueron seguidos hasta un máximo de 8 años en los ensayos de extensión abierta, el perfil de seguridad fue similar al observado en los ensayos a corto plazo controlados con placebo.
Población pediátrica
Los datos de seguridad de los ensayos abiertos en niños desde 1 mes a<16 años de edad son escasos. Un total de 152 niños (1 mes a <16 años de edad) fueron tratados con brivaracetam en un ensayo farmacocinético y su ensayo de seguimiento relacionado. De los datos limitados disponibles, las reacciones adversas emergentes del tratamiento notificadas de forma más frecuente consideradas por el investigador como relacionadas con el medicamento fueron somnolencia (10%), pérdida del apetito (8%), fatiga (5%) y pérdida de peso (5%). El perfil de seguridad fue consistente con el que se conoce en adultos. No hay datos disponibles sobre neurodesarrollo. Actualmente no hay datos clínicos disponibles en neonatos.
Personas de edad avanzada
De las 130 personas de edad avanzada reclutadas en el programa de desarrollo fase 2/3 de brivaracetam (44 con epilepsia), 100 tenían entre 65-74 años de edad y 30 entre 75-84 años de edad. El perfil de seguridad en pacientes de edad avanzada fue similar al observado en pacientes adultos más jóvenes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reaciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V*. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
4.9 Sobredosis
Síntomas
La experiencia clínica con sobredosis de brivaracetam en humanos es escasa. Se han notificado somnolencia y mareo en sujetos sanos que tomaron una única dosis de 1.400 mg de brivaracetam.
Tratamiento de la sobredosis
No hay un antídoto específico para la sobredosis con brivaracetam. El tratamiento de una sobredosis debe incluir medidas generales de soporte. Dado que menos del 10% de brivaracetam se excreta en la orina, no se espera que la hemodiálisis aumente significativamente el aclaramiento de brivaracetam (ver sección 5.2).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX23 Mecanismo de acción
Brivaracetam muestra una alta y selectiva afinidad por la proteína 2A de la vesícula sináptica (SV2A), una glicoproteína transmembrana encontrada a nivel presináptico en las neuronas y en células endocrinas. Aunque el papel exacto de esta proteína todavía tiene que ser dilucidado, se ha visto que modula la exocitosis de los neurotransmisores. Se cree que la unión a SV2A es el mecanismo principal de la actividad anticonvulsivante de brivaracetam.
Eficacia clínica y seguridad
La eficacia de brivaracetam como terapia concomitante en el tratamiento de las crisis de inicio parcial (POS) se estableció en 3 ensayos clínicos aleatorizados, doble-ciego, controlados con placebo, a dosis fijas, multicéntricos, en sujetos a partir de 16 años de edad. La dosis diaria de brivaracetam utilizada en estos ensayos fue de 5 a 200 mg/día. Todos lo ensayos tuvieron un periodo inicial de 8 semanas seguido de un periodo de tratamiento de 12 semanas sin ajuste ascendente de la dosis.
1.558 pacientes recibieron medicamento en estudio, de los cuales 1.099 recibieron brivaracetam. El criterio de reclutamiento en el ensayo requería que los pacientes tuvieran crisis de inicio parcial no controladas a pesar del tratamiento con 1 ó 2 medicamentos antiepilépticos concomitantes. Se requirió que los pacientes tuvieran al menos 8 crisis de inicio parcial durante el periodo inicial. Las variables principales en los ensayos de fase 3 fueron el porcentaje de reducción en la frecuencia de crisis de inicio parcial frente a placebo y una tasa de respuesta del 50% basada en el 50% de reducción de la frecuencia desde el inicio.
Los medicamentos antiepilépticos tomados más frecuentemente a la entrada en el ensayo fueron carbamazepina (40,6%), lamotrigina (25,2%), valproato (20,5%), oxcarbazepina (16,0%), topiramato (13,5%), fenitoína (10,2%) y levetiracetam (9,8%). La frecuencia media de crisis al inicio en los 3 ensayos fue 9 crisis en 28 días. Los pacientes tenían una duración media de la epilepsia de aproximadamente 23 años.
Los resultadosde eficacia se resumen en la Tabla 2. En general, brivaracetam fue eficaz en el tratamiento concomitante de las crisis de inico parcial en pacientes a partir de 16 años de edad a dosis de entre 50 mg/día y 200 mg/día.
Tabla 2: Resultados Clave de Eficacia en la Frecuencia de Crisis de Inicio Parcial en 28 Días
|
Ensayo |
Placebo |
Brivaracetam * Estadísticamente significativo (valor de p) | ||
|
50 mg/día |
100 mg/día |
200 mg/día | ||
|
Ensayo N01253(1) | ||||
|
n= 96 |
n= 101 | |||
|
Tasa de respondedores del 50% |
16,7 |
32,7* (p=0.008) |
~ |
~ |
|
Porcentaje de reducción frente a placebo (%) |
NA |
22,0* (p=0.0040) |
~ |
~ |
|
Ensayo N01252(1) | ||||
|
n = 100 |
n = 99 |
n = 100 | ||
|
Tasa de respondedores del 50% |
20,0 |
27,3 (p=0.372) |
36,0(2) (p=0.023) |
~ |
|
Porcentaje de reducción frente a placebo (%) |
NA |
9,2 (p=0.0274) |
20,5(2) (p=0.0097) |
~ |
|
Ensayo N01358 | ||||
|
n = 259 |
n = 252 |
n = 249 | ||
|
Tasa de respondedores del 50% |
21,6 |
~ |
38,9 (p<0.001) |
37,8 (p<0.001) |
|
Porcentaje de reducción frente a placebo (%) |
NA |
~ |
22,8* (p<0.001) |
23,2* (p<0.001) |
n = pacientes aletorizados que recibieron al menos 1 dosis de la medicación en estudio ~ Dosis no estudiada Estadísticamente significativo
(1) Aproximadamente el 20% de los pacientes estaban tomando levetiracetam
(2) El objetivo primario para N01252 no alcanzó significación estadística basada en el procedimiento de prueba secuencial. La dosis de 100 mg/día fue nominalmente significativa.
En los ensayos clínicos, la reducción en la frecuencia de las crisis frente a placebo fue mayor con la dosis de 100 mg/día que con la de 50 mg/día. A parte de los incrementos dosis-dependientes en la incidencia de somnolencia y fatiga, brivaracetam 50 mg/día y 100 mg/día tuvieron un perfil de seguridad similar incluyendo las reacciones adversas relacionadas con el SNC y con el uso a largo plazo.
La Figura 1 muestra el porcentaje de pacientes (excluyendo los pacientes con levetiracetam concomitante) por categoría de reducción en la frecuencia de las crisis de inicio parcial desde el inicio durante 28 días en los 3 ensayos. Los pacientes con más de un 25% de aumento en las crisis de inicio parcial se muestran a la izquierda como “empeora”. Los pacientes con una mejoría en el porcentaje de reducción en la frecuencia de las crisis de inicio parcial al inicio se muestran en las 4 categorías más a la derecha. El porcentaje de pacientes con al menos una reducción del 50% en la frecuencia de las crisis fue 20,3%, 34,2%, 39,5% y 37,8% para placebo, 50 mg/día, 100 mg/día y 200 mg/día respectivamente.
Figura 1: Proporción de pacientes por categoría de respuesta para brivaracetam y placebo durante 12 semanas a lo largo de los tres ensayos pivotales doble-ciego
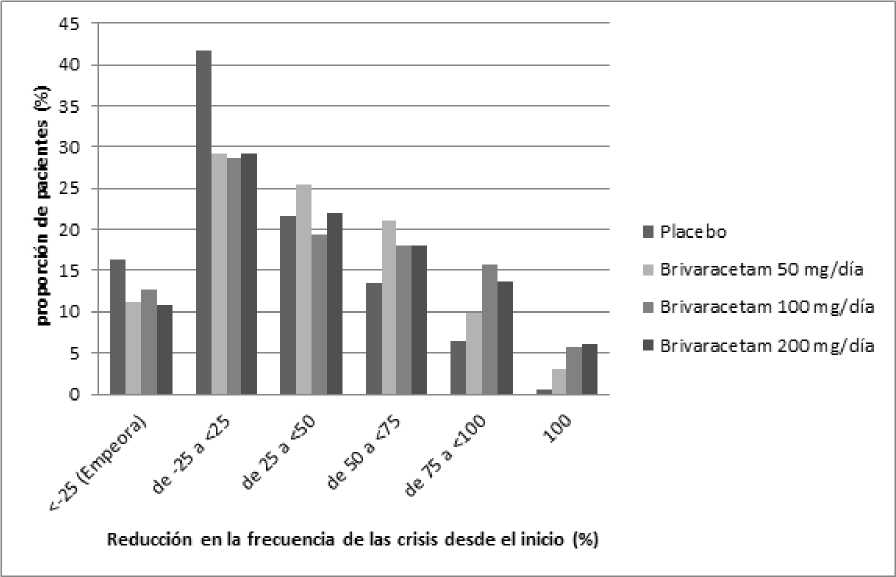
En un análisis conjunto de los tres ensayos pivotales, no se observaron diferencias en eficacia (medida como tasa de respondedores del 50%) dentro del rango de dosis de 50 mg/día a 200 mg/día cuando brivaracetam se combinó con medicamentos antiepilépticos inductores o no inductores enzimáticos.
En los ensayos clínicos el 2,5% (4/161), el 5,1% (17/332) y el 4,0% (10/249) de los pacientes con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente estuvieron libres decrisis durante el período de tratamiento de 12 semanas, comparado con el 0,5% (2/418) con placebo.
Se observó una mejoría en la media del porcentaje de reducción en la frecuencia de las crisis en 28 días en pacientes con crisis tipo IC (crisis tónico-clónicas secundarias generalizadas) tratados al inicio con brivaracetam 66,6% (n=62), el 61,2% (n=100) y el 82,1% (n=75) de los pacientes tratados con brivaracetam 50 mg/día, 100 mg/día y 200 mg/día respectivamente comparado con el 33,3% (n=115).
No se ha establecido la eficacia de brivaracetam en monoterapia.
No se recomienda el uso de brivaracetam en monoterapia.
Tratamiento con levetiracetam
En dos ensayos fase 3 aleatorizados controlados con placebo, se administró levetiracetam como medicamento antiepiléptico concomitante en alrededor del 20% de los pacientes. Aunque el número de sujetos es escaso, no se observó beneficio de brivaracetam frente a placebo en pacientes que estaban tomando levetiracetam de forma simultánea, lo que puede reflejar la competencia al sitio de unión SV2A . No se observaron problemas adicionales de seguridad o tolerabilidad.
En un tercer ensayo, un análisis pre-especificado demostró eficacia sobre placebo para 100 mg/día y 200 mg/día en pacientes con una exposición previa a levetiracetam. La menor eficacia observada en estos pacientes en comparación con pacientes de inicio con levetiracetam fue probablemente debida al mayor número de fármacos antiepilépticos anteriormente utilizados y una mayor frecuencia de las crisis basales.
Pacientes de edad avanzada (65 años de edad y mayores)
Los tres ensayos pivotales, doble-ciego, controlados con placebo incluyeron 38 pacientes de edad avanzada, con edades entre 65 y 80 años. Aunque los datos son escasos, la eficacia fue comparable a los sujetos más jóvenes.
Ensayos de extensión abierta
A lo largo de todos los ensayos, el 81,7% de los pacientes que completaron los ensayos aleatorizados fueron incluidos en los ensayos de extensión abierta a largo plazo. Desde la entrada en los ensayos aleatorizados, el 5,3% de los sujetos expuestos a brivaracetam durante 6 meses (n=1500) estuvieron libres de crisis comparado con el 4,6% y el 3,7% de los sujetos expuestos durante 12 meses (n=1188) y durante 24 meses (n=847), respectivamente. Sin embargo, como una gran proporción de pacientes (26%) abandonó el estudio abierto por una falta de eficacia, pudo producirse un sesgo de selección, puesto que los sujetos que permanecieron en el estudio respondieron mejor que aquellos que terminaron prematuramente.
Población pediátrica
No se ha establecido la eficacia y tolerabilidad de brivaracetam en pacientes pediátricos (ver sección
4.2) . Brivaracetam se evaluó en estos pacientes en un ensayo farmacocinético, abierto, a corto plazo y en el ensayo de extension abierta en curso, en 152 sujetos de 1 mes a 16 años de edad (ver sección
5.2) .
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos con brivaracetam realizados en uno o más grupos de la población pediátrica en epilepsia con crisis de inicio parcial.
5.2 Propiedades farmacocinéticas
Brivaracetam comprimidos recubiertos con película, solución oral y solución inyectable y para perfusión muestran la misma AUC, mientras que la concentración plasmática máxima es ligeramente superior tras la administración intravenosa. Brivaracetam muestra una farmacocinética lineal e independiente del tiempo con baja variabilidad intra- e inter-sujeto, y presenta una absorción completa, muy baja unión a proteínas, excreción renal tras extensa biotransformación, y metabolitos farmacológicamente inactivos.
Absorción
Brivaracetam se absorbe rápida y completamente tras su administración oral y la biodisponibilidad absoluta es aproximadamente el 100%. Eltmax medio para comprimidos tomados sin alimentos es 1 hora (rango de tmax es 0,25 a 3 h).
La administración conjunta con una comida rica en grasa disminuyó la velocidad de absorción (tmax medio 3 h) y disminuyó la concentración plasmática máxima (37% inferior) de brivaracetam, mientras que el grado de absorción permaneció inalterado.
Distribución
Brivaracetam se une débilmente (<20%) a las proteínas plasmáticas. El volumen de distribución es 0,5 l/kg, un valor cercano al de todo el agua corporal.
Debido a su lipofilidad (Log P) brivaracetam tiene una alta permeabilidad a través de las membranas celulares.
Biotransformación
Brivaracetam se metaboliza principalmente por hidrólisis del grupo amida para formar el correspondiente ácido carboxílico (aproximadamente el 60% de la eliminación), y secundariamente por hidroxilación en la cadena lateral de propilo (aproximadamente el 30% de la eliminación). La hidrólisis del grupo amida que conduce a un metabolito ácido carboxílico (34% de la dosis en orina) está mediada por la amidasa hepática y extra-hepática. La hidroxilación de brivaracetam, in vitro, está mediada principalmente por el CYP2C19. Ambos metabolitos, son posteriormente metabolizados para formar un ácido hidroxilado común. In vivo, en humanos que poseen mutaciones ineficaces del CYP2C19, la producción del metabolito hidroxilado está disminuida 10 veces mientras que brivaracetam en sí mismo está aumentado un 22% o un 42% en individuos con uno o los dos alelos mutados. Los tres metabolitos no son farmacológicamente activos.
Eliminación
Brivaracetam se elimina principalmente por metabolismo y excreción en la orina. Más del 95% de la dosis, incluyendo los metabolitos, se excreta en la orina dentro de las 72 horas posteriores a la ingesta. Menos del 1% de la dosis se excreta en las heces y menos del 10% de brivaracetam se excreta inalterado en la orina. La semivida plasmática (t1/2) terminal es aproximadamente 9 horas. Se estimó que el aclaramiento plasmático total en pacientes fue de 3,6 L/h.
Linealidad
La farmacocinética es propocional a la dosis desde 10 hasta al menos 600 mg. Interacciones con medicamentos
Brivaracetam se elimina por múltiples vías incluyendo excreción renal, hidrólisis no mediada por CYP y oxidaciones mediadas por CYP. In vitro, brivaracetamno es sustrato de la glicoproteína P (P-gp) humana, ni de proteínas resistentes a múltiples fármacos (MRP) 1 y 2, ni probablemente del polipéptido transportador de aniones orgánicos 1B1 (OATP1B1) y OATP1B3.
Ensayos in vitro mostraron que la disposición de brivaracetam no debe verse afectada significativamente por ningún inhibidor CYP (ej. CYP1A, 2C8, 2C9, 2D6 y 3A4).
In vitro, brivaracetam no fue un inhibidor de CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 3A4, o de los transportadores P-gp, BCRP, BSEP, MRP2, MATE-K, MATE-1, OATP1B1, OATP1B3, OAT1 y OCT1 a concentraciones clínicamente relevantes. In vitro, brivaracetam no indujo CYP1A2.
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada (65 años de edad y mayores)
En un ensayo en sujetos de edad avanzada (65 a 79 años de edad; con aclaramiento de creatinina de 53 a 98 ml/min/1,73 m2) que recibieron 400 mg/día de brivaracetam administrados en dos dosis, la semivida plasmática de brivaracetam fue 7,9 horas y 9,3 horas en los grupos de edad de 65 a 75 años y >75 años, respectivamente. El aclaramiento plasmático en el estado estacionario de brivaracetam fue similar (0,76 ml/min/kg) al de los sujetos varones jóvenes sanos (0,83 ml/min/kg) (ver sección 4.2)
Insuficiencia renal
Un ensayo en sujetos con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min/1,73 m2 que no requerían diálisis) reveló que el área bajo la curva (AUC) plasmático de brivaracetam estuvo moderadamente aumentado (+21%) respecto al grupo control de voluntarios sanos, mientras que el área bajo la curva de los metabolitos ácido, hidroxi e hidroxiácido estuvo aumentado 3, 4 y 21 veces, respectivamente. El aclaramiento renal de estos metabolitos inactivos estuvo disminuido 10 veces. El metabolito hidroxiácido no rebeló ningún problema de seguridad en estudios preclínicos. No se ha estudiado brivaracetam en pacientes sometidos a hemodiálisis (ver sección 4.2).
Insuficiencia hepática
Un ensayo farmacocinético en sujetos con cirrosis hepática (grados A, B y C según Child-Pugh) mostró aumentos similares en la exposición a brivaracetam independientemente de la gravedad de la enfermedad (50%, 57% y 59%), respecto al grupo control de voluntarios sanos (ver sección 4.2).
Población pediátrica
En un ensayo farmacocinético en 99 sujetos de 1 mes a <16 años de edad que recibieron brivaracetam en solución oral, las concentraciones plasmáticas fueron proporcionales a la dosis en todos los grupos de edad. Los modelos farmacocinéticos de población indicaron que la dosis de 2,0 mg/kg dos veces al día proporciona la misma concentración plasmática media del estado estacionario que en adultos que reciben 100 mg dos veces al día.
Peso corporal
Se ha estimado una disminución del 40% en la concentración plasmática del estado estacionario a lo largo del rango de peso corporal de 46 kg a 115 kg. Sin embargo, esto no se considera una diferencia clínicamente significativa en la farmacocinética de brivaracetam.
Sexo
No hay diferencias clínicamente significativas en la farmacocinética de brivaracetam según el sexo. Raza
En un modelo farmacocinético de población en pacientes epilépticos, la farmacocinética de brivaracetam no se vió afectada significativamentes por la raza (caucásica, asiática). El número de pacientes con otros orígenes étnicos fue escaso.
Relación farmacocinética/farmacodinámica
Se estimó que la CE50 (concentración plasmática de brivaracetam correspondiente al 50% del efecto máximo) es 0,57 mg/l. Esta concentración plasmática está ligeramente por encima de la exposición media obtenida tras dosis de brivaracetam de 50 mg/día. Aumentando la dosis a 100 mg/día y alcanzando un meseta a 200 mg/día se obtiene una mayor reducción en la frecuencia de las crisis.
5.3 Datos preclínicos sobre seguridad
En los estudios de farmacología de seguridad los efectos predominantes estuvieron relacionados con el SNC (principalmente depresión del SNC transitoria y disminución de la actividad locomotora espontánea), observados a dosis varias veces (más de 50) la dosis farmacológicamente activa de brivaracetam 2 mg/kg. No afectó al aprendizaje ni a la memoria.
Los hallazgos no observados en los ensayos clínicos, pero observados en los estudios toxicológicos de dosis repetidas en perros a exposiciones similares a la AUC plasmática clínica fueron efectos hepatotóxicos (principalmente porfiria). Sin embargo, los datos toxicológicos acumulados sobre brivaracetam y sobre un compuesto estructuralmente relacionado indican que los cambios en el hígado de perro se han desarrollado a través de mecanismos no relevantes para humanos. No se observaron cambios adversos en el higado en ratas y monos tras la administración crónica de brivaracetam a 5 y 42 veces el AUC clínica. En monos, signos del SNC (postrado, pérdida de equilibrio, movimientos torpes) sucedieron a 64 veces la Cmax clínica, siendo menos notables con el paso del tiempo.
Los estudios de genotoxicidad no han detectado actividad mutagénica o clastogénica. Los estudios de carcinogenicidad no indicaron ningún potencial oncogénico en ratas, mientras que el aumento de la incidencia de tumores hepatocelulares en ratones macho se consideraron resultado de un modo de acción no genotóxico ligado a la inducción de enzimas hepáticas como fenobarbital, el cual es un fenómeno conocido específico de roedores.
Brivaracetam no afecto a la fertilidad de machos ni hembras y no ha demostrado potencial teratogénico ni en ratas ni en conejos. Se observó embriotoxicidad en conejos a una dosis tóxica materna de brivaracetam con un nivel de exposición de 8 veces la exposición al AUC clínica de la dosis máxima recomendada. En ratas, brivaracetam mostró atravesar la placenta fácilmente y ser excretado en la leche de ratas en período de lactancia con concentraciones similares a los niveles plasmáticos maternos.
Brivaracetam no mostró ningún potencial dependiente en ratas.
Estudios en animales jóvenes
En ratas jóvenes, niveles de exposición a brivaracetam de 6 a 15 veces la exposición del AUC clínica a la dosis máxima recomendada indujeron efectos adversos de desarrollo (ej. mortalidad, signos clínicos, disminución del peso corporal y peso cerebral inferior). No se observaron efectos adversos sobre la función del SNC, en el examen neuropatológico y el examen histopatológico del cerebro. En perros jóvenes los cambios inducidos por brivaracetam a un nivel de exposición de 6 veces el AUC clínica fueron similares a los observados en animales adultos. No hubo efectos adversos sobre ninguna variable estándar de desarrollo o de maduración.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acetato de sodio (trihidratado)
Ácido acético glacial (para ajuste de pH)
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 3 años.
Tras la dilución, brivaracetam solución inyectable y para perfusión fue físicamente compatible y químicamente estable cuando se mezcló con los diluyentes listados en la sección 6.6 durante 24 horas y almacenado en bolsas de PVC o poliolefina a temperatura de hasta 25°C. Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente después de su dilución. En caso de no ser usado inmediatamente, el tiempo y condiciones de almacenaje previas al siguiente uso son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Para las condiciones de conservación del producto diluido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Los 10 mg/ml de solución inyectable y para perfusión se acondicionan en viales de vidrio (tipo I) de 6 ml de capacidad nominal, con tapones de goma de bromobutilo siliconizados y sellados con una cápsula extraíble de aluminio/polipropileno. Cada vial de un sólo uso contiene un volumen extraíble de no menos de 5,0 ml de solución inyectable y para perfusión.
Cada caja contiene 10 viales.
6.6 Precauciones especiales de eliminación
Este medicamento es únicamente para un solo uso, la solución no utilizada se debe desechar.
No utilizar el producto si se observan partículas o si cambia de color.
Brivaracetam solución inyectable y para perfusión es físicamente compatible y químicamente estable cuando se mezcla con los siguientes diluyentes:
Diluyentes:
- Solución inyectable de cloruro de sodio 9 mg/ml (0,9%)
- Solución inyectable de Glucosa 50 mg/ml (5%)
- Solución inyectable de Ringer lactato
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/022
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 14/01/2016
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista enel artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancianecesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA
1. NOMBRE DEL MEDICAMENTO
Briviact 10 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 10 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
14 comprimidos recubiertos con película 56 comprimidos recubiertos con película 100 x 1 comprimidos recubiertos con película 14 x 1 comprimidos recubiertos con película
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/001 14 comprimidos recubiertos con película EU/1/15/1073/002 56 comprimidos recubiertos con película EU/1/15/1073/003 100 x 1 comprimidos recubiertos con película EU/1/15/1073/023 14 x 1 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 10 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTON DEL ENVASE MÚLTIPLE (CON BLUE BOX)
Briviact 10 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 10 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
Envase múltiple: 168 (3 envases de 56) comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/004 168 (3 envases de 56) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 10 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ACONDICIONAMIENTO INTERMEDIO DEL ENVASE MÚLTIPLE (3 ENVASES DE 56 COMPRIMIDOS RECUBIERTOS CON PELÍCULA) (SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Briviact 10 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 10 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
56 comprimidos recubiertos con película. Subunidad de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Briviact 10 mg
Briviact 10 mg comprimidos brivaracetam
UCB Pharma S.A. (logo)
EXP
Lot
Días de la semana: Lun., Mar., Mie., Jue., Vie., Sab., Dom.
(excluido para los envases de 14 x1 y 100 x 1 comprimidos recubiertos con película)
Briviact 25 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 25 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
14 comprimidos recubiertos con película 56 comprimidos recubiertos con película 100 x 1 comprimidos recubiertos con película 14 x 1 comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/005 14 comprimidos recubiertos con película EU/1/15/1073/006 56 comprimidos recubiertos con película EU/1/15/1073/007 100 x 1 comprimidos recubiertos con película EU/1/15/1073/024 14 x 1 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 25 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTON DEL ENVASE MÚLTIPLE(CON BLUE BOX)
Briviact 25 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 25 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos con película)
Envase múltiple: 168 (3 envases de 56) comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/008 168 (3 envases de 56) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 25 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ACONDICIONAMIENTO INTERMEDIO DEL ENVASE MÚLTIPLE (3 ENVASES DE 56 COMPRIMIDOS RECUBIERTOS CON PELÍCULA) (SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Briviact 25 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 25 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
56 comprimidos recubiertos con película. Subunidad de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Briviact 25 mg
Briviact 25 mg comprimidos brivaracetam
UCB Pharma S.A. (logo)
EXP
Lot
Días de la semana: Lun., Mar., Mie., Jue., Vie., Sab., Dom.
(excluido para los envases de 14 x1 y 100 x 1 comprimidos recubiertos con película)
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA
1. NOMBRE DEL MEDICAMENTO
Briviact 50 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 50 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
14 comprimidos recubiertos con película 56 comprimidos recubiertos con película 100 x 1 comprimidos recubiertos con película 14 x 1 comprimidos recubiertos con película
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/009 14 comprimidos recubiertos con película EU/1/15/1073/010 56 comprimidos recubiertos con película EU/1/15/1073/011 100 x 1 comprimidos recubiertos con película EU/1/15/1073/025 14 x 1comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 50 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTON DEL ENVASE MÚLTIPLE(CON BLUE BOX)
Briviact 50 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 50 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
Envase múltiple: 168 (3 envases de 56) comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/012 168 (3 envases de 56) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 50 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ACONDICIONAMIENTO INTERMEDIO DEL ENVASE MÚLTIPLE (3 ENVASES DE 56 COMPRIMIDOS RECUBIERTOS CON PELÍCULA) (SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Briviact 50 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 50 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
56 comprimidos recubiertos con película. Subunidad de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Briviact 50 mg
Briviact 50 mg comprimidos brivaracetam
UCB Pharma S.A. (logo)
EXP
Lot
Días de la semana: Lun., Mar., Mie., Jue., Vie., Sab., Dom.
(excluido para los envases de 14 x1 y 100 x 1 comprimidos recubiertos con película)
Briviact 75 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 75 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
14 comprimidos recubiertos con película 56 comprimidos recubiertos con película 100 x 1 comprimidos recubiertos con película 14 x 1 comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/013 14 comprimidos recubiertos con película EU/1/15/1073/014 56 comprimidos recubiertos con película EU/1/15/1073/015 100 x 1 comprimidos recubiertos con película EU/1/15/1073/026 14 x 1 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 75 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTON DEL ENVASE MÚLTIPLE(CON BLUE BOX)
Briviact 75 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 75 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos con película)
Envase múltiple: 168 (3 envases de 56) comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/016 168 (3 envases de 56) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENEREALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 75 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ACONDICIONAMIENTO INTERMEDIO DEL ENVASE MÚLTIPLE (3 ENVASES DE 56 COMPRIMIDOS RECUBIERTOS CON PELÍCULA) (SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Briviact 75 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 75 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
56 comprimidos recubiertos con película. Subunidad de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Briviact 75 mg
Briviact 75 mg comprimidos brivaracetam
UCB Pharma S.A. (logo)
EXP
Lot
Días de la semana: Lun., Mar., Mie., Jue., Vie., Sab., Dom.
(excluido para los envases de 14 x1 y 100 x 1 comprimidos recubiertos con película)
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA
1. NOMBRE DEL MEDICAMENTO
Briviact 100 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 100 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
14 comprimidos recubiertos con película 56 comprimidos recubiertos con película 100 x 1 comprimidos recubiertos con película 14 x 1 comprimidos recubiertos con película
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/017 14 comprimidos recubiertos con película EU/1/15/1073/018 56 comprimidos recubiertos con película EU/1/15/1073/019 100 x 1 comprimidos recubiertos con película EU/1/15/1073/027 14 x 1 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 100 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTON DEL ENVASE MÚLTIPLE(CON BLUE BOX)
Briviact 100 mg comprimidos recubiertos con película brivaracetam
Cada comprimido recubierto con película contiene 100 mg de brivaracetam.
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
Envase múltiple: 168 (3 envases de 56) comprimidos recubiertos con película
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/020 168 (3 envases de 56) comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMACIÓN EN BRAILLE | |
|
Briviact 100 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ACONDICIONAMIENTO INTERMEDIO DEL ENVASE MÚLTIPLE (3 ENVASES DE 56 COMPRIMIDOS RECUBIERTOS CON PELÍCULA) (SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Briviact 100 mg comprimidos recubiertos con película brivaracetam
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 100 mg de brivaracetam.
3. LISTA DE EXCIPIENTES
Contiene croscarmelosa sódica, lactosa monohidrato y lactosa anhidra.
Para mayor información consultar el prospecto. (Eliminado de los cartonajes de 14 comprimidos recubiertos con película)
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
56 comprimidos recubiertos con película. Subunidad de un envase múltiple, no puede venderse por separado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Briviact 100 mg
Briviact 100 mg comprimidos brivaracetam
UCB Pharma S.A. (logo)
EXP
Lot
Días de la semana: Lun., Mar., Mie., Jue., Vie., Sab., Dom.
(excluido para los envases de 14 x1 y 100 x 1 comprimidos recubiertos con película)
Briviact 10 mg/ml solución oral brivaracetam
Cada ml de solución oral contiene 10 mg de brivaracetam.
Contiene citrato sódico, carmelosa sódica, parahidroxibenzoato de metilo (E218), sorbitol líquido y glicerol (E422).
Para mayor información consultar el prospecto. (Solo en la caja exterior)
300 ml de solución oral
Utilizar la jeringa oral de 10 ml incluida en el envase.
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Después de la primera apertura del frasco, utilizar antes de 5 meses. Fecha de apertura (Solo en la caja exterior)
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/021 solución oral con jeringa oral de 10 ml
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
|
15. |
INSTRUCCIONES DE USO | |
|
16. |
INFORMATION IN BRAILLE | |
|
Briviact 10 mg/ml (Solo en la caja exterior) | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
<Incluido el código de barras 2D que lleva el identificador único.> | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
Briviact 10 mg/ml solución inyectable y para perfusión brivaracetam
Cada ml de solución inyectable y para perfusión contiene 10 mg de brivaracetam. Un vial de 5 ml contiene 50 mg de brivaracetam.
Contiene acetato sódico (trihidrato), cloruro sódico. Para mayor información consultar el prospecto.
50 mg/5 ml
10 viales de solución inyectable y para perfusión
Leer el prospecto antes de utilizar este medicamento Vía intravenosa
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LSO MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCION DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UCB Pharma S.A.
Allée de la Recherche 60 B-1070 Bruselas Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1073/022
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
<Aceptada la justificación para no incluir la información en Braille>
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
<Incluido el código de barras 2D que lleva el identificador único.>
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
INFORMACIÓN MÍNIMA QUE DEBE FIGURAR EN CADA UNIDAD VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Briviact 10 mg/ml inyectable/ perfusión
brivaracetam
Vía IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O UNIDADES
50 mg/5 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Briviact 10 mg comprimidos recubiertos con película Briviact 25 mg comprimidos recubiertos con película Briviact 50 mg comprimidos recubiertos con película Briviact 75 mg comprimidos recubiertos con película Briviact 100 mg comprimidos recubiertos con película brivaracetam
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico,incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es Briviact y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Briviact
3. Cómo tomar Briviact
4. Posibles efectos adversos
5. Conservación de Briviact
6. Contenido del envase e información adicional
1. Qué es Briviact y para qué se utiliza
Qué es Briviact
Briviact contiene el principio activo brivaracetam. Pertenece a un grupo de medicamentos denominados “antiepilépticos”. Estos medicamentos se usan para el tratamiento de la epilepsia.
Para qué se utiliza Briviact
Briviact se utiliza en adultos y adolescentes mayores de 16 años para el tratamiento de un tipo de epilepsia caracterizada por la aparición de ‘crisis parciales’ con o sin generalización secundaria. Las crisis parciales son crisis que comienzan afectando sólo a un lado del cerebro.Estas crisis parciales pueden extenderse a áreas mayores de ambos lados del cerebro - esto se llama “generalización secundaria”. Su médico le ha recetado este medicamento para reducir el número de crisis. Briviact se utiliza junto con otros medicamentos para el tratamiento de la epilepsia.
2. Qué necesita saber antes de empezar a tomar Briviact No tome Briviact
- si es alérgico a brivaracetam o a otros derivados de la pirrolidina o a alguno de los demás
componentes de este medicamento (incluidos en la sección 6). Si no está seguro, consulte a su médico o farmacéutico antes de tomar Briviact.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Briviact:
- Si ha tenido pensamientos de hacerse daño o suicidarse. Un pequeño número de personas en tratamiento con medicamentos antiepilépticos como Briviact han tenido pensamientos de hacerse daño o suicidarse. Si tiene cualquiera de estos pensamientos, contacte inmediatamente con su médico.
- Si tiene problemas hepáticos puede que su médico necesite ajustar su dosis.
Niños y adolescentes
No se recomienda el uso de Briviact en niños y adolescentes menores de 16 años.
Toma de Briviact con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
En particular, su médico necesitará ajustar su dosis de Briviact si está tomando los siguientes medicamentos:
- Rifampicina, un medicamento usado para tratar infecciones bacterianas.
- Hierba de San Juan (también conocida como Hypericum perforatum) un medicamento a base de plantas utilizado para tratar la depresión, la ansiedad y otras afecciones.
Toma de Briviact con alcohol
No se recomienda el uso de este medicamento con alcohol.
- Si toma alcohol mientras toma Briviact los efectos negativos del alcohol pueden aumentar. Embarazo y lactancia
No se recomienda tomar Briviact si está embarazada o en periodo de lactancia, ya que se desconocen los efectos de Briviact en el embarazo, en el feto o en el recién nacido. Acuda inmediatamente a su médico si está embarazada o planea quedarse embarazada.
No interrumpa el tratamiento sin consultar primero a su médico, ya que esto podría aumentar el número de sus crisis y podría dañar a su bebé.
Conducción y uso de máquinas
- Puede sentirse somnoliento, mareado o cansado mientras toma Briviact.
- Estos efectos son más comunes al comienzo del tratamiento o después de un aumento de la dosis.
- No conduzca, monte en bicicleta o utilice cualquier herramienta o maquinaria hasta que compruebe como le afecta este medicamento.
Briviact contiene lactosa
Briviact comprimidos recubiertos con película contiene lactosa (un tipo de azúcar). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Briviact
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Usted tomará Briviact junto con otros medicamentos para tratar la epilepsia.
Dosis
- La dosis recomendada está entre 50 mg y 200 mg cada día, su médico puede que decida ajustar su dosis óptima dentro del rango de dosis.
- Tome el medicamento dos veces al día, en dos dosis igualmente divididas - una vez por la mañana y otra por la noche a la misma hora cada día.
Pacientes con problemas hepáticos
Si tiene problemas de hígado, la dosis máxima que tomará es de 150 mg cada día.
Como tomar los comprimidos de Briviact
- Trague el comprimido entero con líquido.
- El medicamento puede tomarse con o sin comida.
Duración del tratamiento
Briviact es un tratamiento de larga duración - continue tomando Briviact hasta que su médico le indique que deje de tomarlo.
Si toma más Briviact del que debe
Si toma más Briviact del que debe, consulte a su médico. Se puede sentir mareado y somnoliento.
Si olvidó tomar Briviact
- Si olvidó tomar una dosis, tómela tan pronto como se acuerde.
- Tome su siguiente dosis a la hora a la que normalmente la tomaría.
- No tome una dosis doble para compensar la dosis olvidada.
- Si no está seguro de lo que hacer, consulte con su médico o farmacéutico.
Si interrumpe el tratamiento con Briviact
- No interrumpa el tratamiento con este medicamento a menos que su medico le indique que lo haga. Esto es porque la interrupción del tratamiento podría aumentar el número de crisis que usted tiene.
- Si su médico decide interrumpir su tratamiento, él/ella le dará las instrucciones para la retirada gradual de Briviact. Esto ayudará a evitar la reaparición de sus crisis o que empeoren.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Muy frecuentes: pueden afectar a más de 1 de cada 10 pacientes.
- sensación de sueño o mareo
Frecuentes: pueden afectar hasta 1 de cada 10 pacientes.
- gripe
- sentirse muy cansado (fatiga)
- convulsión, sensación de rotación (vértigo)
- sensación de náuseas y vómitos, estreñimiento
- depresión, ansiedad, dificultad para dormir (insomnio), irritabilidad
- infecciones de nariz y garganta (tales como “resfriado común”), tos
- disminución del apetito
Poco frecuentes: Pueden afectar hasta 1 de cada 100 pacientes
- trastorno psicótico, agresividad, pensamientos o intentos de hacerse daño o suicidarse, nerviosismo (agitación)
- una disminución de los glóbulos blancos (llamada ‘neutropenia’) - que aparece en los análisis de sangre
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la
comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Briviact
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el cartonaje después de CAD y el blister después de EXP. La fecha de caducidad es el último día del mes que se indica.
- Este medicamento no requiere condiciones especiales de conservación.
- Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse delos envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Briviact
- El principio activo es brivaracetam.
- Cada comprimido recubierto con película contiene 10 mg, 25 mg, 50 mg, 75 mg o 100 mg de brivaracetam.
Los demás componentes son:
Núcleo
Croscarmelosa sódica, lactosa monohidrato, betadex, lactosa anhidra, estearato magnésico.
Cubierta del comprimido
- Comprimidos recubiertos con película de 10 mg: alcohol polivinílico, dioxido de titanio (E171), macrogol 3350, talco.
- Comprimidos recubiertos con película de 25 mg: alcohol polivinílico, dioxido de titanio (E171), macrogol 3350, talco, óxido de hierro amarillo (E172), óxido de hierro negro (E172).
- Comprimidos recubiertos con película de 50 mg: alcohol polivinílico, dioxido de titanio (E171), macrogol 3350, talco, óxido de hierro amarillo (E172), óxido de hierro rojo (E172).
- Comprimidos recubiertos con película de 75 mg: alcohol polivinílico, dióxido de titanio (E171), macrogol 3350, talco, óxido de hierro amarillo (E172), óxido de hierro rojo (E172), óxido de hierro negro (E172).
- Comprimidos recubiertos con película de 100 mg: alcohol polivinílico, dióxido de titanio (E171), macrogol 3350, talco, óxido de hierro amarillo (E172), óxido de hierro negro (E172).
Aspecto del producto y contenido del envase
Briviact 10 mg son comprimidos recubiertos con película, de color blanco a blanquecino, redondos, de
6.5 mm de diámetro y grabados en una cara con “u 10”.
Briviact 25 mg son comprimidos recubiertos con película, de color gris, ovalados, de 8,9 mm x 5,0 mm y grabados en una cara con “u 25”.
Briviact 50 mg son comprimidos recubiertos con película, de color amarillo, ovalados, de 11,7 mm x
6.6 mm y grabados en una cara con “u 50”.
Briviact 75 mg son comprimidos recubiertos con película, de color morado, ovalado, de 13,0 mm x 7,3 mm y grabados en una cara con “u 75”.
Briviact 100 mg son comprimidos recubiertos con película, de color gris verdoso, ovalado, de 14,5 mm x 8,1 mm y grabados en una cara con “u 100”.
Briviactcomprimidos están acondicionados en blisters incluidos en cajas de cartón que contienen o bien 14, 56 o 14 x 1 o 100 x 1 comprimidos recubiertos con película o en envases múltiples que contienen 168 (3 envases de 56) comprimidos recubiertos con película.
Todos los envases están disponibles en blisters PVC/PCTFE - Aluminio.
Puede que no todos los tamaños de envase estén comercializados.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
UCB Pharma, S.A., Allée de la Recherche 60, B-1070, Bruselas, Bélgica
Responsable de la fabricación
UCB Pharma, S.A., Chemin du Foriest, B-1420 Braine-l’Alleud, Bélgica.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien UCB Pharma SA/NV Tél/Tel: + 32 / (0)2 559 92 00 |
Lietuva UCB Pharma Oy Finland Tel: + 358 10 234 6800 (Suomija) |
|
Etnrapun ro CH EHEtnrapna EOOfl Ten.: + 359 (0) 2 962 30 49 |
Luxembourg/Luxemburg UCB Pharma SA/NV Tél/Tel: + 32 / (0)2 559 92 00 |
|
Ceská republika UCB s.r.o. Tel: + 420 221 773 411 |
Magyarország UCB Magyarország Kft. Tel.: + 36-(1) 391 0060 |
|
Danmark UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
Malta Pharmasud Ltd. Tel: + 356 / 21 37 64 36 |
|
Deutschland UCB Pharma GmbH Tel: + 49 /(0) 2173 48 4848 |
Nederland UCB Pharma B.V. Tel.: + 31 / (0)76-573 11 40 |
|
Eesti UCB Pharma Oy Finland Tel: + 358 10 234 6800 (Soome) |
Norge UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
|
EXXáóa UCB A.E. Tqk: + 30 / 2109974000 |
Osterreich UCB Pharma GmbH Tel: + 43 (1) 291 80 00 |
|
España UCB Pharma, S.A. Tel: + 34 / 91 570 34 44 |
Polska UCB Pharma Sp. z o.o. Tel: + 48 22 696 99 20 |
|
France UCB Pharma S.A. Tél: + 33 / (0)1 47 29 44 35 |
Portugal UCB Pharma (Produtos Farmacéuticos), Lda Tel: + 351 / 21 302 5300 |
|
Hrvatska Medis Adria d.o.o. Tel: +385 (0) 1 230 34 46 |
Romania UCB Pharma Romania S.R.L. Tel: + 40 21 300 29 04 |
|
Ireland UCB (Pharma) Ireland Ltd. |
Slovenija Medis, d.o.o. |
|
98 |
|
Tel: + 353 / (0)1-46 37 395 |
Tel: + 386 1 589 69 00 |
|
Ísland Vistor hf. Simi: + 354 535 7000 |
Slovenská republika UCB s.r.o., organizacná zlozka Tel: + 421 (0) 2 5920 2020 |
|
Italia UCB Pharma S.p.A. Tel: + 39 / 02 300 791 |
Suomi/Finland UCB Pharma Oy Finland Puh/Tel: + 358 10 234 6800 |
|
Kúnpoq Lifepharma (Z.A.M.) Ltd Tpk: + 357 22 34 74 40 |
Sverige UCB Nordic A/S Tel: + 46 / (0) 40 29 49 00 |
|
Latvija UCB Pharma OOy Finland Tel: + 358 10 234 68 00 (Somija) Fecha de la última revisión de este prospecto: Otras fuentes de información |
United Kingdom UCB Pharma Ltd. Tel: + 44 / (0)1753 53 34 655 |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Prospecto: información para el paciente
Briviact 10 mg/ml solución oral
brivaracetam
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico,incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es Briviact y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Briviact
3. Cómo tomar Briviact
4. Posibles efectos adversos
5. Conservación de Briviact
6. Contenido del envase e información adicional
1. Qué es Briviact y para qué se utiliza
Qué es Briviact
Briviact contiene el principio activo brivaracetam. Pertenece a un grupo de medicamentos denominados “antiepilépticos”. Estos medicamentos se usan para el tratamiento de la epilepsia.
Para qué se utiliza Briviact
Briviact se utiliza en adultos y adolescentes mayores de 16 años para el tratamiento de un tipo de epilepsia caracterizada por la aparición de ‘crisis parciales’ con o sin generalización secundaria. Las crisis parciales son crisis que comienzan afectando sólo a un lado del cerebro. Estas crisis parciales pueden extenderse a áreas mayores de ambos lados del cerebro - esto se llama “generalización secundaria”. Su médico le ha recetado este medicamento para reducir el número de crisis. Briviact se utiliza junto con otros medicamentos para el tratamiento de la epilepsia.
2. Qué necesita saber antes de empezar a tomar Briviact No tome Briviact
- si es alérgico a brivaracetam o a otros derivados de la pirrolidina o a alguno de los demás componentes de este medicamento (incluidos en la sección 6). Si no está seguro, consulte a su médico o farmacéutico antes de tomar Briviact.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Briviact:
- Si ha tenido pensamientos de hacerse daño o suicidarse. Un pequeño número de personas en tratamiento con medicamentos antiepilépticos como Briviact han tenido pensamientos de hacerse daño o suicidarse. Si tiene cualquiera de estos pensamientos, contacte inmediatamente con su médico.
- Si tiene problemas hepáticos puede que su médico necesite ajustar su dosis.
Niños y adolescentes
No se recomienda el uso de Briviact en niños y adolescentes menores de 16 años.
Toma de Briviact con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomadorecientemente o pudiera tener que tomar cualquier otro medicamento.
En particular, su médico necesitará ajustar su dosis de Briviact si está tomando los siguientes medicamentos:
- Rifampicina, un medicamento usado para tratar infecciones bacterianas.
- Hierba de San Juan (también conocida como Hypericum perforatum) un medicamento a base de plantas utilizado para tratar la depresión, la ansiedad y otras afecciones.
Toma de Briviact con alcohol
No se recomienda el uso de este medicamento con alcohol.
- Si toma alcohol mientras toma Briviact los efectos negativos del alcohol pueden aumentar. Embarazo y lactancia
No se recomienda tomar Briviact si está embarazada o en periodo de lactancia, ya que se desconocen los efectos de Briviact en el embarazo, en el feto o en el recién nacido. Acuda inmediatamente a su médico si está embarazada o planea quedarse embarazada.
No interrumpa el tratamiento sin consultar primero a su médico, ya que esto podría aumentar el número de sus crisis y podría dañar a su bebé.
Conducción y uso de máquinas
- Puede sentirse somnoliento, mareado o cansado mientras toma Briviact.
- Estos efectos son más comunes al comienzo del tratamiento o después de un aumento de la dosis.
- No conduzca, monte en bicicleta o utilice cualquier herramienta o maquinaria hasta que compruebe como le afecta este medicamento.
Briviact contiene parahidroxibenzoato de metilo, sodio y sorbitol
Briviact solución oral:
- Puede causar reacciones alérgicas (posiblemente retardadas) porque contiene parahidroxibenzoato de metilo (E218).
- Este medicamento contiene 1,16 miligramos de sodio por mililitro, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.Este medicamento contiene sorbitol (un tipo de azucar). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Briviact
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Usted tomará Briviact junto con otros medicamentos para tratar la epilepsia.
Dosis
- La dosis recomendada está entre 50 mg y 200 mg cada día, su médico puede que decida ajustar su dosis óptima dentro del rango de dosis.
- Tome el medicamento dos veces al día, en dos dosis igualmente divididas - una vez por la mañana y otra por la noche a la misma hora cada día.
Pacientes con problemas hepáticos
Si tiene problemas de hígado, la dosis máxima que tomará es de 150 mg cada día.
Como tomar Briviact solución oral
- Puede tomar Briviact solución oral solo o diluido en agua o zumo inmediatamente antes de tragar.
- El medicamento puede tomarse con o sin comida.
Instrucciones para el uso por pacientes/cuidadores:
- Abrir el frasco: apriete el tapón y desenrosquelo en sentido contrario a las agujas del reloj
(figura 1)

Siga estos pasos la primera vez que tome Briviact:
- Separe el adaptador de la jeringa oral (figura 2).
- Inserte el adaptador en el cuello del frasco (figura 3). Asegurese que esté bien fijo. No necesita
quitar el adaptador después de usarlo.

- Coja la jeringa oral e introduzcala en la abertura del adaptador (figura 4).
- Ponga el frasco boca abajo (figura 5)

- Sostenga el frasco boca abajo con una mano y use la otra para llenar la jeringa oral.
- Llene la jeringa oral con una pequeña cantidad de solución bajando el émbolo (figura 5A),
- Después súba el émbolo para eliminar cualquier posible burbuja (figura 5B)
- Baje el émbolo hasta la marca en la jeringa oral que corresponda con la dosis en mililitros (ml)
- Retire la jeringa oral del adaptador (figura 6B).

prescrita por su médico (figura 5C).

- Tome el medicamento - empuje el émbolo de la jeringa hasta el fondo. Puede tomar Briviact directamente de la jeringa oral. Si toma el medicamento diluido, vacíe el contenido de la jeringa oral en un vaso que contenga agua o zumo y beba todo el líquido (figura 7).

- Cierre el frasco con el tapón de rosca de plástico.
Lave la jeringa oral sólo con agua (figura 8).

Duración del tratamiento
Briviact es un tratamiento de larga duración - continué tomando Briviact hasta que su médico le indique que deje de tomarlo.
Si toma más Briviact del que debe
Si toma más Briviact del que debe, consulte a su médico. Se puede sentir mareado y somnoliento.
Si olvidó tomar Briviact
- Si olvidó tomar una dosis, tómela tan pronto como se acuerde.
- Tome su siguiente dosis a la hora a la que normalmente la tomaría.
- No tome una dosis doble para compensar la dosis olvidada.
- Si no está seguro de lo que hacer, consulte con su médico o farmacéutico.
Si interrumpe el tratamiento con Briviact
- No interrumpa el tratamiento con este medicamento a menos que su medico le indique que lo haga. Esto es porque la interrupción del tratamiento podría aumentar el número de crisis que usted tiene.
- Si su médico decide interrumpir su tratamiento, él/ella le dará las instrucciones para la retirada gradual de Briviact. Esto ayudará a evitar la reaparición de sus crisis o que empeoren.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Muy frecuentes: pueden afectar a más de 1 de cada 10 pacientes.
- sensación de sueño o mareo
Frecuentes: pueden afectar hasta 1 de cada 10 pacientes.
- gripe
- sentirse muy cansado (fatiga)
- convulsión, sensación de rotación (vértigo)
- sensación de náuseas y vómitos, estreñimiento
- depresión, ansiedad, dificultad para dormir (insomnio), irritabilidad
- infecciones de nariz y garganta (tales como “resfriado común”), tos
- disminución del apetito
Poco frecuentes: Pueden afectar hasta 1 de cada 100 pacientes
- trastorno psicótico, agresividad, pensamientos o intentos de hacerse daño o suicidarse, nerviosismo (agitación)
- una disminución de los glóbulos blancos (llamada ‘neutropenia’) - que aparece en los análisis de sangre
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Briviact
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el cartonaje y el frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
- Después de la primera apertura del frasco, utilizar antes de 5 meses.
- Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse delos envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Briviact
- El principio activo es brivaracetam.
- Cada mililitro (ml) contiene 10 miligramos (mg) de brivaracetam.
Los demás componentes son: citrato de sodio, ácido cítrico anhidro, parahidroxibenzoato de metilo (E218), carmelosa sódica, sucralosa, sorbitol liquido, glicerol (E422), aroma de frambuesa, agua purificada.
Aspecto del producto y contenido del envase
Briviact 10 mg/ml solución oral es un líquido ligeramente viscoso, transparente, de incoloro a amarillento.
El frasco de vidrio de 300 ml de Briviact se acondiciona en una caja de cartón acompañado de una jeringa oral de 10 ml y de un adaptador para la jeringa.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
UCB Pharma, S.A., Allée de la Recherche 60, B-1070, Bruselas, Bélgica
Responsable de la fabricación
UCB Pharma, S.A., Chemin du Foriest, B-1420 Braine-l’Alleud, Bélgica.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien Lietuva
UCB Pharma SA/NV UCB Pharma Oy Finland
Tél/Tel: + 32 / (0)2 559 92 00 Tel: + 358 10 234 6800 (Suomija)
|
Etarapna ro CH EHEtarapna EOOfl Tea.: + 359 (0) 2 962 30 49 |
Luxembourg/Luxemburg UCB Pharma SA/NV Tél/Tel: + 32 / (0)2 559 92 00 |
|
Ceská republika UCB s.r.o. Tel: + 420 221 773 411 |
Magyarország UCB Magyarország Kft. Tel.: + 36-(1) 391 0060 |
|
Danmark UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
Malta Pharmasud Ltd. Tel: + 356 / 21 37 64 36 |
|
Deutschland UCB Pharma GmbH Tel: + 49 /(0) 2173 48 4848 |
Nederland UCB Pharma B.V. Tel.: + 31 / (0)76-573 11 40 |
|
Eesti UCB Pharma Oy Finland Tel: + 358 10 234 6800 (Soome) |
Norge UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
|
EXXáda UCB A.E. Tnk: + 30 / 2109974000 |
Osterreich UCB Pharma GmbH Tel: + 43 (1) 291 80 00 |
|
España UCB Pharma, S.A. Tel: + 34 / 91 570 34 44 |
Polska UCB Pharma Sp. z o.o. Tel: + 48 22 696 99 20 |
|
France UCB Pharma S.A. Tél: + 33 / (0)1 47 29 44 35 |
Portugal UCB Pharma (Produtos Farmacéuticos), Lda Tel: + 351 / 21 302 5300 |
|
Hrvatska Medis Adria d.o.o. Tel: +385 (0) 1 230 34 46 |
Romania UCB Pharma Romania S.R.L. Tel: + 40 21 300 29 04 |
|
Ireland UCB (Pharma) Ireland Ltd. Tel: + 353 / (0)1-46 37 395 |
Slovenija Medis, d.o.o. Tel: + 386 1 589 69 00 |
|
Ísland Vistor hf. Simi: + 354 535 7000 |
Slovenská republika UCB s.r.o., organizacná zlozka Tel: + 421 (0) 2 5920 2020 |
|
Italia UCB Pharma S.p.A. Tel: + 39 / 02 300 791 |
Suomi/Finland UCB Pharma Oy Finland Puh/Tel: + 358 10 234 6800 |
|
Kúnpoq Lifepharma (Z.A.M.) Ltd Tnk: + 357 22 34 74 40 |
Sverige UCB Nordic A/S Tel: + 46 / (0) 40 29 49 00 |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos:http://www.ema.europa.eu
Latvija
UCB Pharma OOy Finland Tel: + 358 10 234 68 00 (Somija)
United Kingdom
UCB Pharma Ltd.
Tel: + 44 / (0)1753 53 34 655
Prospecto: información para el paciente
Briviact 10 mg/ml solución inyectable y para perfusión
brivaracetam
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico,incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es Briviact y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Briviact
3. Cómo usar Briviact
4. Posibles efectos adversos
5. Conservación de Briviact
6. Contenido del envase e información adicional
1. Qué es Briviact y para qué se utiliza
Qué es Briviact
Briviact contiene el principio activo brivaracetam. Pertenece a un grupo de medicamentos denominados “antiepilépticos”. Estos medicamentos se usan para el tratamiento de la epilepsia.
Para qué se utiliza Briviact
Briviact se utiliza en adultos y adolescentes mayores de 16 años para el tratamiento de un tipo de epilepsia caracterizada por la aparición de ‘crisis parciales’ con o sin generalización secundaria. Las crisis parciales son crisis que comienzan afectando sólo a un lado del cerebro. Estas crisis parciales pueden extenderse a áreas mayores de ambos lados del cerebro - esto se llama “generalización secundaria”. Su médico le ha recetado este medicamento para reducir el número de crisis. Briviact se utiliza junto con otros medicamentos para el tratamiento de la epilepsia.
2. Qué necesita saber antes de empezar a usar Briviact No use Briviact
- si es alérgico a brivaracetam o a otros derivados de la pirrolidina o a alguno de los demás componentes de este medicamento (incluidos en la sección 6). Si no está seguro, consulte a su médico o farmacéutico antes de usar Briviact.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Briviact:
- Si ha tenido pensamientos de hacerse daño o suicidarse. Un pequeño número de personas en tratamiento con medicamentos antiepilépticos como Briviact han tenido pensamientos de hacerse daño o suicidarse. Si tiene cualquiera de estos pensamientos, contacte inmediatamente con su médico.
- Si tiene problemas hepáticos puede que su médico necesite ajustar su dosis.
Niños y adolescentes
No administre Briviact a niños y adolescentes menores de 16 años.
Uso de Briviact con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizadorecientemente o pudiera tener que utilizar cualquier otro medicamento.
En particular, su médico necesitará ajustar su dosis de Briviact si está tomando los siguientes medicamentos:
- Rifampicina, un medicamento usado para tratar infecciones bacterianas.
- Hierba de San Juan (también conocida como Hypericum perforatum) un medicamento a base de plantas utilizado para tratar la depresión, la ansiedad y otras afecciones.
Uso de Briviact con alcohol
No se recomienda el uso de este medicamento con alcohol.
- Si toma alcohol mientras toma Briviact los efectos negativos del alcohol pueden aumentar. Embarazo y lactancia
No se recomienda usar Briviact si está embarazada o en periodo de lactancia, ya que se desconocen los efectos de Briviact en el embarazo, en el feto o en el recién nacido. Acuda inmediatamente a su médico si está embarazada o planea quedarse embarazada.
No interrumpa el tratamiento sin consultar primero a su médico, ya que esto podría aumentar el número de sus crisis y podría dañar al bebé.
Conducción y uso de máquinas
- Usted puede sentirse somnoliento, mareado o cansado mientras usa Briviact.
- Estos efectos son más comunes al comienzo del tratamiento o después de un aumento de la dosis.
- No conduzca, monte en bicicleta o utilice cualquier herramienta o maquinaria hasta quecompruebe como le afecta este medicamento.
Briviact contiene sodio
Briviact 10 mg/ml solución inyectable y para perfusión contiene 19,14 miligramos (0,83 mmoles) de sodio por vial, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
3. Cómo usar Briviact
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Usted usará Briviact junto con otros medicamentos para tratar la epilepsia.
- Cuando comience a usar este medicamento, tomará Briviact por vía oral (como comprimidos o solución oral) o se le administrará como una inyección o perfusión.
- Briviact solución inyectable y para perfusión se utiliza durante un corto período de tiempo mientras que no pueda tomar Briviact vía oral.
- Se puede pasar de Briviact vía oral a la solución inyectable y para perfusión, y viceversa.
Dosis
- La dosis recomendada está entre 50 mg y 200 miligramos mg cada día, su médico puede que decida ajustar su dosis óptima dentro del rango de dosis.
- Le administrarán la medicación dos veces al día, en dosis igualmente divididas- una vez por la mañana y otra por la noche a la misma hora cada día.
Pacientes con problemas hepáticos
Si tiene problemas de hígado, la dosis máxima que le deben administrar es de 150 mg cada día. Como usar Briviact
Briviact se administra por un médico o una enfermera como una inyección o perfusión intravenosa. Este medicamento se inyecta lentamente en su vena o se administra como una perfusión (goteo) durante 15 minutos.
Duración del tratamiento
- Su médico decidirá durante cuantos días le deben administrar las inyecciones o la perfusión.
- Para tratamientos de larga duración con Briviact, su médico le pedirá que tome Briviact comprimidos o solución oral.
Si usa más Briviact del que debe
Si piensa que se le ha administrado demasiado Briviact, consulte inmediatamente a su médico.
Si interrumpe el tratamiento con Briviact
- No interrumpa el tratamiento con este medicamento a menos que su medico le indique que lo haga. Esto es porque la interrupción del tratamiento podría aumentar el número de crisis que usted tiene.
- Si su médico decide interrumpir su tratamiento, él/ella le dará las instrucciones para la retirada gradual de Briviact. Esto ayudará a evitar la reaparición de sus crisis o que empeoren.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Muy frecuentes: pueden afectar a más de 1 de cada 10 pacientes.
- sensación de sueño o mareo
Frecuentes: pueden afectar hasta 1 de cada 10 pacientes.
- gripe
- sentirse muy cansado (fatiga)
- convulsión, sensación de rotación (vértigo)
- sensación de náuseas y vómitos, estreñimiento
- dolor o molestias en el lugar de la inyección
- depresión, ansiedad, dificultad para dormir (insomnio), irritabilidad
- infecciones de nariz y garganta (tales como “resfriado común”), tos
- disminución del apetito
Poco frecuentes: Pueden afectar hasta 1 de cada 100 pacientes
- trastorno psicótico, agresividad, pensamientos o intentos de hacerse daño o suicidarse, nerviosismo (agitación)
- una disminución de los glóbulos blancos (llamada ‘neutropenia’) - que aparece en los análisis de sangre
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Briviact
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el cartonaje después de CAD y el vial después de EXP. La fecha de caducidad es el último día del mes que se indica.
- Briviact puede diluirse antes de ser inyectado por su médico o enfermera. En tales casos, se debe usar inmediatamente después de la dilución.
- Este medicamento no requiere condiciones especiales de conservación.
- Cada vial de Briviact solución inyectable y para perfusión debe usarse solo una vez (de un solo uso). La solución no utilizada debe desecharse.
- Solo debe usarse la solución transparente, libre de partículas y sin decoloración.
- Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse delos envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Briviact
El principio activo es brivaracetam.
- Cada ml contiene 10 mg de brivaracetam.
- Cada vial de 5 ml contiene 50 mg de brivaracetam.
Los demás componentes son: acetato sódico (trihidrato), ácido acético glacial, cloruro de sodio, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Briviact 10 mg/ml solución inyectable y para perfusión es una solución transparente, incolora y estéril. Briviact 10 mg/ml solución inyectable y para perfusión, vial de 5 ml se acondiciona en una caja de cartón con 10 viales.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
UCB Pharma, S.A., Allée de la Recherche 60, B-1070, Bruselas, Bélgica
Responsable de la fabricación
UCB Pharma, S.A., Chemin du Foriest, B-1420 Braine-l’Alleud, Bélgica.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
UCB Pharma SA/NV Tél/Tel: + 32 / (0)2 559 92 00
Etarapun
ro CH EHEtarapna EOOfl Tea.: + 359 (0) 2 962 30 49
Ceská republika UCB s.r.o.
Tel: + 420 221 773 411
Lietuva
UCB Pharma Oy Finland
Tel: + 358 10 234 6800 (Suomija)
Luxembourg/Luxemburg
UCB Pharma SA/NV Tél/Tel: + 32 / (0)2 559 92 00
Magyarország
UCB Magyarország Kft.
Tel.: + 36-(1) 391 0060
|
Danmark UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
Malta Pharmasud Ltd. Tel: + 356 / 21 37 64 36 |
|
Deutschland UCB Pharma GmbH Tel: + 49 /(0) 2173 48 4848 |
Nederland UCB Pharma B.V. Tel.: + 31 / (0)76-573 11 40 |
|
Eesti UCB Pharma Oy Finland Tel: + 358 10 234 6800 (Soome) |
Norge UCB Nordic A/S Tlf: + 45 / 32 46 24 00 |
|
ELXába UCB A.E. Tpk: + 30 / 2109974000 |
Osterreich UCB Pharma GmbH Tel: + 43 (1) 291 80 00 |
|
España UCB Pharma, S.A. Tel: + 34 / 91 570 34 44 |
Polska UCB Pharma Sp. z o.o. Tel: + 48 22 696 99 20 |
|
France UCB Pharma S.A. Tél: + 33 / (0)1 47 29 44 35 |
Portugal UCB Pharma (Produtos Farmacéuticos), Lda Tel: + 351 / 21 302 5300 |
|
Hrvatska Medis Adria d.o.o. Tel: +385 (0) 1 230 34 46 |
Romania UCB Pharma Romania S.R.L. Tel: + 40 21 300 29 04 |
|
Ireland UCB (Pharma) Ireland Ltd. Tel: + 353 / (0)1-46 37 395 |
Slovenija Medis, d.o.o. Tel: + 386 1 589 69 00 |
|
Ísland Vistor hf. Simi: + 354 535 7000 |
Slovenská republika UCB s.r.o., organizacná zlozka Tel: + 421 (0) 2 5920 2020 |
|
Italia UCB Pharma S.p.A. Tel: + 39 / 02 300 791 |
Suomi/Finland UCB Pharma Oy Finland Puh/Tel: + 358 10 234 6800 |
|
Kúrcpog Lifepharma (Z.A.M.) Ltd Tpk: + 357 22 34 74 40 |
Sverige UCB Nordic A/S Tel: + 46 / (0) 40 29 49 00 |
|
Latvija UCB Pharma OOy Finland Tel: + 358 10 234 68 00 (Somija) Fecha de la última revisión de este prospecto: Otras fuentes de información |
United Kingdom UCB Pharma Ltd. Tel: + 44 / (0)1753 53 34 655 |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Esta información está destinada únicamente a profesionales del sector sanitario:
Briviact solución inyectable y para perfusión puede administrarse como inyección en bolo o como perfusión:
• Bolo intravenoso: puede administrarse directamente sin dilución
• Perfusión intravenosa: puede administrase durante 15 minutos en un diluyente compatible
Briviact puede diluirse con las siguientes soluciones: cloruro de sodio 9 mg/ml (0,9 %), solución para inyección de glucosa 50 mg/ml (5 %) o solución de Ringer lactato.
Cada vial de Briviact solución inyectable y para perfusión debe usarse solo una vez (de un solo uso). La solución no utilizada debe desecharse (ver sección 3).
113