Botox 50 Unidades Allergan, Polvo Para Solución Inyectable
¡m
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
BOTOX 50 Unidades Allergan polvo para solución inyectable.
BOTOX 100 Unidades Allergan polvo para solución inyectable.
BOTOX 200 Unidades Allergan polvo para solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
BOTOX 50 Unidades Allergan polvo para solución inyectable.
Toxina botulínica* tipo A, 50 Unidades Allergan/vial
BOTOX 100 Unidades Allergan polvo para solución inyectable.
Toxina botulínica* tipo A, 100 Unidades Allergan/vial
BOTOX 200 Unidades Allergan polvo para solución inyectable.
Toxina botulínica* tipo A, 200 Unidades Allergan/vial
* de Clostridium botulinum
Las unidades de toxina botulínica no son intercambiables con otros medicamentos que contengan toxina botulínica.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución inyectable.
Polvo blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
BOTOX está indicado para el tratamiento de:
Trastornos neurológicos
• Espasticidad focal asociada con la deformidad dinámica del pie equino producida por espasticidad en pacientes pediátricos ambulantes con parálisis cerebral, de dos o más años de edad.
• Espasticidad focal de la muñeca y de la mano secundaria a un ictus en el adulto.
• Espasticidad focal del tobillo secundaria a un ictus en el adulto (ver sección 4.4).
• Blefarospasmo, espasmo hemifacial y distonías focales asociadas.
• Distonía cervical (tortícolis espasmódica).
• Alivio de los síntomas en los adultos que cumplen los criterios de migraña crónica (cefaleas en > 15 días al mes, de los que al menos ocho días corresponden a migraña), en los pacientes que no han respondido adecuadamente o que son intolerantes a los medicamentos profilácticos de la migraña (ver sección 4.4).
Trastornos vesicales
¡m
• Vejiga hiperactiva idiopática con síntomas de incontinencia urinaria, urgencia y frecuencia en pacientes adultos que no han respondido adecuadamente o que son intolerantes a los medicamentos anticolinérgicos.
• Incontinencia urinaria en adultos con hiperactividad neurogénica del detrusor debida a vejiga neurógena por lesión medular subcervical estable o esclerosis múltiple.
Trastornos de la piel y órganos anejos
• Hiperhidrosis primaria de la axila severa y persistente, que interfiere con las actividades de la vida cotidiana y es resistente a tratamiento tópico.
4.2 Posología y forma de administración
Posología
Las unidades de toxina botulínica no son intercambiables de un producto a otro. Las dosis recomendadas en Unidades Allergan son diferentes de otras preparaciones a base de toxina botulínica.
La migraña crónica debe diagnosticarse y BOTOX debe administrarse exclusivamente bajo la supervisión de los neurólogos que son expertos en el tratamiento de la migraña crónica.
Pacientes de edad avanzada
No se requiere un ajuste específico de dosis para los pacientes de edad avanzada. La dosificación inicial debería comenzar por la menor dosis recomendada para cada indicación. Para inyecciones repetidas, se recomienda la menor dosis efectiva con el mayor intervalo entre inyecciones indicado clínicamente. Se debe tratar con precaución a pacientes de edad avanzada con antecedentes médicos significativos y medicación concomitante. Ver secciones 4.4, 4.8 y 5.1 para más información.
Población pediátrica
No se ha demostrado la seguridad y eficacia de BOTOX en el tratamiento de cada indicación individual en niños y adolescentes menores de la edad que aparece en la siguiente tabla. No hay datos disponibles.
|
• Blefarospasmo/espasmo hemifacial |
12 años |
|
• Distonía cervical |
12 años |
|
• Espasticidad focal asociada con parálisis cerebral pediátrica |
2 años |
|
• Espasticidad de miembro superior e inferior secundaria a un ictus |
18 años |
|
• Migraña crónica (MC) |
18 años |
|
• Vejiga hiperactiva (VHI) e Hiperactividad Neurogénica del Detrusor (HND) |
18 años |
|
• Hiperhidrosis primaria de la axila |
12 años (experiencia limitada en adolescentes entre 12 y 17 años de edad) |
La siguiente información es importante:
Si se utilizan diferentes tamaños de viales de BOTOX como parte de un procedimiento de inyección, se debe tener cuidado para usar la cantidad correcta de diluyente cuando se reconstituye un número concreto de unidades por 0,1 ml. La cantidad de diluyente varía entre BOTOX 50 Unidades Allergan, BOTOX 100 Unidades Allergan y BOTOX 200 Unidades Allergan. Cada jeringa se debe etiquetar apropiadamente.
BOTOX sólo se debe reconstituir con solución para inyección estéril de cloruro sódico de 9 mg/ml (0,9%). Se debe preparar la cantidad apropiada de diluyente (ver la tabla de dilución a continuación) en la jeringa.
Este producto es para un solo uso y se debe eliminar cualquier solución restante.
Para las instrucciones de uso, manipulación y eliminación de los viales por favor ver sección 6.6.
Tabla de dilución para viales de BOTOX 50, 100 y 200 Unidades Allergan para todas las indicaciones excepto trastornos vesicales:
|
Vial de 50 Unidades |
Vial de 100 Unidades |
Vial de 200 Unidades | |
|
Dosis resultante (Unidades por 0,1 ml) |
Cantidad de diluyente (solución para inyección de cloruro sódico 9 mg/ml (0,9%)) añadido en un vial de 50 Unidades |
Cantidad de diluyente (solución para inyección de cloruro sódico 9 mg/ml (0,9%)) añadido en un vial de 100 Unidades |
Cantidad de diluyente (solución para inyección de cloruro sódico 9 mg/ml (0,9%)) añadido en un vial de 200 Unidades |
|
20 Unidades |
0,25 ml |
0,5 ml |
1 ml |
|
10 Unidades |
0,5 ml |
1 ml |
2 ml |
|
5 Unidades |
1 ml |
2 ml |
4 ml |
|
2,5 Unidades |
2 ml |
4 ml |
8 ml |
|
1,25 Unidades |
4 ml |
8 ml |
N/A |
Vejiga hiperactiva -
Se recomienda utilizar un vial de 100 Unidades o dos viales de 50 Unidades por resultar más cómoda su reconstitución.
Instrucciones para la dilución de dos viales de 50 Unidades:
• Reconstituir dos viales de 50 Unidades de BOTOX, cada uno con 5 ml de solución salina sin conservantes al 0,9% y mezclar suavemente.
• Extraer los 5 ml de cada vial en una jeringa de 10 ml.
Así se obtiene una jeringa de 10 ml que contendrá un total de 100 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Instrucciones para la dilución de un vial de 100 Unidades:
• Reconstituir un vial de 100 Unidades de BOTOX con 10 ml de solución salina sin conservantes al 0,9% y mezclar suavemente.
• Extraer los 10 ml del vial en una jeringa de 10 ml.
Así se obtiene una jeringa de 10 ml que contendrá un total de 100 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Instrucciones para la dilución de un vial de 200 Unidades:
• Reconstituir un vial de 200 Unidades de BOTOX con 8 ml de solución salina sin conservantes
al 0,9% y mezclar suavemente.
• Extraer 4 ml del vial en una jeringa de 10 ml.
• Finalizar la reconstitución añadiendo 6 ml de solución salina sin conservantes al 0,9% en la jeringa de 10 ml y mezclar suavemente.
Así se obtiene una jeringa de 10 ml que contendrá un total de 100 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Este producto es para un único uso y se debe desechar cualquier resto de producto reconstituido sin utilizar.
Incontinencia urinaria debida a hiperactividad neurogénica del detrusor
Se recomienda utilizar un vial de 200 Unidades o dos viales de 100 Unidades por resultar más cómoda su reconstitución.
Instrucciones para la dilución de 4 viales de 50 Unidades:
• Reconstituir cuatro viales de 50 Unidades de BOTOX, cada uno con 3 ml de solución salina sin conservantes al 0,9% y mezcle los viales suavemente.
• Extraer 3 ml del primer vial y 1 ml del segundo vial en una jeringa de 10 ml.
• Extraer 3 ml del tercer vial y 1 ml del cuarto vial en una segunda jeringa de 10 ml.
• Extraer los 2 ml restantes del segundo y cuarto vial en una tercera jeringa de 10 ml.
• Finalizar la reconstitución añadiendo 6 ml de solución salina sin conservantes al 0,9% en cada una de las jeringas de 10 ml, y mezclar suavemente.
Con este procedimiento, se obtienen tres jeringas de 10 ml que contendrán un total de 200 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Instrucciones para la dilución de 2 viales de 100 Unidades:
• Reconstituir dos viales de 100 Unidades de BOTOX, cada uno con 6 ml de solución salina sin conservantes al 0,9% y mezcle los viales suavemente.
• Extraer 4 ml de cada vial en cada una de las dos jeringas de 10 ml.
• Extraer los 2 ml restantes de cada vial en una tercera jeringa de 10 ml.
• Finalizar la reconstitución añadiendo 6 ml de solución salina sin conservantes al 0,9% en cada una de las jeringas de 10 ml, y mezclar suavemente.
Con este procedimiento, se obtienen tres jeringas de 10 ml que contendrán un total de 200 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Instrucciones para la dilución de un vial de 200 Unidades:
• Reconstituir un vial de 200 Unidades de BOTOX, con 6 ml de solución salina sin conservantes al 0,9% y mezcle los viales suavemente.
• Extraer 2 ml de cada vial en cada una de las tres jeringas de 10 ml.
• Finalizar la reconstitución añadiendo 8 ml de solución salina sin conservantes al 0,9% en cada una de las jeringas de 10 ml, y mezclar suavemente.
Con este procedimiento, se obtienen tres jeringas de 10 ml que contendrán un total de 200 Unidades de BOTOX reconstituido. Utilizar de inmediato después de la reconstitución en la jeringa. Desechar la solución salina no utilizada.
Forma de administración
Consultar la guía específica para cada indicación como se describe más abajo.
BOTOX solamente deberá ser administrado por médicos especialistas y con experiencia en el tratamiento y en el uso del equipo necesario.
En general no se han establecido los niveles de dosis óptimas válidas ni el número de puntos de inyección por músculo en todas las indicaciones. En estos casos, el médico estimará los regímenes individuales de tratamiento. Los niveles óptimos de dosis deben determinarse mediante ajuste individual pero no se debe exceder la dosis máxima recomendada.
Espasticidad focal asociada con parálisis cerebral infantil
Aguja estéril de 23-26 gauge / 0,60-0,45 mm
Se administra la dosis dividida en dos inyecciones, una en la cabeza medial y otra en la lateral del músculo gastrocnemio (gemelos de la pantorrilla) afectado.
Hemiplejía: la dosis inicial recomendada es de 4 Unidades/kg de peso corporal en el miembro afectado.
Diplejía: la dosis inicial recomendada es de 6 Unidades/kg de peso corporal dividida entre los miembros afectados.
200 Unidades
La mejoría clínica generalmente aparece durante las dos semanas siguientes a la inyección. La repetición de tratamiento se debe realizar cuando disminuya el efecto clínico de la inyección anterior, pero nunca con una frecuencia inferior a tres meses. Si es posible, se debe adaptar el régimen posológico para conseguir un intervalo de al menos seis meses entre las sesiones de tratamiento.
Espasticidad de miembro superior secundaria a un ictus
Aguja estéril de calibre 25, 27 ó 30. La longitud de la aguja se determinará en función de la profundidad y localización del músculo.
Puede ser útil localizar la musculatura afectada mediante electromiografía
¡m
o técnicas de neuroestimulación. La inyección del producto en múltiples puntos permitirá un contacto más uniforme entre BOTOX y las áreas musculares inervadas, lo cual es especialmente útil en los músculos de mayor tamaño.
Dosis recomendada: La dosis exacta y el número de puntos de inyección se ajustarán en cada
caso de forma individual, según el tamaño, número y localización de los músculos afectados, de la gravedad de la espasticidad, de la presencia de debilidad muscular local y de la respuesta del paciente al tratamiento previo.
En los ensayos clínicos controlados se han administrado las dosis siguientes:
|
Músculo |
Dosis total; número de puntos de inyección |
|
Flexor profundo de los dedos |
15 - 50 Unidades; 1-2 puntos |
|
Flexor superficial de los dedos |
15 - 50 Unidades; 1-2 puntos |
|
Flexor radial del carpo |
15 - 60 Unidades; 1-2 puntos |
|
Flexor cubital del carpo |
10 - 50 Unidades; 1-2 puntos |
|
Aductor del pulgar |
20 Unidades; 1-2 puntos |
|
Flexor largo del pulgar |
20 Unidades; 1-2 puntos |
Dosis total máxima: En ensayos clínicos controlados y en abiertos no controlados, se
administraron en cada sesión de tratamiento, dosis de entre 200 y 240 Unidades distribuidas entre los músculos seleccionados. No se debe reinyectar antes de que hayan transcurrido 12 semanas desde la última inyección.
Información adicional: En ensayos clínicos controlados se hizo un seguimiento de los pacientes
durante 12 semanas tras un tratamiento único. La mejoría del tono muscular se produjo en las dos semanas siguientes a la administración del tratamiento, observándose el efecto máximo entre las cuatro y seis semanas. En un estudio de seguimiento abierto, no controlado, se reinyectó nuevamente a la mayoría de los pacientes tras un intervalo de 12 a 16 semanas, cuando el efecto sobre el tono muscular había disminuido. Estos pacientes recibieron hasta cuatro inyecciones con una dosis acumulada máxima de 960 unidades en un período de 54 semanas. A criterio del médico, se podrá repetir las dosis, cuando haya disminuido el efecto de una inyección previa. La dosis de BOTOX y la distribución de los músculos a inyectar pueden cambiar en cada reinyección según el grado y patrón de la espasticidad muscular. Se deberá administrar la mínima dosis eficaz.
Espasticidad de miembro inferior secundaria a un ictus
Aguja recomendada:
Aguja estéril de calibre 25, 27 ó 30. La longitud de la aguja se determinará en función de la profundidad y localización del músculo.
Guía de administración:
Puede ser útil localizar la musculatura afectada mediante electromiografía o técnicas de neuroestimulación. La inyección del producto en múltiples puntos permitirá un contacto más uniforme entre BOTOX y las áreas musculares inervadas, lo cual es especialmente útil en los músculos de mayor tamaño.
El siguiente diagrama indica los puntos de inyección para la espasticidad de miembro inferior en adultos:
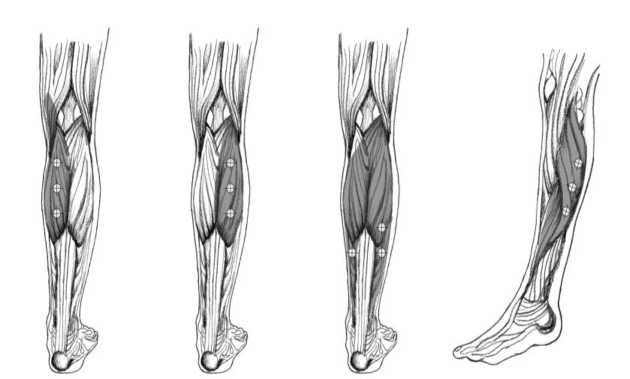
Cabeza medial Cabeza lateral Sóleo
del del
gastrocnemio gastrocnemio
Tibial posterior
Dosis recomendada:
La dosis recomendada para el tratamiento de la espasticidad de miembro inferior en adultos que afecta al tobillo es de 300 Unidades divididas entre 3 músculos.
Posología de BOTOX por músculo para la espasticidad de miembro inferior en adultos:
|
Músculo |
Dosis recomendada Dosis total; número de puntos de inyección |
|
Gastrocnemio Cabeza medial Cabeza lateral |
75 Unidades; 3 puntos 75 Unidades; 3 puntos |
|
Sóleo |
75 Unidades; 3 puntos |
|
Tibial posterior |
75 Unidades; 3 puntos |
Información adicional:
Si el médico lo considera apropiado, debe considerarse repetir las inyecciones cuando se reduzca el efecto clínico de la inyección anterior, aunque generalmente no antes de que hayan transcurrido 12 semanas
desde la inyección anterior.
Blefarospasmo/ Espasmo hemifacial
Aguja recomendada: Aguja estéril, de calibre 27-30/ 0,40-0,30 mm
Guía de administración: No se requiere guía electromiográfica.
Dosis recomendada: La dosis inicial recomendada es de 1,25-2,5 Unidades inyectada en -los
músculos orbiculares del ojo medial y lateral del párpado superior y en el músculo orbicular del ojo lateral del párpado inferior. Si los espasmos interfieren con la visión también se pueden administrar inyecciones adicionales en la región de las cejas, en el músculo orbicular lateral y en la región facial superior.
Dosis total máxima: La dosis inicial no debe exceder las 25 Unidades por ojo. En el tratamiento
del blefarospasmo la dosis total nunca debe exceder las 100 Unidades cada 12 semanas
Información adicional: Evitando la inyección próxima al elevador palpebral superior se pueden
reducir las complicaciones de ptosis. Evitando las inyecciones en la zona medial del párpado inferior y por tanto disminuyendo la difusión hacia el músculo oblicuo inferior, se pueden reducir posibles complicaciones de diplopia. Los gráficos que aparecen a continuación muestran los posibles puntos de inyección:
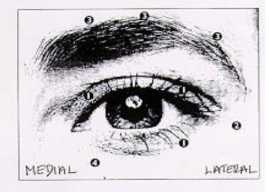
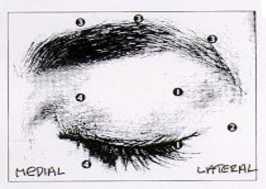
En general, el efecto inicial de las inyecciones se manifiesta durante los tres días siguientes y alcanza un máximo una o dos semanas después del tratamiento. Cada tratamiento dura aproximadamente tres meses, tras lo cual se puede repetir el procedimiento si fuera necesario. Al repetir el tratamiento, se puede aumentar la dosis hasta el doble si se considera insuficiente la respuesta al tratamiento inicial. Sin embargo, el beneficio derivado de inyectar más de 5,0 Unidades por sitio parece ser muy pequeño.
Normalmente, no se obtiene beneficio adicional aplicando el tratamiento con una frecuencia inferior de cada tres meses.
Los pacientes con espasmo hemifacial o con trastornos del VII par (nervio
facial) se deben tratar como a aquellos pacientes con blefarospasmo unilateral, inyectando otros músculos faciales afectados (por ejemplo, cigomático mayor, orbicular de la boca) según se requiera.
Aguja del tamaño apropiado (generalmente de calibre 25-30 / 0,50 - 0,30 mm).
En ensayos clínicos, el tratamiento de la distonía cervical, generalmente implica la inyección de BOTOX en el músculo(s) esternocleidomastoideo, en el elevador de la escápula, escaleno, esplenio de la cabeza, semiespinal, largo del cuello y/o trapecio. Esta lista no es exhaustiva ya que cualquiera de los músculos responsables de controlar la posición de la cabeza puede estar implicado y por tanto requerir tratamiento.
Para seleccionar la dosis adecuada, se debe tener en cuenta la masa muscular y el grado de hipertrofia o atrofia muscular. Los patrones de activación muscular pueden cambiar de forma espontánea en la distonía cervical sin que exista un cambio en la manifestación clínica de la distonía.
En caso de existir alguna dificultad para aislar músculos individuales, las inyecciones se deben realizar con ayuda electromiográfica.
No se deben inyectar más de 200 Unidades totales en la primera sesión de terapia, ajustando la dosis en las sesiones siguientes en función de la respuesta inicial.
En los ensayos clínicos controlados iniciales para establecer la seguridad y eficacia del producto en el tratamiento de la distonía cervical, las dosis de BOTOX reconstituido inyectadas oscilaban entre 140 y 280 Unidades. En estudios más recientes, las dosis oscilan entre 95 y 360 Unidades (con una media aproximada de 240 Unidades). Al igual que con cualquier tratamiento farmacológico, se debe iniciar el mismo con la dosis eficaz más baja en pacientes que no lo hayan recibido previamente. No se deben inyectar más de 50 Unidades en un solo punto. Tampoco se deben administrar más de 100 Unidades en el músculo esternocleidomastoideo. Para reducir al mínimo la incidencia de disfagia, no se debería inyectar el esternocleidomastoideo bilateralmente.
No se debe exceder una dosis total de 300 Unidades en ninguna sesión. El número óptimo de puntos de inyección depende del tamaño del músculo. No se recomienda repetir el tratamiento en intervalos inferiores a 10 semanas.
La mejoría clínica normalmente aparece en las dos primeras semanas posteriores a la inyección. El máximo beneficio clínico generalmente se obtiene aproximadamente seis semanas después de la inyección. Según los
ím
ensayos clínicos realizados, la duración del efecto beneficioso mostró una variación substancial (de 2 a 33 semanas), con una duración típica de aproximadamente 12 semanas.
Migraña crónica
Aguja recomendada: Aguja de calibre 30 gauge y 1,25 cm de largo
Guía de administración: Las inyecciones deben dividirse en siete zonas musculares específicas de
la cabeza y el cuello, tal como se especifica en la siguiente tabla. Puede ser necesaria una aguja de 2,5 cm en la región del cuello para los pacientes con músculos del cuello sumamente gruesos. Con la excepción del músculo prócer, que debe inyectarse en un punto (línea media), se debe inyectar todos los músculos en ambos lados, administrándose la mitad del número de inyecciones en el lado izquierdo de la cabeza y el cuello, y la otra mitad, en el derecho. Si existe una o varias localizaciones predominantes del dolor, pueden administrarse más inyecciones en uno o ambos lados, hasta en tres grupos específicos de músculos (occipital, temporal y trapecio), hasta la dosis máxima por músculo que se indica en la siguiente tabla.
Los siguientes diagramas indican los puntos de inyección:
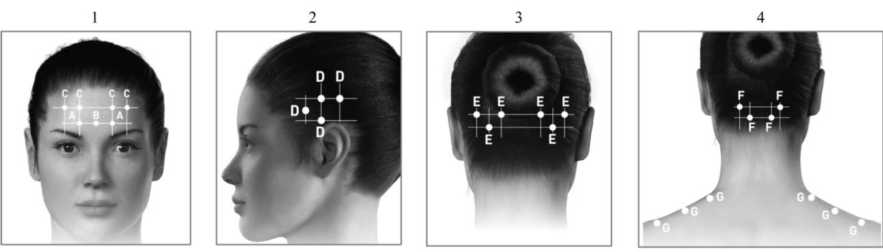
A Corrugador:5 U ■ □. Temporal:20 U ■ E. Occipital: 15 U cada lado I cada lado I cada lado
F. Cervical parae^tir 10 U cada bdo
G Trapecio: 15 U cada lado
E¡. F'róca : 5 U (sitio
único) .{*?/’ J y
C Frontal: 10 U cada laclo
Los siguientes diagramas indican los grupos musculares recomendados para inyecciones adicionales opcionales:
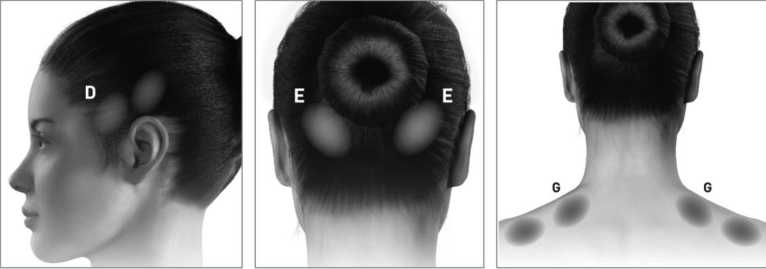
D. Temporal:5 U/punto (¿2 puntos adición des)
E. Occipital: 5 U/punto I G. Trapecio: 5 U/punto (Í2 puntos adiciónale^ I (<4 puntos adiciónale^
Dosis recomendada:
De 155 a 195 Unidades, administradas por vía intramuscular (IM), en inyecciones de 0,1 ml (5 Unidades), en 31 y hasta 39 puntos.
Posología de BOTOX por músculo para la migraña crónica:
|
Dosis recomendada | |
|
Región de la cabeza y el cuello |
Dosificación total (número de puntosa) |
|
Superciliar o corrugador de las cejasb |
10 Unidades (2 puntos) |
|
Prócer |
5 Unidades (1 punto) |
|
Frontalb |
20 Unidades (4 puntos) |
|
Temporalb |
40 Unidades (8 puntos) hasta 50 Unidades (hasta 10 puntos) |
|
Occipitalb |
30 Unidades (6 puntos) hasta 40 Unidades (hasta 8 puntos) |
|
Grupo de músculos paravertebrales cervicalesb |
20 Unidades (4 puntos) |
|
Trapeciob |
30 Unidades (6 puntos) hasta 50 Unidades (hasta 10 puntos) |
|
Rango total de dosis: |
155 a 195 Unidades 31 a 39 puntos |
aUn punto de inyección IM= 0,1 ml = 5 Unidades de BOTOX bDosis distribuida en ambos lados.
Información adicional:
El calendario recomendado de repetición del tratamiento es cada 12 semanas.
TRASTORNOS VESICALES
Los pacientes no deben presentar infección de las vías urinarias en el momento del tratamiento.
Los antibióticos profilácticos deben administrarse entre 1 y 3 días antes del tratamiento, en el día del tratamiento y entre 1 y 3 días después del mismo.
¡m
Se recomienda que los pacientes interrumpan el tratamiento con antiagregantes plaquetarios al menos 3 días antes del procedimiento de inyección. Los pacientes con tratamiento anticoagulante deben tratarse del modo adecuado a fin de reducir el riesgo de hemorragia.
BOTOX debe ser administrado por médicos con experiencia en la evaluación y tratamiento de las disfunciones vesicales (por ejemplo, urólogos y uroginecólogos) para el tratamiento de la incontinencia urinaria.
Vejiga hiperactiva:
Aguja recomendada: Se puede utilizar un cistoscopio rígido o flexible. La aguja de la inyección
debe rellenarse con aproximadamente 1 ml de BOTOX reconstituido antes del inicio de las inyecciones (dependiendo de la longitud de la aguja) para eliminar el aire.
Guía de administración: Antes de la inyección, puede utilizarse una instilación intravesical de
anestésico local diluido (con o sin sedación) según la práctica del centro.
Si se realiza una instilación con anestésico local, la vejiga debe vaciarse y enjuagarse con solución salina estéril antes de continuar con los siguientes pasos del procedimiento.
Se inyecta BOTOX reconstituido (100 Unidades/10 ml) en el músculo detrusor con ayuda de un cistoscopio rígido o flexible, evitando el trígono y la base. La vejiga debe instilarse con suficiente solución salina con el fin de alcanzar una visualización adecuada para las inyecciones, pero debe evitarse la sobredistensión.
Debe introducirse la aguja aproximadamente 2 mm en el detrusor y las 20 inyecciones, de 0,5 ml cada una (volumen total de 10 ml), deben administrarse con una distancia de en torno a 1 cm (ver el diagrama). En la inyección final, debe inyectarse aproximadamente 1 ml de solución salina estéril, de modo que se administre la dosis completa. Tras administrar las inyecciones, la solución salina empleada para la visualización de la pared de la vejiga no debe vaciarse para que los pacientes puedan probar su capacidad de vaciado antes de abandonar la clínica. Debe mantenerse al paciente en observación durante al menos 30 minutos después de las inyecciones y hasta que se haya producido un vaciado espontáneo.

Base vesical
Dosis recomendada: Información adicional:
Incontinencia urinaria debida a Aguja recomendada:
Guía de administración:
Cúpula vesical
Puntos de Inyección
Abertura del uréter izquierdo ----^
Trígono
La dosis recomendada es de 100 Unidades de BOTOX en inyecciones de 0,5 ml (5 Unidades) administradas en 20 puntos del detrusor.
La mejoría clínica suele observarse en un plazo de 2 semanas. Debe considerarse repetir las inyecciones cuando se reduzca el efecto clínico de la inyección anterior (la duración media en los estudios clínicos en fase 3 fue de 166 días [aproximadamente 24 semanas]), pero no antes de 3 meses desde la inyección anterior en la vejiga.
hiperactividad neurogénica del detrusor
Se puede utilizar un cistoscopio rígido o flexible. La aguja de la inyección debe rellenarse con aproximadamente 1 ml de BOTOX reconstituido antes del inicio de las inyecciones (dependiendo de la longitud de la aguja) para eliminar el aire.
Antes de la inyección, puede utilizarse una instilación intravesical de anestésico diluido (con o sin sedación) o bien anestesia general. Si se realiza una instilación con anestésico local, la vejiga debe vaciarse y enjuagarse con solución salina estéril antes de continuar con los siguientes pasos del procedimiento de inyección.
Se inyecta BOTOX reconstituido (200 Unidades/30 ml) en el músculo detrusor con ayuda de un cistoscopio rígido o flexible, evitando el trígono y la base. La vejiga debe instilarse con suficiente solución salina para alcanzar una visualización adecuada para las inyecciones, pero debe evitarse la sobredistensión.
Debe introducirse la aguja aproximadamente 2 mm en el detrusor y las 30 inyecciones, de 1 ml cada una (volumen total de 30 ml), deben
administrarse con una distancia de en tomo a 1 cm (ver la figura más arriba). En la inyección final, debe inyectarse aproximadamente 1 ml de solución salina estéril, de modo que se administre la dosis completa. Tras administrar las inyecciones, debe vaciarse la solución salina empleada para la visualización de la pared de la vejiga. Debe mantenerse al paciente en observación durante al menos 30 minutos después de las inyecciones.
La dosis recomendada es de 200 Unidades de BOTOX en inyecciones de 1 ml (aproximadamente 6,7 Unidades) administradas en 30 puntos del detrusor.
La mejoría clínica suele observarse en un plazo de 2 semanas. Debe considerarse repetir las inyecciones cuando se reduzca el efecto clínico de las anteriores (la duración media en los estudios clínicos de fase 3 fue de entre 256 y 295 días con 200 Unidades de BOTOX), pero no antes de 3 meses desde la inyección anterior en la vejiga.
Hiperhidrosis primaria de la axila
Aguja estéril de calibre 30 gauge.
El área hiperhidrótica se puede definir empleando técnicas estándar de tinción como por ejemplo el test de almidón-yodo de Minor.
Se inyectan 50 Unidades de BOTOX por vía intradérmica, repartidos equitativamente en distintos puntos del área hiperhidrótica de cada axila separados 1-2 cm entre sí.
No se pueden recomendar dosis distintas a las 50 Unidades por axila. No se debe repetir el tratamiento en intervalos inferiores a 16 semanas (ver sección 5.1).
La mejoría clínica normalmente aparece durante la primera semana posterior a la inyección. La repetición de la inyección de BOTOX se podrá realizar cuando disminuya el efecto clínico de la inyección anterior y el especialista lo considere necesario.
En caso de que el tratamiento no sea eficaz después de la primera sesión, es decir si después de un mes tras la inyección, no se observa mejoría clínica significativa respecto a la situación inicial, se deberán tomar las siguientes medidas:
¡m
• Verificación clínica, que puede incluir examen electromiográfico por el especialista, de la acción de la toxina en el músculo(s) inyectado.
• Analizar las causas del fallo, por ejemplo selección errónea del músculo a inyectar, dosis insuficiente, técnica de inyección no adecuada, aparición de contractura fija, músculos antagonistas demasiado débiles, formación de anticuerpos neutralizantes frente a la toxina.
• Evaluar nuevamente si es adecuado el tratamiento con toxina botulínica tipo A.
• En ausencia de cualquier efecto indeseable como resultado de la primera sesión de tratamiento, aplicar una segunda sesión teniendo en cuenta lo siguiente: a) ajustar la dosis en base al análisis de falta de respuesta al tratamiento previo; b) utilizar guía electromiográfica; y c) mantener un intervalo de tres meses entre ambas sesiones de tratamiento.
En caso de que tras inyecciones repetidas no se observe eficacia del tratamiento o disminuya el efecto, se deberán utilizar métodos de tratamiento alternativos..
4.3 Contraindicaciones
BOTOX está contraindicado en:
- individuos con hipersensibilidad conocida a toxina botulínica tipo A o a cualquiera de los excipientes de la formulación que se enumeran en la sección 6.1.
- en caso de que exista infección en el (los) punto(s) de inyección propuestos.
BOTOX también está contraindicado para el tratamiento de trastornos vesicales:
- en pacientes que presentan una infección de las vías urinarias en el momento del tratamiento;
- en pacientes con retención urinaria aguda en el momento del tratamiento, que no se cateterizan de modo rutinario;
- en pacientes que no desean o no pueden cateterizarse después del tratamiento en caso necesario.
4.4 Advertencias y precauciones especiales de empleo
No se deben sobrepasar las dosificaciones y frecuencias de administración de BOTOX recomendadas debido al riesgo de sobredosis, debilidad muscular exagerada, diseminación a distancia de la toxina y formación de anticuerpos neutralizantes. La posología inicial en el tratamiento de pacientes naive debe comenzar con la dosis mínima recomendada para la indicación específica.
Los prescriptores y los pacientes deben conocer que los efectos adversos pueden ocurrir a pesar de que las inyecciones previas hayan sido bien toleradas. Por tanto, se debe tener precaución en cada administración.
Se han notificado reacciones adversas debidas a la diseminación a distancia de la toxina (ver sección 4.8), que en algún caso ha producido la muerte del paciente, y que en algunos casos se han asociado con disfagia, neumonía y/o debilidad significativa. Los síntomas son consistentes con el mecanismo de acción de la toxina botulínica y se han notificado desde horas a semanas tras la inyección. El riesgo de los síntomas es probablemente mayor en pacientes con afecciones subyacentes y comorbilidades que les pueden predisponer a estos síntomas, incluidos niños y adultos tratados para espasticidad, y que están siendo tratados con dosis altas.
Los pacientes tratados con dosis terapéuticas también pueden experimentar debilidad muscular exagerada.
Se debe considerar las implicaciones del balance beneficio-riesgo para el paciente individual antes de plantear el tratamiento con BOTOX.
También se han descrito casos de disfagia tras la inyección en puntos distintos a la musculatura cervical (ver sección 4.4 “Distoma cervical”).
¡m
BOTOX solo se debería utilizar con extrema precaución y bajo estricta supervisión en pacientes con evidencia subclínica o clínica de trastornos de la transmisión neuromuscular, por ejemplo, miastenia gravis o Síndrome de Eaton Lambert, en pacientes con enfermedades tipo neuropatía motora periférica (por ejemplo, esclerosis lateral amiotrófica o neuropatía motora) y en pacientes con trastornos neurológicos subyacente. Estos pacientes pueden tener una sensibilidad aumentada a agentes como BOTOX, incluso a dosis terapéuticas, lo que puede dar lugar a una debilidad muscular excesiva y efectos sistémicos clínicamente significativos incluidos disfagia grave y compromiso respiratorio. El medicamento que contiene toxina botulínica se debe utilizar bajo la supervisión de un especialista en estos pacientes y sólo se debe utilizar si se considera que el beneficio del tratamiento supera el riesgo. En los pacientes con antecedentes de disfagia y aspiración se deberán extremar las precauciones para dicho tratamiento.
Se debe advertir a los pacientes o a sus cuidadores que busquen asistencia médica inmediata en el caso de que se presenten problemas para tragar, hablar o respirar.
Como con cualquier tratamiento que posibilite a los pacientes previamente sedentarios que pueda reanudar sus actividades, se debe advertir al paciente que posiblemente ha llevado una vida sedentaria durante tiempo, de que debe reanudar la actividad de manera gradual.
Antes de administrar BOTOX es necesario conocer la anatomía relevante y cualquier alteración de la misma debida a intervenciones quirúrgicas previas y se deben evitar las inyecciones en estructuras anatómicas vulnerables.
Se ha notificado neumotórax asociado con el procedimiento de inyección tras la administración de BOTOX cerca del tórax. Se necesita precaución cuando se inyecte en la proximidad del pulmón, particularmente de los ápices u otras estructuras anatómicas vulnerables.
Se han notificado reacciones adversas graves, incluyendo desenlace fatal en pacientes que recibieron inyecciones de BOTOX fuera de indicación, directamente en las glándulas salivares, la región orofaríngea y lingual, esófago y estómago. Algunos pacientes tenían disfagia o debilidad significativa previos al tratamiento.
Se han notificado raramente reacciones de hipersensibilidad graves y/o inmediatas que incluyen anafilaxia, enfermedad del suero, urticaria, edema de tejidos blandos, y disnea. Algunas de estas reacciones se han descrito tras el uso de BOTOX sólo o junto con otros productos asociados a otras reacciones similares. Si se producen tales reacciones tras la inyección de BOTOX se debe interrumpir e instituir inmediatamente un tratamiento médico apropiado inmediatamente, como epinefrina. Se ha notificado un caso de anafilaxia en el que el paciente murió después de recibir tratamiento con BOTOX inadecuadamente reconstituido con 5 ml de lidocaína al 1%.
Como con cualquier otra inyección, puede producirse una lesión asociada al procedimiento de inoculación. Una inyección puede dar lugar a una infección, dolor, inflamación, parestesia, hipoestesia, hinchazón, edema, eritema, y/o hemorragia/hematoma localizados. El dolor asociado al pinchazo con la aguja y/o ansiedad puede dar lugar a respuestas vasovagales, por ejemplo, síncope, hipotensión, etc.
Se deberá tener precaución al administrar BOTOX cuando exista inflamación en el sitio de inyección propuesto o cuando exista excesiva debilidad o atrofia en el músculo diana. También se deberá tener precaución cuando se administre BOTOX a pacientes con enfermedades neuropáticas motoras periféricas (por ejemplo, esclerosis lateral amiotrófica o neuropatía motora).
Se han descrito también algunos casos de alteraciones del sistema cardiovascular, tales como arritmia e infarto de miocardio, algunos con desenlace mortal. Algunos de los pacientes afectados, presentaban factores de riesgo tales como afección cardiovascular.
Se han descrito casos de convulsiones de nueva instauración o recurrentes, típicamente en pacientes adultos y pediátricos con predisposición a experimentar estos efectos. No se ha establecido la relación exacta de
¡m
estas reacciones adversas con la inyección de la toxina botulínica. Los casos descritos en niños eran en su mayoría procedentes de pacientes con parálisis cerebral tratados para espasticidad.
La formación de anticuerpos neutralizantes a la toxina botulínica tipo A puede reducir la efectividad del tratamiento con BOTOX inactivando la actividad biológica de la toxina. Los resultados de algunos estudios sugieren que las inyecciones de BOTOX a intervalos más frecuentes o a dosis más altas pueden provocar una mayor incidencia en la formación de anticuerpos. Cuando resulte apropiado, se puede minimizar el riesgo de formación de anticuerpos neutralizantes inyectando la mínima dosis eficaz con el máximo intervalo posible entre inyecciones.
Las fluctuaciones del efecto clínico durante el uso repetido de BOTOX (al igual que con todas las toxinas botulínicas) pueden ser debidas a los distintos procedimiento de reconstitución del vial, intervalos de inyección, músculos inyectados y ligeras variaciones en los valores de potencia debidos al método biológico empleado.
Uso pediátrico
No se ha establecido la seguridad y eficacia de BOTOX en otras indicaciones distintas a las descritas para la población pediátrica en la sección 4.1. Tras la comercialización, se han notificado muy raramente casos de posible diseminación a distancia de la toxina en pacientes pediátricos con comorbilidades, predominantemente con parálisis cerebral. En general, la dosis utilizada en estos casos fue superior a la recomendada (ver sección 4.8).
Se han notificado raramente casos de muerte algunas veces asociada a neumonía por aspiración en niños con parálisis cerebral grave tras el tratamiento con toxina botulínica, incluido el uso fuera de indicación (por ejemplo, en el área del cuello). Se debe tener precaución extrema cuando se traten pacientes pediátricos con una debilidad neurológica significativa, disfagia o que tengan antecedentes recientes de neumonía por aspiración o enfermedad pulmonar. Se debe administrar el tratamiento a aquellos pacientes con un mal estado de salud subyacente sólo si se considera que el beneficio potencial al paciente individual supera los riesgos.
TRASTORNOS NEUROLÓGICOS
Espasticidad focal asociada con la parálisis cerebral infantil y espasticidad focal del tobillo, mano y muñeca secundaria a un ictus en adultos
BOTOX es un tratamiento para la espasticidad focal cuya eficacia sólo se ha estudiado en asociación con los regímenes habituales de cuidado de estos pacientes y no está indicado como sustitutivo de los mismos. No parece que BOTOX sea eficaz para mejorar el grado de movilidad en articulaciones afectadas por una contractura fija.
BOTOX no debe utilizarse para el tratamiento de la espasticidad focal del tobillo secundaria a un ictus en pacientes adultos si no se espera que la reducción del tono muscular mejore la función (p. ej., mejoría al caminar) o los síntomas (p. ej., reducción del dolor), o que facilite el cuidado. Asimismo, la mejoría en la función activa puede verse limitada si el tratamiento con BOTOX se inicia más de 2 años después del ictus o en pacientes con una espasticidad del tobillo menos grave (Escala de Ashworth Modificada (EAM) <3).
Se debe tener precaución al tratar a pacientes adultos con espasticidad secundaria a un ictus que puedan tener un mayor riesgo de caídas.
BOTOX debe utilizarse con precaución en el tratamiento de la espasticidad focal del tobillo secundaria a un ictus en pacientes de edad avanzada con comorbilidades significativas, y únicamente se debe iniciar el tratamiento si se considera que el beneficio del mismo supera el posible riesgo.
BOTOX sólo debe utilizarse para el tratamiento de la espasticidad del miembro inferior secundaria a un ictus tras la evaluación por parte de profesionales sanitarios con experiencia en el manejo de la rehabilitación de pacientes tras un ictus.
¡m
Se han notificado espontáneamente algunos casos de muerte (a veces asociada con neumonía por aspiración) y posible diseminación a distancia de la toxina en pacientes pediátricos con comorbilidades, predominantemente con parálisis cerebral tras el tratamiento con toxina botulínica. Ver advertencias en la sección 4.4, “Uso pediátrico”.
Blefarospasmo
El parpadeo reducido debido a la inyección de toxina botulínica en el músculo orbicular puede conducir a una exposición corneal, defecto epitelial persistente, y ulceración corneal, especialmente en pacientes con trastorno nervioso del VII par. Se debe comprobar cuidadosamente la sensibilidad de la córnea en aquellos ojos que hayan sido operados previamente, para no inyectar en la región del párpado inferior y evitar el ectropión. Se debe también tratar adecuadamente cualquier defecto epitelial; esto puede requerir el uso de gotas protectoras, pomadas, lentes de contacto blandas terapéuticas o cerrar el ojo mediante parches u otros medios.
En los tejidos blandos del párpado se produce equimosis fácilmente; esto se puede reducir/minimizar aplicando presión en el sitio de inyección inmediatamente después de ésta.
Debido a la actividad anticolinérgica de la toxina botulínica, se deberá tener precaución cuando se trate a pacientes con riesgo de glaucoma de ángulo cerrado, incluyendo pacientes con ángulo anatómicamente estrecho.
Distonía cervical
Se deberá informar a los pacientes con distonía cervical de la posibilidad de que sufran disfagia que puede ser muy leve, pero podría ser grave. La disfagia puede persistir de 2 a 3 semanas tras la inyección, pero se han notificado casos en los que puede durar hasta 5 meses después de la inyección. Como consecuencia de la disfagia, puede aparecer aspiración, disnea y en algunos casos puede ser necesaria alimentación enteral asistida. En raros casos de disfagia se ha notificado tras la misma neumonía por aspiración y muerte.
La inyección de menos de 100 Unidades en el músculo esternocleidomastoideo puede reducir la incidencia de aparición de disfagia. Los pacientes con menor masa muscular en el cuello, o aquellos a los que se les inyecta el músculo esternocleidomastoideo bilateralmente, han mostrado tener mayor riesgo de aparición de disfagia. La disfagia es atribuible a la diseminación de la toxina hacia la musculatura esofágica. Las inyecciones en el músculo elevador de la escápula pueden estar asociadas con un aumento del riesgo de infección de las vías respiratorias superiores y disfagia.
La disfagia puede dar lugar a una menor ingesta de comida y agua provocando pérdida de peso y deshidratación. Los pacientes con disfagia subclínica pueden presentar un mayor riesgo de experimentar una disfagia más grave tras la inyección de BOTOX.
Migraña crónica
No se han establecido la seguridad y la eficacia en la profilaxis de cefalea en los pacientes con migraña episódica (cefaleas en < 15 días al mes) o en la cefalea de tipo tensional crónica. No se han estudiado la seguridad y la eficacia de BOTOX en los pacientes que padecen cefalea por abuso de medicamentos (trastorno de cefalea secundaria).
TRASTORNOS VESICALES
Debe tenerse especial precaución al realizar la cistoscopia.
En pacientes no cateterizados, debe evaluarse el volumen de orina residual tras la micción en las 2 semanas siguientes al tratamiento, y periódicamente del modo que resulte adecuado desde el punto de vista médico durante un máximo de 12 semanas. Debe solicitarse a los pacientes que se pongan en contacto con su médico si sufren dificultades para vaciar la vejiga, ya que puede resultar necesaria una cateterización.
Vejiga hiperactiva:
¡m
No deben ser tratados con BOTOX los pacientes varones con vejiga hiperactiva que tengan signos o síntomas de obstrucción urinaria.
Incontinencia urinaria debida a hiperactividad neurogénica del detrusor
Puede aparecer disreflexia autonómica asociada con el procedimiento. Puede necesitarse atención médica urgente.
TRASTORNOS DE LA PIEL Y ÓRGANOS ANEJOS
Hiperhidrosis _primaria de la axila
Se deberá realizar una historia clínica y un examen físico, así como las pruebas complementarias específicas que sean necesarias, para excluir posibles causas de la aparición de hiperhidrosis secundaria (por ejemplo, hipertiroidismo, feocromocitoma). Esto evitará el tratamiento sintomático de la hiperhidrosis sin el diagnóstico y/o tratamiento de la enfermedad subyacente.
4.5 Interacción con otros medicamentos y otras formas de interacción
En teoría, el efecto de la toxina botulínica se puede ver potenciado por los antibióticos aminoglucósidos o espectinomicina, o por otros fármacos que interfieran en la transmisión neuromuscular, como agentes bloqueantes neuromusculares.
Se desconoce el efecto de administrar diferentes serotipos de neurotoxina botulínica al mismo tiempo, o con meses de diferencia. La excesiva debilidad neuromuscular puede ser exacerbada por la administración de otra toxina botulínica antes de la resolución de los efectos de una toxina botulínica administrada previamente.
No se han realizado estudios de interacción. No se han descrito interacciones clínicamente significativas.
Población pediátrica
No se han realizado estudios de interacción en niños.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos suficientes sobre el uso de toxina botulínica tipo A en mujeres embarazadas. Los estudios de reproducción en animales han demostrado que existe toxicidad (ver sección 5.3). No se conoce el riesgo potencial en humanos. Por tanto, no se recomienda el uso de BOTOX durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos a no ser que sea totalmente necesario.
Lactancia
Se desconoce si BOTOX se excreta por la leche materna, por lo que no se recomienda su uso durante la lactancia.
Fertilidad
No hay datos adecuados sobre los efectos del uso de toxina botulínica tipo A en la fertilidad en mujeres en edad fértil. Estudios en ratas hembra y macho han demostrado reducción en la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos de BOTOX sobre la capacidad para conducir y utilizar máquinas. No obstante, BOTOX puede provocar astenia, debilidad muscular, mareo y trastornos visuales, lo cual puede afectar a la conducción y al uso de máquinas.
4.8 Reacciones adversas Generales
Las reacciones adversas consideradas por los investigadores como relacionadas con BOTOX en los ensayos clínicos controlados se notificaron con una frecuencia del 35% de los pacientes con blefarospasmo, en el 28% con distonía cervical, en el 17% con parálisis cerebral infantil, en el 11% con hiperhidrosis axilar primaria, en el 16 % con espasticidad focal de los miembros superiores asociada con ictus y en el 15% con espasticidad focal de los miembros inferiores asociada con ictus. En los ensayos clínicos sobre vejiga hiperactiva, la incidencia fue del 26% con el primer tratamiento y del 22% con un segundo tratamiento. En los ensayos clínicos sobre la incontinencia urinaria debida a hiperactividad neurogénica del detrusor, la incidencia fue de un 32% con el primer tratamiento, reduciéndose a un 18% con el segundo. En los ensayos clínicos sobre la migraña crónica, la incidencia fue del 26% con el primer tratamiento y se redujo al 11% con un segundo tratamiento.
En general, las reacciones adversas se producen en los días siguientes a la inyección y, siendo generalmente transitorios, pueden tener una duración de varios meses, o, en raras ocasiones, superior.
La debilidad muscular local es la acción farmacológicamente esperada de la toxina botulínica en el tejido muscular. Sin embargo, se ha notificado debilidad de los músculos adyacentes y/o lejanos del punto de inyección.
Al igual que con la administración de cualquier inyección, puede aparecer dolor localizado, inflamación, parestesia, hipoestesia, dolor a la palpación, inflamación/edema, eritema, infección localizada, hemorragia y/o hematomas. El dolor relacionado con las agujas y/o ansiedad puede resultar en respuestas vasovagales, incluyendo hipotensión sintomática transitoria y síncope. Se han notificado también casos de fiebre y síndrome gripal tras inyecciones de toxina botulínica.
Las reacciones adversas se clasifican en las siguientes categorías dependiendo de la frecuencia con la que ocurren
|
Muy frecuentes |
Afectan a más de 1 usuario de cada 10 |
|
Frecuentes |
Afecta de 1 a 10 usuarios de cada 100 |
|
Poco frecuentes |
Afecta de 1 a 10 usuarios de cada 1.000 |
|
Raras |
Afecta de 1 a 10 usuarios de cada 10.000 |
|
Muy raras |
Afecta a menos de un usuario de cada 10.000 |
Se enumeran a continuación las listas de reacciones adversas dependiendo de la parte del cuerpo donde se inyecta BOTOX.
TRASTORNOS NEUROLÓGICOS
Espasticidad focal asociada con parálisis cerebral infantil
¡m
|
Órganos | ||
|
Infecciones e infestaciones |
Infección vírica, infección de oído. |
Muy frecuentes |
|
Trastornos del sistema nervioso |
Somnolencia, alteración de la marcha, parestesia |
Frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea. |
Frecuentes |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Mialgia, debilidad muscular, dolor en la extremidad. |
Frecuentes |
|
Trastornos renales y urinarios |
Incontinencia urinaria. |
Frecuentes |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Caídas |
Frecuentes |
|
Trastornos generales y alteraciones en el lugar de administración |
Malestar, dolor en el sitio de inyección y astenia |
Frecuentes |
Espasticidadfocal del miembro superior secundaria a un ictus
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos psiquiátricos |
Depresión, insomnio |
Poco frecuentes |
|
Trastornos del sistema nervioso |
Hipertonía |
Frecuentes |
|
Hipoestesia, dolor de cabeza, parestesia, falta de coordinación, amnesia |
Poco frecuentes | |
|
Trastornos del oído y del laberinto |
Vértigo |
Poco frecuentes |
|
Trastornos vasculares |
Hipotensión ortostática |
Poco frecuentes |
|
Trastornos gastrointestinales |
Nauseas, parestesia oral |
Poco frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Equimosis, púrpura |
Frecuentes |
|
Dermatitis, prurito, erupción cutánea |
Poco frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor en extremidades, debilidad muscular |
Frecuentes |
|
Artralgia, bursitis |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor en el punto de inyección, pirexia, síndrome gripal, hemorragia, irritación en el lugar de inyección |
Frecuentes |
|
Astenia, dolor, hipersensibilidad en el punto de inyección, malestar, edema periférico |
Poco frecuentes |
Algunas de las reacciones poco frecuentes pueden estar relacionadas con la enfermedad.
Espasticidad focal del miembro inferior secundaria a un ictus
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea |
Frecuentes |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia, rigidez musculoesquelética |
Frecuentes |
|
Trastornos generales y alteraciones en el lugar de administración |
Edema periférico |
Frecuentes |
En los ensayos clínicos en los que los pacientes fueron tratados por espasticidad del miembro inferior, la incidencia de caídas fue del 5,9% y 5,3% en los grupos de BOTOX y placebo, respectivamente.
No se observó ningún cambio en el perfil de seguridad general con dosis repetidas.
¡m
Blefarospasmo, espasmo hemifacial y distonías asociadas
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos del sistema nervioso |
Mareos, paresia facial, parálisis facial |
Poco frecuentes |
|
Trastornos oculares |
Ptosis del párpado |
Muy frecuentes |
|
Queratitis punctata, lagoftalmos, ojo seco, fotofobia, irritación ocular, aumento del lagrimeo |
Frecuentes | |
|
Queratitis, ectropion, diplopía, entropion, trastorno visual, visión borrosa |
Poco frecuentes | |
|
Edema de párpado |
Raras | |
|
Queratitis ulcerativa, defecto del epitelio corneal, perforación corneal |
Muy raras | |
|
Trastornos de la piel y del tejido subcutáneo |
Equimosis |
Frecuentes |
|
Erupción cutánea, dermatitis |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Irritación, edema facial |
Frecuentes |
|
Fatiga |
Poco frecuentes |
Distonía cervical
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Infecciones e infestaciones |
Rinitis, infección del tracto respiratorio superior |
Frecuentes |
|
Trastornos del sistema nervioso |
Mareo, hipertonía, hipoestesia, somnolencia, dolor de cabeza |
Frecuentes |
|
Trastornos oculares |
Diplopía y ptosis del párpado |
Poco frecuentes |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea, disfonía |
Poco frecuentes |
|
Trastornos gastrointestinales |
Disfagia |
Muy frecuentes |
|
Sequedad de boca, nauseas |
Frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Debilidad muscular |
Muy frecuentes |
|
Rigidez musculoesquelética, dolor muscular |
Frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor |
Muy frecuentes |
|
Astenia, síndrome gripal, malestar |
Frecuentes | |
|
Pirexia |
Poco frecuentes |
Migraña crónica
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos del sistema nervioso |
Cefalea, migraña, paresia facial |
Frecuentes |
|
Trastornos oculares |
Ptosis palpebral |
Frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, erupción cutánea |
Frecuentes |
|
Dolor de la piel |
Poco frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor del cuello, mialgia, dolor musculoesquelético, rigidez musculoesquelética, espasmos musculares, tirantez muscular y debilidad muscular |
Frecuentes |
|
Dolor en la mandíbula |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor en el lugar de la inyección |
Frecuentes |
|
Trastornos gastrointestinales |
Disfagia |
Poco frecuentes |
¡m
La tasa de suspensión a causa de reacciones adversas en estos ensayos clínicos de fase 3 fue del 3,8% con BOTOX, frente al 1,2% con placebo.
TRASTORNOS VESICALES
Vejiga hiperactiva
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Infecciones e infestaciones |
Infección de las vías urinarias |
Muy frecuentes |
|
Bacteriuria |
Frecuentes | |
|
Trastornos renales y urinarios |
Disuria |
Muy frecuentes |
|
Retención urinaria, volumen residual de orina*, polaquiuria, leucocituria |
Frecuentes |
* Volumen elevado de residuo post-miccional (PVR) que no requiere cateterización.
Las reacciones adversas relacionadas con el procedimiento, categorizadas como frecuentes, fueron disuria y hematuria.
El sondaje limpio intermitente se inició en el 6,5% de los pacientes después del tratamiento con 100 Unidades de BOTOX frente al 0,4% en el grupo del placebo
De los 1242 pacientes de los estudios clínicos controlados con placebo, el 41,4% de los pacientes (n= 514) tenían >65 años y el 14,7% (n= 182) tenían >75 años. No se observó una diferencia global en el perfil de seguridad después del tratamiento con BOTOX entre los pacientes de >65 años en comparación con los pacientes de <65 años en estos estudios, salvo por la infección en las vías urinarias donde la incidencia era más alta en los pacientes de edad avanzada tanto en el grupo placebo como en el de BOTOX, en comparación con los pacientes más jóvenes.
No se observó ningún cambio en el perfil general de seguridad con la repetición de las dosis.
Incontinencia urinaria debida a hiperactividad neurogénica del detrusor
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Infecciones e infestaciones |
Infección de las vías urinarias |
Muy frecuentes |
|
Trastornos psiquiátricos |
Insomnio |
Frecuentes |
|
Trastornos gastrointestinales |
Estreñimiento |
Frecuentes |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Debilidad muscular, espasmo muscular |
Frecuentes |
|
Trastornos renales y urinarios |
Retención urinaria |
Muy frecuentes |
|
Hematuria*, disuria*, divertículo vesical |
Frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga, dificultad para andar |
Frecuentes |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Disreflexia autonómica*, caída |
Frecuentes |
* Reacciones adversas relacionadas con el procedimiento
En los ensayos clínicos, la infección de las vías urinarias se notificó en el 49,2% de los pacientes tratados con 200 Unidades de BOTOX y en el 35,7% de los tratados con placebo (el 53% de los pacientes con esclerosis múltiple tratados con 200 Unidades en comparación con el 29,3% de los tratados con placebo; el 45,4% de los pacientes con lesión medular tratados con 200 Unidades en comparación con el 41,7% de los tratados con placebo). Se notificó retención urinaria en el 17,2% de los pacientes tratados con 200
¡m
Unidades de BOTOX y el 2,9% de los tratados con placebo (el 28,8% de los pacientes con esclerosis múltiple tratados con 200 Unidades en comparación con el 4,5% de los tratados con placebo; el 5,4% de los pacientes con lesión medular tratados con 200 Unidades en comparación con el 1,4% de los tratados con placebo).
No se observaron cambios en el tipo de reacciones adversas con la repetición de la dosis.
No se observaron diferencias en la tasa anual de exacerbaciones de la esclerosis múltiple (EM) (es decir, el número de exacerbaciones de EM por paciente-año) (BOTOX=0,23, placebo=0,20) en pacientes con EM participantes en estudios pivotales.
Entre los pacientes no cateterizados antes del tratamiento, se inició el cateterismo en el 38,9% después del tratamiento con 200 Unidades de BOTOX, en comparación con el 17,3% de los tratados con placebo.
TRASTORNOS DE LA PIEL Y ÓRGANOS ANEJOS
Hiperhidrosis primaria de la axila
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos del sistema nervioso |
Dolor de cabeza, parestesia |
Frecuentes |
|
Trastornos vasculares |
Sofocos |
Frecuentes |
|
Trastornos gastrointestinales |
Nauseas |
Poco frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis (sudoración en zonas distintas a las axilas), olor anormal de la piel, prurito, nódulos subcutáneos, alopecia |
Frecuentes |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor en la extremidad |
Frecuentes |
|
Debilidad muscular, mialgia y artropatía |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor en el punto de inyección |
Muy frecuentes |
|
Dolor, edema en el sitio de inyección, hemorragia en el sitio de inyección, hipersensibilidad en el sitio de inyección, irritación en el sitio de inyección, astenia y reacciones en el punto de inyección |
Frecuentes |
En el tratamiento de la hiperhidrosis primaria de la axila, se ha detectado un aumento de la sudoración en zonas distintas de la axila en el 4,5 % de los pacientes hasta un mes después a la inyección, y no se observó un patrón definido respecto a las zonas anatómicas afectadas. En aproximadamente el 30% de los pacientes esto se resolvió en cuatro meses.
Se han notificado también casos poco frecuentes (0,7%) de debilidad del brazo, que fueron moderados, transitorios y no precisaron tratamiento, recuperándose sin secuelas. Esta reacción adversa puede estar relacionada con el tratamiento, la técnica de inyección, o ambos. En el caso poco frecuente de que aparezca debilidad muscular, se puede considerar el llevar a cabo un examen neurológico. Se recomienda además repetir la evaluación de la técnica de inyección antes de proceder a una nueva inyección, para verificar que ésta se lleva a cabo a nivel intradérmico.
En un estudio de seguridad no controlado de BOTOX (50 Unidades por axila) en pacientes pediátricos de 12 a 17 años de edad (n=144), aparecieron reacciones adversas en más de un paciente (2 pacientes cada una) incluyendo dolor en el sitio de inyección e hiperhidrosis (sudoración no axilar).
Información adicional
La siguiente lista incluye reacciones adversas al medicamento u otras reacciones adversas médicamente relevantes que se han notificado desde que el medicamento se ha comercializado, independientemente de la
¡m
indicación, y que pueden ocurrir además de las citadas en la sección 4.4. (Advertencias y precauciones especiales de empleo) y sección 4.8 (Reacciones adversas).
|
Sistema de Clasificación de Órganos |
Término preferido |
|
Trastornos del sistema inmunológico |
Anafilaxia, angioedema, enfermedad del suero, urticaria |
|
Trastornos del metabolismo y de la nutrición |
Anorexia |
|
Trastornos del sistema nervioso |
Plexopatía braquial, disfonía, disartria, paresia facial, hipoestesia, debilidad muscular, miastenia gravis, neuropatía periférica, parestesia, radiculopatía, convulsiones, síncope, parálisis facial |
|
Trastornos oculares |
Glaucoma de ángulo cerrado (para el tratamiento de blefarospasmo), estrabismo, visión borrosa, alteraciones visuales |
|
Trastornos del oído y del laberinto |
Hipoacusia, tinnitus, vértigo |
|
Trastornos cardiacos |
Arritmia, infarto de miocardio |
|
Trastornos respiratorios, torácicos y mediastínicos |
Neumonía por aspiración (algunas con fatal desenlace), disnea, depresión respiratoria, insuficiencia respiratoria |
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea, estreñimiento, sequedad de boca, disfagia, nauseas, vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia, dermatitis psoriasiforme, eritema multiforme, hiperhidrosis, madarosis, prurito, erupción |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Atrofia muscular, mialgia |
|
Trastornos generales y alteraciones en el lugar de administración |
Atrofia por denervación, malestar, pirexia |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
La sobredosis de BOTOX es un término relativo y depende de la dosis, del lugar de inyección y de las propiedades subyacentes del tejido. No se ha descrito ningún caso de toxicidad sistémica como consecuencia de la inyección accidental de BOTOX. Dosis excesivas pueden producir parálisis neuromuscular local o a distancia, generalizada y profunda.
No se han notificado casos de ingestión de BOTOX.
Los signos y síntomas de sobredosis no son aparentes inmediatamente después de la inyección. En caso de inyección o ingestión accidental o si se sospecha una sobredosis, se debe someter al paciente a monitorización médica hasta varias semanas para detectar posibles signos o síntomas progresivos de debilidad muscular, que puede ser local o a distancia del sitio de inyección, que pueden incluir ptosis, diplopia, disfagia, disartria, debilidad generalizada o fallo respiratorio. Estos pacientes se deben someter a una evaluación médica continuada y a una terapia médica inmediata, que puede incluir hospitalización.
Si se ve afectada la musculatura de la orofaringe y el esófago, se puede producir aspiración que puede llevar a sufrir una neumonía por aspiración. En caso de que se paralicen o se debiliten lo suficiente los músculos respiratorios, será necesario proceder a entubar y aplicar respiración asistida hasta la
¡m
recuperación y puede conllevar la necesidad de traqueotomía y ventilación mecánica prolongada, además de otros cuidados generales de soporte.
5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros relajantes musculares, agentes de acción periférica.
Código ATC M03A X01 Mecanismo de acción
La toxina botulínica tipo A bloquea la liberación de acetilcolina a nivel de las terminaciones nerviosas colinérgicas periféricas por escindir SNAP-25, proteína necesaria para que se produzca adecuadamente la fijación y liberación de acetilcolina de las vesículas situadas en las terminaciones nerviosas.
Efectos farmacodinámicos
Tras la inyección, la toxina inicialmente se une rápidamente y con elevada afinidad a receptores específicos de la superficie celular. A continuación, la toxina pasa a través de la membrana plasmática mediante endocitosis mediada por receptores, liberándose en el citosol. Este último paso va unido a una inhibición progresiva de la liberación de acetilcolina. Los signos clínicos se manifiestan a los 2-3 días, con un efecto máximo a las 5-6 semanas de la inyección.
Normalmente la recuperación tras la inyección intramuscular se produce a las 12 semanas de la inyección a medida que las terminales nerviosas se ramifican y conectan nuevamente con las placas terminales. Después de la inyección intradérmica, donde el objetivo son las glándulas sudoríparas ecrinas, el efecto duró por término medio 7,5 meses tras la primera inyección en los pacientes tratados con 50 Unidades por axila. No obstante, en el 27,5% de los pacientes la duración del efecto fue de 1 año o superior. No se ha estudiado la recuperación de las terminaciones nerviosas simpáticas que inervan las glándulas sudoríparas tras la inyección intradérmica con BOTOX.
Después de la administración de la inyección en el detrusor, BOTOX afecta a las vías eferentes de la actividad de este músculo inhibiendo la liberación de acetilcolina. Además, BOTOX puede inhibir los neurotransmisores aferentes y las vías sensitivas.
Eficacia clínica y seguridad TRASTORNOS NEUROLÓGICOS
Espasticidadfocal de miembro inferior secundaria a un ictus
Se realizó un estudio clínico de fase III multicéntrico, aleatorizado, controlado con placebo y doble ciego en pacientes adultos con espasticidad del miembro inferior secundaria a un ictus que afectaba al tobillo. Se aleatorizó a un total de 120 pacientes para recibir BOTOX (n=58) (dosis total de 300 Unidades) o placebo (n=62). Este estudio se llevó a cabo exclusivamente en pacientes japoneses con un valor en la Escala de Ashworth Modificada(EAM) > 3, que habían sufrido un ictus hacía 6,5 años de media.
Se observó una mejoría significativa frente a placebo en la variable primaria del cambio general desde el inicio hasta la semana 12 en la puntuación del tobillo en la EAM, que se calculó mediante el método del
¡m
área bajo la curva (AUC). También se observaron mejorías significativas frente a placebo en el cambio medio desde el inicio en la puntuación de tobillo en la EAM en las visitas individuales posteriores al tratamiento en las semanas 4, 6 y 8. En estas visitas, la proporción de pacientes respondedores (pacientes con al menos un grado de mejoría) fue también significativamente mayor en comparación con los pacientes tratados con placebo.
El tratamiento con BOTOX también se asoció a una mejoría significativa en la Impresión Clínica Global (ICG) del investigador de la discapacidad funcional (variable secundaria, sin ajuste de multiplicidad) frente a placebo. No hubo mejoría clínicamente significativa en la función de acuerdo con la Physician’s Rating Scale (PRS) y en la velocidad de la marcha.
Los resultados del estudio de fase III se presentan a continuación.
Variables de eficacia primaria y secundarias principales
|
BOTOX (N=58) |
Placebo (N=62) |
Valor de p | |
|
AUC media en la puntuación de la EAM | |||
|
AUC (día 0 a semana 12) |
-8,5 |
-5,1 |
0,006 |
|
Cambio medio con respecto al valor inicial en la puntuación de la EAM | |||
|
Inicio |
3,28 |
3,24 | |
|
Semana 1 |
-0,61 |
-0,52 |
0,222 |
|
Semana 4 |
-0,88 |
-0,43 |
<0,001 |
|
Semana 6 |
-0,91 |
-0,47 |
<0,001 |
|
Semana 8 |
-0,82 |
-0,43 |
<0,001 |
|
Semana 12 |
-0,56 |
-0,40 |
0,240 |
|
Porcentaje de respondedores* | |||
|
Semana 1 |
52,6 % |
38,7 % |
0,128 |
|
Semana 4 |
67,9 % |
30,6 % |
<0,001 |
|
Semana 6 |
68,4 % |
36,1 % |
<0,001 |
|
Semana 8 |
66,7 % |
32,8 % |
<0,001 |
|
Semana 12 |
44,4 % |
34,4 % |
0,272 |
*Pacientes con, al menos, 1 grado de mejoría con respecto al valor inicial en la puntuación de la EAM
Se observó una respuesta consistente con tratamientos repetidos.
Migraña crónica
BOTOX bloquea la liberación de los neurotransmisores relacionados con la génesis del dolor. No se ha establecido completamente el mecanismo de acción de BOTOX para el alivio de los síntomas de la migraña crónica. Los estudios preclínicos y clínicos farmacodinámicos sugieren que BOTOX suprime la sensibilización periférica, con lo cual, posiblemente también inhibe la sensibilización central.
En la siguiente tabla, se muestran los principales resultados conseguidos de los análisis de eficacia agrupados, después de dos tratamientos con BOTOX, administrados en un intervalo de 12 semanas, procedentes de dos ensayos clínicos de fase 3, en pacientes con migraña crónica, que durante un periodo inicial de 28 días habían sufrido por lo menos cuatro episodios y > 15 días de cefalea (por lo menos con
¡m
cuatro horas de cefalea continua), de los cuales un mínimo del 50% de días con cefalea eran días de migraña o probable migraña.
|
Cambio medio con respecto al inicio en la semana 24 |
BOTOX N = 688 |
Placebo N= 696 |
Valor de p |
|
Frecuencia de días con cefalea |
-8,4 |
-6,6 |
p < 0,001 |
|
Frecuencia de días con cefalea moderada o intensa |
-7,7 |
-5,8 |
p < 0,001 |
|
Frecuencia de días con migraña o probable migraña |
-8,2 |
-6,2 |
p < 0,001 |
|
% de pacientes con 50% de disminución de los días con cefalea |
47% |
35% |
p < 0,001 |
|
Total de horas acumuladas de cefalea en los días con cefalea |
-120 |
-80 |
p < 0,001 |
|
Frecuencia de episodios de cefalea |
-5.2 |
-4.9 |
p = 0,009 |
|
Puntuaciones de la prueba de repercusión total de la cefalea (HIT-6) |
-4,8 |
-2,4 |
p < 0,001 |
Aunque los estudios no tenían el poder suficiente para mostrar diferencias entre los subgrupos, se apreció un menor efecto del tratamiento en el subgrupo de pacientes de sexo masculino (N = 188) y en los pacientes no caucásicos (N = 137), que en la población total del estudio.
TRASTORNOS VESICALES
Vejiga hiperactiva
Se realizaron dos estudios clínicos de Fase III multicéntricos, aleatorizados, controlados con placebo y doble ciego, , de 24 semanas de duración, en pacientes con vejiga hiperactiva con síntomas de incontinencia urinaria, urgencia y frecuencia. Se aleatorizó a un total de 1105 pacientes, cuyos síntomas no habían sido tratados adecuadamente con al menos un tratamiento anticolinérgico (respuesta inadecuada o efectos adversos intolerables), para recibir, o bien 100 Unidades de BOTOX (n=557) o placebo (n=548).
En ambos estudios se observaron mejoras significativas en el cambio desde el momento inicial en la frecuencia diaria de episodios de incontinencia para BOTOX (100 Unidades) en comparación con placebo, en la semana 12 (al inicio fue de 5,49 para BOTOX y 5,39 para placebo), incluida la proporción de los pacientes sin incontinencia. Usando la Treatment Benefit Scale, la proporción de pacientes que notificaron una respuesta positiva al tratamiento (su estado había “mejorado notablemente” o “mejorado”) fue significativamente superior en el grupo de BOTOX en comparación con el grupo
placebo en ambos estudios. También se observaron mejoras significativas en comparación con placebo para la frecuencia diaria de los episodios de micción, urgencia y nocturia. El volumen vaciado por micción también fue significativamente superior. Se observaron mejoras significativas en todos los síntomas de vejiga hiperactiva desde la semana 2.
El tratamiento con BOTOX se asoció a unas mejoras significativas con respecto al placebo en la calidad de vida relacionada con la salud, medida con el Cuestionario de Calidad de Vida específico para la Incontinencia (I-QOL) (incluyendo evasión y limitación de la conducta, el impacto psicosocial y la vergüenza social) y el Cuestionario King s Health (KHQ) (incluyendo impacto de la incontinencia, limitaciones de roles, limitaciones sociales, limitaciones físicas, relaciones personales, emociones, medidas sueño/energía y gravedad/aguante).
¡m
No se observó ninguna diferencia general en la eficacia tras el tratamiento con BOTOX entre los pacientes de >65 años de edad en comparación con los de<65 años.
A continuación, se presentan los resultados de los estudios pivotales agrupados:
Variables primaria y secundarias al inicio y cambio con respecto al inicio en los estudios pivotales agrupados:
|
100 Unidades de BOTOX (N=557) |
Placebo (N=548) |
Valor de p | |
|
Frecuencia diaria de los episodios de incontinencia urinaria* Media inicial |
5,49 |
5,39 | |
|
Cambio medio en la semana 2 |
-2,85 |
-1,21 |
p<0,001 |
|
Cambio medio en la semana 6 |
-3,11 |
-1,22 |
p<0,001 |
|
Cambio medio en la semana 12 a |
-2,80 |
-0,95 |
p<0,001 |
|
Porcentaje con respuesta positiva al tratamiento usando la Treatment Benefit Scale (%) Semana 2 |
64,4 |
34,7 |
p<0,001 |
|
Semana 6 |
68,1 |
32,8 |
p<0,001 |
|
Semana 12 a |
61,8 |
28,0 |
p<0,001 |
|
Frecuencia diaria de los episodios de micción Media inicial |
11,99 |
11,48 | |
|
Cambio medio en la semana 2 |
-1,53 |
-0,78 |
p<0,001 |
|
Cambio medio en la semana 6 |
-2,18 |
-0,97 |
p<0,001 |
|
Cambio medio en la semana 12 b |
-2,35 |
-0,87 |
p<0,001 |
|
Frecuencia diaria de los episodios de urgencia Media inicial |
8,82 |
8,31 | |
|
Cambio medio en la semana 2 |
-2,89 |
-1,35 |
p<0,001 |
|
Cambio medio en la semana 6 |
-3,56 |
-1,40 |
p<0,001 |
|
Cambio medio en la semana 12b |
-3,30 |
-1,23 |
p<0,001 |
|
Puntuación total de la calidad de vida relacionada con la incontinenciac Media inicial |
34,1 |
34,7 | |
|
Cambio medio en la semana 12 bc |
+22,5 |
+6,6 |
p<0,001 |
|
Cuestionario Kings Health: limitación de roles Media inicial |
65,4 |
61,2 | |
|
Cambio medio en la semana 12 bc |
-25,4 |
-3,7 |
p<0,001 |
|
Cuestionario King s Health: limitación social Media inicial |
44,8 |
42,4 | |
|
Cambio medio en la semana 12 bc |
-16,8 |
-2,5 |
p<0,001 |
* El porcentaje de pacientes secos (sin incontinencia) en la semana 12 fue del 27,1% para el grupo de BOTOX y del
¡m
8,4% para el grupo placebo. Las proporciones que alcanzaron al menos un 75% y un 50% de reducción desde el momento inicial en los episodios de incontinencia urinaria fueron del 46,0% y del 60,5% en el grupo de BOTOX en comparación con el 17,7% y el 31% en el grupo placebo, respectivamente. a Variables co-primarias b Variables secundarias
c El cambio mínimamente importante predefinido a partir del momento inicial fue de +10 puntos para I-QOL y -5 puntos para KHQ.
La duración media de la respuesta tras el tratamiento con BOTOX, basándose en la solicitud del paciente de repetir el tratamiento, fue de 166 días (aproximadamente 24 semanas).
Aunque sólo se estudiaron un número limitado de pacientes de edad <40 años (n=88, 8,0%), no-caucásicos (n= 101, 9,1%) y varones (n=135, 12,2%) en los dos estudios clínicos en fase 3, los datos en estos subgrupos apoyan un efecto positivo del tratamiento. Se observó mayor incidencia de reacciones adversas como retención urinaria, volumen de orina residual y polaquiuria en varones comparado con mujeres. Los resultados de las variables co-primarias en varones se presentan más abajo:
Variables de eficacia co-primarias en el momento basal y cambio desde el momento basal en pacientes varones (estudios pivotales agrupados):___
|
BOTOX 100 Unidades (N=61) |
Placebo (N=74) |
Valor de p | |
|
Frecuencia diaria de episodios de incontinencia urinaria Media inicial |
5,61 |
4,33 | |
|
Cambio medio en la semana 12 |
-1,86 |
-1,23 |
0,612 |
|
Proporción con respuesta positiva al tratamiento usando la Treatment Benefit Scale (%) Semana 12 |
40,7 |
25,4 |
0,060 |
Se evaluó a un total de 839 pacientes en una extensión del estudio en fase abierta a largo plazo (n= 758 mujeres, n= 81 varones). Los pacientes experimentaron una respuesta consistente con la repetición del tratamiento en relación con todas las variables de eficacia. En el grupo de 345 pacientes (n=316 mujeres, n= 29 varones) que habían alcanzado la semana 12 del ciclo de tratamiento 3, las reducciones medias en la frecuencia diaria de la incontinencia urinaria fueron de -3,07, -3,49 y -3,49 episodios en la semana 12 tras el primer, segundo y tercer tratamiento con BOTOX 100 Unidades respectivamente. Las proporciones correspondientes de pacientes con una respuesta positiva al tratamiento usando la Treatment Benefit Scale fueron del 63,6%, 76,9% y 77,3% respectivamente.
En los estudios pivotales, ninguno de los 615 pacientes con muestras analizadas desarrolló anticuerpos neutralizantes.
Incontinencia urinaria debida a hiperactividad neurogénica del detrusor
Se realizaron dos estudios clínicos de Fase III multicéntricos, aleatorizados, controlados con placebo y doble ciego con pacientes que sufrían incontinencia urinaria debida a hiperactividad neurogénica del detrusor, quienes presentaban micción espontánea o estaban cateterizados. Se incluyó en el estudio un total de 691 pacientes con lesión medular o esclerosis múltiple, los cuales no estaban tratados adecuadamente con al menos un fármaco anticolinérgico. Se aleatorizó a estos pacientes para recibir 200 Unidades de BOTOX (n=227), 300 Unidades de BOTOX (n=223) o placebo (n=241).
En ambos estudios de fase 3, se observaron mejorías significativas, favorables a BOTOX (200 y 300 Unidades) en comparación con el placebo, en la variable de eficacia primaria, es decir, el cambio
¡m
observado en la semana 6 con respecto al inicio en la frecuencia semanal de episodios de incontinencia, incluido el porcentaje de pacientes sin incontinencia. Se observaron mejorías significativas en los parámetros urodinámicos, incluido el aumento de la capacidad cistométrica máxima y la reducción de la presión máxima del detrusor durante la primera contracción involuntaria del detrusor. Asimismo, se observaron mejorías significativas, en comparación con el placebo, en las puntuaciones de la calidad de vida relacionada con la salud y la incontinencia, medida con el I-QOL (incluyendo la limitación de la conducta, el impacto psicosocial y la vergüenza social). No se demostró ningún beneficio de 300 Unidades de BOTOX sobre 200 Unidades, observándose un perfil de seguridad más favorable con 200 Unidades de BOTOX.
A continuación, se presentan los resultados de los estudios pivotales agrupados:
Variables primaria y secundarias al inicio y cambio con respecto al inicio en los estudios pivotales agrupados:
|
200 Unidades de BOTOX (N=227) |
Placebo (N=241) |
Valor de p | |
|
Frecuencia semanal de la incontinencia urinaria | |||
|
Media inicial |
32,4 |
31,5 | |
|
Cambio medio en la semana 2 |
-17,7 |
-9,0 |
p<0,001 |
|
Cambio medio en la semana 6* |
-21,3 |
-10,5 |
p<0,001 |
|
Cambio medio en la semana 12 |
-20,6 |
-9,9 |
p<0,001 |
|
Capacidad cistométrica máxima (ml) | |||
|
Media inicial |
250,2 |
253,5 | |
|
Cambio medio en la semana 6* |
+153,6 |
+11,9 |
p<0,001 |
|
Presión máxima del detrusor durante la 1a contracción involuntaria (cmH20) | |||
|
Media inicial |
51,5 |
47,3 | |
|
Cambio medio en la semana 6b |
-32,4 |
+1,1 |
p<0,001 |
|
Puntuación total de la calidad de vida relacionada con la incontinenciac,d | |||
|
Media inicial |
35,37 |
35,32 | |
|
Cambio medio en la semana 6b |
+25,89 |
+11,15 |
p<0,001 |
|
Cambio medio en la semana 12 |
+28,89 |
+8,86 |
p<0,001 |
* El porcentaje de pacientes sin incontinencia en la semana 6 fue del 37% en el grupo tratado con 200 Unidades de BOTOX y del 9% en el tratado con placebo. Los porcentajes que alcanzaron al menos una reducción del 75% con respecto al inicio, en episodios de incontinencia, fueron del 63% y del 24% respectivamente. Los porcentajes que alcanzaron al menos una reducción del 50% con respecto al inicio fueron del 76% y del 39% respectivamente. a Variable primaria b Variables secundarias
c La puntuación total del I-QOL abarca desde 0 (problema máximo) hasta 100 (no existe ningún problema). d En los estudios pivotales, la diferencia mínima significativa (DMS) especificada previamente para la puntuación total del I-QOL fue de 8 puntos, basada en las estimaciones de la DMS de 4-11 puntos comunicadas por los pacientes con hiperactividad neurógenica del detrusor.
¡m
La duración media de la respuesta en los dos estudios pivotales, basada en la solicitud del paciente de repetir el tratamiento, fue de 256-295 días (36-42 semanas) en el grupo tratado con 200 Unidades, en comparación con los 92 días (13 semanas) del grupo tratado con placebo.
Los pacientes experimentaron una respuesta consistente con la repetición del tratamiento en relación con todas las variables de eficacia.
En los estudios pivotales, ninguno de los 475 pacientes con hiperactividad neurogénica del detrusor con muestras analizadas desarrolló anticuerpos neutralizantes.
TRASTORNOS DE LA PIEL Y ÓRGANOS ANEJOS
Hiperhidrosis primaria de la axila
Se realizó un ensayo clínico multicéntrico, doble ciego en pacientes con hiperhidrosis primaria de la axila bilateral persistente, definida mediante una determinación gravimétrica basal de al menos 50 mg de producción espontánea de sudor en cada axila en 5 minutos a temperatura ambiente y en reposo. Se aleatorizaron trescientos veinte pacientes para que recibieran 50 Unidades de BOTOX (n= 242) o bien placebo (n= 78). Se definieron como pacientes respondedores aquellos que mostraron una disminución de sudoración axilar de al menos un 50% respecto al valor basal. En la variable primaria, 4 semanas después de la inyección, la tasa de respuesta en el grupo tratado con BOTOX fue del 93,8% respecto al 35,9% del grupo tratado con placebo (p<0,001). La incidencia de respondedores en el grupo tratado con BOTOX continuó siendo significativamente superior (p< 0,001) a la de los pacientes tratados con placebo en las subsiguientes determinaciones de hasta 16 semanas.
En un estudio abierto de seguimiento, se reclutaron 207 pacientes que recibieron hasta 3 tratamientos con BOTOX. En total, 174 pacientes completaron los 16 meses de duración de los dos estudios combinados (4 meses doble ciego y 12 meses abierto de seguimiento). La incidencia de respuesta clínica a la semana 16 tras el primero (n= 287), segundo (n= 123) y tercer (n= 30) tratamiento fue del 85,0%, 86,2% y 80% respectivamente. La duración media del efecto basada en el estudio combinado (dosis única y estudio de seguimiento abierto), fue de 7,5 meses tras el primer tratamiento; no obstante en el 27,5% de los pacientes el efecto del tratamiento duró 1 año o más.
La experiencia del uso de BOTOX en ensayos clínicos en hiperhidrosis axilar primaria en niños con edades entre 12 y 18 años es limitada. Se ha llevado a cabo en Estados Unidos un estudio no controlado de seguridad, de un año de duración, con dosis repetidas en pacientes pediátricos de 12 a 17 años de edad (n=144) con hiperhidrosis axilar primaria severa. Los participantes fueron principalmente mujeres (86,1%) y caucásicos (82,6%). Los pacientes fueron tratados con una dosis de 50 Unidades por axila con una dosis total de 100 Unidades por paciente por tratamiento. No obstante, no se han realizado estudios de rango de dosis en adolescentes, por tanto, no se puede hacer una recomendación sobre posología. La eficacia y seguridad de BOTOX en este grupo no se ha establecido de forma concluyente.
5.2 Propiedades farmacocinéticas
Características generales de la sustancia activa:
Estudios de distribución realizados en ratas muestran que tras su inyección, el complejo 125I-neurotoxina botulínica A difunde lentamente por el músculo gemelo tibial, sufre un rápido metabolismo sistémico y se excreta vía urinaria. En el músculo, la cantidad de sustancia marcada se reduce hasta aproximadamente la mitad en aproximadamente 10 horas. En el punto de inyección, la radiactividad se une a grandes moléculas proteicas, mientras que en el plasma se une a moléculas pequeñas, lo que indica un rápido metabolismo sistémico del sustrato. En las 24 horas post inyección, el 60% de la radiactividad se excreta por orina. Probablemente, la toxina se metaboliza mediante proteasas y los componentes moleculares se reciclan a través de los circuitos metabólicos normales.
Dada la naturaleza de este producto, no se han llevado a cabo los habituales estudios de absorción, distribución, biotransformación y eliminación.
Características en pacientes:
Se cree que la distribución sistémica de las dosis terapéuticas de BOTOX es muy pequeña.
Estudios clínicos realizados empleando técnicas electromiográficas de fibra única muestran una actividad muscular electrofisiológica aumentada en músculos alejados del punto de inyección, sin ir ésta acompañada de ningún signo o síntoma clínico.
5.3 Datos preclínicos sobre seguridad
Estudios de reproducción
Al administrar BOTOX por vía intramuscular a ratones, ratas y conejos durante el período de organogénesis, el Nivel de Efecto Adverso No Deseado (NOAEL) resultó ser de 4, 1 y 0,125 U/Kg, respectivamente. Dosis superiores se relacionaban con reducciones en el peso fetal y/o retraso en la osificación y se detectaron abortos en los conejos.
Fertilidad y reproducción
El NOAEL reproductivo tras la inyección intramuscular de BOTOX fue de 4 Unidades/Kg en ratas macho y 8 Unidades/Kg en ratas hembra. Se asociaron dosis superiores con reducciones en fertilidad dosis-dependientes. Una vez que la fecundación tuvo lugar, no hubo efectos adversos en el número o viabilidad de los embriones fecundados o concebidos por ratas hembra o macho tratadas.
Otros estudios
Además de los estudios de toxicología reproductiva, se han llevado a cabo los siguientes estudios preclínicos con BOTOX: Toxicidad aguda, toxicidad por inyecciones repetidas, tolerancia local, mutagenicidad, antigenicidad y de compatibilidad sanguínea humana. Estos estudios mostraron que a las dosis clínicamente relevantes no existe riesgo en humanos. La dosis máxima recomendada en humanos para una sesión de tratamiento es de 300 Unidades (corresponde a 6 Unidades/Kg en una persona de 50 Kg de peso). La DL50 por vía intramuscular en monos jóvenes es de 39 Unidades/Kg.
No se observó toxicidad sistémica después de una única inyección en el detrusor de <50 Unidades/Kg de BOTOX en ratas. Con el objetivo de simular una inyección involuntaria, se administró una única dosis de BOTOX (aproximadamente 7 Unidades/Kg) en la uretra prostática y en el recto proximal, la vesícula seminal y la pared de la vejiga, o el útero de monos (aproximadamente 3 Unidades/Kg) sin efectos clínicos adversos. En un estudio de 9 meses de dosis repetidas en el detrusor (4 inyecciones), se observó ptosis con 24 Unidades/Kg y la mortalidad se observó con dosis >24 Unidades/Kg. Se observó degeneración/regeneración de las miofibras en el músculo esquelético de animales con dosis de 24 Unidades/Kg y superiores. Los cambios miopáticos fueron considerados efectos secundarios de la exposición sistémica. Además, se observó degeneración de las miofibras en un animal que recibió 12 Unidades/Kg. La lesión de este animal resultó mínima en cuanto a gravedad y se consideró no asociada con cualquier manifestación clínica. No se pudo determinar con certeza si estaba relacionada con el tratamiento con BOTOX. La dosis de 12 Unidades/Kg corresponde a una exposición tres veces mayor a BOTOX que la dosis clínica recomendada de 200 Unidades para la incontinencia urinaria debida a hiperactividad neurogénica del detrusor (basada en una persona de 50 Kg).
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Albúmina humana Cloruro de sodio
6.2 Incompatibilidades
Dado que no se dispone de estudios de compatibilidad, no se recomienda el uso de este producto junto con otros fármacos.
6.3 Periodo de validez
3 años.
Estudios de potencia han demostrado que el producto se puede almacenar hasta 5 días a 2 °C-8 °C tras la reconstitución.
Desde un punto de vista microbiológico, el producto debe ser utilizado inmediatamente. Si no se utiliza inmediatamente, las condiciones de almacenamiento una vez reconstituido y previas a la utilización son responsabilidad del usuario y no deberían superar las 24 horas a 2 °C-8 °C, a menos que la reconstitución, dilución (etc.) hayan tenido lugar en condiciones asépticas controladas y validadas.
6.4 Precauciones especiales de conservación
Conservar en nevera (2 °C-8 °C), o conservar en congelador (a una temperatura de -5 °C o inferior).
Para las condiciones de conservación del producto reconstituido ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio incoloro de tipo I, de 5 o 10 ml de capacidad nominal, provisto de un tapón de caucho de clorobutilo y cierre de seguridad de aluminio.
Cada envase contiene 1, 2, 3, 6 ó 10 viales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Se recomienda llevar a cabo la reconstitución del vial y la preparación de la jeringa sobre toallas de papel con recubrimiento plástico para recoger cualquier posible material vertido.
BOTOX sólo debe ser reconstituido con solución para inyección estéril de cloruro sódico 9 mg/ml (9%). Se debe aspirar con la jeringa la cantidad apropiada de diluyente. (Ver sección 4.2 para instrucciones de dilución).
Si se utilizan diferentes tamaños de viales de BOTOX como parte de un procedimiento de inyección, se debe tener cuidado para usar la cantidad correcta de diluyente cuando se reconstituye un número concreto de unidades por 0,1 ml. La cantidad de diluyente varía entre BOTOX 50 Unidades Allergan, BOTOX 100 Unidades Allergan y BOTOX 200 Unidades Allergan. Cada jeringa se debe etiquetar apropiadamente.
Dado que BOTOX se desnaturaliza por agitación violenta o formación de burbujas, el disolvente se debe inyectar en el vial con suavidad. Se debe desechar el vial si el vacío no arrastra el disolvente hacia el interior del mismo. BOTOX reconstituido es una solución clara, de incolora a ligeramente amarillenta, libre de partículas. Antes de su utilización se comprobará visualmente que la solución reconstituida está clara y libre de partículas. Una vez reconstituido en el vial, BOTOX se puede guardar en refrigerador (2 °C-8°C) hasta 24 horas antes de su utilización. La fecha y hora de reconstitución debe anotarse en el espacio de la etiqueta destinado para ello. Si BOTOX se diluye más para la inyección intradetrusor en una jeringa, debe utilizarse inmediatamente. Este producto es para un solo uso, se deberá desechar cualquier resto de solución no utilizada.
Para una eliminación segura, los viales sin usar se deben reconstituir con una pequeña cantidad de agua y a continuación someterlos a autoclave. Todos los viales y jeringas utilizadas y material vertido, etc. se deben someter a autoclave, o el BOTOX residual se puede inactivar con una solución diluida de hipoclorito (0,5%) durante 5 minutos.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con las normativas locales.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
County Mayo
Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
BOTOX 50 Unidades Allergan polvo para solución inyectable: 70602 BOTOX 100 Unidades Allergan polvo para solución inyectable: 63194 BOTOX 200 Unidades Allergan polvo para solución inyectable: 72377
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
BOTOX 50 Unidades Allergan polvo para solución inyectable: Primera autorización: Abril 2011. BOTOX 100 Unidades Allergan polvo para solución inyectable: Primera autorización: Junio 2000. renovación: Octubre 2009
BOTOX 200 Unidades Allergan polvo para solución inyectable: Primera autorización: Abril 2011. renovación: Julio 2013
Última Última
10. FECHA DE LA REVISIÓN DEL TEXTO
Enero 2016
35 de 35