Binocrit, 5000 Ui/0,5 Ml, Solucion Inyectable En Una Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 2.000 UI de epoetina alfa,* que corresponde a 16,8 microgramos por ml Una jeringa precargada de 0,5 ml contiene 1.000 unidades internacionales (UI) y corresponde a
8.4 microgramos de epoetina alfa*.
Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 2.000 UI de epoetina alfa,* que corresponde a 16,8 microgramos por ml Una jeringa precargada de 1 ml contiene 2.000 unidades internacionales (UI) y corresponde a
16.8 microgramos de epoetina alfa*.
Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,3 ml contiene 3.000 unidades internacionales (UI) y corresponde a
25,2 microgramos de epoetina alfa*.
Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,4 ml contiene 4.000 unidades internacionales (UI) y corresponde a 33,6 microgramos de epoetina alfa*.
Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,5 ml contiene 5.000 unidades internacionales (UI) y corresponde a
42,0 microgramos de epoetina alfa*.
Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,6 ml contiene 6.000 unidades internacionales (UI) y corresponde a
50.4 microgramos de epoetina alfa*.
Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,7 ml contiene 7.000 unidades internacionales (UI) y corresponde a
58.8 microgramos de epoetina alfa*.
Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,8 ml contiene 8.000 unidades internacionales (UI) y corresponde a
67,2 microgramos de epoetina alfa*.
Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 0,9 ml contiene 9.000 unidades internacionales (UI) y corresponde a 75,6 microgramos de epoetina alfa*.
Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 10.000 UI de epoetina alfa,* que corresponde a 84,0 microgramos por ml
Una jeringa precargada de 1 ml contiene 10.000 unidades internacionales (UI) y corresponde a
84.0 microgramos de epoetina alfa*.
Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 40.000 UI de epoetina alfa,* que corresponde a 336,0 microgramos por ml
Una jeringa precargada de 0,5 ml contiene 20.000 unidades internacionales (UI) y corresponde a
168.0 microgramos de epoetina alfa*.
Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 40.000 UI de epoetina alfa,* que corresponde a 336,0 microgramos
por ml
Una jeringa precargada de 0,75 ml contiene 30.000 unidades internacionales (UI) y corresponde a
252.0 microgramos de epoetina alfa*.
Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada
Cada ml de solución contiene 40.000 UI de epoetina alfa,* que corresponde a 336,0 microgramos por ml
Una jeringa precargada de 1 ml contiene 40.000 unidades internacionales (UI) y corresponde a
336.0 microgramos de epoetina alfa*.
* Producido en células de ovario de hámster chino (CHO), mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
3. FORMA FARMACÉUTICA
Solución inyectable en jeringa precargada (inyectable) Solución transparente e incolora
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Binocrit está indicado para el tratamiento de la anemia sintomática asociada a la insuficiencia renal crónica (IRC):
- en pacientes adultos y pediátricos de 1 a 18 años de edad en hemodiálisis y en pacientes adultos en diálisis peritoneal (ver sección 4.4).
- en adultos con insuficiencia renal que aún no se someten a diálisis para el tratamiento de la anemia grave de origen renal acompañada de síntomas clínicos en los pacientes (ver sección 4.4).
Binocrit está indicado en adultos que reciben quimioterapia para tumores sólidos, linfoma maligno o mieloma múltiple, con riesgo de transfusión, según la evaluación del estado general del paciente (p. ej.: estado cardiovascular, anemia previa al principio de la quimioterapia) para el tratamiento de la anemia y la reducción de las necesidades de transfusión.
Binocrit está indicado en adultos en programa de predonación para aumentar el rendimiento de sangre autóloga. El tratamiento sólo debe administrarse a los pacientes con anemia moderada (intervalo de concentración de hemoglobina [Hb] entre 10 y 13 g/dl [6,2 y 8,1 mmol/l], sin deficiencia de hierro), si no se dispone de procedimientos para ahorrar sangre o si éstos son insuficientes cuando la intervención quirúrgica electiva mayor programada requiere un volumen grande de sangre (cuatro o más unidades de sangre en las mujeres o cinco o más en los hombres).
Binocrit está indicado antes de una intervención quirúrgica ortopédica electiva mayor en adultos sin deficiencia de hierro, que tienen mayor riesgo de complicaciones debidas a la transfusión, para reducir la necesidad de llevar a cabo alotransfusiones de sangre. El uso deberá restringirse a los pacientes con anemia moderada (p. ej.: intervalo de concentración de hemoglobina entre 10 y 13 g/dl o 6,2 y
8.1 mmol/l) que no tienen un programa de predonación autóloga disponible y con una pérdida esperada de sangre moderada (900 a 1.800 ml).
4.2 Posología y forma de administración
El tratamiento con Binocrit se tiene que iniciar bajo la supervisión de médicos con experiencia, en el tratamiento de las indicaciones anteriores.
Posología
Todas las demás causas de anemia (deficiencia de hierro, folato o vitamina B12, intoxicación por aluminio, infección o inflamación, pérdida de sangre, hemólisis y fibrosis de la médula ósea de cualquier origen) se deben evaluar y tratar antes de iniciar el tratamiento con epoetina alfa y cuando se decida incrementar la dosis. A fin de asegurar una respuesta óptima a la epoetina alfa, deben asegurarse unos depósitos suficientes de hierro y se deben administrar suplementos de hierro si es necesario (ver sección 4.4):
Tratamiento de la anemia sintomática en los _pacientes adultos con insuficiencia renal crónica
Los síntomas y las secuelas de la anemia pueden variar con la edad, el sexo y las enfermedades concomitantes (co-morbilidad); es necesario que el médico realice una evaluación individualizada de la evolución clínica y del estado de cada paciente.
El intervalo deseado de concentración de hemoglobina recomendado es de 10 g/dl a 12 g/dl (6,2 a
7,5 mmol/l). Binocrit debe administrarse a fin de aumentar la hemoglobina a una concentración no superior a 12 g/dl (7,5 mmol/l). Se debe evitar un aumento de la hemoglobina superior a 2 g/dl (1,25 mmol/l) durante un período de cuatro semanas. Si esto ocurre, deberá hacerse el ajuste adecuado de la dosis que sea necesario.
Debido a la variabilidad intrapaciente, de forma ocasional, se pueden observar en algunos pacientes valores individuales de hemoglobina superiores e inferiores al intervalo de concentración deseado. La variabilidad de la hemoglobina deberá tratarse mediante el manejo de la dosis, teniendo en cuenta un intervalo de concentración de la hemoglobina de 10 g/dl (6,2 mmol/l) a 12 g/dl (7,5 mmol/l).
Se debe evitar una concentración prolongada de hemoglobina superior a 12 g/dl (7,5 mmol/l). Si la hemoglobina aumenta más de 2 g/dl (1,25 mmol/l) al mes o si la hemoglobina prolongada es superior a 12 g/dl (7,5 mmol/l), se debe reducir un 25% la dosis de Binocrit. Si la hemoglobina es superior a 13 g/dl (8,1 mmol/l), se debe suspender el tratamiento hasta que descienda a menos de 12 g/dl (7,5 mmol/l) y, luego, se debe reiniciar el tratamiento con Binocrit a una dosis un 25% inferior a la dosis anterior.
Se debe vigilar estrechamente a los pacientes con el fin de asegurar que se emplea la dosis mínima eficaz aprobada de Binocrit para proporcionar un control adecuado de la anemia y de los síntomas de la anemia sin dejar de mantener una concentración de hemoglobina igual o inferior a 12 g/dl (7,45 mmol/l).
Hay que tener precaución con el escalado de la dosis de Binocrit en los pacientes con insuficiencia renal crónica. En los pacientes con una respuesta de hemoglobina deficiente a Binocrit, se deben contemplar explicaciones alternativas para la respuesta deficiente (ver las secciones 4.4 y 5.1).
El tratamiento con Binocrit se divide en dos fases: fase de corrección y de mantenimiento.
Pacientes adultos en hemodiálisis
En los pacientes en hemodiálisis en los que se pueda conseguir fácilmente un acceso intravenoso, es preferible la administración por vía intravenosa.
Fase de corrección
La dosis inicial es de 50 UI/kg tres veces por semana.
Si es necesario, aumentar o reducir la dosis en 25 UI/kg (tres veces por semana) hasta alcanzar el intervalo de concentración de hemoglobina deseado entre 10 g/dl y 12 g/dl (6,2 y 7,5 mmol/l; esto debe hacerse en pasos de al menos cuatro semanas).
Fase de mantenimiento
La dosis semanal total recomendada es de entre 75 y 300 UI/kg.
Se debe hacer un ajuste adecuado de la dosis a fin de mantener los valores de hemoglobina dentro del intervalo de concentración deseado entre 10 g/dl y 12 g/dl (de 6,2 a 7,5 mmol/l).
Los pacientes con hemoglobina inicial muy baja (< 6 g/dl o < 3,75 mmol/l) pueden precisar dosis de mantenimiento más altas que los pacientes cuya anemia inicial es menos grave (> 8 g/dl o > 5 mmol/l).
Pacientes adultos con insuficiencia renal que aún no se someten a diálisis
Cuando no se pueda conseguir fácilmente un acceso intravenoso, Binocrit puede administrarse por vía subcutánea.
Fase de corrección
Dosis inicial de 50 UI/kg tres veces por semana, seguida, si es necesario, de un aumento de la dosificación con incrementos de 25 UI/kg (tres veces por semana), hasta alcanzar el objetivo deseado (esto se debe hacer en pasos de al menos cuatro semanas).
Fase de mantenimiento
Durante la fase de mantenimiento, Binocrit puede administrarse, bien tres veces por semana, o bien, en el caso de la administración por vía subcutánea, una vez por semana o una vez cada dos semanas.
Se debe hacer un ajuste adecuado de la dosis y de los intervalos de dosis a fin de mantener los valores de hemoglobina al nivel deseado: hemoglobina entre 10 g/dl y 12 g/dl (de 6,2 a 7,5 mmol/l). La ampliación de los intervalos de dosis puede exigir un aumento de la dosis.
La dosificación máxima no debe ser superior a 150 UI/kg tres veces por semana, 240 UI/kg (hasta un máximo de 20.000 UI) una vez por semana o 480 UI/kg (hasta un máximo de 40.000 UI) una vez cada dos semanas.
Cuando no se pueda conseguir fácilmente un acceso intravenoso, Binocrit puede administrarse por vía subcutánea.
Fase de corrección
La dosis inicial es de 50 UI/kg dos veces por semana.
Fase de mantenimiento
La dosis de mantenimiento recomendada es de entre 25 UI/kg y 50 UI/kg, dos veces por semana, en dos inyecciones iguales.
Se debe hacer un ajuste adecuado de la dosis a fin de mantener los valores de hemoglobina al nivel deseado entre 10 g/dl y 12 g/dl (de 6,2 a 7,5 mmol/l).
Tratamiento de _pacientes adultos con anemia inducida por la quimioterapia
Los síntomas y las secuelas de la anemia pueden variar con la edad, el sexo y la carga total de la enfermedad, por lo que es necesario que el médico evalúe la evolución y el estado clínico del paciente.
Binocrit debe administrarse a los pacientes con anemia (por ejemplo, concentración de hemoglobina < 10 g/dl (6,2 mmol/l)).
La dosis inicial es de 150 UI/kg por vía subcutánea, tres veces por semana.
Alternativamente, Binocrit puede administrarse a una dosis inicial de 450 UI/kg por vía subcutánea una vez por semana.
Se debe hacer un ajuste adecuado de la dosis a fin de mantener las concentraciones de hemoglobina dentro del intervalo de concentración deseado entre 10 g/dl y 12 g/dl (de 6,2 a 7,5 mmol/l).
Debido a la variabilidad intrapaciente, pueden observarse concentraciones individuales y ocasionales de la hemoglobina superiores e inferiores al intervalo de concentración deseado para un paciente. La variabilidad de la hemoglobina debe abordarse por medio de la gestión de las dosis, teniendo en cuenta el intervalo de concentración deseado de la hemoglobina comprendido entre 10 g/dl (6,2 mmol/l) a 12 g/dl (7,5 mmol/l). Se debe evitar una concentración sostenida de la hemoglobina superior a 12 g/dl (7,5 mmol/l); a continuación, se describe una guía para realizar un ajuste correcto de las dosis cuando las concentraciones de hemoglobina son superiores a 12 g/dl (7,5 mmol/l).
- Si la concentración de hemoglobina ha aumentado por lo menos en 1 g/dl (0,62 mmol/l) o si el recuento de reticulocitos ha aumentado > 40.000 células/microlitro (^l) por encima del valor inicial después de cuatro semanas de tratamiento, la dosis deberá mantenerse a 150 UI/kg, tres veces por semana o 450 UI/kg una vez a la semana.
- Si el aumento de la concentración de hemoglobina es < 1 g/dl (< 0,62 mmol/l) y el recuento de reticulocitos ha aumentado < 40.000 células/^l por encima del valor inicial, la dosis debe aumentarse a 300 UI/kg tres veces por semana. Si, después de otras cuatro semanas de tratamiento, a 300 UI/kg tres veces por semana, la concentración de hemoglobina ha aumentado > 1 g/dl (> 0,62 mmol/l) o si el recuento de reticulocitos ha aumentado > 40.000 células/^l, la dosis deberá mantenerse a 300 UI/kg tres veces por semana.
- Si la concentración de hemoglobina ha aumentado < 1 g/dl (< 0,62 mmol/l) y el recuento de reticulocitos ha aumentado < 40.000 células/^l por encima del valor inicial, la respuesta al tratamiento es improbable y el tratamiento deberá suspenderse.
Ajuste de la dosis para mantener concentraciones de hemoglobina entre 10 g/dl y 12 g/dl (de 6,2 a
7,5 mmol/l)
Si la concentración de hemoglobina aumenta más de 2 g/dl (1,25 mmol/l) al mes, o si el nivel de concentración de hemoglobina es superior a 12 g/dl (7,5 mmol/l), reduzca la dosis de Binocrit en alrededor de un 25 a un 50%.
Si el nivel de concentración de hemoglobina es superior a 13 g/dl (8,1 mmol/l), interrumpa el tratamiento hasta que descienda por debajo de 12 g/dl (7,5 mmol/l) y después, reinicie el tratamiento con Binocrit a una dosis un 25% inferior a la dosis anterior.
La pauta de dosificación recomendada se describe en el siguiente diagrama:
150 UI/kg 3x/semana o 450 UI/kg una vez a la semana durante 4 semanas
r~ ~í
Aumento del recuento de reticulocitos < 40.000V
y aumento de Hb < 1 g/dl 1
300 UI/kg 3x/semana durante 4 semanas
-4
Aumento del recuento de reticulocitos > 40.000/^l o aumento de Hb > 1 g/d
i
Objetivo de Hb (< 12 g/dl)
t
Aumento del recuento de reticulocitos > 40.000/^l o aumento de Hb > 1 g/dl
Aumento del recuento de reticulocitos < 40.000V
y aumento de Hb < 1 g/dl
1
Suspender el tratamiento
Se debe vigilar estrechamente a los pacientes con el fin de asegurar de que se emplea la dosis mínima aprobada de estimulante de la eritropoyesis para proporcionar un control adecuado de los síntomas de la anemia.
El tratamiento con epoetina alfa debe continuar hasta un mes después del fin de la quimioterapia.
Tratamiento de pacientes quirúrgicos adultos en un programa de predonación autóloga
Los pacientes con anemia leve (hematocrito del 33 al 39%) y que precisan un depósito previo de > 4 unidades de sangre, deben recibir tratamiento con Binocrit 600 UI/kg por vía intravenosa, dos veces por semana, durante tres semanas antes de la intervención. Binocrit debe administrarse después de finalizar la donación de sangre.
Tratamiento de _pacientes adultos _programados _para intervención quirúrgica ortopédica electiva mayor
La dosis recomendada es de Binocrit 600 UI/kg, administrada por vía subcutánea semanalmente, durante tres semanas (días - 21, - 14 y - 7) antes de la intervención y en el día de la intervención (día 0).
En los casos en los que hay una necesidad médica de acortar el tiempo previo a la intervención quirúrgica a menos de tres semanas, deberán administrarse Binocrit 300 UI/kg por vía subcutánea diariamente durante diez días consecutivos antes de la intervención quirúrgica, en el día de la intervención quirúrgica y durante cuatro días inmediatamente después.
Si la concentración de hemoglobina es igual o superior a 15 g/dl (9,38 mmol/l), durante el periodo preoperatorio, la administración de Binocrit deberá suspenderse y no deberán administrarse más dosificaciones adicionales.
Población pediátrica
Tratamiento de la anemia sintomática en los pacientes con insuficiencia renal crónica en hemodiálisis Los síntomas y las secuelas de la anemia pueden variar con la edad, el sexo y las enfermedades concomitantes (co-morbilidad); es necesario que el médico realice una evaluación individualizada de la evolución clínica y del estado de cada paciente.
En los pacientes pediátricos, el intervalo de concentración de hemoglobina recomendado es de entre
9,5 g/dl y 11 g/dl (5,9 y 6,8 mmol/l). Binocrit debe administrarse a fin de aumentar la hemoglobina a una concentración no superior a 11 g/dl (6,8 mmol/l). Se debe evitar un aumento de la hemoglobina superior a 2 g/dl (1,25 mmol/l) durante un período de cuatro semanas. Si esto ocurre, se debe hacer el ajuste adecuado de la dosis que sea necesario.
Se debe vigilar estrechamente a los pacientes con el fin de asegurar que se emplea la dosis mínima aprobada de Binocrit para proporcionar un control adecuado de los síntomas de la anemia.
El tratamiento con Binocrit se divide en dos fases: fase de corrección y de mantenimiento.
En los pacientes pediátricos en hemodiálisis en los que se pueda conseguir fácilmente un acceso intravenoso, es preferible la administración por vía intravenosa.
Fase de corrección
La dosis inicial es 50 UI/kg administrada por vía intravenosa tres veces por semana.
Si es necesario, aumentar o reducir la dosis en 25 UI/kg (tres veces por semana) hasta alcanzar el intervalo de concentración de hemoglobina deseado de entre 9,5 g/dl y 11 g/dl (5,9 y 6,8 mmol/l; esto debe hacerse en pasos de al menos cuatro semanas).
Fase de mantenimiento
Se debe hacer un ajuste adecuado de la dosis, a fin de mantener los niveles de hemoglobina dentro del intervalo de concentración deseado entre 9,5 g/dl y 11 g/dl (5,9 y 6,8 mmol/l).
Por lo general, los niños con un peso inferior a 30 kg requieren dosis de mantenimiento más altas que los niños con un peso superior a 30 kg y que los adultos.
Los pacientes pediátricos con una hemoglobina inicial muy baja (< 6,8 g/dl o < 4,25 mmol/l) pueden requerir dosis de mantenimiento más altas que los pacientes cuya hemoglobina inicial es más alta (> 6,8 g/dl o > 4,25 mmol/l).
Anemia en _pacientes con insuficiencia renal crónica antes del inicio de la diálisis o en diálisis peritoneal
No se ha establecido la seguridad y eficacia de epoetina alfa en los pacientes con insuficiencia renal crónica y anemia antes del inicio de la diálisis o en diálisis peritoneal. Los datos actualmente disponibles sobre el uso subcutáneo de epoetina alfa en esta población de pacientes están descritos en la sección 5.1, sin embargo no se puede hacer una recomendación posológica.
Tratamiento de _pacientes pediátricos con anemia inducida _por la quimioterapia
No se ha establecido la seguridad y eficacia de la epoetina alfa en pacientes pediátricos que reciben
quimioterapia (ver sección 5.1).
Tratamiento de pacientes quirúrgicos pediátricos en un programa de predonación autóloga
No se ha establecido la seguridad y eficacia de la epoetina alfa en pacientes pediátricos. No se dispone
de datos.
Tratamiento de pacientes pediátricos programados para una intervención quirúrgica ortopédica electiva mayor
No se ha establecido la seguridad y eficacia de la epoetina alfa en pacientes pediátricos. No se dispone de datos.
Forma de administración
Precauciones que se deben tomar antes de manipular o administrar el medicamento.
Antes del uso, deje reposar la jeringa de Binocrit hasta que alcance la temperatura ambiente. Esto suele llevar entre 15 y 30 minutos.
Al igual que con cualquier otro producto inyectable, compruebe que no haya partículas en la solución ni cambios en su coloración. Binocrit es un producto estéril pero no conservado, para un solo uso. Debe administrarse la cantidad necesaria.
Tratamiento de la anemia sintomática en los pacientes adultos con insuficiencia renal crónica
En los pacientes con insuficiencia renal crónica en los que se pueda conseguir de forma sistemática un acceso intravenoso (pacientes en hemodiálisis), es preferible administrar Binocrit por vía intravenosa.
Cuando no se pueda conseguir fácilmente un acceso intravenoso (pacientes que no reciben hemodiálisis y pacientes en diálisis peritoneal), Binocrit puede administrarse en inyección subcutánea.
Tratamiento de _pacientes adultos con anemia inducida por la quimioterapia Binocrit debe administrarse en inyección subcutánea.
Tratamiento de pacientes quirúrgicos adultos en un programa de predonación autóloga Binocrit debe administrarse por vía intravenosa.
Tratamiento de _pacientes adultos _programados _para una intervención quirúrgica ortopédica electiva mayor
Binocrit debe administrarse en inyección subcutánea.
Tratamiento de la anemia sintomática en los _pacientes _pediátricos con insuficiencia renal crónica en hemodiálisis
En los pacientes pediátricos con insuficiencia renal crónica en los que se pueda conseguir de forma sistemática un acceso intravenoso (pacientes en hemodiálisis), es preferible administrar Binocrit por vía intravenosa.
Administración intravenosa
Administrar durante al menos de uno a cinco minutos, dependiendo de la dosis total. En los pacientes en hemodiálisis, puede administrarse una inyección en bolo durante la sesión de diálisis, a través de un punto de entrada venoso adecuado en la vía de diálisis. O bien, la inyección puede administrarse al final de la sesión de diálisis, por medio del tubo de la aguja de la fístula, seguido de 10 ml de solución salina isotónica para purgar el tubo y asegurar una inyección satisfactoria del producto en la circulación (ver Posología, Pacientes adultos en hemodiálisis).
Es preferible una administración más lenta en los pacientes que reaccionan al tratamiento con síntomas “de tipo gripal” (ver sección 4.8).
No administre Binocrit por perfusión intravenosa ni conjuntamente con otras soluciones de medicamentos (para más información, consulte la sección 6.6).
Administración subcutánea
En general, no deberá sobrepasarse un volumen máximo de 1 ml en un lugar de inyección. En caso de volúmenes más grandes, debe elegirse más de un lugar para la inyección.
Las inyecciones se deben administrar en las extremidades o en la pared abdominal anterior.
En aquellas situaciones en las que el médico determine que el paciente o su cuidador puede administrar Binocrit por vía subcutánea por sí mismo de forma eficaz y segura, deben proporcionarse las instrucciones pertinentes a su adecuada dosificación y administración.
Al final del prospecto se encuentran las “Instrucciones de autoinyección de Binocrit”.
4.3 Contraindicaciones
- Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
- Los pacientes que presentan aplasia eritrocítica pura (AEP) después del tratamiento con cualquier eritropoyetina no deberán recibir Binocrit ni ninguna otra eritropoyetina (ver sección 4.4).
- Hipertensión no controlada.
- En los pacientes tratados con suplementos de Binocrit deben respetarse todas las contraindicaciones asociadas con los programas de predonación de sangre autóloga.
El empleo de Binocrit en los pacientes programados para una intervención quirúrgica ortopédica electiva mayor que no participan en un programa de predonación de sangre autóloga, está contraindicado en los pacientes con enfermedad coronaria, arterial periférica, carotídea o vascular cerebral grave, incluidos los pacientes con infarto de miocardio o accidente vascular cerebral reciente.
- Pacientes quirúrgicos que, por cualquier razón, no pueden recibir profilaxis antitrombótica adecuada.
4.4 Advertencias y precauciones especiales de empleo
Generales
En todos los pacientes que reciben epoetina alfa, debe monitorizarse y controlarse estrechamente la presión arterial según sea necesario. La epoetina alfa deberá emplearse con precaución en presencia de hipertensión no tratada, tratada insuficientemente o deficientemente controlable. Puede ser necesario añadir o aumentar el tratamiento antihipertensivo. Si la presión arterial no puede controlarse, el tratamiento con epoetina alfa deberá suspenderse.
Durante el tratamiento con epoetina alfa en pacientes con presión arterial previamente normal o baja se han producido crisis de hipertensión con encefalopatía y convulsiones, que han precisado la atención inmediata de un médico y cuidados médicos intensivos. Debe prestarse una atención especial a las cefaleas súbitas y lacerantes de tipo migrañoso, como posible señal de advertencia (ver sección 4.8).
La epoetina alfa debe emplearse con precaución en pacientes con epilepsia, antecedentes de convulsiones o enfermedades asociadas a una predisposición a la actividad convulsiva como infecciones del SNC y metástasis cerebrales.
La epoetina alfa debe emplearse con precaución en pacientes con insuficiencia hepática crónica. No se ha establecido la seguridad de la epoetina alfa en pacientes con disfunción hepática.
Se ha observado un aumento de la incidencia de episodios vasculares trombóticos (EVT) en los pacientes que reciben estimulantes de la eritropoyesis (ver sección 4.8). Entre ellos se incluyen trombosis y embolias, venosas y arteriales (incluso algunas con resultados mortales), como trombosis venosa profunda, embolia pulmonar, trombosis de la retina e infarto de miocardio. Además se han notificado accidentes cerebrovasculares (incluso infarto cerebral, hemorragia cerebral y ataques isquémicos transitorios).
Se debe sopesar con cuidado el riesgo notificado de estos EVT frente a los beneficios que se derivarán del tratamiento con epoetina alfa, en particular en pacientes con factores de riesgo preexistentes para EVT, entre ellos, obesidad y antecedentes previos de EVT (p. ej.: trombosis venosa profunda, embolia pulmonar y accidente cerebrovascular).
En todos los pacientes, los niveles de hemoglobina deben ser cuidadosamente controlados debido al posible aumento del riesgo de episodios tromboembólicos que pueden en algunos casos conducir a la muerte, cuando se trata a pacientes que presentan un nivel de hemoglobina por encima del intervalo de concentración establecido para la indicación.
Durante el tratamiento con epoetina alfa, puede haber un aumento moderado dosis-dependiente del recuento de plaquetas, dentro de los límites normales. El recuento vuelve a su nivel anterior durante el transcurso del tratamiento. Además, se ha notificado trombocitemia por encima de los límites normales. Se recomienda monitorizar el recuento de plaquetas con regularidad durante las ocho primeras semanas de tratamiento.
Todas las demás causas de anemia (deficiencia de hierro, folato o vitamina B12, intoxicación por aluminio, infección o inflamación, pérdida de sangre, hemólisis y fibrosis de la médula ósea de cualquier origen) deben evaluarse y tratarse antes de iniciar el tratamiento con epoetina alfa y cuando se decida incrementar la dosis. En la mayoría de los casos, los valores de ferritina en el suero descienden simultáneamente con el volumen de células empaquetadas. A fin de asegurar una respuesta óptima a la epoetina alfa, deben asegurarse unos depósitos suficientes de hierro y se deben administrar suplementos de hierro si es necesario (ver sección 4.2):
- Para los pacientes con insuficiencia renal crónica, se recomiendan suplementos de hierro (hierro elemental 200 a 300 mg/día por vía oral para los adultos y 100 a 200 mg/día por vía oral en los pacientes pediátricos) si los valores de ferritina en suero son inferiores a 100 ng/ml.
- Para los pacientes con cáncer se recomiendan suplementos de hierro (hierro elemental 200 a 300 mg/día por vía oral) si la saturación de transferrina es inferior al 20%.
- Para los pacientes en un programa de predonación autóloga, deben administrarse suplementos de hierro (hierro elemental 200 mg/día por vía oral) varias semanas antes de iniciar el depósito previo autólogo, a fin de alcanzar unos depósitos de hierro altos antes de comenzar el tratamiento con epoetina alfa, y durante todo el transcurso del tratamiento con epoetina alfa.
- Para los pacientes programados para una intervención quirúrgica ortopédica electiva mayor, deben administrarse suplementos de hierro (hierro elemental 200 mg/día por vía oral) durante todo el transcurso del tratamiento con epoetina alfa. Si es posible, la administración de suplementos de hierro se debe iniciar antes de empezar el tratamiento con epoetina alfa a fin de conseguir unos depósitos de hierro suficientes.
Muy raramente, se ha observado la aparición o la exacerbación de una porfiria en pacientes tratados con epoetina alfa. La epoetina alfa debe usarse con precaución en los pacientes con porfiria.
A fin de mejorar la trazabilidad de los estimulantes de la eritropoyesis, el nombre del fármaco administrado debe anotarse (o declararse) claramente en el historial médico del paciente.
El cambio de un estimulante de la eritropoyesis a otro en un paciente debe realizarse siempre bajo una supervisión apropiada.
Aplasia eritrocítica pura (AEP)
La AEP mediada por anticuerpos se ha descrito después de meses o años de tratamiento con epoetina por vía subcutánea, principalmente en pacientes con insuficiencia renal crónica. También se han notificado casos en pacientes con hepatitis C tratada con interferón y ribavirina, cuando se usan estimulantes de la eritropoyesis simultáneamente. No se ha aprobado la epoetina alfa para el tratamiento de la anemia asociada a hepatitis C.
En los pacientes que presentan una falta súbita de eficacia, caracterizada por un descenso de la hemoglobina (1 a 2 g/dl o 0,62 a 1,25 mmol/l al mes) con un aumento de la necesidad de transfusiones, deberá realizarse un recuento de reticulocitos y deberán investigarse las causas típicas de ausencia de respuesta (deficiencia de p. ej.: hierro, folato o vitamina B12, intoxicación por aluminio, infección o inflamación, pérdida de sangre, hemólisis y fibrosis de la médula ósea de cualquier origen).
Una disminución paradójica de la hemoglobina y la aparición de anemia grave asociada a recuentos bajos de reticulocitos darán lugar a la suspensión del tratamiento con epoetina alfa y a la realización de análisis de anticuerpos anti-eritropoyetina. También debe plantearse una exploración de la médula ósea para el diagnóstico de una AEP.
No debe iniciarse una terapia con otro estimulante de la eritropoyesis debido al riesgo de reacción cruzada.
Tratamiento de la anemia sintomática en los pacientes adultos y pediátricos con insuficiencia renal crónica
En los pacientes con insuficiencia renal crónica que reciben tratamiento con epoetina alfa, los niveles de hemoglobina deben ser medidos regularmente hasta que se alcance un nivel estable y, posteriormente, de manera periódica.
En los pacientes con insuficiencia renal crónica, la tasa de aumento de la hemoglobina deberá ser de aproximadamente 1 g/dl (0,62 mmol/l) al mes y no deberá ser superior a 2 g/dl (1,25 mmol/l) por mes, a fin de reducir al mínimo los riesgos de un aumento de la hipertensión.
En los pacientes con insuficiencia renal crónica, la concentración de mantenimiento de hemoglobina no debe exceder el límite superior del intervalo de la concentración de hemoglobina tal como se recomienda en la sección 4.2. En los ensayos clínicos, se observó un aumento del riesgo de muerte y de acontecimientos cardiovasculares graves cuando se administraron estimulantes de la eritropoyesis para lograr un nivel de concentración de hemoglobina superior a 12 g/dl (7,5 mmol/l).
Los ensayos clínicos controlados no han demostrado ventajas clínicas significativas atribuibles a la administración de epoetinas cuando la concentración de hemoglobina se aumenta más allá del valor necesario para controlar los síntomas de la anemia y para evitar la transfusión de sangre.
Hay que tener precaución con el escalado de la dosis de Binocrit en los pacientes con insuficiencia renal crónica, ya que las dosis acumulativas elevadas de epoetina se pueden asociar a un aumento del riesgo de mortalidad y de episodios cardiovasculares y cerebrovasculares graves. En los pacientes con una respuesta de hemoglobina deficiente a las epoetinas, se deben contemplar explicaciones alternativas para la respuesta deficiente (ver las secciones 4.2 y 5.1).
Se debe vigilar con regularidad a los pacientes con insuficiencia renal crónica tratados con epoetina alfa para detectar la pérdida de eficacia, definida como la ausencia o la disminución de la respuesta al tratamiento con epoetina alfa en los pacientes que respondieron anteriormente a dicho tratamiento. Se caracteriza por un descenso de la hemoglobina a pesar del aumento de la dosis de epoetina alfa (ver sección 4.8).
Es posible que algunos pacientes con intervalos de dosificación más ampliados (superiores a una vez a la semana) de epoetina alfa no mantengan unas concentraciones adecuadas de hemoglobina (ver sección 5.1) y pueden necesitar un aumento de la dosis de epoetina alfa. Se debe vigilar con regularidad la concentración de hemoglobina.
En los pacientes en hemodiálisis se han producido trombosis arteriovenosas, especialmente en los que tienen una tendencia a la hipotensión o en aquellos cuyas fístulas arteriovenosas presentan complicaciones (por ejemplo, estenosis, aneurismas, etc.). En estos pacientes se recomienda un examen temprano de la derivación y profilaxis de la trombosis, mediante la administración de ácido acetilsalicílico, por ejemplo.
En casos aislados se ha observado hiperpotasemia, aunque no se ha establecido su causalidad. En los pacientes con insuficiencia renal crónica deben monitorizarse los electrolitos en el suero. Si se detecta un aumento de la concentración sérica de potasio, además del adecuado tratamiento de la hiperpotasemia, deberá interrumpirse la administración de epoetina alfa hasta que la concentración sérica de potasio se haya corregido.
Durante el transcurso del tratamiento con epoetina alfa se requiere con frecuencia un aumento de la dosis de heparina, a consecuencia del aumento del volumen de células empaquetadas. Es posible la oclusión del sistema de diálisis si la heparinización no es óptima.
Teniendo en cuenta la información disponible hasta la fecha, la corrección de la anemia con epoetina alfa en pacientes adultos con insuficiencia renal que aún no se someten a diálisis no acelera la velocidad de progresión de la insuficiencia renal.
Tratamiento de los pacientes con anemia inducida por quimioterapia
En los pacientes con cáncer que reciben tratamiento con epoetina alfa, los niveles de hemoglobina deben ser medidos regularmente hasta que se alcance un nivel estable y, posteriormente, de manera periódica.
Las epoetinas son factores de crecimiento que estimulan principalmente la producción de los glóbulos rojos. Los receptores de la eritropoyetina pueden expresarse en la superficie de una variedad de células tumorales. Al igual que con todos los factores de crecimiento, existe la preocupación de que las epoetinas puedan estimular el crecimiento de cualquier tipo de tumores. No se puede excluir el papel de los estimulantes de la eritropoyesis en la progresión del tumor o en la disminución de la supervivencia sin progresión. En ensayos clínicos controlados, el uso de epoetina alfa y de otros estimulantes de la eritropoyesis se ha asociado a una disminución del control tumoral locorregional o una disminución de la supervivencia global:
- Disminución del control locorregional en los pacientes con cáncer avanzado de la cabeza y el cuello, que reciben radioterapia, cuando se administra para lograr un nivel de concentración de hemoglobina superior a 14 g/dl (8,7 mmol/l).
- Un acortamiento de la supervivencia global y un aumento de las muertes atribuidas a la progresión de la enfermedad a los cuatro meses en los pacientes con cáncer de mama que reciben quimioterapia cuando se administra para lograr un nivel de concentración de hemoglobina de 12 a 14 g/dl (7,5 a 8,7 mmol/l).
- Un aumento del riesgo de fallecimiento cuando se administra para lograr un nivel de concentración de hemoglobina de 12 g/dl (7,5 mmol/l) en los pacientes con enfermedad maligna activa que no reciben ni quimioterapia ni radioterapia. Los estimuladores de la eritropoyesis no están indicados en esta población de pacientes.
- Un aumento observado del 9 % del riesgo de progresión de la enfermedad o de muerte en el grupo de epoetina alfa y tratamiento de referencia a partir de un análisis primario, y un aumento del riesgo del 15 % que estadísticamente no se puede descartar en pacientes con cáncer de mama metastásico que reciben quimioterapia cuando se administra para lograr un nivel de concentración de hemoglobina de 10 a 12 g/dl (6,2 a 7,5 mmol/l).
Teniendo en cuenta lo anterior, en algunas situaciones clínicas, la transfusión de sangre debe ser el tratamiento de elección para la anemia en pacientes con cáncer. La decisión de administrar tratamiento con eritropoyetina recombinante deberá basarse en la evaluación de la relación beneficio/riesgo, en la que se tendrá en consideración a cada paciente individualmente, así como el contexto clínico específico. Los factores que deben considerarse en esta evaluación son el tipo de tumor y su estadio, el grado de anemia, la esperanza de vida, el entorno en el que el paciente está siendo tratado y la preferencia del paciente (ver sección 5.1).
En los pacientes con cáncer que reciben quimioterapia, las dos o tres semanas que transcurren entre la administración de estimulantes de la eritropoyesis y la aparición de los hematíes inducidos por eritropoyetina deben tenerse en cuenta al evaluar si el tratamiento con epoetina alfa es adecuado (paciente con riesgo de recibir una transfusión).
Pacientes quirúrgicos en programas de predonación autóloga
Deben respetarse todas las advertencias especiales y precauciones especiales asociadas a los programas de predonación autóloga, especialmente el reemplazo sistemático de volumen.
Pacientes programados para una intervención quirúrgica ortopédica electiva mayor
En el entorno periquirúrgico se deben aplicar siempre las buenas prácticas de tratamiento sanguíneo.
Los pacientes programados para una intervención quirúrgica ortopédica electiva mayor deben recibir profilaxis antitrombótica suficiente, ya que los episodios trombóticos y vasculares pueden producirse en pacientes quirúrgicos, especialmente los que padecen una enfermedad cardiovascular de base. Asimismo debe tenerse especial precaución en aquellos pacientes con predisposición para la aparición de TVP. Además, en los pacientes con niveles de hemoglobina inicial de > 13 g/dl (> 8,1 mmol/l), no puede excluirse la posibilidad de que el tratamiento con epoetina alfa esté asociado con un aumento del riesgo de episodios trombóticos o vasculares postoperatorios. Por lo tanto, no debe emplearse epoetina alfa en los pacientes con una hemoglobina inicial > 13 g/dl (> 8,1 mmol/l).
Excipientes
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por jeringa precargada, esto es, esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No existen pruebas que indiquen que el tratamiento con epoetina alfa altere el metabolismo de otros medicamentos. Los medicamentos que reducen la eritropoyesis pueden reducir la respuesta a la epoetina alfa.
Puesto que la ciclosporina se fija a los eritrocitos (GR), existe la posibilidad de interacción farmacológica. Si la epoetina alfa se administra concomitantemente con ciclosporina, debe vigilarse las concentraciones sanguíneas de ciclosporina y la dosis de ciclosporina debe ajustarse a medida que el hematocrito aumente.
No existen pruebas que indiquen una interacción entre la epoetina alfa y el factor estimulante de colonias de granulocitos (G-CSF) o el factor estimulante de colonias de granulocitos macrófagos (GM-CSF) en lo que respecta a la diferenciación hematológica o la proliferación de muestras de biopsia de tumor in vitro.
En pacientes adultas con cáncer de mama metastásico, la administración conjunta subcutánea de 40.000 UI/ml de epoetina alfa con trastuzumab 6 mg/kg no tuvo efecto alguno sobre la farmacocinética del trastuzumab.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de epoetina alfa en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3). En consecuencia, la epoetina alfa debe utilizarse en el embarazo sólo si los beneficios potenciales superan a los riesgos potenciales para el feto. No se recomienda el uso de epoetina alfa en las pacientes quirúrgicas embarazadas que participen en un programa de predonación autóloga.
Lactancia
Se desconoce si la epoetina alfa exógena se excreta en la leche materna. La epoetina alfa debe usarse con precaución en las mujeres en periodo de lactancia. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con epoetina alfa tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento con epoetina alfa para la madre.
No se recomienda el uso de epoetina alfa en las pacientes quirúrgicas en periodo de lactancia que participen en un programa de predonación autóloga.
Fertilidad
No existen estudios que evalúen el efecto potencial de la epoetina alfa sobre la fertilidad masculina o femenina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. La influencia de Binocrit sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del_perfil de seguridad
La reacción adversa al fármaco más frecuente durante el tratamiento con epoetina alfa es un aumento dosis-dependiente de la presión arterial o un agravamiento de una hipertensión existente. Debe realizarse un control de la presión arterial, sobre todo al comienzo del tratamiento (ver sección 4.4).
Las reacciones adversas al fármaco ocurridas con más frecuencia observadas en los ensayos clínicos con epoetina alfa, son la diarrea, náuseas, vómitos, pirexia y cefalea. La aparición de un cuadro pseudogripal puede tener lugar especialmente al comienzo del tratamiento.
En estudios con ampliación del intervalo de dosificación en pacientes adultos con insuficiencia renal que aún no se someten a diálisis, se ha informado congestión de las vías respiratorias, que consta de episodios de congestión de las vías respiratorias altas, congestión nasal y nasofaringitis.
Se ha observado un aumento de la incidencia de episodios vasculares trombóticos (EVT) en los pacientes que reciben estimulantes de la eritropoyesis (ver sección 4.4).
Tabla de reacciones adversas
De un total de 3.262 sujetos en 23 estudios aleatorizados, doble ciego y controlados con placebo o con el tratamiento de referencia, se evaluó el perfil de seguridad global de la epoetina alfa en 1.992 sujetos anémicos. Se incluyó a 228 sujetos con IRC tratados con epoetina alfa en 4 estudios de la insuficiencia renal crónica (2 estudios en prediálisis [N = 131 sujetos con IRC expuestos] y 2 en diálisis [N = 97 sujetos con IRC expuestos]), a 1.404 sujetos expuestos con cáncer en 16 estudios de la anemia debida a la quimioterapia, a 147 sujetos expuestos en 2 estudios de la donación de sangre autóloga y a 213 sujetos expuestos en un estudio en el período periquirúrgico. Las reacciones adversas al fármaco notificadas por > 1% de los sujetos tratados con epoetina alfa en estos ensayos se muestran en la tabla siguiente.
Estimación de la frecuencia: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Frecuencia | |||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
Frecuencia no conocida | |
|
Trastornos de la |
Aplasia | |||||
|
sangre y del sistema linfático |
eritrocítica pura, mediada por anticuerpos contra la eritropoyetina1,4, trombocitemia1 | |||||
|
Trastornos del metabolismo y de la nutrición |
Hiperpotasemia2 | |||||
|
Trastornos del sistema inmunológico |
Reacción anafiláctica3, hipersensibil idad3 | |||||
|
Trastornos del sistema nervioso |
Cefalea |
Convulsiones | ||||
|
Trastornos vasculares |
Trombosis venosas y arteriales4, hipertensión |
Crisis hipertensiva 4 | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Congestión de las vías respiratorias | ||||
|
Trastornos gastrointestinales |
Diarrea, náuseas, vómitos | |||||
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea |
Edema angioneuróti co3, urticaria3 | ||||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artralgia, dolor óseo, mialgia, dolor de una extremidad | |||||
|
Trastornos congénitos, familiares y genéticos |
Porfiria3 | |||||
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Escalofríos, enfermedad de tipo gripal, reacción en el lugar de la inyección, edema periférico |
Ineficacia del medicament o4 |
transitorios y trombosis de la derivación arteriovenosa (incluido el equipo de diálisis) y trombosis en aneurismas de una derivación arteriovenosa.
4 Abordado en la subsección siguiente o en la sección 4.4.
Descripción de reacciones adversas seleccionadas
Se han notificado reacciones de hipersensibilidad, incluso casos de erupción cutánea (entre ellos urticaria), reacciones anafilácticas y edema angioneurótico (ver sección 4.4).
Durante el tratamiento con epoetina alfa en pacientes con presión arterial previamente normal o baja se han producido crisis de hipertensión con encefalopatía y convulsiones, que han precisado la atención inmediata de un médico y cuidados médicos intensivos. Debe prestarse una atención especial a las cefaleas súbitas y lacerantes de tipo migrañoso, como posible señal de advertencia (ver sección 4.4).
En casos muy raros en < 1/10.000 casos por año-paciente se ha notificado aplasia eritrocítica pura mediada por anticuerpos, después de meses o años de tratamiento con epoetina alfa (ver sección 4.4).
Población _pediátrica con insuficiencia renal crónica en hemodiálisis
La exposición de pacientes pediátricos con insuficiencia renal crónica en hemodiálisis en los ensayos clínicos y en la experiencia posterior a la comercialización es limitada. En esta población no se notificaron reacciones adversas específicamente pediátricas no citadas previamente en la tabla anterior ni ninguna que no fuera compatible con la enfermedad subyacente.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
El margen terapéutico de la epoetina alfa es muy amplio. La sobredosificación de epoetina alfa puede producir efectos que son derivados de los efectos farmacológicos de la hormona. Puede realizarse una flebotomía si se produce una concentración excesivamente alta de hemoglobina. Pueden proporcionarse las medidas adicionales de apoyo que sean necesarias. 5 basándose en análisis funcionales. El peso molecular aparente de la eritropoyetina es de 32.000 a 40.000 daltons.
La eritropoyetina es un factor de crecimiento que estimula principalmente la producción de eritrocitos. Se pueden expresar receptores de eritropoyetina en la superficie de diversas células tumorales.
Efectos farmacodinámicos
Voluntarios sanos
Tras dosis únicas (20.000 a 160.000 UI por vía subcutánea) de epoetina alfa, se observó una respuesta dependiente de la dosis para los marcadores farmacodinámicos investigados, entre ellos reticulocitos, GR y hemoglobina. Para los cambios del porcentaje de reticulocitos se observó un perfil definido de concentración-tiempo con máximo y regreso a la situación inicial. Para los GR y la hemoglobina se observó un perfil menos definido. En general, todos los marcadores farmacodinámicos aumentaron de forma lineal con la dosis, alcanzando una respuesta máxima a los niveles máximos de dosis.
Posteriores estudios farmacodinámicos exploraron 40.000 UI una vez por semana frente a 150 UI/kg tres veces por semana. Pese a las diferencias en los perfiles de concentración-tiempo, la respuesta farmacodinámica (determinada por los cambios del porcentaje de reticulocitos, hemoglobina y GR totales) fue similar entre estas pautas. Otros estudios adicionales compararon la pauta de 40.000 UI de epoetina alfa una vez por semana con dosis cada dos semanas que oscilaron entre 80.000 y 120.000 UI por vía subcutánea. En conjunto, basándose en los resultados de estos estudios farmacodinámicos en sujetos sanos, la pauta posológica de 40.000 UI una vez por semana parece ser más eficaz para la producción de GR que las pautas cada dos semanas, pese a una similitud observada en la producción de reticulocitos en las pautas semanal y cada dos semanas.
Insuficiencia renal crónica
Se ha demostrado que la epoetina alfa estimula la eritropoyesis en pacientes anémicos con IRC, incluso los pacientes en diálisis y prediálisis. La primera prueba de una respuesta a la epoetina alfa es un aumento del recuento de reticulocitos en el plazo de 10 días, seguido de un aumento del recuento de eritrocitos, la hemoglobina y el hematocrito, habitualmente en el plazo de 2 a 6 semanas. La respuesta de la hemoglobina varía entre pacientes y puede verse afectada por las reservas de hierro y la presencia de problemas médicos concurrentes.
Anemia inducida _por la quimioterapia
La epoetina alfa administrada tres veces por semana o una vez por semana ha demostrado aumentar la hemoglobina y reducir las necesidades de transfusión después del primer mes de tratamiento en pacientes anémicos con cáncer que recibían quimioterapia.
En un estudio que comparó las pautas posológicas de 150 UI/kg tres veces por semana y 40.000 UI una vez por semana en sujetos sanos y en sujetos anémicos con cáncer, los perfiles temporales de los cambios del porcentaje de reticulocitos, la hemoglobina y los eritrocitos totales fueron similares entre ambas pautas posológicas, tanto en sujetos sanos como en los anémicos con cáncer. Las AUC de los respectivos parámetros farmacodinámicos fueron similares entre las pautas posológicas de 150 UI/kg tres veces por semana y 40.000 UI una vez por semana en sujetos sanos y también en sujetos anémicos con cáncer.
Pacientes quirúrgicos adultos en un programa de predonación autóloga
Se ha demostrado que la epoetina alfa estimula la producción de eritrocitos con el fin de aumentar la extracción de sangre autóloga y limitar el descenso de la hemoglobina en pacientes adultos programados para una intervención quirúrgica electiva mayor que no se espera que predepositen sus necesidades preoperatorias completas de sangre. Los mayores efectos se observan en los pacientes con hemoglobina baja (< 13 g/dl).
Tratamiento de pacientes adultos programados para una intervención quirúrgica ortopédica electiva mayor
En los pacientes programados para una intervención quirúrgica ortopédica electiva mayor con una hemoglobina antes del tratamiento > 10 a < 13 g/dl, la epoetina alfa ha demostrado reducir el riesgo de
recibir alotransfusiones y facilitar la recuperación eritroide (aumento de los niveles de hemoglobina y hematocrito y de los recuentos de reticulocitos).
Eficacia clínica y seguridad
Insuficiencia renal crónica
La epoetina alfa se ha estudiado en ensayos clínicos en pacientes adultos anémicos con IRC, incluso pacientes en diálisis y prediálisis, para tratar la anemia y mantener el hematocrito dentro de un intervalo de concentración deseado del 30 al 36%.
En los ensayos clínicos a dosis iniciales de 50 a 150 UI/kg tres veces por semana, aproximadamente el 95% de todos los pacientes respondieron con un aumento clínicamente significativo del hematocrito. Tras aproximadamente dos meses de tratamiento, prácticamente todos los pacientes podían prescindir de las transfusiones. Una vez alcanzado el hematocrito deseado, la dosis de mantenimiento se individualizó para cada paciente.
En los tres ensayos clínicos más extensos realizados en pacientes adultos en diálisis, la mediana de la dosis de mantenimiento necesaria para mantener el hematocrito entre el 30 y el 36% fue de unas 75 UI/kg administradas tres veces por semana.
En un estudio multicéntrico doble ciego y controlado con placebo de la calidad de vida en pacientes con IRC en hemodiálisis, se demostró una mejoría clínica y estadísticamente significativa en los pacientes tratados con epoetina alfa en comparación con el grupo del placebo al determinar la fatiga, los síntomas físicos, las relaciones y la depresión (cuestionario de la enfermedad renal) tras seis meses de tratamiento. Los pacientes del grupo tratado con epoetina alfa se inscribieron también en un estudio abierto de ampliación que demostró mejoras en su calidad de vida que se mantuvieron durante 12 meses adicionales.
Pacientes adultos con insuficiencia renal que aún no se someten a diálisis
En los ensayos clínicos realizados en pacientes con IRC no sometidos a diálisis tratados con epoetina alfa, la duración media del tratamiento fue de casi cinco meses. Estos pacientes respondieron al tratamiento con epoetina alfa de forma similar a la observada en los pacientes sometidos a diálisis. Los pacientes con IRC no sometidos a diálisis demostraron un aumento del hematocrito dependiente de la dosis y sostenido cuando se administró epoetina alfa por vía intravenosa o subcutánea. Se observaron tasas similares de aumento del hematocrito cuando se administró epoetina alfa por cualquiera de las dos rutas. Además, se demostró que las dosis de epoetina alfa de 75 a 150 UI/kg por semana mantienen hematocritos del 36 al 38% durante un máximo de seis meses.
En dos estudios con una dosificación de epoetina alfa con intervalos ampliados (tres veces por semana, una vez por semana, una vez cada dos semanas y una vez cada cuatro semanas) algunos pacientes con intervalos de dosificación más largos no mantuvieron niveles adecuados de hemoglobina y alcanzaron los criterios de retirada por hemoglobina definidos en el protocolo (0% en el grupo de una vez por semana, 3,7% en el de una vez cada dos semanas y 3,3% en el de una vez cada cuatro semanas).
En un ensayo prospectivo aleatorizado se evaluó a 1.432 pacientes anémicos con insuficiencia renal crónica que no estaban sometidos a diálisis. Se asignó a los pacientes a un tratamiento con epoetina alfa con el objetivo de mantener un nivel de hemoglobina de 13,5 g/dl (superior al nivel de concentración de hemoglobina recomendado) o de 11,3 g/dl. Se produjo un acontecimiento cardíaco importante (muerte, infarto de miocardio, apoplejía u hospitalización por insuficiencia cardíaca congestiva) en 125 (18%) de los 751 pacientes en el grupo de más hemoglobina en comparación con 97 (14%) en los 717 pacientes del grupo de menos hemoglobina (razón de riesgo [RR] 1,3, IC del 95%: 1,0, 1,7, p = 0,03).
Se han realizado análisis agrupados a posteriori de estudios clínicos de estimulantes de la eritropoyesis en pacientes con insuficiencia renal crónica (sometidos o no a diálisis, en pacientes diabéticos y no diabéticos). Se observó una tendencia hacia mayores estimaciones de riesgo de mortalidad por todas las causas y episodios cardiovasculares y cerebrovasculares asociadas a mayores dosis acumulativas de estimulantes de la eritropoyesis independientemente del estado de diabetes o diálisis (ver sección 4.2 y sección 4.4).
Tratamiento de pacientes con anemia inducida por la quimioterapia
La epoetina alfa se ha estudiado en ensayos clínicos en pacientes adultos anémicos con cáncer con tumores linfáticos y sólidos y en pacientes con diversas pautas quimioterapéuticas, entre ellas pautas con platino y sin platino. En estos ensayos la epoetina alfa administrada tres veces por semana y una vez por semana demostró aumentar la hemoglobina y reducir las necesidades de transfusión después del primer mes de tratamiento en pacientes anémicos con cáncer. En algunos estudios, la fase doble ciego fue seguida de una fase abierta durante la cual todos los pacientes recibieron epoetina alfa y se observó un mantenimiento del efecto.
Las pruebas disponibles sugieren que los pacientes con neoplasias malignas hematológicas y tumores sólidos responden de forma equivalente al tratamiento con epoetina alfa, y que los pacientes con o sin infiltración tumoral de la médula ósea responden de forma equivalente al tratamiento con epoetina alfa. La intensidad similar de la quimioterapia en los grupos de epoetina alfa y placebo en los ensayos de quimioterapia se demostró por un área bajo la curva de neutrófilos-tiempo similar en los pacientes tratados con epoetina alfa y en los pacientes tratados con placebo, así como por una proporción similar de pacientes en los grupos tratados con epoetina alfa y con placebo cuyos recuentos absolutos de neutrófilos descendieron por debajo de 1.000 y 500 células/^l.
En un ensayo clínico prospectivo, aleatorizado, doble ciego y controlado con placebo, realizado en 375 pacientes anémicos con diversas neoplasias malignas no mieloides, que recibieron quimioterapia sin platino, hubo una reducción significativa de las secuelas relacionadas con la anemia (p. ej.: fatiga, disminución de la energía y reducción de la actividad), que se midieron mediante los siguientes instrumentos y escalas: Escala general de Evaluación funcional del tratamiento del cáncer-anemia (FACT-An), Escala de fatiga FACT-An y Escala lineal analógica del cáncer (CLAS). Otros dos ensayos clínicos más pequeños, aleatorizados y controlados con placebo no mostraron una mejoría significativa de los parámetros de calidad de vida en la escala EORTC-QLQ-C30 o en la CLAS, respectivamente.
Se han examinado la supervivencia y la progresión de los tumores en cinco ensayos controlados, a gran escala, con un total de 2.833 pacientes, de los cuales cuatro fueron ensayos doble ciego y controlados con placebo y uno fue un ensayo abierto. En los ensayos se incluyó a pacientes que recibían quimioterapia (dos ensayos) o se usaron poblaciones de pacientes en las que no están indicados los estimuladores de la eritropoyesis: anemia en los pacientes que no reciben quimioterapia, y pacientes con cáncer de cabeza y cuello que reciben radioterapia. El nivel deseado de la concentración de hemoglobina en dos ensayos fue > 13 g/dl (8,1 mmol/l); en los tres ensayos restantes, 12 a 14 g/dl (7,5 a 8,7 mmol/l). En el ensayo abierto no hubo ninguna diferencia en la supervivencia global entre los pacientes tratados con eritropoyetina humana recombinante y los controles. En los cuatro ensayos controlados con placebo, las razones de riesgo de supervivencia global variaron entre 1,25 y 2,47, a favor de los controles. Estos ensayos han demostrado un exceso de mortalidad concluyente, inexplicado y estadísticamente significativo en los pacientes que sufren anemia asociada a diversos tipos frecuentes de cáncer que recibieron eritropoyetina humana recombinante, en comparación con los controles. El resultado de supervivencia global en los ensayos clínicos no se pudo explicar satisfactoriamente por las diferencias en la incidencia de trombosis y las complicaciones relacionadas entre los pacientes que recibieron eritropoyetina humana recombinante y los del grupo placebo.
Se ha realizado también un análisis de datos, al nivel de los pacientes, de más de 13.900 pacientes con cáncer (quimioterapia, radioterapia, quimiorradioterapia o sin tratamiento), que participaron en 53 ensayos clínicos controlados con varias epoetinas. El metaanálisis de los datos de supervivencia global produjo una estimación de punto de razón de riesgos de 1,06 a favor de los controles (IC 95%: 1,00, 1,12; 53 ensayos clínicos y 13.933 pacientes); y en el caso de los pacientes con cáncer que recibieron quimioterapia, la razón de riesgos de supervivencia global fue de 1,04 (IC 95%: 0,97, 1,11; 38 ensayos clínicos y 10.441 pacientes). Los metaanálisis también indican de manera concluyente un aumento significativo del riesgo relativo de episodios tromboembólicos en los pacientes con cáncer que recibieron eritropoyetina humana recombinante (ver sección 4.4).
Se realizó un ensayo aleatorizado, abierto y multicéntrico en 2.098 mujeres con anemia y cáncer de mama metastásico que habían recibido quimioterapia de primera o segunda línea. Se trataba de un estudio de no inferioridad con epoetina alfa y tratamiento de referencia frente a tratamiento de referencia solo diseñado para descartar un aumento del riesgo del 15 % de progresión tumoral o muerte. La mediana de la supervivencia sin progresión (SSP) según la evaluación de la progresión de la enfermedad por parte del investigador fue de 7,4 meses en cada grupo (CRI 1,09, IC del 95 %: 0,99, 1,20), lo que indicó que no se había alcanzado el objetivo del ensayo. En la fecha de corte clínica, se notificaron 1.337 muertes. La mediana de la supervivencia global en el grupo de epoetina alfa y tratamiento de referencia fue de 17,2 meses, en comparación con los 17,4 meses en el grupo de tratamiento de referencia solo (CRI 1,06, IC del 95 %: 0,95, 1,18). Hubo significativamente menos pacientes que recibieron transfusiones de GR en el grupo de epoetina alfa y tratamiento de referencia (5,8 % frente a 11,4 %); sin embargo, hubo significativamente más pacientes con episodios vasculares trombóticos en el grupo de epoetina alfa y tratamiento de referencia (2,8 % frente a 1,4 %).
Programa de _predonación autóloga
El efecto de la epoetina alfa para facilitar la donación autóloga de sangre en pacientes con hematocrito bajo (< 39% y sin anemia subyacente debida a deficiencia de hierro) programados para una intervención quirúrgica ortopédica mayor se evaluó en un estudio doble ciego controlado con placebo realizado en 204 pacientes, y en un estudio simple ciego controlado con placebo realizado en 55 pacientes.
En el estudio doble ciego, se trató a los pacientes con epoetina alfa 600 UI/kg o placebo por vía intravenosa una vez al día cada 3 o 4 días durante tres semanas (un total de 6 dosis). Por término medio, los pacientes tratados con epoetina alfa pudieron depositar un número significativamente mayor de unidades de sangre (4,5 unidades) que los pacientes tratados con placebo (3,0 unidades).
En el estudio simple ciego, se trató a los pacientes con epoetina alfa 300 UI/kg o 600 UI/kg o placebo por vía intravenosa una vez al día cada 3 o 4 días durante tres semanas (un total de 6 dosis). Los pacientes tratados con epoetina alfa pudieron depositar también un número significativamente mayor de unidades de sangre (epoetina alfa 300 UI/kg = 4,4 unidades, epoetina alfa 600 UI/kg = 4,7 unidades) que los pacientes tratados con placebo (2,9 unidades).
El tratamiento con epoetina alfa redujo el riesgo de exposición a sangre alógena en un 50% en comparación con los pacientes que no recibieron epoetina alfa.
Intervención quirúrgica ortopédica electiva mayor
El efecto de la epoetina alfa (300 UI/kg o 100 UI/kg) sobre la exposición a alotransfusión de sangre se evaluó en un ensayo clínico doble ciego controlado con placebo en pacientes adultos sin deficiencia de hierro programados para una intervención quirúrgica ortopédica electiva mayor de cadera o rodilla. Se administró epoetina alfa por vía subcutánea durante 10 días antes de la intervención, el día de la intervención y durante cuatro días después de la intervención. Se estratificó a los pacientes en función de su hemoglobina inicial (< 10 g/dl, > 10 a < 13 g/dl y > 13 g/dl).
La epoetina alfa 300 UI/kg redujo significativamente el riesgo de alotransfusión en los pacientes con un nivel de hemoglobina antes del tratamiento de > 10 a < 13 g/dl. El 16% de los pacientes tratados con epoetina alfa 300 UI/kg, el 23% de los tratados con epoetina alfa 100 UI/kg y el 45% de los tratados con placebo requirieron transfusión.
En un ensayo abierto de grupos paralelos en sujetos adultos sin deficiencia de hierro con un nivel de hemoglobina antes del tratamiento de > 10 a < 13 g/dl programados para una intervención quirúrgica ortopédica mayor de cadera o rodilla, se comparó la epoetina alfa 300 UI/kg por vía subcutánea durante 10 días antes de la intervención, el día de la intervención y durante cuatro días después de la intervención con epoetina alfa 600 UI/kg por vía subcutánea una vez por semana durante tres semanas antes de la intervención y el día de la intervención.
Desde el pretratamiento hasta antes de la intervención, el aumento medio de la hemoglobina en el grupo de 600 UI/kg semanales (1,44 g/dl) fue el doble que el observado en el grupo de 300 UI/kg diarias (0,73 g/dl). Los niveles medios de hemoglobina fueron similares para ambos grupos de tratamiento durante todo el período posquirúrgico.
La respuesta eritropoyética observada en ambos grupos de tratamiento dio lugar a tasas de transfusión similares (16% en el grupo de 600 UI/kg semanales y 20% en el grupo de 300 UI/kg diarias).
Población _ pediátrica
Insuficiencia renal crónica
Se evaluó la epoetina alfa en un estudio clínico abierto, no aleatorizado, con intervalo de dosis abierto, de 52 semanas, en pacientes pediátricos con IRC sometidos a hemodiálisis. La mediana de edad de los pacientes inscritos en el estudio fue de 11,6 años (intervalo de 0,5 a 20,1 años).
Se administró epoetina alfa a 75 UI/kg/semana por vía intravenosa en 2 o 3 dosis divididas después de la diálisis, tituladas a 75 UI/kg/semana a intervalos de cuatro semanas (hasta un máximo de 300 UI/kg/semana), para alcanzar un aumento de la hemoglobina de 1 g/dl/mes. El intervalo de concentración de hemoglobina deseado fue de 9,6 a 11,2 g/dl. El 81% de los pacientes alcanzaron el nivel de concentración de hemoglobina. La mediana del tiempo hasta el objetivo fue de 11 semanas y la mediana de la dosis en el objetivo fue de 150 UI/kg/semana. De los pacientes que alcanzaron el objetivo, el 90% lo hicieron con una pauta posológica de tres veces por semana.
Después de 52 semanas, el 57% de los pacientes continuaban en el estudio, recibiendo una dosis mediana de 200 UI/kg/semana.
Los datos clínicos para la administración subcutánea en niños son limitados. En cinco ensayos abiertos, no controlados y de tamaño reducido (el número de pacientes osciló entre 9 y 22, en total N = 72), se administró epoetina alfa por vía subcutánea en niños a dosis iniciales de 100 UI/kg/semana a 150 UI/kg/semana, con la posibilidad de aumentarlas hasta 300 UI/kg/semana. En estos ensayos, la mayoría de los pacientes eran prediálisis (N = 44), 27 pacientes estaban en diálisis peritoneal y 2 pacientes en hemodiálisis, con un rango de edad de entre 4 meses y 17 años. En general, estos ensayos presentan limitaciones metodológicas, aunque el tratamiento se asoció positivamente con unos niveles de hemoglobina mayores. No se notificaron acontecimientos adversos inesperados (ver sección 4.2).
Anemia inducida por quimioterapia
Se evaluó la epoetina alfa 600 UI/kg (administrada por vía intravenosa o subcutánea una vez por semana) en un ensayo aleatorizado, doble ciego, controlado con placebo de 16 semanas de duración y en otro ensayo abierto, aleatorizado y controlado de 20 semanas de duración en pacientes pediátricos con anemia que recibieron quimioterapia mielosupresora para el tratamiento de diversas neoplasias malignas no mieloides de la infancia.
En el ensayo de 16 semanas de duración (N = 222), los pacientes tratados con epoetina alfa no mostraron ningún efecto estadísticamente significativo en el Cuestionario de calidad de vida pediátrico (Paediatric Quality of Life Inventory) completado por el propio paciente o por los progenitores ni en las puntuaciones del Módulo de cáncer (Cancer Module), en comparación con los pacientes tratados con placebo (criterio principal de valoración). Asimismo, tampoco se observó ninguna diferencia estadística entre la proporción de pacientes tratados con epoetina alfa que precisaron transfusiones de GR y el grupo de pacientes tratado con placebo.
En el ensayo de 20 semanas de duración (N = 225), no se observó ninguna diferencia significativa en la variable principal de eficacia; es decir, la proporción de pacientes que precisaron una transfusión de GR después del día 28 (62 % de los pacientes tratados con epoetina alfa frente al 69 % de los pacientes que recibieron tratamiento estándar).
5.2 Propiedades farmacocinéticas
Absorción
Tras una inyección subcutánea, los niveles séricos de epoetina alfa alcanzan un máximo entre 12 y 18 horas después de la dosis. No hubo acumulación tras la administración de varias dosis de 600 UI/kg administradas por vía subcutánea semanalmente.
La biodisponibilidad absoluta de la epoetina alfa inyectada por vía subcutánea es de aproximadamente el 20% en sujetos sanos.
Distribución
El volumen medio de distribución fue de 49,3 ml/kg tras dosis intravenosas de 50 y 100 UI/kg en sujetos sanos. Tras la administración intravenosa de epoetina alfa en sujetos con insuficiencia renal crónica, el volumen de distribución osciló entre 57-107 ml/kg tras una dosificación única (12 UI/kg) y 42-64 ml/kg tras varias dosificaciones (48-192 UI/kg), respectivamente. Así, el volumen de distribución es algo mayor que el espacio plasmático.
Eliminación
La semivida de la epoetina alfa después de la administración de varias dosis por vía intravenosa es de aproximadamente cuatro horas en sujetos sanos.
Se calcula que la semivida con la vía subcutánea es de aproximadamente 24 horas en sujetos sanos.
La CL/F media para las pautas de 150 UI/kg tres veces por semana y de 40.000 UI una vez por semana en sujetos sanos fueron de 31,2 y 12,6 ml/h/kg, respectivamente. La CL/F media para las pautas de 150 UI/kg tres veces por semana y de 40.000 UI una vez por semana en sujetos anémicos con cáncer fueron de 45,8 y 11,3 ml/h/kg, respectivamente. En la mayoría de los sujetos anémicos con cáncer que recibían quimioterapia cíclica, la CL/F fue más baja tras dosis subcutáneas de 40.000 UI una vez por semana y 150 UI/kg tres veces por semana en comparación con los valores para sujetos sanos.
Linealidad/No linealidad
En sujetos sanos se observó un aumento proporcional a la dosis de las concentraciones séricas de epoetina alfa tras la administración intravenosa de 150 y 300 UI/kg tres veces por semana. La administración de dosis únicas de 300 a 2.400 UI/kg de epoetina alfa subcutánea dio lugar a una relación lineal entre la Cmax media y la dosis y entre el AUC media y la dosis. Se observó una relación inversa entre el aclaramiento aparente y la dosis en sujetos sanos.
En estudios para explorar la ampliación del intervalo de dosificación (40.000 UI una vez por semana y 80.000, 100.000 y 120.000 UI cada dos semanas), se observó una relación lineal pero no proporcional a la dosis entre la Cmax media y la dosis, y entre el AUC media y la dosis en estado estacionario.
Relacion(es) _ farmacocinética(s)/farmacodinámica(s)
La epoetina alfa presenta un efecto relacionado con la dosis sobre los parámetros hematológicos que es independiente de la vía de administración.
Población pediátrica
Se ha informado una semivida de aproximadamente 6,2 a 8,7 horas en pacientes pediátricos con insuficiencia renal crónica tras la administración de varias dosis intravenosas de epoetina alfa. El perfil farmacocinético de la epoetina alfa en niños y adolescentes parece ser similar al de los adultos.
Los datos farmacocinéticos en neonatos son limitados.
Un ensayo llevado a cabo en 7 neonatos prematuros con muy bajo peso al nacer y 10 adultos sanos que recibieron eritropoyetina por vía intravenosa indicó que el volumen de distribución fue aproximadamente de 1,5 a 2 veces mayor en los neonatos prematuros que en los adultos sanos, y que el aclaramiento fue aproximadamente 3 veces mayor en los neonatos prematuros que en los adultos sanos.
Insuficiencia renal
En los pacientes con insuficiencia renal crónica, la semivida de la epoetina alfa administrada por vía intravenosa está ligeramente prolongada, aproximadamente 5 horas, en comparación con los sujetos sanos.
5.3 Datos preclínicos sobre seguridad
En los estudios toxicológicos a dosis repetidas en perros y ratas, pero no en monos, el tratamiento con epoetina alfa se asoció a fibrosis subclínica de la médula ósea. La fibrosis de la médula ósea es una complicación conocida de la insuficiencia renal crónica en los seres humanos y puede estar relacionada con hiperparatiroidismo secundario o factores desconocidos. La incidencia de fibrosis de la médula ósea no aumentó en un ensayo en pacientes en hemodiálisis que recibieron tratamiento con epoetina alfa durante tres años, en comparación con un grupo control de pacientes sometidos a diálisis que no habían recibido tratamiento con epoetina alfa.
La epoetina alfa no induce mutaciones genéticas bacterianas (prueba de Ames), aberraciones cromosómicas en células de mamíferos, micronúcleos en ratones, ni mutación génica en el locus HGPRT.
No se han realizado estudios de carcinogenia a largo plazo. Los resultados contradictorios en la bibliografía, basados en los datos in vitro de muestras de tumores humanos, sugieren que las eritropoyetinas pueden desempeñar una función como proliferadores tumorales. Esto tiene una significación indeterminada en la situación clínica.
En cultivos celulares de médula ósea humana, la epoetina alfa estimula la eritropoyesis específicamente y no afecta a la leucopoyesis. No se pudieron detectar acciones citotóxicas de la epoetina alfa en las células de la médula ósea.
En estudios en animales, se ha demostrado que la epoetina alfa reduce el peso corporal fetal, retrasa la osificación y aumenta la mortalidad fetal cuando se administra a dosis semanales de aproximadamente 20 veces la dosis semanal recomendada para el ser humano. Estos cambios se interpretaron como secundarios a una disminución del aumento de peso corporal materno, y su significación para el ser humano es indeterminada dados los niveles posológicos terapéuticos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato dihidrógeno de sodio dihidratado
Fosfato disódico dihidratado
Cloruro de sodio
Glicina
Polisorbato 80
Agua para preparaciones inyectables Ácido clorhídrico (para el ajuste del pH)
Hidróxido de sodio (para el ajuste del pH)
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 2 años.
6.4 Precauciones especiales de conservación
Conservar y transportar refrigerado (entre 2°C y 8°C). Este intervalo de temperatura debe mantenerse estrechamente hasta la administración al paciente.
Para su uso ambulatorio, el producto puede sacarse de la nevera, sin volverlo a meter en ella, durante un plazo máximo de tres días a una temperatura no superior a 25°C. Si el medicamento no se ha utilizado al final de este plazo, debe desecharse.
No congelar ni agitar.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Jeringas precargadas (vidrio de tipo I), con o sin protector de seguridad para la aguja, con tapón de émbolo (goma con lado de Teflon), selladas en un blister.
Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,5 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada Cada jeringa contiene 1 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,3 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,4 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,5 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,6 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,7 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,8 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,9 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada Cada jeringa contiene 1 ml solución inyectable.
Envase de 1 o 6 jeringas.
Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,5 ml solución inyectable.
Envase de 1, 4 o 6 jeringas.
Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada Cada jeringa contiene 0,75 ml solución inyectable.
Envase de 1, 4 o 6 jeringas.
Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada Cada jeringa contiene 1 ml solución inyectable.
Envase de 1, 4 o 6 jeringas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Binocrit no debería utilizarse y debe desecharse
- si el líquido está coloreado u observa partículas flotando en él,
- si el precinto está roto,
- si sabe o cree que puede haberse congelado accidentalmente, o
- si se ha producido un fallo de la nevera.
Las jeringas precargadas están listas para usar (ver sección 4.2). La jeringa precargada no debe agitarse. Las jeringas están grabadas con anillos de graduación, a fin de permitir el uso parcial si es necesario. Cada anillo de graduación corresponde a un volumen de 0,1 ml. El producto es para un solo uso. Tome sólo una dosis de Binocrit de cada jeringa, desechando la solución no deseada antes de la inyección.
Uso de la jeringa precargada con protector de seguridad para la aguja
El protector de seguridad para la aguja cubre ésta tras haber realizado la inyección con el fin de prevenir pinchazos accidentales. Ello no afecta a la forma de utilizar la jeringa. Empujar el émbolo lenta y uniformemente hasta que se haya administrado la totalidad de la dosis y el émbolo no pueda seguir avanzando. Retirar la jeringa, manteniendo la presión sobre el émbolo. El protector de seguridad para la aguja cubrirá ésta una vez que se suelte el émbolo.
Uso de la jeringa precargada sin protector de seguridad para la aguja.
Administrar la dosis según el protocolo estándar.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestr. 10 A-6250 Kundl Austria
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada
EU/1/07/410/001
EU/1/07/410/002
EU/1/07/410/027
EU/1/07/410/028
Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada
EU/1/07/410/003
EU/1/07/410/004
EU/1/07/410/029
EU/1/07/410/030
Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada
EU/1/07/410/005
EU/1/07/410/006
EU/1/07/410/031
EU/1/07/410/032
Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada
EU/1/07/410/007
EU/1/07/410/008
EU/1/07/410/033
EU/1/07/410/034
Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada
EU/1/07/410/009
EU/1/07/410/010
EU/1/07/410/035
EU/1/07/410/036
Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada
EU/1/07/410/011
EU/1/07/410/012
EU/1/07/410/037
EU/1/07/410/038
Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada
EU/1/07/410/017
EU/1/07/410/018
EU/1/07/410/039
EU/1/07/410/040
Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada
EU/1/07/410/013
EU/1/07/410/014
EU/1/07/410/041
EU/1/07/410/042
Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada
EU/1/07/410/019
EU/1/07/410/020
EU/1/07/410/043
EU/1/07/410/044
Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada
EU/1/07/410/015
EU/1/07/410/016
EU/1/07/410/045
EU/1/07/410/046
Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada
EU/1/07/410/021
EU/1/07/410/022
EU/1/07/410/047
EU/1/07/410/053
EU/1/07/410/048
Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada
EU/1/07/410/023
EU/1/07/410/024
EU/1/07/410/049
EU/1/07/410/054
EU/1/07/410/050
Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada
EU/1/07/410/025
EU/1/07/410/026
EU/1/07/410/051
EU/1/07/410/055
EU/1/07/410/052
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 28 de agosto de 2007 Fecha de la última renovación: 18 de junio de 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del principio activo biológico
Rentschler Biotechnologie GmbH Erwin-Rentschler-Strasse 21 D-88471 Laupheim Alemania
Lek Pharmaceuticals d.d.
Kolodvorska 27 SI-1234 Menges Eslovenia
Nombre y dirección del fabricante responsable de la liberación de los lotes
Sandoz GmbH Biochemiestr. 10 A-6250 Kundl Austria
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
• Liberación oficial de los lotes
De conformidad con el artículo 114 de la Directiva 2001/83/CE modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o
como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,5 ml contiene 1.000 unidades internacionales (UI) y corresponde a 8,4 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,5 ml 6 jeringas precargadas de 0,5 ml
1 jeringa precargada de 0,5 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,5 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/001
EU/1/07/410/002
EU/1/07/410/027
EU/1/07/410/028
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 1.000 UI/0,5 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
PC:
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 1.000 UI/0,5 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 1 ml contiene 2.000 unidades internacionales (UI) y corresponde a 16,8 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 1 ml 6 jeringas precargadas de 1 ml
1 jeringa precargada de 1 ml con protector de seguridad para la aguja 6 jeringas precargadas de 1 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/003
EU/1/07/410/004
EU/1/07/410/029
EU/1/07/410/030
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 2.000 UI/1 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 2.000 UI/1 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,3 ml contiene 3.000 unidades internacionales (UI) y corresponde a 25,2 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,3 ml 6 jeringas precargadas de 0,3 ml
1 jeringa precargada de 0,3 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,3 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/005
EU/1/07/410/006
EU/1/07/410/031
EU/1/07/410/032
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 3.000 UI/0,3 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
PC:
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 3.000 UI/0,3 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,4 ml contiene 4.000 unidades internacionales (UI) y corresponde a 33,6 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,4 ml 6 jeringas precargadas de 0,4 ml
1 jeringa precargada de 0,4 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,4 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/007
EU/1/07/410/008
EU/1/07/410/033
EU/1/07/410/034
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 4.000 UI/0,4 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 4.000 UI/0,4 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,5 ml contiene 5.000 unidades internacionales (UI) y corresponde a 42,0 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,5 ml 6 jeringas precargadas de 0,5 ml
1 jeringa precargada de 0,5 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,5 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/009
EU/1/07/410/010
EU/1/07/410/035
EU/1/07/410/036
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 5.000 UI/0,5 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 5.000 UI/0,5 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,6 ml contiene 6.000 unidades internacionales (UI) y corresponde a 50,4 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,6 ml 6 jeringas precargadas de 0,6 ml
1 jeringa precargada de 0,6 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,6 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/011
EU/1/07/410/012
EU/1/07/410/037
EU/1/07/410/038
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 6.000 UI/0,6 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 6.000 UI/0,6 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,7 ml contiene 7.000 unidades internacionales (UI) y corresponde a 58,8 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,7 ml 6 jeringas precargadas de 0,7 ml
1 jeringa precargada de 0,7 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,7 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/017
EU/1/07/410/018
EU/1/07/410/039
EU/1/07/410/040
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 7.000 UI/0,7 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 7.000 UI/0,7 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,8 ml contiene 8.000 unidades internacionales (UI) y corresponde a 67,2 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,8 ml 6 jeringas precargadas de 0,8 ml
1 jeringa precargada de 0,8 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,8 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/013
EU/1/07/410/014
EU/1/07/410/041
EU/1/07/410/042
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 8.000 UI/0,8 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 8.000 UI/0,8 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,9 ml contiene 9.000 unidades internacionales (UI) y corresponde a 75,6 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,9 ml 6 jeringas precargadas de 0,9 ml
1 jeringa precargada de 0,9 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,9 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/019
EU/1/07/410/020
EU/1/07/410/043
EU/1/07/410/044
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 9.000 UI/0,9 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 9.000 UI/0,9 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 1 ml contiene 10.000 unidades internacionales (UI) y corresponde a 84,0 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 1 ml 6 jeringas precargadas de 1 ml
1 jeringa precargada de 1 ml con protector de seguridad para la aguja 6 jeringas precargadas de 1 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/410/015
EU/1/07/410/016
EU/1/07/410/045
EU/1/07/410/046
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Binocrit 10.000 UI/1 ml
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 10.000 UI/1 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,5 ml contiene 20.000 unidades internacionales (UI) y corresponde a 168,0 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,5 ml 6 jeringas precargadas de 0,5 ml
1 jeringa precargada de 0,5 ml con protector de seguridad para la aguja 4 jeringas precargadas de 0,5 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,5 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
EU/1/07/410/021
EU/1/07/410/022
EU/1/07/410/047
EU/1/07/410/053
EU/1/07/410/048
Lote
Binocrit 20.000 UI/0,5 ml
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 20.000 UI/0,5 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 0,75 ml contiene 30.000 unidades internacionales (UI) y corresponde a 252,0 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 0,75 ml 6 jeringas precargadas de 0,75 ml
1 jeringa precargada de 0,75 ml con protector de seguridad para la aguja 4 jeringas precargadas de 0,75 ml con protector de seguridad para la aguja 6 jeringas precargadas de 0,75 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
EU/1/07/410/023
EU/1/07/410/024
EU/1/07/410/049
EU/1/07/410/054
EU/1/07/410/050
Lote
Binocrit 30.000 UI/0,75 ml
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 30.000 UI/0,75 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada Epoetina alfa
1 jeringa precargada de 1 ml contiene 40.000 unidades internacionales (UI) y corresponde a 336,0 microgramos de epoetina alfa.
Excipientes: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada.
1 jeringa precargada de 1 ml 6 jeringas precargadas de 1 ml
1 jeringa precargada de 1 ml con protector de seguridad para la aguja 4 jeringas precargadas de 1 ml con protector de seguridad para la aguja 6 jeringas precargadas de 1 ml con protector de seguridad para la aguja
Vía subcutánea e intravenosa.
Leer el prospecto antes de utilizar este medicamento. No agitar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Mantener la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Sandoz GmbH, Biochemiestr. 10, A-6250 Kundl, Austria
EU/1/07/410/025
EU/1/07/410/026
EU/1/07/410/051
EU/1/07/410/055
EU/1/07/410/052
Lote
Binocrit 40.000 UI/1 ml
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
ETIQUETA/JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Binocrit 40.000 UI/1 ml inyectable
Epoetina alfa IV/SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente Binocrit 1.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 2.000 UI/1 ml solución inyectable en una jeringa precargada Binocrit 3.000 UI/0,3 ml solución inyectable en una jeringa precargada Binocrit 4.000 UI/0,4 ml solución inyectable en una jeringa precargada Binocrit 5.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 6.000 UI/0,6 ml solución inyectable en una jeringa precargada Binocrit 7.000 UI/0,7 ml solución inyectable en una jeringa precargada Binocrit 8.000 UI/0,8 ml solución inyectable en una jeringa precargada Binocrit 9.000 UI/0,9 ml solución inyectable en una jeringa precargada Binocrit 10.000 UI/1 ml solución inyectable en una jeringa precargada Binocrit 20.000 UI/0,5 ml solución inyectable en una jeringa precargada Binocrit 30.000 UI/0,75 ml solución inyectable en una jeringa precargada
Binocrit 40.000 UI/1 ml solución inyectable en una jeringa precargada
Epoetina alfa
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Binocrit y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Binocrit
3. Cómo usar Binocrit
4. Posibles efectos adversos
5. Conservación de Binocrit
6. Contenido del envase e información adicional
1. Qué es Binocrit y para qué se utiliza
Binocrit contiene el principio activo epoetina alfa, una proteína que estimula a la médula ósea para que produzca más glóbulos rojos, que llevan la hemoglobina (una sustancia que transporta oxígeno). La epoetina alfa es una copia de la proteína humana eritropoyetina y actúa de la misma manera.
Binocrit se usa para tratar la anemia sintomática causada por una enfermedad renal:
• En niños en hemodiálisis.
• En adultos en hemodiálisis o diálisis peritoneal.
• En adultos con anemia grave que aún no se someten a diálisis.
Si padece una enfermedad renal, puede que tenga un número bajo de glóbulos rojos si su riñón no produce suficiente eritropoyetina (necesaria para la producción de glóbulos rojos). Binocrit se receta con el fin de estimular a la médula ósea para que produzca más glóbulos rojos.
Binocrit se usa para tratar la anemia en adultos que reciben quimioterapia para el tratamiento de tumores sólidos, linfoma maligno o mieloma múltiple (cáncer de la médula ósea) que pueden necesitar una transfusión sanguínea. Binocrit puede reducir la necesidad de recibir una transfusión sanguínea en estos pacientes.
Binocrit se usa en adultos con anemia moderada que donan parte de su sangre antes de una intervención quirúrgica, para que se les pueda readministrar durante la intervención o después de ella. Dado que Binocrit estimula la producción de glóbulos rojos, los médicos pueden extraer más sangre de estas personas.
Binocrit se usa en adultos con anemia moderada que están a punto de someterse a una intervención quirúrgica ortopédica mayor (por ejemplo, intervenciones de reemplazo de cadera o rodilla), para reducir la posible necesidad de transfusiones de sangre.
2. Qué necesita saber antes de empezar a usar Binocrit No use Binocrit:
• Si es alérgico a la epoetina alfa o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
• Si le han diagnosticado una aplasia eritrocítica pura (la médula ósea no puede producir suficientes glóbulos rojos) después del tratamiento previo con cualquier producto que estimule la producción de glóbulos rojos (incluido Binocrit). Ver sección 4.
• Si tiene hipertensión arterial no correctamente controlada con medicamentos.
• Para estimular la producción de glóbulos rojos (de modo que sus médicos le puedan extraer más sangre), si no puede recibir transfusiones de su propia sangre durante la intervención quirúrgica o después de ella.
• Si está a punto de someterse a una intervención quirúrgica ortopédica electiva mayor (como, por ejemplo, una intervención de cadera o rodilla) y usted:
• padece una enfermedad cardiaca grave,
• padece trastornos graves de las venas y arterias,
• ha sufrido recientemente un ataque al corazón o un derrame cerebral,
• no puede tomar medicamentos para hacer menos espesa la sangre.
Puede que Binocrit no sea adecuado para usted. Hable con su médico. Algunas personas necesitan medicamentos para reducir el riesgo de que se formen coágulos de sangre durante el tratamiento con Binocrit. Si no puede tomar medicamentos para prevenir la formación de coágulos de sangre, no debe tomar Binocrit.
Advertencias y precauciones:
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Binocrit.
Binocrit y otros productos que estimulan la producción de glóbulos rojos pueden aumentar el riesgo de formación de coágulos sanguíneos en todos los pacientes. Este riesgo puede ser mayor si usted tiene otros factores de riesgo para la formación de coágulos sanguíneos (por ejemplo, si ha tenido un coágulo sanguíneo en el pasado o tiene sobrepeso, diabetes, padece una enfermedad del corazón o se encuentra postrado durante mucho tiempo debido a una intervención quirúrgica o enfermedad). Informe a su médico acerca de cualquiera de estas cosas. Su médico le ayudará a decidir si Binocrit es adecuado para usted.
Es importante que informe a su médico si se identifica con alguna de las siguientes situaciones. Es posible que aún así pueda usar Binocrit, pero coméntelo antes con su médico.
Si sabe que padece o ha padecido:
• hipertensión arterial;
• crisis epilépticas o convulsiones;
• una enfermedad del hígado;
• anemia de otras causas;
• porfiria (un trastorno raro de la sangre).
Si es un paciente con cáncer, debe saber que los productos que estimulan la producción de glóbulos rojos (como Binocrit) pueden actuar como un factor de crecimiento y por tanto pueden afectar, en teoría, a la progresión del cáncer.
Dependiendo de su situación individual, puede ser preferible una transfusión de sangre.
Comente esto con su médico.
Si es un paciente con hepatitis C y recibe interferón y ribavirina, debe comentarlo con su médico, ya que la combinación de epoetina alfa con interferón y ribavirina ha provocado una pérdida del efecto y la aparición de una enfermedad llamada aplasia eritrocítica pura (AEP), una forma grave de anemia, en casos raros. Binocrit no está aprobado para el tratamiento de la anemia asociada a la hepatitis C.
Si es un paciente con insuficiencia renal crónica, y en especial si no responde bien a Binocrit, su médico comprobará su dosis de Binocrit, porque aumentar repetidamente la dosis de Binocrit si no responde al tratamiento puede aumentar el riesgo de padecer un problema de corazón o de los vasos sanguíneos y podría aumentar el riesgo de infarto de miocardio, apoplejía y muerte.
Si es un paciente con cáncer, debe saber que el uso de Binocrit puede asociarse a una menor supervivencia y una mayor tasa de mortalidad en pacientes con cáncer de cabeza y cuello y cáncer de mama metastásico que reciben quimioterapia.
Tenga especial cuidado con otros productos que estimulan la producción de glóbulos rojos:
Binocrit es un producto perteneciente a un grupo de productos que estimulan la producción de glóbulos rojos al igual que la eritropoyetina, que es una proteína humana. Su profesional médico anotará siempre exactamente el producto que usted usa. Si, durante su tratamiento, se le administra un producto perteneciente a este grupo, distinto a Binocrit, consulte a su médico o farmacéutico antes de usarlo.
Uso de Binocrit con otros medicamentos
Normalmente, Binocrit no reacciona con otros medicamentos, pero informe a su médico si está utilizando (o ha utilizado recientemente) cualquier otro medicamento, incluso los adquiridos sin receta.
Si toma un medicamento llamado ciclosporina (que se utiliza, por ejemplo, tras un trasplante de riñón), su médico puede solicitar análisis de sangre para comprobar la concentración de ciclosporina, mientras se encuentre en tratamiento con Binocrit.
Los suplementos de hierro y otros estimulantes de la sangre pueden aumentar la eficacia de Binocrit. Su médico decidirá si es adecuado que los tome.
Si visita un hospital, clínica o médico de cabecera, dígales que recibe tratamiento con Binocrit, ya que puede afectar a otros tratamientos o resultados de análisis.
Embarazo y lactancia
Es importante que informe a su médico si se identifica con alguna de las siguientes situaciones. Es posible que aún así pueda usar Binocrit, pero coméntelo antes con su médico:
• si está embarazada o cree que podría estar embarazada,
• si está en periodo de lactancia.
Binocrit contiene menos de 1 mmol de sodio (23 mg) por dosis, esto es, esencialmente “exento de sodio”.
3. Cómo usar Binocrit
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Su médico le ha realizado análisis de sangre y ha decidido que necesita Binocrit.
Binocrit puede administrarse mediante inyección:
• O bien en una vena o a través de un tubo que se introduce en una vena (por vía intravenosa).
• O bien debajo de la piel (por vía subcutánea).
Su médico decidirá de qué modo se inyectará Binocrit. Las inyecciones las realizará habitualmente un médico, un enfermero u otro profesional del sector sanitario. Más adelante y dependiendo del motivo por el que necesiten el tratamiento con Binocrit, algunas personas pueden aprender a autoinyectarse el medicamento debajo de la piel: ver Instrucciones de autoinyección de Binocrit al final del prospecto.
Binocrit no debe usarse:
• después de la fecha de caducidad de la etiqueta y la caja de cartón;
• si usted sabe o cree que puede haberse congelado accidentalmente, o
• si se ha producido una avería en la nevera.
La dosis de Binocrit que recibirá se basa en su peso corporal en kilogramos. La causa de su anemia también es un factor que su médico tendrá en cuenta a la hora de decidir la dosis correcta.
Su médico controlará su presión arterial periódicamente mientras se encuentre en tratamiento con Binocrit.
Personas con enfermedad renal
• Su médico mantendrá sus niveles de hemoglobina entre 10 y 12 g/dl, ya que un nivel alto de hemoglobina puede aumentar el riesgo de coágulos sanguíneos y de muerte.
• La dosis inicial habitual de Binocrit para adultos y niños es de 50 unidades internacionales (UI) por kilogramo (kg) de peso corporal, administrada tres veces por semana. En los pacientes en diálisis peritoneal, Binocrit se puede administrar dos veces por semana.
• Tanto en los adultos como en los niños, Binocrit se administra en forma de inyección, bien en una vena (vía intravenosa) o bien a través de un tubo que se introduce en una vena. Cuando no se pueda conseguir fácilmente este acceso (a través de una vena o un tubo), su médico puede decidir que Binocrit debe inyectarse bajo la piel (vía subcutánea). En esto se incluyen los pacientes en diálisis y los que todavía no lo están.
• Su médico mandará análisis periódicos de sangre para ver cómo está respondiendo la anemia, generalmente con una frecuencia no superior a cada cuatro semanas, y puede ajustar la dosis.
• Una vez corregida la anemia, su médico seguirá realizándole análisis de sangre periódicos. Es posible que le vuelva a ajustar la dosis y frecuencia de administración de Binocrit para mantener su respuesta al tratamiento. Su médico utilizará la mínima dosis eficaz para controlar los síntomas de la anemia.
• Si no responde bien a Binocrit, su médico comprobará su dosis y le informará si necesita modificar la dosis de Binocrit.
• Si usted recibe un intervalo de dosificación más ampliado (más de una vez por semana) de Binocrit, tal vez no mantenga una concentración adecuada de hemoglobina y quizás requiera un aumento de la dosis de Binocrit o de la frecuencia de su administración.
• Puede que se le administren suplementos de hierro antes del tratamiento con Binocrit y durante el mismo a fin de aumentar su eficacia.
• Si en el momento de inicio de la terapia con Binocrit se encuentra usted en tratamiento con diálisis, es posible que haya que ajustar la pauta de diálisis. Su médico decidirá si esto es necesario.
Adultos en tratamiento con quimioterapia
• Su médico puede iniciar el tratamiento con Binocrit si su nivel de hemoglobina es de 10 g/dl o menor.
• Su médico mantendrá sus niveles de hemoglobina entre 10 y 12 g/dl, ya que un nivel alto de hemoglobina puede aumentar el riesgo de coágulos sanguíneos y de muerte.
• La dosis inicial es de 150 UI por kilogramo de peso corporal tres veces por semana, o bien 450 UI por kilogramo de peso corporal, una vez por semana.
• Binocrit se administra por inyección debajo de la piel.
• Su médico solicitará análisis de sangre y puede ajustar la dosis, dependiendo de cómo responda su anemia al tratamiento con Binocrit.
• Puede que se le administren suplementos de hierro antes del tratamiento con Binocrit y durante el mismo, a fin de aumentar su eficacia.
• Habitualmente, seguirá en tratamiento con Binocrit durante un mes después del fin de la quimioterapia.
Adultos que donan su propia sangre
• La dosis habitual es de 600 UI por kilogramo de peso corporal dos veces a la semana.
• Binocrit se administra mediante una inyección intravenosa inmediatamente tras haber donado sangre durante las tres semanas anteriores a la intervención.
• Puede que se le administren suplementos de hierro antes del tratamiento con Binocrit y durante el mismo, a fin de aumentar su eficacia.
Adultos programados para una intervención quirúrgica ortopédica mayor
• La dosis recomendada es de 600 UI por kilogramo de peso corporal una vez a la semana.
• Binocrit se administra mediante inyección debajo de la piel cada semana durante las tres semanas anteriores a la intervención y el día de la intervención.
• Si existen una necesidad médica de reducir el tiempo previo a la intervención, se le administrará una dosis diaria de 300 UI/kg durante un máximo de diez días antes de la intervención, el día de la intervención y durante los cuatro días inmediatamente después.
• El tratamiento se interrumpirá si los análisis de sangre muestran que su hemoglobina es demasiado alta antes de la intervención.
• Puede que se le administren suplementos de hierro antes del tratamiento con Binocrit y durante el mismo a fin de aumentar su eficacia.
Instrucciones para inyectarse Binocrit debajo de la piel
Cuando se inicia el tratamiento, el personal médico o de enfermería suele inyectar Binocrit. Más tarde,
su médico puede proponer que usted o su cuidador aprendan a inyectar Binocrit bajo la piel (por vía
subcutánea) por sí mismos.
• No intente autoinyectarse a no ser que su médico o enfermero le hayan enseñado cómo hacerlo.
• Siga exactamente las instrucciones de administración de Binocrit indicadas por su médico o enfermero.
• Asegúrese de que se inyecta solamente la cantidad de líquido indicada por su médico o enfermero.
• Sólo use Binocrit si se ha conservado correctamente; ver sección 5, Conservación de Binocrit.
• Antes del uso, deje reposar la jeringa de Binocrit hasta que alcance la temperatura ambiente. Esto suele llevar entre 15 y 30 minutos. Use la jeringa en un plazo máximo de 3 días después de sacarla de la nevera.
Extraiga sólo una dosis de Binocrit de cada jeringa.
Si Binocrit se inyecta debajo de la piel (por vía subcutánea), la cantidad inyectada normalmente no es mayor de un mililitro (1 ml) en una sola inyección.
Binocrit se administra solo y no se mezcla con otros líquidos inyectables.
No agite las jeringas de Binocrit. Una agitación prolongada y enérgica puede causar daños al producto. Si el producto se ha agitado enérgicamente, no lo utilice.
Al final de este prospecto, puede encontrar las instrucciones de autoinyección de Binocrit.
Si usa más Binocrit del que debe
Informe inmediatamente a su médico o enfermero si cree que se ha inyectado demasiado Binocrit. Es improbable que se produzcan efectos adversos como consecuencia de una sobredosis de Binocrit.
Si olvidó usar Binocrit
Póngase la siguiente inyección tan pronto como se acuerde. Si queda menos de un día para la siguiente inyección, prescinda de la dosis omitida y continúe con su programa habitual. No duplique las inyecciones.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, enfermero o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Informe inmediatamente a su médico o enfermero si nota alguno de los efectos de esta lista.
Efectos adversos muy frecuentes
Pueden afectar a más de 1 de cada 10 personas en tratamiento con Binocrit.
• Diarrea.
• Sensación de náuseas.
• Vómitos.
• Fiebre.
• Congestión de las vías respiratorias, como la nariz tapada y dolor de garganta, que se han informado en los pacientes con enfermedad renal que aún no se someten a diálisis.
Efectos adversos frecuentes
Pueden afectar hasta a 1 de cada 10 personas en tratamiento con Binocrit.
• Aumento de la presión arterial. Los dolores de cabeza, especialmente súbitos, lacerantes y de tipo migrañoso, la sensación de confusión o las convulsiones, pueden ser signos de un aumento súbito de la presión arterial. Esto precisa un tratamiento urgente. El aumento de la presión arterial puede hacer necesario el tratamiento con otros medicamentos (o el ajuste de cualquier medicamento que ya esté tomando para la presión arterial elevada).
• Coágulos sanguíneos (entre ellos trombosis venosa profunda y embolia) que pueden requerir tratamiento urgente. Puede padecer dolor torácico, dificultad para respirar e hinchazón dolorosa y enrojecimiento, generalmente de una pierna como síntomas.
• Tos.
• Erupción cutánea, que pueden producirse a consecuencia de una reacción alérgica.
• Dolor óseo o muscular.
• Síntomas de tipo gripal, como dolor de cabeza, dolores en las articulaciones, sensación de debilidad, escalofríos, cansancio y mareos. Pueden ser más frecuentes al comienzo del tratamiento. Si aparecen estos síntomas durante la inyección en la vena, una administración más lenta de la inyección puede ayudar a evitarlos en el futuro.
• Enrojecimiento, escozor y dolor en el lugar de la inyección.
• Hinchazón de los tobillos, pies o dedos de las manos.
Efectos adversos poco frecuentes
Pueden afectar hasta a 1 de cada 100 personas en tratamiento con Binocrit.
• Niveles altos de potasio en la sangre que pueden ocasionar un ritmo cardíaco anormal (este es un efecto adverso muy frecuente en los pacientes en hemodiálisis).
• Convulsiones.
• Congestión de la nariz o de las vías respiratorias.
Efectos adversos muy raros
Pueden afectar hasta a 1 de cada 10.000 personas en tratamiento con Binocrit.
• Síntomas de aplasia eritrocítica pura (AEP)
La AEP significa que la médula ósea no fabrica una cantidad suficiente de glóbulos rojos. La AEP causa una anemia súbita y grave. Los síntomas son:
• Cansancio inusual.
• Sensación de mareos.
• Dificultad para respirar.
La AEP se ha notificado en casos muy raros principalmente en pacientes con enfermedad renal después de meses o años de tratamiento con epoetina alfa y otros productos que estimulan la producción de glóbulos rojos.
• Puede producirse un aumento de la cantidad de unas células sanguíneas pequeñas (plaquetas), que normalmente intervienen en la formación de coágulos de sangre, sobre todo al comienzo del tratamiento. Su médico examinará esto.
Si está en tratamiento de hemodiálisis:
• Pueden formarse coágulos de sangre (trombosis) en la derivación arteriovenosa de su diálisis. Esto es más probable si usted tiene la presión arterial baja o si su fístula tiene complicaciones.
• Se pueden formar también coágulos de sangre en su sistema de hemodiálisis. Su médico puede decidir aumentar la dosis de heparina durante la diálisis.
Informe a su médico o enfermero inmediatamente si advierte alguno de estos efectos, o si nota cualquier otro efecto mientras está recibiendo tratamiento con Binocrit.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico, enfermero o farmacéutico.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Mantener este medicamento fuera de la vista y del alcance de los niños.
• Conservar y transportar refrigerado (entre 2°C y 8°C).
• No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja después de CAD/EXP. Puede sacar Binocrit de la nevera y mantenerlo a temperatura ambiente (hasta 25°C) por un periodo no superior a tres días. Una vez que una jeringa se haya extraído de la nevera y haya alcanzado la temperatura ambiente (hasta 25°C), debe utilizarse en un plazo de tres días o desecharse.
• No congelar ni agitar.
• Conservar en el embalaje original para protegerlo de la luz.
No utilice este medicamento si sabe o cree
• que puede haberse congelado accidentalmente o
• se ha producido un fallo de la nevera,
• el líquido está coloreado u observa partículas flotando en él,
• el precinto está roto.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico
cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a
proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Binocrit
- El principio activo es: epoetina alfa (para saber la cantidad, consulte la tabla que aparece a continuación).
- Los demás componentes son: fosfato dihidrógeno sódico dihidratado, fosfato disódico dihidratado, cloruro de sodio, glicina, polisorbato 80, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH) y agua para soluciones inyectables.
Aspecto del producto y contenido del envase
Binocrit se presenta como una solución inyectable transparente e incolora, para inyección en una
jeringa precargada. Las jeringas están selladas en un blister.
|
Presentación |
Presentaciones correspondientes en cantidad/volumen por cada presentación de dosis |
Cantidad de epoetina alfa |
|
Jeringas precargadas* |
2.000 UI/ml: | |
|
1.000 UI/0,5 ml |
8,4 microgramos | |
|
2.000 UI/1 ml |
16,8 microgramos | |
|
10.000 UI/ml: | ||
|
3.000 UI/0,3 ml |
25,2 microgramos | |
|
4.000 UI/0,4 ml |
33,6 microgramos | |
|
5.000 UI/0,5 ml |
42,0 microgramos | |
|
6.000 UI/0,6 ml |
50,4 microgramos | |
|
7.000 UI/0,7 ml |
58,8 microgramos | |
|
8.000 UI/0,8 ml |
67,2 microgramos | |
|
9.000 UI/0,9 ml |
75,6 microgramos | |
|
10.000 UI/1 ml |
84,0 microgramos | |
|
40.000 UI/ml: | ||
|
20.000 UI/0,5 ml |
168,0 microgramos | |
|
30.000 UI/0,75 ml |
252,0 microgramos |
40.000 UI/1 ml_ 336,0 microgramos
"Tamaño del envase de 1, 4 o 6 jeringa(s) precargada(s) con o sin protector de seguridad para la aguja. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Sandoz GmbH Biochemiestr. 10 A-6250 Kundl Austria
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Sandoz nv-sa Tél/Tel: +32 2 722 97 97 |
Lietuva Sandoz Pharmaceuticals d.d filialas Tel: +370 5 2636 037 |
|
Etarapna TtproBCKO npegcraBHTeacTBO CaHgo3 g.g. Tea.: +359 2 970 47 47 |
Luxembourg/Luxemburg Sandoz GmbH Tél/Tel: +43 5338 2000 |
|
Ceská republika Sandoz s.r.o. Tel: +420 221 421 611 |
Magyarország Sandoz Hungária Kft. Tel.: +36 1 430 2890 |
|
Danmark/Ísland/Norge/Sverige Sandoz A/S Tlf/Sími/Tel: +45 63 95 10 00 |
Malta Sandoz GmbH Tel: +43 5338 2000 |
|
Deutschland Hexal AG Tel: +49 8024 908 0 |
Nederland Sandoz B.V. Tel: +31 36 52 41 600 |
|
Eesti Sandoz d.d. Eesti filiaal Tel: +372 6652 400 |
Osterreich Sandoz GmbH Tel: +43 5338 2000 |
|
EXXáSa Sandoz Pharmaceuticals d.d, Tr|X: +30 216 600 5000 ^DEMO Avmvu^og Bio^nxaviKq Kai E^nopiKq Exaipsía T^X: +30 210 816 18 02 n Novartis (Hellas) A.E.B.E. Tr|X: +30 210 281 17 12 |
Polska Sandoz Polska Sp. z o.o. Tel.: +48 22 209 70 00 |
|
España Sandoz Farmacéutica, S.A. Tel: +34 900 456 856 |
Portugal Sandoz Farmacéutica Lda. Tel: +351 21 924 19 11 |
|
France Sandoz Tél: + 33 1 49 64 48 00 |
Romania Sandoz Pharma Services SRL Tel: 021-4075160 |
|
Hrvatska |
Slovenija |
Fecha de la última revisión de este prospecto: {MM/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de autoinyección (para pacientes con anemia sintomática causada por una enfermedad renal, para pacientes que reciben quimioterapia o pacientes adultos programados sólo para una intervención quirúrgica traumatológica)
Esta sección contiene información sobre cómo administrarse usted mismo una inyección de Binocrit. Es importante que no intente administrarse la inyección sin que antes su médico o enfermero le haya explicado cómo hacerlo. Binocrit puede suministrarse o no con un protector de seguridad para la aguja, que su médico o enfermero le enseñará a utilizar. Si no está seguro de querer administrarse la inyección usted mismo o tiene alguna pregunta, consulte a su médico o enfermero.
1. Lávese las manos.
2. Extraiga una jeringa del envase y retire la cápsula de cierre de la aguja. Las jeringas están grabadas con anillos de graduación, a fin de permitir el uso parcial si es necesario. Cada anillo de graduación corresponde a un volumen de 0,1 ml. Si se precisa el uso parcial de la jeringa, elimine la solución no deseada antes de la inyección.
3. Limpie la piel del lugar de la inyección con un algodón impregnado en alcohol.
4. Forme un pliegue en la piel, pellizcando la piel entre el pulgar y el índice.
5. Introduzca la aguja en el pliegue de la piel, con una acción rápida y firme. Inyecte la solución de Binocrit tal y como su médico le ha enseñado. Consulte a su médico o farmacéutico si tiene dudas.
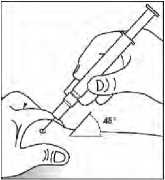
Sandoz d.o.o.
Tel: +385 1 23 53 111
Ireland
Novartis Ireland Limited Tel: + 353 1 260 12 55
Italia
Sandoz S.p.A.
Tel: +39 02 96541
Kúrcpog
P.T.Hadjigeorgiou co ltd T^: +357 25372425
Latvija
Sandoz d.d. Parstavnieciba Latvija Tel: +371 67 892 006
Lek farmacevtska druzba d.d. Tel: +386 1 580 21 11
Slovenská republika
Sandoz d.d. - organizacná zlozka Tel: +421 2 48 200 600
Suomi/Finland
Sandoz A/S
Puh/Tel: +358 10 6133 415
United Kingdom
Sandoz Ltd
Tel: + 44 1276 69 8020
Jeringa precargada sin protector de seguridad para la aguja
6. Manteniendo la piel pellizcada, presione el émbolo lenta y uniformemente.
7. Una vez inyectado el líquido, retire la aguja y suelte la piel. Aplique presión sobre el lugar de la inyección, con una gasa seca y estéril.
8. Elimine el medicamento no utilizado y todos los materiales que hayan estado en contacto con él. Use cada jeringa sólo para una inyección.
Jeringa precargada con protector de seguridad para la aguja
6.
7.
8. 9.
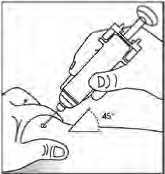
Manteniendo la piel pellizcada, presione el émbolo lenta y uniformemente hasta que se haya administrado la totalidad de la dosis y el émbolo no pueda avanzar más. ¡No deje de mantener la presión sobre el émbolo!
Una vez inyectado el líquido, retire la aguja mientras mantiene la presión sobre el émbolo y suelte la piel. Aplique presión sobre el lugar de la inyección, con una gasa seca y estéril.
Suelte el émbolo. El protector de seguridad para la aguja se desplazará rápidamente hasta cubrir la aguja.
Elimine el medicamento no utilizado y todos los materiales que hayan estado en contacto con él. Use cada jeringa sólo para una inyección.
97
Identificada durante la experiencia posterior a la comercialización y categoría de frecuencia estimada a partir de las tasas de notificación espontánea.
Frecuente en diálisis.
profunda, embolia pulmonar, trombosis de la retina, trombosis arterial (incluso infarto de miocardio), accidentes cerebrovasculares (incluso infarto cerebral y hemorragia cerebral), ataques isquémicos
Incluye acontecimientos arteriales y venosos, mortales y no mortales, tales como trombosis venosa
PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antianémicos, eritropoetina, código ATC: B03XA01.
Binocrit es un medicamento biosimilar. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Mecanismo de acción
La eritropoyetina (EPO) es una hormona glucoproteica producida principalmente por el riñón en respuesta a la hipoxia y es el principal regulador de la producción de glóbulos rojos (GR). La EPO participa en todas las fases de desarrollo eritroide y ejerce su efecto principal al nivel de los precursores eritroides. Una vez que la EPO se fija a su receptor en la superficie celular, activa vías de transducción de señales que interfieren con la apoptosis y estimulan la proliferación de células eritroides.
La EPO humana recombinante (epoetina alfa), expresada en células de ovario de hámster chino, tiene una secuencia de 165 aminoácidos idéntica a la de la EPO urinaria humana; ambas son indistinguibles