Beriplex 500 Ui Polvo Y Disolvente Para Solucion Para Inyeccion
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Beriplex 1000 UI
Polvo y disolvente para solución inyectable Complejo de protrombina humano
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
• Si experimenta efectos adversos, informe a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Contenido del prospecto
1. Qué es Beriplex y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Beriplex
3. Cómo usar Beriplex
4. Posibles efectos adversos
5. Conservación de Beriplex
6. Contenido del envase e información adicional
1. Qué es BERIPLEX y para qué se utiliza Qué es Beriplex
Beriplex se presenta en forma de polvo y disolvente. Es un polvo blanco o ligeramente coloreado o sólido friable. La solución preparada se debe administrar mediante inyección en una vena.
Beriplex se prepara a partir de plasma humano (la parte líquida de la sangre) y contiene los factores II, VII, IX y X de la coagulación humanos. Los concentrados que contienen estos factores de la coagulación se denominan productos del complejo de protrombina. Los factores de la coagulación II, VII, IX y X son dependientes de la vitamina K y son importantes para la coagulación de la sangre. La falta de alguno de estos factores significa que la sangre no coagula con la rapidez que debiera y se da un aumento de la tendencia al sangrado. La sustitución de los factores II, VII, IX y X con Beriplex repara los mecanismos de la coagulación.
Para qué se utiliza Beriplex
Beriplex se utiliza para la profilaxis (durante la cirugía) y el tratamiento de las hemorragias causadas por la falta adquirida o congénita de factores de la coagulación dependientes de la vitamina K, es decir factores II, VII, IX y X en la sangre, cuando no se dispone de productos purificados del factor de la coagulación específico.
2. Qué necesita saber antes de empezar a usar Beriplex
Las siguientes secciones contienen información que su médico debería tener en consideración antes de administrarle Beriplex.
No use Beriplex
• Si es alérgico a los principios activos o a cualquiera de los demás componentes de este medicamento (ver sección 6).
Informe a su médico si usted es alérgico a algún medicamento o a algún alimento.
• Si usted es más propenso a sufrir de coágulos de sangre que lo habitual. (pacientes en riesgo de coagulación intravascular diseminada.
• Si usted muestra una respuesta alérgica a la heparina que causa una caída en el número de plaquetas sanguíneas (trombocitopenia de tipo II asociada a la heparina, TAH tipo II).
Informe a su médico o farmacéutico si usted padece alguna de estas enfermedades.
Advertencias y precauciones
• Deficiencia adquirida de factores de la coagulación dependientes de la vitamina K. Ello puede estar inducido por medicamentos que inhiben el efecto de la vitamina K. Beriplex sólo se debe utilizar cuando es necesaria una rápida corrección de los niveles de complejo de protrombina, p.ej. en caso de hemorragias graves o cirugía de urgencia.
• Deficiencia congénita de cualquiera de los factores dependientes de la vitamina K. En este caso deberá utilizar productos del factor de la coagulación específico, si se encuentran a disposición.
• Reacciones de tipo alérgico o anafiláctico (una reacción alérgica grave que causa una importante dificultad de respirar o mareos). Se debe interrumpir inmediatamente la administración de Beriplex (p.ej. interrumpiendo la inyección).
• Administración de inhibidores de la coagulación.
• Mayor riesgo de formación de coágulos de sangre en un vaso sanguíneo (trombosis), en especial:
- Si ha sufrido un ataque de corazón (historial de enfermedad cardiaca coronaria o infarto de miocardio).
- Si padece alguna enfermedad del hígado.
- Si le han intervenido recientemente (pacientes en el pre o postoperatorio).
- En recién nacidos (neonatos).
- Si es más propenso de lo normal a la formación de coágulos de sangre (pacientes de riesgo de episodios tromboembólicos o de coagulación intravascular diseminada o deficiencia simultánea de inhibidor de la coagulación).
• Riesgo aumentado de coagulación debido a un aumento del consumo de plaquetas o de factores sanguíneos de la coagulación. El tratamiento con Beriplex solamente se puede iniciar una vez que se ha tratado la causa subyacente.
Su médico sopesará minuciosamente el beneficio del tratamiento con Beriplex comparado con el riesgo de padecer estas complicaciones.
Seguridad vírica
Cuando se preparan medicamentos a partir de sangre o plasma humanos se aplican determinadas medidas para prevenir la transmisión de infecciones a los pacientes. Dichas medidas incluyen:
• una cuidadosa selección de los donantes de sangre y plasma para garantizar que se excluyen aquellos que presentan riesgo de ser portadores de infecciones,
• el análisis de cada donación y de las mezclas de plasmas para detectar signos de virus o infecciones,
la inclusión de pasos en el procesamiento de la sangre o plasma que pueden inactivar o eliminar virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humano, no se puede excluir por completo la posibilidad de transmisión de una infección. Ello también es cierto en el caso de virus u otros tipos de infección desconocidos o emergentes.
Las medidas aplicadas se consideran eficaces para los virus con cubierta tales como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C (inflamación del hígado), y para los virus no envuelto de la hepatitis A y parvovirus B19.
Es posible que su médico le recomiende la vacunación contra la hepatitis A y B si usted se trata periódicamente/repetidamente con productos del complejo protrombínico derivados de plasma humano.
Se recomienda encarecidamente que cada vez que se le administre una dosis de Beriplex, se registre el nombre y el número de lote del medicamento, con la finalidad de tener un historial de los lotes utilizados.
Interacción de Beriplex con otros medicamentos
• Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
• Beriplex puede inhibir el efecto del tratamiento antagonista de la vitamina K. No se conocen interacciones con otros medicamentos.
• Beriplex no se debe mezclar con otros medicamentos, diluyentes o disolventes.
Embarazo, lactancia y fertilidad
• Si está embarazada o en periodo de lactancia, o cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
• Durante el embarazo y la lactancia Beriplex sólo deberá utilizarse si está claramente indicado.
• No se disponen de datos sobre fertilidad.
Influencia sobre la capacidad para conducir y utilizar máquinas
No se ha realizado estudios sobre la capacidad de conducir o usar maquinaria.
Beriplex contiene sodio
Los pacientes con dietas pobres en sodio deben tener en cuenta que este medicamento contiene hasta 343 mg de sodio (aproximadamente 15 mmol) por 100 ml. Esto deberá ser tenido en cuenta por los pacientes bajo dieta controlada en sodio.
3. Cómo Usar Beriplex
El tratamiento debe iniciarse y ser supervisado por un médico con experiencia en el tratamiento de este tipo de trastornos.
Posología
La cantidad de Factor II, VII, IX y X que usted precisa y la duración del tratamiento dependerán de diversos factores, tales como su peso corporal, la gravedad de su enfermedad, la localización y gravedad de la hemorragia o la necesidad de prevenir la hemorragia durante una operación o
investigación (ver la sección “Esta información está destinada únicamente a médicos o profesionales del sector sanitario”).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Sobredosis
Su médico deberá examinar periódicamente el estado de coagulación de su sangre durante el tratamiento. Las dosis elevadas de concentrado de complejo de protrombina se han asociado a episodios de ataques de corazón, coagulación intravascular diseminada y aumento de la formación de coágulos de sangre en los vasos sanguíneos, en pacientes con riesgo de padecer dichas complicaciones.
4. Posibles efectos adversos
Al igual que todos los medicamentos este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Póngase inmediatamente en contacto con su médico:
• si se produce cualquiera de dichos efectos adversos o
• si advierte cualquier efecto adverso no mencionado en este prospecto.
Los siguientes efectos adversos se han observado muy raramente:
• Una reacción alérgica súbita (como enrojecimiento, quemazón o punzadas en la piel en el lugar de la inyección, escalofríos, sofoco, enrojecimiento de la piel en todo el cuerpo, dolor de cabeza, ronchas, caída de la presión sanguínea, cansancio, náuseas, vómitos, agitación, hormigueo, aceleración de los latidos del corazón y presión en el pecho, dificultad respiratoria).
• Desarrollo de anticuerpos frente a uno o varios factores de la coagulación.
• Aumento de la temperatura corporal.
• Existe un riesgo potencial de aumento en la formación de coágulos de sangre (ver sección 2).
• Disminución de la generación de plaquetas debido a la heparina (trombocitopenia asociada a heparina, TAH tipo II). La heparina, una proteína que posee un efecto de disolución de los coágulos sanguíneos, es un componente de Beriplex. La forma grave de la disminución de las plaquetas se puede asociar a:
- coágulos de sangre en una vena o la pierna,
- un aumento en la formación de coágulos de sangre,
- en algunos casos con enrojecimiento de la piel en el lugar de la inyección,
- petequias (hemorragias en forma de puntos) y
- heces oscuras.
En estos casos el efecto de la heparina puede estar disminuido (tolerancia a la heparina). Si aparecen dichos síntomas, debe interrumpir inmediatamente el uso del producto y avisar a su médico. En el futuro no deberá utilizar productos que contengan heparina.
El siguiente efecto adverso tuvo lugar en una única ocasión:
• Se informó de una forma especial de inflamación de los riñones tras tratamiento de pacientes que presentan inhibidores del factor IX. Se conocía que dichos pacientes poseían un historial de reacción alérgica.
5. Conservación de BERIPLEX
• No utilice Beriplex después de la fecha de caducidad que aparece en la etiqueta y en el envase.
• No conservar a temperatura superior a 25°C.
• No congelar.
• Conservar el envase en el embalaje exterior para protegerlo de la luz.
• Beriplex no contiene conservantes de modo que es preferible que la solución preparada se utilice inmediatamente.
• Si la solución preparada no se administra inmediatamente se deberá utilizar en el plazo de 8 horas.
• Mantener este medicamento fuera de la vista del alcance de los niños.
6. Contenido del envase e información adicional Composición de Beriplex
Beriplex se presenta en forma de polvo y disolvente. El polvo se debe disolver en 20 ml de agua para inyectables.
Beriplex 500 UI contiene 400 - 620 UI de factor IX de la coagulación humano por vial.
El principio activo es:
Un concentrado de los factores de la coagulación II, VII, IX y X humanos, Proteínas C y S.
Los demás componentes son:
Antitrombina III humana, heparina, albúmina humana, cloruro sódico, citrato sódico, HCl o NaOH (en pequeñas cantidades para ajustar el pH).
Disolvente: Agua para preparaciones inyectables.
Aspecto de Beriplex y contenido del envase
Beriplex se presenta como un polvo blanco o ligeramente coloreado y se suministra con agua para inyectables como disolvente.
La solución preparada debe ser transparente o ligeramente opalescente, es decir, puede presentar burbujitas cuando se coloca frente a la luz pero no debe contener partículas detectables.
Presentación
Un envase con 500 UI que contiene:
- 1 vial con polvo.
- 1 vial con 20 ml agua para preparaciones inyectables.
- 1 trasvasador con filtro 20/20.
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH Emil-von-Behring-Strasse 76 35041 Marburg Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
CSL Behring SA Avenida Diagonal 601, 7C 08028 Barcelona. España
Este medicamento se encuentra autorizado en los Estados Miembros del Espacio Económico Europeo con los siguientes nombres:
Beriplex P/N Beriplex P/N 500 Beriplex P/N 500 IU Beriplex P/N 500 IE Beriplex P/N 500 IU Beriplex 500 UI Confidex 500 IU Confidex 500 Confidex 500 IE Confidex 500 IU
Grecia
Alemania, Hungría, Polonia,
Reino Unido
Austria
Holanda
España, Portugal
Francia
Italia
Bélgica, Luxemburgo, Noruega, Suecia Finlandia
Este prospecto ha sido revisado en julio de 2015
La información detallada y actualizada de este medicamento está disponible en la página Web de l a Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
Esta información está destinada únicamente a profesionales del sector sanitario:
Composición cualitativa y cuantitativa
El contenido nominal de los factores de la coagulación humanos se expresa en la siguiente tabla, expresándose en UI:
|
Nombre del componente |
Contenido después de la reconstitución (UI/ml) |
Beriplex 500 UI contenido por vial (UI) |
|
Principios activos | ||
|
Factor II de la coagulación, humano |
20 - 48 |
400 - 960 |
|
Factor VII de la coagulación, humano |
10 - 25 |
200 - 500 |
|
Factor IX de la coagulación, humano |
20 - 31 |
400 - 620 |
|
Factor X de la coagulación, humano |
22 - 60 |
440 - 1200 |
|
Otros principios activos | ||
|
Proteína C |
15 - 45 |
300 - 900 |
|
Proteína S |
12 - 38 |
240 - 760 |
El contenido total en proteínas es de 6 - 14 mg/ml de solución reconstituida.
La actividad específica expresada en factor IX es de 2,5 UI/mg de proteína total.
La actividad de todos los factores de la coagulación, así como de las proteínas C y S (antígeno) ha sido testada de acuerdo con los estándares internacionales vigentes establecidos por la Organización Mundial de la Salud (OMS).
Posología y método de administración
Posología
Las pautas posológicas que siguen son únicamente de carácter general.
La posología y la frecuencia de administración se establecerán de forma individual para cada paciente. Los intervalos de dosificación deben adaptarse a las vidas medias circulantes de los respectivos factores de la coagulación del complejo de protrombina. Los requerimientos posológicos individuales sólo pueden ser identificados sobre la base de una determinación periódica de los niveles plasmáticos de los factores de la coagulación en cuestión, o del análisis global de los niveles del complejo de protrombina (INR, Prueba de Quick) y la monitorización continua de la situación clínica del paciente.
En el caso de intervenciones de cirugía mayor es imprescindible una monitorización precisa de la terapia de sustitución, por medio de análisis de la coagulación (ensayos específicos de los factores de la coagulación y/o análisis globales para medir los niveles del complejo de protrombina).
• Sangrado y profilaxis perioperativa de sangrados durante el tratamiento con medicamentos antagonistas de la vitamina K:
La posología dependerá del valor del INR antes del tratamiento y del INR que se desea conseguir. En la siguiente tabla se dan dosis aproximadas (ml de solución reconstituida del producto/kg de peso corporal y UI de FIX/kg de peso corporal) que se requieren para normalizar el INR (p.ej. < 1,3) a diferentes niveles iniciales de INR.
|
INR inicial |
2,0 - 3,9 |
4,0 - 6,0 |
> 6,0 |
|
Dosis aproximada (ml/kg de peso corporal) |
1 |
1,4 |
2 |
|
Dosis aproximada de Factor IX (UI)/kg de peso corporal |
25 |
35 |
50 |
La dosis en bolo máxima recomendada no debe exceder un máximo de 5000 UI de FIX.
La corrección del trastorno de la hemostasia inducido por los antagonistas de la vitamina K se produce como muy tarde 30 minutos después de la inyección y persistirá durante 6 - 8 horas aproximadamente. Sin embargo, el efecto de la vitamina K, si se administra de manera concomitante, se alcanza normalmente transcurridas de 4 a 6 horas. Por eso, no se requiere, usualmente, un tratamiento repetido con el complejo humano de protrombina cuando se ha administrado vitamina K.
Estas recomendaciones están basadas en datos de ensayos clínicos con un número limitado de individuos. La recuperación y la duración del efecto pueden variar, por lo que la monitorización del INR durante el tratamiento es obligatoria.
• Los sangrados y la profilaxis perioperativa en deficiencia congénita de algunos de los factores de la coagulación dependientes de la vitamina K, cuando no se dispone de productos del factor de la coagulación específico.
El cálculo de la dosis requerida del concentrado del complejo de protrombina se basa en datos de ensayos clínicos:
• 1 UI de factor IX por kilo de peso corporal puede incrementar la actividad plasmática del factor IX en un 1,3 % (0,013 Ul/ml) de la actividad normal.
• 1 UI de factor VII por kg de peso corporal incrementa la actividad plasmática del factor VII en un 1,7 % (0,017 UI/ml) de la actividad normal.
• 1 UI de factor II por kg de peso corporal incrementa la actividad plasmática del factor II en un 1,9 % (0,019 UI/ml) de la actividad normal.
• 1 UI de factor X por kg de peso corporal incrementa la actividad plasmática del factor X en un 1,8 % (0,018 UI/ml) de la actividad normal.
La posología de un factor específico administrado se expresa en Unidades Internacionales (UI), que están relacionadas con el estándar vigente de la OMS para cada factor. La actividad plasmática de un factor de la coagulación específico se expresa, bien como un porcentaje (relativo al plasma normal) o en Unidades Internacionales (relativas al estándar internacional para el factor de la coagulación específico).
Una Unidad Internacional (UI) de actividad de un factor de la coagulación es equivalente a la cantidad contenida en un ml de plasma humano normal.
Por ejemplo, el cálculo de la dosis requerida de factor X se basa en el hallazgo de que 1 Unidad Internacional (UI) de factor X por kg de peso corporal incrementa la actividad plasmática del factor X en 0,018 UI/ml.
La dosis requerida se determina usando la siguiente formula:
Unidades requeridas = peso corporal [kg] x incremento deseado de factor X [UI/ml] x 56, donde 56 (ml/kg) es el valor recíproco de la recuperación estimada.
Si se conoce la recuperación individual, debe usarse este valor en el cálculo.
Población pediátrica
Todavía no se ha establecido la seguridad y eficacia de Beriplex en niños y adolescentes mediante ensayos clínicos controlados.
Población geriátrica
La posología y la forma de administración en pacientes ancianos (mayores de 65 años) se corresponden con las recomendaciones generales.
Método de administración
Instrucciones generales
- La solución debe ser transparente o ligeramente opalescente. Tras la filtración/extracción (ver más abajo), y antes de su administración el producto reconstituido se debe inspeccionar visualmente para detectar presencia de partículas extrañas y decoloración. No utilizar soluciones turbias o que contengan residuos.
- La reconstitución y la extracción se deben realizar bajo condiciones asépticas.
Reconstitución
Llevar el disolvente a temperatura ambiente. Comprobar que se han retirado los precintos de los viales de producto y solvente y que los tapones se han tratado con una solución aséptica, dejando que se seque antes de abrir el envase del dispositivo Mix2Vial.
1

3
2
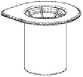
1. Abra el blister del Mix2Vial desprendiendo el precinto. No retire el Mix2Vial del blister
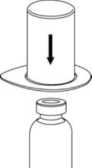
2. Coloque el vial del disolvente sobre una superficie limpia y plana y sujételo con firmeza. Sujete el Mix2Vial junto con el blister y empuje el terminal azul hacia abajo encajándolo en el tapón del vial del disolvente.
3. Retire, con cuidado, el blister del Mix2Vial sujetando el borde y tirando verticalmente hacia arriba. Asegúrese de que sólo retira el blister y no el Mix2Vial.

4

5
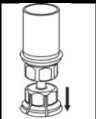
4. Coloque el vial del polvo liofilizado sobre una superficie plana y firme. Invierta el vial del disolvente con el Mix2Vial acoplado y empuje el terminal del adaptador transparente hacia abajo encajándolo en el tapón del vial con el polvo. El disolvente se transferirá automáticamente al vial del polvo liofilizado.
5. Con una mano, sujete el vial con el producto con el Mix2Vial y, con la otra mano, sujete el vial del disolvente y desenrosque con cuidado el sistema separándolo en dos piezas. Deseche el vial del disolvente con el adaptador azul del Mix2Vial acoplado.

6

6. Someta el vial de la solución reconstituida
con el adaptador transparente acoplado a movimientos de rotación suaves hasta que la sustancia se haya disuelto por completo. No lo agite._
7. Llene de aire una jeringa vacía y estéril. Manteniendo el vial con la solución en posición vertical, conecte la jeringa al adaptador Luer Lock del Mix2Vial. Inyecte el aire en el vial de la solución.
.-StP.
SBS
Extracción y administración
|
1 8 |
8. Manteniendo presionado el émbolo de la jeringa, invierta el sistema y aspire la solución al interior de la jeringa haciendo retroceder lentamente el émbolo de la jeringa. | ||||
|
\ |
9. Una vez que la solución se haya transferido a la jeringa, sujete con firmeza el cuerpo de la jeringa (manteniendo el émbolo hacia abajo) y desconecte el adaptador transparente del Mix2Vial de la jeringa. |
Se debe tener la precaución de que no penetre sangre en la jeringa cargada con el producto puesto que existe el riesgo de que la sangre coagule en la jeringa y que con ello se administren coágulos de fibrina al paciente.
La solución reconstituida se debe administrar por vía intravenosa (no más de 8 ml/min*).
La eliminación del medicamento no utilizado, y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Advertencias y precauciones especiales de empleo
No se dispone de datos relativos al uso de Beriplex en el caso de hemorragia perinatal debida a la deficiencia de vitamina K en neonatos.
Pautas para el control del recuento plaquetario:
Controlar cuidadosamente el recuento plaquetario.
Interacción con otros medicamentos y otras formas de interacción
Cuando se realizan pruebas de coagulación sensibles a la heparina, en pacientes tratados con altas dosis de complejo de protrombina humano, se debe considerar la heparina contenida en el producto administrado.
* en ensayos clínicos con Beriplex, se administraron las dosis con una velocidad máxima de infusión de 0,12 ml/kg/min (menos de 8 ml/min) a pacientes con un peso <70 kg.
10 de 10 WINISTWIODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia española oe medicamentos y productos sarttaros