Beriate 250 Ui Polvo Y Disolvente Para Solucion Inyectable O Perfusion
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Beriate 250 UI polvo y disolvente para solución inyectable o perfusión Factor VIII de la coagulación humano
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
• Conserve este prospecto ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles
• Si considera que alguno de los efectos adversos que sufre es grave, o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico
Contenido del prospecto
1. Qué es Beriate y para qué se utiliza
2. Antes de usar Beriate
3. Cómo usar Beriate
4. Posibles efectos adversos
5. Conservación de Beriate
6. Otra información
1. Qué es BERIATE y para qué se utiliza ¿Qué es Beriate?
Beriate se presenta como polvo, acompañado del disolvente. La solución obtenida debe administrarse en una vena, bien por inyección, bien por perfusión.
Beriate se obtiene del plasma humano (que es la parte líquida de la sangre) y contiene el factor VIII de la coagulación humano. Se utiliza para prevenir o detener las hemorragias que están causadas por la falta del factor VIII (hemofilia A) en la sangre. Puede usarse también en el tratamiento de la deficiencia adquirida de factor VIII.
¿Para qué se utiliza Beriate?
El factor VIII está involucrado en la coagulación de la sangre. La falta de factor VIII significa que la sangre no coagula con la rapidez que debería hacerlo, con lo que se poduce un incremento de la tendencia al sangrado. Beriate aporta factor VIII con lo que se normalizan, temporalmente, los mecanismos de la coagulación.
2. Antes de usar BERIATE
Los siguientes párrafos contienen información que usted y su médico deben tener en consideración antes de usar Beriate.
NO use Beriate:
Si Vd. es alérgico (hipersensible) al factor VIII de la coagulación humano o a algún componente de Beriate.
Tenga especial cuidado con Beriate:
• Tal como sucede con cualquier inyección de una proteína, es posible que se presenten reacciones de hipersensibilidad de tipo alérgico. Su médico deberá informarle sobre la aparición de síntomas precoces de reacciones de hipersensibilidad, incluyendo ronchas, urticaria generalizada, presión del pecho, respiración dificultosa, caída de la tensión sanguínea y anafilaxia (reacción alérgica grave que causa problemas graves en la respiración, o mareos). Si se presentan estos síntomas, debe interrumpir de inmediato la administración del medicamento y contactar con su médico.
• La formación de inhibidores (anticuerpos neutralizantes) del factor VIII es una complicación conocida del tratamiento, lo que significa que el tratamiento no funciona. Si su hemorragia no se controla con Beriate, consulte informe a su médico inmediatamente. Debe ser controlado estrechamente acerca del desarrollo de inhibidores.
Su médico valorará cuidadosamente el beneficio del tratamiento con Beriate frente al riesgo de estas complicaciones.
Seguridad vírica
Para prevenir la transmisión de enfermedades infecciosas a los pacientes, cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándar como la selección de donantes de sangre y plasma para asegurar que se excluye el riesgo de transmisión de enfermedades infecciosas Análisis de las donaciones individuales y en las mezclas de plasma de signos de virus/infecciones. Los fabricantes de estos productos también incluirán en el proceso de producción, etapas para eliminar / inactivar virus u otros patógenos. A pesar de estas medidas, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus desconocidos o emergentes u otro tipo de agentes infecciosos.
Estos procedimientos se consideran efectivos frente a virus envueltos tal como al virus de la inmunodeficiencia humana (VIH, virus del SIDA), virus de la hepatitis B y virus de la hepatitis C (inflamación del hígado). Estas medidas pueden tener un valor limitado para virus no envueltos tales como el virus de la hepatitis A y parvovirus B19.
La infección por parvovirus B19 puede ser grave para:
- para mujeres gestantes (infección del niño aún no nacido) o
- individuos con un sistema inmunitario deprimido, o individuos con una producción aumentada de glóbulos rojos debida a cierto tipo de anemias (por ejemplo, anemia drepanocítica o anemia hemolítica).
Si es tratado con derivados plasmáticos (por ejemplo, factor VIII) regular o repetidamente, su médico puede recomendarle que se vacune contra la hepatitis A y B.
Se recomienda encarecidamente que cada vez que se le administre Beriate, deje constancia en su diario de tratamiento del número del lote del producto y del volumen inyectado.
Uso de otros medicamentos:
• Por favor, informe a su médico o farmacéutico si está utilizando, o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta médica.
• Beriate no debe mezclarse con otros medicamentos, diluyentes y disolventes, excepto aquellos que están recomendados por el fabricante (ver Apartado 6 ” Otra información").
Embarazo y lactancia
• Si usted está embarazada o en periodo de lactancia, por favor consulte con su médico o farmacéutico antes de utilizar cualquier medicamento.
• Durante el embarazo y la lactancia, Beriate solo debe usarse en el caso de que esté claramente indicado.
Efecto sobre la capacidad de conducir y utilizar máquinas
Beriate no afecta la capacidad de conducir vehículos o utilizar maquinaria.
Información importante sobre ciertos componentes de Beriate
Beriate contiene hasta 7 mg de sodio por 250 UI. Por favor tenga en cuenta esta información si lleva una dieta controlada de sodio.
3. Cómo usar BERIATE
Siempre que use Beriate, siga siempre exactamente las instrucciones de su médico. Si tiene dudas consulte con su médico o farmacéutico.
El tratamiento de la hemofilia A debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de este tipo de alteraciones.
Posología
La dosis de factor VIII que usted necesita y la duración del tratamiento dependen de varios factores, tales como su peso corporal, la gravedad de su enfermedad, la localización e importancia de la hemorragia o la necesidad de prevenir la hemorragia durante una operación o una revisión médica.
Si le han indicado que debe usar Beriate en casa, su médico se asegurará de que usted reciba las instrucciones debidas de cómo se inyecta el producto y cuanto producto debe usar.
Siga las instrucciones que le ha dado su médico o las indicaciones de las enfermeras de su centro de hemofilia.
Sobredosis
No se ha informado sobre síntomas de sobredosificación con el factor VIII.
Reconstitución y administración
Instrucciones generales:
• El polvo debe mezclarse (reconstituido) con el disolvente (líquido) y retirado del vial bajo condiciones asépticas.
• La solución debe ser clara o ligeramente opalescente, es decir puede brillar cuando se sobrepone contra una luz pero no debe contener partículas. Después de la filtración o cuando se retira del vial, (ver, más adelante), y antes de la administración, la solución debe ser controlada mediante un control
visual a fin de detectar pequeñas partículas y decoloraciones. No usar las soluciones que presenten una turbidez visible o que contengan flóculos o partículas.
• El producto no utilizado y los materiales desechados deberán eliminarse adecuadamente según los requerimientos locales y según las instrucciones de su médico.
Reconstitución:
Atemperar los viales de Beriate (vial con el polvo y el vial con el líquido), sin abrirlos, a temperatura ambiente. Esto puede hacerse dejando los viales a temperatura ambiente durante 1 hora, o bien manteniéndolos en las manos durante unos minutos.
NO exponer los viales al calor directo. Los viales no deben calentarse por encima de la temperatura corporal (37°C).
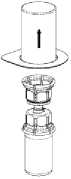
Retirar cuidadosamente las cápsulas protectoras de los viales que contienen el polvo y el líquido, y limpiar la parte expuesta de los tapones con una toallita empapada en alcohol. Dejar secar los viales antes de abrir el contenedor del Mix2Vial, y siga las siguientes instrucciones.

3
4
5
1. Abrir el envase que contiene el Mix2Vial, desgarrando el precinto
2. Coloque el vial del liquido (disolvente) sobre una superficie plana y limpia. Tomar el envase con el Mix2Vial y y encajar el terminal azul del Mix2Vial en el tapón del disolvente
3.Retirar con mucho cuidado el envase del Mix2Vial, teniendo la precaución de no retirar el Mix2Vial.
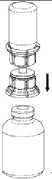
4. Manteniendo el vial del polvo (producto) apoyado sobre una superficie firme, invertir el vial de disolvente con el Mix2Vial acoplado. Encajar el adaptador transparente del Mix2Vial en el tapón del vial del producto.
El disolvente pasa automáticamente al vial del producto_
5. Con los dos viales aún acoplados, agitar suavemente mediante movimientos de rotación el vial con el producto para garantizar la disolución de todo el polvo. No agitar el vial

6
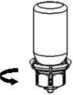
6. Sujetar con una mano el vial del producto con el Mix2Vial, coger con la otra mano el otro extremo que corresponde al vial del disolvente. Desenroscar el conjunto en 2 piezas.
Llenar con aire una jeringa vacía y estéril Manteniendo el vial del producto en posición vertical, conectar la jeringa al Mix2Vial. Inyectar el aire en el vial del producto
Aplicación y retirada:
|
i |
7. Manteniendo presionado el émbolo de la jeringa, invertir el sistema, aspirar la solución reconstituida en la jeringa tirando despacio del émbolo. | ||
|
o© |
8. Una vez que la solución reconstituida ha sido transferida a la jeringa, sujetar firmemente el cuerpo de la jeringa (manteniendo el émbolo de la jeringa mirando hacia abajo) y desconectar el Mix2Vial de la jeringa. |
Usar el equipo de punción venosa que se suministra con el producto. Insertar la aguja en la vena. Dejar que entre la sangre hasta el final del tubo. Acoplar la jeringa al final roscado y con cierre del equipo de punción venosa. Inyectar lentamente la solución reconstituida en la vena, siguiendo las instrucciones de su médico. Tenga cuidado de que no entre sangre en la jeringa que contiene el producto.
Cuando deba administrarse un volumen grande, la perfusión es una opción a tener en cuenta. El producto reconstituido debe transferirse a un sistema de perfusión autorizado. La perfusión debe realizarse de acuerdo con las instrucciones de su médico.
Contrólese usted mismo acerca de cualquier efecto adverso que pudieran presentarse inmediatamente. Si usted tiene algún efecto adverso que esté relacionado con la administración de Beriate, la inyección o la perfusión debe interrumpirse (ver también, Sección “Tenga especial cuidado con Beriate”).
Si usted tiene alguna otra pregunta sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Beriate puede producir efectos adversos, sin embargo no todo el mundo los padece.
Si alguno de los siguientes efectos adversos se presentara, consulte con su médico inmediatamente o vaya al Servicio de Urgencia o centro de hemofilia en su hospital más próximo:
• Síntomas de angioedema
> inflamación del rostro, lengua o faringe,
> dificultad para tragar,
> ronchas y dificultad para respirar.
Estos efectos adversos han sido observados muy raramente, y en algunos casos pueden dar lugar a reacciones alérgicas graves (anafilaxia), incluido el shock
• Pérdida de efecto (sangrado no se detiene) usted puede desarrollar un inhibidor (anticuerpo neutralizante) contra el factor VIII; en estos casos el factor VIII ya no ejerce su función correctamente. Sí esto sucediera, se recomienda contactar con un centro especializado en hemofilia.
Otros efectos adversos son:
• Reacciones alérgicas (hipersensibilidad), que pueden incluir:
> Sensación de quemazón y picor en el lugar donde se inyectó o perfundió el producto.
> Escalofríos, enrojecimiento, sarpullido de la piel de todo el cuerpo, pápulas.
> Dolor de cabeza.
> Caída de la presión sanguínea, desasosiego, corazón late más rápido, opresión en el pecho, respiración dificultosa.
> Somnolencia (letalgia).
> Nauseas, vómitos.
> Hormigueo.
Estos efectos adversos han sido observados muy raramente, pero en algunos casos pueden evolucionar a reacciones alérgicas graves (anafilaxia), incluido el shock.
• En muy raras ocasiones se ha observado fiebre.
Si ocurriera alguno de estos efectos adversos, o si usted notara algún efecto adverso no mencionado en este prospecto, por favor comuníquelo a su médico o farmacéutico.
5. Conservación de BERIATE
No use Beriate después de la fecha de caducidad indicada en la etiqueta y en el envase.
• Conservar en nevera entre 2° y 8° C.
• Durante su periodo de validez Bariate P puede almacenarse hasta 25° C, durante un periodo de 1 mes como máximo. Este periodo de almacenamiento a temperatura ambiente debe apuntarse en su diario de tratamiento a fin de cumplir el periodo de 1 mes en su totalidad.
• Beriate no contiene conservantes, por lo que el producto reconstituido debe usarse inmediatamente.
• No congelar.
• Mantener el producto en su envase, a fin de protegerlo de la luz.
• Mantener fuera de la vista y del alcance de los niños.
6. Otra Información Qué contiene Beriate
Beriate se presenta como un polvo (conteniendo nominalmente 250 UI de factor VIII de la coagulación humano por vial) y un líquido (disolvente). La solución reconstituida se administra, bien por inyección, bien por perfusión).
Beriate 250 UI se reconstituye con 2,5 ml, de agua para preparaciones inyectables y contiene aproximadamente 100 UI de factor VIII de la coagulación humano.
Otros componentes son:
Glicina, cloruro cálcico, hidróxido sódico (en pequeñas cantidades) para ajustar el pH, sacarosa y cloruro sódico Disolvente: Agua para preparaciones inyectables de 2,5 ml.
Como se presenta Beriate y contenido del envase
Beriate se presenta como un polvo blanco, y se suministra con la correspondiente Agua para preparaciones inyectables.
La solución reconstituida debe ser clara o ligeramente opalescente, es decir, es decir puede brillar cuando se sobrepone contra una luz pero no debe contener partículas.
Presentación
Un envase con 250 UI que contiene:
- 1 vial con polvo.
- 1 vial con 2,5 ml de Agua para preparaciones inyectables.
Un envase con equipo de administración que contiene:
- 1 trasvasador con filtro 20/20.
- 1 jeringa de 5 ml un solo uso.
- 1 equipo de punción venosa.
- 2 toallitas con alcohol.
- 1 apósito adhesivo no estéril.
Titular de la Autorización de comercialización y Fabricante
CSL Behring GmbH Emil-von-Behring-StraBe 76 35041 Marburg, Alemania
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de autorización de comercialización:
CSL Behring S.A.
Avenida Diagonal, 601, 7C 08028 Barcelona, España
Este medicamento está autorizado en los siguientes miembros de la Unión Europea bajo la marca Beriate: Austria, Alemania, España, Portugal y Suecia.
Este prospecto fue revisado en Junio de 2015 Mayo 2012
La información detallada y acutalizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
La siguiente información está destinada solamente para los médicos o profesionales de la sanidad
Posología
El número de unidades de factor VIII administradas se expresa en Unidades Internacionales (UI), en relación con el estándar de la Organización Mundial de la Salud (OMS) vigente para productos con factor VIII. La actividad plasmática de factor VIII se expresa como un porcentaje (en relación con el plasma humano normal) o en UI (en relación con un estándar internacional para el factor VIII en plasma).
La actividad de una UI de factor VIII es equivalente a la cantidad de factor VIII contenido en un ml de plasma humano normal.
La posología, el método así como la frecuencia de administración se establecerán siempre en función de la eficacia clínica observada en cada caso.
El cálculo de la dosis necesaria de factor VIII se basa en la observación empírica de que 1 UI de factor VIII por kg. de peso corporal, incrementa la actividad plasmática de factor VIII aproximadamente en un 2% sobre la actividad normal (2 UI/dL). La dosis requerida se determina mediante la fórmula siguiente:
Unidades requeridas = peso corporal (kg) x aumento deseado de factor VIII [% o UI/dl] x 0,5
El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
En los siguientes episodios hemorrágicos, la actividad de factor VIII no debe ser inferior al nivel plasmático de actividad que se indica (en % del nivel normal o UI/dL), durante el periodo correspondiente. La tabla siguiente puede usarse como una guía posológica en episodios hemorrágicos y cirugía.
|
Tipo de episodio hemorrágico/ Tipo de procedimiento quirúrgico |
Nivel de factor VIII requerido (% o UI/dL) |
Frecuencia de dosificación (horas) / Duración de la terapia (días) |
|
Hemorragia Hemartrosis precoz, sangrado muscular o de la cavidad bucal |
20-40 |
Repetir la perfusión cada 12-24 horas. Al menos 1 día, hasta que la hemorragia se haya resuelto, en función del dolor, o hasta la cicatrización adecuada de la herida |
|
Hemartrosis más extensa, sangrado muscular o hematoma |
30-60 |
Repetir la perfusión cada 12-24 horas, durante 3-4 días o más, hasta que el dolor y la discapacidad aguda se hayan resuelto |
|
Hemorragias con riesgo vital |
60-100 |
Repetir la perfusión cada 8-24 horas hasta que desaparezca el riesgo. |
|
Tipo de episodio hemorrágico/ Tipo de procedimiento quirúrgico |
Nivel de factor VIII requerido (% o UI/dL) |
Frecuencia de dosificación (horas) / Duración de la terapia (días) |
|
Cirugía Menor, incluyendo extracciones dentales |
30-60 |
Cada 24 horas, al menos 1 día, hasta la cicatrización de la herida. |
|
Mayor |
80-100 (pre y postoperatorio) |
Repetir la perfusión cada 8-24 horas hasta la cicatrización adecuada de la herida; continuar la terapia durante un mínimo de 7 días más para mantener una actividad de factor VIII del 30 al 60 % (30-60 UI/dl correspondientes a 0,30-0,60 UI/ml) |
Durante el tratamiento se recomienda controlar, adecuadamente, los niveles de factor VIII para determinar la dosis a administrar y la frecuencia de las perfusiones. En el caso especial de la cirugía mayor, es indispensable monitorizar con precisión la terapia de sustitución mediante pruebas de la coagulación (actividad plasmática del factor VIII). La respuesta de cada paciente frente al factor VIII puede variar y alcanzar distintos niveles de recuperación in vivo y demostrar semividas diferentes.
Para la profilaxis a largo plazo de las hemorragias, en pacientes con hemofilia A grave, las dosis usuales son de 20 a 40 UI de factor VIII por kg de peso corporal, cada 2 ó 3 días. En ciertos casos, especialmente en pacientes jóvenes, puede ser necesario acortar los intervalos entre administraciones, o utilizar dosis más elevadas.
La posología en pediatría se basa en el peso corporal y por lo tanto sigue, generalmente, las mismas directrices que se usan para los adultos. La frecuencia de administración debe estar siempre orientada a conseguir la eficacia clínica en cada caso particular. Existe alguna experiencia clínica en el tratamiento de niños menores de 6 años.
En los pacientes deberá controlarse el desarrollo de inhibidores del factor VIII. Si no se alcanzan los niveles de actividad plasmática de factor VIII esperados, o si el sangrado no se controla con la dosis adecuada, deberá realizarse una prueba para determinar la presencia de inhibidores del factor VIIII. En pacientes con títulos altos de inhibidores, la terapia con factor VIII puede ser no efectiva, por lo que deberán considerarse otras opciones terapéuticas. El manejo de estos pacientes deberá estar dirigido por médicos con experiencia en el tratamiento de la hemofilia.
Información sobre las propiedades farmacológicas del Factor de von Willebrand
Además de su función protectora del factor VIII, el factor de von Willebrand facilita la adhesión de las plaquetas en los sitios con una herida vascular y juega un papel en la agregación plaquetaria.
9 de 9