Bemfola 225Ui/0,375Ml Solucion Inyectable En Pluma Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bemfola 75 UI/0,125 ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de la solución contiene 600 UI (equivalente a 44 microgramos) de folitropina alfa*. Cada pluma precargada administra 75 UI (equivalente a 5,5 microgramos) en 0,125 ml.
*hormona foliculoestimulante humana recombinante (hFSH-r) producida en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada (inyectable).
Solución límpida, incolora.
El pH de la solución es de 6,7 a 7,3.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas
• Anovulación (incluyendo el síndrome del ovario poliquístico) en mujeres que no han respondido al tratamiento con citrato de clomifeno.
• Estimulación del desarrollo folicular múltiple en pacientes sometidas a superovulación para realizar técnicas de reproducción asistida (TRA), tales como la fertilización in vitro (FIV), transferencia intratubárica de gametos y transferencia intratubárica de cigotos.
• La folitropina alfa, asociada a un preparado de hormona luteinizante (LH), se recomienda para la estimulación del desarrollo folicular en mujeres con deficiencia severa de LH y FSH. En los ensayos clínicos, estas pacientes se definieron por un nivel sérico de LH endógena de
< 1,2 UI/l.
En varones adultos
• La folitropina alfa está indicada para estimular la espermatogénesis en varones con
hipogonadismo hipogonadotropo congénito o adquirido, administrado de forma concomitante con Gonadotropina Coriónica humana (hCG).
4.2 Posología y forma de administración
El tratamiento con Bemfola debe iniciarse bajo la supervisión de un médico con experiencia en el
tratamiento de los trastornos de la fertilidad.
Debe proporcionarse a los pacientes el número adecuado de plumas para su ciclo de tratamiento e instruirles en el uso de las técnicas de inyección correctas.
Posología
Las recomendaciones posológicas para la folitropina alfa son las mismas que se utilizan para la FSH urinaria. La evaluación clínica de la folitropina alfa indica que sus dosis diarias, pautas de administración y procedimientos para monitorizar el tratamiento no deben ser distintos de los que se utilizan actualmente para los medicamentos que contienen FSH urinaria. Se aconseja adherirse a las dosis iniciales recomendadas, que se indican a continuación.
Estudios clínicos comparativos han demostrado que de media los pacientes requieren una dosis acumulativa menor y un periodo de tratamiento más corto con la folitropina alfa que con el tratamiento con FSH urinaria. Por tanto, se considera apropiado dar una dosis total menor de folitropina alfa que la generalmente utilizada para la FSH urinaria, no sólo para optimizar el desarrollo folicular sino también para minimizar el riesgo de hiperestimulación ovárica no deseada (ver sección 5.1).
Mujeres con anovulación (incluyendo el síndrome de ovario _poliquístico)
Bemfola puede administrarse mediante un ciclo de inyecciones diarias. En las mujeres con menstruación el tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual.
Una pauta comúnmente utilizada comienza con 75-150 UI de FSH diarias y se incrementa preferiblemente en 37,5 o 75 UI a intervalos de 7 días o, preferiblemente, 14 días, si fuera necesario para obtener una respuesta adecuada, pero no excesiva. El tratamiento debe adaptarse a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y/o la secreción de estrógenos. La dosis máxima diaria no suele ser superior a 225 UI de FSH. Si una paciente no responde adecuadamente después de 4 semanas de tratamiento, ese ciclo debe interrumpirse y la paciente se debe someter a evaluaciones adicionales antes de que pueda reiniciar el tratamiento con una dosis inicial más alta que la del ciclo cancelado.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de coriogonadotropina alfa humana recombinante (hCG-r), ó 5.000 UI, hasta 10.000 UI, de hCG, 24 -48 horas después de la última inyección de folitropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente. Alternativamente, puede practicarse inseminación intrauterina (IIU).
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG (ver la sección 4.4). El tratamiento se debe reiniciar en el ciclo siguiente con una dosis más baja que la del ciclo previo.
Mujeres sometidas a estimulación ovárica_para el desarrollo _folicular múltiple _previo a la fertilización in vitro u otras técnicas de reproducción asistida
Una pauta frecuente de tratamiento para inducir superovulación consiste en la administración de 150225 UI de folitropina alfa por día, comenzando el día 2 ó 3 del ciclo. El tratamiento debe continuar hasta que se alcance un desarrollo folicular adecuado (según los niveles séricos de estrógenos y/o la ecografía); las dosis deben ajustarse en función de la respuesta de la paciente, sin que se rebasen habitualmente las 450 UI diarias. En general, se alcanza un desarrollo folicular adecuado como media antes del décimo día de tratamiento (entre 5 y 20 días).
Al cabo de 24 -48 horas de la última inyección de folitropina alfa se debe administrar una única inyección de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI de hCG, para inducir la maduración folicular final.
En la actualidad, se realiza frecuentemente un bloqueo hipofisario con un agonista o antagonista de la hormona liberadora de gonadotropinas (GnRH), para suprimir el pico endógeno de LH y controlar su secreción. En un protocolo habitual, la administración de folitropina alfa se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, tras 2 semanas de tratamiento con el agonista, se administran 150 -225 UI de folitropina alfa durante los primeros 7 días y, a continuación, se ajusta la dosis según la respuesta ovárica.
La experiencia global con técnicas de FIV indica que, en general, la tasa de éxito del tratamiento permanece estable durante los primeros cuatro intentos, disminuyendo posteriormente de forma gradual.
Mujeres con anovulación debida a un déficit severo de LH y FSH
En mujeres con déficit de LH y FSH (hipogonadismo hipogonadotropo), el objetivo del tratamiento con Bemfola asociado a lutropina alfa es desarrollar un único folículo de Graaf maduro, a partir del cual se liberará el ovocito tras la administración de gonadotropina coriónica humana (hCG). La folitropina alfa se debe administrar como un ciclo de inyecciones diarias, conjuntamente con lutropina alfa. . Puesto que estas pacientes son amenorreicas y tienen una escasa secreción endógena de estrógenos, el tratamiento puede comenzar en cualquier momento.
Una pauta recomendada comienza con 75 UI de lutropina alfa por día junto con 75 - 150 UI de FSH.
El tratamiento se debe adaptar a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y la respuesta estrogénica.
Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 -75 UI. Puede ser aceptable prolongar la duración de la estimulación en un ciclo determinado hasta 5 semanas.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI, de hCG, 24 - 48 horas después de la última inyección de folitropina alfa y lutropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente.
De forma alternativa, se puede realizar IIU.
Se puede considerar la necesidad de apoyo de la fase lútea, ya que la falta de sustancias con actividad luteotropa (LH/hCG) después de la ovulación puede dar lugar a un fracaso prematuro del cuerpo lúteo.
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG. El tratamiento se debe reiniciar en el ciclo siguiente con una dosis de FSH más baja que la del ciclo previo.
Varones con hipogonadismo hipogonadotropo
Bemfola se debe administrar a dosis de 150 UI tres veces por semana, de forma concomitante con hCG, durante un mínimo de 4 meses. Si después de este periodo el paciente no ha respondido, se puede continuar el tratamiento combinado; la experiencia clínica actual indica que se puede requerir un tratamiento de al menos 18 meses para lograr la espermatogénesis.
Poblaciones especiales
Población de edad avanzada
No existe una recomendación de uso específica para folitropina alfa en la población de edad avanzada. No se ha establecido la seguridad y eficacia de la folitropina alfa en los pacientes de edad avanzada.
No se ha establecido la seguridad la eficacia y las propiedades farmacocinéticas de la folitropina alfa en los pacientes con insuficiencia renal o hepática.
Población _ pediátrica
La folitropina alfa no se debe utilizar en la población pediátrica.
Forma de administración
Bemfola está indicado para la administración por vía subcutánea. La primera inyección de Bemfola se debe realizar bajo supervisión médica directa. La autoadministración de Bemfola sólo debe ser realizada por pacientes que estén bien motivados, adecuadamente instruidos y que tengan acceso a los consejos de un profesional.
Dado que la pluma precargada de Bemfola con cartucho de una sola dosis está destinada a una sola inyección, se deben proporcionar instrucciones claras a los pacientes, a fin de evitar el uso inadecuado de la presentación unidosis.
Para consultar las instrucciones sobre la administración con la pluma precargada, ver sección 6.6 y el prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo folitropina alfa, a la FSH o a alguno de los excipientes incluidos en la sección 6.1;
• Tumores del hipotálamo o de la hipófisis;
• Aumento del tamaño de los ovarios o quistes ováricos no causados por el síndrome del ovario poliquístico;
• Hemorragias ginecológicas de etiología desconocida;
• Carcinoma ovárico, uterino o mamario.
La folitropina alfa no se debe utilizar cuando no se puede obtener una respuesta eficaz, en casos tales como:
• Fallo ovárico primario;
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Tumores fibroides del útero incompatibles con el embarazo.
• Fallo testicular primario.
4.4 Advertencias y precauciones especiales de empleo
La folitropina alfa es una sustancia gonadotrópica potente capaz de causar reacciones adversas de leves a graves, y sólo se debe utilizar por médicos que estén muy familiarizados con los problemas de la infertilidad y su tratamiento.
El tratamiento con gonadotropinas requiere una cierta dedicación de tiempo por parte de los médicos y profesionales sanitarios, además de disponer de las instalaciones de monitorización apropiadas, En mujeres, el uso seguro y eficaz de la folitropina alfa requiere monitorizar la respuesta ovárica mediante ecografías, solas o preferiblemente combinadas con la determinación de los niveles séricos de estradiol, de manera regular. Puede existir un cierto grado de variabilidad en la respuesta a la administración de FSH entre unas pacientes y otras, con una respuesta escasa a la FSH en algunas pacientes y una respuesta exagerada en otras. Tanto en varones como en mujeres, se debe utilizar la mínima dosis efectiva para lograr el objetivo del tratamiento.
Porfíria
Los pacientes con porfiria o con antecedentes familiares de porfiria se deben controlar estrechamente durante el tratamiento con folitropina alfa. El deterioro de dicha enfermedad o su aparición por primera vez puede requerir la interrupción del tratamiento.
Tratamiento en mujeres
Antes de iniciar el tratamiento, se debe valorar adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, se debe descartar la presencia de hipotiroidismo, insuficiencia suprarrenal e hiperprolactinemia, instaurando el tratamiento específico apropiado.
Las pacientes sometidas a estimulación del desarrollo folicular, ya sea como tratamiento de la infertilidad por anovulación o bien para practicar TRA, pueden presentar aumento del tamaño de los ovarios o hiperestimulación. La incidencia de estos eventos puede minimizarse aplicando las dosis y pautas de administración de folitropina alfa recomendadas y monitorizando cuidadosamente el tratamiento. Para la interpretación correcta de los índices de desarrollo y maduración folicular, el médico debe tener experiencia en la interpretación de las pruebas correspondientes.
En los ensayos clínicos se ha demostrado un aumento de la sensibilidad ovárica a la folitropina alfa cuando se administra con lutropina alfa. Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 - 75 UI.
No se ha efectuado una comparación directa de la folitropina alfa/LH frente a la gonadotropina menopáusica humana (hMG). La comparación con datos históricos sugiere que la tasa de ovulación obtenida con folitropina alfa/LH es similar a la que se obtiene con hMG.
Síndrome de hiperestimulación ovárica (SHO)
Un cierto grado de incremento del tamaño del ovario es un efecto esperado de la estimulación ovárica controlada. Se observa con mayor frecuencia en mujeres con síndrome del ovario poliquístico y, por lo general, remite sin tratamiento.
A diferencia del aumento de tamaño ovárico no complicado, el SHO es una afección que puede manifestarse con grados crecientes de gravedad. Incluye un aumento marcado del tamaño de los ovarios, niveles séricos elevados de esteroides sexuales y un aumento de la permeabilidad vascular que puede dar lugar a una acumulación de líquidos en la cavidad peritoneal, pleural y, raramente, pericárdica.
En los casos de SHO grave puede observarse la siguiente sintomatología: dolor abdominal, distensión abdominal, aumento importante del tamaño de los ovarios, aumento de peso, disnea, oliguria y síntomas gastrointestinales incluyendo náuseas, vómitos y diarrea. La evaluación clínica puede revelar hipovolemia, hemoconcentración, desequilibrio electrolítico, ascitis, hemoperitoneo, derrames pleurales, hidrotórax o distrés respiratorio agudo. Muy raramente, el SHO grave puede complicarse con torsión del ovario o episodios tromboembólicos como embolia pulmonar, accidente cerebrovascular isquémico o infarto de miocardio.
Algunos factores de riesgo independientes para presentar el síndrome de hiperestimulación ovárica son el síndrome del ovario poliquístico, las concentraciones absolutas altas o en rápido aumento de estradiol en el suero (por ejemplo, > 900 pg/ml o > 3.300 pmol/l en la anovulación; > 3.000 pg/ml o
> 11.000 pmol/l en TRA) y una gran cantidad de folículos ováricos en desarrollo (por ejemplo,
> 3 folículos de > 14 mm de diámetro en la anovulación; > 20 folículos de > 12 mm de diámetro en las TRA).
El cumplimiento de la dosis recomendada de folitropina alfa y la pauta de administración pueden minimizar el riesgo de hiperestimulación ovárica (ver secciones 4.2 y 4.8). Para identificar tempranamente los factores de riesgo, se recomienda la vigilancia de los ciclos de estimulación mediante ecografías y determinaciones de estradiol.
Hay evidencias que sugieren que la hCG desempeña una función fundamental en el desencadenamiento del SHO y que el síndrome puede ser más grave y puede tener una duración más prolongada si se produce un embarazo. Por tanto, si se producen signos de hiperestimulación ovárica, por ejemplo, una concentración sérica de estradiol > 5.500 pg/ml o > 20.200 pmol/ml y/o > 40 folículos en total, se recomienda no administrar hCG y se debe advertir a la paciente que no realice el coito o que utilice métodos anticonceptivos de barrera durante al menos cuatro días. El SHO puede progresar rápidamente (en menos de 24 horas) o en varios días hasta convertirse en un cuadro clínico grave. La mayoría de las veces se produce después de que el tratamiento hormonal se ha suspendido y alcanza su máxima intensidad aproximadamente de siete a diez días después del tratamiento. Por lo tanto, se debe seguir a las pacientes durante al menos dos semanas tras la administración de hCG.
En las técnicas de reproducción asistida, la aspiración de todos los folículos, antes de la ovulación, puede reducir la incidencia de hiperestimulación.
El síndrome de hiperestimulación ovárica leve o moderado se resuelve generalmente de manera espontánea. Si se produce un SHO grave, se recomienda interrumpir el tratamiento con gonadotropinas si es que todavía continúa, y hospitalizar a la paciente e iniciar el tratamiento adecuado.
Embarazo múltiple
En pacientes sometidas a la inducción de la ovulación, la incidencia de embarazo múltiple es más elevada que en el caso de la concepción natural. La mayoría de embarazos múltiples son gemelares. El embarazo múltiple, especialmente si el número de fetos es alto, conlleva un mayor riesgo de complicaciones maternas y perinatales.
Para minimizar el riesgo de embarazo múltiple, se recomienda una monitorización cuidadosa de la respuesta ovárica.
El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona principalmente con el número de embriones transferidos, con la calidad de los mismos y con la edad de la paciente.
Antes de empezar el tratamiento se debe informar a las pacientes del riesgo potencial de partos múltiples.
Pérdida del embarazo
La incidencia de pérdida del embarazo debido a aborto espontáneo o provocado es mayor en pacientes sometidas a estimulación del desarrollo folicular para inducir la ovulación o practicar TRA que la observada tras la concepción natural.
Embarazo ectópico
Las mujeres con historia de enfermedad tubárica presentan riesgo de embarazo ectópico, tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad. Se ha notificado que la prevalencia del embarazo ectópico tras practicar TRA es mayor que en la población general.
Neoplasias del aparato reproductor
Se han descrito neoplasias, tanto benignas como malignas, del ovario y de otros órganos del aparato reproductor, en mujeres sometidas a múltiples pautas terapéuticas para el tratamiento de la infertilidad. Todavía no está establecido si el tratamiento con gonadotropinas aumenta o no el riesgo de estos tumores en mujeres estériles.
Malformaciones congénitas
La prevalencia de malformaciones congénitas tras TRA puede ser ligeramente superior a la observada tras la concepción natural. Esto se considera debido a diferencias en las características de los progenitores (por ejemplo, la edad de la madre, las características del semen) y a los embarazos múltiples.
Eventos tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso o en mujeres con factores de riesgo generalmente reconocidos para presentar problemas tromboembólicos, tales como antecedentes familiares o personales, el tratamiento con gonadotropinas puede aumentar más el riesgo de empeoramiento o aparición de dichos fenómenos. En estas mujeres, los beneficios de la administración de gonadotropinas se deben sopesar frente a los riesgos. No obstante, hay que tener en cuenta que el embarazo por sí mismo, así como el síndrome de hiperestimulación ovárica, también comportan un aumento del riesgo de acontecimientos tromboembólicos.
Tratamiento en varones
Unos niveles elevados de FSH endógena indican fallo testicular primario. Dichos pacientes no responden al tratamiento con folitropina alfa/hCG. La folitropina alfa no se debe usar cuando no se pueda obtener una respuesta eficaz.
Se recomienda practicar espermiogramas de 4 a 6 meses después de iniciar el tratamiento, como parte de la evaluación de la respuesta.
Contenido de sodio
Bemfola contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente «exento de sodio»
4.5 Interacción con otros medicamentos y otras formas de interacción
La utilización concomitante de folitropina alfa con otros medicamentos utilizados para estimular la ovulación (por ejemplo, hCG, citrato de clomifeno) puede potenciar la respuesta folicular, mientras que la utilización concomitante de un agonista o antagonista de la GnRH para provocar una desensibilización hipofisaria puede incrementar la dosis de folitropina alfa necesaria para lograr una respuesta ovárica adecuada. No se han descrito otras interacciones con medicamentos clínicamente significativas durante el tratamiento con folitropina alfa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para utilizar Bemfola durante el embarazo. Existen datos sobre un número limitado de embarazos expuestos (menos de 300 embarazos) que indican que folitropina alfa no produce malformaciones ni toxicidad fetal/neonatal.
No se han observado efectos teratogénicos en los estudios en animales (ver sección 5.3). En caso de exposición durante el embarazo, los datos clínicos no son suficientes para descartar un efecto teratógeno de la folitropina alfa.
Lactancia
Bemfola no está indicado durante la lactancia.
Fertilidad
Bemfola está indicado para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se espera que la influencia de Bemfola sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas notificadas con mayor frecuencia son cefalea, quistes ováricos y reacciones locales en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón y/o irritación en el lugar de la inyección).
Se ha notificado con frecuencia síndrome de hiperestimulación ovárica leve o moderado y se debe considerar como un riesgo intrínseco del proceso de estimulación. El síndrome de hiperestimulación ovárica grave es poco frecuente (ver sección 4.4).
En casos muy raros se puede producir tromboembolismo, asociado generalmente a un síndrome de hiperestimulación ovárica grave (ver sección 4.4).
Las siguientes definiciones se aplican a la terminología de frecuencia usada de aquí en adelante:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Tratamiento en mujeres
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos del sistema nervioso
Muy frecuentes: Cefalea Trastornos vasculares
Muy raras: Tromboembolismo, generalmente asociado a síndrome de hiperestimulación
ovárica grave (ver sección 4.4)
Trastornos respiratorios, torácicos y mediastínicos
Muy raras: Exacerbación o empeoramiento del asma
Trastornos gastrointestinales
Frecuentes: Dolor abdominal, distensión abdominal, molestias abdominales, náuseas, vómitos,
diarrea
Trastornos del aparato reproductor y de la mama Muy frecuentes: Quistes ováricos
Frecuentes: Síndrome de hiperestimulación ovárica leve o moderado (incluida la
sintomatología relacionada)
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (incluida la sintomatología relacionada) (ver sección 4.4)
Raras: Complicación del síndrome de hiperestimulación ovárica grave
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Tratamiento en varones
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos respiratorios, torácicos y mediastínicos Muy raras: Exacerbación y/o empeoramiento del asma
Trastornos de la _piel y del tejido subcutáneo Frecuentes: Acné
Trastornos del aparato reproductor y de la mama
Frecuentes: Ginecomastia, varicocele
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Exploraciones complementarias
Frecuentes: Aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Los efectos de una sobredosis de folitropina alfa se desconocen; sin embargo, existe la posibilidad de que se produzca un síndrome de hiperestimulación ovárica (ver sección 4.4).
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA05.
Bemfola es un medicamento biosimilar, es decir un medicamento que se ha demostrado que es similar en lo que respecta a la calidad, seguridad y eficacia al medicamento de referencia GONAL-f. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Efectos farmacodinámicos
En mujeres, el efecto más importante que se produce tras la administración parenteral de FSH es el desarrollo de folículos de Graaf maduros. En mujeres con anovulación, el objetivo del tratamiento con folitropina alfa es desarrollar un único folículo de Graaf maduro a partir del cual se liberará el óvulo después de la administración de hCG.
Eficacia clínica y seguridad en mujeres
En los ensayos clínicos, las pacientes con déficit severo de FSH y LH se definieron por un nivel sérico de LH endógena de < 1,2 UI/l, medido en un laboratorio central. Sin embargo, se debe tener en cuenta que existen variaciones entre las determinaciones de LH realizadas en diferentes laboratorios.
En estudios clínicos comparativos de hFSH-r (folitropina alfa) y FSH urinaria en las técnicas de reproducción asistida (ver tabla a continuación) y en inducción a la ovulación, la folitropina alfa se mostró más potente que la FSH urinaria en términos de una dosis total menor necesaria y un periodo de tratamiento más corto para desencadenar la maduración folicular.
En las técnicas de reproducción asistida, la folitropina alfa a una dosis total menor y durante un periodo de tratamiento más corto que la FSH urinaria, permitió la recuperación de un número mayor de ovocitos, en comparación con la FSH urinaria.
Tabla: Resultados del estudio GF 8407 (estudio paralelo aleatorizado y comparativo de la eficacia y
|
seguridad de la folitropina alfa con la FSH urinaria en técnicas c |
e reproducción asistida). | |
|
folitropina alfa (n = 130) |
FSH urinaria (n = 116) | |
|
Número de ovocitos recuperados |
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Días de estimulación con FSH requeridos |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Dosis total de FSH requerida (número de ampollas de FSH 75 UI) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Necesidad de aumentar la dosis (%) |
56,2 |
85,3 |
Las diferencias entre los dos grupos fueron estadísticamente significativas (p < 0,05) para todos los criterios incluidos.
Eficacia clínica y seguridad en varones
En varones con déficit de FSH, la folitropina alfa administrada de forma concomitante con hCG durante al menos 4 meses induce la espermatogénesis.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la folitropina alfa se distribuye en el espacio extracelular. La semivida de distribución es de unas 2 horas y la semivida de eliminación, de alrededor de 1 día. En estado estacionario, el volumen de distribución es de 10 l y el aclaramiento total, de 0,6 l/h. La octava parte de la dosis de folitropina alfa administrada se excreta en la orina.
Tras la administración subcutánea, la biodisponibilidad absoluta es de alrededor del 70 %. Tras la administración de dosis repetidas de folitropina alfa, se produce una acumulación de 3 veces, alcanzando un estado estacionario en un periodo de 3-4 días. En mujeres con supresión de la secreción endógena de gonadotropinas, la folitropina alfa estimula adecuadamente el desarrollo folicular y la esteroidogénesis, a pesar de unos niveles indetectables de LH.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad de dosis única y a dosis repetidas y genotoxicidad, adicionales a los ya descritos en otras secciones de esta ficha técnica.
Se han notificado trastornos de la fertilidad en ratas expuestas a dosis farmacológicas de folitropina alfa (> 40 UI/kg/día) durante largos períodos de tiempo, mostrando una disminución de la fecundidad.
La administración de dosis altas (> 5 UI/kg/día) de folitropina alfa produjo un descenso en el número de fetos viables, aunque no tuvo efectos teratógenos, así como distocia similar a la observada con la hormona Gonadotropina Menopáusica (hMG) urinaria. Sin embargo, puesto que Bemfola no está indicado en el embarazo, estos datos tienen escasa relevancia clínica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poloxámero 188
Sacarosa
Metionina
Hidrogenofosfato de disodio dihidrato Dihidrogenofosfato de sodio dihidrato Ácido fosfórico
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Antes de la apertura y durante su periodo de validez, el medicamento se puede extraer de la nevera, sin refrigerar de nuevo, hasta un máximo de 3 meses a temperatura igual o inferior a 25 °C. El producto se debe desechar si después de 3 meses no se ha utilizado.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de 1,5 ml (vidrio de tipo I) que contiene 0,125 ml de solución inyectable con un tapón (goma de halobutilo) y una cápsula de cierre de aluminio superpuesta con incrustación de goma.
Envases con 1, 5 o 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases. Para la administración con la pluma se debe utilizar una aguja y una gasa empapada en alcohol.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver el prospecto.
La solución no se debe administrar si contiene partículas o no es transparente.
Bemfola 75 UI/0,125 ml (5,5 microgramos/0,125 ml) no está diseñado para permitir la extracción del cartucho.
Las agujas utilizadas se deben desechar inmediatamente tras la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/001
EU/1/13/909/006
EU/1/13/909/007
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/03/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bemfola 150 UI/0,25 ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de la solución contiene 600 UI (equivalente a 44 microgramos) de folitropina alfa*. Cada pluma precargada administra 150 UI (equivalente a 11 microgramos) en 0,125 ml.
*hormona foliculoestimulante humana recombinante (hFSH-r) producida en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada (inyectable). Solución límpida, incolora.
El pH de la solución es de 6,7 a 7,3.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas
• Anovulación (incluyendo el síndrome del ovario poliquístico) en mujeres que no han respondido al tratamiento con citrato de clomifeno.
• Estimulación del desarrollo folicular múltiple en pacientes sometidas a superovulación para realizar técnicas de reproducción asistida (TRA), tales como la fertilización in vitro (FIV), transferencia intratubárica de gametos y transferencia intratubárica de cigotos.
• La folitropina alfa, asociada a un preparado de hormona luteinizante (LH), se recomienda para la estimulación del desarrollo folicular en mujeres con deficiencia severa de LH y FSH. En los ensayos clínicos, estas pacientes se definieron por un nivel sérico de LH endógena de
< 1,2 UI/l.
En varones adultos
• La folitropina alfa está indicada para estimular la espermatogénesis en varones con
hipogonadismo hipogonadotropo congénito o adquirido, administrado de forma concomitante con Gonadotropina Coriónica humana (hCG).
4.2 Posología y forma de administración
El tratamiento con Bemfola debe iniciarse bajo la supervisión de un médico con experiencia en el
tratamiento de los trastornos de la fertilidad.
Debe proporcionarse a los pacientes el número adecuado de plumas para su ciclo de tratamiento e instruirles en el uso de las técnicas de inyección correctas.
Posología
Las recomendaciones posológicas para la folitropina alfa son las mismas que se utilizan para la FSH urinaria. La evaluación clínica de la folitropina alfa indica que sus dosis diarias, pautas de administración y procedimientos para monitorizar el tratamiento no deben ser distintos de los que se utilizan actualmente para los medicamentos que contienen FSH urinaria. Se aconseja adherirse a las dosis iniciales recomendadas, que se indican a continuación.
Estudios clínicos comparativos han demostrado que de media los pacientes requieren una dosis acumulativa menor y un periodo de tratamiento más corto con la folitropina alfa que con el tratamiento con FSH urinaria. Por tanto, se considera apropiado dar una dosis total menor de folitropina alfa que la generalmente utilizada para la FSH urinaria, no sólo para optimizar el desarrollo folicular sino también para minimizar el riesgo de hiperestimulación ovárica no deseada (ver sección 5.1).
Mujeres con anovulación (incluyendo el síndrome de ovario _poliquístico)
Bemfola puede administrarse mediante un ciclo de inyecciones diarias. En las mujeres con menstruación el tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual.
Una pauta comúnmente utilizada comienza con 75-150 UI de FSH diarias y se incrementa preferiblemente en 37,5 o 75 UI a intervalos de 7 días o, preferiblemente, 14 días, si fuera necesario para obtener una respuesta adecuada, pero no excesiva. El tratamiento debe adaptarse a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y/o la secreción de estrógenos. La dosis máxima diaria no suele ser superior a 225 UI de FSH. Si una paciente no responde adecuadamente después de 4 semanas de tratamiento, ese ciclo debe interrumpirse y la paciente se debe someter a evaluaciones adicionales antes de que pueda reiniciar el tratamiento con una dosis inicial más alta que la del ciclo cancelado.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de coriogonadotropina alfa humana recombinante (hCG-r), ó 5.000 UI, hasta 10.000 UI, de hCG, 24 -48 horas después de la última inyección de folitropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente. Alternativamente, puede practicarse inseminación intrauterina (IIU).
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG (ver la sección 4.4). El tratamiento se debe reiniciar en el ciclo siguiente con una dosis más baja que la del ciclo previo.
Mujeres sometidas a estimulación ovárica_para el desarrollo _folicular múltiple _previo a la fertilización in vitro u otras técnicas de reproducción asistida
Una pauta frecuente de tratamiento para inducir superovulación consiste en la administración de 150225 UI de folitropina alfa por día, comenzando el día 2 ó 3 del ciclo. El tratamiento debe continuar hasta que se alcance un desarrollo folicular adecuado (según los niveles séricos de estrógenos y/o la ecografía); las dosis deben ajustarse en función de la respuesta de la paciente, sin que se rebasen habitualmente las 450 UI diarias. En general, se alcanza un desarrollo folicular adecuado como media antes del décimo día de tratamiento (entre 5 y 20 días).
Al cabo de 24 -48 horas de la última inyección de folitropina alfa se debe administrar una única inyección de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI de hCG, para inducir la maduración folicular final.
En la actualidad, se realiza frecuentemente un bloqueo hipofisario con un agonista o antagonista de la hormona liberadora de gonadotropinas (GnRH), para suprimir el pico endógeno de LH y controlar su secreción. En un protocolo habitual, la administración de folitropina alfa se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, tras 2 semanas de tratamiento con el agonista, se administran 150 -225 UI de folitropina alfa durante los primeros 7 días y, a continuación, se ajusta la dosis según la respuesta ovárica.
La experiencia global con técnicas de FIV indica que, en general, la tasa de éxito del tratamiento permanece estable durante los primeros cuatro intentos, disminuyendo posteriormente de forma gradual.
Mujeres con anovulación debida a un déficit severo de LH y FSH
En mujeres con déficit de LH y FSH (hipogonadismo hipogonadotropo), el objetivo del tratamiento con Bemfola asociado a lutropina alfa es desarrollar un único folículo de Graaf maduro, a partir del cual se liberará el ovocito tras la administración de gonadotropina coriónica humana (hCG). La folitropina alfa se debe administrar como un ciclo de inyecciones diarias, conjuntamente con lutropina alfa. . Puesto que estas pacientes son amenorreicas y tienen una escasa secreción endógena de estrógenos, el tratamiento puede comenzar en cualquier momento.
Una pauta recomendada comienza con 75 UI de lutropina alfa por día junto con 75 - 150 UI de FSH.
El tratamiento se debe adaptar a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y la respuesta estrogénica.
Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 -75 UI. Puede ser aceptable prolongar la duración de la estimulación en un ciclo determinado hasta 5 semanas.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI, de hCG, 24 - 48 horas después de la última inyección de folitropina alfa y lutropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente.
De forma alternativa, se puede realizar IIU.
Se puede considerar la necesidad de apoyo de la fase lútea, ya que la falta de sustancias con actividad luteotropa (LH/hCG) después de la ovulación puede dar lugar a un fracaso prematuro del cuerpo lúteo.
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG. El tratamiento se debe reiniciar en el ciclo siguiente con una dosis de FSH más baja que la del ciclo previo.
Varones con hipogonadismo hipogonadotropo
Bemfola se debe administrar a dosis de 150 UI tres veces por semana, de forma concomitante con hCG, durante un mínimo de 4 meses. Si después de este periodo el paciente no ha respondido, se puede continuar el tratamiento combinado; la experiencia clínica actual indica que se puede requerir un tratamiento de al menos 18 meses para lograr la espermatogénesis.
Poblaciones especiales
Población de edad avanzada
No existe una recomendación de uso específica para folitropina alfa en la población de edad avanzada. No se ha establecido la seguridad y eficacia de la folitropina alfa en los pacientes de edad avanzada.
No se ha establecido la seguridad la eficacia y las propiedades farmacocinéticas de la folitropina alfa en los pacientes con insuficiencia renal o hepática.
Población _ pediátrica
La folitropina alfa no se debe utilizar en la población pediátrica.
Forma de administración
Bemfola está indicado para la administración por vía subcutánea. La primera inyección de Bemfola se debe realizar bajo supervisión médica directa. La autoadministración de Bemfola sólo debe ser realizada por pacientes que estén bien motivados, adecuadamente instruidos y que tengan acceso a los consejos de un profesional.
Dado que la pluma precargada de Bemfola con cartucho de una sola dosis está destinada a una sola inyección, se deben proporcionar instrucciones claras a los pacientes, a fin de evitar el uso inadecuado de la presentación unidosis.
Para consultar las instrucciones sobre la administración con la pluma precargada, ver sección 6.6 y el prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo folitropina alfa, a la FSH o a alguno de los excipientes incluidos en la sección 6.1;
• Tumores del hipotálamo o de la hipófisis;
• Aumento del tamaño de los ovarios o quistes ováricos no causados por el síndrome del ovario poliquístico;
• Hemorragias ginecológicas de etiología desconocida;
• Carcinoma ovárico, uterino o mamario.
La folitropina alfa no se debe utilizar cuando no se puede obtener una respuesta eficaz, en casos tales como:
• Fallo ovárico primario;
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Tumores fibroides del útero incompatibles con el embarazo.
• Fallo testicular primario.
4.4 Advertencias y precauciones especiales de empleo
La folitropina alfa es una sustancia gonadotrópica potente capaz de causar reacciones adversas de leves a graves, y sólo se debe utilizar por médicos que estén muy familiarizados con los problemas de la infertilidad y su tratamiento.
El tratamiento con gonadotropinas requiere una cierta dedicación de tiempo por parte de los médicos y profesionales sanitarios, además de disponer de las instalaciones de monitorización apropiadas, En mujeres, el uso seguro y eficaz de la folitropina alfa requiere monitorizar la respuesta ovárica mediante ecografías, solas o preferiblemente combinadas con la determinación de los niveles séricos de estradiol, de manera regular. Puede existir un cierto grado de variabilidad en la respuesta a la administración de FSH entre unas pacientes y otras, con una respuesta escasa a la FSH en algunas pacientes y una respuesta exagerada en otras. Tanto en varones como en mujeres, se debe utilizar la mínima dosis efectiva para lograr el objetivo del tratamiento.
Porfíria
Los pacientes con porfiria o con antecedentes familiares de porfiria se deben controlar estrechamente durante el tratamiento con folitropina alfa. El deterioro de dicha enfermedad o su aparición por primera vez puede requerir la interrupción del tratamiento.
Tratamiento en mujeres
Antes de iniciar el tratamiento, se debe valorar adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, se debe descartar la presencia de hipotiroidismo, insuficiencia suprarrenal e hiperprolactinemia, instaurando el tratamiento específico apropiado.
Las pacientes sometidas a estimulación del desarrollo folicular, ya sea como tratamiento de la infertilidad por anovulación o bien para practicar TRA, pueden presentar aumento del tamaño de los ovarios o hiperestimulación. La incidencia de estos eventos puede minimizarse aplicando las dosis y pautas de administración de folitropina alfa recomendadas y monitorizando cuidadosamente el tratamiento. Para la interpretación correcta de los índices de desarrollo y maduración folicular, el médico debe tener experiencia en la interpretación de las pruebas correspondientes.
En los ensayos clínicos se ha demostrado un aumento de la sensibilidad ovárica a la folitropina alfa cuando se administra con lutropina alfa. Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 - 75 UI.
No se ha efectuado una comparación directa de la folitropina alfa/LH frente a la gonadotropina menopáusica humana (hMG). La comparación con datos históricos sugiere que la tasa de ovulación obtenida con folitropina alfa/LH es similar a la que se obtiene con hMG.
Síndrome de hiperestimulación ovárica (SHO)
Un cierto grado de incremento del tamaño del ovario es un efecto esperado de la estimulación ovárica controlada. Se observa con mayor frecuencia en mujeres con síndrome del ovario poliquístico y, por lo general, remite sin tratamiento.
A diferencia del aumento de tamaño ovárico no complicado, el SHO es una afección que puede manifestarse con grados crecientes de gravedad. Incluye un aumento marcado del tamaño de los ovarios, niveles séricos elevados de esteroides sexuales y un aumento de la permeabilidad vascular que puede dar lugar a una acumulación de líquidos en la cavidad peritoneal, pleural y, raramente, pericárdica.
En los casos de SHO grave puede observarse la siguiente sintomatología: dolor abdominal, distensión abdominal, aumento importante del tamaño de los ovarios, aumento de peso, disnea, oliguria y síntomas gastrointestinales incluyendo náuseas, vómitos y diarrea. La evaluación clínica puede revelar hipovolemia, hemoconcentración, desequilibrio electrolítico, ascitis, hemoperitoneo, derrames pleurales, hidrotórax o distrés respiratorio agudo. Muy raramente, el SHO grave puede complicarse con torsión del ovario o episodios tromboembólicos como embolia pulmonar, accidente cerebrovascular isquémico o infarto de miocardio.
Algunos factores de riesgo independientes para presentar el síndrome de hiperestimulación ovárica son el síndrome del ovario poliquístico, las concentraciones absolutas altas o en rápido aumento de estradiol en el suero (por ejemplo, > 900 pg/ml o > 3.300 pmol/l en la anovulación; > 3.000 pg/ml o
> 11.000 pmol/l en TRA) y una gran cantidad de folículos ováricos en desarrollo (por ejemplo,
> 3 folículos de > 14 mm de diámetro en la anovulación; > 20 folículos de > 12 mm de diámetro en las TRA).
El cumplimiento de la dosis recomendada de folitropina alfa y la pauta de administración pueden minimizar el riesgo de hiperestimulación ovárica (ver secciones 4.2 y 4.8). Para identificar tempranamente los factores de riesgo, se recomienda la vigilancia de los ciclos de estimulación mediante ecografías y determinaciones de estradiol.
Hay evidencias que sugieren que la hCG desempeña una función fundamental en el desencadenamiento del SHO y que el síndrome puede ser más grave y puede tener una duración más prolongada si se produce un embarazo. Por tanto, si se producen signos de hiperestimulación ovárica, por ejemplo, una concentración sérica de estradiol > 5.500 pg/ml o > 20.200 pmol/ml y/o > 40 folículos en total, se recomienda no administrar hCG y se debe advertir a la paciente que no realice el coito o que utilice métodos anticonceptivos de barrera durante al menos cuatro días. El SHO puede progresar rápidamente (en menos de 24 horas) o en varios días hasta convertirse en un cuadro clínico grave. La mayoría de las veces se produce después de que el tratamiento hormonal se ha suspendido y alcanza su máxima intensidad aproximadamente de siete a diez días después del tratamiento. Por lo tanto, se debe seguir a las pacientes durante al menos dos semanas tras la administración de hCG.
En las técnicas de reproducción asistida, la aspiración de todos los folículos, antes de la ovulación, puede reducir la incidencia de hiperestimulación.
El síndrome de hiperestimulación ovárica leve o moderado se resuelve generalmente de manera espontánea. Si se produce un SHO grave, se recomienda interrumpir el tratamiento con gonadotropinas si es que todavía continúa, y hospitalizar a la paciente e iniciar el tratamiento adecuado.
Embarazo múltiple
En pacientes sometidas a la inducción de la ovulación, la incidencia de embarazo múltiple es más elevada que en el caso de la concepción natural. La mayoría de embarazos múltiples son gemelares. El embarazo múltiple, especialmente si el número de fetos es alto, conlleva un mayor riesgo de complicaciones maternas y perinatales.
Para minimizar el riesgo de embarazo múltiple, se recomienda una monitorización cuidadosa de la respuesta ovárica.
El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona principalmente con el número de embriones transferidos, con la calidad de los mismos y con la edad de la paciente.
Antes de empezar el tratamiento se debe informar a las pacientes del riesgo potencial de partos múltiples.
Pérdida del embarazo
La incidencia de pérdida del embarazo debido a aborto espontáneo o provocado es mayor en pacientes sometidas a estimulación del desarrollo folicular para inducir la ovulación o practicar TRA que la observada tras la concepción natural.
Embarazo ectópico
Las mujeres con historia de enfermedad tubárica presentan riesgo de embarazo ectópico, tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad. Se ha notificado que la prevalencia del embarazo ectópico tras practicar TRA es mayor que en la población general.
Neoplasias del aparato reproductor
Se han descrito neoplasias, tanto benignas como malignas, del ovario y de otros órganos del aparato reproductor, en mujeres sometidas a múltiples pautas terapéuticas para el tratamiento de la infertilidad. Todavía no está establecido si el tratamiento con gonadotropinas aumenta o no el riesgo de estos tumores en mujeres estériles.
Malformaciones congénitas
La prevalencia de malformaciones congénitas tras TRA puede ser ligeramente superior a la observada tras la concepción natural. Esto se considera debido a diferencias en las características de los progenitores (por ejemplo, la edad de la madre, las características del semen) y a los embarazos múltiples.
Eventos tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso o en mujeres con factores de riesgo generalmente reconocidos para presentar problemas tromboembólicos, tales como antecedentes familiares o personales, el tratamiento con gonadotropinas puede aumentar más el riesgo de empeoramiento o aparición de dichos fenómenos. En estas mujeres, los beneficios de la administración de gonadotropinas se deben sopesar frente a los riesgos. No obstante, hay que tener en cuenta que el embarazo por sí mismo, así como el síndrome de hiperestimulación ovárica, también comportan un aumento del riesgo de acontecimientos tromboembólicos.
Tratamiento en varones
Unos niveles elevados de FSH endógena indican fallo testicular primario. Dichos pacientes no responden al tratamiento con folitropina alfa/hCG. La folitropina alfa no se debe usar cuando no se pueda obtener una respuesta eficaz.
Se recomienda practicar espermiogramas de 4 a 6 meses después de iniciar el tratamiento, como parte de la evaluación de la respuesta.
Contenido de sodio
Bemfola contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente «exento de sodio»
4.5 Interacción con otros medicamentos y otras formas de interacción
La utilización concomitante de folitropina alfa con otros medicamentos utilizados para estimular la ovulación (por ejemplo, hCG, citrato de clomifeno) puede potenciar la respuesta folicular, mientras que la utilización concomitante de un agonista o antagonista de la GnRH para provocar una desensibilización hipofisaria puede incrementar la dosis de folitropina alfa necesaria para lograr una respuesta ovárica adecuada. No se han descrito otras interacciones con medicamentos clínicamente significativas durante el tratamiento con folitropina alfa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para utilizar Bemfola durante el embarazo. Existen datos sobre un número limitado de embarazos expuestos (menos de 300 embarazos) que indican que folitropina alfa no produce malformaciones ni toxicidad fetal/neonatal.
No se han observado efectos teratogénicos en los estudios en animales (ver sección 5.3). En caso de exposición durante el embarazo, los datos clínicos no son suficientes para descartar un efecto teratógeno de la folitropina alfa.
Lactancia
Bemfola no está indicado durante la lactancia.
Fertilidad
Bemfola está indicado para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se espera que la influencia de Bemfola sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas notificadas con mayor frecuencia son cefalea, quistes ováricos y reacciones locales en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón y/o irritación en el lugar de la inyección).
Se ha notificado con frecuencia síndrome de hiperestimulación ovárica leve o moderado y se debe considerar como un riesgo intrínseco del proceso de estimulación. El síndrome de hiperestimulación ovárica grave es poco frecuente (ver sección 4.4).
En casos muy raros se puede producir tromboembolismo, asociado generalmente a un síndrome de hiperestimulación ovárica grave (ver sección 4.4).
Las siguientes definiciones se aplican a la terminología de frecuencia usada de aquí en adelante:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Tratamiento en mujeres
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos del sistema nervioso
Muy frecuentes: Cefalea Trastornos vasculares
Muy raras: Tromboembolismo, generalmente asociado a síndrome de hiperestimulación
ovárica grave (ver sección 4.4)
Trastornos respiratorios, torácicos y mediastínicos
Muy raras: Exacerbación o empeoramiento del asma
Trastornos gastrointestinales
Frecuentes: Dolor abdominal, distensión abdominal, molestias abdominales, náuseas, vómitos,
diarrea
Trastornos del aparato reproductor y de la mama Muy frecuentes: Quistes ováricos
Frecuentes: Síndrome de hiperestimulación ovárica leve o moderado (incluida la
sintomatología relacionada)
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (incluida la sintomatología relacionada) (ver sección 4.4)
Raras: Complicación del síndrome de hiperestimulación ovárica grave
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Tratamiento en varones
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos respiratorios, torácicos y mediastínicos Muy raras: Exacerbación y/o empeoramiento del asma
Trastornos de la _piel y del tejido subcutáneo Frecuentes: Acné
Trastornos del aparato reproductor y de la mama
Frecuentes: Ginecomastia, varicocele
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Exploraciones complementarias
Frecuentes: Aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Los efectos de una sobredosis de folitropina alfa se desconocen; sin embargo, existe la posibilidad de que se produzca un síndrome de hiperestimulación ovárica (ver sección 4.4).
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA05.
Bemfola es un medicamento biosimilar, es decir un medicamento que se ha demostrado que es similar en lo que respecta a la calidad, seguridad y eficacia al medicamento de referencia GONAL-f. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Efectos farmacodinámicos
En mujeres, el efecto más importante que se produce tras la administración parenteral de FSH es el desarrollo de folículos de Graaf maduros. En mujeres con anovulación, el objetivo del tratamiento con folitropina alfa es desarrollar un único folículo de Graaf maduro a partir del cual se liberará el óvulo después de la administración de hCG.
Eficacia clínica y seguridad en mujeres
En los ensayos clínicos, las pacientes con déficit severo de FSH y LH se definieron por un nivel sérico de LH endógena de < 1,2 UI/l, medido en un laboratorio central. Sin embargo, se debe tener en cuenta que existen variaciones entre las determinaciones de LH realizadas en diferentes laboratorios.
En estudios clínicos comparativos de hFSH-r (folitropina alfa) y FSH urinaria en las técnicas de reproducción asistida (ver tabla a continuación) y en inducción a la ovulación, la folitropina alfa se mostró más potente que la FSH urinaria en términos de una dosis total menor necesaria y un periodo de tratamiento más corto para desencadenar la maduración folicular.
En las técnicas de reproducción asistida, la folitropina alfa a una dosis total menor y durante un periodo de tratamiento más corto que la FSH urinaria, permitió la recuperación de un número mayor de ovocitos, en comparación con la FSH urinaria.
Tabla: Resultados del estudio GF 8407 (estudio paralelo aleatorizado y comparativo de la eficacia y
|
seguridad de la folitropina alfa con la FSH urinaria en técnicas c |
e reproducción asistida). | |
|
folitropina alfa (n = 130) |
FSH urinaria (n = 116) | |
|
Número de ovocitos recuperados |
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Días de estimulación con FSH requeridos |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Dosis total de FSH requerida (número de ampollas de FSH 75 UI) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Necesidad de aumentar la dosis (%) |
56,2 |
85,3 |
Las diferencias entre los dos grupos fueron estadísticamente significativas (p < 0,05) para todos los criterios incluidos.
Eficacia clínica y seguridad en varones
En varones con déficit de FSH, la folitropina alfa administrada de forma concomitante con hCG durante al menos 4 meses induce la espermatogénesis.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la folitropina alfa se distribuye en el espacio extracelular. La semivida de distribución es de unas 2 horas y la semivida de eliminación, de alrededor de 1 día. En estado estacionario, el volumen de distribución es de 10 l y el aclaramiento total, de 0,6 l/h. La octava parte de la dosis de folitropina alfa administrada se excreta en la orina.
Tras la administración subcutánea, la biodisponibilidad absoluta es de alrededor del 70 %. Tras la administración de dosis repetidas de folitropina alfa, se produce una acumulación de 3 veces, alcanzando un estado estacionario en un periodo de 3-4 días. En mujeres con supresión de la secreción endógena de gonadotropinas, la folitropina alfa estimula adecuadamente el desarrollo folicular y la esteroidogénesis, a pesar de unos niveles indetectables de LH.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad de dosis única y a dosis repetidas y genotoxicidad, adicionales a los ya descritos en otras secciones de esta ficha técnica.
Se han notificado trastornos de la fertilidad en ratas expuestas a dosis farmacológicas de folitropina alfa (> 40 UI/kg/día) durante largos períodos de tiempo, mostrando una disminución de la fecundidad.
La administración de dosis altas (> 5 UI/kg/día) de folitropina alfa produjo un descenso en el número de fetos viables, aunque no tuvo efectos teratógenos, así como distocia similar a la observada con la hormona Gonadotropina Menopáusica (hMG) urinaria. Sin embargo, puesto que Bemfola no está indicado en el embarazo, estos datos tienen escasa relevancia clínica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poloxámero 188
Sacarosa
Metionina
Hidrogenofosfato de disodio dihidrato Dihidrogenofosfato de sodio dihidrato Ácido fosfórico
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Antes de la apertura y durante su periodo de validez, el medicamento se puede extraer de la nevera, sin refrigerar de nuevo, hasta un máximo de 3 meses a temperatura igual o inferior a 25 °C. El producto se debe desechar si después de 3 meses no se ha utilizado.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de 1,5 ml (vidrio de tipo I) que contiene 0,25 ml de solución inyectable con un pistón (goma de halobutilo) y una cápsula de aluminio superpuesta con incrustación de goma.
Envases con 1, 5 o 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases. Para la administración con la pluma se debe utilizar una aguja y una gasa empapada en alcohol.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver el prospecto.
La solución no se debe administrar si contiene partículas o no es transparente.
Bemfola 150 UI/0,25 ml (11 microgramos/0,25 ml) no está diseñado para permitir la extracción del cartucho.
Las agujas utilizadas se deben desechar inmediatamente tras la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/002
EU/1/13/909/008
EU/1/13/909/009
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/03/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bemfola 225 UI/0,375 ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de la solución contiene 600 iu (equivalente a 44 microgramas) de folitropín alfa*.Cada pluma precargada administra 225 UI (equivalente a 16,5 microgramos) en 0,375 ml.
*hormona foliculoestimulante humana recombinante (hFSH-r) producida en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada (inyectable). Solución límpida, incolora.
El pH de la solución es de 6,7 a 7,3.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas
• Anovulación (incluyendo el síndrome del ovario poliquístico) en mujeres que no han respondido al tratamiento con citrato de clomifeno.
• Estimulación del desarrollo folicular múltiple en pacientes sometidas a superovulación para realizar técnicas de reproducción asistida (TRA), tales como la fertilización in vitro (FIV), transferencia intratubárica de gametos y transferencia intratubárica de cigotos.
• La folitropina alfa, asociada a un preparado de hormona luteinizante (LH), se recomienda para la estimulación del desarrollo folicular en mujeres con deficiencia severa de LH y FSH. En los ensayos clínicos, estas pacientes se definieron por un nivel sérico de LH endógena de
< 1,2 UI/l.
En varones adultos
• La folitropina alfa está indicada para estimular la espermatogénesis en varones con
hipogonadismo hipogonadotropo congénito o adquirido, administrado de forma concomitante con Gonadotropina Coriónica humana (hCG).
4.2 Posología y forma de administración
El tratamiento con Bemfola debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de los trastornos de la fertilidad.
Debe proporcionarse a los pacientes el número adecuado de plumas para su ciclo de tratamiento e instruirles en el uso de las técnicas de inyección correctas.
Posología
Las recomendaciones posológicas para la folitropina alfa son las mismas que se utilizan para la FSH urinaria. La evaluación clínica de la folitropina alfa indica que sus dosis diarias, pautas de administración y procedimientos para monitorizar el tratamiento no deben ser distintos de los que se utilizan actualmente para los medicamentos que contienen FSH urinaria. Se aconseja adherirse a las dosis iniciales recomendadas, que se indican a continuación.
Estudios clínicos comparativos han demostrado que de media los pacientes requieren una dosis acumulativa menor y un periodo de tratamiento más corto con la folitropina alfa que con el tratamiento con FSH urinaria. Por tanto, se considera apropiado dar una dosis total menor de folitropina alfa que la generalmente utilizada para la FSH urinaria, no sólo para optimizar el desarrollo folicular sino también para minimizar el riesgo de hiperestimulación ovárica no deseada (ver sección 5.1).
Mujeres con anovulación (incluyendo el síndrome de ovario _poliquístico)
Bemfola puede administrarse mediante un ciclo de inyecciones diarias. En las mujeres con menstruación el tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual.
Una pauta comúnmente utilizada comienza con 75-150 UI de FSH diarias y se incrementa preferiblemente en 37,5 o 75 UI a intervalos de 7 días o, preferiblemente, 14 días, si fuera necesario para obtener una respuesta adecuada, pero no excesiva. El tratamiento debe adaptarse a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y/o la secreción de estrógenos. La dosis máxima diaria no suele ser superior a 225 UI de FSH. Si una paciente no responde adecuadamente después de 4 semanas de tratamiento, ese ciclo debe interrumpirse y la paciente se debe someter a evaluaciones adicionales antes de que pueda reiniciar el tratamiento con una dosis inicial más alta que la del ciclo cancelado.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de coriogonadotropina alfa humana recombinante (hCG-r), ó 5.000 UI, hasta 10.000 UI, de hCG, 24 -48 horas después de la última inyección de folitropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente. Alternativamente, puede practicarse inseminación intrauterina (IIU).
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG (ver la sección 4.4). El tratamiento se debe reiniciar en el ciclo siguiente con una dosis más baja que la del ciclo previo.
Mujeres sometidas a estimulación ovárica_para el desarrollo _folicular múltiple _previo a la fertilización in vitro u otras técnicas de reproducción asistida
Una pauta frecuente de tratamiento para inducir superovulación consiste en la administración de 150225 UI de folitropina alfa por día, comenzando el día 2 ó 3 del ciclo. El tratamiento debe continuar hasta que se alcance un desarrollo folicular adecuado (según los niveles séricos de estrógenos y/o la ecografía); las dosis deben ajustarse en función de la respuesta de la paciente, sin que se rebasen habitualmente las 450 UI diarias. En general, se alcanza un desarrollo folicular adecuado como media antes del décimo día de tratamiento (entre 5 y 20 días).
Al cabo de 24 -48 horas de la última inyección de folitropina alfa se debe administrar una única inyección de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI de hCG, para inducir la maduración folicular final.
En la actualidad, se realiza frecuentemente un bloqueo hipofisario con un agonista o antagonista de la hormona liberadora de gonadotropinas (GnRH), para suprimir el pico endógeno de LH y controlar su secreción. En un protocolo habitual, la administración de folitropina alfa se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, tras 2 semanas de tratamiento con el agonista, se administran 150 -225 UI de folitropina alfa durante los primeros 7 días y, a continuación, se ajusta la dosis según la respuesta ovárica.
La experiencia global con técnicas de FIV indica que, en general, la tasa de éxito del tratamiento permanece estable durante los primeros cuatro intentos, disminuyendo posteriormente de forma gradual.
Mujeres con anovulación debida a un déficit severo de LH y FSH
En mujeres con déficit de LH y FSH (hipogonadismo hipogonadotropo), el objetivo del tratamiento con Bemfola asociado a lutropina alfa es desarrollar un único folículo de Graaf maduro, a partir del cual se liberará el ovocito tras la administración de gonadotropina coriónica humana (hCG). La folitropina alfa se debe administrar como un ciclo de inyecciones diarias, conjuntamente con lutropina alfa. . Puesto que estas pacientes son amenorreicas y tienen una escasa secreción endógena de estrógenos, el tratamiento puede comenzar en cualquier momento.
Una pauta recomendada comienza con 75 UI de lutropina alfa por día junto con 75 - 150 UI de FSH.
El tratamiento se debe adaptar a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y la respuesta estrogénica.
Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 -75 UI. Puede ser aceptable prolongar la duración de la estimulación en un ciclo determinado hasta 5 semanas.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI, de hCG, 24 - 48 horas después de la última inyección de folitropina alfa y lutropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente.
De forma alternativa, se puede realizar IIU.
Se puede considerar la necesidad de apoyo de la fase lútea, ya que la falta de sustancias con actividad luteotropa (LH/hCG) después de la ovulación puede dar lugar a un fracaso prematuro del cuerpo lúteo.
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG. El tratamiento se debe reiniciar en el ciclo siguiente con una dosis de FSH más baja que la del ciclo previo.
Varones con hipogonadismo hipogonadotropo
Bemfola se debe administrar a dosis de 150 UI tres veces por semana, de forma concomitante con hCG, durante un mínimo de 4 meses. Si después de este periodo el paciente no ha respondido, se puede continuar el tratamiento combinado; la experiencia clínica actual indica que se puede requerir un tratamiento de al menos 18 meses para lograr la espermatogénesis.
Poblaciones especiales
Población de edad avanzada
No existe una recomendación de uso específica para folitropina alfa en la población de edad avanzada. No se ha establecido la seguridad y eficacia de la folitropina alfa en los pacientes de edad avanzada.
Insuficiencia renal o hepática
No se ha establecido la seguridad la eficacia y las propiedades farmacocinéticas de la folitropina alfa en los pacientes con insuficiencia renal o hepática.
Población pediátrica
La folitropina alfa no se debe utilizar en la población pediátrica.
Forma de administración
Bemfola está indicado para la administración por vía subcutánea. La primera inyección de Bemfola se debe realizar bajo supervisión médica directa. La autoadministración de Bemfola sólo debe ser realizada por pacientes que estén bien motivados, adecuadamente instruidos y que tengan acceso a los consejos de un profesional.
Dado que la pluma precargada de Bemfola con cartucho de una sola dosis está destinada a una sola inyección, se deben proporcionar instrucciones claras a los pacientes, a fin de evitar el uso inadecuado de la presentación unidosis.
Para consultar las instrucciones sobre la administración con la pluma precargada, ver sección 6.6 y el prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo folitropina alfa, a la FSH o a alguno de los excipientes incluidos en la sección 6.1;
• Tumores del hipotálamo o de la hipófisis;
• Aumento del tamaño de los ovarios o quistes ováricos no causados por el síndrome del ovario poliquístico;
• Hemorragias ginecológicas de etiología desconocida;
• Carcinoma ovárico, uterino o mamario.
La folitropina alfa no se debe utilizar cuando no se puede obtener una respuesta eficaz, en casos tales como:
• Fallo ovárico primario;
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Tumores fibroides del útero incompatibles con el embarazo.
• Fallo testicular primario.
4.4 Advertencias y precauciones especiales de empleo
La folitropina alfa es una sustancia gonadotrópica potente capaz de causar reacciones adversas de leves a graves, y sólo se debe utilizar por médicos que estén muy familiarizados con los problemas de la infertilidad y su tratamiento.
El tratamiento con gonadotropinas requiere una cierta dedicación de tiempo por parte de los médicos y profesionales sanitarios, además de disponer de las instalaciones de monitorización apropiadas, En mujeres, el uso seguro y eficaz de la folitropina alfa requiere monitorizar la respuesta ovárica mediante ecografías, solas o preferiblemente combinadas con la determinación de los niveles séricos de estradiol, de manera regular. Puede existir un cierto grado de variabilidad en la respuesta a la administración de FSH entre unas pacientes y otras, con una respuesta escasa a la FSH en algunas pacientes y una respuesta exagerada en otras. Tanto en varones como en mujeres, se debe utilizar la mínima dosis efectiva para lograr el objetivo del tratamiento.
Porfiria
Los pacientes con porfiria o con antecedentes familiares de porfiria se deben controlar estrechamente durante el tratamiento con folitropina alfa. El deterioro de dicha enfermedad o su aparición por primera vez puede requerir la interrupción del tratamiento.
Tratamiento en mujeres
Antes de iniciar el tratamiento, se debe valorar adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, se debe descartar la presencia de hipotiroidismo, insuficiencia suprarrenal e hiperprolactinemia, instaurando el tratamiento específico apropiado.
Las pacientes sometidas a estimulación del desarrollo folicular, ya sea como tratamiento de la infertilidad por anovulación o bien para practicar TRA, pueden presentar aumento del tamaño de los ovarios o hiperestimulación. La incidencia de estos eventos puede minimizarse aplicando las dosis y pautas de administración de folitropina alfa recomendadas y monitorizando cuidadosamente el tratamiento. Para la interpretación correcta de los índices de desarrollo y maduración folicular, el médico debe tener experiencia en la interpretación de las pruebas correspondientes.
En los ensayos clínicos se ha demostrado un aumento de la sensibilidad ovárica a la folitropina alfa cuando se administra con lutropina alfa. Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 - 75 UI.
No se ha efectuado una comparación directa de la folitropina alfa/LH frente a la gonadotropina menopáusica humana (hMG). La comparación con datos históricos sugiere que la tasa de ovulación obtenida con folitropina alfa/LH es similar a la que se obtiene con hMG.
Síndrome de hiperestimulación ovárica (SHO)
Un cierto grado de incremento del tamaño del ovario es un efecto esperado de la estimulación ovárica controlada. Se observa con mayor frecuencia en mujeres con síndrome del ovario poliquístico y, por lo general, remite sin tratamiento.
A diferencia del aumento de tamaño ovárico no complicado, el SHO es una afección que puede manifestarse con grados crecientes de gravedad. Incluye un aumento marcado del tamaño de los ovarios, niveles séricos elevados de esteroides sexuales y un aumento de la permeabilidad vascular que puede dar lugar a una acumulación de líquidos en la cavidad peritoneal, pleural y, raramente, pericárdica.
En los casos de SHO grave puede observarse la siguiente sintomatología: dolor abdominal, distensión abdominal, aumento importante del tamaño de los ovarios, aumento de peso, disnea, oliguria y síntomas gastrointestinales incluyendo náuseas, vómitos y diarrea. La evaluación clínica puede revelar hipovolemia, hemoconcentración, desequilibrio electrolítico, ascitis, hemoperitoneo, derrames pleurales, hidrotórax o distrés respiratorio agudo. Muy raramente, el SHO grave puede complicarse con torsión del ovario o episodios tromboembólicos como embolia pulmonar, accidente cerebrovascular isquémico o infarto de miocardio.
Algunos factores de riesgo independientes para presentar el síndrome de hiperestimulación ovárica son el síndrome del ovario poliquístico, las concentraciones absolutas altas o en rápido aumento de estradiol en el suero (por ejemplo, > 900 pg/ml o > 3.300 pmol/l en la anovulación; > 3.000 pg/ml o > 11.000 pmol/l en TRA) y una gran cantidad de folículos ováricos en desarrollo (por ejemplo,
> 3 folículos de > 14 mm de diámetro en la anovulación; > 20 folículos de > 12 mm de diámetro en las TRA).
El cumplimiento de la dosis recomendada de folitropina alfa y la pauta de administración pueden minimizar el riesgo de hiperestimulación ovárica (ver secciones 4.2 y 4.8). Para identificar tempranamente los factores de riesgo, se recomienda la vigilancia de los ciclos de estimulación mediante ecografías y determinaciones de estradiol.
Hay evidencias que sugieren que la hCG desempeña una función fundamental en el desencadenamiento del SHO y que el síndrome puede ser más grave y puede tener una duración más prolongada si se produce un embarazo. Por tanto, si se producen signos de hiperestimulación ovárica, por ejemplo, una concentración sérica de estradiol > 5.500 pg/ml o > 20.200 pmol/ml y/o
> 40 folículos en total, se recomienda no administrar hCG y se debe advertir a la paciente que no realice el coito o que utilice métodos anticonceptivos de barrera durante al menos cuatro días. El SHO puede progresar rápidamente (en menos de 24 horas) o en varios días hasta convertirse en un cuadro clínico grave. La mayoría de las veces se produce después de que el tratamiento hormonal se ha suspendido y alcanza su máxima intensidad aproximadamente de siete a diez días después del tratamiento. Por lo tanto, se debe seguir a las pacientes durante al menos dos semanas tras la administración de hCG.
En las técnicas de reproducción asistida, la aspiración de todos los folículos, antes de la ovulación, puede reducir la incidencia de hiperestimulación.
El síndrome de hiperestimulación ovárica leve o moderado se resuelve generalmente de manera espontánea. Si se produce un SHO grave, se recomienda interrumpir el tratamiento con gonadotropinas si es que todavía continúa, y hospitalizar a la paciente e iniciar el tratamiento adecuado.
Embarazo múltiple
En pacientes sometidas a la inducción de la ovulación, la incidencia de embarazo múltiple es más elevada que en el caso de la concepción natural. La mayoría de embarazos múltiples son gemelares. El embarazo múltiple, especialmente si el número de fetos es alto, conlleva un mayor riesgo de complicaciones maternas y perinatales.
Para minimizar el riesgo de embarazo múltiple, se recomienda una monitorización cuidadosa de la respuesta ovárica.
El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona principalmente con el número de embriones transferidos, con la calidad de los mismos y con la edad de la paciente.
Antes de empezar el tratamiento se debe informar a las pacientes del riesgo potencial de partos múltiples.
Pérdida del embarazo
La incidencia de pérdida del embarazo debido a aborto espontáneo o provocado es mayor en pacientes sometidas a estimulación del desarrollo folicular para inducir la ovulación o practicar TRA que la observada tras la concepción natural.
Embarazo ectópico
Las mujeres con historia de enfermedad tubárica presentan riesgo de embarazo ectópico, tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad. Se ha notificado que la prevalencia del embarazo ectópico tras practicar TRA es mayor que en la población general.
Neoplasias del aparato reproductor
Se han descrito neoplasias, tanto benignas como malignas, del ovario y de otros órganos del aparato reproductor, en mujeres sometidas a múltiples pautas terapéuticas para el tratamiento de la infertilidad. Todavía no está establecido si el tratamiento con gonadotropinas aumenta o no el riesgo de estos tumores en mujeres estériles.
Malformaciones congénitas
La prevalencia de malformaciones congénitas tras TRA puede ser ligeramente superior a la observada tras la concepción natural. Esto se considera debido a diferencias en las características de los progenitores (por ejemplo, la edad de la madre, las características del semen) y a los embarazos múltiples.
Eventos tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso o en mujeres con factores de riesgo generalmente reconocidos para presentar problemas tromboembólicos, tales como antecedentes familiares o personales, el tratamiento con gonadotropinas puede aumentar más el riesgo de empeoramiento o aparición de dichos fenómenos. En estas mujeres, los beneficios de la administración de gonadotropinas se deben sopesar frente a los riesgos. No obstante, hay que tener en cuenta que el embarazo por sí mismo, así como el síndrome de hiperestimulación ovárica, también comportan un aumento del riesgo de acontecimientos tromboembólicos.
Tratamiento en varones
Unos niveles elevados de FSH endógena indican fallo testicular primario. Dichos pacientes no responden al tratamiento con folitropina alfa/hCG. La folitropina alfa no se debe usar cuando no se pueda obtener una respuesta eficaz.
Se recomienda practicar espermiogramas de 4 a 6 meses después de iniciar el tratamiento, como parte de la evaluación de la respuesta.
Contenido de sodio
Bemfola contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente «exento de sodio»
4.5 Interacción con otros medicamentos y otras formas de interacción
La utilización concomitante de folitropina alfa con otros medicamentos utilizados para estimular la ovulación (por ejemplo, hCG, citrato de clomifeno) puede potenciar la respuesta folicular, mientras que la utilización concomitante de un agonista o antagonista de la GnRH para provocar una desensibilización hipofisaria puede incrementar la dosis de folitropina alfa necesaria para lograr una respuesta ovárica adecuada. No se han descrito otras interacciones con medicamentos clínicamente significativas durante el tratamiento con folitropina alfa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para utilizar Bemfola durante el embarazo. Existen datos sobre un número limitado de embarazos expuestos (menos de 300 embarazos) que indican que folitropina alfa no produce malformaciones ni toxicidad fetal/neonatal.
No se han observado efectos teratogénicos en los estudios en animales (ver sección 5.3). En caso de exposición durante el embarazo, los datos clínicos no son suficientes para descartar un efecto teratógeno de la folitropina alfa.
Lactancia
Bemfola no está indicado durante la lactancia.
Fertilidad
Bemfola está indicado para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se espera que la influencia de Bemfola sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas notificadas con mayor frecuencia son cefalea, quistes ováricos y reacciones locales en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón y/o irritación en el lugar de la inyección).
Se ha notificado con frecuencia síndrome de hiperestimulación ovárica leve o moderado y se debe considerar como un riesgo intrínseco del proceso de estimulación. El síndrome de hiperestimulación ovárica grave es poco frecuente (ver sección 4.4).
En casos muy raros se puede producir tromboembolismo, asociado generalmente a un síndrome de hiperestimulación ovárica grave (ver sección 4.4).
Las siguientes definiciones se aplican a la terminología de frecuencia usada de aquí en adelante:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Tratamiento en mujeres
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos del sistema nervioso
Muy frecuentes: Cefalea Trastornos vasculares
Muy raras: Tromboembolismo, generalmente asociado a síndrome de hiperestimulación
ovárica grave (ver sección 4.4)
Trastornos respiratorios, torácicos y mediastínicos
Muy raras: Exacerbación o empeoramiento del asma
Trastornos gastrointestinales
Frecuentes: Dolor abdominal, distensión abdominal, molestias abdominales, náuseas, vómitos,
diarrea
Síndrome de hiperestimulación ovárica leve o moderado (incluida la sintomatología relacionada)
Muy frecuentes: Quistes ováricos Frecuentes:
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (incluida la sintomatología relacionada) (ver sección 4.4)
Raras:
Complicación del síndrome de hiperestimulación ovárica grave
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Tratamiento en varones
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos respiratorios, torácicos y mediastínicos Muy raras: Exacerbación y/o empeoramiento del asma
Trastornos de la _piel y del tejido subcutáneo Frecuentes: Acné
Trastornos del aparato reproductor y de la mama
Frecuentes: Ginecomastia, varicocele
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Exploraciones complementarias
Frecuentes: Aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional
4.9 Sobredosis
Los efectos de una sobredosis de folitropina alfa se desconocen; sin embargo, existe la posibilidad de que se produzca un síndrome de hiperestimulación ovárica (ver sección 4.4).
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA05.
Bemfola es un medicamento biosimilar, es decir un medicamento que se ha demostrado que es similar en lo que respecta a la calidad, seguridad y eficacia al medicamento de referencia GONAL-f. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Efectos farmacodinámicos
En mujeres, el efecto más importante que se produce tras la administración parenteral de FSH es el desarrollo de folículos de Graaf maduros. En mujeres con anovulación, el objetivo del tratamiento con folitropina alfa es desarrollar un único folículo de Graaf maduro a partir del cual se liberará el óvulo después de la administración de hCG.
Eficacia clínica y seguridad en mujeres
En los ensayos clínicos, las pacientes con déficit severo de FSH y LH se definieron por un nivel sérico de LH endógena de < 1,2 UI/l, medido en un laboratorio central. Sin embargo, se debe tener en cuenta que existen variaciones entre las determinaciones de LH realizadas en diferentes laboratorios.
En estudios clínicos comparativos de hFSH-r (folitropina alfa) y FSH urinaria en las técnicas de reproducción asistida (ver tabla a continuación) y en inducción a la ovulación, la folitropina alfa se mostró más potente que la FSH urinaria en términos de una dosis total menor necesaria y un periodo de tratamiento más corto para desencadenar la maduración folicular.
En las técnicas de reproducción asistida, la folitropina alfa a una dosis total menor y durante un periodo de tratamiento más corto que la FSH urinaria, permitió la recuperación de un número mayor de ovocitos, en comparación con la FSH urinaria.
Tabla: Resultados del estudio GF 8407 (estudio paralelo aleatorizado y comparativo de la eficacia y
|
seguridad de la folitropina alfa con la FSH urinaria en técnicas c |
e reproducción asistida). | |
|
folitropina alfa (n = 130) |
FSH urinaria (n = 116) | |
|
Número de ovocitos recuperados |
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Días de estimulación con FSH requeridos |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Dosis total de FSH requerida (número de ampollas de FSH 75 UI) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Necesidad de aumentar la dosis (%) |
56,2 |
85,3 |
Las diferencias entre los dos grupos fueron estadísticamente significativas (p < 0,05) para todos los criterios incluidos.
Eficacia clínica y seguridad en varones
En varones con déficit de FSH, la folitropina alfa administrada de forma concomitante con hCG durante al menos 4 meses induce la espermatogénesis.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la folitropina alfa se distribuye en el espacio extracelular. La semivida de distribución es de unas 2 horas y la semivida de eliminación, de alrededor de 1 día. En estado estacionario, el volumen de distribución es de 10 l y el aclaramiento total, de 0,6 l/h. La octava parte de la dosis de folitropina alfa administrada se excreta en la orina.
Tras la administración subcutánea, la biodisponibilidad absoluta es de alrededor del 70 %. Tras la administración de dosis repetidas de folitropina alfa, se produce una acumulación de 3 veces, alcanzando un estado estacionario en un periodo de 3-4 días. En mujeres con supresión de la secreción endógena de gonadotropinas, la folitropina alfa estimula adecuadamente el desarrollo folicular y la esteroidogénesis, a pesar de unos niveles indetectables de LH.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad de dosis única y a dosis repetidas y genotoxicidad, adicionales a los ya descritos en otras secciones de esta ficha técnica.
Se han notificado trastornos de la fertilidad en ratas expuestas a dosis farmacológicas de folitropina alfa (> 40 UI/kg/día) durante largos períodos de tiempo, mostrando una disminución de la fecundidad.
La administración de dosis altas (> 5 UI/kg/día) de folitropina alfa produjo un descenso en el número de fetos viables, aunque no tuvo efectos teratógenos, así como distocia similar a la observada con la hormona Gonadotropina Menopáusica (hMG) urinaria. Sin embargo, puesto que Bemfola no está indicado en el embarazo, estos datos tienen escasa relevancia clínica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poloxámero 188
Sacarosa
Metionina
Hidrogenofosfato de disodio dihidrato Dihidrogenofosfato de sodio dihidrato Ácido fosfórico
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Antes de la apertura y durante su periodo de validez, el medicamento se puede extraer de la nevera, sin refrigerar de nuevo, hasta un máximo de 3 meses a temperatura igual o inferior a 25 °C. El producto se debe desechar si después de 3 meses no se ha utilizado.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de 1,5 ml (vidrio de tipo I) que contiene 0,375 ml de solución inyectable con un pistón (goma de halobutilo) y una cápsula de aluminio superpuesta con incrustación de goma.
Envases con 1, 5 o 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases. Para la administración con la pluma se debe utilizar una aguja y una gasa empapada en alcohol.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver el prospecto.
La solución no se debe administrar si contiene partículas o no es transparente.
Bemfola 225 UI/0,375 ml (16,5 microgramos/0,375 ml) no está diseñado para permitir la extracción del cartucho.
Las agujas utilizadas se deben desechar inmediatamente tras la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/003
EU/1/13/909/010
EU/1/13/909/011
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/03/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bemfola 300 UI/0,50 ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de la solución contiene 600 iu (equivalente a 44 microgramas) de folitropín alfa*.Cada pluma precargada administra 300 UI (equivalente a 22 microgramos) en 0,5 ml.
*hormona foliculoestimulante humana recombinante (hFSH-r) producida en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada (inyectable). Solución límpida, incolora.
El pH de la solución es de 6,7 a 7,3.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas
• Anovulación (incluyendo el síndrome del ovario poliquístico) en mujeres que no han respondido al tratamiento con citrato de clomifeno.
• Estimulación del desarrollo folicular múltiple en pacientes sometidas a superovulación para realizar técnicas de reproducción asistida (TRA), tales como la fertilización in vitro (FIV), transferencia intratubárica de gametos y transferencia intratubárica de cigotos.
• La folitropina alfa, asociada a un preparado de hormona luteinizante (LH), se recomienda para la estimulación del desarrollo folicular en mujeres con deficiencia severa de LH y FSH. En los ensayos clínicos, estas pacientes se definieron por un nivel sérico de LH endógena de
< 1,2 UI/l.
En varones adultos
• La folitropina alfa está indicada para estimular la espermatogénesis en varones con
hipogonadismo hipogonadotropo congénito o adquirido, administrado de forma concomitante con Gonadotropina Coriónica humana (hCG).
4.2 Posología y forma de administración
El tratamiento con Bemfola debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de los trastornos de la fertilidad.
Debe proporcionarse a los pacientes el número adecuado de plumas para su ciclo de tratamiento e instruirles en el uso de las técnicas de inyección correctas.
Posología
Las recomendaciones posológicas para la folitropina alfa son las mismas que se utilizan para la FSH urinaria. La evaluación clínica de la folitropina alfa indica que sus dosis diarias, pautas de administración y procedimientos para monitorizar el tratamiento no deben ser distintos de los que se utilizan actualmente para los medicamentos que contienen FSH urinaria. Se aconseja adherirse a las dosis iniciales recomendadas, que se indican a continuación.
Estudios clínicos comparativos han demostrado que de media los pacientes requieren una dosis acumulativa menor y un periodo de tratamiento más corto con la folitropina alfa que con el tratamiento con FSH urinaria. Por tanto, se considera apropiado dar una dosis total menor de folitropina alfa que la generalmente utilizada para la FSH urinaria, no sólo para optimizar el desarrollo folicular sino también para minimizar el riesgo de hiperestimulación ovárica no deseada (ver sección 5.1).
Mujeres con anovulación (incluyendo el síndrome de ovario _poliquístico)
Bemfola puede administrarse mediante un ciclo de inyecciones diarias. En las mujeres con menstruación el tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual.
Una pauta comúnmente utilizada comienza con 75-150 UI de FSH diarias y se incrementa preferiblemente en 37,5 o 75 UI a intervalos de 7 días o, preferiblemente, 14 días, si fuera necesario para obtener una respuesta adecuada, pero no excesiva. El tratamiento debe adaptarse a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y/o la secreción de estrógenos. La dosis máxima diaria no suele ser superior a 225 UI de FSH. Si una paciente no responde adecuadamente después de 4 semanas de tratamiento, ese ciclo debe interrumpirse y la paciente se debe someter a evaluaciones adicionales antes de que pueda reiniciar el tratamiento con una dosis inicial más alta que la del ciclo cancelado.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de coriogonadotropina alfa humana recombinante (hCG-r), ó 5.000 UI, hasta 10.000 UI, de hCG, 24 -48 horas después de la última inyección de folitropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente. Alternativamente, puede practicarse inseminación intrauterina (IIU).
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG (ver la sección 4.4). El tratamiento se debe reiniciar en el ciclo siguiente con una dosis más baja que la del ciclo previo.
Mujeres sometidas a estimulación ovárica_para el desarrollo _folicular múltiple _previo a la fertilización in vitro u otras técnicas de reproducción asistida
Una pauta frecuente de tratamiento para inducir superovulación consiste en la administración de 150225 UI de folitropina alfa por día, comenzando el día 2 ó 3 del ciclo. El tratamiento debe continuar hasta que se alcance un desarrollo folicular adecuado (según los niveles séricos de estrógenos y/o la ecografía); las dosis deben ajustarse en función de la respuesta de la paciente, sin que se rebasen habitualmente las 450 UI diarias. En general, se alcanza un desarrollo folicular adecuado como media antes del décimo día de tratamiento (entre 5 y 20 días).
Al cabo de 24 -48 horas de la última inyección de folitropina alfa se debe administrar una única inyección de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI de hCG, para inducir la maduración folicular final.
En la actualidad, se realiza frecuentemente un bloqueo hipofisario con un agonista o antagonista de la hormona liberadora de gonadotropinas (GnRH), para suprimir el pico endógeno de LH y controlar su secreción. En un protocolo habitual, la administración de folitropina alfa se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, tras 2 semanas de tratamiento con el agonista, se administran 150 -225 UI de folitropina alfa durante los primeros 7 días y, a continuación, se ajusta la dosis según la respuesta ovárica.
La experiencia global con técnicas de FIV indica que, en general, la tasa de éxito del tratamiento permanece estable durante los primeros cuatro intentos, disminuyendo posteriormente de forma gradual.
Mujeres con anovulación debida a un déficit severo de LH y FSH
En mujeres con déficit de LH y FSH (hipogonadismo hipogonadotropo), el objetivo del tratamiento con Bemfola asociado a lutropina alfa es desarrollar un único folículo de Graaf maduro, a partir del cual se liberará el ovocito tras la administración de gonadotropina coriónica humana (hCG). La folitropina alfa se debe administrar como un ciclo de inyecciones diarias, conjuntamente con lutropina alfa. . Puesto que estas pacientes son amenorreicas y tienen una escasa secreción endógena de estrógenos, el tratamiento puede comenzar en cualquier momento.
Una pauta recomendada comienza con 75 UI de lutropina alfa por día junto con 75 - 150 UI de FSH.
El tratamiento se debe adaptar a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y la respuesta estrogénica.
Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 -75 UI. Puede ser aceptable prolongar la duración de la estimulación en un ciclo determinado hasta 5 semanas.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI, de hCG, 24 - 48 horas después de la última inyección de folitropina alfa y lutropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente.
De forma alternativa, se puede realizar IIU.
Se puede considerar la necesidad de apoyo de la fase lútea, ya que la falta de sustancias con actividad luteotropa (LH/hCG) después de la ovulación puede dar lugar a un fracaso prematuro del cuerpo lúteo.
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG. El tratamiento se debe reiniciar en el ciclo siguiente con una dosis de FSH más baja que la del ciclo previo.
Varones con hipogonadismo hipogonadotropo
Bemfola se debe administrar a dosis de 150 UI tres veces por semana, de forma concomitante con hCG, durante un mínimo de 4 meses. Si después de este periodo el paciente no ha respondido, se puede continuar el tratamiento combinado; la experiencia clínica actual indica que se puede requerir un tratamiento de al menos 18 meses para lograr la espermatogénesis.
Poblaciones especiales
Población de edad avanzada
No existe una recomendación de uso específica para folitropina alfa en la población de edad avanzada. No se ha establecido la seguridad y eficacia de la folitropina alfa en los pacientes de edad avanzada.
Insuficiencia renal o hepática
No se ha establecido la seguridad la eficacia y las propiedades farmacocinéticas de la folitropina alfa en los pacientes con insuficiencia renal o hepática.
Población pediátrica
La folitropina alfa no se debe utilizar en la población pediátrica.
Forma de administración
Bemfola está indicado para la administración por vía subcutánea. La primera inyección de Bemfola se debe realizar bajo supervisión médica directa. La autoadministración de Bemfola sólo debe ser realizada por pacientes que estén bien motivados, adecuadamente instruidos y que tengan acceso a los consejos de un profesional.
Dado que la pluma precargada de Bemfola con cartucho de una sola dosis está destinada a una sola inyección, se deben proporcionar instrucciones claras a los pacientes, a fin de evitar el uso inadecuado de la presentación unidosis.
Para consultar las instrucciones sobre la administración con la pluma precargada, ver sección 6.6 y el prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo folitropina alfa, a la FSH o a alguno de los excipientes incluidos en la sección 6.1;
• Tumores del hipotálamo o de la hipófisis;
• Aumento del tamaño de los ovarios o quistes ováricos no causados por el síndrome del ovario poliquístico;
• Hemorragias ginecológicas de etiología desconocida;
• Carcinoma ovárico, uterino o mamario.
La folitropina alfa no se debe utilizar cuando no se puede obtener una respuesta eficaz, en casos tales como:
• Fallo ovárico primario;
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Tumores fibroides del útero incompatibles con el embarazo.
• Fallo testicular primario.
4.4 Advertencias y precauciones especiales de empleo
La folitropina alfa es una sustancia gonadotrópica potente capaz de causar reacciones adversas de leves a graves, y sólo se debe utilizar por médicos que estén muy familiarizados con los problemas de la infertilidad y su tratamiento.
El tratamiento con gonadotropinas requiere una cierta dedicación de tiempo por parte de los médicos y profesionales sanitarios, además de disponer de las instalaciones de monitorización apropiadas, En mujeres, el uso seguro y eficaz de la folitropina alfa requiere monitorizar la respuesta ovárica mediante ecografías, solas o preferiblemente combinadas con la determinación de los niveles séricos de estradiol, de manera regular. Puede existir un cierto grado de variabilidad en la respuesta a la administración de FSH entre unas pacientes y otras, con una respuesta escasa a la FSH en algunas pacientes y una respuesta exagerada en otras. Tanto en varones como en mujeres, se debe utilizar la mínima dosis efectiva para lograr el objetivo del tratamiento.
Porfiria
Los pacientes con porfiria o con antecedentes familiares de porfiria se deben controlar estrechamente durante el tratamiento con folitropina alfa. El deterioro de dicha enfermedad o su aparición por primera vez puede requerir la interrupción del tratamiento.
Tratamiento en mujeres
Antes de iniciar el tratamiento, se debe valorar adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, se debe descartar la presencia de hipotiroidismo, insuficiencia suprarrenal e hiperprolactinemia, instaurando el tratamiento específico apropiado.
Las pacientes sometidas a estimulación del desarrollo folicular, ya sea como tratamiento de la infertilidad por anovulación o bien para practicar TRA, pueden presentar aumento del tamaño de los ovarios o hiperestimulación. La incidencia de estos eventos puede minimizarse aplicando las dosis y pautas de administración de folitropina alfa recomendadas y monitorizando cuidadosamente el tratamiento. Para la interpretación correcta de los índices de desarrollo y maduración folicular, el médico debe tener experiencia en la interpretación de las pruebas correspondientes.
En los ensayos clínicos se ha demostrado un aumento de la sensibilidad ovárica a la folitropina alfa cuando se administra con lutropina alfa. Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 - 75 UI.
No se ha efectuado una comparación directa de la folitropina alfa/LH frente a la gonadotropina menopáusica humana (hMG). La comparación con datos históricos sugiere que la tasa de ovulación obtenida con folitropina alfa/LH es similar a la que se obtiene con hMG.
Síndrome de hiperestimulación ovárica (SHO)
Un cierto grado de incremento del tamaño del ovario es un efecto esperado de la estimulación ovárica controlada. Se observa con mayor frecuencia en mujeres con síndrome del ovario poliquístico y, por lo general, remite sin tratamiento.
A diferencia del aumento de tamaño ovárico no complicado, el SHO es una afección que puede manifestarse con grados crecientes de gravedad. Incluye un aumento marcado del tamaño de los ovarios, niveles séricos elevados de esteroides sexuales y un aumento de la permeabilidad vascular que puede dar lugar a una acumulación de líquidos en la cavidad peritoneal, pleural y, raramente, pericárdica.
En los casos de SHO grave puede observarse la siguiente sintomatología: dolor abdominal, distensión abdominal, aumento importante del tamaño de los ovarios, aumento de peso, disnea, oliguria y síntomas gastrointestinales incluyendo náuseas, vómitos y diarrea. La evaluación clínica puede revelar hipovolemia, hemoconcentración, desequilibrio electrolítico, ascitis, hemoperitoneo, derrames pleurales, hidrotórax o distrés respiratorio agudo. Muy raramente, el SHO grave puede complicarse con torsión del ovario o episodios tromboembólicos como embolia pulmonar, accidente cerebrovascular isquémico o infarto de miocardio.
Algunos factores de riesgo independientes para presentar el síndrome de hiperestimulación ovárica son el síndrome del ovario poliquístico, las concentraciones absolutas altas o en rápido aumento de estradiol en el suero (por ejemplo, > 900 pg/ml o > 3.300 pmol/l en la anovulación; > 3.000 pg/ml o
> 11.000 pmol/l en TRA) y una gran cantidad de folículos ováricos en desarrollo (por ejemplo,
> 3 folículos de > 14 mm de diámetro en la anovulación; > 20 folículos de > 12 mm de diámetro en las TRA).
El cumplimiento de la dosis recomendada de folitropina alfa y la pauta de administración pueden minimizar el riesgo de hiperestimulación ovárica (ver secciones 4.2 y 4.8). Para identificar tempranamente los factores de riesgo, se recomienda la vigilancia de los ciclos de estimulación mediante ecografías y determinaciones de estradiol.
Hay evidencias que sugieren que la hCG desempeña una función fundamental en el desencadenamiento del SHO y que el síndrome puede ser más grave y puede tener una duración más prolongada si se produce un embarazo. Por tanto, si se producen signos de hiperestimulación ovárica, por ejemplo, una concentración sérica de estradiol > 5.500 pg/ml o > 20.200 pmol/ml y/o > 40 folículos en total, se recomienda no administrar hCG y se debe advertir a la paciente que no realice el coito o que utilice métodos anticonceptivos de barrera durante al menos cuatro días. El SHO puede progresar rápidamente (en menos de 24 horas) o en varios días hasta convertirse en un cuadro clínico grave. La mayoría de las veces se produce después de que el tratamiento hormonal se ha suspendido y alcanza su máxima intensidad aproximadamente de siete a diez días después del tratamiento. Por lo tanto, se debe seguir a las pacientes durante al menos dos semanas tras la administración de hCG.
En las técnicas de reproducción asistida, la aspiración de todos los folículos, antes de la ovulación, puede reducir la incidencia de hiperestimulación.
El síndrome de hiperestimulación ovárica leve o moderado se resuelve generalmente de manera espontánea. Si se produce un SHO grave, se recomienda interrumpir el tratamiento con gonadotropinas si es que todavía continúa, y hospitalizar a la paciente e iniciar el tratamiento adecuado.
Embarazo múltiple
En pacientes sometidas a la inducción de la ovulación, la incidencia de embarazo múltiple es más elevada que en el caso de la concepción natural. La mayoría de embarazos múltiples son gemelares. El embarazo múltiple, especialmente si el número de fetos es alto, conlleva un mayor riesgo de complicaciones maternas y perinatales.
Para minimizar el riesgo de embarazo múltiple, se recomienda una monitorización cuidadosa de la respuesta ovárica.
El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona principalmente con el número de embriones transferidos, con la calidad de los mismos y con la edad de la paciente.
Antes de empezar el tratamiento se debe informar a las pacientes del riesgo potencial de partos múltiples.
Pérdida del embarazo
La incidencia de pérdida del embarazo debido a aborto espontáneo o provocado es mayor en pacientes sometidas a estimulación del desarrollo folicular para inducir la ovulación o practicar TRA que la observada tras la concepción natural.
Embarazo ectópico
Las mujeres con historia de enfermedad tubárica presentan riesgo de embarazo ectópico, tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad. Se ha notificado que la prevalencia del embarazo ectópico tras practicar TRA es mayor que en la población general.
Neoplasias del aparato reproductor
Se han descrito neoplasias, tanto benignas como malignas, del ovario y de otros órganos del aparato reproductor, en mujeres sometidas a múltiples pautas terapéuticas para el tratamiento de la infertilidad. Todavía no está establecido si el tratamiento con gonadotropinas aumenta o no el riesgo de estos tumores en mujeres estériles.
Malformaciones congénitas
La prevalencia de malformaciones congénitas tras TRA puede ser ligeramente superior a la observada tras la concepción natural. Esto se considera debido a diferencias en las características de los progenitores (por ejemplo, la edad de la madre, las características del semen) y a los embarazos múltiples.
Eventos tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso o en mujeres con factores de riesgo generalmente reconocidos para presentar problemas tromboembólicos, tales como antecedentes familiares o personales, el tratamiento con gonadotropinas puede aumentar más el riesgo de empeoramiento o aparición de dichos fenómenos. En estas mujeres, los beneficios de la administración de gonadotropinas se deben sopesar frente a los riesgos. No obstante, hay que tener en cuenta que el embarazo por sí mismo, así como el síndrome de hiperestimulación ovárica, también comportan un aumento del riesgo de acontecimientos tromboembólicos.
Tratamiento en varones
Unos niveles elevados de FSH endógena indican fallo testicular primario. Dichos pacientes no responden al tratamiento con folitropina alfa/hCG. La folitropina alfa no se debe usar cuando no se pueda obtener una respuesta eficaz.
Se recomienda practicar espermiogramas de 4 a 6 meses después de iniciar el tratamiento, como parte de la evaluación de la respuesta.
Contenido de sodio
Bemfola contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente «exento de sodio»
4.5 Interacción con otros medicamentos y otras formas de interacción
La utilización concomitante de folitropina alfa con otros medicamentos utilizados para estimular la ovulación (por ejemplo, hCG, citrato de clomifeno) puede potenciar la respuesta folicular, mientras que la utilización concomitante de un agonista o antagonista de la GnRH para provocar una desensibilización hipofisaria puede incrementar la dosis de folitropina alfa necesaria para lograr una respuesta ovárica adecuada. No se han descrito otras interacciones con medicamentos clínicamente significativas durante el tratamiento con folitropina alfa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para utilizar Bemfola durante el embarazo. Existen datos sobre un número limitado de embarazos expuestos (menos de 300 embarazos) que indican que folitropina alfa no produce malformaciones ni toxicidad fetal/neonatal.
No se han observado efectos teratogénicos en los estudios en animales (ver sección 5.3). En caso de exposición durante el embarazo, los datos clínicos no son suficientes para descartar un efecto teratógeno de la folitropina alfa.
Lactancia
Bemfola no está indicado durante la lactancia.
Fertilidad
Bemfola está indicado para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se espera que la influencia de Bemfola sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas notificadas con mayor frecuencia son cefalea, quistes ováricos y reacciones locales en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón y/o irritación en el lugar de la inyección).
Se ha notificado con frecuencia síndrome de hiperestimulación ovárica leve o moderado y se debe considerar como un riesgo intrínseco del proceso de estimulación. El síndrome de hiperestimulación ovárica grave es poco frecuente (ver sección 4.4).
En casos muy raros se puede producir tromboembolismo, asociado generalmente a un síndrome de hiperestimulación ovárica grave (ver sección 4.4).
Las siguientes definiciones se aplican a la terminología de frecuencia usada de aquí en adelante:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Tratamiento en mujeres
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos del sistema nervioso
Muy frecuentes: Cefalea Trastornos vasculares
Muy raras: Tromboembolismo, generalmente asociado a síndrome de hiperestimulación
ovárica grave (ver sección 4.4)
Trastornos respiratorios, torácicos y mediastínicos
Muy raras: Exacerbación o empeoramiento del asma
Trastornos gastrointestinales
Frecuentes: Dolor abdominal, distensión abdominal, molestias abdominales, náuseas, vómitos,
diarrea
Trastornos del aparato reproductor y de la mama Muy frecuentes: Quistes ováricos
Frecuentes: Síndrome de hiperestimulación ovárica leve o moderado (incluida la
sintomatología relacionada)
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (incluida la sintomatología relacionada) (ver sección 4.4)
Raras: Complicación del síndrome de hiperestimulación ovárica grave
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Tratamiento en varones
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos respiratorios, torácicos y mediastínicos Muy raras: Exacerbación y/o empeoramiento del asma
Trastornos de la _piel y del tejido subcutáneo Frecuentes: Acné
Trastornos del aparato reproductor y de la mama
Frecuentes: Ginecomastia, varicocele
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Exploraciones complementarias
Frecuentes: Aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Los efectos de una sobredosis de folitropina alfa se desconocen; sin embargo, existe la posibilidad de que se produzca un síndrome de hiperestimulación ovárica (ver sección 4.4).
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA05.
Bemfola es un medicamento biosimilar, es decir un medicamento que se ha demostrado que es similar en lo que respecta a la calidad, seguridad y eficacia al medicamento de referencia GONAL-f. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Efectos farmacodinámicos
En mujeres, el efecto más importante que se produce tras la administración parenteral de FSH es el desarrollo de folículos de Graaf maduros. En mujeres con anovulación, el objetivo del tratamiento con folitropina alfa es desarrollar un único folículo de Graaf maduro a partir del cual se liberará el óvulo después de la administración de hCG.
Eficacia clínica y seguridad en mujeres
En los ensayos clínicos, las pacientes con déficit severo de FSH y LH se definieron por un nivel sérico de LH endógena de < 1,2 UI/l, medido en un laboratorio central. Sin embargo, se debe tener en cuenta que existen variaciones entre las determinaciones de LH realizadas en diferentes laboratorios.
En estudios clínicos comparativos de hFSH-r (folitropina alfa) y FSH urinaria en las técnicas de reproducción asistida (ver tabla a continuación) y en inducción a la ovulación, la folitropina alfa se mostró más potente que la FSH urinaria en términos de una dosis total menor necesaria y un periodo de tratamiento más corto para desencadenar la maduración folicular.
En las técnicas de reproducción asistida, la folitropina alfa a una dosis total menor y durante un periodo de tratamiento más corto que la FSH urinaria, permitió la recuperación de un número mayor de ovocitos, en comparación con la FSH urinaria.
Tabla: Resultados del estudio GF 8407 (estudio paralelo aleatorizado y comparativo de la eficacia y
|
seguridad de la folitropina alfa con la FSH urinaria en técnicas c |
e reproducción asistida). | |
|
folitropina alfa (n = 130) |
FSH urinaria (n = 116) | |
|
Número de ovocitos recuperados |
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Días de estimulación con FSH requeridos |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Dosis total de FSH requerida (número de ampollas de FSH 75 UI) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Necesidad de aumentar la dosis (%) |
56,2 |
85,3 |
Las diferencias entre los dos grupos fueron estadísticamente significativas (p < 0,05) para todos los criterios incluidos.
Eficacia clínica y seguridad en varones
En varones con déficit de FSH, la folitropina alfa administrada de forma concomitante con hCG durante al menos 4 meses induce la espermatogénesis.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la folitropina alfa se distribuye en el espacio extracelular. La semivida de distribución es de unas 2 horas y la semivida de eliminación, de alrededor de 1 día. En estado estacionario, el volumen de distribución es de 10 l y el aclaramiento total, de 0,6 l/h. La octava parte de la dosis de folitropina alfa administrada se excreta en la orina.
Tras la administración subcutánea, la biodisponibilidad absoluta es de alrededor del 70 %. Tras la administración de dosis repetidas de folitropina alfa, se produce una acumulación de 3 veces, alcanzando un estado estacionario en un periodo de 3-4 días. En mujeres con supresión de la secreción endógena de gonadotropinas, la folitropina alfa estimula adecuadamente el desarrollo folicular y la esteroidogénesis, a pesar de unos niveles indetectables de LH.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad de dosis única y a dosis repetidas y genotoxicidad, adicionales a los ya descritos en otras secciones de esta ficha técnica.
Se han notificado trastornos de la fertilidad en ratas expuestas a dosis farmacológicas de folitropina alfa (> 40 UI/kg/día) durante largos períodos de tiempo, mostrando una disminución de la fecundidad.
La administración de dosis altas (> 5 UI/kg/día) de folitropina alfa produjo un descenso en el número de fetos viables, aunque no tuvo efectos teratógenos, así como distocia similar a la observada con la hormona Gonadotropina Menopáusica (hMG) urinaria. Sin embargo, puesto que Bemfola no está indicado en el embarazo, estos datos tienen escasa relevancia clínica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poloxámero 188
Sacarosa
Metionina
Hidrogenofosfato de disodio dihidrato Dihidrogenofosfato de sodio dihidrato Ácido fosfórico
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Antes de la apertura y durante su periodo de validez, el medicamento se puede extraer de la nevera, sin refrigerar de nuevo, hasta un máximo de 3 meses a temperatura igual o inferior a 25 °C. El producto se debe desechar si después de 3 meses no se ha utilizado.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de 1,5 ml (vidrio de tipo I) que contiene 0,5 ml de solución inyectable con un pistón (goma de halobutilo) y una cápsula de aluminio superpuesta con incrustación de goma.
Envases con 1, 5 o 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases. Para la administración con la pluma se debe utilizar una aguja y una gasa empapada en alcohol.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver el prospecto.
La solución no se debe administrar si contiene partículas o no es transparente.
Bemfola 300 UI/0,50 ml (22 microgramos/0,5 ml) no está diseñado para permitir la extracción del cartucho.
Las agujas utilizadas se deben desechar inmediatamente tras la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/004
EU/1/13/909/012
EU/1/13/909/013
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/03/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bemfola 450 UI/0,75 ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de la solución contiene 600 UI (equivalente a 44 microgramos) de folitropina alfa*. Cada pluma precargada administra 450 UI (equivalente a 33 microgramos) en 0,75 ml.
*hormona foliculoestimulante humana recombinante (hFSH-r) producida en células de ovario de hámster chino (CHO) mediante tecnología de ADN recombinante.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada (inyectable). Solución límpida, incolora.
El pH de la solución es de 6,7 a 7,3.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas
• Anovulación (incluyendo el síndrome del ovario poliquístico) en mujeres que no han respondido al tratamiento con citrato de clomifeno.
• Estimulación del desarrollo folicular múltiple en pacientes sometidas a superovulación para realizar técnicas de reproducción asistida (TRA), tales como la fertilización in vitro (FIV), transferencia intratubárica de gametos y transferencia intratubárica de cigotos.
• La folitropina alfa, asociada a un preparado de hormona luteinizante (LH), se recomienda para la estimulación del desarrollo folicular en mujeres con deficiencia severa de LH y FSH. En los ensayos clínicos, estas pacientes se definieron por un nivel sérico de LH endógena de
< 1,2 UI/l.
En varones adultos
• La folitropina alfa está indicada para estimular la espermatogénesis en varones con
hipogonadismo hipogonadotropo congénito o adquirido, administrado de forma concomitante con Gonadotropina Coriónica humana (hCG).
4.2 Posología y forma de administración
El tratamiento con Bemfola debe iniciarse bajo la supervisión de un médico con experiencia en el
tratamiento de los trastornos de la fertilidad.
Debe proporcionarse a los pacientes el número adecuado de plumas para su ciclo de tratamiento e instruirles en el uso de las técnicas de inyección correctas.
Posología
Las recomendaciones posológicas para la folitropina alfa son las mismas que se utilizan para la FSH urinaria. La evaluación clínica de la folitropina alfa indica que sus dosis diarias, pautas de administración y procedimientos para monitorizar el tratamiento no deben ser distintos de los que se utilizan actualmente para los medicamentos que contienen FSH urinaria. Se aconseja adherirse a las dosis iniciales recomendadas, que se indican a continuación.
Estudios clínicos comparativos han demostrado que de media los pacientes requieren una dosis acumulativa menor y un periodo de tratamiento más corto con la folitropina alfa que con el tratamiento con FSH urinaria. Por tanto, se considera apropiado dar una dosis total menor de folitropina alfa que la generalmente utilizada para la FSH urinaria, no sólo para optimizar el desarrollo folicular sino también para minimizar el riesgo de hiperestimulación ovárica no deseada (ver sección 5.1).
Mujeres con anovulación (incluyendo el síndrome de ovario _poliquístico)
Bemfola puede administrarse mediante un ciclo de inyecciones diarias. En las mujeres con menstruación el tratamiento debe comenzar dentro de los primeros 7 días del ciclo menstrual.
Una pauta comúnmente utilizada comienza con 75-150 UI de FSH diarias y se incrementa preferiblemente en 37,5 o 75 UI a intervalos de 7 días o, preferiblemente, 14 días, si fuera necesario para obtener una respuesta adecuada, pero no excesiva. El tratamiento debe adaptarse a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y/o la secreción de estrógenos. La dosis máxima diaria no suele ser superior a 225 UI de FSH. Si una paciente no responde adecuadamente después de 4 semanas de tratamiento, ese ciclo debe interrumpirse y la paciente se debe someter a evaluaciones adicionales antes de que pueda reiniciar el tratamiento con una dosis inicial más alta que la del ciclo cancelado.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de coriogonadotropina alfa humana recombinante (hCG-r), ó 5.000 UI, hasta 10.000 UI, de hCG, 24 -48 horas después de la última inyección de folitropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente. Alternativamente, puede practicarse inseminación intrauterina (IIU).
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG (ver la sección 4.4). El tratamiento se debe reiniciar en el ciclo siguiente con una dosis más baja que la del ciclo previo.
Mujeres sometidas a estimulación ovárica_para el desarrollo _folicular múltiple _previo a la fertilización in vitro u otras técnicas de reproducción asistida
Una pauta frecuente de tratamiento para inducir superovulación consiste en la administración de 150225 UI de folitropina alfa por día, comenzando el día 2 ó 3 del ciclo. El tratamiento debe continuar hasta que se alcance un desarrollo folicular adecuado (según los niveles séricos de estrógenos y/o la ecografía); las dosis deben ajustarse en función de la respuesta de la paciente, sin que se rebasen habitualmente las 450 UI diarias. En general, se alcanza un desarrollo folicular adecuado como media antes del décimo día de tratamiento (entre 5 y 20 días).
Al cabo de 24 -48 horas de la última inyección de folitropina alfa se debe administrar una única inyección de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI de hCG, para inducir la maduración folicular final.
En la actualidad, se realiza frecuentemente un bloqueo hipofisario con un agonista o antagonista de la hormona liberadora de gonadotropinas (GnRH), para suprimir el pico endógeno de LH y controlar su secreción. En un protocolo habitual, la administración de folitropina alfa se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, tras 2 semanas de tratamiento con el agonista, se administran 150 -225 UI de folitropina alfa durante los primeros 7 días y, a continuación, se ajusta la dosis según la respuesta ovárica.
La experiencia global con técnicas de FIV indica que, en general, la tasa de éxito del tratamiento permanece estable durante los primeros cuatro intentos, disminuyendo posteriormente de forma gradual.
Mujeres con anovulación debida a un déficit severo de LH y FSH
En mujeres con déficit de LH y FSH (hipogonadismo hipogonadotropo), el objetivo del tratamiento con Bemfola asociado a lutropina alfa es desarrollar un único folículo de Graaf maduro, a partir del cual se liberará el ovocito tras la administración de gonadotropina coriónica humana (hCG). La folitropina alfa se debe administrar como un ciclo de inyecciones diarias, conjuntamente con lutropina alfa. . Puesto que estas pacientes son amenorreicas y tienen una escasa secreción endógena de estrógenos, el tratamiento puede comenzar en cualquier momento.
Una pauta recomendada comienza con 75 UI de lutropina alfa por día junto con 75 - 150 UI de FSH.
El tratamiento se debe adaptar a la respuesta individual de la paciente, evaluada mediante el tamaño folicular determinado por una ecografía y la respuesta estrogénica.
Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 -75 UI. Puede ser aceptable prolongar la duración de la estimulación en un ciclo determinado hasta 5 semanas.
Cuando se obtiene una respuesta óptima, se debe administrar una inyección única de 250 microgramos de hCG-r, ó 5.000 UI, hasta 10.000 UI, de hCG, 24 - 48 horas después de la última inyección de folitropina alfa y lutropina alfa. Se recomienda a la paciente que realice el coito el mismo día de la administración de hCG, así como al día siguiente.
De forma alternativa, se puede realizar IIU.
Se puede considerar la necesidad de apoyo de la fase lútea, ya que la falta de sustancias con actividad luteotropa (LH/hCG) después de la ovulación puede dar lugar a un fracaso prematuro del cuerpo lúteo.
Si se obtiene una respuesta excesiva, se debe interrumpir el tratamiento y no administrarse hCG. El tratamiento se debe reiniciar en el ciclo siguiente con una dosis de FSH más baja que la del ciclo previo.
Varones con hipogonadismo hipogonadotropo
Bemfola se debe administrar a dosis de 150 UI tres veces por semana, de forma concomitante con hCG, durante un mínimo de 4 meses. Si después de este periodo el paciente no ha respondido, se puede continuar el tratamiento combinado; la experiencia clínica actual indica que se puede requerir un tratamiento de al menos 18 meses para lograr la espermatogénesis.
Poblaciones especiales
Población de edad avanzada
No existe una recomendación de uso específica para folitropina alfa en la población de edad avanzada. No se ha establecido la seguridad y eficacia de la folitropina alfa en los pacientes de edad avanzada.
No se ha establecido la seguridad la eficacia y las propiedades farmacocinéticas de la folitropina alfa en los pacientes con insuficiencia renal o hepática.
Población _ pediátrica
La folitropina alfa no se debe utilizar en la población pediátrica.
Forma de administración
Bemfola está indicado para la administración por vía subcutánea. La primera inyección de Bemfola se debe realizar bajo supervisión médica directa. La autoadministración de Bemfola sólo debe ser realizada por pacientes que estén bien motivados, adecuadamente instruidos y que tengan acceso a los consejos de un profesional.
Dado que la pluma precargada de Bemfola con cartucho de una sola dosis está destinada a una sola inyección, se deben proporcionar instrucciones claras a los pacientes, a fin de evitar el uso inadecuado de la presentación unidosis.
Para consultar las instrucciones sobre la administración con la pluma precargada, ver sección 6.6 y el prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo folitropina alfa, a la FSH o a alguno de los excipientes incluidos en la sección 6.1;
• Tumores del hipotálamo o de la hipófisis;
• Aumento del tamaño de los ovarios o quistes ováricos no causados por el síndrome del ovario poliquístico;
• Hemorragias ginecológicas de etiología desconocida;
• Carcinoma ovárico, uterino o mamario.
La folitropina alfa no se debe utilizar cuando no se puede obtener una respuesta eficaz, en casos tales como:
• Fallo ovárico primario;
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Tumores fibroides del útero incompatibles con el embarazo.
• Fallo testicular primario.
4.4 Advertencias y precauciones especiales de empleo
La folitropina alfa es una sustancia gonadotrópica potente capaz de causar reacciones adversas de leves a graves, y sólo se debe utilizar por médicos que estén muy familiarizados con los problemas de la infertilidad y su tratamiento.
El tratamiento con gonadotropinas requiere una cierta dedicación de tiempo por parte de los médicos y profesionales sanitarios, además de disponer de las instalaciones de monitorización apropiadas, En mujeres, el uso seguro y eficaz de la folitropina alfa requiere monitorizar la respuesta ovárica mediante ecografías, solas o preferiblemente combinadas con la determinación de los niveles séricos de estradiol, de manera regular. Puede existir un cierto grado de variabilidad en la respuesta a la administración de FSH entre unas pacientes y otras, con una respuesta escasa a la FSH en algunas pacientes y una respuesta exagerada en otras. Tanto en varones como en mujeres, se debe utilizar la mínima dosis efectiva para lograr el objetivo del tratamiento.
Porfíria
Los pacientes con porfiria o con antecedentes familiares de porfiria se deben controlar estrechamente durante el tratamiento con folitropina alfa. El deterioro de dicha enfermedad o su aparición por primera vez puede requerir la interrupción del tratamiento.
Tratamiento en mujeres
Antes de iniciar el tratamiento, se debe valorar adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, se debe descartar la presencia de hipotiroidismo, insuficiencia suprarrenal e hiperprolactinemia, instaurando el tratamiento específico apropiado.
Las pacientes sometidas a estimulación del desarrollo folicular, ya sea como tratamiento de la infertilidad por anovulación o bien para practicar TRA, pueden presentar aumento del tamaño de los ovarios o hiperestimulación. La incidencia de estos eventos puede minimizarse aplicando las dosis y pautas de administración de folitropina alfa recomendadas y monitorizando cuidadosamente el tratamiento. Para la interpretación correcta de los índices de desarrollo y maduración folicular, el médico debe tener experiencia en la interpretación de las pruebas correspondientes.
En los ensayos clínicos se ha demostrado un aumento de la sensibilidad ovárica a la folitropina alfa cuando se administra con lutropina alfa. Si se considera apropiado aumentar la dosis de FSH, el ajuste de dosis se debe realizar preferiblemente a intervalos de 7 - 14 días y preferiblemente con incrementos de 37,5 - 75 UI.
No se ha efectuado una comparación directa de la folitropina alfa/LH frente a la gonadotropina menopáusica humana (h MG). La comparación con datos históricos sugiere que la tasa de ovulación obtenida con folitropina alfa/LH es similar a la que se obtiene con h MG.
Síndrome de hiperestimulación ovárica (SHO)
Un cierto grado de incremento del tamaño del ovario es un efecto esperado de la estimulación ovárica controlada. Se observa con mayor frecuencia en mujeres con síndrome del ovario poliquístico y, por lo general, remite sin tratamiento.
A diferencia del aumento de tamaño ovárico no complicado, el SHO es una afección que puede manifestarse con grados crecientes de gravedad. Incluye un aumento marcado del tamaño de los ovarios, niveles séricos elevados de esteroides sexuales y un aumento de la permeabilidad vascular que puede dar lugar a una acumulación de líquidos en la cavidad peritoneal, pleural y, raramente, pericárdica.
En los casos de SHO grave puede observarse la siguiente sintomatología: dolor abdominal, distensión abdominal, aumento importante del tamaño de los ovarios, aumento de peso, disnea, oliguria y síntomas gastrointestinales incluyendo náuseas, vómitos y diarrea. La evaluación clínica puede revelar hipovolemia, hemoconcentración, desequilibrio electrolítico, ascitis, hemoperitoneo, derrames pleurales, hidrotórax o distrés respiratorio agudo. Muy raramente, el SHO grave puede complicarse con torsión del ovario o episodios tromboembólicos como embolia pulmonar, accidente cerebrovascular isquémico o infarto de miocardio.
Algunos factores de riesgo independientes para presentar el síndrome de hiperestimulación ovárica son el síndrome del ovario poliquístico, las concentraciones absolutas altas o en rápido aumento de estradiol en el suero (por ejemplo, > 900 pg/ml o > 3.300 pmol/l en la anovulación; > 3.000 pg/ml o
> 11.000 pmol/l en TRA) y una gran cantidad de folículos ováricos en desarrollo (por ejemplo,
> 3 folículos de > 14 mm de diámetro en la anovulación; > 20 folículos de > 12 mm de diámetro en las TRA).
El cumplimiento de la dosis recomendada de folitropina alfa y la pauta de administración pueden minimizar el riesgo de hiperestimulación ovárica (ver secciones 4.2 y 4.8). Para identificar tempranamente los factores de riesgo, se recomienda la vigilancia de los ciclos de estimulación mediante ecografías y determinaciones de estradiol.
Hay evidencias que sugieren que la hCG desempeña una función fundamental en el desencadenamiento del SHO y que el síndrome puede ser más grave y puede tener una duración más prolongada si se produce un embarazo. Por tanto, si se producen signos de hiperestimulación ovárica, por ejemplo, una concentración sérica de estradiol > 5.500 pg/ml o > 20.200 pmol/ml y/o > 40 folículos en total, se recomienda no administrar hCG y se debe advertir a la paciente que no realice el coito o que utilice métodos anticonceptivos de barrera durante al menos cuatro días. El SHO puede progresar rápidamente (en menos de 24 horas) o en varios días hasta convertirse en un cuadro clínico grave. La mayoría de las veces se produce después de que el tratamiento hormonal se ha suspendido y alcanza su máxima intensidad aproximadamente de siete a diez días después del tratamiento. Por lo tanto, se debe seguir a las pacientes durante al menos dos semanas tras la administración de hCG.
En las técnicas de reproducción asistida, la aspiración de todos los folículos, antes de la ovulación, puede reducir la incidencia de hiperestimulación.
El síndrome de hiperestimulación ovárica leve o moderado se resuelve generalmente de manera espontánea. Si se produce un SHO grave, se recomienda interrumpir el tratamiento con gonadotropinas si es que todavía continúa, y hospitalizar a la paciente e iniciar el tratamiento adecuado.
Embarazo múltiple
En pacientes sometidas a la inducción de la ovulación, la incidencia de embarazo múltiple es más elevada que en el caso de la concepción natural. La mayoría de embarazos múltiples son gemelares. El embarazo múltiple, especialmente si el número de fetos es alto, conlleva un mayor riesgo de complicaciones maternas y perinatales.
Para minimizar el riesgo de embarazo múltiple, se recomienda una monitorización cuidadosa de la respuesta ovárica.
El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona principalmente con el número de embriones transferidos, con la calidad de los mismos y con la edad de la paciente.
Antes de empezar el tratamiento se debe informar a las pacientes del riesgo potencial de partos múltiples.
Pérdida del embarazo
La incidencia de pérdida del embarazo debido a aborto espontáneo o provocado es mayor en pacientes sometidas a estimulación del desarrollo folicular para inducir la ovulación o practicar TRA que la observada tras la concepción natural.
Embarazo ectópico
Las mujeres con historia de enfermedad tubárica presentan riesgo de embarazo ectópico, tanto si el embarazo es por concepción espontánea como si se logra mediante tratamientos de fertilidad. Se ha notificado que la prevalencia del embarazo ectópico tras practicar TRA es mayor que en la población general.
Neoplasias del aparato reproductor
Se han descrito neoplasias, tanto benignas como malignas, del ovario y de otros órganos del aparato reproductor, en mujeres sometidas a múltiples pautas terapéuticas para el tratamiento de la infertilidad. Todavía no está establecido si el tratamiento con gonadotropinas aumenta o no el riesgo de estos tumores en mujeres estériles.
Malformaciones congénitas
La prevalencia de malformaciones congénitas tras TRA puede ser ligeramente superior a la observada tras la concepción natural. Esto se considera debido a diferencias en las características de los progenitores (por ejemplo, la edad de la madre, las características del semen) y a los embarazos múltiples.
Eventos tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso o en mujeres con factores de riesgo generalmente reconocidos para presentar problemas tromboembólicos, tales como antecedentes familiares o personales, el tratamiento con gonadotropinas puede aumentar más el riesgo de empeoramiento o aparición de dichos fenómenos. En estas mujeres, los beneficios de la administración de gonadotropinas se deben sopesar frente a los riesgos. No obstante, hay que tener en cuenta que el embarazo por sí mismo, así como el síndrome de hiperestimulación ovárica, también comportan un aumento del riesgo de acontecimientos tromboembólicos.
Tratamiento en varones
Unos niveles elevados de FSH endógena indican fallo testicular primario. Dichos pacientes no responden al tratamiento con folitropina alfa/hCG. La folitropina alfa no se debe usar cuando no se pueda obtener una respuesta eficaz.
Se recomienda practicar espermiogramas de 4 a 6 meses después de iniciar el tratamiento, como parte de la evaluación de la respuesta.
Contenido de sodio
Bemfola contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente «exento de sodio»
4.5 Interacción con otros medicamentos y otras formas de interacción
La utilización concomitante de folitropina alfa con otros medicamentos utilizados para estimular la ovulación (por ejemplo, hCG, citrato de clomifeno) puede potenciar la respuesta folicular, mientras que la utilización concomitante de un agonista o antagonista de la GnRH para provocar una desensibilización hipofisaria puede incrementar la dosis de folitropina alfa necesaria para lograr una respuesta ovárica adecuada. No se han descrito otras interacciones con medicamentos clínicamente significativas durante el tratamiento con folitropina alfa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para utilizar Bemfola durante el embarazo. Existen datos sobre un número limitado de embarazos expuestos (menos de 300 embarazos) que indican que folitropina alfa no produce malformaciones ni toxicidad fetal/neonatal.
No se han observado efectos teratogénicos en los estudios en animales (ver sección 5.3). En caso de exposición durante el embarazo, los datos clínicos no son suficientes para descartar un efecto teratógeno de la folitropina alfa.
Lactancia
Bemfola no está indicado durante la lactancia.
Fertilidad
Bemfola está indicado para su uso en la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se espera que la influencia de Bemfola sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas notificadas con mayor frecuencia son cefalea, quistes ováricos y reacciones locales en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón y/o irritación en el lugar de la inyección).
Se ha notificado con frecuencia síndrome de hiperestimulación ovárica leve o moderado y se debe considerar como un riesgo intrínseco del proceso de estimulación. El síndrome de hiperestimulación ovárica grave es poco frecuente (ver sección 4.4).
En casos muy raros se puede producir tromboembolismo, asociado generalmente a un síndrome de hiperestimulación ovárica grave (ver sección 4.4).
Las siguientes definiciones se aplican a la terminología de frecuencia usada de aquí en adelante:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Tratamiento en mujeres
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos del sistema nervioso
Muy frecuentes: Cefalea Trastornos vasculares
Muy raras: Tromboembolismo, generalmente asociado a síndrome de hiperestimulación
ovárica grave (ver sección 4.4)
Trastornos respiratorios, torácicos y mediastínicos
Muy raras: Exacerbación o empeoramiento del asma
Trastornos gastrointestinales
Frecuentes: Dolor abdominal, distensión abdominal, molestias abdominales, náuseas, vómitos,
diarrea
Trastornos del aparato reproductor y de la mama Muy frecuentes: Quistes ováricos
Frecuentes: Síndrome de hiperestimulación ovárica leve o moderado (incluida la
sintomatología relacionada)
Poco frecuentes: Síndrome de hiperestimulación ovárica grave (incluida la sintomatología relacionada) (ver sección 4.4)
Raras: Complicación del síndrome de hiperestimulación ovárica grave
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Tratamiento en varones
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad de leves a graves, incluyendo shock y reacciones
anafilácticas
Trastornos respiratorios, torácicos y mediastínicos Muy raras: Exacerbación y/o empeoramiento del asma
Trastornos de la _piel y del tejido subcutáneo Frecuentes: Acné
Trastornos del aparato reproductor y de la mama
Frecuentes: Ginecomastia, varicocele
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: Reacciones en el lugar de inyección (por ejemplo, dolor, eritema, hematoma, hinchazón o irritación en el lugar de inyección)
Exploraciones complementarias
Frecuentes: Aumento de peso
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Los efectos de una sobredosis de folitropina alfa se desconocen; sin embargo, existe la posibilidad de que se produzca un síndrome de hiperestimulación ovárica (ver sección 4.4).
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotropinas, código ATC: G03GA05.
Bemfola es un medicamento biosimilar, es decir un medicamento que se ha demostrado que es similar en lo que respecta a la calidad, seguridad y eficacia al medicamento de referencia GONAL-f. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Efectos farmacodinámicos
En mujeres, el efecto más importante que se produce tras la administración parenteral de FSH es el desarrollo de folículos de Graaf maduros. En mujeres con anovulación, el objetivo del tratamiento con folitropina alfa es desarrollar un único folículo de Graaf maduro a partir del cual se liberará el óvulo después de la administración de hCG.
Eficacia clínica y seguridad en mujeres
En los ensayos clínicos, las pacientes con déficit severo de FSH y LH se definieron por un nivel sérico de LH endógena de < 1,2 UI/l, medido en un laboratorio central. Sin embargo, se debe tener en cuenta que existen variaciones entre las determinaciones de LH realizadas en diferentes laboratorios.
En estudios clínicos comparativos de hFSH-r (folitropina alfa) y FSH urinaria en las técnicas de reproducción asistida (ver tabla a continuación) y en inducción a la ovulación, la folitropina alfa se mostró más potente que la FSH urinaria en términos de una dosis total menor necesaria y un periodo de tratamiento más corto para desencadenar la maduración folicular.
En las técnicas de reproducción asistida, la folitropina alfa a una dosis total menor y durante un periodo de tratamiento más corto que la FSH urinaria, permitió la recuperación de un número mayor de ovocitos, en comparación con la FSH urinaria.
Tabla: Resultados del estudio GF 8407 (estudio paralelo aleatorizado y comparativo de la eficacia y
|
seguridad de la folitropina alfa con la FSH urinaria en técnicas c |
e reproducción asistida). | |
|
folitropina alfa (n = 130) |
FSH urinaria (n = 116) | |
|
Número de ovocitos recuperados |
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Días de estimulación con FSH requeridos |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Dosis total de FSH requerida (número de ampollas de FSH 75 UI) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Necesidad de aumentar la dosis (%) |
56,2 |
85,3 |
Las diferencias entre los dos grupos fueron estadísticamente significativas (p < 0,05) para todos los criterios incluidos.
Eficacia clínica y seguridad en varones
En varones con déficit de FSH, la folitropina alfa administrada de forma concomitante con hCG durante al menos 4 meses induce la espermatogénesis.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la folitropina alfa se distribuye en el espacio extracelular. La semivida de distribución es de unas 2 horas y la semivida de eliminación, de alrededor de 1 día. En estado estacionario, el volumen de distribución es de 10 l y el aclaramiento total, de 0,6 l/h. La octava parte de la dosis de folitropina alfa administrada se excreta en la orina.
Tras la administración subcutánea, la biodisponibilidad absoluta es de alrededor del 70 %. Tras la administración de dosis repetidas de folitropina alfa, se produce una acumulación de 3 veces, alcanzando un estado estacionario en un periodo de 3-4 días. En mujeres con supresión de la secreción endógena de gonadotropinas, la folitropina alfa estimula adecuadamente el desarrollo folicular y la esteroidogénesis, a pesar de unos niveles indetectables de LH.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad de dosis única y a dosis repetidas y genotoxicidad, adicionales a los ya descritos en otras secciones de esta ficha técnica.
Se han notificado trastornos de la fertilidad en ratas expuestas a dosis farmacológicas de folitropina alfa (> 40 UI/kg/día) durante largos períodos de tiempo, mostrando una disminución de la fecundidad.
La administración de dosis altas (> 5 UI/kg/día) de folitropina alfa produjo un descenso en el número de fetos viables, aunque no tuvo efectos teratógenos, así como distocia similar a la observada con la hormona Gonadotropina Menopáusica (hMG) urinaria. Sin embargo, puesto que Bemfola no está indicado en el embarazo, estos datos tienen escasa relevancia clínica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poloxámero 188
Sacarosa
Metionina
Hidrogenofosfato de disodio dihidrato Dihidrogenofosfato de sodio dihidrato Ácido fosfórico
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Antes de la apertura y durante su periodo de validez, el medicamento se puede extraer de la nevera, sin refrigerar de nuevo, hasta un máximo de 3 meses a temperatura igual o inferior a 25 °C. El producto se debe desechar si después de 3 meses no se ha utilizado.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Cartucho de 1,5 ml (vidrio de tipo I) que contiene 0,75 ml de solución inyectable con un pistón (goma de halobutilo) y una cápsula de aluminio superpuesta con incrustación de goma.
Envases con 1, 5 o 10 plumas precargadas. Puede que solamente estén comercializados algunos tamaños de envases. Para la administración con la pluma se debe utilizar una aguja y una gasa empapada en alcohol.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver el prospecto.
La solución no se debe administrar si contiene partículas o no es transparente.
Bemfola 450 UI/0,75 ml (33 microgramos/0,75 ml) no está diseñado para permitir la extracción del cartucho.
Las agujas utilizadas se deben desechar inmediatamente tras la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/005
EU/1/13/909/014
EU/1/13/909/015
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/03/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Polymun Scientific Immunbiologische Forschung GmbH DonaustraBe 99 Klosterneuburg 3400 Austria
Nombre y dirección del fabricante responsable de la liberación de los lotes
Finox Biotech AG Gewerbestrasse 7 FL-9496 Balzers Liechtenstein
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujetos a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos;
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
bemfola 75 UI/0,125 ml solución inyectable en pluma precargada folitropina alfa
Cada pluma precargada administra 75 UI, equivalente a 5,5 microgramos, de folitropina alfa en 0,125 ml.
Cada ml de la solución contiene 600 UI equivalente a 44 microgramos.
Poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 1 pluma precargada 1 aguja para inyección
5 plumas precargadas 5 agujas para inyección
10 plumas precargadas 10 agujas para inyección
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Durante su periodo de validez, el medicamento se puede conservar a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/001
EU/1/13/909/006
EU/1/13/909/007
13. NÚMERO DE LOTE <, CÓDIGO DE DONACIÓN Y DEL PRODUCTO >
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DE LA PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
bemfola 75 UI/0,125 ml inyectable folitropina alfa SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,125 ml
6. OTROS
bemfola 150 UI/0,25 ml solución inyectable en pluma precargada folitropina alfa
Cada pluma precargada administra 150 UI, equivalente a 11 microgramos de folitropina alfa en 0,25 ml. Cada ml de la solución contiene 600 UI equivalente a 44 microgramos.
Poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 1 pluma precargada 1 aguja para inyección
5 plumas precargadas 5 agujas para inyección
10 plumas precargadas 10 agujas para inyección
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Durante su periodo de validez, el medicamento se puede conservar a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers
EU/1/13/909/002
EU/1/13/909/008
EU/1/13/909/009
Lote
Medicamento sujeto a prescripción médica.
ETIQUETA DE LA PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
bemfola 150 UI/0,25 ml inyectable folitropina alfa SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,25 ml
6. OTROS
bemfola 225 UI/0,375 ml solución inyectable en pluma precargada folitropina alfa
Cada pluma precargada administra 225 UI, equivalente a 16,5 microgramos de folitropina alfa en 0,375 ml. Cada ml de la solución contiene 600 UI equivalente a 44 microgramos.
Poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 1 pluma precargada 1 aguja para inyección
5 plumas precargadas 5 agujas para inyección
10 plumas precargadas 10 agujas para inyección
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Durante su periodo de validez, el medicamento se puede conservar a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/003
EU/1/13/909/010
EU/1/13/909/011
13. NÚMERO DE LOTE <, CÓDIGO DE DONACIÓN Y DEL PRODUCTO >
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ETIQUETA DE LA PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
bemfola 225 UI/0,375 ml inyectable folitropina alfa SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,375 ml
6. OTROS
bemfola 300 UI/0,50 ml solución inyectable en pluma precargada folitropina alfa
Cada pluma precargada administra 300 UI, equivalente a 22 microgramos de folitropina alfa en 0,5 ml. Cada ml de la solución contiene 600 UI equivalente a 44 microgramos.
Poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 1 pluma precargada 1 aguja para inyección
5 plumas precargadas 5 agujas para inyección
10 plumas precargadas 10 agujas para inyección
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Durante su periodo de validez, el medicamento se puede conservar a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/004
EU/1/13/909/012
EU/1/13/909/013
13. NÚMERO DE LOTE <, CÓDIGO DE DONACIÓN Y DEL PRODUCTO >
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
300 ui/0,5 ml
ETIQUETA DE LA PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
bemfola 300 UI/0,50 ml inyectable folitropina alfa SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
bemfola 450 UI/0,75 ml solución inyectable en pluma precargada folitropina alfa
Cada pluma precargada administra 450 UI, equivalente a 33 microgramos de folitropina alfa en 0,75 ml. Cada ml de la solución contiene 600 UI equivalente a 44 microgramos.
Poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Solución inyectable en pluma precargada 1 pluma precargada 1 aguja para inyección
5 plumas precargadas 5 agujas para inyección
10 plumas precargadas 10 agujas para inyección
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Durante su periodo de validez, el medicamento se puede conservar a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FINOX Biotech AG Gewerbestrasse 7 FL-9496 Balzers
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/909/005
EU/1/13/909/014
EU/1/13/909/015
13. NÚMERO DE LOTE <, CÓDIGO DE DONACIÓN Y DEL PRODUCTO >
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
bemfola 450 ui/0,75 ml
ETIQUETA DE LA PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
bemfola 450 UI/0,75 ml inyectable folitropina alfa SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,75 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Bemfola 75 UI/0,125 ml solución inyectable en pluma precargada Bemfola 150 UI/0,25 ml solución inyectable en pluma precargada Bemfola 225 UI/0,375 ml solución inyectable en pluma precargada Bemfola 300 UI/0,50 ml solución inyectable en pluma precargada Bemfola 450 UI/0,75 ml solución inyectable en pluma precargada
Folitropina alfa
'VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Bemfola y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Bemfola
3. Cómo usar Bemfola
4. Posibles efectos adversos
5. Conservación de Bemfola
6. Contenido del envase e información adicional
1. Qué es Bemfola y para qué se utiliza Qué es Bemfola
Este medicamento contiene el principio activo folitropina alfa, que es casi idéntico a una hormona natural producida por su organismo que se denomina «hormona foliculoestimulante» (FSH). La FSH es una gonadotropina, un tipo de hormona que desempeña un papel importante en la reproducción y la fertilidad humana. En mujeres, la FSH es necesaria para el crecimiento y desarrollo de los sacos (folículos) de los ovarios que contienen los óvulos. En varones, la FSH es necesaria para la producción de esperma.
Para qué se utiliza Bemfola
En mujeres adultas, Bemfola se utiliza:
• para ayudar a liberar un óvulo del ovario (ovulación) en mujeres que no pueden ovular y que no han respondido al tratamiento con una sustancia llamada «citrato de clomifeno»
• junto con otra sustancia llamada «lutropina alfa» («hormona luteinizante» o LH), para ayudar a liberar un óvulo del ovario (ovulación) en mujeres que no están ovulando porque su organismo produce cantidades muy pequeñas de gonadotropinas (FSH y LH).
• para ayudar a desarrollar varios folículos (que contiene cada uno un óvulo) en mujeres que se someten a técnicas de reproducción asistida (técnicas que pueden ayudarla a quedarse embarazada), como la «fertilización in vitro», la «transferencia intratubárica de gametos» o la «transferencia intratubárica de cigotos».
En varones adultos, Bemfola se utiliza:
• junto con otro medicamento llamado «Gonadotropina Coriónica humana» (hCG), para ayudar a producir esperma en varones que son estériles debido a una concentración baja de ciertas hormonas.
2. Qué necesita saber antes de empezar a usar Bemfola
Antes de iniciar el tratamiento se debe valorar su fertilidad y la de su pareja por parte de un médico experimentado en el tratamiento de los trastornos de la fertilidad.
No use Bemfola
• si es alérgico (hipersensible) a la hormona foliculoestimulante o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si tiene un tumor en el hipotálamo o en la hipófisis (ambos son partes del cerebro).
• si usted es una mujer:
- con ovarios grandes o bolsas de líquido en el interior de los ovarios (quistes ováricos) de origen desconocido.
- con hemorragia vaginal inexplicada.
- con cáncer de ovario, de útero o de mama.
• si tiene una afección que normalmente hace que el embarazo sea imposible, como la insuficiencia ovárica (menopausia precoz) o una malformación de los órganos reproductivos.
• si usted es un varón:
- con testículos dañados que no pueden curarse.
No utilice Bemfola si sufre alguna de estas afecciones. Si no está seguro, pregunte a su médico o farmacéutico antes de usar este medicamento.
Advertencias y precauciones
Porfiria
Informe a su médico antes de iniciar el tratamiento, si usted o cualquier miembro de su familia padecen porfiria (una incapacidad para degradar las porfirinas que puede transmitirse de padres a hijos).
Informe inmediatamente a su médico si:
• su piel se vuelve frágil y le salen ampollas con facilidad, especialmente en las zonas expuestas al sol con frecuencia, y/o
• si tiene dolor de estómago, de brazos o piernas.
En estos casos, su médico puede recomendarle que interrumpa el tratamiento.
Síndrome de hiperestimulación ovárica (SHO)
Si es usted una mujer, este medicamento aumenta el riesgo de que presente un SHO. Esto ocurre cuando sus folículos se desarrollan demasiado y se convierten en quistes de gran tamaño. Si tiene dolor en la región pélvica, aumenta de peso rápidamente, tiene náuseas o vómitos o dificultad para respirar, consulte inmediatamente con su médico, quien puede interrumpir el tratamiento (ver la sección 4).
En caso de que no ovule y se respeten la dosis y el esquema posológico recomendados, ese síndrome es menos probable que ocurra. El tratamiento con Bemfola rara vez causa un síndrome de hiperestimulación ovárica grave, a menos que se administre el medicamento que se usa para la maduración folicular final (que contiene Gonadotropina Coriónica humana, hCG). En caso de desarrollar SHO, su médico puede no recetarle hCG en este ciclo de tratamiento y aconsejarle que se abstenga de realizar el coito o que utilice métodos anticonceptivos de barrera durante al menos 4 días.
Embarazo múltiple
Si usa Bemfola, tiene un riesgo más alto de quedarse embarazada de más de un niño a la vez («embarazo múltiple», generalmente gemelos), que si se queda embarazada por concepción natural. El embarazo múltiple puede causar complicaciones médicas para usted y sus bebés. Usted puede reducir el riesgo de embarazo múltiple usando la dosis correcta de Bemfola a las horas correctas. Si se somete a técnicas de reproducción asistida, el riesgo de embarazo múltiple está relacionado con su edad y con la calidad y el número de óvulos fertilizados o embriones que se coloquen en su interior.
Aborto
Si se somete a técnicas de reproducción asistida o a estimulación de sus ovarios para producir óvulos, la probabilidad de tener un aborto es mayor que en el promedio de las mujeres.
Problemas de coagulación de la sangre (episodios tromboembólicos)
Si usted o algún miembro de su familia ha sufrido, en el pasado o recientemente, coágulos de sangre en la pierna o en el pulmón, infarto de miocardio o ictus, usted podría tener un riesgo más alto de presentar estos problemas o de que empeorasen con el tratamiento con Bemfola.
Varones con niveles altos de FSH en la sangre
Si usted es varón, unos niveles demasiado altos de FSH en la sangre pueden ser un signo de lesión de los testículos. Por lo general, Bemfola no suele ser eficaz en estos casos.
Si su médico decide intentar el tratamiento con Bemfola para controlar el tratamiento, su médico puede pedirle que se haga un análisis de semen, de 4 a 6 meses después de iniciar el tratamiento.
Niños y adolescentes
Bemfola no está indicado en niños y adolescentes menores de 18 años.
Uso de Bemfola y otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar otros medicamentos.
• Si usa Bemfola con otros medicamentos que ayudan a la ovulación (por ejemplo, hCG o citrato de clomifeno), la respuesta de sus folículos puede verse aumentada.
• Si usa Bemfola al mismo tiempo que un agonista o un antagonista de la «hormona liberadora de gonadotropinas» (GnRH) (estos medicamentos disminuyen las concentraciones de las hormonas sexuales y detienen la ovulación), puede necesitar una dosis más alta de Bemfola para producir folículos.
Embarazo y lactancia
No use Bemfola si está embarazada o durante el periodo de lactancia.
Conducción y uso de máquinas
No se espera que este medicamento afecte a su capacidad para conducir y utilizar máquinas.
Bemfola contiene sodio
Bemfola contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que se considera esencialmente «exento de sodio».
3. Cómo usar Bemfola
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
Uso de este medicamento
• Bemfola está diseñado para que se administre mediante inyección justo debajo de la piel (por vía subcutánea). La pluma precargada se usa una única vez y después se desecha. La solución no se debe administrar si contiene partículas o no es transparente.
• La primera inyección de Bemfola se debe administrar bajo la supervisión de su médico.
• Su médico o enfermero le enseñarán cómo usar la pluma precargada de Bemfola para inyectarse el medicamento.
• Si usted se autoadministra Bemfola lea y siga atentamente las «Instrucciones de uso». Estas instrucciones se pueden consultar al final del prospecto.
Qué cantidad se debe usar
Su médico decidirá qué cantidad de medicamento se administrará y con qué frecuencia. Las dosis que se describen a continuación están expresadas en Unidades Internacionales (UI) y mililitros (ml).
Mujeres
Si no está ovulando y tiene menstruaciones irregulares o no tiene menstruación
• Bemfola se administra generalmente todos los días.
• Si usted tiene una menstruación irregular, empiece usando Bemfola los 7 primeros días del ciclo menstrual. Si no tiene menstruación, puede empezar a usar el medicamento cualquier día que le resulte cómodo.
• La dosis inicial habitual de Bemfola es de 75 a 150 UI (0,12 a 0,25 ml) cada día.
• Su dosis de Bemfola puede aumentarse cada 7 ó 14 días en 37,5 a 75 UI, hasta que se obtenga la respuesta deseada.
• La dosis máxima diaria de Bemfola no suele ser mayor de 225 UI (0,375 ml).
• Cuando se obtenga la respuesta deseada, se le administrará una inyección única de
250 microgramos de «hCG recombinante» (hCG-r, una hCG fabricada en un laboratorio mediante una técnica especial de ADN), ó 5.000 a 10.000 UI de hCG, 24 a 48 horas después de la última inyección de Bemfola. El mejor momento para mantener relaciones sexuales es el mismo día de la inyección de hCG y al día siguiente.
Si su médico no observa la respuesta deseada después de 4 semanas de tratamiento, ese ciclo de tratamiento con Bemfola se debe interrumpir. Para el siguiente ciclo, su médico le administrará una dosis inicial más alta de Bemfola que la anterior.
Si se obtiene una respuesta excesiva, se interrumpirá su tratamiento y no le administrarán hCG (ver la sección 2, Síndrome de hiperestimulación ovárica). Para el siguiente ciclo, su médico le administrará una dosis de Bemfola más baja que la del ciclo previo.
Si no está ovulando, no tiene menstruación y se le ha diagnosticado un déficit de hormonas FSH y LH
• La dosis inicial habitual de Bemfola es de 75 a 150 UI (0,12 a 0,25 ml), junto con 75 UI (0,12 ml) de lutropina alfa.
• Usará estos dos medicamentos cada día, hasta un período de cinco semanas.
• La dosis de Bemfola puede aumentarse cada 7 ó 14 días, en 37,5 a 75 UI, hasta que se obtenga la respuesta deseada.
• Cuando se obtenga la respuesta deseada, se le administrará una inyección única de
250 microgramos de «hCG recombinante» (hCG-r, una hCG fabricada en un laboratorio mediante una técnica especial de ADN), ó 5.000 a 10.000 UI de hCG, 24 a 48 horas después de la última inyección de Bemfola y lutropina alfa. El mejor momento para mantener relaciones sexuales es el mismo día de la inyección de hCG y al día siguiente. También, puede realizarse una inseminación intrauterina, mediante la colocación de esperma en la cavidad uterina.
Si su médico no observa la respuesta deseada después de cinco semanas, ese ciclo de tratamiento con Bemfola se debe interrumpir. Para el siguiente ciclo, su médico le administrará una dosis inicial más alta de Bemfola que la del ciclo cancelado.
Si se obtiene una respuesta excesiva, se interrumpirá su tratamiento y no le administrarán hCG (ver la sección 2, Síndrome de hiperestimulación ovárica). Para el siguiente ciclo, su médico le administrará una dosis de Bemfola más baja que la del ciclo previo.
Si tiene que desarrollar varios óvulos para su extracción previamente a cualquier técnica de reproducción asistida
• La dosis inicial habitual de Bemfola es de 150 a 225 UI (0,25 a 0,37 ml) cada día, desde el 2° o 3 er día de su ciclo de tratamiento.
• La dosis de Bemfola puede aumentarse, dependiendo de su respuesta. La dosis diaria máxima es de 450 UI (0,75 ml).
• El tratamiento continúa hasta que los óvulos se hayan desarrollado hasta el punto deseado. Esto requiere normalmente unos 10 días, pero puede variar entre 5 y 20 días. Su médico lo comprobará mediante análisis de sangre y/o ecografías.
• Cuando los óvulos estén listos, se le administrará una inyección única de 250 microgramos de «hCG recombinante» (hCG-r, una hCG fabricada en un laboratorio mediante una técnica especial de ADN recombinante), ó 5.000 UI a 10.000 UI de hCG, 24 a 48 horas después de la última inyección de Bemfola. Esto hace que sus óvulos estén listos para su extracción.
En otros casos, su médico puede interrumpir primero la ovulación, mediante el uso de un agonista o un antagonista de la hormona liberadora de gonadotropinas (GnRH). En tales casos, la administración de Bemfola se inicia aproximadamente 2 semanas después de iniciar el tratamiento con el agonista, continuando ambos tratamientos hasta lograr un desarrollo folicular adecuado. Por ejemplo, después de dos semanas de tratamiento con el agonista de la GnRH, se administran de 150 a 225 UI de Bemfola durante 7 días. A continuación, la dosis se ajusta según la respuesta de los ovarios. Si se usa un antagonista de la GnRH, se administra desde el 5° o el 6° día de tratamiento con Bemfola y se continúa hasta la inducción de la ovulación.
Varones
• La dosis habitual de Bemfola es de 150 UI (0,25 ml) junto con hCG.
• Usted usará estos dos medicamentos tres veces por semana, durante al menos 4 meses.
• Si no ha respondido al tratamiento después de 4 meses, su médico puede sugerirle que siga usando estos dos medicamentos al menos durante 18 meses.
Si usa más Bemfola del que debiera
Se desconocen los efectos de usar una cantidad excesiva de Bemfola. Sin embargo, puede esperarse que se produzca un síndrome de hiperestimulación ovárica, que se describe en la sección 4. Sin embargo, este síndrome sólo ocurrirá si se administra también hCG (ver la sección 2, Síndrome de hiperestimulación ovárica).
Si olvidó usar Bemfola
Si olvidó usar Bemfola, no use una dosis doble para compensar las dosis olvidadas. Consulte a su médico tan pronto como se dé cuenta de que se ha olvidado de administrar una dosis.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Efectos adversos importantes
Efectos adversos graves en mujeres
• El dolor pélvico, acompañado de náuseas o vómitos, pueden ser síntomas del síndrome de hiperestimulación ovárica (SHO). Esto puede indicar que los ovarios han reaccionado de forma excesiva al tratamiento y se han desarrollado quistes ováricos de gran tamaño (ver también la sección 2 «Tenga especial cuidado con Bemfola»). Este efecto adverso es frecuente (puede afectar hasta 1 de cada 10 personas).
• El síndrome de hiperestimulación ovárica puede agravarse con ovarios claramente aumentados de tamaño, disminución de la producción de orina, aumento de peso, dificultad para respirar y/o posible acumulación de líquido en el abdomen o en el pecho. Este efecto adverso es poco frecuente (puede afectar hasta 1 de cada 100 personas).
• En casos raros, también se pueden producir complicaciones del síndrome de hiperestimulación ovárica como torsión ovárica o coagulación de la sangre (puede afectar hasta 1 de cada 1.000 personas).
• En casos muy raros se pueden producir complicaciones graves de la coagulación de la sangre (episodios tromboembólicos), independientes del síndrome de hiperestimulación ovárica (puede afectar hasta 1 de cada 10.000 personas). Esto podría causar dolor en el pecho, sensación de falta de aire, ictus o infarto de miocardio (ver también la sección 2 «Tenga especial cuidado con Bemfola»).
Efectos adversos graves en varones y en mujeres
• Las reacciones alérgicas, como erupción cutánea, enrojecimiento de la piel, ampollas, hinchazón de la cara con dificultad para respirar, a veces pueden ser graves. Este efecto adverso es muy raro (puede afectar hasta 1 de cada 10.000 personas).
Si observa alguno de los efectos adversos antes mencionados, debe consultar inmediatamente a su
médico, quien podría pedirle que interrumpa el tratamiento con Bemfola.
Otros efectos adversos en mujeres
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
• Bolsas de líquido en el interior de los ovarios (quistes ováricos).
• Dolor de cabeza
• Reacciones locales en el lugar de la inyección, como dolor, enrojecimiento, hematoma, hinchazón y/o irritación.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
• Dolor abdominal
• Náuseas, vómitos, diarrea, retortijones y flatulencias
Muy raros (pueden afectar hasta 1 de cada 10.000 personas):
• Pueden producirse reacciones alérgicas, como erupción cutánea, enrojecimiento de la piel, ampollas, hinchazón de la cara con dificultad para respirar. En ocasiones, estas reacciones pueden ser graves.
• El asma puede empeorar
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
• Reacciones locales en el lugar de la inyección, como dolor, enrojecimiento, hematoma, hinchazón y/o irritación.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
• Hinchazón de las venas por encima y por detrás de los testículos (varicocele).
• Desarrollo de mamas, acné o aumento de peso.
Muy raros (pueden afectar hasta 1 de cada 10.000 personas):
• Pueden producirse reacciones alérgicas, como erupción cutánea, enrojecimiento de la piel, ampollas, hinchazón de la cara con dificultad para respirar. En ocasiones, estas reacciones pueden ser graves.
• El asma puede empeorar
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Bemfola
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta o la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Durante su periodo de validez, el medicamento no abierto puede conservarse a temperatura igual o inferior a 25 °C durante un máximo de 3 meses sin refrigerar y se debe desechar si no se ha utilizado en el plazo de 3 meses.
Conservar en el embalaje original para protegerlo de la luz.
No utilice este medicamento si observa cualquier indicio visible de deterioro, si el líquido contiene partículas o si no es transparente.
Una vez abierto, el medicamento se inyectará inmediatamente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Bemfola
• El principio activo es folitropina alfa.
• Bemfola 75 UI/0,125 ml: cada cartucho contiene 75 UI (equivalente a 5,5 microgramos) de folitropina alfa en 0,125 ml de solución.
• Bemfola 150 UI/0,25 ml: cada cartucho contiene 150 UI (equivalente a 11 microgramos) de folitropina alfa en 0,25 ml de solución.
• Bemfola 225 UI/0,375 ml: cada cartucho contiene 225 UI (equivalente a 16,5 microgramos) de folitropina alfa en 0,375 ml de solución.
• Bemfola 300 UI/0,50 ml: cada cartucho contiene 300 UI (equivalente a 22 microgramos) de folitropina alfa en 0,50 ml de solución.
• Bemfola 450 UI/0,75 ml: cada cartucho contiene 450 UI (equivalente a 33 microgramos) de folitropina alfa en 0,75 ml de solución.
• Cada ml de la solución contiene 600 UI (equivalente a 44 microgramos) de folitropina alfa.
• Los demás componentes son poloxámero 188, sacarosa, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido fosfórico y agua para preparaciones inyectables.
Aspecto de Bemfola y contenido del envase
• Bemfola se presenta como un líquido inyectable, transparente e incoloro, en una pluma precargada.
• Bemfola se suministra en envases de 1, 5 o 10 plumas precargadas, 1, 5 o 10 agujas desechables y 1, 5 o 10 gasas empapadas en alcohol. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
FINOX Biotech AG, Gewerbestrasse 7, FL-9496 Balzers
Fecha de la última revisión de este prospecto
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas
las lenguas de la Unión Europea/Espacio Económico Europeo.
Bemfola 75 UI/0,125 ml pluma precargada Bemfola 150 UI/0,25 ml pluma precargada Bemfola 225 UI/0,375 ml pluma precargada Bemfola 300 UI/0,50 ml pluma precargada Bemfola 450 UI/0,75 ml pluma precargada
Instrucciones de uso CONTENIDO
1. Cómo usar la pluma precargada de Bemfola
2. Antes de comenzar a usar la pluma precargada
3. Preparación de la pluma precargada para la inyección
4. Fijación de la dosis
5. Inyección de la dosis
6. Después de la inyección
1. Cómo usar la pluma precargada de Bemfola
• Antes de empezar a usar la pluma precargada, lea primero estas instrucciones íntegramente.
• Esta pluma es sólo para su uso personal; no deje que nadie más la use.
• Los números que figuran en el indicador de la dosis están medidos en unidades internacionales o UI. Su médico le habrá dicho cuántas UI debe inyectarse cada día.
• Su médico/farmacéutico le dirán cuántas plumas de Bemfola necesita usar para su ciclo completo de tratamiento.
• Póngase la inyección a la misma hora cada día.
2. Antes de comenzar a usar la pluma precargada
2.1. Lávese las manos
• Es importante que las manos y los objetos que utilice para preparar la pluma estén lo más limpios posible.
2.2. Busque un lugar limpio
• Un lugar adecuado es una mesa o superficie limpia.
3. Preparación de la pluma precargada para la inyección
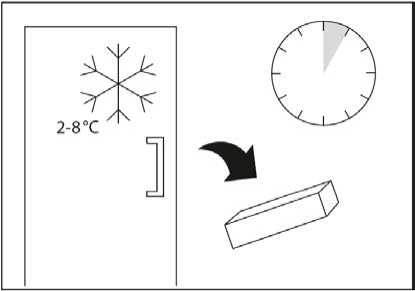
Póngase la inyección a la misma hora cada día. Saque la pluma del frigorífico de 5 a 10 minutos antes de usarla. Nota: compruebe que el medicamento no está congelado.
Retire la lengüeta de la aguja.
Enrosque la aguja hasta que esté bien sujeta. Precaución: no presione el émbolo mientras está fijando la aguja de inyección.
Retire los capuchones de protección externo e interno de la aguja.
Sujete la pluma con la aguja hacia arriba. Golpee suavemente con el dedo la pluma para hacer subir las burbujas, si las hubiera.
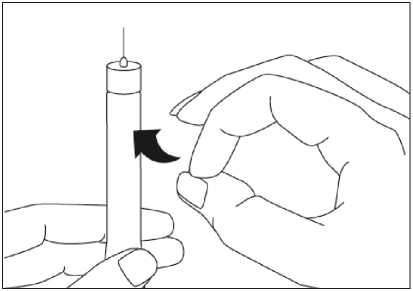
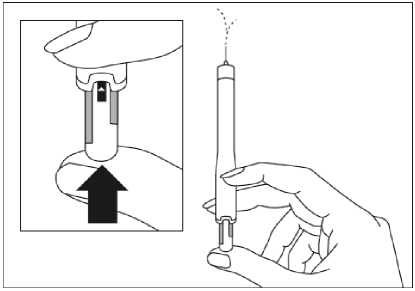
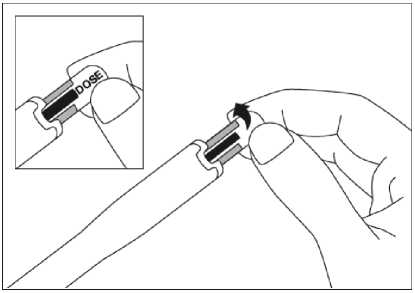
Con la aguja todavía apuntando hacia arriba, presione el botón de ajuste de la dosis hasta que haga tope. Nota: la barra de activación desaparece y se derramará una pequeña cantidad de líquido.
Si no se derrama una pequeña cantidad de líquido, no use la pluma.
Gire el botón de ajuste de la dosis hasta que aparezca la dosis deseada (indicador de la dosis) en la ventana de visualización. Nota: la pluma precargada está ahora lista para la inyección. Precaución: no presione el botón de ajuste de la dosis.
Inyecte inmediatamente la solución: su médico o enfermero le habrán indicado dónde debe ponerse la inyección (p. ej., en el vientre, en la parte anterior del muslo). Para reducir al mínimo la irritación de la piel, seleccione cada día un lugar de inyección diferente.
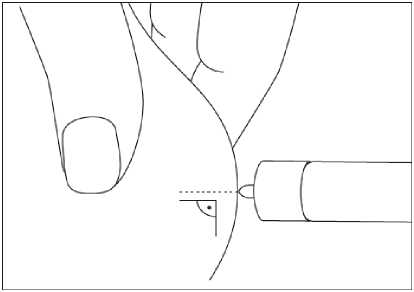
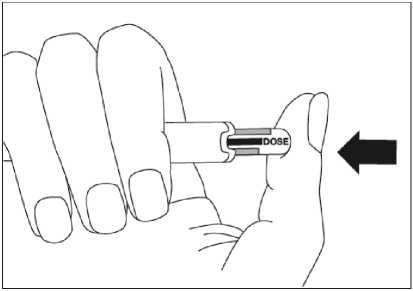
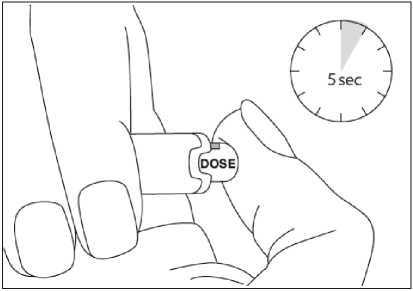
Limpie la zona elegida de la piel con la gasa empapada en alcohol. Pliegue suavemente la piel e introduzca la aguja con un ángulo de 45° a 90°, con un movimiento similar al de los dardos. Precaución: No empuje el botón de ajuste de la dosis mientras está insertando la aguja de inyección.
Empuje el botón de ajuste de la dosis hasta que haga tope. Nota: empuje de forma lenta pero continuada; el indicador de la dosis desaparece.
Fin de la inyección: el indicador de la dosis ha desaparecido por completo detrás de la ventana de visualización (la ventana de visualización muestra la dosis inyectada). Espere 5 segundos y retire la aguja.
Después de retirar la aguja: limpie la piel donde ha realizado la inyección con la gasa empapada en alcohol, realizando un movimiento circular.
Vuelva a colocar cuidadosamente el capuchón extemo de la aguja.
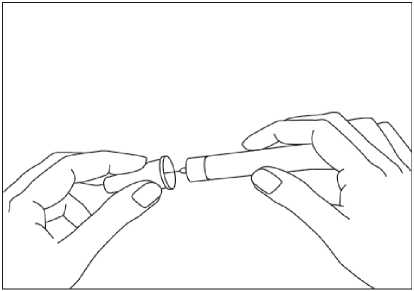
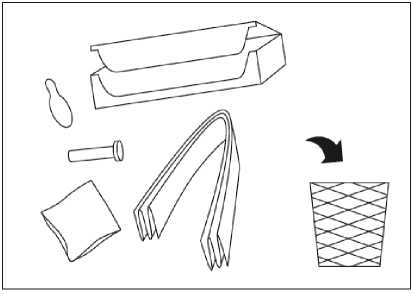
Deseche el embalaje, el capuchón interno de la aguja, la lengüeta, la gasa empapada en alcohol y las instrucciones de uso en la basura doméstica. Devuelva las plumas precargadas a su farmacéutico.
94