Avonex 30 Microgramos/0,5 Ml (Interferon Beta - 1A) Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
AVONEX 30 microgramos polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial BIO-SET contiene 30 microgramos (6 millones de UI) de interferón beta-1a.
Después de la reconstitución con el disolvente (agua para preparaciones inyectables), el vial contiene
1,0 ml de solución. La concentración de interferón beta-1a es de 30 microgramos por mililitro.
Utilizando el Estándar Internacional para Interferón de la Organización Mundial de la Salud (OMS), 30 microgramos de AVONEX contienen 6 millones de UI de actividad antivírica. Se desconoce la actividad frente a otros estándares.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El vial contiene polvo compactado de color blanco o casi blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
AVONEX está indicado para el tratamiento de
• Pacientes diagnosticados con esclerosis múltiple (EM) recidivante. En ensayos clínicos, se caracterizó por dos o más exacerbaciones agudas (recaídas) en los últimos tres años sin evidencia de progresión continua entre recaídas; AVONEX retrasa la progresión de la incapacidad y disminuye la frecuencia de las recaídas.
• Pacientes con un único acontecimiento desmielinizante con un proceso inflamatorio activo, si es lo bastante grave como para justificar el tratamiento con corticosteroides intravenosos, si se han excluido diagnósticos alternativos y si resultan tener un riesgo elevado para el desarrollo de esclerosis múltiple definida clínicamente (ver sección 5.1).
AVONEX se debe interrumpir en los pacientes que desarrollen EM progresiva.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico experto en el tratamiento de la enfermedad.
Posología
Adultos: la dosis recomendada para el tratamiento de la EM recidivante es de 30 microgramos (1 ml de solución) administrados en inyección intramuscular (IM) una vez por semana (ver sección 6.6). No se ha observado ningún beneficio adicional mediante la administración de una dosis más alta (60 microgramos) una vez a la semana.
Ajuste de la dosis: A fin de ayudar a los pacientes a reducir la incidencia y gravedad de los síntomas seudogripales (ver sección 4.8), al iniciarse el tratamiento puede efectuarse una fase de ajuste de la dosis. El ajuste de dosis usando el BIOSET o la jeringa precargada puede iniciarse en incrementos de % de dosis por semana hasta alcanzar la dosis completa (30 microgramos/semana) a la cuarta semana.
Una pauta de ajuste de la dosis alternativa consiste en iniciar la terapia con aproximadamente 'A dosis de AVONEX una vez por semana antes de pasar a la dosis total. Para obtener una eficacia adecuada se debe alcanzar y mantener una dosis de 30 pg una vez por semana tras completarse el período inicial de ajuste de dosis.
Antes de la inyección, y durante un período adicional de 24 horas tras cada inyección, se aconseja el uso de un analgésico antipirético para disminuir los síntomas seudogripales asociados con la administración de AVONEX. Estos síntomas generalmente se presentan durante los primeros meses de tratamiento.
Población pediátrica: No se ha establecido todavía la seguridad y eficacia de AVONEX en adolescentes de 12 a 16 años. Los datos actualmente disponibles están descritos en la sección 4.8 y 5.1, sin embargo no se puede hacer una recomendación posológica.
No se ha establecido todavía la seguridad y eficacia de AVONEX en niños menores de 12 años. No se dispone de datos.
Pacientes de edad avanzada: Los ensayos clínicos no han incluido un número de pacientes de 65 años o más suficiente para determinar si responden de forma distinta que los más jóvenes. Sin embargo, teniendo en cuenta el modo de eliminación del principio activo, no hay motivos teóricos para ajustar la dosis en pacientes de edad avanzada.
Forma de administración
Se debe cambiar cada semana el punto de inyección intramuscular (ver sección 5.3).
El médico puede prescribir una aguja de 25 mm, de calibre 25 si la considera adecuada para administrar una inyección intramuscular al paciente.
En el momento actual, se desconoce durante cuánto tiempo se deben tratar los pacientes. Los pacientes deben ser evaluados clínicamente después de dos años de tratamiento y la continuación del tratamiento debe ser decidida por el médico prescriptor de una forma individualizada. El tratamiento debe ser interrumpido si el paciente desarrolla EM progresiva crónica.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
- Inicio del tratamiento en el embarazo (ver sección 4.6)
- Pacientes con antecedentes de hipersensibilidad al interferón p recombinante o natural, a la albúmina humana o a alguno de los excipientes incluidos en la sección 6.1.
- Pacientes con depresión severa activa y/o ideación suicida (ver secciones 4.4 y 4.8).
4.4 Advertencias y precauciones especiales de empleo
Se debe administrar AVONEX con precaución a pacientes con trastornos depresivos anteriores o activos, en particular a aquéllos con antecedentes de ideación suicida (ver sección 4.3). Es sabido que la depresión y la ideación suicida se presentan con elevada frecuencia en la población con esclerosis múltiple y en asociación con el uso de interferón. Se debe aconsejar a los pacientes que informen de inmediato a su médico ante cualquier síntoma de depresión y/o ideas de suicidio.
Se debe controlar estrechamente a aquellos pacientes que muestren signos de depresión durante el tratamiento y tratarlos de manera adecuada. Se debe considerar la interrupción del tratamiento con AVONEX (ver secciones 4.3 y 4.8).
Se debe administrar AVONEX con precaución a pacientes con antecedentes de crisis epilépticas y a los que estén recibiendo tratamiento con antiepilépticos, en particular si la epilepsia no está adecuadamente controlada con antiepilépticos (ver secciones 4.5 y 4.8).
Se debe tener precaución y se debe vigilar estrechamente cuando se administre AVONEX a pacientes con insuficiencia renal o hepática grave y a aquellos pacientes con mielosupresión grave.
Microangiopatía trombótica (MAT): Se han notificado casos de MAT, manifestada como púrpura trombótica trombocitopénica (PTT) o síndrome urémico hemolítico (SUH), incluidos casos mortales, con medicamentos con interferón beta. Los acontecimientos se notificaron en diferentes momentos del tratamiento y pueden ocurrir transcurridas varias semanas o años después de comenzar el tratamiento con interferón beta. Las manifestaciones clínicas incipientes incluyen trombocitopenia, hipertensión de nueva aparición, fiebre, síntomas del sistema nervioso central (por ejemplo, confusión, paresia) e insuficiencia renal. Los resultados de laboratorio sugestivos de MAT incluyen disminución del recuento de plaquetas, aumento de lactato deshidrogenasa (LDH) en suero debido a la hemólisis y esquistocitos (fragmentación de los eritrocitos) en un frotis de sangre. Por lo tanto, si se observan manifestaciones clínicas de MAT, se recomienda realizar más pruebas para controlar los niveles de plaquetas en sangre, la LDH en suero, frotis de sangre y función renal. Si se diagnostica MAT, es preciso iniciar el tratamiento inmediatamente (considerar recambio plasmático) y se recomienda suspender inmediatamente AVONEX.
Síndrome nefrótico: se han notificado casos de síndrome nefrótico con diferentes nefropatías subyacentes, incluyendo la glomeruloesclerosis focal y segmentaria colapsante (GESFC), enfermedad con cambios mínimos (ECM), glomerulonefritis membranoproliferativa (GNMP) y glomerulopatía membranosa (GNM) durante el tratamiento con medicamentos a base de interferón beta. Los acontecimientos se notificaron en diversos momentos durante el tratamiento y pueden ocurrir después de varios años de tratamiento con interferón beta. Se recomienda monitorizar periódicamente para detectar signos o síntomas precoces tales como edema, proteinuria y deterioro de la función renal, especialmente en pacientes con mayor riesgo de enfermedad renal. Es necesario tratar inmediatamente el síndrome nefrótico y considerar la suspensión del tratamiento con AVONEX.
Se ha notificado lesión hepática con niveles elevados de enzimas hepáticas en suero, hepatitis, hepatitis autoinmune e insuficiencia hepática con interferón beta en estudios poscomercialización (ver sección 4.8). A veces, estas reacciones se han producido en presencia de otros medicamentos asociados a lesión hepática. No se ha determinado la posibilidad de efectos aditivos debidos a varios medicamentos o a otros agentes hepatotóxicos (p. ej., alcohol). Se debe vigilar en los pacientes la aparición de signos de lesión hepática y se tomarán precauciones cuando se utilicen interferones conjuntamente con otros medicamentos asociados a lesión hepática.
Se debe controlar estrechamente a aquellos pacientes con enfermedades cardíacas tales como angina, insuficiencia cardíaca congestiva o arritmia por el empeoramiento de su situación clínica durante el tratamiento con AVONEX. Los síntomas seudogripales asociados al tratamiento con AVONEX pueden resultar estresantes para aquellos pacientes con una alteración cardíaca subyacente.
El uso de interferón se asocia con alteraciones analíticas. Por lo tanto, además de las pruebas analíticas que se realizan normalmente para controlar a aquellos pacientes con EM, se recomienda llevar a cabo recuento leucocitario completo y diferencial, recuento de plaquetas y química sanguínea, incluyendo pruebas de función hepática durante el tratamiento con AVONEX. Aquellos pacientes con mielosupresión pueden necesitar una monitorización más estrecha del recuento hematológico completo, con diferencial y de la cifra de plaquetas.
Los pacientes pueden desarrollar anticuerpos frente a AVONEX. Los anticuerpos de algunos de esos pacientes reducen la actividad del interferón beta-1a in vitro (anticuerpos neutralizantes). Los anticuerpos neutralizantes se asocian con una reducción de los efectos biológicos in vivo de AVONEX y pueden estar potencialmente asociados con una reducción de la eficacia clínica. Se estima que la meseta de incidencia de formación de anticuerpos neutralizantes se alcanza después de 12 meses de tratamiento. Los datos obtenidos de pacientes tratados con AVONEX hasta dos años sugieren que aproximadamente el 8 % desarrolla anticuerpos neutralizantes.
La utilización de diversos análisis para detectar los anticuerpos séricos a los interferones limita la capacidad para comparar la antigenicidad entre diferentes productos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones convencionales en humanos.
La interacción de AVONEX con corticosteroides o con la corticotropina (ACTH) no ha sido estudiada sistemáticamente. Los ensayos clínicos indican que los pacientes con EM pueden recibir AVONEX y corticosteroides o ACTH durante las recidivas.
Se ha comunicado que los interferones reducen la actividad de los enzimas dependientes del citocromo P450 hepático en humanos y animales. Se evaluó el efecto de la administración de AVONEX a alta dosis sobre el metabolismo dependiente de P450 en el mono, y no se observaron cambios en la capacidad de metabolización hepática. Se debe tener precaución cuando se administre AVONEX en combinación con otras especialidades farmacéuticas de índice terapéutico estrecho y que dependan en su mayor parte del sistema citocromo P450 hepático para su aclaramiento, tales como algunas clases de antiepilépticos y antidepresivos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los datos relativos al uso de AVONEX durante el embarazo son limitados. Los datos disponibles indican que puede aumentar el riesgo de aborto espontáneo. El inicio del tratamiento durante el embarazo está contraindicado (ver sección 4.3).
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos. Si la paciente queda embarazada o tienen intención de quedarse embarazada durante el tratamiento con AVONEX, se le debe informar de los riesgos potenciales y considerar la conveniencia de interrumpir el tratamiento (ver sección 5.3). En pacientes con una tasa elevada de recaídas antes del inicio del tratamiento, hay que sopesar el riesgo de una recaída grave después de interrumpir la administración de AVONEX en caso de embarazo frente al posible aumento del riesgo de aborto espontáneo.
Lactancia
Se desconoce si AVONEX se excreta en la leche materna. Dada la posibilidad de reacciones adversas graves en los lactantes, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con AVONEX.
Fertilidad
Se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo (ver sección 5.3).
No hay datos disponibles sobre los efectos del interferón beta-1a sobre la fertilidad masculina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos de AVONEX sobre la capacidad para conducir y utilizar máquinas. Las reacciones adversas que afectan al sistema nervioso central puede influir ligeramente sobre la capacidad para conducir y utilizar máquinas en pacientes susceptibles (ver sección 4.8).
4.8 Reacciones adversas
La incidencia más alta de reacciones adversas asociadas a AVONEX está relacionada con los síntomas seudogripales. Los síntomas seudogripales notificados con más frecuencia son dolores musculares, fiebre, escalofríos, sudoración, astenia, cefalea y náuseas. El ajuste de la dosis de AVONEX al inicio del tratamiento ha demostrado una reducción en la gravedad e incidencia de síntomas seudogripales. Los síntomas seudogripales tienden a ser más acusados al principio del tratamiento y disminuyen en frecuencia con el tratamiento continuado.
Después de las inyecciones pueden aparecer síntomas neurológicos transitorios que recuerden a las exacerbaciones de la EM. En cualquier momento durante el tratamiento pueden aparecer episodios transitorios de hipertonía y/o debilidad muscular intensa que impidan los movimientos voluntarios. Estos episodios tienen una duración limitada, guardan relación temporal con las inyecciones y pueden reaparecer con las siguientes inyecciones. En algunos casos estos síntomas se asocian a síntomas seudogripales.
Las frecuencias de las reacciones adversas se expresan en pacientes-año, de acuerdo con las siguientes categorías:
Muy frecuentes (>1/10 pacientes-año);
Frecuentes (>1/100 a <1/10 pacientes-año);
Poco frecuentes (>1/1.000 a <1/100 pacientes-año);
Raras (>1/10.000 a <1/1.000 pacientes-año);
Muy raras (<1/10.000 pacientes-año);
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
La unidad paciente-tiempo es la suma de las unidades individuales de tiempo que el paciente del estudio ha estado expuesto a AVONEX antes de experimentar la reacción adversa. Por ejemplo, 100 personas-año podría corresponder a una reacción observada en 100 pacientes en tratamiento durante un año o en 200 pacientes tratados durante medio año.
En la siguiente tabla se citan las reacciones adversas identificadas en estudios (ensayos clínicos y estudios de observación, con un periodo de seguimiento comprendido entre dos y seis años) y otras reacciones adversas identificadas mediante notificación espontánea tras la comercialización con una frecuencia desconocida.
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Exploraciones complementarias | |
|
frecuentes |
disminución del recuento de linfocitos, disminución del recuento de leucocitos, disminución del recuento de neutrófilos, disminución del hematocrito, aumento del potasio en sangre, aumento del nitrógeno ureico en sangre |
|
poco frecuentes |
disminución del recuento de plaquetas reducción de peso, aumento de peso, |
|
frecuencia no conocida |
anomalías en las pruebas de función hepática |
|
Trastornos cardíacos | |
|
frecuencia no conocida |
miocardiopatía, insuficiencia cardíaca congestiva (ver sección 4.4), palpitaciones, arritmia, taquicardia |
|
Trastornos de la sangre y del sistema linfático | |
|
frecuencia no conocida |
pancitopenia, trombocitopenia |
|
raras |
microangiopatía trombótica que incluye púrpura trombótica trombocitopénica /síndrome urémico hemolítico.* |
|
Trastornos del sistema nervioso | |
|
muy frecuentes |
cefalea2 |
|
frecuentes |
espasticidad muscular, hipoestesia |
|
frecuencia no conocida |
síntomas neurológicos, síncope3, hipertonía, mareo, parestesias, epilepsia, migraña |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
frecuentes |
rinorrea |
|
raras |
disnea |
|
frecuencia no conocida |
hipertensión arterial pulmonar^ |
|
Trastornos gastrointestinales | |
|
frecuentes |
vómitos, diarrea, náuseas2 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
frecuentes |
erupción, aumento de la sudoración, contusión |
|
poco frecuentes |
alopecia |
|
frecuencia no conocida |
edema angioneurótico, prurito, erupción vesiculosa, urticaria, agravamiento de la psoriasis |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
frecuentes |
calambres musculares, dolor de cuello, mialgia2, artralgia, dolor en extremidad, dolor de espalda rigidez muscular, rigidez osteoarticular |
|
frecuencia no conocida |
lupus eritematoso sistémico, debilidad muscular, artritis |
|
Trastornos renales y urinarios | |
|
raras |
síndrome nefrótico, glomeruloesclerosis (ver sección 4.4 “Advertencias y precauciones especiales de empleo”) |
|
Trastornos endocrinos | |
|
frecuencia no conocida |
hipotiroidismo, hipertiroidismo |
|
Trastornos del metabolismo y de la nutrición | |
|
frecuentes |
anorexia |
|
Infecciones e infestaciones | |
|
frecuencia no conocida |
absceso en el punto de inyección1 |
|
Trastornos vasculares | |
|
frecuentes |
rubor facial |
|
frecuencia no conocida |
vasodilatación |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
muy frecuentes | |
|
frecuentes |
dolor en el lugar de inyección, eritema en el lugar de inyección, hematoma en el lugar de inyección, astenia1, dolor, fatiga1, malestar, sudoración nocturna |
|
poco frecuentes |
sensación de quemazón en el lugar de inyección |
|
frecuencia no conocida |
reacción en el lugar de inyección , inflamación en el lugar de inyección, celulitis en el lugar de inyección', necrosis en el lugar de inyección, hemorragia en el lugar de inyección, dolor torácico |
|
Trastornos del sistema inmunológico | |
|
frecuencia no conocida |
reacción anafiláctica, shock anafiláctico, reacciones de hipersensibilidad (angioedema, disnea, urticaria, erupción, erupción pruriginosa) |
|
Trastornos hepatobiliares | |
|
frecuencia no conocida |
insuficiencia hepática (ver sección 4.4), hepatitis, hepatitis autoinmune |
|
Trastornos de aparato reproductor y de la mama | |
|
poco frecuentes |
metrorragia, menorragia |
|
Trastornos psiquiátricos | |
|
frecuentes |
insomnio, depresión (ver sección 4.4) |
|
frecuencia no conocida |
suicidio, psicosis, ansiedad, confusión, labilidad emocional |
*Etiquetado de clase de los productos que contienen interferón beta (ver sección 4.4).
^Etiquetado de clase de los productos que contienen interferón, ver más abajo Hipertensión arterial pulmonar.
'Se han notificado reacciones en el lugar de inyección, como dolor, inflamación y casos muy raros de absceso o celulitis que hayan requerido intervención quirúrgica.
3Puede aparecer un episodio de síncope después de la inyección de AVONEX; habitualmente es un episodio aislado que normalmente aparece al comienzo del tratamiento y que no se repite con las siguientes inyecciones.
Hipertensión arterial pulmonar
Se han notificado casos de hipertensión arterial pulmonar (HAP) con medicamentos que contienen interferón beta. Los episodios se notificaron en distintos momentos, incluso varios años después de comenzar el tratamiento con interferón beta.
Población pediátrica
Los datos limitados publicados indican que el perfil de seguridad en adolescentes de 12 a 16 años que reciben AVONEX 30 microgramos por vía intramuscular una vez a la semana es similar al observado en adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han notificado casos de sobredosis. Sin embargo, si se produjera, se debe hospitalizar a los pacientes para su observación y tratamiento de soporte adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Interferones, código ATC: L03 AB07.
Los interferones son una familia de proteínas naturales producidas por células eucarióticas en respuesta a infecciones víricas y a diferentes inductores de origen biológico. Los interferones son citocinas que median actividades antivíricas, antiproliferativas e inmunomoduladoras. Se han identificado tres clases principales de interferones: alfa, beta y gamma. Los interferones alfa y beta son interferones de tipo I, y el interferón gamma es un interferón de tipo II. Dichos interferones poseen actividades biológicas superpuestas pero claramente distinguibles. También pueden diferir con respecto a su lugar celular de síntesis.
El interferón beta se produce en varios tipos de células, incluidos los fibroblastos y macrófagos. El interferón beta natural y AVONEX (interferón beta-1a) están glucosilados y tienen una única unión N-grupo carbohidrato complejo. Se sabe que la glucosilación de otras proteínas afecta a su estabilidad, actividad, biodistribución y semivida en la sangre. Sin embargo, no se han definido por completo los efectos del interferón beta que dependen de la glucosilación.
Mecanismo de acción
AVONEX ejerce sus efectos biológicos mediante su unión a receptores específicos en la superficie de las células humanas. Dicha unión inicia una compleja secuencia de fenómenos intracelulares que conduce a la expresión de numerosos productos y marcadores inducidos genéticamente por el interferón. Entre ellos están la clase I del complejo principal de histocompatibilidad (CPH), la proteína Mx, la 2’ / 5’-oligoadenilato sintetasa, la p2-microglobulina y la neopterina. Algunos de estos productos se han medido en el suero y en la fracción celular de la sangre de pacientes tratados con
AVONEX. Después de una sola dosis intramuscular de AVONEX, los niveles séricos de dichos productos permanecen altos durante al menos cuatro días e incluso hasta una semana.
Se desconoce si el mecanismo de acción de AVONEX en la EM sigue la misma ruta que los efectos biológicos descritos anteriormente, porque no está bien establecida la fisiopatología de la EM.
Eficacia clínica y seguridad
Los efectos del tratamiento de la EM con AVONEX liofilizado se demostraron en un ensayo controlado con placebo de 301 pacientes (AVONEX, n = 158; placebo, n = 143) con EM recidivante caracterizada por al menos 2 exacerbaciones en los últimos tres años o al menos una exacerbación en el año anterior a la entrada del paciente en el ensayo, cuando la duración de la enfermedad era inferior a 3 años. En el ensayo clínico se incluyeron pacientes con un EDSS entre 1,0 y 3,5. Debido al diseño del estudio, el seguimiento de los pacientes se realizó en periodos variables. 150 pacientes tratados con AVONEX completaron un año en estudio y 85 completaron dos años en estudio. En el estudio, el porcentaje acumulado de pacientes que desarrollaron progresión de la incapacidad (según el análisis de la tabla de vida de Kaplan-Meier) al final del periodo de dos años fue del 35 % en los pacientes tratados con placebo y del 22 % en los pacientes tratados con AVONEX. La progresión de la incapacidad se midió como un incremento en la escala ampliada del estado de discapacidad (EDSS, Expanded Disability Status Scale) de 1,0 punto, sostenido durante al menos seis meses. También se demostró una reducción de un tercio del índice anual de recaída. Este último efecto clínico fue observado después de más de un año de tratamiento.
Tras un estudio doble ciego aleatorizado y de comparación de dosis con 802 pacientes con EM recidivante (AVONEX 30 microgramos n = 402, AVONEX 60 microgramos n = 400) no se observaron diferencias estadísticamente significativas o tendencias entre las dosis de AVONEX de 30 microgramos y de 60 microgramos en cuanto a los parámetros clínicos y mediante imagen por resonancia magnética.
Los efectos de AVONEX en el tratamiento de la EM también se demostraron en un ensayo doble ciego aleatorizado con 383 pacientes (AVONEX n = 193, placebo n = 190) con un único acontecimiento desmielinizante asociado con al menos dos lesiones cerebrales compatibles en la resonancia magnética. En el grupo de tratamiento con AVONEX se observó una reducción del riesgo de experimentar un segundo acontecimiento. También se observó un efecto sobre los parámetros medidos por resonancia magnética. El riesgo estimado de un segundo acontecimiento fue del 50 % en tres años y del 39 % en dos años en el grupo de placebo y del 35 % (tres años) y 21 % (dos años) en el grupo de AVONEX. En un análisis post-hoc, aquellos pacientes con una resonancia magnética basal con al menos una lesión realzada con gadolinio y nueve lesiones en T2 tuvieron un riesgo de sufrir un segundo acontecimiento del 56 % en el grupo de placebo y del 21 % en el grupo tratado con AVONEX a los dos años. Sin embargo, el impacto del tratamiento precoz con AVONEX se desconoce incluso en este subgrupo de alto riesgo, ya que el estudio fue principalmente diseñado para evaluar el tiempo hasta el segundo acontecimiento, en lugar de la evolución a largo plazo de la enfermedad. Además, por ahora no hay una definición bien establecida de pacientes de alto riesgo, aunque un planteamiento más conservador es aceptar al menos nueve lesiones hiperintensas en T2 en el estudio inicial y al menos una nueva en T2 o una nueva lesión realzada con gadolinio sobre una resonancia de seguimiento recogida al menos tres meses después de la inicial. En cualquier caso el tratamiento debe considerarse solamente para pacientes clasificados como de alto riesgo.
Población pediátrica
Los datos limitados sobre la eficacia/seguridad de AVONEX 15 microgramos por vía intramuscular una vez a la semana (n=8) en comparación con ningún tratamiento (n=8) con un seguimiento durante 4 años mostraron resultados acordes con los observados en adultos, aunque las puntuaciones de EDSS aumentaron en el grupo tratado durante el seguimiento de 4 años; por tanto, esto indica la progresión de la enfermedad. No hay comparación directa con la dosis actualmente recomendada en adultos.
5.2 Propiedades farmacocinéticas
El perfil farmacocinético de AVONEX se ha investigado indirectamente mediante un análisis que mide la actividad antivírica del interferón. Este análisis es limitado, pues es sensible para el interferón pero carece de especificidad para el interferón beta. Las técnicas de análisis alternativas no son lo suficientemente sensibles.
Tras la administración intramuscular de AVONEX, el pico de los niveles de actividad antivírica sérica ocurre entre 5 y 15 horas después de la administración y disminuye con una vida media de aproximadamente 10 horas. Con un ajuste adecuado de la tasa de absorción desde el punto de inyección, la biodisponibilidad calculada es de aproximadamente el 40 %. La biodisponibilidad calculada es mayor sin dichos ajustes. La administración subcutánea no puede suplir la administración intramuscular.
5.3 Datos preclínicos sobre seguridad
Carcinogénesis: no se dispone de datos de carcinogenicidad del interferón beta-1a en animales o humanos.
Toxicidad crónica: no se observó respuesta inmune al interferón beta-1a ni signos de toxicidad en un estudio de toxicidad con dosis repetidas de 26 semanas de duración, administrado en monos rhesus por vía intramuscular una vez a la semana, en combinación con otro agente inmunomodulador, un anticuerpo monoclonal ligando CD40.
Tolerancia local: no se ha evaluado la irritación intramuscular en animales tras la administración repetida en el mismo punto de inyección.
Mutagénesis: se han llevado a cabo pruebas de mutagénesis limitadas pero relevantes. Los resultados han sido negativos.
Alteración de la fertilidad: se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo. También se han observado efectos reproductivos similares relacionados con la dosis con otras formas de interferones alfa y beta. No se han observado efectos teratogénicos ni efectos en el desarrollo fetal, pero la información disponible sobre los efectos del interferón beta-1a en los periodos perinatal y posnatal es limitada.
No hay información disponible sobre los efectos del interferón beta-1a sobre la fertilidad masculina. 2
AVONEX debe administrarse tan pronto como sea posible después de la reconstitución. Sin embargo, la solución reconstituida puede conservarse a 2°C-8°C hasta un máximo de seis horas antes de la inyección.
6.4 Precauciones especiales de conservación
Conservar por debajo de 25°C.
NO CONGELAR el polvo ni el producto reconstituido.
Para las condiciones de conservación tras la reconstitución, ver sección 6.3.
6.5 Naturaleza y contenido del envase
AVONEX está disponible en un envase con cuatro dosis individuales. Cada dosis se presenta en un vial de vidrio transparente de 3 ml con dispositivo BIO-SET y un tapón de goma de bromobutilo de 13 mm. Se suministra con una jeringa de vidrio precargada con 1 ml de disolvente
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para reconstituir AVONEX para inyección, se emplea la jeringa precargada de disolvente que se suministra. No debe utilizarse otro disolvente. El contenido de la jeringa se inyecta en el vial de AVONEX mediante la conexión de la jeringa precargada al dispositivo BIO-SET. Se debe mover el contenido del vial con suavidad hasta que se disuelvan todos los materiales; NO AGITAR. El producto reconstituido se inspeccionará y, en caso de que contenga partículas o su color no vaya de incoloro a amarillento pálido, el vial no debe utilizarse. Tras la reconstitución, se extrae con la jeringa todo el líquido (1 ml) del vial para administrar 30 microgramos de AVONEX. Se suministra la aguja de inyección para inyección intramuscular. La formulación no contiene conservantes. Cada vial de AVONEX contiene solamente una dosis única. Se debe desechar la porción no utilizada de cualquier vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LIMITED
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/002 3
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
AVONEX 30 microgramos/0,5 ml solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada de 0,5 ml contiene 30 microgramos (6 millones de UI) de interferón beta-1a. La concentración de interferón beta-1a es de 30 microgramos por 0,5 ml.
Utilizando el Estándar Internacional para Interferón de la Organización Mundial de la Salud (OMS), 30 microgramos de AVONEX contienen 6 millones de UI de actividad antivírica. Se desconoce la actividad frente a otros estándares.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
AVONEX está indicado para el tratamiento de
• Pacientes diagnosticados con esclerosis múltiple (EM) recidivante. En ensayos clínicos, se caracterizó por dos o más exacerbaciones agudas (recaídas) en los últimos tres años sin evidencia de progresión continua entre recaídas; AVONEX retrasa la progresión de la incapacidad y disminuye la frecuencia de las recaídas.
• Pacientes con un único acontecimiento desmielinizante con un proceso inflamatorio activo, si es lo bastante grave como para justificar el tratamiento con corticosteroides intravenosos, si se han excluido diagnósticos alternativos y si resultan tener un riesgo elevado para el desarrollo de esclerosis múltiple definida clínicamente (ver sección 5.1).
AVONEX se debe interrumpir en los pacientes que desarrollen EM progresiva.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico experto en el tratamiento de la enfermedad.
Posología
Adultos: la dosis recomendada para el tratamiento de la EM recidivante es de 30 microgramos (0,5 ml de solución) administrados en inyección intramuscular (IM) una vez por semana (ver sección 6.6). No se ha observado ningún beneficio adicional mediante la administración de una dosis más alta (60 microgramos) una vez a la semana.
Ajuste de la dosis: A fin de ayudar a los pacientes a reducir la incidencia y gravedad de los síntomas seudogripales (ver sección 4.8), al iniciarse el tratamiento puede efectuarse una fase de ajuste de la
dosis. El ajuste de la dosis usando el BIOSET o la jeringa precargada puede iniciarse en incrementos de % de dosis por semana hasta alcanzar la dosis completa (30 microgramos/semana) a la cuarta semana.
Una pauta de ajuste de la dosis alternativa consiste en iniciar la terapia con aproximadamente 'A dosis de AVONEX una vez por semana antes de pasar a la dosis total. Para obtener una eficacia adecuada se debe alcanzar y mantener una dosis de 30 pg una vez por semana tras completarse el período inicial de ajuste de la dosis.
El dispositivo de ajuste de la dosis AVOSTARTCLIP está diseñado para usarse solamente con la jeringa precargada, y puede usarse para implementar los incrementos de % y 4 dosis. Cada AVOSTARTCLIP es de uso único y se debe desechar junto con el resto de AVONEX que quede en la jeringa.
Antes de la inyección, y durante un período adicional de 24 horas tras cada inyección, se aconseja el uso de un analgésico antipirético para disminuir los síntomas seudogripales asociados con la administración de AVONEX. Estos síntomas generalmente se presentan durante los primeros meses de tratamiento.
Población pediátrica: No se ha establecido todavía la seguridad y eficacia de AVONEX en adolescentes de 12 a 16 años.
Los datos actualmente disponibles están descritos en la sección 4.8 y 5.1, sin embargo no se puede hacer una recomendación posológica.
No se ha establecido todavía la seguridad y eficacia de AVONEX en niños menores de 12 años. No se dispone de datos.
Pacientes de edad avanzada: Los ensayos clínicos no han incluido un número de pacientes de 65 años o más suficiente para determinar si responden de forma distinta que los más jóvenes. Sin embargo, teniendo en cuenta el modo de eliminación del principio activo, no hay motivos teóricos para ajustar la dosis en pacientes de edad avanzada.
Forma de administración
Se debe cambiar cada semana el punto de inyección intramuscular (ver sección 5.3).
El médico puede prescribir una aguja de 25 mm, de calibre 25 si la considera adecuada para administrar una inyección intramuscular al paciente.
En el momento actual, se desconoce durante cuánto tiempo se deben tratar los pacientes. Los pacientes deben ser evaluados clínicamente después de dos años de tratamiento y la continuación del tratamiento debe ser decidida por el médico prescriptor de una forma individualizada. El tratamiento debe ser interrumpido si el paciente desarrolla EM progresiva crónica.
4.3 Contraindicaciones
- Inicio del tratamiento en el embarazo (ver sección 4.6)
- Pacientes con antecedentes de hipersensibilidad al interferón p recombinante o natural o a alguno de los excipientes incluidos en la sección 6.1.
- Pacientes con depresión severa activa y/o ideación suicida (ver secciones 4.4 y 4.8).
4.4 Advertencias y precauciones especiales de empleo
Se debe administrar AVONEX con precaución a pacientes con trastornos depresivos anteriores o activos, en particular a aquéllos con antecedentes de ideación suicida (ver sección 4.3). Es sabido que la depresión y la ideación suicida se presentan con elevada frecuencia en la población con esclerosis múltiple y en asociación con el uso de interferón. Se debe aconsejar a los pacientes que informen de inmediato a su médico ante cualquier síntoma de depresión y/o ideas de suicidio.
Se debe controlar estrechamente a aquellos pacientes que muestren signos de depresión durante el tratamiento y tratarlos de manera adecuada. Se debe considerar la interrupción del tratamiento con AVONEX (ver secciones 4.3 y 4.8).
Se debe administrar AVONEX con precaución a pacientes con antecedentes de crisis epilépticas y a los que estén recibiendo tratamiento con antiepilépticos, en particular si la epilepsia no está adecuadamente controlada con antiepilépticos (ver secciones 4.5 y 4.8).
Se debe tener precaución y se debe vigilar estrechamente cuando se administre AVONEX a pacientes con insuficiencia renal o hepática grave y a aquellos pacientes con mielosupresión grave.
Microangiopatía trombótica (MAT): Se han notificado casos de MAT, manifestada como púrpura trombótica trombocitopénica (PTT) o síndrome urémico hemolítico (SUH), incluidos casos mortales, con medicamentos con interferón beta. Los acontecimientos se notificaron en diferentes momentos del tratamiento y pueden ocurrir transcurridas varias semanas o años después de comenzar el tratamiento con interferón beta. Las manifestaciones clínicas incipientes incluyen trombocitopenia, hipertensión de nueva aparición, fiebre, síntomas del sistema nervioso central (por ejemplo, confusión, paresia) e insuficiencia renal. Los resultados de laboratorio sugestivos de MAT incluyen disminución del recuento de plaquetas, aumento de lactato deshidrogenasa (LDH) en suero debido a la hemólisis y esquistocitos (fragmentación de los eritrocitos) en un frotis de sangre. Por lo tanto, si se observan manifestaciones clínicas de MAT, se recomienda realizar más pruebas para controlar los niveles de plaquetas en sangre, la LDH en suero, frotis de sangre y función renal. Si se diagnostica MAT, es preciso iniciar el tratamiento inmediatamente (considerar recambio plasmático) y se recomienda suspender inmediatamente AVONEX.
Síndrome nefrótico: se han notificado casos de síndrome nefrótico con diferentes nefropatías subyacentes, incluyendo la glomeruloesclerosis focal y segmentaria colapsante (GESFC), enfermedad con cambios mínimos (ECM), glomerulonefritis membranoproliferativa (GNMP) y glomerulopatía membranosa (GNM) durante el tratamiento con medicamentos a base de interferón beta. Los acontecimientos se notificaron en diversos momentos durante el tratamiento y pueden ocurrir después de varios años de tratamiento con interferón beta. Se recomienda monitorizar periódicamente para detectar signos o síntomas precoces tales como edema, proteinuria y deterioro de la función renal, especialmente en pacientes con mayor riesgo de enfermedad renal. Es necesario tratar inmediatamente el síndrome nefrótico y considerar la suspensión del tratamiento con AVONEX.
Se ha notificado lesión hepática con niveles elevados de enzimas hepáticas en suero, hepatitis, hepatitis autoinmune e insuficiencia hepática con interferón beta en estudios poscomercialización (ver sección 4.8). A veces, estas reacciones se han producido en presencia de otros medicamentos asociados a lesión hepática. No se ha determinado la posibilidad de efectos aditivos debidos a varios medicamentos o a otros agentes hepatotóxicos (p. ej., alcohol). Se debe vigilar en los pacientes la aparición de signos de lesión hepática y se tomarán precauciones cuando se utilicen interferones conjuntamente con otros medicamentos asociados a lesión hepática.
Se debe controlar estrechamente a aquellos pacientes con enfermedades cardíacas tales como angina, insuficiencia cardíaca congestiva o arritmia por el empeoramiento de su situación clínica durante el tratamiento con AVONEX. Los síntomas seudogripales asociados al tratamiento con AVONEX pueden resultar estresantes para aquellos pacientes con una alteración cardíaca subyacente.
El uso de interferón se asocia con alteraciones analíticas. Por lo tanto, además de las pruebas analíticas que se realizan normalmente para controlar a aquellos pacientes con EM, se recomienda llevar a cabo recuento leucocitario completo y diferencial, recuento de plaquetas y química sanguínea, incluyendo pruebas de función hepática durante el tratamiento con AVONEX. Aquellos pacientes con mielosupresión pueden necesitar una monitorización más estrecha del recuento hematológico completo, con diferencial y de la cifra de plaquetas.
Los pacientes pueden desarrollar anticuerpos frente a AVONEX. Los anticuerpos de algunos de esos pacientes reducen la actividad del interferón beta-1a in vitro (anticuerpos neutralizantes). Los anticuerpos neutralizantes se asocian con una reducción de los efectos biológicos in vivo de AVONEX y pueden estar potencialmente asociados con una reducción de la eficacia clínica. Se estima que la meseta de incidencia de formación de anticuerpos neutralizantes se alcanza después de 12 meses de tratamiento. Ensayos clínicos recientes con pacientes tratados con AVONEX hasta tres años sugieren que aproximadamente del 5 % al 8 % desarrolla anticuerpos neutralizantes.
La utilización de diversos análisis para detectar los anticuerpos séricos a los interferones limita la capacidad para comparar la antigenicidad entre diferentes productos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones convencionales en humanos.
La interacción de AVONEX con corticosteroides o con la corticotropina (ACTH) no ha sido estudiada sistemáticamente. Los ensayos clínicos indican que los pacientes con EM pueden recibir AVONEX y corticosteroides o ACTH durante las recidivas.
Se ha comunicado que los interferones reducen la actividad de los enzimas dependientes del citocromo P450 hepático en humanos y animales. Se evaluó el efecto de la administración de AVONEX a alta dosis sobre el metabolismo dependiente de P450 en el mono, y no se observaron cambios en la capacidad de metabolización hepática. Se debe tener precaución cuando se administre AVONEX en combinación con otras especialidades farmacéuticas de índice terapéutico estrecho y que dependan en su mayor parte del sistema citocromo P450 hepático para su aclaramiento, tales como algunas clases de antiepilépticos y antidepresivos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los datos relativos al uso de AVONEX durante el embarazo son limitados. Los datos disponibles indican que puede aumentar el riesgo de aborto espontáneo. El inicio del tratamiento durante el embarazo está contraindicado (ver sección 4.3).
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos. Si la paciente queda embarazada o tienen intención de quedarse embarazada durante el tratamiento con AVONEX, se le debe informar de los riesgos potenciales y considerar la conveniencia de interrumpir el tratamiento (ver sección 5.3). En pacientes con una tasa elevada de recaídas antes del inicio del tratamiento, hay que sopesar el riesgo de una recaída grave después de interrumpir la administración de AVONEX en caso de embarazo frente al posible aumento del riesgo de aborto espontáneo.
Lactancia
Se desconoce si AVONEX se excreta en la leche materna. Dada la posibilidad de reacciones adversas graves en los lactantes, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con AVONEX.
Fertilidad
Se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo (ver sección 5.3).
No hay datos disponibles sobre los efectos del interferón beta-la sobre la fertilidad masculina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos de AVONEX sobre la capacidad para conducir y utilizar máquinas. Las reacciones adversas que afectan al sistema nervioso central puede influir ligeramente sobre la capacidad para conducir y utilizar máquinas en pacientes susceptibles (ver sección 4.8).
4.8 Reacciones adversas
La incidencia más alta de reacciones adversas asociadas a AVONEX está relacionada con los síntomas seudogripales. Los síntomas seudogripales notificados con más frecuencia son dolores musculares, fiebre, escalofríos, sudoración, astenia, cefalea y náuseas. El ajuste de la dosis de AVONEX al inicio del tratamiento ha demostrado una reducción en la gravedad e incidencia de síntomas seudogripales. Los síntomas seudogripales tienden a ser más acusados al principio del tratamiento y disminuyen en frecuencia con el tratamiento continuado.
Después de las inyecciones pueden aparecer síntomas neurológicos transitorios que recuerden a las exacerbaciones de la EM. En cualquier momento durante el tratamiento pueden aparecer episodios transitorios de hipertonía y/o debilidad muscular intensa que impidan los movimientos voluntarios. Estos episodios tienen una duración limitada, guardan relación temporal con las inyecciones y pueden reaparecer con las siguientes inyecciones. En algunos casos estos síntomas se asocian a síntomas seudogripales.
Las frecuencias de las reacciones adversas se expresan en pacientes-año, de acuerdo con las siguientes categorías:
Muy frecuentes (>1/10 pacientes-año);
Frecuentes (>1/100 a <1/10 pacientes-año);
Poco frecuentes (>1/1.000 a <1/100 pacientes-año);
Raras (>1/10.000 a <1/1.000 pacientes-año);
Muy raras (<1/10.000 pacientes-año);
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
La unidad paciente-tiempo es la suma de las unidades individuales de tiempo que el paciente del estudio ha estado expuesto a AVONEX antes de experimentar la reacción adversa. Por ejemplo, 100 personas-año podría corresponder a una reacción observada en 100 pacientes en tratamiento durante un año o en 200 pacientes tratados durante medio año.
En la siguiente tabla se citan las reacciones adversas identificadas en estudios (ensayos clínicos y estudios de observación, con un periodo de seguimiento comprendido entre dos y seis años) y otras reacciones adversas identificadas mediante notificación espontánea tras la comercialización con una frecuencia desconocida.
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Exploraciones complementarias | |
|
frecuentes |
disminución del recuento de linfocitos, disminución del recuento de leucocitos, disminución del recuento de neutrófilos, disminución del hematocrito, aumento del potasio en sangre, aumento del nitrógeno ureico en sangre |
|
Poco frecuentes |
disminución del recuento de plaquetas |
|
frecuencia no conocida |
reducción de peso, aumento de peso, anomalías en las pruebas de función hepática |
|
Trastornos cardíacos | |
|
frecuencia no conocida |
miocardiopatía, insuficiencia cardíaca congestiva (ver sección 4.4), palpitaciones, arritmia, taquicardia |
|
Trastornos de la sangre y del sistema linfático | |
|
frecuencia no conocida |
pancitopenia, trombocitopenia |
|
raras |
microangiopatía trombótica que incluye púrpura trombótica trombocitopénica /síndrome urémico hemolítico.* |
|
Trastornos del sistema nervioso | |
|
muy frecuentes |
cefalea2 |
|
frecuentes |
espasticidad muscular, hipoestesia |
|
frecuencia no conocida |
síntomas neurológicos, síncope3, hipertonía, mareo, parestesias, epilepsia, migraña |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
frecuentes |
rinorrea |
|
raras |
disnea |
|
frecuencia no conocida |
hipertensión arterial pulmonar^ |
|
Trastornos gastrointestinales | |
|
frecuentes |
vómitos, diarrea, náuseas2 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
frecuentes |
erupción, aumento de la sudoración, contusión |
|
poco frecuentes |
alopecia |
|
frecuencia no conocida |
edema angioneurótico, prurito, erupción vesiculosa, urticaria, agravamiento de la psoriasis |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
frecuentes |
calambres musculares, dolor de cuello, mialgia2, artralgia, dolor en extremidad, dolor de espalda rigidez muscular, rigidez osteoarticular |
|
frecuencia no conocida |
lupus eritematoso sistémico, debilidad muscular, artritis |
|
Trastornos renales y urinarios | |
|
raras |
síndrome nefrótico, glomeruloesclerosis (ver sección 4.4 “Advertencias y precauciones especiales de empleo”) |
|
Trastornos endocrinos | |
|
frecuencia no conocida |
hipotiroidismo, hipertiroidismo |
|
Trastornos del metabolismo y de la nutrición | |
|
frecuentes |
anorexia |
|
Infecciones e infestaciones | |
|
frecuencia no conocida |
absceso en el punto de inyección1 |
|
Trastornos vasculares | |
|
frecuentes |
rubor facial |
|
frecuencia no conocida |
vasodilatación |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
muy frecuentes | |
|
frecuentes |
dolor en el lugar de inyección, eritema en el lugar de inyección, hematoma en el lugar de inyección, astenia4, dolor, fatiga4, malestar, sudoración nocturna |
|
poco frecuentes |
sensación de quemazón en el lugar de inyección |
|
frecuencia no conocida |
reacción en el lugar de inyección , inflamación en el lugar de inyección, celulitis en el lugar de inyección', necrosis en el lugar de inyección, hemorragia en el lugar de inyección, dolor torácico |
|
Trastornos del sistema inmunológico | |
|
frecuencia no conocida |
reacción anafiláctica, shock anafiláctico, reacciones de hipersensibilidad (angioedema, disnea, urticaria, erupción, erupción pruriginosa) |
|
Trastornos hepatobiliares | |
|
frecuencia no conocida |
insuficiencia hepática (ver sección 4.4), hepatitis, hepatitis autoinmune |
|
Trastornos de aparato reproductor y de la mama | |
|
poco frecuentes |
metrorragia, menorragia |
|
Trastornos psiquiátricos | |
|
frecuentes |
insomnio, depresión (ver sección 4.4) |
|
frecuencia no conocida |
suicidio, psicosis, ansiedad, confusión, labilidad emocional |
*Etiquetado de clase de los productos que contienen interferón beta (ver sección 4.4).
^ Etiquetado de clase de los productos que contienen interferón, ver más abajo Hipertensión arterial pulmonar.
'Se han notificado reacciones en el lugar de inyección, como dolor, inflamación y casos muy raros de absceso o celulitis que hayan requerido intervención quirúrgica.
3Puede aparecer un episodio de síncope después de la inyección de AVONEX; habitualmente es un episodio aislado que normalmente aparece al comienzo del tratamiento y que no se repite con las siguientes inyecciones.
Hipertensión arterial pulmonar
Se han notificado casos de hipertensión arterial pulmonar (HAP) con medicamentos que contienen interferón beta. Los episodios se notificaron en distintos momentos, incluso varios años después de comenzar el tratamiento con interferón beta.
Población pediátrica
Los datos limitados publicados indican que el perfil de seguridad en adolescentes de 12 a 16 años que reciben AVONEX 30 microgramos por vía intramuscular una vez a la semana es similar al observado en adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han notificado casos de sobredosis. Sin embargo, si se produjera, se debe hospitalizar a los pacientes para su observación y tratamiento de soporte adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Interferones, código ATC: L03 AB07.
Los interferones son una familia de proteínas naturales producidas por células eucarióticas en respuesta a infecciones víricas y a diferentes inductores de origen biológico. Los interferones son citocinas que median actividades antivíricas, antiproliferativas e inmunomoduladoras. Se han identificado tres clases principales de interferones: alfa, beta y gamma. Los interferones alfa y beta son interferones de tipo I, y el interferón gamma es un interferón de tipo II. Dichos interferones poseen actividades biológicas superpuestas pero claramente distinguibles. También pueden diferir con respecto a su lugar celular de síntesis.
El interferón beta se produce en varios tipos de células, incluidos los fibroblastos y macrófagos. El interferón beta natural y AVONEX (interferón beta-1a) están glucosilados y tienen una única unión N-grupo carbohidrato complejo. Se sabe que la glucosilación de otras proteínas afecta a su estabilidad, actividad, biodistribución y semivida en la sangre. Sin embargo, no se han definido por completo los efectos del interferón beta que dependen de la glucosilación.
Mecanismo de acción
AVONEX ejerce sus efectos biológicos mediante su unión a receptores específicos en la superficie de las células humanas. Dicha unión inicia una compleja secuencia de fenómenos intracelulares que conduce a la expresión de numerosos productos y marcadores inducidos genéticamente por el interferón. Entre ellos están la clase I del complejo principal de histocompatibilidad (CPH), la proteína Mx, la 2’ / 5’-oligoadenilato sintetasa, la p2-microglobulina y la neopterina. Algunos de estos productos se han medido en el suero y en la fracción celular de la sangre de pacientes tratados con
AVONEX. Después de una sola dosis intramuscular de AVONEX, los niveles séricos de dichos productos permanecen altos durante al menos cuatro días e incluso hasta una semana.
Se desconoce si el mecanismo de acción de AVONEX en la EM sigue la misma ruta que los efectos biológicos descritos anteriormente, porque no está bien establecida la fisiopatología de la EM.
Eficacia clínica y seguridad
Los efectos del tratamiento con AVONEX liofilizado se demostraron en un único ensayo controlado con placebo en 301 pacientes (AVONEX, n = 158; placebo, n = 143) con EM recidivante caracterizada por al menos 2 exacerbaciones en los últimos tres años o al menos una exacerbación en el año anterior a la entrada del paciente en el ensayo, cuando la duración de la enfermedad era inferior a 3 años. En el ensayo clínico se incluyeron pacientes con un EDSS entre 1,0 y 3,5. Debido al diseño del estudio, el seguimiento de los pacientes se realizó en periodos de tiempo variables. 150 pacientes tratados con AVONEX completaron un año en estudio y 85 completaron dos años en estudio. En el estudio, el porcentaje acumulado de pacientes que desarrollaron progresión de la incapacidad (según el análisis de la tabla de vida de Kaplan-Meier) al final del periodo de dos años fue del 35 % en los pacientes tratados con placebo y del 22 % en los pacientes tratados con AVONEX. La progresión de la incapacidad se midió como un incremento en la escala ampliada del estado de discapacidad (EDSS, Expanded Disability Status Scale) de 1,0 punto, sostenido durante al menos seis meses. También se demostró una reducción de un tercio del índice anual de recaída. Este último efecto clínico fue observado después de más de un año de tratamiento.
Tras un estudio doble ciego aleatorizado y de comparación de dosis con 802 pacientes con EM recidivante (AVONEX 30 pg n = 402, AVONEX 60 pg n = 400) no se observaron diferencias estadísticamente significativas o tendencias entre las dosis de AVONEX de 30 pg y de 60 pg en cuanto a los parámetros clínicos y mediante imagen por resonancia magnética.
Los efectos de AVONEX en el tratamiento de la EM también se demostraron en un ensayo doble ciego aleatorizado con 383 pacientes (AVONEX n = 193, placebo n = 190) con un único acontecimiento desmielinizante asociado con al menos dos lesiones cerebrales compatibles en la resonancia magnética. En el grupo de tratamiento con AVONEX se observó una reducción del riesgo de experimentar un segundo acontecimiento. También se observó un efecto sobre los parámetros medidos por resonancia magnética. El riesgo estimado de un segundo acontecimiento fue del 50 % en tres años y del 39 % en dos años en el grupo de placebo y del 35 % (tres años) y 21 % (dos años) en el grupo de AVONEX. En un análisis post-hoc, aquellos pacientes con una resonancia magnética basal con al menos una lesión realzada con gadolinio y nueve lesiones en T2 tuvieron un riesgo de sufrir un segundo acontecimiento del 56 % en el grupo de placebo y del 21 % en el grupo tratado con AVONEX a los dos años. Sin embargo, el impacto del tratamiento precoz con AVONEX se desconoce incluso en este subgrupo de alto riesgo, ya que el estudio fue principalmente diseñado para evaluar el tiempo hasta el segundo acontecimiento, en lugar de la evolución a largo plazo de la enfermedad. Además, por ahora no hay una definición bien establecida de pacientes de alto riesgo, aunque un planteamiento más conservador es aceptar al menos nueve lesiones hiperintensas en T2 en el estudio inicial y al menos una nueva en T2 o una nueva lesión realzada con gadolinio sobre una resonancia de seguimiento recogida al menos tres meses después de la inicial. En cualquier caso el tratamiento debe considerarse solamente para pacientes clasificados como de alto riesgo.
Población pediátrica
Los datos limitados sobre la eficacia/seguridad de AVONEX 15 microgramos por vía intramuscular una vez a la semana (n=8) en comparación con ningún tratamiento (n=8) con un seguimiento durante 4 años mostraron resultados acordes con los observados en adultos, aunque las puntuaciones de EDSS aumentaron en el grupo tratado durante el seguimiento de 4 años; por tanto, esto indica la progresión de la enfermedad. No hay comparación directa con la dosis actualmente recomendada en adultos.
5.2 Propiedades farmacocinéticas
El perfil farmacocinético de AVONEX se ha investigado indirectamente mediante un análisis que mide la actividad antivírica del interferón. Este análisis es limitado, pues es sensible para el interferón pero carece de especificidad para el interferón beta. Las técnicas de análisis alternativas no son lo suficientemente sensibles.
Tras la administración intramuscular de AVONEX, el pico de los niveles de actividad antivírica sérica ocurre entre 5 y 15 horas después de la administración y disminuye con una vida media de aproximadamente 10 horas. Con un ajuste adecuado de la tasa de absorción desde el punto de inyección, la biodisponibilidad calculada es de aproximadamente el 40 %. La biodisponibilidad calculada es mayor sin dichos ajustes. La administración subcutánea no puede suplir la administración intramuscular.
5.3 Datos preclínicos sobre seguridad
Carcinogénesis: no se dispone de datos de carcinogenicidad del interferón beta-1a en animales o humanos.
Toxicidad crónica: no se observó respuesta inmune al interferón beta-1a ni signos de toxicidad en un estudio de toxicidad con dosis repetidas de 26 semanas de duración, administrado en monos rhesus por vía intramuscular una vez a la semana, en combinación con otro agente inmunomodulador, un anticuerpo monoclonal ligando CD40.
Tolerancia local: no se ha evaluado la irritación intramuscular en animales tras la administración repetida en el mismo punto de inyección.
Mutagénesis: se han llevado a cabo pruebas de mutagénesis limitadas pero relevantes. Los resultados han sido negativos.
Alteración de la fertilidad: Se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo. También se han observado efectos reproductivos similares relacionados con la dosis con otras formas de interferones alfa y beta. No se han observado efectos teratogénicos ni efectos en el desarrollo fetal, pero la información disponible sobre los efectos del interferón beta-1a en los periodos perinatal y posnatal es limitada.
No hay información disponible sobre los efectos del interferón beta-1a sobre la fertilidad masculina. 5
Conservar en nevera (entre 2°C y 8°C). NO CONGELAR.
AVONEX puede conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
Conservar en el embalaje original (bandeja de plástico sellada) para protegerlo de la luz (ver sección 6.5).
6.5 Naturaleza y contenido del envase
Jeringa precargada de 1 ml de vidrio (Tipo I) con capuchón a prueba de manipulaciones y tope de émbolo (bromobutilo) que contiene 0,5 ml de solución.
Tamaño del envase: caja de cuatro o doce jeringas precargadas de 0,5 ml. Cada jeringa está acondicionada en una bandeja de plástico sellada que también contiene una aguja de inyección para vía intramuscular.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
AVONEX se presenta listo para usar en una jeringa precargada para solución inyectable.
Una vez retirado del refrigerador, se debe dejar que AVONEX en jeringa precargada se ponga a temperatura ambiente (15°C -30°C) durante 30 minutos aproximadamente.
No utilizar fuentes externas de calor tales como agua caliente para calentar AVONEX 30 pg solución inyectable.
Si la solución inyectable contiene partículas o si tiene cualquier color que no sea claro e incoloro, la jeringa precargada no debe usarse. Se suministra la aguja de inyección para inyección intramuscular.
La formulación no contiene conservante. Cada jeringa precargada de AVONEX contiene una sola dosis única. La porción no utilizada de cualquier jeringa precargada debe desecharse.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LIMITED
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido 6
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13/marzo/1997 Fecha de la última renovación: 13/marzo/2007
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
AVONEX 30 microgramos/0,5 ml solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pluma precargada de un solo uso contiene 30 microgramos (6 millones de UI) de interferón beta-1a en 0,5 ml de solución.
La concentración de interferón beta-1a es de 30 microgramos por 0,5 ml.
Utilizando el Estándar Internacional para Interferón de la Organización Mundial de la Salud (OMS),
30 microgramos de AVONEX contienen 6 millones de UI de actividad antivírica. Se desconoce la actividad frente a otros estándares.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada. Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
AVONEX está indicado para el tratamiento de
• Pacientes diagnosticados con esclerosis múltiple (EM) recidivante. En ensayos clínicos, se caracterizó por dos o más exacerbaciones agudas (recaídas) en los últimos tres años sin evidencia de progresión continua entre recaídas; AVONEX retrasa la progresión de la incapacidad y disminuye la frecuencia de las recaídas.
• Pacientes con un único acontecimiento desmielinizante con un proceso inflamatorio activo, si es lo bastante grave como para justificar el tratamiento con corticosteroides intravenosos, si se han excluido diagnósticos alternativos, y si resultan tener un riesgo elevado para el desarrollo de esclerosis múltiple definida clínicamente (ver sección 5.1).
AVONEX se debe interrumpir en los pacientes que desarrollen EM progresiva.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico experto en el tratamiento de la enfermedad.
Posología
Adultos: la dosis recomendada para el tratamiento de la EM recidivante es de 30 microgramos (0,5 ml de solución) administrados en inyección intramuscular (IM) una vez por semana (ver sección 6.6). No se ha observado ningún beneficio adicional mediante la administración de una dosis más alta (60 microgramos) una vez a la semana.
Ajuste de la dosis: A fin de ayudar a los pacientes a reducir la incidencia y gravedad de los síntomas seudogripales (ver sección 4.8), al iniciarse el tratamiento puede efectuarse una fase de ajuste de la dosis. El ajuste de la dosis usando el BIOSET o la jeringa precargada puede iniciarse en incrementos de % de dosis por semana hasta alcanzar la dosis completa (30 microgramos/semana) a la cuarta semana.
Una pauta de ajuste de la dosis alternativa consiste en iniciar la terapia con aproximadamente 'A dosis de AVONEX una vez por semana antes de pasar a la dosis total. Para obtener una eficacia adecuada se debe alcanzar y mantener una dosis de 30 pg una vez por semana tras completarse el período inicial de ajuste de dosis. Una vez que se alcance la dosis completa, los pacientes pueden comenzar a utilizar AVONEX PEN.
Antes de la inyección, y durante un período adicional de 24 horas tras cada inyección, se aconseja el uso de un analgésico antipirético para disminuir los síntomas seudogripales asociados con la administración de AVONEX. Estos síntomas generalmente se presentan durante los primeros meses de tratamiento.
Población pediátrica: No se ha establecido todavía la seguridad y eficacia de AVONEX en adolescentes de 12 a 16 años. Los datos actualmente disponibles están descritos en la sección 4.8 y 5.1, sin embargo no se puede hacer una recomendación posológica.
No se ha establecido todavía la seguridad y eficacia de AVONEX en niños menores de 12 años. No se dispone de datos.
Pacientes de edad avanzada:Los ensayos clínicos no han incluido un número de pacientes de 65 años o más suficiente para determinar si responden de forma distinta que los más jóvenes. Sin embargo, teniendo en cuenta el modo de eliminación del principio activo, no hay motivos teóricos para ajustar la dosis en pacientes de edad avanzada.
Forma de administración
En el momento actual, se desconoce durante cuánto tiempo se deben tratar los pacientes. Los pacientes deben ser evaluados clínicamente después de dos años de tratamiento y la continuación del tratamiento debe ser decidida por el médico prescriptor de una forma individualizada. El tratamiento debe ser interrumpido si el paciente desarrolla EM progresiva crónica.
AVONEX PEN es una pluma precargada, de un solo uso y únicamente se deberá utilizar tras haber recibido la formación adecuada.
El lugar de inyección intramuscular recomendado utilizando el AVONEX PEN es la región superior externa del músculo del muslo. Se deberá cambiar el lugar de inyección cada semana.
Para administrar AVONEX con AVONEX PEN, se deben seguir las instrucciones del prospecto contenido en el envase.
4.3 Contraindicaciones
- Inicio del tratamiento en el embarazo (ver sección 4.6)
- Pacientes con antecedentes de hipersensibilidad al interferón p recombinante o natural o a alguno de los excipientes incluidos en la sección 6.1.
- Pacientes con depresión severa activa y/o ideación suicida (ver secciones 4.4 y 4.8).
4.4 Advertencias y precauciones especiales de empleo
Se debe administrar AVONEX con precaución a pacientes con trastornos depresivos anteriores o activos, en particular a aquéllos con antecedentes de ideación suicida (ver sección 4.3). Es sabido que la depresión y la ideación suicida se presentan con elevada frecuencia en la población con esclerosis múltiple y en asociación con el uso de interferón. Se debe aconsejar a los pacientes que informen de inmediato a su médico ante cualquier síntoma de depresión y/o ideas de suicidio.
Se debe controlar estrechamente a aquellos pacientes que muestren signos de depresión durante el tratamiento y tratarlos de manera adecuada. Se debe considerar la interrupción del tratamiento con AVONEX (ver secciones 4.3 y 4.8).
Se debe administrar AVONEX con precaución a pacientes con antecedentes de crisis epilépticas y a los que estén recibiendo tratamiento con antiepilépticos, en particular si la epilepsia no está adecuadamente controlada con antiepilépticos (ver secciones 4.5 y 4.8).
Se debe tener precaución y se debe vigilar estrechamente cuando se administre AVONEX a pacientes con insuficiencia renal o hepática grave y a aquellos pacientes con mielosupresión grave.
Microangiopatía trombótica (MAT): Se han notificado casos de MAT, manifestada como púrpura trombótica trombocitopénica (PTT) o síndrome urémico hemolítico (SUH), incluidos casos mortales, con medicamentos con interferón beta. Los acontecimientos se notificaron en diferentes momentos del tratamiento y pueden ocurrir transcurridas varias semanas o años después de comenzar el tratamiento con interferón beta. Las manifestaciones clínicas incipientes incluyen trombocitopenia, hipertensión de nueva aparición, fiebre, síntomas del sistema nervioso central (por ejemplo, confusión, paresia) e insuficiencia renal. Los resultados de laboratorio sugestivos de MAT incluyen disminución del recuento de plaquetas, aumento de lactato deshidrogenasa (LDH) en suero debido a la hemólisis y esquistocitos (fragmentación de los eritrocitos) en un frotis de sangre. Por lo tanto, si se observan manifestaciones clínicas de MAT, se recomienda realizar más pruebas para controlar los niveles de plaquetas en sangre, la LDH en suero, frotis de sangre y función renal. Si se diagnostica MAT, es preciso iniciar el tratamiento inmediatamente (considerar recambio plasmático) y se recomienda suspender inmediatamente AVONEX.
Síndrome nefrótico: se han notificado casos de síndrome nefrótico con diferentes nefropatías subyacentes, incluyendo la glomeruloesclerosis focal y segmentaria colapsante (GESFC), enfermedad con cambios mínimos (ECM), glomerulonefritis membranoproliferativa (GNMP) y glomerulopatía membranosa (GNM) durante el tratamiento con medicamentos a base de interferón beta. Los acontecimientos se notificaron en diversos momentos durante el tratamiento y pueden ocurrir después de varios años de tratamiento con interferón beta. Se recomienda monitorizar periódicamente para detectar signos o síntomas precoces tales como edema, proteinuria y deterioro de la función renal, especialmente en pacientes con mayor riesgo de enfermedad renal. Es necesario tratar inmediatamente el síndrome nefrótico y considerar la suspensión del tratamiento con AVONEX.
Se ha notificado lesión hepática con niveles elevados de enzimas hepáticas en suero, hepatitis, hepatitis autoinmune e insuficiencia hepática con interferón beta en estudios postcomercialización (ver sección 4.8). A veces, estas reacciones se han producido en presencia de otros medicamentos asociados a lesión hepática. No se ha determinado la posibilidad de efectos aditivos debidos a varios medicamentos o a otros agentes hepatotóxicos (p. ej., alcohol). Se debe vigilar en los pacientes la aparición de signos de lesión hepática y se tomarán precauciones cuando se utilicen interferones conjuntamente con otros medicamentos asociados a lesión hepática.
Se debe controlar estrechamente a aquellos pacientes con enfermedades cardíacas tales como angina, insuficiencia cardíaca congestiva o arritmia por el empeoramiento de su situación clínica durante el tratamiento con AVONEX. Los síntomas seudogripales asociados al tratamiento con AVONEX pueden resultar estresantes para aquellos pacientes con una alteración cardíaca subyacente.
El uso de interferón se asocia con alteraciones analíticas. Por lo tanto, además de las pruebas analíticas que se realizan normalmente para controlar a aquellos pacientes con EM, se recomienda llevar a cabo recuento leucocitario completo y diferencial, recuento de plaquetas y química sanguínea, incluyendo pruebas de función hepática durante el tratamiento con AVONEX. Aquellos pacientes con mielosupresión pueden necesitar una monitorización más estrecha del recuento hematológico completo, con diferencial y de la cifra de plaquetas.
Los pacientes pueden desarrollar anticuerpos frente a AVONEX. Los anticuerpos de algunos de esos pacientes reducen la actividad del interferón beta-1a in vitro (anticuerpos neutralizantes). Los anticuerpos neutralizantes se asocian con una reducción de los efectos biológicos in vivo de AVONEX y pueden estar potencialmente asociados con una reducción de la eficacia clínica. Se estima que la meseta de incidencia de formación de anticuerpos neutralizantes se alcanza después de 12 meses de tratamiento. Ensayos clínicos recientes con pacientes tratados con AVONEX hasta tres años sugieren que aproximadamente del 5 % al 8 % desarrolla anticuerpos neutralizantes.
La utilización de diversos análisis para detectar los anticuerpos séricos a los interferones limita la capacidad para comparar la antigenicidad entre diferentes productos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones convencionales en humanos.
La interacción de AVONEX con corticosteroides o con la corticotropina (ACTH) no ha sido estudiada sistemáticamente. Los ensayos clínicos indican que los pacientes con EM pueden recibir AVONEX y corticosteroides o ACTH durante las recidivas.
Se ha comunicado que los interferones reducen la actividad de los enzimas dependientes del citocromo P450 hepático en humanos y animales. Se evaluó el efecto de la administración de AVONEX a alta dosis sobre el metabolismo dependiente de P450 en el mono, y no se observaron cambios en la capacidad de metabolización hepática. Se debe tener precaución cuando se administre AVONEX en combinación con otras especialidades farmacéuticas de índice terapéutico estrecho y que dependan en su mayor parte del sistema citocromo P450 hepático para su aclaramiento, tales como algunas clases de antiepilépticos y antidepresivos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los datos relativos al uso de AVONEX durante el embarazo son limitados. Los datos disponibles indican que puede aumentar el riesgo de aborto espontáneo. El inicio del tratamiento durante el embarazo está contraindicado (ver sección 4.3).
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos. Si la paciente queda embarazada o tiene intención de quedarse embarazada durante el tratamiento con AVONEX, se le debe informar de los riesgos potenciales y considerar la conveniencia de interrumpir el tratamiento (ver sección 5.3). En pacientes con una tasa elevada de recaídas antes del inicio del tratamiento, hay que sopesar el riesgo de una recaída grave después de interrumpir la administración de AVONEX en caso de embarazo frente al posible aumento del riesgo de aborto espontáneo.
Lactancia
Se desconoce si AVONEX se excreta en la leche materna. Dada la posibilidad de reacciones adversas graves en los lactantes, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con AVONEX.
Fertilidad
Se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo (ver sección 5.3).
No hay datos disponibles sobre los efectos del interferón beta-la sobre la fertilidad masculina.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos de AVONEX sobre la capacidad para conducir y utilizar máquinas. Las reacciones adversas que afectan al sistema nervioso central puede influir ligeramente sobre la capacidad para conducir y utilizar máquinas en pacientes susceptibles (ver sección 4.8).
4.8 Reacciones adversas
La incidencia más alta de reacciones adversas asociadas a AVONEX está relacionada con los síntomas seudogripales. Los síntomas seudogripales notificados con más frecuencia son dolores musculares, fiebre, escalofríos, sudoración, astenia, cefalea y náuseas. El ajuste de la dosis de AVONEX al inicio del tratamiento ha demostrado una reducción en la gravedad e incidencia de síntomas seudogripales. Los síntomas seudogripales tienden a ser más acusados al principio del tratamiento y disminuyen en frecuencia con el tratamiento continuado.
Después de las inyecciones pueden aparecer síntomas neurológicos transitorios que recuerden a las exacerbaciones de la EM. En cualquier momento durante el tratamiento pueden aparecer episodios transitorios de hipertonía y/o debilidad muscular intensa que impidan los movimientos voluntarios. Estos episodios tienen una duración limitada, guardan relación temporal con las inyecciones y pueden reaparecer con las siguientes inyecciones. En algunos casos estos síntomas se asocian a síntomas seudogripales.
Las frecuencias de las reacciones adversas se expresan en pacientes-año, de acuerdo con las siguientes categorías:
Muy frecuentes (>1/10 pacientes-año);
Frecuentes (>1/100 a <1/10 pacientes-año);
Poco frecuentes (>1/1.000 a <1/100 pacientes-año);
Raras (>1/10.000 a <1/1.000 pacientes-año);
Muy raras (<1/10.000 pacientes-año);
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
La unidad paciente-tiempo es la suma de las unidades individuales de tiempo que el paciente del estudio ha estado expuesto a AVONEX antes de experimentar la reacción adversa. Por ejemplo, 100 personas-año podría corresponder a una reacción observada en 100 pacientes en tratamiento durante un año o en 200 pacientes tratados durante medio año.
En la siguiente tabla se citan las reacciones adversas identificadas en estudios (ensayos clínicos y estudios de observación, con un periodo de seguimiento comprendido entre dos y seis años) y otras reacciones adversas identificadas mediante notificación espontánea tras la comercialización con una frecuencia desconocida.
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Exploraciones complementarias | |
|
frecuentes |
disminución del recuento de linfocitos, disminución del recuento de leucocitos, disminución del recuento de neutrófilos, disminución del hematocrito, aumento del potasio en sangre, aumento del nitrógeno ureico en sangre |
|
Poco frecuentes |
disminución del recuento de plaquetas |
|
frecuencia no conocida |
reducción de peso, aumento de peso, anomalías en las pruebas de función hepática |
|
Trastornos cardíacos | |
|
frecuencia no conocida |
miocardiopatía, insuficiencia cardíaca congestiva (ver sección 4.4), palpitaciones, arritmia, taquicardia |
|
Trastornos de la sangre y del sistema linfático | |
|
frecuencia no conocida |
pancitopenia, trombocitopenia |
|
raras |
microangiopatía trombótica que incluye púrpura trombótica trombocitopénica /síndrome urémico hemolítico.* |
|
Trastornos del sistema nervioso | |
|
muy frecuentes |
cefalea2 |
|
frecuentes |
espasticidad muscular, hipoestesia |
|
frecuencia no conocida |
síntomas neurológicos, síncope3, hipertonía, mareo, parestesias, epilepsia, migraña |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
frecuentes |
rinorrea |
|
raras |
disnea |
|
frecuencia no conocida |
hipertensión arterial pulmonar^ |
|
Trastornos gastrointestinales | |
|
frecuentes |
vómitos, diarrea, náuseas2 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
frecuentes |
erupción, aumento de la sudoración, contusión |
|
poco frecuentes |
alopecia |
|
frecuencia no conocida |
edema angioneurótico, prurito, erupción vesiculosa, urticaria, agravamiento de la psoriasis |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
frecuentes |
calambres musculares, dolor de cuello, mialgia2, artralgia, dolor en extremidad, dolor de espalda rigidez muscular, rigidez osteoarticular |
|
frecuencia no conocida |
lupus eritematoso sistémico, debilidad muscular, artritis |
|
Trastornos renales y urinarios | |
|
raras |
síndrome nefrótico, glomeruloesclerosis (ver sección 4.4 “Advertencias y precauciones especiales de empleo”) |
|
Trastornos endocrinos | |
|
frecuencia no conocida |
hipotiroidismo, hipertiroidismo |
|
Trastornos del metabolismo y de la nutrición | |
|
frecuentes |
anorexia |
|
Infecciones e infestaciones | |
|
frecuencia no conocida |
absceso en el punto de inyección1 |
|
Trastornos vasculares | |
|
frecuentes |
rubor facial |
|
frecuencia no conocida |
vasodilatación |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
muy frecuentes | |
|
frecuentes |
dolor en el lugar de inyección, eritema en el lugar de inyección, hematoma en el lugar de inyección, astenia7, dolor, fatiga7, malestar, sudoración nocturna |
|
poco frecuentes |
sensación de quemazón en el lugar de inyección |
|
frecuencia no conocida |
reacción en el lugar de inyección , inflamación en el lugar de inyección, celulitis en el lugar de inyección', necrosis en el lugar de inyección, hemorragia en el lugar de inyección, dolor torácico |
|
Trastornos del sistema inmunológico | |
|
frecuencia no conocida |
reacción anafiláctica, shock anafiláctico, reacciones de hipersensibilidad (angioedema, disnea, urticaria, erupción, erupción pruriginosa) |
|
Trastornos hepatobiliares | |
|
frecuencia no conocida |
insuficiencia hepática (ver sección 4.4), hepatitis, hepatitis autoinmune |
|
Trastornos de aparato reproductor y de la mama | |
|
poco frecuentes |
metrorragia, menorragia |
|
Trastornos psiquiátricos | |
|
frecuentes |
insomnio, depresión (ver sección 4.4) |
|
frecuencia no conocida |
suicidio, psicosis, ansiedad, confusión, labilidad emocional |
*Etiquetado de clase de los productos que contienen interferón beta (ver sección 4.4).
^ Etiquetado de clase de los productos que contienen interferón, ver más abajo Hipertensión arterial pulmonar.
'Se han notificado reacciones en el lugar de inyección, como dolor, inflamación y casos muy raros de absceso o celulitis que hayan requerido intervención quirúrgica.
3Puede aparecer un episodio de síncope después de la inyección de AVONEX; habitualmente es un episodio aislado que normalmente aparece al comienzo del tratamiento y que no se repite con las siguientes inyecciones.
Hipertensión arterial pulmonar
Se han notificado casos de hipertensión arterial pulmonar (HAP) con medicamentos que contienen interferón beta. Los episodios se notificaron en distintos momentos, incluso varios años después de comenzar el tratamiento con interferón beta.
Población pediátrica
Los datos limitados publicados indican que el perfil de seguridad en adolescentes de 12 a 16 años que reciben AVONEX 30 microgramos por vía intramuscular una vez a la semana es similar al observado en adultos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han notificado casos de sobredosis. Sin embargo, si se produjera, se debe hospitalizar a los pacientes para su observación y tratamiento de soporte adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Interferones, código ATC: L03 AB07.
Los interferones son una familia de proteínas naturales producidas por células eucarióticas en respuesta a infecciones víricas y a diferentes inductores de origen biológico. Los interferones son citocinas que median actividades antivíricas, antiproliferativas e inmunomoduladoras. Se han identificado tres clases principales de interferones: alfa, beta y gamma. Los interferones alfa y beta son interferones de tipo I, y el interferón gamma es un interferón de tipo II. Dichos interferones poseen actividades biológicas superpuestas pero claramente distinguibles. También pueden diferir con respecto a su lugar celular de síntesis.
El interferón beta se produce en varios tipos de células, incluidos los fibroblastos y macrófagos. El interferón beta natural y AVONEX (interferón beta-1a) están glucosilados y tienen una única unión N-grupo carbohidrato complejo. Se sabe que la glucosilación de otras proteínas afecta a su estabilidad, actividad, biodistribución y semivida en la sangre. Sin embargo, no se han definido por completo los efectos del interferón beta que dependen de la glucosilación.
Mecanismo de acción
AVONEX ejerce sus efectos biológicos mediante su unión a receptores específicos en la superficie de las células humanas. Dicha unión inicia una compleja secuencia de fenómenos intracelulares que conduce a la expresión de numerosos productos y marcadores inducidos genéticamente por el interferón. Entre ellos están la clase I del complejo principal de histocompatibilidad (CPH), la proteína Mx, la 2’ / 5’-oligoadenilato sintetasa, la p2-microglobulina y la neopterina. Algunos de estos productos se han medido en el suero y en la fracción celular de la sangre de pacientes tratados con
AVONEX. Después de una sola dosis intramuscular de AVONEX, los niveles séricos de dichos productos permanecen altos durante al menos cuatro días e incluso hasta una semana.
Se desconoce si el mecanismo de acción de AVONEX en la EM sigue la misma ruta que los efectos biológicos descritos anteriormente, porque no está bien establecida la fisiopatología de la EM.
Eficacia clínica y seguridad
Los efectos del tratamiento con AVONEX liofilizado se demostraron en un único ensayo controlado con placebo en 301 pacientes (AVONEX, n = 158; placebo, n = 143) con EM recidivante caracterizada por al menos 2 exacerbaciones en los últimos tres años o al menos una exacerbación en el año anterior a la entrada del paciente en el ensayo, cuando la duración de la enfermedad era inferior a 3 años. En el ensayo clínico se incluyeron pacientes con un EDSS entre 1,0 y 3,5. Debido al diseño del estudio, el seguimiento de los pacientes se realizó en periodos de tiempo variables. 150 pacientes tratados con AVONEX completaron un año en estudio y 85 completaron dos años en estudio. En el estudio, el porcentaje acumulado de pacientes que desarrollaron progresión de la incapacidad (según el análisis de la tabla de vida de Kaplan-Meier) al final del periodo de dos años fue del 35 % en los pacientes tratados con placebo y del 22 % en los pacientes tratados con AVONEX. La progresión de la incapacidad se midió como un incremento en la escala ampliada del estado de discapacidad (EDSS, Expanded Disability Status Scale) de 1,0 punto, sostenido durante al menos seis meses. También se demostró una reducción de un tercio del índice anual de recaída. Este último efecto clínico fue observado después de más de un año de tratamiento.
Tras un estudio doble ciego aleatorizado y de comparación de dosis con 802 pacientes con EM recidivante (AVONEX 30 pg n = 402, AVONEX 60 pg n = 400) no se observaron diferencias estadísticamente significativas o tendencias entre las dosis de AVONEX de 30 pg y de 60 pg en cuanto a los parámetros clínicos y mediante imagen por resonancia magnética.
Los efectos de AVONEX en el tratamiento de la EM también se demostraron en un ensayo doble ciego aleatorizado con 383 pacientes (AVONEX n = 193, placebo n = 190) con un único acontecimiento desmielinizante asociado con al menos dos lesiones cerebrales compatibles en la resonancia magnética. En el grupo de tratamiento con AVONEX se observó una reducción del riesgo de experimentar un segundo acontecimiento. También se observó un efecto sobre los parámetros medidos por resonancia magnética. El riesgo estimado de un segundo acontecimiento fue del 50 % en tres años y del 39 % en dos años en el grupo de placebo y del 35 % (tres años) y 21 % (dos años) en el grupo de AVONEX. En un análisis post-hoc, aquellos pacientes con una resonancia magnética basal con al menos una lesión realzada con gadolinio y nueve lesiones en T2 tuvieron un riesgo de sufrir un segundo acontecimiento del 56 % en el grupo de placebo y del 21 % en el grupo tratado con AVONEX a los dos años. Sin embargo, el impacto del tratamiento precoz con AVONEX se desconoce incluso en este subgrupo de alto riesgo, ya que el estudio fue principalmente diseñado para evaluar el tiempo hasta el segundo acontecimiento, en lugar de la evolución a largo plazo de la enfermedad. Además, por ahora no hay una definición bien establecida de pacientes de alto riesgo, aunque un planteamiento más conservador es aceptar al menos nueve lesiones hiperintensas en T2 en el estudio inicial y al menos una nueva en T2 o una nueva lesión realzada con gadolinio sobre una resonancia de seguimiento recogida al menos tres meses después de la inicial. En cualquier caso el tratamiento debe considerarse solamente para pacientes clasificados como de alto riesgo.
Población pediátrica
Los datos limitados sobre la eficacia/seguridad de AVONEX 15 microgramos por vía intramuscular una vez a la semana (n=8) en comparación con ningún tratamiento (n=8) con un seguimiento durante 4 años mostraron resultados acordes con los observados en adultos, aunque las puntuaciones de EDSS aumentaron en el grupo tratado durante el seguimiento de 4 años; por tanto, esto indica la progresión de la enfermedad. No hay comparación directa con la dosis actualmente recomendada en adultos.
5.2 Propiedades farmacocinéticas
El perfil farmacocinético de AVONEX se ha investigado indirectamente mediante un análisis que mide la actividad antivírica del interferón. Este análisis es limitado, pues es sensible para el interferón pero carece de especificidad para el interferón beta. Las técnicas de análisis alternativas no son lo suficientemente sensibles.
Tras la administración intramuscular de AVONEX, el pico de los niveles de actividad antivírica sérica ocurre entre 5 y 15 horas después de la administración y disminuye con una vida media de aproximadamente 10 horas. Con un ajuste adecuado de la tasa de absorción desde el punto de inyección, la biodisponibilidad calculada es de aproximadamente el 40 %. La biodisponibilidad calculada es mayor sin dichos ajustes. La administración subcutánea no puede suplir la administración intramuscular.
5.3 Datos preclínicos sobre seguridad
Carcinogénesis: no se dispone de datos de carcinogenicidad del interferón beta-1a en animales o humanos.
Toxicidad crónica: no se observó respuesta inmune al interferón beta-1a ni signos de toxicidad en un estudio de toxicidad con dosis repetidas de 26 semanas de duración, administrado en monos rhesus por vía intramuscular una vez a la semana, en combinación con otro agente inmunomodulador, un anticuerpo monoclonal ligando CD40.
Tolerancia local: no se ha evaluado la irritación intramuscular en animales tras la administración repetida en el mismo punto de inyección.
Mutagénesis: se han llevado a cabo pruebas de mutagénesis limitadas pero relevantes. Los resultados han sido negativos.
Alteración de la fertilidad: Se han llevado a cabo estudios de fertilidad y desarrollo en el mono rhesus con una forma relacionada del interferón beta-1a. A dosis muy altas, se observaron efectos anovulatorios y abortivos en animales de ensayo. También se han observado efectos reproductivos similares relacionados con la dosis con otras formas de interferones alfa y beta. No se han observado efectos teratogénicos ni efectos en el desarrollo fetal, pero la información disponible sobre los efectos del interferón beta-1a en los periodos perinatal y posnatal es limitada.
No hay información disponible sobre los efectos del interferón beta-1a sobre la fertilidad masculina.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acetato de sodio trihidrato Ácido acético glacial Hidrocloruro de arginina Polisorbato 20
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede
6.3 Periodo de validez 3 años.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
NO CONGELAR.
AVONEX PEN contiene una jeringa precargada de AVONEX y se debe conservar en nevera.
En caso de que no se pueda conservar en nevera, AVONEX PEN se puede conservar a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
Conservar AVONEX PEN en el acondicionamiento primario para protegerlo de la luz (ver sección 6.5).
6.5 Naturaleza y contenido del envase
Dentro de un inyector de pluma, accionado por un muelle, desechable y de un solo uso, llamado AVONEX PEN, viene una jeringa precargada de AVONEX. La jeringa del interior de la pluma es una jeringa precargada de 1 ml, de vidrio (tipo I), con una cápsula de garantía de cierre y un tapón de émbolo (bromobutilo), que contiene 0,5 ml de solución.
Tamaño del envase: Cada AVONEX PEN de un solo uso está envasado en una caja individual, con una aguja de inyección y un protector de la pluma. AVONEX PEN se presenta en tamaños de envase de cuatro o doce.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Unicamente para un solo uso. La solución inyectable en jeringa precargada está contenida dentro de AVONEX PEN.
Una vez sacada de la nevera, se deberá dejar que AVONEX PEN alcance la temperatura ambiente (15°C a 30°C) durante unos 30 minutos.
No utilizar fuentes externas de calor tales como agua caliente para calentar AVONEX 30 pg solución inyectable.
Cada pluma precargada desechable y de un solo uso contiene una sola dosis de AVONEX. Se puede ver la solución inyectable por una ventana de visualización de la medicación ovalada que hay en AVONEX PEN. Si la solución inyectable contiene partículas o si presenta otro color que no sea incoloro y transparente, no debe utilizarse la pluma precargada. Se facilita la aguja de inyección. La formulación no contiene conservantes.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LIMITED
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/005
EU/1/97/033/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13/marzo/1997 Fecha de la última renovación: 13/marzo/2007
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S)RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) del (de los) principio(s) activo(s) biológico(s).
Biogen Inc., 250 Binney Street, Cambridge, Massachusetts 02142, EE. UU.
Biogen Inc., 5000 Davis Drive, POB 14627, Research Triangle Park, North Carolina, 27709, EE. UU.
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Biogen (Denmark) Manufacturing ApS, Biogen, Allé 1, DK-3400 Hillerod, Dinamarca
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
El Titular de la Autorización de Comercialización informará a la Comisión Europea sobre los planes de comercialización para el medicamento autorizado mediante la presente decisión.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
PRESENTACIÓN DEL BIO-SET

1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos polvo y disolvente para solución inyectable Interferón beta-1a
2. PRINCIPIO(S) ACTIVO(S)
Cada vial contiene 30 microgramos (6 millones de UI) de interferón beta-1a.
3. LISTA DE EXCIPIENTES
Seroalbúmina humana, cloruro de sodio, fosfato de sodio dibásico y fosfato de sodio monobásico.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable.
Envases con cuatro dosis que se presentan como: vial con el dispositivo BIO-SET que contiene el medicamento, jeringa precargada con agua para preparaciones inyectables, una aguja para administración intramuscular.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para administración intramuscular después de la reconstitución con el disolvente. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar por debajo de 25°C. NO CONGELAR.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
avonex
1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos polvo y disolvente para solución inyectable Interferón beta-1a
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
Para administración intramuscular después de la reconstitución con el disolvente. Leer el prospecto antes de utilizar este medicamento.
Conservar por debajo de 25°C.
NO CONGELAR.
Medicamento (vial de 3 ml):
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
AVONEX 30 microgramos polvo para inyección Interferón beta-1a IM
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 microgramos de interferón beta-1a
6. OTROS
Disolvente para la reconstitución: (jeringa precargada con 1 ml)
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Agua para preparaciones inyectables IM
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
EXP |
4. NÚMERO DE LOTE
|
Lot | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
1 ml | |
|
6. |
OTROS |

1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos/0,5 ml solución inyectable Interferón beta-1a
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada de 0,5 ml contiene 30 microgramos (6 millones de UI) de interferón beta-1a.
3. LISTA DE EXCIPIENTES
Acetato de sodio trihidrato, ácido acético glacial, arginina hidrocloruro, polisorbato 20, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable.
Envase de cuatro jeringas precargadas de 0,5 ml de solución. Envase de doce jeringas precargadas de 0,5 ml de solución.
Cada jeringa está acondicionada en una bandeja de plástico sellada que también contiene una aguja de inyección para vía intramuscular.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intramuscular.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
Avonex puede conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
NO CONGELAR.
Conservar en el embalaje original (bandeja plástica sellada) para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/003 envase de 4 EU/1/97/033/004 envase de 12
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
avonex
1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos/0,5 ml solución inyectable Interferón beta-1a
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS_
Vía intramuscular.
Leer el prospecto antes de utilizar este medicamento.
Conservar en nevera.
Avonex puede conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
NO CONGELAR.
Conservar en el embalaje original (bandeja plástica sellada) para protegerlo de la luz.
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
AVONEX 30 microgramos/0,5 ml solución inyectable Interferón beta-1a IM
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS

1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos/0,5 ml solución inyectable en pluma precargada Interferón beta-1a.
2. PRINCIPIO(S) ACTIVO(S)
Cada pluma precargada contiene 30 microgramos (6 millones de UI) de interferón beta-1a en 0,5 ml de solución.
3. LISTA DE EXCIPIENTES
Acetato de sodio trihidrato, ácido acético glacial, arginina hidrocloruro, polisorbato 20, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable en pluma precargada
4 plumas precargadas. Cada envase individual contiene 1 Avonex pen, una aguja de inyección y un protector de la pluma.
12 plumas precargadas. Cada envase individual contiene 1 Avonex pen, una aguja de inyección y un protector de la pluma.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intramuscular.
Leer el prospecto antes de utilizar este medicamento. Únicamente para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN_
Conservar en nevera.
No congelar.
Avonex pen puede conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
Sensible a la luz. Conservar Avonex pen en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/005 envase de 4 EU/1/97/033/006 envase de 12
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
avonex pen
1. NOMBRE DEL MEDICAMENTO
AVONEX 30 microgramos/0,5 ml solución inyectable en pluma precargada Interferón beta-1a
2. PRINCIPIO(S) ACTIVO(S)
Cada pluma precargada contiene 30 microgramos (6 millones de UI) de interferón beta- 1a en 0,5 ml de solución.
3. LISTA DE EXCIPIENTES
Acetato de sodio trihidrato, ácido acético glacial, arginina hidrocloruro, polisorbato 20, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Forma parte de un envase múltiple. No puede venderse por separado.
Solución inyectable en pluma precargada
Avonex pen, aguja de inyección y protector de la pluma.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intramuscular.
Leer el prospecto antes de utilizar este medicamento. Únicamente para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Conservar en nevera.
No congelar.
Avonex pen puede conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
Sensible a la luz. Conservar Avonex pen en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BIOGEN IDEC LTD.
Innovation House
70 Norden Road
Maidenhead
Berkshire
SL6 4AY
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
avonex pen
ETIQUETA DE LA PLUMA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
AVONEX 30 microgramos/0,5 ml solución inyectable en pluma precargada Interferón beta-1a IM
2. FORMA DE ADMINISTRACIÓN
Véase el prospecto.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
AVONEX 30 microgramos, polvo y disolvente para solución inyectable
(Interferón beta-1a)
BIO-SET
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Aunque haya utilizado Avonex con anterioridad, parte de la información puede haber cambiado.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
(Notas informativas)
Este prospecto cambia de vez en cuando.
Compruebe la posible actualización de este prospecto cada vez que renueve su receta.
Contenido del prospecto
1. Qué es AVONEX y para qué se utiliza
2. Qué necesita saber antes de empezar a usar AVONEX
3. Cómo usar AV ONEX
4. Posibles efectos adversos
5. Conservación de AVONEX
6. Contenido del envase e información adicional
7. Cómo inyectar AVONEX
1. Qué es AVONEX y para qué se utiliza ¿Qué es AVONEX?
El principio activo de Avonex es una proteína llamada interferón beta-1a. Los interferones son sustancias naturales elaboradas por su organismo para protegerle de infecciones y enfermedades. La proteína de Avonex se elabora exactamente con los mismos ingredientes que el interferón beta presente en el organismo humano.
¿Para qué se utiliza AVONEX?
Avonex se utiliza para tratar la esclerosis múltiple (EM). El tratamiento con Avonex puede ayudar a evitar que empeore, aunque no curará la EM.
Cada paciente tiene unos síntomas específicos de EM. Pueden ser:
- Sensación de inestabilidad o mareo, problemas para caminar, rigidez y espasmos musculares, cansancio, hormigueo en la cara, brazos o piernas.
- Dolor agudo o crónico, problemas vesicales e intestinales, problemas sexuales y problemas visuales.
- Dificultad para pensar y concentrarse, depresión.
La EM también tiende a exacerbarse cada cierto tiempo: esto es lo que se conoce como recidiva.
(Notas informativas)
Avonex actúa mejor cuando lo utiliza a la misma hora, una vez por semana, de forma regular.
No interrumpa el tratamiento de Avonex sin hablar con su neurólogo.
Avonex puede ayudar a reducir el número de recidivas que pueda presentar y a frenar los efectos incapacitantes de la EM. Su médico le explicará durante cuánto tiempo puede utilizar Avonex o cuándo interrumpir el tratamiento.
¿Cómo actúa AVONEX?
La esclerosis múltiple se asocia a una lesión neural (del cerebro o de la médula espinal). En la EM, el sistema de defensa de su organismo reacciona frente a su propia mielina, es decir, el aislamiento que rodea las fibras nerviosas. Cuando se lesiona la mielina, se alteran los mensajes entre el cerebro y las demás partes del organismo. Esto es lo que provoca los síntomas de la EM. Avonex parece que actúa impidiendo que el sistema de defensa de su organismo ataque la mielina.
2. Qué necesita saber antes de empezar a usar AVONEX No use AVONEX
- Si es alérgico al interferón beta, a la seroalbúmina humana o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- Si está embarazada, no comience a utilizar Avonex
- Si padece una depresión grave o tiene ideas de suicidio.
Hable inmediatamente con su médico en cualquiera de estos casos.
(Notas informativas)
Avonex y las reacciones alérgicas. Como Avonex está elaborado con una proteína, existe una pequeña probabilidad de que aparezca una reacción alérgica.
Información adicional sobre la depresión. No debe utilizar Avonex si padece una depresión grave o tiene ideas de suicidio.
Si tiene depresión, su médico puede prescribirle Avonex pero es importante que éste sepa si ha tenido depresión u otro problema similar que afecte a su estado de ánimo.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Avonex si tiene o ha tenido en el pasado:
- Depresión o problemas que afecten a su estado de ánimo
- Pensamientos suicidas.
Debe informar inmediatamente a su médico de los cambios en el estado de ánimo, ideas de suicidio,
sensación inusual de tristeza, ansiedad o desesperanza.
- Epilepsia u otros trastornos convulsivos no controlados con medicación
- Problemas renales o hepáticos graves
- Recuentos bajos de leucocitos o plaquetas, lo que puede incrementar el riesgo de infección, hemorragia o anemia
- Problemas de corazón que puedan producir síntomas como dolor torácico (angina), especialmente después de cualquier actividad; hinchazón de tobillos, dificultad respiratoria (insuficiencia cardíaca congestiva) o un ritmo cardíaco irregular (arritmias).
Hable con su médico si presenta alguna de estas enfermedades o si empeoran mientras usa
Avonex.
Durante el tratamiento, se pueden formar coágulos de sangre en los vasos sanguíneos pequeños . Estos coágulos podrían afectar a sus riñones. Esto puede ocurrir tras varias semanas o varios años después de comenzar el tratamiento con Avonex.
Su médico posiblemente quiera realizar controles de su tensión arterial, sangre (recuento de plaquetas) y función renal.
Informe a su médico de que está utilizando Avonex:
- Si se le va a realizar un análisis de sangre. Avonex puede interferir en los resultados.
(Notas informativas)
En alguna ocasión será necesario que recuerde a otros profesionales médicos que está siendo tratado con Avonex. Por ejemplo, si se le prescriben otros medicamentos o si se le realiza un análisis de sangre, Avonex puede interaccionar con otros fármacos o con el resultado de la prueba.
Uso de AVONEX con otros medicamentos
Informe a su médico si está utilizando otros medicamentos, especialmente para el tratamiento de la epilepsia o de la depresión. Avonex puede afectar a otros medicamentos o resultar afectado por éstos. Esto afecta también a los medicamentos obtenidos sin receta.
Embarazo y lactancia:
Si está embarazada, no comience a utilizar Avonex.
- Si puede quedar embarazada, debe utilizar un método anticonceptivo mientras utilice Avonex.
- Si tiene previsto tener un hijo o si se queda embarazada mientras se administra Avonex, informe a su médico. Comente con su médico si debe continuar con el tratamiento.
- Si ya está embarazada o cree que podría estarlo, informe a su médico lo antes posible.
- Si quiere dar el pecho a su hijo, hable primero con su médico.
Conducción y uso de máquinas
Si tiene sensación de mareo, no conduzca. Avonex hace que algunas personas se sientan mareadas. Si le ocurre esto o si presenta cualquier otro efecto secundario que pueda afectar a su capacidad, no conduzca ni utilice máquinas.
Información importante sobre algunos de los componentes de AVONEX:
Este medicamento está esencialmente exento de sodio. Contiene menos de 23 mg (1 mmol) de sodio por cada dosis semanal.
3. Cómo usar AVONEX Dosis recomendada
Una inyección de Avonex una vez por semana.
Intente utilizar Avonex a la misma hora el mismo día de cada semana.
Su médico o enfermera puede aumentar gradualmente la dosis de Avonex al iniciarse el tratamiento. Esto ayudará a limitar los síntomas seudogripales.
No utilizar en niños
Avonex no se debe utilizar en niños menores de 12 años.
Autoinyección
Puede inyectarse Avonex sin la ayuda de su médico si le han enseñado a hacerlo. Consulte las instrucciones de autoinyección al final de este prospecto (véase la sección 7, Cómo inyectar AVONEX).
Si tiene problemas para manejar la jeringa, hable con su médico. Puede recibir ayuda.
(Notas informativas)
Al final de este prospecto se incluyen más detalles sobre cómo inyectar Avonex.
Aguja alternativa:
El envase de Avonex ya contiene una aguja para inyección. El médico puede prescribirle una aguja más corta y fina, dependiendo de sus características corporales. Hable con su médico para saber si es adecuado para usted.
Si tiene problemas para manejar la jeringa, hable con su médico sobre el uso de un asidero para la jeringa. Es un soporte diseñado especialmente que le ayuda a inyectar Avonex.
Duración del tratamiento con AVONEX
Su médico le informará durante cuánto tiempo debe utilizar Avonex. Es importante que utilice Avonex de forma regular. No haga ningún cambio que no le haya indicado su médico.
Si se inyecta demasiada cantidad
Sólo debe administrarse una inyección de Avonex una vez por semana. Si se ha administrado más de una inyección de Avonex en el plazo de tres días, contacte inmediatamente con su médico o farmacéutico.
Si olvida una inyección
Si olvida su dosis semanal habitual, inyecte una dosis tan pronto como sea posible. A continuación suspenda el tratamiento durante una semana. Continúe la inyección ese día de cada semana. Si tiene un día preferido para utilizar Avonex, hable con su médico para ajustar la dosis y recuperar su día preferido. No se administre dos inyecciones para compensar la inyección olvidada.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
(Notas informativas)
Aunque la lista de posibles efectos adversos puede parecer preocupante, cabe la posibilidad de que no presente ninguno de ellos.
Efectos adversos graves: solicite ayuda médica.
Reacciones alérgicas graves
Si presenta alguno de los síntomas siguientes:
- Hinchazón de cara, labios o lengua
- Dificultad para respirar
- Erupción.
Llame a un médico inmediatamente. No utilice Avonex hasta que haya hablado con un médico. Depresión
Si presenta algún síntoma de depresión:
- Sensación inusual de tristeza, ansiedad o desesperanza.
Llame a un médico inmediatamente.
Problemas hepáticos
Si presenta alguno de los síntomas siguientes:
- Coloración amarillenta de la piel o de la parte blanca de los ojos (ictericia)
- Picor generalizado
- Sensación de malestar (náuseas y vómitos)
- Hematomas que aparecen fácilmente en la piel.
Llame a un médico inmediatamente ya que pueden ser manifestaciones de un posible problema hepático.
Efectos adversos observados en ensayos clínicos
(Notas informativas)
Efectos adversos observados en ensayos clínicos. Son efectos adversos notificados por personas durante la evaluación de Avonex. Las cifras se basan en el número de personas que los presentaron. Dan una idea de la probabilidad de que usted desarrolle efectos adversos similares.
Efectos adversos muy frecuentes
(afectan al menos a 1 de cada 10 personas)
- Síntomas seudogripales: dolor de cabeza, dolores musculares, escalofríos o fiebre: véase Síntomas seudogripales, más adelante
- Dolor de cabeza.
Efectos adversos frecuentes
(afectan a menos de 1 de cada 10 personas)
- Pérdida del apetito
- Sensación de debilidad y cansancio
- Dificultad para dormir
- Depresión
- Rubor facial
- Destilación nasal
- Diarrea (deposiciones blandas)
- Sensación de malestar (náuseas o vómitos)
- Entumecimiento u hormigueo de la piel
- Erupción, hematomas cutáneos
- Aumento de la sudoración, sudores nocturnos
- Dolor en músculos, articulaciones, brazos, piernas o cuello
- Calambres musculares, rigidez en músculos y articulaciones
- Dolor, hematoma y enrojecimiento en el sitio de inyección
- Cambios en los análisis de sangre. Los síntomas que podría presentar son cansancio, infección repetida, hematoma o hemorragia sin causa aparente.
Efectos adversos poco frecuentes
(afectan a menos de 1 de cada 100 personas)
- Pérdida de cabello
- Cambios en la menstruación
- Sensación de quemazón en el sitio de inyección.
Efectos adversos raros
(afectan a menos de 1 de cada 1.000 personas)
- Dificultad para respirar
- Problemas renales que incluyen cicatrización que puede reducir su función renal Si presenta alguno o todos de los síntomas siguientes:
- Orina con espuma
- Fatiga
- Hinchazón, especialmente de tobillos y párpados, y aumento de peso.
Informe a su médico ya que pueden ser manifestaciones de un posible problema renal.
- Coágulos de sangre en los vasos sanguíneos pequeños que pueden afectar a sus riñones (púrpura trombótica trombocitopénica o síndrome urémico hemolítico). Los síntomas pueden incluir un aumento de moratones, sangrado, fiebre, debilidad extrema, dolor de cabeza, mareos o aturdimiento. Su médico puede encontrar alteraciones en su sangre y en la función renal.
Si le preocupa alguno de los efectos, hable con su médico.
Otros efectos adversos
(Notas informativas)
Estos efectos se han observado en personas que utilizan Avonex pero desconocemos la frecuencia con la que aparecen.
- Déficit o exceso de actividad del tiroides
- Nerviosismo o ansiedad, inestabilidad emocional, pensamientos irracionales o alucinaciones (ver o escuchar cosas que no son reales), confusión o suicidio
- Entumecimiento, mareo, convulsiones o crisis epilépticas y migrañas
- Percepción de su latido cardíaco (palpitaciones), frecuencia cardíaca rápida o irregular, o problemas de corazón que se acompañan de los siguientes síntomas: capacidad reducida para el ejercicio, incapacidad para permanecer tumbado, dificultad respiratoria o hinchazón de tobillos
- Problemas hepáticos como los descritos previamente
- Urticaria o erupción seudovesiculosa, picor, empeoramiento de una psoriasis que ya tuviera
- Hinchazón o hemorragia en el sitio de inyección o dolor torácico después de una inyección
- Aumento o pérdida de peso
- Cambios en los resultados de los análisis, como la variación de las pruebas de función hepática.
- Hipertensión arterial pulmonar: Enfermedad en la que se produce un gran estrechamiento de los vasos sanguíneos de los pulmones que provoca un aumento de la presión en los vasos sanguíneos que transportan la sangre del corazón a los pulmones. La hipertensión arterial pulmonar se observó en distintos momentos, incluso varios años después del inicio del tratamiento con medicamentos que contienen interferón beta.
Si le preocupa alguno de los efectos, hable con su médico.
Efectos de la inyección
- Sensación de desmayo: La primera inyección de Avonex puede ser administrada por su médico. Es posible que se maree. Puede que incluso se desmaye. Es improbable que ocurra de nuevo.
- Inmediatamente después de la inyección puede notar los músculos tensos o muy débiles,
como si se fuera a repetir la experiencia. Es raro. Sólo ocurre cuando se autoinyecta y los efectos pasan rápidamente. Pueden manifestarse en cualquier momento después de comenzar el tratamiento con Avonex.
- Si nota alguna irritación en la piel u otro problema cutáneo después de una inyección, hable con su médico.
Síntomas seudogripales
(Notas informativas)
Tres formas sencillas para reducir el impacto de los síntomas seudogripales:
1. Adminístrese la inyección de Avonex justo antes de acostarse. Estará dormido mientras aparecen los efectos.
2. Tome paracetamol o ibuprofeno media hora antes de la inyección de Avonex y continúe tomándolo durante el día siguiente. Comente con su médico o farmacéutico la dosis adecuada.
3. Si tiene fiebre, beba bastante agua para mantenerse hidratado.
Algunas personas refieren que después de inyectarse Avonex tienen una sensación seudogripal.
Los signos son:
- Dolor de cabeza
- Dolores musculares
- Escalofríos o fiebre.
Estos síntomas realmente no corresponden a la gripe.
No los puede transmitir a nadie. Son más frecuentes cuando utiliza Avonex por primera vez. Su médico o enfermera puede aumentar gradualmente la dosis de Avonex al iniciarse el tratamiento. Los síntomas seudogripales disminuyen gradualmente a medida que se administran más inyecciones.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de AVONEX
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta.
Conservar por debajo de 25°C.
Una vez preparado en la jeringa, utilizar lo antes posible. Sin embargo, la jeringa preparada se puede conservar en la nevera (entre 2°C y 8°C) durante un plazo máximo de 6 horas antes de la inyección. No congelar.
Sacar media hora antes de la inyección.
NO utilice Avonex si observa que:
- el precinto del tapón del dispositivo BIO-SET está dañado.
- la bandeja de plástico sellada está dañada o abierta.
- el líquido del vial obtenido tras la reconstitución no es incoloro o de color amarillo claro o presenta partículas en suspensión.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de AVONEX
El principio activo es: interferón beta-la 30 microgramos.
Los demás componentes son: seroalbúmina humana, cloruro sódico, fosfato dibásico de sodio y fosfato monobásico de sodio.
Aspecto del producto y contenido del envase
Una caja de Avonex Bioset contiene cuatro dosis de Avonex.
Cada dosis se presenta en una bandeja de plástico sellada y consta de un envase de vidrio (vial) que contiene un polvo de color blanco o casi blanco y de una jeringa para inyección cargada con agua. Se mezclan para formar la inyección que usted se administra (solución inyectable). En la bandeja también se incluye otra aguja para administrar la inyección.
Titular de la autorización de comercialización y responsable de la fabricación El titular de la autorización de comercialización es:
Biogen Idec Limited, Innovation House, 70 Norden Road, Maidenhead, Berkshire, SL6 4AY, Reino Unido.
Avonex es elaborado por:
Biogen (Denmark) Manufacturing ApS, Biogen Allé 1, DK-3400 Hillerod, Dinamarca.
Contacte con los representantes locales si desea una versión de este prospecto con letra más grande.
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Lietuva
UAB "JOHNSON & JOHNSON"
® +370 5 278 68 88
Luxembourg/Luxemburg
Biogen Belgium NV/SA ® +3222191218
Magyarország
Biogen Hungary Kft.
® +36 1 899 9883
Malta
Pharma. MT Ltd..
® +356 21337008
Nederland
Biogen Netherlands B.V.
® +31 20 542 2000
Norge
Biogen Norway AS ® +47 23 40 01 00
Belgie/Belgique/Belgien
Biogen Belgium NV/SA ® +3222191218
Bt^rapnn
Tn EBOOAPMA
® +359 2 962 12 00
Ceská republika
Biogen (Czech Republic) s.r.o.
® +420 255 706 200
Danmark
Biogen Denmark A/S ® +45 77 41 57 57
Deutschland
Biogen GmbH ® +49 (0) 89 99 6170
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal ® +372 617 7410
EXXúóa
Genesis Pharma SA ® +30 210 8771500
España
Biogen Spain S.L.
® +34 91 310 7110
France
Biogen France SAS ® +33 (0)1 41 37 9595
Hrvatska
Medis Adria d.o.o.
® +385 1 230 34 46
Ireland
Biogen Idec (Ireland) Ltd.
® +353 (0)1 463 7799
Ísland
Icepharma hf ® +354 540 8000
Italia
Biogen Italia s.r.l.
® +39 02 584 9901
Kúrcpog
Genesis Pharma Cyprus Ltd ® +3572 2 769946
Latvija
UAB "JOHNSON & JOHNSON" filíale Latvij ® +371 678 93561
Osterreich
Biogen Austria GmbH ® +43 1 484 46 13
Polska
Biogen Poland Sp. z o.o.
® +48 22 351 51 00
Portugal
Biogen Portugal
Sociedade Farmacéutica, Unipessoal Lda. ® +351 21 318 8450
Romania
Johnson & Johnson Romania S.R.L.
® +40 21 207 18 00
Slovenija
Biogen Pharma d.o.o.
® +386 1 511 02 90
Slovenská republika
Biogen Slovakia s.r.o.
® +421 2 323 34008
Suomi/Finland
Biogen Finland Oy ® +358 207 401 200
Sverige
Biogen Sweden AB ® +46 8 594 113 60
United Kingdom
Biogen Idec Limited ® +44 (0) 1628 50 1000
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
7. Cómo inyectar AVONEX
Debe recibir formación sobre cómo inyectarse Avonex.
Estas notas son un recordatorio. Si tiene alguna duda, consulte a su médico o farmacéutico. Dónde inyectar
• Avonex se inyecta en un músculo, por ejemplo, en los músculos de la región superior del muslo. No se recomienda la inyección de Avonex en las nalgas.
• Inyecte en un sitio diferente cada semana. Esto implica menos riesgo de irritación cutánea o muscular.
• No utilice regiones de la piel con hematomas, úlceras o infectadas o si presentan una herida abierta.
|
Tapón \ |
Contenido de la bandeja de plástico | ||||
|
Dispositivo | |||||
|
Puerto de conexión |
títu-Sh i Puerto de conexión de la jeringa | ||||
|
Protector de la jeringa |
Base de lajeringa |
Émbolo | |||
|
Base |
| |
_ J _ _m |
J . | ||
|
feWafif ft¡ ■ ™ | |||||
|
f— \ | |||||
|
Vial de vidrio |
Protector de la aguja A®U-'a | ||||
|
| 1 |
Puerto de conexión | ||||
|
de la aguja | |||||
A. Preparación
1. Extraiga una bandeja de la caja.
Compruebe la fecha de caducidad en la tapa de la bandeja. No utilizar si está caducada. Retire completamente la tapa de papel. Compruebe que la bandeja blister contiene:
• un BIO-SET (vial + base + tapón).
• una jeringa.
• una aguja de inyección (véase la imagen “Contenido de la bandeja de plástico”).
2. Lávese bien las manos con agua y jabón y séqueselas.
3. Prepare torundas de algodón humedecidas en alcohol y apósitos de tipo tirita (no
suministrados) si los necesita.
4. Localice una superficie limpia y resistente para depositar el material necesario para la inyección. Sitúe la bandeja sobre la misma.
B. Preparación de la inyección
1

2

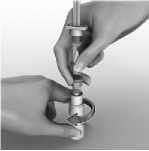
Retire el tapón del vial
Gire el tapón y a continuación retírelo.
No toque el puerto de conexión.
Retire el protector de la jeringa
Sostenga la base de la jeringa. Retire el protector.
No toque el puerto de conexión.
No presione el émbolo.
Alinee la jeringa y el vial
Coloque el Bio Set sobre una superficie plana.
Alinee los dos puertos de conexión de modo que queden en línea recta. Sostenga la jeringa por la base. Enrósquela firmemente en el vial en el sentido de las agujas del reloj.
7

Desplace la jeringa hacia abajo hasta que haga clic
Mantenga el Bio Set sobre una superficie plana y sostenga la jeringa por la base. Manténgalos en línea recta.
Consejo: habrá fugas si la jeringa forma ángulo con respecto al BIO-SET.
Desplace la jeringa hasta que haga clic
5

6


8
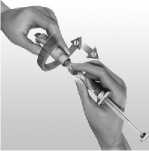
Mezcle el agua y el polvo
Transfiera lentamente toda el agua desde la aguja al vial.
Consejo: no presione el émbolo con rapidez. Esto forma espuma en la solución y no pasará a la jeringa.
Desplace el émbolo hasta abajo para eliminar el aire de la jeringa.
Disuelva completamente el polvo
Sujete el vial y la jeringa manteniéndoles unidos en línea recta. Gire lentamente el vial hasta que se haya disuelto todo el polvo.
No agitar: se formará espuma
Llene la jeringa
Gire la jeringa y el vial al revés, manteniendo una línea recta. Consejo: habrá fugas si la jeringa forma ángulo con respecto al BIO-SET.
Tire lentamente del émbolo hasta que todo el líquido pase la jeringa.
Separe la jeringa del vial
Sostenga la jeringa cargada por la base. Gírela en sentido contrario a las agujas del reloj para separarla del vial BIO-SET.
No toque el puerto de conexión de la jeringa.
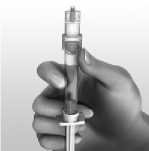
Inspeccione el líquido de la jeringa
Debe ser transparente e incoloro. No inyecte la solución si no es incolora o de color amarillo claro o si observa partículas en suspensión.
2

Conecte la aguja
Desenvuelva la aguja para exponer el puerto de conexión. No retire el protector.
Empuje y gire la aguja sobre la jeringa en el sentido de las agujas del reloj.
Ahora retire el protector plástico de la aguja.
No lo gire.
Consejo: si gira el protector de la aguja para retirarlo, también puede desconectar accidentalmente la aguja.
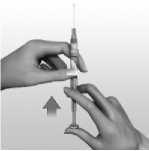
4

5
6


Extraiga el aire
Para eliminar el aire, oriente la aguja de la jeringa hacia arriba. Golpee suavemente la jeringa para desplazar las burbujas de aire hacia la parte superior.
Desplace cuidadosamente el émbolo para eliminar el aire. No permita que salga más que una pequeña cantidad de líquido.
Limpie y estire el sitio de inyección
Si es necesario, utilice una torunda humedecida en alcohol para limpiar la piel en el sitio de inyección que ha elegido. Permita que se seque la piel. Con una mano, estire la piel que rodea el sitio de inyección.
Relaje la musculatura.
Administre la inyección
Introduzca la aguja de inyección en el músculo con un movimiento rápido, como si lanzara un dardo, formado un ángulo recto con la piel. Se debe introducir toda la aguja.
Presione el émbolo lentamente hasta vaciar la jeringa.
Su médico o enfermera puede aumentar gradualmente la dosis de Avonex al iniciarse el tratamiento para limitar los síntomas seudogripales. El resto de Avonex no administrado se debe desechar y no se debe usar.
Extraiga la aguja
Mantenga la piel perfectamente estirada o comprima la piel alrededor del lugar de inyección y extraiga la aguja.
Si utiliza torundas humedecidas en alcohol, aplique una en el sitio de inyección.
Si es necesario, aplique un apósito (tirita) sobre el sitio de inyección.
Deseche debidamente los residuos
Cuando finalice cada inyección, tire la aguja, la jeringa y el vial a un recipiente especial (como el destinado a objetos cortantes), no a la basura general.
El papel de desecho y las torundas utilizadas se pueden tirar a la basura general.
AVONEX 30 microgramos/0,5 ml solución inyectable
(Interferón beta-1a)
Jeringa precargada
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Aunque haya utilizado Avonex con anterioridad, parte de la información puede haber cambiado.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
(Notas informativas)
Este prospecto cambia de vez en cuando.
Compruebe la posible actualización de este prospecto cada vez que renueve su receta.
Contenido del prospecto:
1. Qué es AVONEX y para qué se utiliza
2. Qué necesita saber antes de empezar a usar AVONEX
3. Cómo usar AV ONEX
4. Posibles efectos adversos
5. Conservación de AVONEX
6. Contenido del envase e información adicional
7. Cómo inyectar AVONEX
1. Qué es AVONEX y para qué se utiliza ¿Qué es AVONEX?
El principio activo de Avonex es una proteína llamada interferón beta-1a. Los interferones son sustancias naturales elaboradas por su organismo para protegerle de infecciones y enfermedades. La proteína de Avonex se elabora exactamente con los mismos ingredientes que el interferón beta presente en el organismo humano.
¿Para qué se utiliza AVONEX?
Avonex se utiliza para tratar la esclerosis múltiple (EM). El tratamiento con Avonex puede ayudar a evitar que empeore, aunque no curará la EM.
Cada paciente tiene unos síntomas específicos de EM. Pueden ser:
- Sensación de inestabilidad o mareo, problemas para caminar, rigidez y espasmos musculares, cansancio, hormigueo en la cara, brazos o piernas
- Dolor agudo o crónico, problemas vesicales e intestinales, problemas sexuales y problemas visuales
- Dificultad para pensar y concentrarse, depresión.
La EM también tiende a exacerbarse cada cierto tiempo: esto es lo que se conoce como recidiva.
Avonex actúa mejor cuando lo utiliza a la misma hora, una vez por semana, de forma regular. No interrumpa el tratamiento de Avonex sin hablar con su neurólogo.
Avonex puede ayudar a reducir el número de recidivas que pueda presentar y a frenar los efectos incapacitantes de la EM. Su médico le explicará durante cuánto tiempo puede utilizar Avonex o cuándo interrumpir el tratamiento.
¿Cómo actúa AVONEX?
La esclerosis múltiple se asocia a una lesión neural (del cerebro o de la médula espinal). En la EM, el sistema de defensa de su organismo reacciona frente a su propia mielina, es decir, el aislamiento que rodea las fibras nerviosas. Cuando se lesiona la mielina, se alteran los mensajes entre el cerebro y las demás partes del organismo. Esto es lo que provoca los síntomas de la EM. Avonex parece que actúa impidiendo que el sistema de defensa de su organismo ataque la mielina.
2. Qué necesita saber antes de empezar a usar AVONEX No use AVONEX
- Si es alérgico al interferón beta o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- Si está embarazada, no comience a utilizar Avonex
- Si padece una depresión grave o tiene ideas de suicidio.
Hable inmediatamente con su médico en cualquiera de estos casos.
(Notas informativas)
Avonex y las reacciones alérgicas. Como Avonex está elaborado con una proteína, existe una pequeña probabilidad de que aparezca una reacción alérgica.
Información adicional sobre la depresión. No debe utilizar Avonex si padece una depresión grave o tiene ideas de suicidio.
Si tiene depresión, su médico puede prescribirle Avonex pero es importante que éste sepa si ha tenido depresión u otro problema similar que afecte a su estado de ánimo.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Avonex si tiene o ha tenido en el pasado:
- Depresión o problemas que afecten a su estado de ánimo
- Pensamientos suicidas.
Debe informar inmediatamente a su médico de los cambios en el estado de ánimo, ideas de suicidio,
sensación inusual de tristeza, ansiedad o desesperanza.
- Epilepsia u otros trastornos convulsivos no controlados con medicación
- Problemas renales o hepáticos graves
- Recuentos bajos de leucocitos o plaquetas, lo que puede incrementar el riesgo de infección, hemorragia o anemia
- Problemas de corazón que puedan producir síntomas como dolor torácico (angina), especialmente después de cualquier actividad; hinchazón de tobillos, dificultad respiratoria (insuficiencia cardíaca congestiva) o un ritmo cardíaco irregular (arritmias).
Hable con su médico si presenta alguna de estas enfermedades o si empeoran mientras usa Avonex.
Durante el tratamiento, se pueden formar coágulos de sangre en los vasos sanguíneos pequeños . Estos coágulos podrían afectar a sus riñones. Esto puede ocurrir tras varias semanas o varios años después de comenzar el tratamiento con Avonex.
Su médico posiblemente quiera realizar controles de su tensión arterial, sangre (recuento de plaquetas) y función renal.
Informe a su médico de que está utilizando Avonex:
- Si se le va a realizar un análisis de sangre. Avonex puede interferir en los resultados.
(Notas informativas)
En alguna ocasión será necesario que recuerde a otros profesionales médicos que está siendo tratado con Avonex. Por ejemplo, si se le prescriben otros medicamentos o si se le realiza un análisis de sangre, Avonex puede interaccionar con otros fármacos o con el resultado de la prueba.
Uso de AVONEX con otros medicamentos
Informe a su médico si está utilizando otros medicamentos, especialmente para el tratamiento de la epilepsia o de la depresión. Avonex puede afectar a otros medicamentos o resultar afectado por éstos. Esto incluye cualquier otro medicamento, incluidos medicamentos obtenidos sin receta.
Embarazo y lactancia
Si está embarazada, no comience a utilizar Avonex.
- Si puede quedar embarazada, debe utilizar un método anticonceptivo mientras use Avonex.
- Si tiene previsto tener un hijo o si se queda embarazada mientras se administra Avonex, informe a su médico. Comente con su médico si debe continuar con el tratamiento.
- Si ya está embarazada o cree que podría estarlo, informe a su médico lo antes posible.
- Si quiere dar el pecho a su hijo, hable primero con su médico.
Conducción y uso de máquinas
Si tiene sensación de mareo, no conduzca. Avonex hace que algunas personas se sientan mareadas. Si le ocurre esto o si presenta cualquier otro efecto secundario que pueda afectar a su capacidad, no conduzca ni utilice máquinas.
Información importante sobre algunos de los componentes de AVONEX:
Este medicamento está esencialmente exento de sodio. Contiene menos de 23 mg (1 mmol) de sodio por cada dosis semanal.
3. Cómo usar AVONEX Dosis recomendada
Una inyección de Avonex una vez por semana.
Intente utilizar Avonex a la misma hora el mismo día de cada semana.
No utilizar en niños
Avonex no se debe utilizar en niños menores de 12 años.
Si ha decidido empezar el tratamiento con Avonex, su médico puede suministrarle un dispositivo de ajuste de la dosis Avostartclip. El Avostartclip se acopla a la jeringa y le permite aumentar gradualmente la dosis de Avonex al iniciar usted el tratamiento. Esto es para limitar los síntomas seudogripales que algunos pacientes experimentan cuando comienzan a usar Avonex. Su médico o enfermera le ayudarán a usar el dispositivo de ajuste de dosis Avostartclip.
(Notas informativas)
Al iniciar Avonex
Si va a utilizar Avonex por primera vez, su médico puede aconsejarle que empiece a aumentar gradualmente la dosis para ajustar los efectos de Avonex_antes de administrar la dosis completa. Se le suministrará un dispositivo de ajuste de dosis Avostartclip. El Avostartclip se acopla a la jeringa para poder administrar una dosis reducida de Avonex al iniciar usted el tratamiento. Cada Avostartclip es para un solo uso, y se debe desechar junto con el resto de Avonex. Para obtener mayores detalles sobre su uso, hable con su médico.
Autoinyección
Puede inyectarse Avonex sin la ayuda de su médico si le han enseñado a hacerlo. Consulte las instrucciones de autoinyección al final de este prospecto (véase la sección 7, Cómo inyectar AVONEX).
Si tiene problemas para manejar la jeringa, hable con su médico. Puede recibir ayuda.
(Notas informativas)
Al final de este prospecto se incluyen más detalles sobre cómo inyectar Avonex.
Aguja alternativa:
El envase de Avonex ya contiene una aguja para inyección. El médico puede prescribirle una aguja más corta y fina, dependiendo de sus características corporales. Hable con su médico para saber si es adecuado para usted.
Si tiene problemas para manejar la jeringa, hable con su médico sobre el uso de un asidero para la jeringa. Es un soporte diseñado especialmente que le ayuda a inyectar Avonex.
Duración del tratamiento con AVONEX
Su médico le informará durante cuánto tiempo debe utilizar Avonex. Es importante que utilice Avonex de forma regular. No haga ningún cambio que no le haya indicado su médico.
Si se inyecta demasiada cantidad
Sólo debe administrarse una inyección de Avonex una vez por semana. Si se ha administrado más de una inyección de Avonex en el plazo de tres días, contacte inmediatamente con su médico o farmacéutico.
Si olvida una inyección
Si olvida su dosis semanal habitual, inyecte una dosis tan pronto como sea posible. A continuación suspenda el tratamiento durante una semana. Continúe la inyección ese día de cada semana. Si tiene un día preferido para utilizar Avonex, hable con su médico para ajustar la dosis y recuperar su día preferido. No se administre dos inyecciones para compensar la inyección olvidada.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
(Notas informativas)
Aunque la lista de posibles efectos adversos puede parecer preocupante, cabe la posibilidad de que no presente ninguno de ellos.
Efectos adversos graves: solicite ayuda médica
Reacciones alérgicas graves
Si presenta alguno de los síntomas siguientes:
- Hinchazón de cara, labios o lengua
- Dificultad para respirar
- Erupción.
Llame a un médico inmediatamente. No utilice Avonex hasta que haya hablado con un médico. Depresión
Si presenta algún síntoma de depresión:
- Sensación inusual de tristeza, ansiedad o desesperanza.
Llame a un médico inmediatamente.
Problemas hepáticos
Si presenta alguno de los síntomas siguientes:
- Coloración amarillenta de la piel o de la parte blanca de los ojos (ictericia)
- Picor generalizado
- Sensación de malestar (náuseas y vómitos)
- Hematomas que aparecen fácilmente en la piel.
Llame a un médico inmediatamente ya que pueden ser manifestaciones de un posible problema hepático.
Efectos adversos observados en ensayos clínicos
(Notas informativas)
Efectos adversos observados en ensayos clínicos. Son efectos adversos notificados por personas durante la evaluación de Avonex. Las cifras se basan en el número de personas que los presentaron. Dan una idea de la probabilidad de que usted desarrolle efectos adversos similares.
Efectos adversos muy frecuentes
(afectan al menos a 1 de cada 10 personas)
- Síntomas seudogripales: dolor de cabeza, dolores musculares, escalofríos o fiebre: véase Síntomas seudogripales, más adelante
- Dolor de cabeza.
Efectos adversos frecuentes
(afectan a menos de 1 de cada 10 personas)
- Pérdida del apetito
- Sensación de debilidad y cansancio
- Dificultad para dormir
- Depresión
- Rubor facial
- Destilación nasal
- Diarrea (deposiciones blandas)
- Sensación de malestar (náuseas o vómitos)
- Entumecimiento u hormigueo de la piel
- Erupción, hematomas cutáneos
- Aumento de la sudoración, sudores nocturnos
- Dolor en músculos, articulaciones, brazos, piernas o cuello
- Calambres musculares, rigidez en músculos y articulaciones
- Dolor, hematoma y enrojecimiento en el sitio de inyección
- Cambios en los análisis de sangre. Los síntomas que podría presentar son cansancio, infección repetida, hematoma o hemorragia sin causa aparente.
Efectos adversos poco frecuentes
(afectan a menos de 1 de cada 100 personas)
- Pérdida de cabello
- Cambios en la menstruación
- Sensación de quemazón en el sitio de inyección.
Efectos adversos raros
(afectan a menos de 1 de cada 1.000 personas)
- Dificultad para respirar
- Problemas renales que incluyen cicatrización que puede reducir su función renal Si presenta alguno o todos de los síntomas siguientes:
- Orina con espuma
- Fatiga
- Hinchazón, especialmente de tobillos y párpados, y aumento de peso.
Informe a su médico ya que pueden ser manifestaciones de un posible problema renal.
- Coágulos de sangre en los vasos sanguíneos pequeños que pueden afectar a sus riñones (púrpura trombótica trombocitopénica o síndrome urémico hemolítico). Los síntomas pueden incluir un aumento de moratones, sangrado, fiebre, debilidad extrema, dolor de cabeza, mareos o aturdimiento. Su médico puede encontrar alteraciones en su sangre y en la función renal.
Si le preocupa alguno de los efectos, hable con su médico.
Otros efectos adversos
(Notas informativas)
Estos efectos se han observado en personas que utilizan Avonex pero desconocemos la frecuencia con la que aparecen.
Déficit o exceso de actividad del tiroides
Nerviosismo o ansiedad, inestabilidad emocional, pensamientos irracionales o alucinaciones
(ver o escuchar cosas que no son reales), confusión o suicidio
Entumecimiento, mareo, convulsiones o crisis epilépticas y migrañas
Percepción de su latido cardíaco (palpitaciones), frecuencia cardíaca rápida o irregular, o
problemas de corazón que se acompañan de los siguientes síntomas: capacidad reducida para el
ejercicio, incapacidad para permanecer tumbado, dificultad respiratoria o hinchazón de tobillos
Problemas hepáticos como los descritos previamente
Urticaria o erupción seudovesiculosa, picor, empeoramiento de una psoriasis que ya tuviera Hinchazón o hemorragia en el sitio de inyección o dolor torácico después de una inyección Aumento o pérdida de peso
Cambios en los resultados de los análisis, como la variación de las pruebas de función hepática. Hipertensión arterial pulmonar: Enfermedad en la que se produce un gran estrechamiento de los vasos sanguíneos de los pulmones que provoca un aumento de la presión en los vasos sanguíneos que transportan la sangre del corazón a los pulmones. La hipertensión arterial pulmonar se observó en distintos momentos, incluso varios años después del inicio del tratamiento con medicamentos que contienen interferón beta.
Si le preocupa alguno de los efectos, hable con su médico.
Efectos de la inyección
- Sensación de desmayo: La primera inyección de Avonex puede ser administrada por su médico. Es posible que se maree. Puede que incluso se desmaye. Es improbable que ocurra de nuevo.
- Inmediatamente después de la inyección puede notar los músculos tensos o muy débiles,
como si se fuera a repetir la experiencia. Es raro. Sólo ocurre cuando se autoinyecta y los efectos pasan rápidamente. Pueden manifestarse en cualquier momento después de comenzar el tratamiento con Avonex.
- Si nota alguna irritación en la piel u otro problema cutáneo después de una inyección, hable con su médico.
Síntomas seudogripales
(Notas informativas)
Tres formas sencillas para reducir el impacto de los síntomas seudogripales:
1. Adminístrese la inyección de Avonex justo antes de acostarse. Estará dormido mientras aparecen los efectos.
2. Tome paracetamol o ibuprofeno media hora antes de la inyección de Avonex y continúe tomándolo durante el día siguiente. Comente con su médico o farmacéutico la dosis adecuada.
3. Si tiene fiebre, beba bastante agua para mantenerse hidratado.
Algunas personas refieren que después de inyectarse Avonex tienen una sensación seudogripal.
Los signos son:
- Dolor de cabeza
- Dolores musculares
- Escalofríos o fiebre.
Estos síntomas realmente no corresponden a la gripe.
No los puede transmitir a nadie. Son más frecuentes cuando utiliza Avonex por primera vez. Su médico puede suministrarle un dispositivo de ajuste de la dosis Avostartclip, que le permitirá aumentar gradualmente la dosis al iniciar usted el tratamiento a fin de ayudarle a limitar los síntomas seudogripales. Los síntomas seudogripales disminuyen gradualmente a medida que se administran más inyecciones.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de AVONEX
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta.
Conservar en el embalaje original (bandeja de plástico sellada) para protegerlo de la luz. Conservar en nevera (entre 2°C y 8°C). No congelar.
Avonex también se puede conservar a temperatura ambiente (entre 15°C y 30°C) durante un plazo máximo de una semana.
NO utilice Avonex si observa que:
- la j eringa precargada está rota.
- la bandeja de plástico sellada está dañada o abierta.
- la solución es coloreada u observa partículas en suspensión.
- el tapón a prueba de manipulaciones está dañado.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de AVONEX
El principio activo es: interferón beta-1a 30 microgramos/0,5 ml.
Los demás componentes son: acetato sódico trihidrato, ácido acético glacial, clorhidrato de arginina, polisorbato 20 y agua para inyectables.
Aspecto del producto y contenido del envase
Avonex Solución inyectable se presenta como una inyección lista para uso.
Una caja de Avonex contiene cuatro o doce jeringas (precargadas) listas para uso, cada una con 0,5 ml de un líquido transparente e incoloro en su interior. Puede que solamente estén comercializados algunos tamaños de envases. Cada jeringa está acondicionada en una bandeja de plástico sellada. En la bandeja también se incluye una aguja para administrar la inyección.
Titular de la autorización de comercialización y responsable de la fabricación
El titular de la autorización de comercialización es:
Biogen Idec Limited, Innovation House, 70 Norden Road, Maidenhead, Berkshire, SL6 4AY, Reino Unido.
Avonex es elaborado por:
Biogen (Denmark) Manufacturing ApS, Biogen Allé 1, DK-3400 Hillerod, Dinamarca.
Contacte con los representantes locales si desea una versión de este prospecto con letra más grande.
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgie/Belgique/Belgien
Biogen Belgium NV/SA ® +3222191218
Bt^rapuu
Tn EBOOAPMA
® +359 2 962 12 00
Ceská republika
Biogen (Czech Republic) s.r.o. ® +420 255 706 200
Lietuva
UAB "JOHNSON & JOHNSON"
® +370 5 278 68 88
Luxembourg/Luxemburg
Biogen Belgium NV/SA ® +3222191218
Magyarország
Biogen Hungary Kft.
® +36 1 899 9883
|
Danmark Biogen Denmark A/S ® +45 77 41 57 57 |
Malta Pharma. MT Ltd.. ® +356 21337008 |
|
Deutschland Biogen GmbH ® +49 (0) 89 99 6170 |
Nederland Biogen Netherlands B.V. ® +31 20 542 2000 |
|
Eesti UAB "JOHNSON & JOHNSON" Eesti filiaal ® +372 617 7410 |
Norge Biogen Norway AS ® +47 23 40 01 00 |
|
ELXába Genesis Pharma SA ® +30 210 8771500 |
Osterreich Biogen Austria GmbH ® +43 1 484 46 13 |
|
España Biogen Spain S.L. ® +34 91 310 7110 |
Polska Biogen Poland Sp. z o.o. ® +48 22 351 51 00 |
|
France Biogen France SAS ® +33 (0)1 41 37 9595 |
Portugal Biogen Portugal Sociedade Farmacéutica, Unipessoal Lda. ® +351 21 318 8450 |
|
Hrvatska Medis Adria d.o.o. ® +385 1 230 34 46 |
Romania Johnson & Johnson Romania S.R.L. ® +40 21 207 18 00 |
|
Ireland Biogen Idec (Ireland) Ltd. ® +353 (0)1 463 7799 |
Slovenija Biogen Pharma d.o.o. ® +386 1 511 02 90 |
|
Ísland Icepharma hf ® +354 540 8000 |
Slovenská republika Biogen Slovakia s.r.o. ® +421 2 323 34008 |
|
Italia Biogen Italia s.r.l. ® +39 02 584 9901 |
Suomi/Finland Biogen Finland Oy ® +358 207 401 200 |
|
Kúrcpog Genesis Pharma Cyprus Ltd ® +3572 2 769946 |
Sverige Biogen Sweden AB ® +46 8 594 113 60 |
|
Latvija UAB "JOHNSON & JOHNSON" filíale Latvija ® +371 678 93561 |
United Kingdom Biogen Idec Limited ® +44 (0) 1628 50 1000 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Debe recibir formación sobre cómo inyectarse Avonex
Estas notas son un recordatorio. Si tiene alguna duda, consulte a su médico o farmacéutico.
Dónde inyectar
• Avonex se inyecta en un músculo, por ejemplo, en los músculos de la región superior del muslo. No se recomienda la inyección de Avonex en las nalgas.
• Inyecte en un sitio diferente cada semana. Esto implica menos riesgo de irritación cutánea o muscular.
• No utilice regiones de la piel con hematomas, úlceras o infectadas o si presentan una herida abierta.
Contenido de la bandeja de plástico

Protector blanco a prueba Jeringa Émbolo
de manipulación
Protector de la aguja
Aguja
A. Preparación
1. Extraiga una bandeja de plástico sellada de la nevera.
- Compruebe la fecha de caducidad en la tapa de la bandeja. No utilizar si está caducada.
- Retire completamente la tapa de papel. Compruebe que la bandeja blister contiene una jeringa precargada y una aguja de inyección (véase la imagen “Contenido de la bandeja de plástico”).
2. Permita que se caliente la jeringa
- Déjela a temperatura ambiente durante media hora. Esto hace que la inyección sea más cómoda que si se inyecta procedente directamente de la nevera.
Consejo: no utilice fuentes externas de calor, como agua caliente, para calentar la jeringa.
3. Lávese bien las manos con agua y jabón y séqueselas.
4. Prepare torundas de algodón humedecidas en alcohol y apósitos de tipo tirita (no
suministrados) si los necesita.
Localice una superficie limpia y resistente para depositar el material necesario para la
inyección. Sitúe la bandeja sobre la misma.
B. Preparación de la inyección
1

2

3


Inspeccione el líquido de la jeringa
Debe ser transparente e incoloro. Si la solución está turbia, no es transparente o contiene partículas en suspensión, no utilice la jeringa precargada.
Retire el protector de la jeringa
La jeringa tiene un protector blanco a prueba de manipulaciones.
Asegúrese de que el protector está intacto y de que no ha sido abierto.
No utilice esa jeringa si le parece que el protector ha sido abierto. Sostenga la jeringa de modo que el protector blanco esté situado hacia arriba.
Doble el protector formando un ángulo recto hasta que se rompa.
No toque el puerto de conexión.
No presione el émbolo.
Conecte la aguja
Abra la aguja para exponer el puerto de conexión. No retire el protector.
Haga presión con la aguja sobre la jeringa.
Gire en el sentido de las agujas del reloj hasta que se bloquee
Consejo: asegúrese de que la aguja de inyección está firmemente conectada a la jeringa. Puede haber fugas en caso contrario.
Si le han indicado aumentar gradualmente la dosis de Avonex, tal vez necesite utilizar un dispositivo de ajuste de dosis Avostartclip que su médico le facilitará. Para mayores detalles, hable con su médico.
Ahora retire el protector plástico de la aguja. No lo gire.
Consejo: si gira el protector de la aguja para retirarlo, también puede desconectar accidentalmente la aguja.
C. Administración de la inyección

Limpie y estire el sitio de inyección
Si es necesario, utilice una torunda humedecida en alcohol para limpiar la piel en el sitio de inyección que ha elegido. Permita que se seque la piel. Con una mano, estire la piel que rodea el sitio de inyección.
Relaje la musculatura.
2

Administre la inyección
Introduzca la aguja de inyección en el músculo con un movimiento rápido, como si lanzara un dardo, formado un ángulo recto con la piel. Se debe introducir toda la aguja.
Presione el émbolo lentamente hasta vaciar la jeringa.
Si utiliza la jeringa con un Avostartclip acoplado, usted recibirá una dosis más baja de Avonex.
La jeringa no se vaciará del todo.
Extraiga la aguja



Mantenga la piel perfectamente estirada o comprima la piel alrededor del lugar de inyección y extraiga la aguja.
Si utiliza torundas humedecidas en alcohol, aplique una en el sitio de inyección.
Si es necesario, aplique un apósito (tirita) sobre el sitio de inyección.
Deseche debidamente los residuos
Cuando finalice cada inyección, tire la aguja y la jeringa en un recipiente especial (como el destinado a objetos cortantes), no a la basura general. Si ha utilizado el Avostartclip, la jeringa (y el Avostartclip) debe desecharse después del uso. No debe utilizarse el resto de Avonex que quede.
El papel de desecho y las torundas utilizadas se pueden tirar a la basura general.
Prospecto: información para el usuario
AVONEX 30 microgramos/0,5 ml solución inyectable en pluma precargada
(Interferón beta-1a)
Pluma precargada
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Aunque haya utilizado Avonex con anterioridad, parte de la información puede haber cambiado.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
(Notas informativas)
Este prospecto cambia de vez en cuando.
Compruebe la posible actualización de este prospecto cada vez que renueve su receta.
(Notas informativas)
Si tiene alguna duda, consulte a su médico o farmacéutico.
Contenido del prospecto
Las páginas de la derecha contienen la información que necesitará para utilizar Avonex Pen correctamente.
En cada página a la izquierda encontrará consejos y explicaciones útiles sobre cómo sacar el máximo beneficio de su medicamento.
En el interior de la contraportada encontrará un gráfico desplegable con todo lo que necesita para poder administrarse las inyecciones con la pluma Avonex.
Contenido del prospecto
1. Qué es AVONEX y para qué se utiliza
2. Qué necesita saber antes de empezar a usar AVONEX
3. Cómo usar AVONEX PEN
4. Posibles efectos adversos
5. Conservación del AVONEX PEN
6. Contenido del envase e información adicional
7. Cómo inyectarse utilizando AVONEX PEN
1. Qué es AVONEX y para qué se utiliza
(Notas informativas)
Avonex funciona mejor cuando lo utiliza:
- a la misma hora
- una vez por semana
- periódicamente
No deje su tratamiento con Avonex sin hablar previamente con su neurólogo.
Avonex Pen se utiliza para inyectar Avonex. El principio activo de Avonex es una proteína llamada interferón beta-1a. Los interferones son sustancias naturales elaboradas por su organismo para protegerle de infecciones y enfermedades. La proteína de Avonex se elabora exactamente con los mismos ingredientes que el interferón beta presente en el organismo humano.
¿Para qué se utiliza AVONEX?
Avonex se utiliza para tratar la esclerosis múltiple (EM). El tratamiento con Avonex puede ayudar a evitar que empeore, aunque no curará la EM.
Cada paciente tiene unos síntomas específicos de EM. Pueden ser:
- Sensación de inestabilidad o mareo, problemas para caminar, rigidez y espasmos musculares, cansancio, hormigueo en la cara, brazos o piernas
- Dolor agudo o crónico, problemas vesicales e intestinales, problemas sexuales y problemas visuales
- Dificultad para pensar y concentrarse, depresión.
La EM también tiende a exacerbarse cada cierto tiempo: esto es lo que se conoce como recidiva.
Avonex puede ayudar a reducir el número de recidivas que pueda presentar y a frenar los efectos incapacitantes de la EM. Su médico le explicará durante cuánto tiempo puede utilizar Avonex o cuándo interrumpir el tratamiento.
¿Cómo actúa AVONEX?
La esclerosis múltiple se asocia a una lesión neural (del cerebro o de la médula espinal). En la EM, el sistema de defensa de su organismo reacciona frente a su propia mielina, es decir, el aislamiento que rodea las fibras nerviosas. Cuando se lesiona la mielina, se alteran los mensajes entre el cerebro y las demás partes del organismo. Esto es lo que provoca los síntomas de la EM. Avonex parece que actúa impidiendo que el sistema de defensa de su organismo ataque la mielina.
2. Qué necesita saber antes de empezar a usar AVONEX
(Notas informativas)
Avonex y las reacciones alérgicas
Como Avonex está elaborado con una proteína, existe una pequeña probabilidad de que aparezca una reacción alérgica.
Información adicional sobre la depresión
No debe utilizar Avonex si padece una depresión severa o tiene pensamientos suicidas. Si tiene depresión, su médico puede aún prescribirle Avonex, pero es importante que le haga saber si ha tenido depresión u otro problema similar que afecte a su estado de ánimo.
No use AVONEX:
- Si es alérgico al interferón beta o a cualquier componente de este medicamento (incluidos en la sección 6)
- Si está embarazada, no comience a utilizar Avonex
- Si padece una depresión grave o tiene ideas de suicidio.
Hable inmediatamente con su médico en cualquiera de estos casos.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Avonex si tiene o ha tenido en el pasado:
- Depresión o problemas que afecten a su estado de ánimo
- Pensamientos suicidas.
Debe informar inmediatamente a su médico de los cambios en el estado de ánimo, ideas de suicidio, sensación inusual de tristeza, ansiedad o desesperanza.
- Epilepsia u otros trastornos convulsivos no controlados con medicación
- Problemas renales o hepáticos graves
- Recuentos bajos de leucocitos o plaquetas, lo que puede incrementar el riesgo de infección, hemorragia o anemia
- Problemas de corazón que puedan producir síntomas como dolor torácico (angina), especialmente después de cualquier actividad; hinchazón de tobillos, dificultad respiratoria (insuficiencia cardíaca congestiva) o un ritmo cardíaco irregular (arritmias).
Hable con su médico si presenta alguna de estas enfermedades o si empeoran mientras usa Avonex.
Durante el tratamiento, se pueden formar coágulos de sangre en los vasos sanguíneos pequeños . Estos coágulos podrían afectar a sus riñones. Esto puede ocurrir tras varias semanas o varios años después de comenzar el tratamiento con Avonex.
Su médico posiblemente quiera realizar controles de su tensión arterial, sangre (recuento de plaquetas) y función renal.
Informe a su médico de que está utilizando Avonex:
- Si se le va a realizar un análisis de sangre. Avonex puede interferir en los resultados.
(Notas informativas)
En alguna ocasión será necesario que recuerde a otros profesionales médicos que está siendo tratado con Avonex. Por ejemplo, si se le prescriben otros medicamentos o si se le realiza un análisis de sangre, Avonex puede interaccionar con otros fármacos o con el resultado de la prueba.
Uso de AVONEX con otros medicamentos
Informe a su médico si está utilizando otros medicamentos, especialmente para el tratamiento de la epilepsia o de la depresión. Avonex puede afectar a otros medicamentos o resultar afectado por éstos. Esto incluye también cualquier medicamento obtenido sin receta.
Embarazo y lactancia
Si está embarazada, no comience a utilizar Avonex.
- Si puede quedar embarazada, debe utilizar un método anticonceptivo mientras use Avonex.
- Si tiene previsto tener un hijo o si se queda embarazada mientras se administra Avonex, informe a su médico. Comente con su médico si debe continuar con el tratamiento.
- Si ya está embarazada o cree que podría estarlo, informe a su médico lo antes posible.
- Si quiere dar el pecho a su hijo, hable primero con su médico.
Conducción y uso de máquinas
Si tiene sensación de mareo, no conduzca. Avonex hace que algunas personas se sientan mareadas. Si le ocurre esto o si presenta cualquier otro efecto secundario que pueda afectar a su capacidad, no conduzca ni utilice máquinas.
Información importante sobre algunos de los componentes de Avonex:
Este medicamento está esencialmente exento de sodio. Contiene menos de 23 mg (1 mmol) de sodio por cada dosis semanal.
3. Cómo usar AVONEX PEN
(Notas informativas)
Hay más información sobre cómo inyectarse utilizando Avonex Pen: En la sección desplegable en la parte posterior de este prospecto.
Dosis semanal recomendada
Una inyección utilizando Avonex Pen, una vez por semana.
Intente utilizar Avonex a la misma hora el mismo día de cada semana.
No utilizar en niños
Avonex no se debe utilizar en niños menores de 12 años.
Autoinyección
Puede autoinyectarse utilizando Avonex Pen sin la ayuda de su médico si le han enseñado a hacerlo. Consulte las instrucciones de autoinyección al final de este prospecto (ver sección 7, Cómo inyectarse utilizando Avonex Pen).
Si tiene problemas para manipular Avonex Pen, consulte a su médico quien podrá ayudarle.
Duración del tratamiento con AVONEX
Su médico le informará durante cuánto tiempo debe utilizar Avonex. Es importante que utilice Avonex de forma regular. No haga ningún cambio que no le haya indicado su médico.
Si se inyecta demasiada cantidad
Debe administrarse la inyección utilizando únicamente un Avonex Pen, una vez por semana. Si ha utilizado más de un Avonex Pen en el plazo de tres días, contacte inmediatamente con su médico o farmacéutico para que le aconsejen.
Si olvida una inyección
Si olvida su dosis semanal habitual, inyecte una dosis tan pronto como sea posible. A continuación deje pasar una semana antes de volver a utilizar Avonex Pen. Continúe la inyección ese día de cada semana. Si tiene un día preferido para utilizar Avonex, hable con su médico para ajustar la dosis y recuperar su día preferido. No se administre dos inyecciones para compensar la inyección olvidada.
4. Posibles efectos adversos
(Notas informativas)
Aunque la lista de posibles efectos adversos puede parecer preocupante, cabe la posibilidad de que no presente ninguno de ellos.
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves: solicite ayuda médica.
Reacciones alérgicas graves
Si presenta alguno de los síntomas siguientes:
- Hinchazón de cara, labios o lengua
- Dificultad para respirar
- Erupción.
Llame a un médico inmediatamente. No utilice Avonex hasta que haya hablado con un médico. Depresión
Si presenta algún síntoma de depresión:
- Sensación inusual de tristeza, ansiedad o desesperanza.
Llame a un médico inmediatamente.
Problemas hepáticos
Si presenta alguno de los síntomas siguientes:
- Coloración amarillenta de la piel o de la parte blanca de los ojos (ictericia)
- Picor generalizado
- Sensación de malestar (náuseas y vómitos)
- Hematomas que aparecen fácilmente en la piel.
Llame a un médico inmediatamente ya que pueden ser manifestaciones de un posible problema hepático.
Efectos adversos observados en ensayos clínicos
(Notas informativas)
Efectos adversos observados en ensayos clínicos.
Son efectos adversos notificados por personas durante la evaluación de Avonex. Las cifras se basan en el número de personas que los presentaron. Dan una idea de la probabilidad de que usted desarrolle efectos adversos similares.
Efectos adversos muy frecuentes (afectan al menos a 1 de cada 10personas)
- síntomas seudogripales: dolor de cabeza, dolores musculares, escalofríos o fiebre: véase Síntomas seudogripales, más adelante
- Dolor de cabeza.
Efectos adversos frecuentes (afectan a menos de 1 de cada 10 personas)
- Pérdida del apetito
- Sensación de debilidad y cansancio
- Dificultad para dormir
- Depresión
- Rubor facial
- Destilación nasal
- Diarrea (deposiciones blandas)
- Sensación de malestar (náuseas o vómitos)
- Entumecimiento u hormigueo de la piel
- Erupción, hematomas cutáneos
- Aumento de la sudoración, sudores nocturnos
- Dolor en músculos, articulaciones, brazos, piernas o cuello
- Calambres musculares, rigidez en músculos y articulaciones
- Dolor, hematoma y enrojecimiento en el sitio de inyección
- Cambios en los análisis de sangre. Los síntomas que podría presentar son cansancio, infección repetida, hematoma o hemorragia sin causa aparente.
Efectos adversos poco frecuentes (afectan a menos de 1 de cada 100 personas)
- Pérdida de cabello
- Cambios en la menstruación
- Sensación de quemazón en el sitio de inyección.
Efectos adversos raros (afectan a menos de 1 de cada 1.000 personas)
- Dificultad para respirar
- Problemas renales que incluyen cicatrización que puede reducir su función renal Si presenta alguno o todos de los síntomas siguientes:
- Orina con espuma
- Fatiga
- Hinchazón, especialmente de tobillos y párpados, y aumento de peso.
Informe a su médico ya que pueden ser manifestaciones de un posible problema renal.
- Coágulos de sangre en los vasos sanguíneos pequeños que pueden afectar a sus riñones (púrpura trombótica trombocitopénica o síndrome urémico hemolítico). Los síntomas pueden incluir un aumento de moratones, sangrado, fiebre, debilidad extrema, dolor de cabeza, mareos o aturdimiento. Su médico puede encontrar alteraciones en su sangre y en la función renal.
Si le preocupa alguno de los efectos, hable con su médico.
Otros efectos adversos
(Notas informativas)
Estos efectos se han observado en personas que utilizan Avonex pero desconocemos la frecuencia con la que aparecen.
Si se siente mareado, no conduzca.
- Déficit o exceso de actividad del tiroides
- Nerviosismo o ansiedad, inestabilidad emocional, pensamientos irracionales o alucinaciones (ver o escuchar cosas que no son reales), confusión o suicidio
- Entumecimiento, mareo, convulsiones o crisis epilépticas y migrañas
- Percepción de su latido cardíaco (palpitaciones), frecuencia cardíaca rápida o irregular, o problemas de corazón que se acompañan de los siguientes síntomas: capacidad reducida para el ejercicio, incapacidad para permanecer tumbado, dificultad respiratoria o hinchazón de tobillos
- Problemas hepáticos como los descritos previamente
- Urticaria o erupción seudovesiculosa, picor, empeoramiento de una psoriasis que ya tuviera
- Hinchazón o hemorragia en el sitio de inyección o dolor torácico después de una inyección
- Aumento o pérdida de peso
- Cambios en los resultados de los análisis, como la variación de las pruebas de función hepática.
- Hipertensión arterial pulmonar: Enfermedad en la que se produce un gran estrechamiento de los vasos sanguíneos de los pulmones que provoca un aumento de la presión en los vasos sanguíneos que transportan la sangre del corazón a los pulmones. La hipertensión arterial pulmonar se observó en distintos momentos, incluso varios años después del inicio del tratamiento con medicamentos que contienen interferón beta.
Si le preocupa alguno de los efectos, hable con su médico.
Efectos de la inyección
- Sensación de desmayo: La primera inyección de Avonex puede ser administrada por su médico. Es posible que se maree. Puede que incluso se desmaye. Es improbable que ocurra de nuevo.
- Inmediatamente después de la inyección puede notar los músculos tensos o muy débiles,
como si se fuera a repetir la experiencia. Es raro. Sólo ocurre cuando se autoinyecta y los efectos pasan rápidamente. Pueden manifestarse en cualquier momento después de comenzar el tratamiento con Avonex.
- Si nota alguna irritación en la piel u otro problema cutáneo después de una inyección, hable con su médico.
Síntomas seudogripales
(Notas informativas)
Tres formas sencillas para reducir el impacto de los síntomas seudogripales:
1. Adminístrese la inyección con Avonex Pen justo antes de acostarse. Así podrán pasar los efectos mientras duerme.
2. Tome paracetamol o ibuprofeno media hora antes de la inyección con Avonex Pen y continúe tomándolo durante un día. Hable con su médico o farmacéutico sobre la dosis adecuada.
3. Si tiene fiebre, beba bastante agua para mantenerse hidratado.
Algunas personas refieren que después de usar Avonex Pen se sienten como si tuvieran gripe.
Los signos son:
- Dolor de cabeza
- Dolores musculares
- Escalofríos o fiebre.
Estos síntomas realmente no corresponden a la gripe.
No los puede transmitir a nadie. Son más frecuentes cuando utiliza Avonex por primera vez. Los síntomas seudogripales disminuyen gradualmente a medida que se administran más inyecciones.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación del AVONEX PEN
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta.
Avonex Pen contiene una jeringa precargada de Avonex. Conservar en el embalaje original para protegerlo de la luz.
Conservar en nevera (entre 2°C y 8°C). No congelar.
Avonex Pen puede también conservarse a temperatura ambiente (entre 15°C y 30°C) durante una semana como máximo.
No utilice Avonex pen si observa que:
- La pluma está rota.
- La solución tiene color y puede ver partículas flotando.
- La cápsula de garantía de cierre está rota.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de AVONEX PEN
El principio activo es: interferón beta-la 30 microgramos/0,5 ml.
Los demás componentes son: acetato sódico trihidrato, ácido acético glacial, clorhidrato de arginina, polisorbato 20 y agua para inyectables.
Aspecto de AVONEX PEN y contenido del envase
Cada envase individual contiene un Avonex Pen, una aguja y un protector de la pluma. Avonex Pen contiene una jeringa precargada de Avonex y únicamente deberá utilizarse después de haber recibido la formación adecuada. Avonex Pen se presenta en envases con cuatro o doce, para un mes o tres meses de inyección.
Titular de la autorización de comercialización y responsable de la fabricación El titular de la autorización de comercialización es:
Biogen Idec Limited, Innovation House, 70 Norden Road, Maidenhead, Berkshire, SL6 4AY, Reino Unido.
Avonex es elaborado por:
Biogen (Denmark) Manufacturing ApS, Biogen Allé 1, DK-3400 Hillerod, Dinamarca.
Contacte con los representantes locales si desea una versión de este prospecto con letra más grande.
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Lietuva
UAB "JOHNSON & JOHNSON"
W +370 5 278 68 88
Luxembourg/Luxemburg
Biogen Belgium NV/SA W +3222191218
Magyarország
Biogen Hungary Kft.
W +36 1 899 9883
Malta
Pharma. MT Ltd..
W +356 21337008
Nederland
Biogen Netherlands B.V.
W +31 20 542 2000
Norge
Biogen Norway AS W +47 23 40 01 00
Belgie/Belgique/Belgien
Biogen Belgium NV/SA W +3222191218
Bt^rapnn
Tn EBOOAPMA
W +359 2 962 12 00
Ceská republika
Biogen (Czech Republic) s.r.o.
W +420 255 706 200
Danmark
Biogen Denmark A/S W +45 77 41 57 57
Deutschland
Biogen GmbH W +49 (0) 89 99 6170
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal W +372 617 7410
|
ELXúba Genesis Pharma SA W +30 210 8771500 |
Osterreich Biogen Austria GmbH W +43 1 484 46 13 |
|
España Biogen Spain S.L. W +34 91 310 7110 |
Polska Biogen Poland Sp. z o.o. W +48 22 351 51 00 |
|
France Biogen France SAS W +33 (0)1 41 37 9595 |
Portugal Biogen Portugal Sociedade Farmacéutica, Unipessoal Lda. W +351 21 318 8450 |
|
Hrvatska Medis Adria d.o.o. W +385 1 230 34 46 |
Romania Johnson & Johnson Romania S.R.L. W +40 21 207 18 00 |
|
Ireland Biogen Idec (Ireland) Ltd. W +353 (0)1 463 7799 |
Slovenija Biogen Pharma d.o.o. W +386 1 511 02 90 |
|
Ísland Icepharma hf W +354 540 8000 |
Slovenská republika Biogen Slovakia s.r.o. W +421 2 323 34008 |
|
Italia Biogen Italia s.r.l. W +39 02 584 9901 |
Suomi/Finland Biogen Finland Oy W +358 207 401 200 |
|
Kúrcpog Genesis Pharma Cyprus Ltd W +3572 2 769946 |
Sverige Biogen Sweden AB W +46 8 594 113 60 |
|
Latvija UAB "JOHNSON & JOHNSON" filíale Latvija W +371 678 93561 |
United Kingdom Biogen Idec Limited W +44 (0) 1628 50 1000 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
7. Cómo inyectarse utilizando AVONEX PEN
Avonex Pen (un solo uso)
Contenido del envase - Avonex Pen, aguja y protector de Avonex Pen

Avonex Pen - preparado para la inyección

Avonex Pen - después de la inyección (preparado para la eliminación)
Ventana de visualizad ón circular

Tapadera de la pluma Avonex
Deberá haber recibido formación sobre cómo utilizar Avonex Pen.
Estas notas son un recordatorio. Si tiene alguna duda o algún problema, consulte a su médico o farmacéutico.
Dónde inyectar
(Notas informativas)

Utilice un lugar de inyección diferente cada semana
La mejor zona es la cara externa en la región superior del músculo del muslo. Alterne entre el muslo izquierdo y el derecho.
Anote el lugar de inyección de cada semana.
• Avonex se inyecta en un músculo, la mejor zona es la cara externa en la región superior
del músculo del muslo como se muestra en el diagrama al lado. No se recomienda la inyección en nalgas.
• Utilice un lugar de inyección diferente cada semana. Esto implica menos riesgo de irritación cutánea o muscular.
• No utilice regiones de la piel con hematomas, doloridas o infectadas o si presentan una herida abierta.
(Notas informativas) Dé la vuelta a la hoja
A. Preparación
1. Saque un Avonex Pen de la nevera
Compruebe que el envase contiene un Avonex Pen, una aguja y un protector de la pluma.
No agite Avonex Pen.
Compruebe la fecha de caducidad que aparece en la etiqueta del Avonex Pen.
No la utilice si está caducada.
2. Deje que el Avonex Pen se caliente
Déjela a temperatura ambiente durante media hora.
Esto hace que la inyección resulte más cómoda que cuando se utiliza directamente de la nevera. Consejo: No utilice fuentes de calor externo como agua caliente para calentar Avonex Pen.
3. Lávese bien las manos con agua y jabón y séqueselas.
4. Prepare toallitas empapadas en alcohol y tiritas (no se suministran) si las necesita.
5. Localice una superficie limpia y resistente para depositar el material necesario para la inyección.
(Notas informativas)
Desdoble la hoja
B. Preparación de Avonex
1
Antes

Después

2
Antes
Después
Pen
1 Retire la cápsula de garantía de cierre Asegúrese de que la cápsula de cierre esté intacta y no ha sido abierto. Si parece que se ha abierto, no utilice ese Avonex Pen.
• Sujete Avonex Pen de modo que la cápsula de cierre mire hacia arriba.
• Doble la cápsula de cierre en un ángulo recto para que se desacople.
• No toque la punta de cristal que queda expuesta.
Consejo: Ponga la pluma sobre la mesa antes de comenzar con el paso 2.
2 Conecte la aguja.
• El diseño de Avonex Pen permite que funcione únicamente con la aguja suministrada
• Retire el envoltorio desde la base del protector de la aguja.
• Acople la aguja presionándola sobre la punta de vidrio de la pluma. Mantenga la pluma en vertical hacia arriba.
• No retire el protector de la aguja.
• Con cuidado, gire la aguja en el sentido de las agujas del reloj hasta que quede firmemente acoplada, de lo contrario podría haber fugas. Podría no recibir una dosis completa si hay fugas.
Consejo: El protector de la aguja se desprenderá
automáticamente durante el paso 3 siguiente.
3

3 Extender el protector del inyector.
• Sujete firmemente el cuerpo de la pluma con una mano. Apunte con el protector de la punta lejos de usted y de cualquier otra persona.
• Con la otra mano y con un movimiento rápido, levante la pantalla del inyector (zona ranurada) por encima de la aguja hasta que la aguja quede totalmente cubierta.
• El protector plástico de la aguja se desprenderá.
Consejo: No pulse el botón de activación azul al mismo tiempo.
5


4 Compruebe que la pantalla del inyector esté correctamente extendida.
• Compruebe que la pantalla del inyector esté totalmente extendida. Quedará a la vista una pequeña zona rectangular junto a la ventana de visualización ovalada. Es el cierre de seguridad.
5 Compruebe el líquido
• Mire por la ventana de visualización ovalada. El líquido debe ser transparente e incoloro.
Si la solución está turbia, tiene color o contiene partículas flotando, no utilice esta pluma.
Las burbujas de aire son normales.
1

2

1 Limpie el sitio de inyección
Si necesita, utilice una toallita empapada con alcohol para limpiar la piel en el lugar de inyección elegido. Deje secar la piel.
Consejo: La mejor zona es la parte superior externa del muslo.
2 Ponga Avonex Pen sobre la piel
• Sujete con una mano el cuerpo de la pluma formando un ángulo recto con el lugar de inyección. Asegúrese de que se vean las ventanas de la pluma.
Consejo: Tenga cuidado de no pulsar el botón de activación azul demasiado pronto.
• Presione con firmeza el cuerpo de la pluma sobre la piel para liberar el cierre de seguridad.
• Compruebe que el cierre de seguridad esté liberado. La ventana pequeña rectangular desaparecerá. Avonex Pen está listo para inyectar.
Consejo: Continúe sujetando la pluma con firmeza sobre la piel.
4
5



3 Administración de la inyección
• Pulse el botón de activación azul con el dedo pulgar para comenzar la inyección.
Escuchará un “clic” que indica que el proceso de inyección ha
comenzado. No aparte la pluma de la piel.
• Continúe sujetando la pluma sobre la piel y cuente despacio hasta 10 segundos.
• Después de 10 segundos, tire de la pluma para sacar la aguja del lugar de inyección.
• Presione sobre el lugar de inyección durante unos segundos. Si hay algo de sangre en el lugar, límpiela.
4 Confirme la administración de la inyección
• Compruebe la ventana de visualización circular. Cuando se ha administrado la dosis completa, la ventana se ve amarilla.
• No reutilice Avonex Pen. Es de un solo uso.
5 Eliminación
• Ponga el protector de la pluma sobre una superficie plana y resistente
Consejo: No sujete el protector de la pluma. Podrá sufrir una
lesión por pinchazo.
• Introduzca la aguja directamente en el protector de la pluma.
• Presione con firmeza hasta que escuche un “clic” para sellar la aguja. Puede que necesite utilizar las dos manos. Una vez que la pluma esté sellada, no hay riesgo de lesiones.
• Elimine la basura correctamente. Su médico, enfermera o farmacéutico le facilitarán instrucciones sobre cómo eliminar Avonex Pen utilizado, por ejemplo en un recipiente para objetos cortantes.
99
La frecuencia de aparición es mayor al comienzo del tratamiento.
DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Seroalbúmina humana Fosfato de sodio dibásico Fosfato de sodio monobásico Cloruro de sodio
6.2 Incompatibilidades
No procede
6.3 Periodo de validez 2 años.
FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13/marzo/1997 Fecha de la última renovación: 13/marzo/2007
La frecuencia de aparición es mayor al comienzo del tratamiento.
DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acetato de sodio trihidrato Ácido acético glacial Hidrocloruro de arginina Polisorbato 20
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede
6.3 Periodo de validez 3 años.
6.4 Precauciones especiales de conservación
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/97/033/003
EU/1/97/033/004
La frecuencia de aparición es mayor al comienzo del tratamiento.