Avandia 8 Mg Comprimidos Con Cubierta Pelicular
Información obsoleta, busque otro
1. NOMBRE DEL MEDICAMENTO
AVANDIA 2 mg comprimidos recubiertos con película
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
<2>
Cada comprimido contiene una cantidad de maleato de rosiglitazona correspondiente a 2 mg de rosiglitazona.
Excipiente
Contiene lactosa (aproximadamente 108 mg).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
.O
Comprimido recubierto con película (comprimido).
Comprimidos recubiertos con película de color rosa que llevan la inscripción "GSK" en una cara y "2" en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Rosiglitazona está indicada para el tratamiento de la diabetes mellitus tipo 2:
<Nr
en monoterapia
- en adultos (especialmente aquéllos con sobrepeso) con control insuficiente con dieta y ejercicio en los que el tratamiento con metformina se considera inadecuado, por existir contraindicaciones o intolerancia
en doble terapia oral en combinación con
- metformina, en adultos (especialmente aquéllos con sobrepeso) con control glucémico insuficiente a pesar de recibir la dosis máxima tolerada en monoterapia con metformina
- una sulfonilurea, sólo en adultos con intolerancia a metformina o para los que metformina está contraindicada, con control glucémico insuficiente a pesar del tratamiento en monoterapia con una sulfonilurea
en triple terapia oral en combinación con

4P.o2s
metformina y una sulfonilurea, en adultos (especialmente aquéllos con sobrepeso) con control glucémico insuficiente a pesar de la doble terapia oral (ver sección 4.4).
Posología y forma de administración
osología
El tratamiento con rosiglitazona se suele iniciar con 4 mg/día. Esta posología se puede incrementar hasta 8 mg/día después de ocho semanas si se precisa un mayor control de la glucemia. En pacientes a los que se administra rosiglitazona en combinación con una sulfonilurea, se debe realizar un incremento en la posología de rosiglitazona de hasta 8 mg/día cautelosamente, después de efectuar la evaluación clínica adecuada para valorar el riesgo de que el paciente desarrolle reacciones adversas relacionadas con la retención de líquidos (ver secciones 4.4 y 4.8).
Rosiglitazona se puede administrar en una o dos tomas diarias (bien como una dosis diaria o dividida en dos dosis).
Poblaciones especiales
Pacientes de edad avanzada (>65 años) (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)

No es necesario ajustar la dosis en los pacientes de edad avanzada.
Insuficiencia renal (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve y moderada. Se dispone de datos limitados en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) por tanto, rosiglitazona se debe utilizar con precaución en estos pacientes.
Insuficiencia hepática
No se debe utilizar rosiglitazona en pacientes con insuficiencia hepática (ver sección 4.3 Población pediátrica
No se dispone de datos sobre el empleo de rosiglitazona en niños menores de 10 años. Existen datos limitados sobre el tratamiento en monoterapia con rosiglitazona en niños y adolescentes de edades entre 10 y 17 años (ver secciones 5.1 y 5.2). Los datos disponibles no confirman la eficacia en la población pediátrica, por lo que no se recomienda su uso.
Forma de administración
Los comprimidos se deben tragar con agua y se pueden tomar con o sin alimentos.
&
Para mejorar el cumplimiento terapéutico, se sugiere que a los pacientes se les aconseje tomar los comprimidos en torno a la misma hora cada día.
La utilización de rosiglitazona está contraindicada en pacientes con:
- hipersensibilidad conocida a rosiglitazona o a alguno de los excipientes
- insuficiencia cardiaca o historia de insuficiencia cardiaca (clases I a IV de la NYHA)
- un Síndrome Coronario Agudo (angina inestable, infarto de miocardio sin elevación del
segmento ST (IAMSEST) e infarto de miocardio con elevación del segmento ST (IAMCEST)) (ver sección 4.4)
- insuficiencia hepática
♦ if\
- cetoacidosis diabética o pre-coma diabético.
4.4 Advertencias y precauciones especiales de empleo
tención de líquidos e insuficiencia cardiaca
sLiagsn
líqui
iazolidindionas pueden causar retención de líquidos, lo que podría exacerbar o desencadenar os o síntomas de insuficiencia cardiaca congestiva. Rosiglitazona puede causar retención de íquidos dosis-dependiente. Se debe evaluar de forma individual la posible contribución de la retención de líquidos al aumento de peso, ya que el aumento de peso rápido y excesivo se ha notificado muy raramente como un signo de retención de líquidos. Deben controlarse los signos y síntomas de reacciones adversas relacionadas con la retención de líquidos, incluidos el aumento de peso y la insuficiencia cardiaca, en todos los pacientes, especialmente en aquéllos que reciben tratamiento en combinación con insulina o sulfonilurea, aquéllos con riesgo de insuficiencia cardiaca y aquéllos con reserva cardiaca reducida. Se recomienda intensificar la monitorización del paciente si se administra rosiglitazona en combinación con metformina e insulina. El tratamiento con rosiglitazona debe interrumpirse si se produce un deterioro de la función cardiaca.
También se ha notificado más frecuentemente insuficiencia cardiaca en pacientes con antecedentes de insuficiencia cardiaca; además, se han notificado más frecuentemente edema e insuficiencia cardiaca en pacientes de edad avanzada y en pacientes con insuficiencia renal leve o moderada. Se deben tomar precauciones en pacientes mayores de 75 años debido a la experiencia limitada en este grupo de pacientes. Dado que los AINEs y la rosiglitazona se asocian con retención de líquidos, su administración concomitante puede incrementar el riesgo de edema.
Combinación con insulina
do
.
En los ensayos clínicos se ha observado un aumento en la incidencia de insuficiencia cardiaca cuan se utiliza rosiglitazona en combinación con insulina. Insulina y rosiglitazona están ambas asociadas con la retención de líquidos, por lo que su administración conjunta puede aumentar el riesgo de edema y podría aumentar el riesgo de cardiopatía isquémica. Sólo en circunstancias excepcionales y bajo un control estricto se puede tratar con insulina a pacientes que ya estén tomando rosiglitazona.
Isquemia miocárdica
Un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración indicó que el tratamiento con rosiglitazona podría estar asociado a un aumento del riesgo de eventos de isquemia miocárdica. Sin embargo, en su totalidad, los datos disponibles sobre el riesgo de isquemia miocárdica no son concluyentes (ver sección 4.8). Existen datos limitados de ensayos clínicos en pacientes con cardiopatía isquémica y/o enfermedad arterial periférica. Por ello, como medida de precaución, no se recomienda el uso de rosiglitazona en estos pacientes, particularmente en aquéllos con síntomas de isquemia miocárdica.
♦ (V
Síndrome Coronario Agudo (SCA)
Los pacientes con SCA no han sido estudiados en ensayos clínicos controlados con rosiglitazona. Por consiguiente, dada la posibilidad de que dichos pacientes desarrollen insuficiencia cardiaca, no debe iniciarse el tratamiento con rosiglitazona en pacientes que tengan un evento coronario agudo, y si el tratamiento estuviera previamente instaurado, debe interrumpirse durante la fase aguda del evento coronario (ver sección 4.3).
(V
Monitorización de la _función hepática
, que se disponga de los resultados de laboratorio. Si se observa ictericia, se debe interrumpir el atamiento con rosiglitazona.
En raras ocasiones se ha notificado disfunción hepatocelular durante el uso post-comercialización (ver sección 4.8). La experiencia en el tratamiento con rosiglitazona en pacientes con enzimas hepáticas elevadas (ALT > 2,5 veces el límite superior de la normalidad) es limitada. Por tanto, se debe comprobar el nivel de enzimas hepáticas en todos los pacientes antes de comenzar el tratamiento con rosiglitazona y posteriormente, cada cierto tiempo, según el criterio clínico. No debe iniciarse el tratamiento con rosiglitazona en pacientes con niveles basales elevados de enzimas hepáticas (ALT >
2,5 veces el límite superior de la normalidad) o ante cualquier otra evidencia clínica de enfermedad hepática. Si se incrementan los niveles de ALT por encima de 3 veces el límite superior de la normalidad durante el tratamiento con rosiglitazona, se deben volver a evaluar los niveles de enzimas hepáticas tan pronto como sea posible. Si los niveles de ALT permanecen por encima de 3 veces el límite superior de la normalidad, se debe interrumpir el tratamiento. Si algún paciente desarrolla síntomas que sugieran una disfunción hepática, como náuseas, vómitos, dolor abdominal, fatiga, anorexia y/u oscurecimiento de la orina de origen desconocido, se deben comprobar las enzimas hepáticas. La decisión de continuar el tratamiento con rosiglitazona se debe basar en el juicio clínico hasta trata
Trastornos oculares
Durante la fase post-comercialización se han notificado casos de nueva aparición o empeoramiento de edema macular diabético con disminución de la agudeza visual con el uso de tiazolidindionas, incluyendo rosiglitazona. Muchos de estos pacientes notificaron además edema periférico. No se ha establecido si existe una relación directa entre la administración de rosiglitazona y la aparición de edema macular, pero los médicos deben considerar el diagnóstico de edema macular en el caso de pacientes que notifiquen alteraciones en la agudeza visual, y en dichos casos se debe considerar una revisión apropiada por el oftalmólogo.
Aumento de peso
En ensayos clínicos con rosiglitazona hubo evidencia de aumento de peso dosis-dependiente, que fue mayor cuando se utilizó en combinación con insulina. Por tanto, el peso debe monitorizarse rigurosamente dado que su aumento puede ser el resultado de la retención de líquidos, que podría estar asociada a insuficiencia cardiaca.
Anemia
existe
Jy
El tratamiento con rosiglitazona se asocia con una reducción de los niveles de hemoglobina dosis-dependiente. En pacientes con niveles de hemoglobina bajos antes de comenzar el tratamiento, un mayor riesgo de desarrollar anemia durante el tratamiento con rosiglitazona.
Hiposlucemia
etformi
Los pacientes que reciban rosiglitazona como terapia oral de combinación con una sulfonilurea o con insulina pueden presentar riesgo de hipoglucemia dosis-dependiente. Puede ser necesaria una reducción de la dosis del medicamento usado en combinación y la intensificación de la monitorización del paciente.
Triple terapia oral
El tratamiento con rosiglitazona en la triple terapia oral, en combinación con metformina y una sulfonilurea, podría estar asociado con un aumento del riesgo de retención de líquido e insuficiencia cardiaca, así como hipoglucemia (ver sección 4.8). Se recomienda intensificar la monitorización del paciente, pudiendo ser necesario el ajuste de la dosis de la sulfonilurea administrada. En la decisión de iniciar el tratamiento con triple terapia oral debe considerarse la alternativa de cambiar el tratamiento a insulina.
Trastornos óseos
Ensayos a largo plazo muestran un aumento de la incidencia de fracturas óseas en los pacientes, especialmente en las mujeres, tratados con rosiglitazona (ver sección 4.8). La mayoría de las fracturas han ocurrido en las extremidades superiores y en las extremidades distales inferiores. En mujeres, este aumento de la incidencia se detectó después del primer año de tratamiento y persistió durante tratamientos a largo plazo. Se debe tener en cuenta el riesgo de fractura en el cuidado de los pacientes tratados con rosiglitazona, especialmente en pacientes mujeres.
Otros
Durante los ensayos clínicos se administró rosiglitazona a mujeres premenopáusicas. Aunque en los estudios preclínicos (ver sección 5.3) se observó un desequilibrio hormonal, no se han detectado reacciones adversas significativas asociadas con alteraciones menstruales. Como consecuencia de la potenciación de la sensibilidad a la insulina, se puede producir una reanudación de la ovulación en pacientes que presentaban anovulación debido a la resistencia a la insulina. Se debe advertir a las pacientes del riesgo de embarazo y si una paciente desea quedarse embarazada o se produce un embarazo, se debe interrumpir el tratamiento (ver sección 4.6).
Rosiglitazona debe utilizarse con precaución en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min).

Rosiglitazona debe utilizarse con precaución durante la administración concomitante de inhibidores del CYP2C8 (por ej. gemfibrozilo) o inductores de esta enzima (por ej. rifampicina). Se deberá monitorizar rigurosamente la glucemia. Se debe considerar el ajuste de la dosis de rosiglitazona de acuerdo con la posología recomendada o cambios en el tratamiento de la diabetes (ver sección 4.5).
Los comprimidos de AVANDIA contienen lactosa, por lo que los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios in vitro demuestran que rosiglitazona se metaboliza principalmente por el CYP2C8, mientras que el CYP2C9 representa una vía minoritaria.

La administración conjunta de rosiglitazona y gemfibrozilo (un inhibidor del CYP2C8) tuvo como resultado un incremento de dos veces las concentraciones plasmáticas de rosiglitazona. Debido al potencial aumento del riesgo de reacciones adversas dosis-dependientes, puede ser necesaria una reducción de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4).
ratos del CY tidiabético
La administración conjunta de rosiglitazona y rifampicina (un inductor del CYP2C8) tuvo como resultado una reducción del 66 % en las concentraciones plasmáticas de rosiglitazona. No puede si descartado que otros inductores (por ej. fenitoína, carbamazepina, fenobarbital, hipérico o hierba de San Juan) también puedan afectar a la exposición a rosiglitazona. Puede ser necesario un aumento de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4).
No se prevén interacciones clínicamente significativas con inhibidores o sustratos del CYP2C9.
xO
con digoxin
La administración concomitante de rosiglitazona con medicamentos antidiabéticos orales como metformina, glibenclamida y acarbosa no dio lugar a ninguna interacción farmacocinética clínicamente relevante. El consumo moderado de alcohol, junto con rosiglitazona, no modifica el control de la glucemia.
No se han observado interacciones clínicamente relevantes con digoxina, warfarina (sustrato del CYP2C9), ni con los sustratos del CYP3A4 nifedipino, etinilestradiol o noretindrona, después de la administración conjunta con rosiglitazona.
4.6
♦jCo
Fertilidad, embarazo y lactancia
a la pl
Embarazo
Se ha notificado que rosiglitazona atraviesa la placenta humana y que se detecta en tejidos fetales. No existen datos suficientes sobre la utilización de rosiglitazona en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. No se debe utilizar rosiglitazona durante el embarazo.
Lactancia
Se ha detectado rosig lactancia producir en mujeres en per

ona en la leche de animales de experimentación. No se sabe con certeza si la ión del lactante al medicamento. Por tanto, no se debe utilizar rosiglitazona actancia.

uencia del aumento de la sensibilidad a la insulina, puede reanudarse la ovulación en e no ovulen debido a la resistencia a la insulina (por ej. pacientes con síndrome de ovario poliquístico). Las pacientes deben ser conscientes del riesgo de embarazo, y si una paciente desea quedarse embarazada o si se queda embarazada, se debe interrumpir el tratamiento.
Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de AVANDIA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Datos de ensayos clínicos
nscyia
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con rosiglitazona son reacciones relacionadas con los fluidos dosis-dependientes, entre las que se incluyen edema y anemia. El tratamiento conjunto de rosiglitazona y sulfonilurea se puede asociar a un incremento de la frecuencia de hipoglucemia y anemia, en comparación con la administración de rosiglitazona en monoterapia. Es importante monitorizar la retención de líquidos en los pacientes, en los que podría exacerbar o precipitar signos o síntomas de insuficiencia cardiaca congestiva (ver sección 4.4).
Las reacciones adversas para cada tratamiento se enumeran a continuación, clasificadas por órganos sistemas y por frecuencia absoluta. En el caso de reacciones adversas dosis-dependientes, la frecue se refiere a la dosis mayor de rosiglitazona. Las categorías de frecuencia no consideran otros facto como la variación de la duración del ensayo, patologías pre-existentes y características basa paciente. Las categorías de frecuencia asignadas a las reacciones adversas de acuerdo con la experiencia de los ensayos clínicos pueden no corresponderse con la frecuencia de las reacciones adversas que ocurren durante la práctica clínica normal. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10) y poco frecuentes (> 1/1.000 a < 1/100).
La tabla 1 recoge las reacciones adversas identificadas durante la revisión de los ensayos clínicos en los que han participado más de 5.000 pacientes tratados con rosiglitazona. Dentro de cada clase de órganos y sistemas, las reacciones adversas se presentan por frecuencia decreciente para el tratamiento en monoterapia con rosiglitazona. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
&
&
&
&
|
Reacción adversa |
Frecuencia de la reacción adversa según el régimen de tratamiento | |||
|
RSG |
RSG + MET |
RSG + SU |
RSG + MET + SU | |
|
Trastornos de la sangre y del sistema linfático | ||||
|
anemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
leucopenia |
Frecuentes | |||
|
trombocitopenia |
Frecuentes | |||
|
granulocitopenia |
Frecuentes | |||
|
Trastornos del metabolismo y de la nutrición | ||||
|
hipercolesterolemia1 |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
hipertrigliceridemia |
Frecuentes |
Frecuentes | ||
|
hiperlipidemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de peso |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de apetito |
Frecuentes |
Poco frecuentes | ||
|
hipoglucemia |
Frecuentes |
Muy frecuentes |
Muy frecuentes | |
|
Trastornos del sistema nervioso | ||||
|
mareos* |
Frecuentes |
Frecuentes | ||
|
dolor de cabeza* |
_4 |
Frecuentes | ||
|
_M V_ | ||||
|
Trastornos cardiacos | ||||
|
insuficiencia cardiaca1 |
Frecuentes |
Frecuentes |
Frecuentes | |
|
isquemia cardiaca2* |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos gastrointestinales | ||||
|
estreñimiento |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||||
|
fracturas óseas3 |
Frecuentes |
Frecuentes |
Frecuentes | |
|
mialgia* |
Frecuentes | |||
|
Trastornos generales y alteraciones en el lugar de administración | ||||
|
edema |
Frecuentes |
Frecuentes |
Muy frecuentes |
Muy frecuentes |
RSG: Rosiglitazona en monoterapia; RSG + MET: Rosiglitazona con metformina; RSG + SU: Rosiglitazona con sulfonilurea; RSG + MET + SU: Rosiglitazona con metformina y sulfonilurea

* Para estas reacciones adversas, la categoría de la frecuencia de la incidencia basal en el grupo placebo en los ensayos clínicos es “frecuentes”.
1 Se notificó hipercolesterolemia en hasta un 5,3 % de pacientes tratados con rosiglitazona (monoterapia, doble y triple terapia oral). El aumento de los niveles de colesterol total se asoció a un incremento tanto de LDL-colesterol (LDLc) como de HDL-colesterol (HDLc), si bien el cociente de colesterol total: HDLc no se modificó o mejoró en los ensayos de larga duración. En conjunto, estos incrementos fueron generalmente de leves a moderados y normalmente no requirieron la interrupción del tratamiento.
incidencia de insuficiencia cardiaca en la combinación con insulina (rosiglitazona añadida a la terapia establecida con insulina) fue de un 2,4 %, comparado con el 1,1 % con insulina sola. Además, un ensayo de un año de duración controlado con placebo, realizado en pacientes con insuficiencia cardiaca congestiva clases I-II de la NYHA, demostró un empeoramiento o posible empeoramiento de la insuficiencia cardiaca en un 6,4 % de los pacientes tratados con rosiglitazona en comparación con un 3,5 % de los pacientes del grupo placebo.


3 En un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración, la incidencia global de eventos que se asocian típicamente con isquemia cardiaca fue superior en los regímenes de tratamiento que incluían rosiglitazona (2,00 %), frente a los que incluían los grupos combinados de comparador activo y placebo (1,53 %) [hazard ratio (HR) 1,30 (intervalo de confian (IC) 95 % 1,004 - 1,69)]. El riesgo fue mayor cuando se añadió rosiglitazona a tratamientos insulíni ya instaurados, así como en pacientes que recibían nitratos para una cardiopatía isquémica con En una actualización de este análisis retrospectivo que incluyó 10 estudios más que cumplía criterios de inclusión, pero que no estaban disponibles en el momento del análisis origin incidencia global de los eventos que se asocian típicamente con isquemia cardiaca no fue estadísticamente diferente para los regímenes de tratamiento que incluían rosiglitazona (2,21 %), frente a los que incluían los grupos combinados de comparador activo y placebo (2,08 %) [HR 1,098 (IC 95 % 0,809 - 1,354)]. En un estudio prospectivo de eventos cardiovasculares (seguimiento medio de 5,5 años) la variable primaria de muerte y hospitalización de causa cardiovascular fue similar en el grupo de rosiglitazona y en el grupo de los comparadores activos [HR 0,99 (IC 95 % 0,85 - 1,16)]. Otros dos ensayos clínicos controlados, prospectivos, aleatorizados (9.620 pacientes, duración de cada estudio > 3 años), en los que se comparó rosiglitazona frente a otros medicamentos antidiabéticos orales autorizados o placebo, no han confirmado ni excluido el potencial riesgo de isquemia cardiaca. En su conjunto, los datos disponibles relativos al riesgo de isquemia cardiaca no son concluyentes.
4 Estudios a largo plazo muestran un aumento en la incidencia de fractura ósea en pacientes, especialmente mujeres, en tratamiento con rosiglitazona. En un estudio en monoterapia, la incidencia en mujeres tratadas con rosiglitazona fue un 9,3 % (2,7 pacientes por cada 100 pacientes-año) frente a un 5,1 % (1,5 pacientes por cada 100 pacientes-año) con metformina o un 3,5 % (1,3 pacientes por cada 100 pacientes-año) con glibenclamida. En otro estudio a largo plazo, hubo un aumento de la incidencia de fractura ósea en los pacientes del grupo de combinación con rosiglitazona respecto al comparador activo [8,3 % vs 5,3 %, razón de riesgos 1,57 (IC 95 % 1,26 - 1,97)]. El riesgo de fractura pareció ser mayor en mujeres en relación al control [11,5% vs 6,3 %, razón de riesgos 1,82 (95 % IC 1,37 - 2,41)], que en varones en relación al control [5,3 % vs 4,3 %, razón de riesgos 1,23 (95 % IC 0,85 - 1,77)]. Se necesitan más datos para determinar si existe un aumento de riesgo de fractura en varones tras un periodo largo de seguimiento. La mayoría de las fracturas ocurrieron en las extremidades superiores y las extremidades distales inferiores (ver sección 4.4).
En los ensayos clínicos doble ciego con rosiglitazona, la incidencia de elevación de ALT por encima de tres veces el límite superior de la normalidad fue igual a la registrada con placebo (0,2 %) y menor que con comparadores activos (0,5 % metformina/sulfonilureas). La incidencia total de reacciones adversas hepatobiliares fue < 1,5 % en cualquier grupo tratado y similar a la registrada con placebo.
JSUIL
rAedaec
freci
Datos post-comercialización
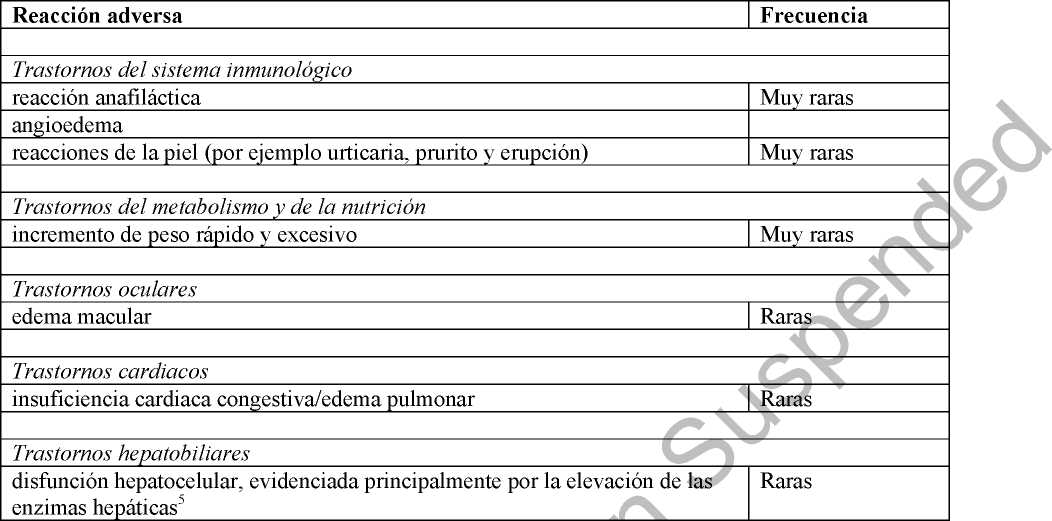
demás de las reacciones adversas identificadas en los ensayos clínicos, la tabla 2 recoge las ciones adversas que se han identificado después de la autorización de rosiglitazona. Las recuencias se definen como: raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000).
Tabla 2. Frecuencia de las reacciones adversas identificadas para rosiglitazona a partir de los datos post-comercialización
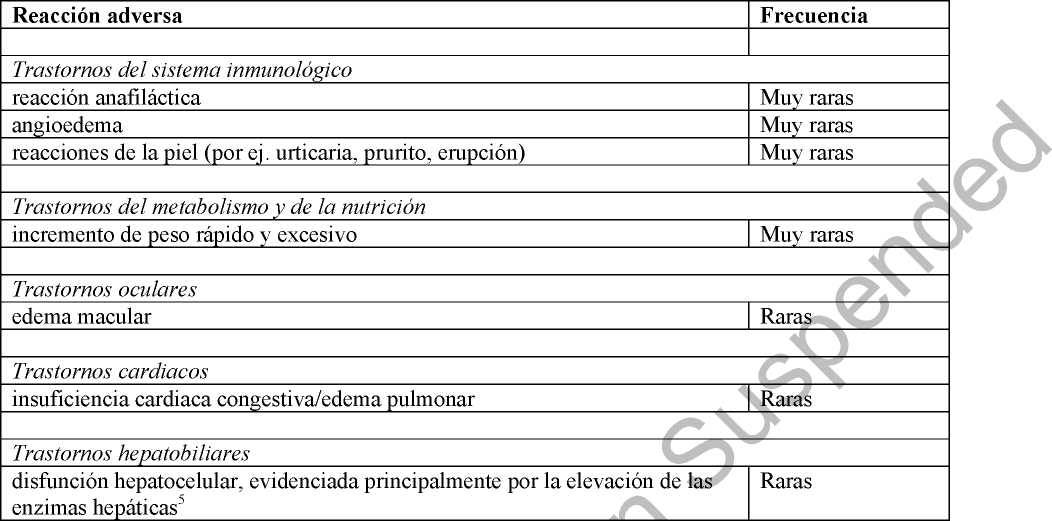
5 Se han notificado casos raros de elevación de enzimas hepáticas y disfunción hepatocelular. Se han notificado casos muy raros con desenlace fatal. ar
Mos.
3?
4.9 Sobredosis
Los datos sobre la sobredosis en humanos son limitados. Durante los ensayos clínicos con voluntarios se administró rosiglitazona a dosis orales únicas de hasta 20 mg y no se observaron reacciones adversas graves.
Vv^
En caso de sobredosis se recomienda iniciar un tratamiento de soporte adecuado, de acuerdo con el estado clínico del enfermo. La rosiglitazona se une en una elevada proporción a las proteínas y no se
elimina con la hemodiálisi
is.
FARMACO
5. PROPIEDADES FARMACOLOGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos utilizados para el tratamiento de la diabetes, fármacos hipoglucemiantes, excluyendo las insulinas, código ATC: A10BG02
Rosiglitazona es un agonista selectivo del receptor nuclear PPARy (receptor gamma activado por el proliferador de peroxisomas), y es un medicamento antidiabético de la clase de las tiazolidindionas. Reduce la glucemia disminuyendo la resistencia a la insulina en el tejido adiposo, el músculo esquelético y el hígado.
Datos preclínicos
El efecto antidiabético de la rosiglitazona se ha demostrado en diversos modelos animales de diabetes tipo 2. Además, la rosiglitazona preserva la función de la célula B, como lo revela el aumento en la masa de los islotes pancreáticos y el contenido de insulina, y evita la hiperglucemia manifiesta en los modelos animales de diabetes tipo 2. La rosiglitazona no estimula la secreción pancreática de insulina ni induce hipoglucemia en las ratas o ratones. El principal metabolito (para-hidroxi-sulfato), con gran afinidad por el PPARy humano soluble, mostró una potencia relativamente alta en un ensayo de tolerancia a la glucosa en modelos de ratón obeso. La relevancia clínica de esta observación no ha sido aclarada completamente.
Datos de ensayos clínicos

El efecto terapéutico hipoglucemiante es gradual al principio, alcanzando reducciones cercanas al máximo en la glucosa plasmática en ayunas tras aproximadamente 8 semanas de tratamiento. La mejora en el control glucémico se asocia con reducciones tanto en los niveles de glucosa en ayunas como en los de glucosa post-prandial.
Rosiglitazona se asoció con aumento de peso. En estudios mecanísticos se observó que el aumento peso se debía predominantemente a un incremento en la grasa subcutánea, con disminución en la gr visceral e intra-hepática.
Consistente con el mecanismo de acción, rosiglitazona disminuye la resistencia a la insulina y mejora la función de la célula B pancreática. La mejoría del control glucémico se asoció también con descensos significativos en los ácidos grasos libres. La doble terapia oral de rosiglitazona con sulfonilurea o metformina dio lugar a un efecto aditivo sobre el control glucémico en pacientes diabéticos tipo 2 debido a que sus mecanismos de acción son diferentes pero complementarios.
En estudios con una duración máxima de tres años, rosiglitazona administrada una o dos veces al día produjo una mejoría mantenida del control glucémico (glucosa plasmática en ayunas y HbAlc). Este efecto terapéutico hipoglucemiante observado fue más pronunciado en pacientes obesos. No se han completado estudios con rosiglitazona sobre eventos clínicos, por lo tanto, no se han demostrado los beneficios a largo plazo asociados a la mejoría del control glucémico.
ADOPT (A Diabetes Outcome Progresión Trial) fue un ensayo clínico controlado, doble ciego y multicéntrico con una duración de 4 a 6 años (duración media 4 años) en el que se comparó el tratamiento con rosiglitazona (4 a 8 mg/día) frente a metformina (500 mg a 2.000 mg/día) y glibenclamida (2,5 a 15 mg/día) en 4.351 pacientes con diabetes tipo 2 de reciente diagnóstico (< 3 años) sin tratamiento previo. El tratamiento con rosiglitazona redujo significativamente el riesgo de fracaso de la monoterapia (glucosa plasmática en ayunas > 10,0 mmol/l) un 63 % comparado con glibenclamida [razón de riesgos (hazard ratio) 0,37, intervalo de confianza 0,30 - 0,45] y un 32 % comparado con metformina [razón de riesgos (hazard ratio) 0,68, intervalo de confianza 0,55 - 0,85] durante el curso del estudio (hasta 72 meses de tratamiento). Esto se traduce en una incidencia acumulada de fracaso en el tratamiento del 10,3 % de los pacientes tratados con rosiglitazona, 14,8 % de los tratados con metformina y 23,3 % de los tratados con glibenclamida. En general, el 43 %, 47 % y 42 % de los pacientes que recibieron rosiglitazona, glibenclamida y metformina, respectivamente, abandonó el estudio por causas distintas al fracaso de la monoterapia. No se conoce como afectan estos resultados al progreso de la enfermedad o a los resultados microvasculares o macrovasculares. Los acontecimientos adversos observados en este estudio concuerdan con los perfiles de acontecimientos adversos conocidos para cada uno de los tratamientos, incluyendo el aumento continuado de peso con rosiglitazona. Adicionalmente, se observó un aumento de la incidencia de fracturas óseas en mujeres tratadas con rosiglitazona (ver secciones 4.4 y 4.8).


CORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of glycaemia in s) fue un ensayo clínico amplio (4.447 sujetos), abierto, prospectivo, controlado (media de imiento de 5,5 años), en el que los pacientes con diabetes tipo 2 con un control inadecuado con formina o sulfonilurea fueron aleatorizados para añadir rosiglitazona o metformina o sulfonilurea. duración media de la diabetes en esos pacientes era aproximadamente de 7 años. La variable principal adjudicada fue la hospitalización por motivos cardiovasculares (que incluía hospitalización por insuficiencia cardiaca) o muerte cardiovascular. Las dosis medias al final del tratamiento aleatorizado se muestran en la siguiente tabla:
|
Tratamiento aleatorizadof |
Dosis media (DM) al final del tratamiento aleatorizado |
|
Rosiglitazona (SU o metformina) |
6,7 (1,9) mg |
|
Sulfonilurea (tratamiento previo metformina) | |
|
Glimepirida* |
3,6 (1,8) mg |
|
Metformina (tratamiento previo sulfonilurea) |
1995,5 (682,6) mg |
fPacientes que tomaron los tratamientos designados de forma aleatoria en combinación con el tratamiento previo correcto y con datos evaluables.
*Dosis efectiva relativa similar (por ej. aproximadamente la mitad de la dosis máxima) para otras sulfonilureas (glibenclamida y glicazida).
No hubo diferencias en el número de eventos de la variable principal adjudicada para rosiglitazon (321/2.220) vs el control activo (323/2.227) (HR 0,99, IC 0,85 - 1,16), alcanzando el criterio de n< inferioridad predefinido de 1,20 (p de no inferioridad = 0,02). HR e IC para las variables secund; fueron: muerte por cualquier causa (HR 0,86, IC 0,68 - 1,08), MACE (Eventos Cardiacos Adversos Mayores - muerte cardiovascular, infarto agudo de miocardio, ictus) (HR 0,93, IC 0,74 - 1,15), muerte cardiovascular (HR 0,84, IC 0,59 - 1,18), infarto agudo de miocardio (HR 1,14, IC 0,80 - 1,63) e ictus (HR 0,72, IC 0,49 - 1,06). En un sub-estudio a los 18 meses del tratamiento con rosiglitazona en doble terapia con metformina o sulfonilurea, la reducción de HbA1c fue “no inferior” a la del tratamiento combinado de sulfonilurea y metformina. En el análisis final a los 5 años, se observó una reducción media ajustada al valor basal de HbA1c del 0,14 % en pacientes tratados con metformina a los que se les añadió rosiglitazona durante el tratamiento aleatorizado a doble terapia combinada, vs un incremento del 0,17 % en pacientes que tomaban metformina y se les añadió sulfonilurea (p<0,0001 para diferencia de tratamientos). Se observó una reducción media ajustada de HbA1c del 0,24 % en pacientes tratados con sulfonilurea a los que se les añadió rosiglitazona, vs una reducción de HbA1c del 0,10 % para pacientes que tomaban sulfonilurea y se les añadió metformina (p=0,0083 para la diferencia entre tratamientos). Hubo un incremento significativo de insuficiencia cardiaca (mortal y no mortal) (HR 2,10, IC 1,35 - 3,27) y fracturas óseas (razón de riesgos 1,57, IC 1,26 - 1,97) en tratamientos que contenían rosiglitazona comparados con el control activo (ver secciones 4.4 y 4.8).

Se retiraron un total de 564 pacientes por causas cardiovasculares que representaban el 12,3 % de los pacientes tratados con rosiglitazona y el 13 % de los pacientes control; lo cual supone el 7,2 % de pacientes-año perdidos para seguimiento de eventos cardiovasculares y el 2,0 % de pacientes-año perdidos para seguimiento de mortalidad por cualquier causa.
Población pediátrica
Se realizó un ensayo clínico controlado con comparador activo (hasta 8 mg diarios de rosiglitazona o hasta 2.000 mg diarios de metformina) de 24 semanas de duración en 197 niños y adolescentes (de 10 a 17 años de edad) con diabetes tipo 2. Se observó una mejora estadísticamente significativa de los niveles basales de HbA1c sólo en el grupo tratado con metformina. Rosiglitazona fracasó en demostrar no-inferioridad frente a metformina. Tras el tratamiento con rosiglitazona no se observó ningún nuevo problema de seguridad en niños y adolescentes en comparación con pacientes adultos con diabetes mellitus tipo 2. No se dispone de datos de eficacia y seguridad a largo plazo en pacientes pediátricos.
La Agencia Europea de Medicamentos exime de la obligación de presentar los resultados de estudios con AVANDIA en todos los subconjuntos de la población pediátrica con diabetes mellitus tipo II (ver sección 4.2 para información sobre uso pediátrico).

Absorción
La biodisponibilidad absoluta de la rosiglitazona se aproxima al 99 % después de administrar una dosis oral de 4 ó de 8 mg. Las concentraciones plasmáticas máximas de rosiglitazona se alcanzan aproximadamente una hora después de la ingesta. Las concentraciones plasmáticas son prácticamente proporcionales a la dosis en el intervalo terapéutico.
Cuando se administra rosiglitazona con los alimentos, no se altera la exposición global (AUC), pero disminuye ligeramente la Cmax (aprox. 20 a 28 %) y se retrasa el tmax (aprox. 1,75 h) en relación con la administración en ayunas. Estos ligeros cambios no tienen relevancia clínica y, por tanto, no es necesario administrar rosiglitazona en un momento concreto en relación con las comidas. El incremento del pH gástrico no influye en la absorción de rosiglitazona.
Distribución
El volumen de distribución de rosiglitazona se aproxima a los 14 litros en voluntarios sanos. La unión de rosiglitazona a las proteínas plasmáticas es alta (aprox. 99,8 %) sin que se observe una influencia de la concentración o la edad. La unión a proteínas del metabolito principal (para-hidroxi-sulfato) es muy alta (> 99,99 %).
Biotransformación


Rosiglitazona se metaboliza de manera amplia; el compuesto precursor se elimina después de su transformación. Las principales vías metabólicas son la N-desmetilación y la hidroxilación, se, de la conjugación con sulfato y ácido glucurónico. La contribución del metabolito principal (par; hidroxi-sulfato) a la actividad antidiabética global de rosiglitazona no ha sido completame dilucidada en el hombre y no se puede descartar que el metabolito pueda contribuir atividad. Sin embargo, esto no implica ningún problema de seguridad para los pacientes diabéticoeneral ni en situaciones especiales ya que rosiglitazona está contraindicada en insuficiencia hepát los ensayos clínicos de fase III incluyeron un número considerable de pacientes de edad avanzad cientes con insuficiencia renal de leve a moderada.
Estudios in vitro demuestran que rosiglitazona se metaboliza fundamentalmente por el CYP2C8, con una contribución menor del CYP2C9.
Rosiglitazona no inhibe de forma significativa las isoformas CYP1A2, 2A6, 2C19, 2D6, 2E1, 3A ó 4A del citocromo P450 en condiciones in vitro; por eso, es poco probable que ocurran interacciones significativas a nivel metabólico con los compuestos metabolizados por estas enzimas. Rosiglitazona mostró una inhibición in vitro moderada del CYP2C8 (CI50 18 pM) y baja del CYP2C9 (CI50 5 0 pM) (ver sección 4.5). En un estudio de interacciones in vivo con warfarina se observó que rosiglitazona no interacciona con sustratos del CYP2C9 in vivo

nes in vivo o.
Eliminación
El aclaramiento plasmático total de rosiglitazona es aproximadamente 3 l/h y la semivida de eliminación terminal de rosiglitazona es aproximadamente de 3 a 4 horas. No existe evidencia de acumulación inesperada de rosiglitazona, después de administrarse una o dos veces al día. La vía principal de eliminación es la urinaria: cerca de dos tercios de la dosis se eliminan por esta vía, mientras que la eliminación fecal representa un 25 % de la dosis. No se excreta el fármaco inalterado en orina o heces. La semivida de eliminación terminal del marcaje radiactivo fue aproximadamente de 130 horas indicando que la eliminación de metabolitos es muy lenta. Se espera una acumulación de metabolitos en plasma después de dosis repetidas, especialmente del metabolito principal (para-hidroxi-sulfato), para el que se prevé una acumulación 8 veces superior.
Poblaciones especiales
Sexo: al efectuar un análisis farmacocinético poblacional a partir de datos agrupados no se advirtieron diferencias considerables en la farmacocinética de la rosiglitazona entre ambos sexos.
aPgarcui
cientes de edad avanzada: al efectuar el análisis farmacocinético poblacional a partir de datos pados no se apreció que la edad afectara significativamente a la farmacocinética de rosiglitazona.
Niños y adolescentes: en el análisis farmacocinético poblacional que incluía a 96 pacientes pediátricos de 10 a 18 años de edad y peso entre 35 y 178 kg se estimó un valor medio del aclaramiento aparente (CL/F) similar en niños y adolescentes en comparación con el de adultos. El CL/F individual en la población pediátrica se encontraba dentro del mismo intervalo que los valores individuales en adultos. El CL/F aparentemente era independiente de la edad, pero aumentó con el peso en la población pediátrica.
Insuficiencia hepática: en pacientes cirróticos con insuficiencia hepática moderada (clase B de Child-Pugh), los valores de la Cmax libre y AUC resultaron 2 y 3 veces mayores que en sujetos normales. Se observó una gran variabilidad inter-individuo, con una diferencia entre pacientes de 7 veces en el valor de AUC libre.
Insuficiencia renal: no se observa ninguna diferencia clínicamente significativa en la farmacocinética de rosiglitazona en enfermos con insuficiencia renal o enfermedad renal terminal sometidos a diálisis crónica.
toros
5.3 Datos preclínicos sobre seguridad
urante la fa
el
ado
Los efectos adversos observados en estudios con animales con posible relevancia para el uso clínic fueron los siguientes: aumento del volumen plasmático acompañado de un descenso en los paráme de la serie roja y un aumento en el peso del corazón. También se observaron aumentos en e hígado, en los niveles plasmáticos de ALT (sólo en el perro) y en el tejido adiposo. Se han ot efectos similares con otras tiazolidindionas.
En estudios de toxicidad reproductiva, la administración de rosiglitazona a ratas durante la fase intermedia o final de la gestación se asoció con muerte fetal y retraso del desarrollo del feto. Además, rosiglitazona inhibió la síntesis de progesterona y estradiol en el ovario y disminuyó los niveles plasmáticos de estas hormonas, dando lugar a efectos sobre los ciclos estro/menstruales y la fertilidad (ver sección 4.4).
En un modelo animal de poliposis adenomatosa familiar (PAF), el tratamiento con rosiglitazona a una dosis 200 veces superior a la dosis farmacológicamente activa, incrementó el número de tumores en el colon. La relevancia de este hallazgo es desconocida. Sin embargo, rosiglitazona promovió la diferenciación y reversión in vitro de los cambios mutagénicos en células humanas de cáncer de colon. Además, rosiglitazona no resultó ser genotóxica en una batería de estudios de genotoxicidad in vivo e in vitro y no hubo evidencia de tumores de colon en estudios con rosiglitazona, en dos especies de roedores, realizados durante toda la vida del animal.
Núcleo del comprimido carboximetilalmidón de sodio (tipo A) hipromelosa celulosa microcristalina lactosa monohidrato estearato de magnesio
dióxido macrog lact tria
Cubierta pelicular hipromelosa 6cP
de titanio (E171) ogol 3000 osa monohidrato riacetato de glicerol óxido de hierro rojo (E172)
No procede.
6.3 Periodo de validez 2 años
6.4 Precauciones especiales de conservación
Este medicamento no precisa condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
56
<2>
Envases blíster opacos (PVC/aluminio). 56, 112, 168 ó 180 comprimidos recubiertos con película ó comprimidos recubiertos con película, envase con dosis unitarias.
Puede que solamente estén comercializados algunos tamaños de envases.

6.6 Precauciones especiales de eliminación
.o-
La elimininación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
SmithKline Beecham Ltd, 980 Great West Road, Brentford, Middlesex, TW8 9GS, Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COM
ERCIAL
ALIZ
lesex,
ZACIÓN
EU/1/00/137/002-004, EU/1/00/137/013, EU/1/00/137/016
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 11 julio 2000 Fecha de la última renovación: 11 julio 2005
EVISIÓ
10. FECHA DE LA REVISIÓN DEL TEXTO
allada d
La información detallada de este medicamento está disponible en la pagina web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
AVANDIA 4 mg comprimidos recubiertos con película.
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
<2>
Cada comprimido contiene una cantidad de maleato de rosiglitazona correspondiente a 4 mg de rosiglitazona
Excipiente
Contiene lactosa (aproximadamente 105 mg).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
.O
Comprimido recubierto con película (comprimido).
Comprimidos recubiertos con película de color naranja que llevan la inscripción "GSK" en una cara y "4" en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Rosiglitazona está indicada para el tratamiento de la diabetes mellitus tipo 2:
<Nr
en monoterapia
- en adultos (especialmente aquéllos con sobrepeso) con control insuficiente con dieta y ejercicio en los que el tratamiento con metformina se considera inadecuado, por existir contraindicaciones o intolerancia
en doble terapia oral en combinación con
- metformina, en adultos (especialmente aquéllos con sobrepeso) con control glucémico insuficiente a pesar de recibir la dosis máxima tolerada en monoterapia con metformina
- una sulfonilurea, sólo en adultos con intolerancia a metformina o para los que metformina está contraindicada, con control glucémico insuficiente a pesar del tratamiento en monoterapia con una sulfonilurea
en triple terapia oral en combinación con

4P.o2s
metformina y una sulfonilurea, en adultos (especialmente aquellos con sobrepeso) con control glucémico insuficiente a pesar de la doble terapia oral (ver sección 4.4).
Posología y forma de administración
osología
El tratamiento con rosiglitazona se suele iniciar con 4 mg/día. Esta posología se puede incrementar hasta 8 mg/día después de ocho semanas si se precisa un mayor control de la glucemia. En pacientes a los que se administra rosiglitazona en combinación con una sulfonilurea, se debe realizar un incremento en la posología de rosiglitazona de hasta 8 mg/día cautelosamente, después de efectuar la evaluación clínica adecuada para valorar el riesgo de que el paciente desarrolle reacciones adversas relacionadas con la retención de líquidos (ver secciones 4.4 y 4.8).
Rosiglitazona se puede administrar en una o dos tomas diarias (bien como una dosis diaria o dividida en dos dosis).
Poblaciones especiales
Pacientes de edad avanzada (>65 años) (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)

No es necesario ajustar la dosis en los pacientes de edad avanzada.
Insuficiencia renal (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve y moderada. Se dispone de datos limitados en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) por tanto, rosiglitazona se debe utilizar con precaución en estos pacientes.
Insuficiencia hepática
No se debe utilizar rosiglitazona en pacientes con insuficiencia hepática (ver sección 4.3 Población pediátrica
No se dispone de datos sobre el empleo de rosiglitazona en niños menores de 10 años. Existen datos limitados sobre el tratamiento en monoterapia con rosiglitazona en niños y adolescentes de edades entre 10 y 17 años (ver secciones 5.1 y 5.2). Los datos disponibles no confirman la eficacia en la población pediátrica, por lo que no se recomienda su uso.
Forma de administración
Los comprimidos se deben tragar con agua y se pueden tomar con o sin alimentos.
&
Para mejorar el cumplimiento terapéutico, se sugiere que a los pacientes se les aconseje tomar los comprimidos en torno a la misma hora cada día.
La utilización de rosiglitazona está contraindicada en pacientes con:
- hipersensibilidad conocida a rosiglitazona o a alguno de los excipientes
- insuficiencia cardiaca o historia de insuficiencia cardiaca (clases I a IV de la NYHA)
- un Síndrome Coronario Agudo (angina inestable infarto de miocardio sin elevación del segmento ST (IAMSEST) e infarto de miocardio con elevación del segmento ST (IAMCEST) (ver sección 4.4)
- insuficiencia hepática
♦ if\
- cetoacidosis diabética o pre-coma diabético.
4.4 Advertencias y precauciones especiales de empleo
tención de líquidos e insuficiencia cardiaca
sLiagsn
líqui
iazolidindionas pueden causar retención de líquidos, lo que podría exacerbar o desencadenar os o síntomas de insuficiencia cardiaca congestiva. Rosiglitazona puede causar retención de íquidos dosis-dependiente. Se debe evaluar de forma individual la posible contribución de la retención de líquidos al aumento de peso, ya que el aumento de peso rápido y excesivo se ha notificado muy raramente como un signo de retención de líquidos. Deben controlarse los signos y síntomas de reacciones adversas relacionadas con la retención de líquidos, incluidos el aumento de peso y la insuficiencia cardiaca, en todos los pacientes, especialmente en aquéllos que reciben tratamiento en combinación con insulina o sulfonilurea, aquéllos con riesgo de insuficiencia cardiaca y aquéllos con reserva cardiaca reducida. Se recomienda intensificar la monitorización del paciente si se administra rosiglitazona en combinación con metformina e insulina. El tratamiento con rosiglitazona debe interrumpirse si se produce un deterioro de la función cardiaca.
También se ha notificado más frecuentemente insuficiencia cardiaca en pacientes con antecedentes de insuficiencia cardiaca; además, se han notificado más frecuentemente edema e insuficiencia cardiaca en pacientes de edad avanzada y en pacientes con insuficiencia renal leve o moderada. Se deben tomar precauciones en pacientes mayores de 75 años debido a la experiencia limitada en este grupo de pacientes. Dado que los AINEs y la rosiglitazona se asocian con retención de líquidos, su administración concomitante puede incrementar el riesgo de edema.
Combinación con insulina
do
.
En los ensayos clínicos se ha observado un aumento en la incidencia de insuficiencia cardiaca cuan se utiliza rosiglitazona en combinación con insulina. Insulina y rosiglitazona están ambas asociadas con la retención de líquidos, por lo que su administración conjunta puede aumentar el riesgo de edema y podría aumentar el riesgo de cardiopatía isquémica. Sólo en circunstancias excepcionales y bajo un control estricto se puede tratar con insulina a pacientes que ya estén tomando rosiglitazona.
Isquemia miocárdica
Un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración, indicó que el tratamiento con rosiglitazona podría estar asociado a un aumento del riesgo de eventos de isquemia miocárdica. Sin embargo, en su totalidad, los datos disponibles sobre el riesgo de isquemia miocárdica en su no son concluyentes (ver sección 4.8). Existen datos limitados de ensayos clínicos en pacientes con cardiopatía isquémica y/o enfermedad arterial periférica. Por ello, como medida de precaución, no se recomienda el uso de rosiglitazona en estos pacientes, particularmente en aquéllos con síntomas de isquemia miocárdica.
♦ (V
Síndrome Coronario Agudo (SCA)
Los pacientes con SCA no han sido estudiados en ensayos clínicos controlados con rosiglitazona. Por consiguiente, dada la posibilidad de que dichos pacientes desarrollen insuficiencia cardiaca, no debe iniciarse el tratamiento con rosiglitazona en pacientes que tengan un evento coronario agudo, y si el tratamiento estuviera previamente instaurado, debe interrumpirse durante la fase aguda del evento coronario (ver sección 4.3).
(V
Monitorización de la _función hepática
, que se disponga de los resultados de laboratorio. Si se observa ictericia, se debe interrumpir el atamiento con rosiglitazona.
En raras ocasiones se ha notificado disfunción hepatocelular durante el uso post-comercialización (ver sección 4.8). La experiencia en el tratamiento con rosiglitazona en pacientes con enzimas hepáticas elevadas (ALT > 2,5 veces el límite superior de la normalidad) es limitada. Por tanto, se debe comprobar el nivel de enzimas hepáticas en todos los pacientes antes de comenzar el tratamiento con rosiglitazona y posteriormente, cada cierto tiempo, según el criterio clínico. No debe iniciarse el tratamiento con rosiglitazona en pacientes con niveles basales elevados de enzimas hepáticas (ALT >
2,5 veces el límite superior de la normalidad) o ante cualquier otra evidencia clínica de enfermedad hepática. Si se incrementan los niveles de ALT por encima de 3 veces el límite superior de la normalidad durante el tratamiento con rosiglitazona, se deben volver a evaluar los niveles de enzimas hepáticas tan pronto como sea posible. Si los niveles de ALT permanecen por encima de 3 veces el límite superior de la normalidad, se debe interrumpir el tratamiento. Si algún paciente desarrolla síntomas que sugieran una disfunción hepática, como náuseas, vómitos, dolor abdominal, fatiga, anorexia y/u oscurecimiento de la orina de origen desconocido, se deben comprobar las enzimas hepáticas. La decisión de continuar el tratamiento con rosiglitazona se debe basar en el juicio clínico hasta trata
Trastornos oculares
Durante la fase post-comercialización se han notificado casos de nueva aparición o empeoramiento de edema macular diabético con disminución de la agudeza visual con el uso de tiazolidindionas, incluyendo rosiglitazona. Muchos de estos pacientes notificaron además edema periférico. No se ha establecido si existe una relación directa entre la administración de rosiglitazona y la aparición de edema macular, pero los médicos deben considerar el diagnóstico de edema macular en el caso de pacientes que notifiquen alteraciones en la agudeza visual, y en dichos casos se debe considerar una revisión apropiada por el oftalmólogo.
Aumento de peso
En ensayos clínicos con rosiglitazona hubo evidencia de aumento de peso dosis-dependiente, que fue mayor cuando se utilizó en combinación con insulina. Por tanto, el peso debe monitorizarse rigurosamente dado que su aumento puede ser el resultado de la retención de líquidos, que podría estar asociada a insuficiencia cardiaca.
Anemia
existe
Jy
El tratamiento con rosiglitazona se asocia con una reducción de los niveles de hemoglobina dosis-dependiente. En pacientes con niveles de hemoglobina bajos antes de comenzar el tratamiento, un mayor riesgo de desarrollar anemia durante el tratamiento con rosiglitazona.
Hiposlucemia
etformi
Los pacientes que reciban rosiglitazona como terapia oral de combinación con una sulfonilurea o con insulina pueden presentar riesgo de hipoglucemia dosis-dependiente. Puede ser necesaria una reducción de la dosis del medicamento usado en combinación y la intensificación de la monitorización del paciente.
Triple terapia oral
la alterna
sP
El tratamiento con rosiglitazona en la triple terapia oral, en combinación con metformina y una sulfonilurea, podría estar asociado con un aumento del riesgo de retención de líquido e insuficiencia cardiaca, así como hipoglucemia (ver sección 4.8). Se recomienda intensificar la monitorización del paciente, pudiendo ser necesario el ajuste de la dosis de la sulfonilurea administrada. En la decisión de iniciar el tratamiento con triple terapia oral debe considerarse la alternativa de cambiar el tratamiento a insulina.
Trastornos óseos
Ensayos a largo plazo muestran un aumento de la incidencia de fracturas óseas en los pacientes, especialmente en las mujeres, tratados con rosiglitazona (ver sección 4.8). La mayoría de las fracturas han ocurrido en las extremidades superiores y en las extremidades distales inferiores. En mujeres, este aumento de la incidencia se detectó despúés del primer año de tratamiento y persistió durante tratamientos a largo plazo. Se debe tener en cuenta el riesgo de fractura en el cuidado de los pacientes tratados con rosiglitazona, especialmente en pacientes mujeres.
Otros
Durante los ensayos clínicos se administró rosiglitazona a mujeres premenopáusicas. Aunque en los estudios preclínicos (ver sección 5.3) se observó un desequilibrio hormonal, no se han detectado reacciones adversas significativas asociadas con alteraciones menstruales. Como consecuencia de la potenciación de la sensibilidad a la insulina, se puede producir una reanudación de la ovulación en pacientes que presentaban anovulación debido a la resistencia a la insulina. Se debe advertir a las pacientes del riesgo de embarazo y si una paciente desea quedarse embarazada o se produce un embarazo, se debe interrumpir el tratamiento (ver sección 4.6).
Rosiglitazona debe utilizarse con precaución en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min).

Rosiglitazona debe utilizarse con precaución durante la administración concomitante de inhibidores del CYP2C8 (por ej. gemfibrozilo) o inductores de esta enzima (por ej. rifampicina). Se deberá monitorizar rigurosamente la glucemia. Se debe considerar el ajuste de la dosis de rosiglitazona de acuerdo con la posología recomendada o cambios en el tratamiento de la diabetes (ver sección 4.5).
Los comprimidos de AVANDIA contienen lactosa, por lo que los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios in vitro demuestran que rosiglitazona se metaboliza principalmente por el CYP2C8, mientras que el CYP2C9 representa una vía minoritaria.
La administración conjunta de rosiglitazona y gemfibrozilo (un inhibidor del CYP2C8) tuvo como resultado un incremento de dos veces las concentraciones plasmáticas de rosiglitazona. Debido al potencial aumento del riesgo de reacciones adversas dosis-dependientes, puede ser necesaria una reducción de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4). <¿r
atos del CY tidiabéti
La administración conjunta de rosiglitazona y rifampicina (un inductor del CYP2C8) tuvo como resultado una reducción del 66 % en las concentraciones plasmáticas de rosiglitazona. No puede se descartado que otros inductores (por ej. fenitoína, carbamazepina, fenobarbital, hipérico o hierba de San Juan) también puedan afectar a la exposición a rosiglitazona. Puede ser necesario un aumento de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4).
YP2C9.
No se prevén interacciones clínicamente significativas con inhibidores o sustr;
xO
con digoxin
La administración concomitante de rosiglitazona con mediccamentos antidiabéticos orales como metformina, glibenclamida y acarbosa no dio lugar a ninguna interacción farmacocinética clínicamente relevante. El consumo moderado de alcohol, junto con rosiglitazona, no modifica el control de la glucemia.
No se han observado interacciones clínicamente relevantes con digoxina, warfarina (sustrato del CYP2C9), ni con los sustratos del CYP3A4 nifedipino, etinilestradiol o noretindrona, después de la administración conjunta con rosiglitazona.
4.6
wir
Fertilidad, embarazo y lactancia
a la pl
Embarazo
.....
Se ha notificado que rosiglitazona atraviesa la placenta humana y que se detecta en tejidos fetales. No existen datos suficientes sobre la utilización de rosiglitazona en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. No se debe utilizar rosiglitazona durante el embarazo.
Lactancia
Se ha detectado rosiglitazona en la leche de animales de experimentación. No se sabe con certeza si la lactancia producirá exposición del lactante al fármaco. Por tanto, no se debe utilizar rosiglitazona en mujeres en periodo de lactancia.
Fertilida Como c pacientes
cuencia del aumento de la sensibilidad a la insulina, puede reanudarse la ovulación en ue no ovulen debido a la resistencia a la insulina (por ej. pacientes con síndrome de ovario

poliquístico). Las pacientes deben ser conscientes del riesgo de embarazo, y si una paciente desea quedarse embarazada o si se queda embarazada, se debe interrumpir el tratamiento.
Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de AVANDIA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Datos de ensayos clínicos
nscyia
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con rosiglitazona son reacciones relacionadas con los fluidos dosis-dependientes, entre las que se incluyen edema y anemia. El tratamiento conjunto de rosiglitazona y sulfonilurea se puede asociar a un incremento de la frecuencia de hipoglucemia y anemia, en comparación con la administración de rosiglitazona en monoterapia. Es importante monitorizar la retención de líquidos en los pacientes, en los que podría exacerbar o precipitar signos o síntomas de insuficiencia cardiaca congestiva (ver sección 4.4).
Las reacciones adversas para cada tratamiento se enumeran a continuación, clasificadas por órganos sistemas y por frecuencia absoluta. En el caso de reacciones adversas dosis-dependientes, la frecue se refiere a la dosis mayor de rosiglitazona. Las categorías de frecuencia no consideran otros facto como la variación de la duración del ensayo, patologías pre-existentes y características basa paciente. Las categorías de frecuencia asignadas a las reacciones adversas de acuerdo con la experiencia de los ensayos clínicos pueden no corresponderse con la frecuencia de las reacciones adversas que ocurren durante la práctica clínica normal. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10) y poco frecuentes (> 1/1.000 a < 1/100).
La tabla 1 recoge las reacciones adversas identificadas durante la revisión de los ensayos clínicos en los que han participado más de 5.000 pacientes tratados con rosiglitazona. Dentro de cada clase de órganos y sistemas, las reacciones adversas se presentan por frecuencia decreciente para el tratamiento en monoterapia con rosiglitazona. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
&
&
&
&
|
Reacción adversa |
Frecuencia de la reacción adversa según el régime de tratamiento | |||
|
RSG |
RSG + MET |
RSG + SU |
RSG + MET + SU | |
|
Trastornos de la sangre y del sistema linfático | ||||
|
anemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
leucopenia |
Frecuentes | |||
|
trombocitopenia |
Frecuentes |
A | ||
|
granulocitopenia |
Frecuentes | |||
|
Trastornos del metabolismo y de la nutrición | ||||
|
hipercolesterolemia1 |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
hipertrigliceridemia |
Frecuentes |
Frecuentes | ||
|
hiperlipidemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de peso |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de apetito |
Frecuentes |
Poco frecuentes | ||
|
hipoglucemia |
Frecuentes |
Muy frecuentes |
Muy frecuentes | |
|
Trastornos del sistema nervioso | ||||
|
mareos* |
Frecuentes |
Frecuentes | ||
|
dolor de cabeza* |
_ +A |
_ |
Frecuentes | |
|
Trastornos cardiacos | ||||
|
insuficiencia cardiaca4 |
Frecuentes ♦ |
Frecuentes |
Frecuentes | |
|
isquemia cardiaca 5* |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos gastrointestinales | ||||
|
estreñimiento |
Frecuentes Frecuentes |
Frecuentes |
Frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||||
|
fracturas óseas6 |
Frecuentes |
Frecuentes |
Frecuentes | |
|
mialgia* |
Frecuentes | |||
|
Trastornos generales y alteraciones en el lugar de administración | ||||
|
edema _.vC>« |
Frecuentes |
Frecuentes |
Muy frecuentes |
Muy frecuentes |
RSG: Rosiglitazona en monoterapia; RSG + MET: Rosiglitazona con metformina; RSG + SU: Rosiglitazona con sulfonilurea; RSG + MET + SU: Rosiglitazona con metformina y sulfonilurea
<2>
* Para estas reacciones adversas, la categoría de la frecuencia de la incidencia basal en el grupo placebo en los ensayos clínicos es “frecuentes”.
V
1 Se notificó hipercolesterolemia en hasta un 5,3 % de pacientes tratados con rosiglitazona (monoterapia, doble y triple terapia oral). El aumento de los niveles de colesterol total se asoció a un incremento tanto de LDL-colesterol (LDLc) como de HDL-colesterol (HDLc), si bien el cociente de colesterol total: HDLc no se modificó o mejoró en los ensayos de larga duración. En conjunto, estos incrementos fueron generalmente de leves a moderados y normalmente no requirieron la interrupción del tratamiento.
total). La incidencia de insuficiencia cardiaca en la triple terapia oral fue de un 1,4 % en el ensayo doble ciego principal, comparado con un 0,4 % para la doble terapia metformina más sulfonilurea. La incidencia de insuficiencia cardiaca en la combinación con insulina (rosiglitazona añadida a la terapia establecida con insulina) fue de un 2,4 %, comparado con el 1,1 % con insulina sola. Además, un ensayo de un año de duración controlado con placebo, realizado en pacientes con insuficiencia cardiaca congestiva clases I-II de la NYHA, demostró un empeoramiento o posible empeoramiento de la insuficiencia cardiaca en un 6,4 % de los pacientes tratados con rosiglitazona en comparación con un 3,5 % de los pacientes del grupo placebo.
*
3 En un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración, la incidencia global de eventos que se asocian típicamente con isquemia cardiaca fue superior en los regímenes de tratamiento que incluían rosiglitazona (2,00 %), frente a los que incluían los grupos combinados de comparador activo y placebo (1,53 %) [hazard ratio (HR) 1,30 (intervalo de confianza (IC) 95 % 1,004 - 1,69)]. El riesgo fue mayor cuando se añadió rosiglitazona a tratamientos insulínicos ya instaurados, así como en pacientes que recibían nitratos para una cardiopatía isquémica conocida. En una actualización de este análisis retrospectivo que incluyó 10 estudios más que cumplían los criterios de inclusión, pero que no estaban disponibles en el momento del análisis original, la incidencia global de los eventos que se asocian típicamente con isquemia cardiaca no fue estadísticamente diferente para los regímenes de tratamiento que incluían rosiglitazona (2,21 %), frente a los que incluían los grupos combinados de comparador activo y placebo (2,08 %) [HR 1,098 (IC 95 % 0,809 - 1,354)]. En un estudio prospectivo de eventos cardiovasculares (seguimiento medio de 5,5 años) la variable primaria de muerte y hospitalización de causa cardiovascular fue similar en el grupo de rosiglitazona y en el grupo de los comparadores activos [HR 0,99 (IC 95 % 0,85 - 1,16)]. Otros dos ensayos clínicos controlados, prospectivos, aleatorizados (9.620 pacientes, duración de cada estudio > 3 años), en los que se comparó rosiglitazona frente a otros medicamentos antidiabéticos orales autorizados o placebo, no han confirmado ni excluido el potencial riesgo de isquemia cardiaca. En su conjunto, los datos disponibles relativos al riesgo de isquemia cardiaca no son concluyentes.
4 Estudios a largo plazo muestran un aumento en la incidencia de fractura ósea en pacientes, especialmente mujeres, en tratamiento con rosiglitazona. En un estudio en monoterapia, la incidencia en mujeres tratadas con rosiglitazona fue un 9,3% (2,7 pacientes por cada 100 pacientes-año) frente a un 5,1 % (1,5 pacientes por cada 100 pacientes-año) con metformina o un 3,5 % (1,3 pacientes por cada 100 pacientes-año) con glibenclamida. En otro estudio a largo plazo, hubo un aumento de la incidencia de fractura ósea en los pacientes del grupo de combinación con rosiglitazona respecto al comparador activo [8,3 % vs 5,3 %, razón de riesgos 1,57 (IC 95 % 1,26 - 1,97)]. El riesgo de fractura pareció ser mayor en mujeres en relación al control [11,5 % vs 6,3 %, razón de riesgos 1,82 (95 % IC 1,37 - 2,41)], que en varones en relación al control [5,3 % vs 4,3 %, razón de riesgos 1,23 (95 % IC 0,85 - 1,77)]. Se necesitan más datos para determinar si existe un aumento de riesgo de fractura en varones tras un periodo largo de seguimiento. La mayoría de las fracturas ocurrieron en las extremidades superiores y las extremidades distales inferiores (ver sección 4.4).
En los ensayos clínicos doble ciego con rosiglitazona, la incidencia de elevación de ALT por encima de tres veces el límite superior de la normalidad fue igual a la registrada con placebo (0,2 %) y menor que con comparadores activos (0,5 % metformina/sulfonilureas). La incidencia total de reacciones adversas hepatobiliares fue < 1,5 % en cualquier grupo tratado y similar a la registrada con placebo.
Datos _ post-comercialización Además de las reacciones adversas identificadas en los ensayos clínicos, la tabla 2 recoge las reacciones adversas que se han identificado después de la autorización de rosiglitazona. Las frecuencias se definen como: raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000).
Tabla 2. Frecuencia de las reacciones adversas identificadas para rosiglitazona a partir de los datos post-comercialización
5 Se han notificado casos raros de elevación de enzimas hepáticas y disfunción hepatocelular. Se han notificado casos muy raros con desenlace fatal. ar
Mos.
3?
4.9 Sobredosis
Los datos sobre la sobredosis en humanos son limitados. Durante los ensayos clínicos con voluntarios se administró rosiglitazona a dosis orales únicas de hasta 20 mg y no se observaron reacciones adversas graves.
Vv^
En caso de sobredosis se recomienda iniciar un tratamiento de soporte adecuado, de acuerdo con el estado clínico del enfermo. La rosiglitazona se une en elevada alta proporción a las proteínas y no se
elimina con la hemodiálisi
is.
FARMACO
5. PROPIEDADES FARMACOLOGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos utilizados para el tratamiento de la diabetes, fármacos hipoglucemiantes, excluyendo las insulinas, código ATC: A10BG02
Rosiglitazona es un agonista selectivo del receptor nuclear PPARy (receptor gamma activado por el proliferador de peroxisomas), y es un medicamento antidiabético de la clase de las tiazolidindionas. Reduce la glucemia disminuyendo la resistencia a la insulina en el tejido adiposo, el músculo esquelético y el hígado.
Datos preclínicos
El efecto antidiabético de la rosiglitazona se ha demostrado en diversos modelos animales de diabetes tipo 2. Además, la rosiglitazona preserva la función de la célula B, como lo revela el aumento en la masa de los islotes pancreáticos y el contenido de insulina, y evita la hiperglucemia manifiesta en los modelos animales de diabetes tipo 2. La rosiglitazona no estimula la secreción pancreática de insulina ni induce hipoglucemia en las ratas o ratones. El principal metabolito (para-hidroxi-sulfato), con gran afinidad por el PPARy humano soluble, mostró una potencia relativamente alta en un ensayo de tolerancia a la glucosa en modelos de ratón obeso. La relevancia clínica de esta observación no ha sido aclarada completamente.
Datos de ensayos clínicos

El efecto terapéutico hipoglucemiante es gradual al principio, alcanzando reducciones cercanas al máximo en la glucosa plasmática en ayunas tras aproximadamente 8 semanas de tratamiento. La mejora en el control glucémico se asocia con reducciones tanto en los niveles de glucosa en ayunas como en los de glucosa post-prandial.
Rosiglitazona se asoció con aumento de peso. En estudios mecanísticos se observó que el aumento peso se debía predominantemente a un incremento en la grasa subcutánea, con disminución en la gr visceral e intra-hepática.
Consistente con el mecanismo de acción, rosiglitazona disminuye la resistencia a la insulina y mejora la función de la célula B pancreática. La mejoría del control glucémico se asoció también con descensos significativos en los ácidos grasos libres. La doble terapia oral de rosiglitazona con sulfonilurea o metformina dio lugar a un efecto aditivo sobre el control glucémico en pacientes diabéticos tipo 2 debido a que sus mecanismos de acción son diferentes pero complementarios.
En estudios con una duración máxima de tres años, rosiglitazona administrada una o dos veces al día produjo una mejoría mantenida del control glucémico (glucosa plasmática en ayunas y HbAlc). Este efecto terapéutico hipoglucemiante observado fue más pronunciado en pacientes obesos. No se han completado estudios con rosiglitazona sobre eventos clínicos, por lo tanto, no se han demostrado los beneficios a largo plazo asociados a la mejoría del control glucémico.
ADOPT (A Diabetes Outcome Progresión Trial) fue un ensayo clínico controlado, doble ciego y multicéntrico con una duración de 4 a 6 años (duración media 4 años) en el que se comparó el tratamiento con rosiglitazona (4 a 8 mg/día) frente a metformina (500 mg a 2.000 mg/día) y glibenclamida (2,5 a 15 mg/día) en 4.351 pacientes con diabetes tipo 2 de reciente diagnóstico (< 3 años) sin tratamiento previo. El tratamiento con rosiglitazona redujo significativamente el riesgo de fracaso de la monoterapia (glucosa plasmática en ayunas > 10,0 mmol/l) un 63 % comparado con glibenclamida [razón de riesgos (hazard ratio) 0,37, intervalo de confianza 0,30 - 0,45] y un 32 % comparado con metformina [razón de riesgos (hazard ratio) 0,68, intervalo de confianza 0,55 - 0,85] durante el curso del estudio (hasta 72 meses de tratamiento). Esto se traduce en una incidencia acumulada de fracaso en el tratamiento del 10,3 % de los pacientes tratados con rosiglitazona, 14,8 % de los tratados con metformina y 23,3 % de los tratados con glibenclamida. En general, el 43 %, 47 % y 42 % de los pacientes que recibieron rosiglitazona, glibenclamida y metformina, respectivamente, abandonó el estudio por causas distintas al fracaso de la monoterapia. No se conoce como afectan estos resultados al progreso de la enfermedad o a los resultados microvasculares o macrovasculares. Los acontecimientos adversos observados en este estudio concuerdan con los perfiles de acontecimientos adversos conocidos para cada uno de los tratamientos, incluyendo el aumento continuado de peso con rosiglitazona. Adicionalmente, se observó un aumento de la incidencia de fracturas óseas en mujeres tratadas con rosiglitazona (ver secciones 4.4 y 4.8).


CORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of glycaemia in s) fue un ensayo clínico amplio (4.447 sujetos), abierto, prospectivo, controlado (media de imiento de 5,5 años), en el que los pacientes con diabetes tipo 2 con un control inadecuado con formina o sulfonilurea fueron aleatorizados para añadir rosiglitazona o metformina o sulfonilurea. duración media de la diabetes en esos pacientes era aproximadamente de 7 años. La variable principal adjudicada fue la hospitalización por motivos cardiovasculares (que incluía hospitalización por insuficiencia cardiaca) o muerte cardiovascular. Las dosis medias al final del tratamiento aleatorizado se muestran en la siguiente tabla:
|
Tratamiento aleatorizadof |
Dosis media (DM) al final del tratamiento aleatorizado |
|
Rosiglitazona (SU o metformina) |
6,7 (1,9) mg |
|
Sulfonilurea (tratamiento previo metformina) | |
|
Glimepirida* |
3,6 (1,8) mg |
|
Metformina (tratamiento previo sulfonilurea) |
1995,5 (682,6) mg |
fPacientes que tomaron los tratamientos designados de forma aleatoria en combinación con el tratamiento previo correcto y con datos evaluables.
*Dosis efectiva relativa similar (por ej. aproximadamente la mitad de la dosis máxima) para otras sulfonilureas (glibenclamida y glicazida).
No hubo diferencias en el número de eventos de la variable principal adjudicada para rosiglitazon (321/2.220) vs el control activo (323/2.227) (HR 0,99, IC 0,85 - 1,16), alcanzando el criterio de n< inferioridad predefinido de 1,20 (p de no inferioridad = 0,02). HR e IC para las variables secund; fueron: muerte por cualquier causa (HR 0,86, IC 0,68 - 1,08), MACE (Eventos Cardiacos Adversos Mayores - muerte cardiovascular, infarto agudo de miocardio, ictus) (HR 0,93, IC 0,74 - 1,15), muerte cardiovascular (HR 0,84, IC 0,59 - 1,18), infarto agudo de miocardio (HR 1,14, IC 0,80 - 1,63) e ictus (HR 0,72, IC 0,49 - 1,06). En un sub-estudio a los 18 meses del tratamiento con rosiglitazona en doble terapia con metformina o sulfonilurea, la reducción de HbA1c fue “no inferior” a la del tratamiento combinado de sulfonilurea y metformina. En el análisis final a los 5 años, se observó una reducción media ajustada al valor basal de HbA1c del 0,14 % en pacientes tratados con metformina a los que se les añadió rosiglitazona durante el tratamiento aleatorizado a doble terapia combinada, vs un incremento del 0,17 % en pacientes que tomaban metformina y se les añadió sulfonilurea (p<0,0001 para diferencia de tratamientos). Se observó una reducción media ajustada de HbA1c del 0,24 % en pacientes tratados con sulfonilurea a los que se les añadió rosiglitazona, vs una reducción de HbA1c del 0,10 % para pacientes que tomaban sulfonilurea y se les añadió metformina (p=0,0083 para la diferencia entre tratamientos). Hubo un incremento significativo de insuficiencia cardiaca (mortal y no mortal) (HR 2,10, IC 1,35 - 3,27) y fracturas óseas (razón de riesgos 1,57, IC 1,26 - 1,97) en tratamientos que contenían rosiglitazona comparados con el control activo (ver secciones 4.4 y 4.8).

Se retiraron un total de 564 pacientes por causas cardiovasculares que representaban el 12,3 % de los pacientes tratados con rosiglitazona y el 13 % de los pacientes control; lo cual supone el 7,2 % de pacientes-año perdidos para seguimiento de eventos cardiovasculares y el 2,0 % de pacientes-año perdidos para seguimiento de mortalidad por cualquier causa.
Población pediátrica
Se realizó un ensayo clínico controlado con comparador activo (hasta 8 mg diarios de rosiglitazona o hasta 2.000 mg diarios de metformina) de 24 semanas de duración en 197 niños y adolescentes (de 10 a 17 años de edad) con diabetes tipo 2. Se observó una mejora estadísticamente significativa de los niveles basales de HbA1c sólo en el grupo tratado con metformina. Rosiglitazona fracasó en demostrar no-inferioridad frente a metformina. Tras el tratamiento con rosiglitazona no se observó ningún nuevo problema de seguridad en niños y adolescentes en comparación con pacientes adultos con diabetes mellitus tipo 2. No se dispone de datos de eficacia y seguridad a largo plazo en pacientes pediátricos.
La Agencia Europea de Medicamentos exime de la obligación de presentar los resultados de estudios con AVANDIA en todos los subconjuntos de la población pediátrica con diabetes mellitus tipo II (ver sección 4.2 para información sobre uso pediátrico).

Absorción
La biodisponibilidad absoluta de la rosiglitazona se aproxima al 99% después de administrar una dosis oral de 4 ó de 8 mg. Las concentraciones plasmáticas máximas de rosiglitazona se alcanzan aproximadamente una hora después de la ingesta. Las concentraciones plasmáticas son prácticamente proporcionales a la dosis en el intervalo terapéutico.
Cuando se administra rosiglitazona con los alimentos, no se altera la exposición global (AUC), pero disminuye ligeramente la Cmax (aprox. 20 a 28%) y se retrasa el tmax (aprox. 1,75 h) en relación con la administración en ayunas. Estos ligeros cambios no tienen relevancia clínica y, por tanto, no es necesario administrar rosiglitazona en un momento concreto en relación con las comidas. El incremento del pH gástrico no influye en la absorción de rosiglitazona.
Distribución
El volumen de distribución de rosiglitazona se aproxima a los 14 litros en voluntarios sanos. La unión de rosiglitazona a las proteínas plasmáticas es alta (aprox. 99,8%) sin que se observe una influencia de la concentración o la edad. La unión a proteínas del metabolito principal (para-hidroxi-sulfato) es muy alta (> 99,99%).
Biotransformación


Rosiglitazona se metaboliza de manera amplia; el compuesto precursor se elimina después de su transformación. Las principales vías metabólicas son la N-desmetilación y la hidroxilación, se, de la conjugación con sulfato y ácido glucurónico. La contribución del metabolito principal (par; hidroxi-sulfato) a la actividad antidiabética global de rosiglitazona no ha sido completame dilucidada en el hombre y no se puede descartar que el metabolito pueda contribuir atividad. Sin embargo, esto no implica ningún problema de seguridad para los pacientes diabéticoeneral ni en situaciones especiales ya que rosiglitazona está contraindicada en insuficiencia hepát los ensayos clínicos de fase III incluyeron un número considerable de pacientes de edad avanzad cientes con insuficiencia renal de leve a moderada.
Estudios in vitro demuestran que rosiglitazona se metaboliza fundamentalmente por el CYP2C8, con una contribución menor del CYP2C9.
Rosiglitazona no inhibe de forma significativa las isoformas CYP1A2, 2A6, 2C19, 2D6, 2E1, 3A ó 4A del citocromo P450 en condiciones in vitro; por eso, es poco probable que ocurran interacciones significativas a nivel metabólico con los compuestos metabolizados por estas enzimas. Rosiglitazona mostró una inhibición in vitro moderada del CYP2C8 (CI50 18 pM) y baja del CYP2C9 (CI50 5 0 pM) (ver sección 4.5). En un estudio de interacciones in vivo con warfarina se observó que rosiglitazona no interacciona con sustratos del CYP2C9 in vivo

nes in vivo o.
Eliminación
El aclaramiento plasmático total de rosiglitazona es aproximadamente 3 l/h y la semivida de eliminación terminal de rosiglitazona es aproximadamente de 3 a 4 horas. No existe evidencia de acumulación inesperada de rosiglitazona, después de administrarse una o dos veces al día. La vía principal de eliminación es la urinaria: cerca de dos tercios de la dosis se eliminan por esta vía, mientras que la eliminación fecal representa un 25% de la dosis. No se excreta el fármaco inalterado en orina o heces. La semivida de eliminación terminal del marcaje radiactivo fue aproximadamente 130 horas indicando que la eliminación de metabolitos es muy lenta. Se espera una acumulación de metabolitos en plasma después de dosis repetidas, especialmente del metabolito principal (para-hidroxi-sulfato), para el que se prevé una acumulación 8 veces superior.
Poblaciones especiales
Sexo: al efectuar un análisis farmacocinético poblacional a partir de datos agrupados no se advirtieron diferencias considerables en la farmacocinética de la rosiglitazona entre ambos sexos.
aPgarcui
cientes de edad avanzada: al efectuar el análisis farmacocinético poblacional a partir de datos pados no se apreció que la edad afectara significativamente a la farmacocinética de rosiglitazona.
Niños y adolescentes: en el análisis farmacocinético poblacional que incluía a 96 pacientes pediátricos de 10 a 18 años de edad y peso entre 35 y 178 kg se estimó un valor medio del aclaramiento aparente (CL/F) similar en niños y adolescentes en comparación con el de adultos. El CL/F individual en la población pediátrica se encontraba dentro del mismo intervalo que los valores individuales en adultos. El CL/F aparentemente era independiente de la edad, pero aumentó con el peso en la población pediátrica.
Insuficiencia hepática: en pacientes cirróticos con insuficiencia hepática moderada (clase B de Child-Pugh), los valores de la Cmax libre y AUC resultaron 2 y 3 veces mayores que en sujetos normales. Se observó una gran variabilidad inter-individuo, con una diferencia entre pacientes de 7 veces en el valor de AUC libre.
Insuficiencia renal: no se observa ninguna diferencia clínicamente significativa en la farmacocinética de rosiglitazona en enfermos con insuficiencia renal o enfermedad renal terminal sometidos a diálisis crónica.
toros
5.3 Datos preclínicos sobre seguridad
urante la fa
el
ado
Los efectos adversos observados en estudios con animales con posible relevancia para el uso clínic fueron los siguientes: aumento del volumen plasmático acompañado de un descenso en los paráme de la serie roja y un aumento en el peso del corazón. También se observaron aumentos en e hígado, en los niveles plasmáticos de ALT (sólo en el perro) y en el tejido adiposo. Se han ot efectos similares con otras tiazolidindionas.
En estudios de toxicidad reproductiva, la administración de rosiglitazona a ratas durante la fase intermedia o final de la gestación se asoció con muerte fetal y retraso del desarrollo del feto. Además, rosiglitazona inhibió la síntesis de progesterona y estradiol en el ovario y disminuyó los niveles plasmáticos de estas hormonas, dando lugar a efectos sobre los ciclos estro/menstruales y la fertilidad (ver sección 4.4).
En un modelo animal de poliposis adenomatosa familiar (PAF), el tratamiento con rosiglitazona a una dosis 200 veces superior a la dosis farmacológicamente activa, incrementó el número de tumores en el colon. La relevancia de este hallazgo es desconocida. Sin embargo, rosiglitazona promovió la diferenciación y reversión in vitro de los cambios mutagénicos en células humanas de cáncer de colon. Además, rosiglitazona no resultó ser genotóxica en una batería de estudios de genotoxicidad in vivo e in vitro y no hubo evidencia de tumores de colon en estudios con rosiglitazona, en dos especies de roedores, realizados durante toda la vida del animal.

Núcleo del comprimido carboximetilalmidón de sodio (tipo A) hipromelosa celulosa microcristalina lactosa monohidrato estearato de magnesio.
dióxido macrog lact tria
Cubierta pelicular hipromelosa 6cP
de titanio (E171) ogol 3000 osa monohidrato riacetato de glicerol óxido de hierro amarillo (E172) Óxido de hierro rojo (E172) talco purificado
No procede.
6.3 Periodo de validez 2 años
6.4 Precauciones especiales de conservación
Este medicamento no precisa condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
la
<2>
Envases blíster opacos (PVC/aluminio). 7, 28, 56, 84, 90 ó 112 comprimidos recubiertos con películ ó 56 comprimidos recubiertos con película, envase con dosis unitarias.
Puede que solamente estén comercializados algunos tamaños de envases.

6.6 Precauciones especiales de eliminación
.o-
La elimininación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
SmithKline Beecham Ltd, 980 Great West Road, Brentford, Middlesex, TW8 9GS, Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COM
ERCIAL
ALIZ
lesex,
ZACIÓN
EU/1/00/137/005-009, EU/1/00/137/014, EU/1/00/137/017
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 11 julio 2000 Fecha de la última renovación: 11 julio 2005
EVISIÓ
10. FECHA DE LA REVISIÓN DEL TEXTO
allada d
La información detallada de este medicamento está disponible en la pagina web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
AVANDIA 8 mg comprimidos recubiertos con película
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
<2>
Cada comprimido contiene una cantidad de maleato de rosiglitazona correspondiente a 8 mg de rosiglitazona
Excipiente
Contiene lactosa (aproximadamente 209 mg).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA

N>
Comprimido recubierto con película (comprimido).
Comprimidos recubiertos con película de color marrón rojizo que llevan la inscripción "GSK" en una cara y "8" en la otra.
4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas
Rosiglitazona está indicada para el tratamiento de la diabetes mellitus tipo 2: en monoterapia
- en adultos (especialmente aquéllos con sobrepeso) con control insuficiente con dieta y ejercicio en los que el tratamiento con metformina se considera inadecuado, por existir contraindicaciones o intolerancia
en doble terapia oral en combinación con
- metformina, en adultos (especialmente aquéllos con sobrepeso) con control glucémico insuficiente a pesar de recibir la dosis máxima tolerada en monoterapia con metformina
- una sulfonilurea, sólo en adultos con intolerancia a metformina o para los que metformina está contraindicada, con control glucémico insuficiente a pesar del tratamiento en monoterapia con una sulfonilurea
en triple terapia oral en combinación con

4P.o2s
metformina y una sulfonilurea, en adultos (especialmente aquellos con sobrepeso) con control glucémico insuficiente a pesar de la doble terapia oral (ver sección 4.4).
Posología y forma de administración
osología
El tratamiento con rosiglitazona se suele iniciar con 4 mg/día. Esta posología se puede incrementar hasta 8 mg/día después de ocho semanas si se precisa un mayor control de la glucemia. En pacientes a los que se administra rosiglitazona en combinación con una sulfonilurea, se debe realizar un incremento en la posología de rosiglitazona de hasta 8 mg/día cautelosamente, después de efectuar la evaluación clínica adecuada para valorar el riesgo de que el paciente desarrolle reacciones adversas relacionadas con la retención de líquidos (ver secciones 4.4 y 4.8).
Rosiglitazona se puede administrar en una o dos tomas diarias (bien como una dosis diaria o dividida en dos dosis).
Poblaciones especiales
Pacientes de edad avanzada (>65 años) (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)

No es necesario ajustar la dosis en los pacientes de edad avanzada.
Insuficiencia renal (ver sección 4.4 Retención de líquidos e insuficiencia cardiaca)
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve y moderada. Se dispone de datos limitados en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) por tanto, rosiglitazona se debe utilizar con precaución en estos pacientes.
Insuficiencia hepática
No se debe utilizar rosiglitazona en pacientes con insuficiencia hepática (ver sección 4.3 Población pediátrica
No se dispone de datos sobre el empleo de rosiglitazona en niños menores de 10 años. Existen datos limitados sobre el tratamiento en monoterapia con rosiglitazona en niños y adolescentes de edades entre 10 y 17 años (ver secciones 5.1 y 5.2). Los datos disponibles no confirman la eficacia en la población pediátrica, por lo que no se recomienda su uso.
Forma de administración
Los comprimidos se deben tragar con agua y se pueden tomar con o sin alimentos.
&
Para mejorar el cumplimiento terapéutico, se sugiere que a los pacientes se les aconseje tomar los comprimidos en torno a la misma hora cada día.
La utilización de rosiglitazona está contraindicada en pacientes con:
- hipersensibilidad conocida a rosiglitazona o a alguno de los excipientes
- insuficiencia cardiaca o historia de insuficiencia cardiaca (clases I a IV de la NYHA)
- un Síndrome Coronario Agudo (angina inestable, infarto de miocardio sin elevación del
segmento ST (IAMSEST) e infarto de miocardio con elevación del segmento ST (IAMCEST) (ver sección 4.4)
- insuficiencia hepática
♦ if\
- cetoacidosis diabética o pre-coma diabético.
4.4 Advertencias y precauciones especiales de empleo
tención de líquidos e insuficiencia cardiaca
sLiagsn
líqui
iazolidindionas pueden causar retención de líquidos, lo que podría exacerbar o desencadenar os o síntomas de insuficiencia cardiaca congestiva. Rosiglitazona puede causar retención de íquidos dosis-dependiente. Se debe evaluar de forma individual la posible contribución de la retención de líquidos al aumento de peso, ya que el aumento de peso rápido y excesivo se ha notificado muy raramente como un signo de retención de líquidos. Deben controlarse los signos y síntomas de reacciones adversas relacionadas con la retención de líquidos, incluidos el aumento de peso y la insuficiencia cardiaca, en todos los pacientes, especialmente en aquéllos que reciben tratamiento en combinación con insulina o sulfonilurea, aquéllos con riesgo de insuficiencia cardiaca y aquéllos con reserva cardiaca reducida. Se recomienda intensificar la monitorización del paciente si se administra rosiglitazona en combinación con metformina e insulina. El tratamiento con rosiglitazona debe interrumpirse si se produce un deterioro de la función cardiaca.
También se ha notificado más frecuentemente insuficiencia cardiaca en pacientes con antecedentes de insuficiencia cardiaca; además, se han notificado más frecuentemente edema e insuficiencia cardiaca en pacientes de edad avanzada y en pacientes con insuficiencia renal leve o moderada. Se deben tomar precauciones en pacientes mayores de 75 años debido a la experiencia limitada en este grupo de pacientes. Dado que los AINEs y la rosiglitazona se asocian con retención de líquidos, su administración concomitante puede incrementar el riesgo de edema.
Combinación con insulina
o
.
En los ensayos clínicos se ha observado unaumento en la incidencia de insuficiencia cardiaca cuand se utiliza rosiglitazona en combinación con insulina. Insulina y rosiglitazona están ambas asociadas con la retención de líquidos, por lo que su administración conjunta puede aumentar el riesgo de edema y podría aumentar el riesgo de cardiopatía isquémica. Sólo en circunstancias excepcionales y bajo un control estricto se puede tratar con insulina a pacientes que ya estén tomando rosiglitazona.
Isquemia miocárdica
Un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración, indicó que el tratamiento con rosiglitazona podría estar asociado a un aumento del riesgo de eventos de isquemia miocárdica. Sin embargo, en su totalidad los datos disponibles sobre el riesgo de isquemia miocárdica no son concluyentes (ver sección 4.8). Existen datos limitados de ensayos clínicos en pacientes con cardiopatía isquémica y/o enfermedad arterial periférica. Por ello, como medida de precaución, no se recomienda el uso de rosiglitazona en estos pacientes, particularmente en aquéllos con síntomas de isquemia miocárdica.
♦ (V
Síndrome Coronario Agudo (SCA)
Los pacientes con SCA no han sido estudiados en ensayos clínicos controlados con rosiglitazona. Por consiguiente, dada la posibilidad de que dichos pacientes desarrollen insuficiencia cardiaca, no debe iniciarse el tratamiento con rosiglitazona en pacientes que tengan un evento coronario agudo, y si el tratamiento estuviera previamente instaurado, debe interrumpirse durante la fase aguda del evento coronario (ver sección 4.3).
(Y
Monitorización de la _función hepática
, que se disponga de los resultados de laboratorio. Si se observa ictericia, se debe interrumpir el atamiento con rosiglitazona.
En raras ocasiones se ha notificado disfunción hepatocelular durante el uso post-comercialización (ver sección 4.8). La experiencia en el tratamiento con rosiglitazona en pacientes con enzimas hepáticas elevadas (ALT > 2,5 veces el límite superior de la normalidad) es limitada. Por tanto, se debe comprobar el nivel de enzimas hepáticas en todos los pacientes antes de comenzar el tratamiento con rosiglitazona y posteriormente, cada cierto tiempo, según el criterio clínico. No debe iniciarse el tratamiento con rosiglitazona en pacientes con niveles basales elevados de enzimas hepáticas (ALT >
2,5 veces el límite superior de la normalidad) o ante cualquier otra evidencia clínica de enfermedad hepática. Si se incrementan los niveles de ALT por encima de 3 veces el límite superior de la normalidad durante el tratamiento con rosiglitazona, se deben volver a evaluar los niveles de enzimas hepáticas tan pronto como sea posible. Si los niveles de ALT permanecen por encima de tres veces el límite superior de la normalidad, se debe interrumpir el tratamiento. Si algún paciente desarrolla síntomas que sugieran una disfunción hepática, como náuseas, vómitos, dolor abdominal, fatiga, anorexia y/u oscurecimiento de la orina de origen desconocido, se deben comprobar las enzimas hepáticas. La decisión de continuar el tratamiento con rosiglitazona se debe basar en el juicio clínico hasta trata
Trastornos oculares
Durante la fase post-comercialización se han notificado casos de nueva aparición o empeoramiento de edema macular diabético con disminución de la agudeza visual con el uso de tiazolidindionas, incluyendo rosiglitazona. Muchos de estos pacientes notificaron además edema periférico. No se ha establecido si existe una relación directa entre la administración de rosiglitazona y la aparición de edema macular, pero los médicos deben considerar el diagnóstico de edema macular en el caso de pacientes que notifiquen alteraciones en la agudeza visual, y en dichos casos se debe considerar una revisión apropiada por el oftalmólogo.
Aumento de peso
En ensayos clínicos con rosiglitazona hubo evidencia de aumento de peso dosis-dependiente, que fue mayor cuando se utilizó en combinación con insulina. Por tanto, el peso debe monitorizarse rigurosamente, dado que su aumento puede ser el resultado de la retención de líquidos, que podría estar asociada a insuficiencia cardiaca.
Anemia
existe
Jy
El tratamiento con rosiglitazona se asocia con una reducción de los niveles de hemoglobina dosis-dependiente. En pacientes con niveles de hemoglobina bajos antes de comenzar el tratamiento, un mayor riesgo de desarrollar anemia durante el tratamiento con rosiglitazona.
Hiposlucemia
etformi
Los pacientes que reciban rosiglitazona como terapia oral de combinación con una sulfonilurea o con insulina pueden presentar riesgo de hipoglucemia dosis-dependiente. Puede ser necesaria una reducción de la dosis del medicamento usado en combinación y la intensificación de la monitorización del paciente.
Triple terapia oral
e la alt
sP
El tratamiento con rosiglitazona en la triple terapia oral, en combinación con metformina y una sulfonilurea, podría estar asociado con un aumento del riesgo de retención de líquido e insuficiencia cardiaca, así como hipoglucemia (ver sección 4.8). Se recomienda intensificar la monitorización del paciente, pudiendo ser necesario el ajuste de la dosis de la sulfonilurea administrada. En la decisión de iniciar el tratamiento con la triple terapia oral debe considerarse la alternativa de cambiar el tratamiento a insulina.
Trastornos óseos
Ensayos a largo plazo muestran un aumento de la incidencia de fracturas óseas en los pacientes, especialmente en las mujeres, tratados con rosiglitazona (ver sección 4.8). La mayoría de las fracturas han ocurrido en las extremidades superiores y en las extremidades distales inferiores. En mujeres, este aumento de la incidencia se detectó después del primer año de tratamiento y persistió durante tratamientos a largo plazo. Se debe tener en cuenta el riesgo de fractura en el cuidado de los pacientes tratados con rosiglitazona, especialmente en pacientes mujeres.
Otros
Durante los ensayos clínicos se administró rosiglitazona a mujeres premenopáusicas. Aunque en los estudios preclínicos (ver sección 5.3) se observó un desequilibrio hormonal, no se han detectado reacciones adversas significativas asociadas con alteraciones menstruales. Como consecuencia de la potenciación de la sensibilidad a la insulina, se puede producir una reanudación de la ovulación en pacientes que presentaban anovulación debido a la resistencia a la insulina. Se debe advertir a las pacientes del riesgo de embarazo y si una paciente desea quedarse embarazada o se produce un embarazo, se debe interrumpir el tratamiento (ver sección 4.6).
Rosiglitazona debe utilizarse con precaución en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min).

Rosiglitazona debe utilizarse con precaución durante la administración concomitante de inhibidores del CYP2C8 (por ej. gemfibrozilo) o inductores de esta enzima (por ej. rifampicina). Se deberá monitorizar rigurosamente la glucemia. Se debe considerar el ajuste de la dosis de rosiglitazona de acuerdo con la posología recomendada o cambios en el tratamiento de la diabetes (ver sección 4.5).
Los comprimidos de AVANDIA contienen lactosa, por lo que los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios in vitro demuestran que rosiglitazona se metaboliza principalmente por el CYP2C8, mientras que el CYP2C9 representa una vía minoritaria.

La administración conjunta de rosiglitazona y gemfibrozilo (un inhibidor del CYP2C8) tuvo como resultado un incremento de dos veces las concentraciones plasmáticas de rosiglitazona. Debido al potencial aumento del riesgo de reacciones adversas dosis-dependiente, puede ser necesaria una reducción de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4).
ratos del CY tidiabético
La administración conjunta de rosiglitazona y rifampicina (un inductor del CYP2C8) tuvo como resultado una reducción del 66 % en las concentraciones plasmáticas de rosiglitazona. No puede si descartado que otros inductores (por ej. fenitoína, carbamazepina, fenobarbital, hipérico o hierba de San Juan) también puedan afectar a la exposición a rosiglitazona. Puede ser necesario un aumento de la dosis de rosiglitazona. Se debe considerar la rigurosa monitorización de la glucemia (ver sección 4.4).
No se prevén interacciones clínicamente significativas con inhibidores o sustratos del CYP2C9.
xO
con digoxin
La administración concomitante de rosiglitazona con medicamentos antidiabéticos orales como metformina, glibenclamida y acarbosa no dio lugar a ninguna interacción farmacocinética clínicamente relevante. El consumo moderado de alcohol, junto con rosiglitazona, no modifica el control de la glucemia.
No se han observado interacciones clínicamente relevantes con digoxina, warfarina (sustrato del CYP2C9), ni con los sustratos del CYP3A4 nifedipino, etinilestradiol o noretindrona, después de la administración conjunta con rosiglitazona.
4.6
♦jCo
Fertilidad, embarazo y lactancia
a la pl
Embarazo
Se ha notificado que rosiglitazona atraviesa la placenta humana y que se detecta en tejidos fetales. No existen datos suficientes sobre la utilización de rosiglitazona en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. No se debe utilizar rosiglitazona durante el embarazo.
Lactancia
Se ha detectado rosig lactancia producir en mujeres en per

ona en la leche de animales de experimentación. No se sabe con certeza si la ión del lactante al medicamento. Por tanto, no se debe utilizar rosiglitazona actancia.

uencia del aumento de la sensibilidad a la insulina, puede reanudarse la ovulación en e no ovulen debido a la resistencia a la insulina (por ej. pacientes con síndrome de ovario poliquístico). Las pacientes deben ser conscientes del riesgo de embarazo, y si una paciente desea quedarse embarazada o si se queda embarazada, se debe interrumpir el tratamiento.
Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de AVANDIA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Datos de ensayos clínicos
nscyia
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con rosiglitazona son reacciones relacionadas con los fluidos dosis-dependientes, entre las que se incluyen edema y anemia. El tratamiento conjunto de rosiglitazona y sulfonilurea se puede asociar a un incremento de la frecuencia de hipoglucemia y anemia, en comparación con la administración de rosiglitazona en monoterapia. Es importante monitorizar la retención de líquidos en los pacientes, en los que podría exacerbar o precipitar signos o síntomas de insuficiencia cardiaca congestiva (ver sección 4.4).
Las reacciones adversas para cada tratamiento se enumeran a continuación, clasificadas por órganos sistemas y por frecuencia absoluta. En el caso de reacciones adversas dosis-dependientes, la frecue se refiere a la dosis mayor de rosiglitazona. Las categorías de frecuencia no consideran otros facto como la variación de la duración del ensayo, patologías pre-existentes y características basa paciente. Las categorías de frecuencia asignadas a las reacciones adversas de acuerdo con la experiencia de los ensayos clínicos pueden no corresponderse con la frecuencia de las reacciones adversas que ocurren durante la práctica clínica normal. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10) y poco frecuentes (> 1/1.000 a < 1/100).
La tabla 1 recoge las reacciones adversas identificadas durante la revisión de los ensayos clínicos en los que han participado más de 5.000 pacientes tratados con rosiglitazona. Dentro de cada clase de órganos y sistemas, las reacciones adversas se presentan por frecuencia decreciente para el tratamiento en monoterapia con rosiglitazona. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
&
&
&
&
|
Reacción adversa |
Frecuencia de la reacción adversa según el régimen de tratamiento | |||
|
RSG |
RSG + MET |
RSG + SU |
RSG + MET + SU | |
|
Trastornos de la sangre y del sistema linfático | ||||
|
anemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
leucopenia |
Frecuentes | |||
|
trombocitopenia |
Frecuentes |
A | ||
|
granulocitopenia |
Frecuentes | |||
|
Trastornos del metabolismo y de la nutrición | ||||
|
hipercolesterolemia1 |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
hipertrigliceridemia |
Frecuentes |
Frecuentes | ||
|
hiperlipidemia |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de peso |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
aumento de apetito |
Frecuentes |
Poco frecuentes | ||
|
hipoglucemia |
Frecuentes |
Muy frecuentes |
Muy frecuentes | |
|
Trastornos del sistema nervioso | ||||
|
mareos* |
Frecuentes |
Frecuentes | ||
|
dolor de cabeza* |
_ +A |
_ |
Frecuentes | |
|
Trastornos cardiacos | ||||
|
insuficiencia cardiaca7 |
Frecuentes |
Frecuentes |
Frecuentes | |
|
isquemia cardiaca 8* |
Frecuentes |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos gastrointestinales | ||||
|
estreñimiento |
Frecuentes Frecuentes |
Frecuentes |
Frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||||
|
fracturas óseas9 |
Frecuentes |
Frecuentes |
Frecuentes | |
|
mialgia* |
Frecuentes | |||
|
Trastornos generales y alteraciones en el lugar de administración | ||||
|
edema _.vC>« |
Frecuentes |
Frecuentes |
Muy frecuentes |
Muy frecuentes |
RSG: Rosiglitazona en monoterapia; RSG + MET: Rosiglitazona con metformina; RSG + SU: Rosiglitazona con sulfonilurea; RSG + MET + SU: Rosiglitazona con metformina y sulfonilurea
<2>
* Para estas reacciones adversas, la categoría de la frecuencia de la incidencia basal en el grupo placebo en los ensayos clínicos es “frecuentes”.
V
1 Se notificó hipercolesterolemia en hasta un 5,3 % de pacientes tratados con rosiglitazona (monoterapia, doble y triple terapia oral). El aumento de los niveles de colesterol total se asoció a un incremento tanto de LDL-colesterol (LDLc) como de HDL-colesterol (HDLc), si bien el cociente de colesterol total:HDLc no se modificó o mejoró en los ensayos de larga duración. En conjunto, estos incrementos fueron generalmente de leves a moderados y normalmente no requirieron la interrupción del tratamiento.
total). La incidencia de insuficiencia cardiaca en la triple terapia oral fue de un 1,4 % en el ensayo doble ciego principal, comparado con un 0,4 % para la doble terapia metformina más sulfonilurea. La incidencia de insuficiencia cardiaca en la combinación con insulina (rosiglitazona añadida a la terapia establecida con insulina) fue de un 2,4 %, comparado con el 1,1 % con insulina sola. Además, un ensayo de un año de duración controlado con placebo, realizado en pacientes con insuficiencia cardiaca congestiva clases I-II de la NYHA, demostró un empeoramiento o posible empeoramiento de la insuficiencia cardiaca en un 6,4% de los pacientes tratados con rosiglitazona en comparación con un
3,5 % de los pacientes del grupo placebo.
3 En un análisis retrospectivo de datos agrupados de 42 ensayos clínicos de corta duración, la incidencia global de eventos que se asocian típicamente con isquemia cardiaca fue superior en los regímenes de tratamiento que incluían rosiglitazona (2,00 %), frente a los que incluían los grupos combinados de comparador activo y placebo (1,53%) [hazard ratio (HR) 1,30 (intervalo de confianza (IC) 95 % 1,004 - 1,69)]. El riesgo fue mayor cuando se añadió rosiglitazona a tratamientos insulínicos ya instaurados, así como en pacientes que recibían nitratos para una cardiopatía isquémica conocida. En una actualización de este análisis retrospectivo que incluyó 10 estudios más que cumplían los criterios de inclusión, pero que no estaban disponibles en el momento del análisis original, la incidencia global de los eventos que se asocian típicamente con isquemia cardiaca no fue estadísticamente diferente para los regímenes de tratamiento que incluían rosiglitazona (2,21 %), frente a los que incluían los grupos combinados de comparador activo y placebo (2,08 %) [HR 1,098 (IC 95 % 0,809 - 1,354)]. En un estudio prospectivo de eventos cardiovasculares (seguimiento medio de 5,5 años) la variable primaria de muerte y hospitalización de causa cardiovascular fue similar en el grupo de rosiglitazona y en el grupo de los comparadores activos [HR 0,99 (IC 95 % 0,85 - 1,16)]. Otros dos ensayos clínicos controlados, prospectivos, aleatorizados (9.620 pacientes, duración de cada estudio > 3 años), en los que se comparó rosiglitazona frente a otros medicamentos antidiabéticos orales autorizados o placebo, no han confirmado ni excluido el potencial riesgo de isquemia cardiaca. En su conjunto, los datos disponibles relativos al riesgo de isquemia cardiaca no son concluyentes.
4 Estudios a largo plazo muestran un aumento en la incidencia de fractura ósea en pacientes, especialmente mujeres, en tratamiento con rosiglitazona. En un estudio en monoterapia, la incidencia en mujeres tratadas con rosiglitazona fue un 9,3 % (2,7 pacientes por cada 100 pacientes-año) frente a un 5,1 % (1,5 pacientes por cada 100 pacientes-año) con metformina o un 3,5 % (1,3 pacientes por cada 100 pacientes-año) con glibenclamida. En otro estudio a largo plazo, hubo un aumento de la incidencia de fractura ósea en los pacientes del grupo de combinación con rosiglitazona respecto al comparador activo [8,3 % vs 5,3 %, razón de riesgos 1,57 (IC 95 % 1,26 - 1,97)]. El riesgo de fractura pareció ser mayor en mujeres en relación al control [11,5 % vs 6,3 %, razón de riesgos 1,82 (95 % IC 1,37 - 2,41)], que en varones en relación al control [5,3 % vs 4,3 %, razón de riesgos 1,23 (95 % IC 0,85 - 1,77)]. Se necesitan más datos para determinar si existe un aumento de riesgo de fractura en varones tras un periodo largo de seguimiento. La mayoría de las fracturas ocurrieron en las extremidades superiores y las extremidades distales inferiores (ver sección 4.4).
En los ensayos clínicos doble ciego con rosiglitazona, la incidencia de elevación de ALT por encima de tres veces el límite superior de la normalidad fue igual a la registrada con placebo (0,2 %) y menor que con comparadores activos (0,5 % metformina/sulfonilureas). La incidencia total de reacciones adversas hepatobiliares fue < 1,5 % en cualquier grupo tratado y similar a la registrada con placebo.
Datos _ post-comercialización Además de las reacciones adversas identificadas en los ensayos clínicos, la tabla 2 recoge las reacciones adversas que se han identificado después de la autorización de rosiglitazona. Las frecuencias se definen como: raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000).
Tabla 2. Frecuencia de las reacciones adversas identificadas para rosiglitazona a partir de los datos post-comercialización
|
Reacción adversa |
Frecuencia | |
|
Trastornos del sistema inmunológico) | ||
|
reacción anafiláctica | ||
|
angioedema |
Muy raras | |
|
reacciones de la piel (por ej. urticaria, prurito y erupción) |
Muy raras | |
|
_V | ||
|
Trastornos del metabolismo y de la nutrición | ||
|
incremento de peso rápido y excesivo |
Muy raras | |
|
_ | ||
|
Trastornos oculares | ||
|
edema macular |
Raras | |
|
Trastornos cardiacos | ||
|
insuficiencia cardiaca congestiva/edema pulmonar |
Raras | |
|
A* VT | ||
|
Trastornos hepatobiliares | ||
|
disfunción hepatocelular, evidenciada principalmente por la elevación de las |
Raras | |
|
enzimas hepáticas5 |
_Y\_ | |
epáticas y d
disfunción hepatocelular. Se han
5 Se han notificado casos raros de elevación de enzimas h notificado casos muy raros con desenlace fatal.
imitad
Los datos sobre la sobredosis en humanos son limitados. Durante los ensayos clínicos con voluntarios se administró rosiglitazona a dosis orales únicas de hasta 20 mg y no se observaron reacciones adversas graves.
En caso de sobredosis se recomienda iniciar un tratamiento de soporte adecuado, de acuerdo con el estado clínico del enfermo. La rosiglitazona se une en una elevada proporción a las proteínas y no se elimina con la hemodiálisis.
5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos utilizados para el tratamiento de la diabetes, fármacos hipoglucemiantes, exvluyendo las insulinas, código ATC: A10BG02

Rosiglitazona es un agonista selectivo del receptor nuclear PPARy (receptor gamma activado por el proliferador de peroxisomas), y es un medicamento antidiabético de la clase de las tiazolidindionas. Reduce la glucemia disminuyendo la resistencia a la insulina en el tejido adiposo, el músculo esquelético y el hígado.
Datos preclínicos
El efecto antidiabético de la rosiglitazona se ha demostrado en diversos modelos animales de diabetes tipo 2. Además, la rosiglitazona preserva la función de la célula B, como lo revela el aumento en la masa de los islotes pancreáticos y el contenido de insulina, y evita la hiperglucemia manifiesta en los modelos animales de diabetes tipo 2. La rosiglitazona no estimula la secreción pancreática de insulina ni induce hipoglucemia en las ratas o ratones. El principal metabolito (para-hidroxi-sulfato), con gran afinidad por el PPARy humano soluble, mostró una potencia relativamente alta en un ensayo de tolerancia a la glucosa en modelos de ratón obeso. La relevancia clínica de esta observación no ha sido aclarada completamente.
Datos de ensayos clínicos
El efecto terapéutico hipoglucemiante es gradual al principio, alcanzando reducciones cercanas al máximo en la glucosa plasmática en ayunas tras aproximadamente 8 semanas de tratamiento. La mejora en el control glucémico se asocia con reducciones tanto en los niveles de glucosa en ayunas como en los de glucosa post-prandial.
Rosiglitazona se asoció con aumento de peso. En estudios mecanísticos se observó que el aumento de peso se debía predominantemente a un incremento en la grasa subcutánea, con disminución en la grasa visceral e intra-hepática.
Consistente con el mecanismo de acción, rosiglitazona disminuye la resistencia a la insulina y mejora la función de la célula B pancreática. La mejoría del control glucémico se asoció también con descensos significativos en los ácidos grasos libres. La doble terapia oral de rosiglitazona con sulfonilurea o metformina dio lugar a un efecto aditivo sobre el control glucémico en pacientes diabéticos tipo 2 debido a que sus mecanismos de acción son diferentes pero complementarios.
En estudios con una duración máxima de tres años, rosiglitazona administrada una o dos veces al día produjo una mejoría mantenida del control glucémico (glucosa plasmática en ayunas y HbAlc). Este efecto terapéutico hipoglucemiante observado fue más pronunciado en pacientes obesos. No se han completado estudios con rosiglitazona sobre eventos clínicos, por lo tanto, no se han demostrado los beneficios a largo plazo asociados a la mejoría del control glucémico.
ADOPT (A Diabetes Outcome Progresión Trial) fue un ensayo clínico controlado, doble ciego y multicéntrico con una duración de 4 a 6 años (duración media 4 años) en el que se comparó el tratamiento con rosiglitazona (4 a 8 mg/día) frente a metformina (500 mg a 2.000 mg/día) y glibenclamida (2,5 a 15 mg/día) en 4.351 pacientes con diabetes tipo 2 de reciente diagnóstico (< 3 años) sin tratamiento previo. El tratamiento con rosiglitazona redujo significativamente el riesgo de fracaso de la monoterapia (glucosa plasmática en ayunas > 10,0 mmol/l) un 63 % comparado con glibenclamida [razón de riesgos (hazard ratio) 0,37, intervalo de confianza 0,30 - 0,45] y un 32 % comparado con metformina [razón de riesgos (hazard ratio) 0,68, intervalo de confianza 0,55 - 0,85] durante el curso del estudio (hasta 72 meses de tratamiento). Esto se traduce en una incidencia acumulada de fracaso en el tratamiento del 10,3 % de los pacientes tratados con rosiglitazona, 14,8 % de los tratados con metformina y 23,3 % de los tratados con glibenclamida. En general, el 43 %, 47 % y 42 % de los pacientes que recibieron rosiglitazona, glibenclamida y metformina, respectivamente, abandonó el estudio por causas distintas al fracaso de la monoterapia. No se conoce como afectan estos resultados al progreso de la enfermedad o a los resultados microvasculares o macrovasculares. Los acontecimientos adversos observados en este estudio concuerdan con los perfiles de acontecimientos adversos conocidos para cada uno de los tratamientos, incluyendo el aumento continuado de peso con rosiglitazona. Adicionalmente, se observó un aumento de la incidencia de fracturas óseas en mujeres tratadas con rosiglitazona (ver secciones 4.4 y 4.8).

El estudio RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of glycaemia in Diabetes) fue un ensayo clínico amplio (4.447 sujetos), abierto, prospectivo, controlado (media de seguimiento de 5,5 años), en el que los pacientes con diabetes tipo 2 con un control inadecuado con metformina o sulfonilurea fueron aleatorizados para añadir rosiglitazona o metformina o sulfonilurea. La duración media de la diabetes en esos pacientes era aproximadamente de 7 años. La variable principal adjudicada fue la hospitalización por motivos cardiovasculares (que incluía hospitalización por insuficiencia cardiaca) o muerte cardiovascular. Las dosis medias al final del tratamiento aleatorizado se muestran en la s