Asnervon 1000 Mg Granulado Recubierto En Sobre Efg
Información obsoleta, busque otroÍTT1
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Asnervon 250 mg granulado recubierto en sobre EFG Asnervon 500 mg granulado recubierto en sobre EFG Asnervon 750 mg granulado recubierto en sobre EFG Asnervon 1000 mg granulado recubierto en sobre EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Asnervon 250 mg granulado recubierto en sobre EFG Cada sobre contiene 250 mg de levetiracetam.
Asnervon 500 mg granulado recubierto en sobre EFG Cada sobre contiene 500 mg de levetiracetam.
Asnervon 750 mg granulado recubierto en sobre EFG Cada sobre contiene 750 mg de levetiracetam.
Asnervon 1000 mg granulado recubierto en sobre EFG Cada sobre contiene 1000 mg de levetiracetam.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Granulado recubierto en sobre.
Sobres con gránulos recubiertos, redondos (de aproximadamente 2 mm de diámetro), blancos o casi blancos.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Asnervon está indicado como monoterapia en el tratamiento de las crisis de inicio parcial
con o sin generalización secundaria en adultos y adolescentes de 16 años de edad o mayores
con un nuevo diagnóstico de epilepsia.
Asnervon está indicado como terapia concomitante
• en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en adultos, adolescentes, niños y lactantes desde 1 mes de edad con epilepsia.
• en el tratamiento de las crisis mioclónicas en adultos y adolescentes mayores de 12 años con Epilepsia Mioclónica Juvenil.
• en el tratamiento de las crisis tónico-clónicas generalizadas primarias en adultos y adolescentes mayores de 12 años con Epilepsia Generalizada Idiopática.
4.2 Posología y forma de administración
Posología
Monoterapia en adultos y adolescentes mayores de 16 años
,<Tfo.
ÍTTI
La dosis inicial recomendada es de 250 mg dos veces al día, la cual debe aumentarse hasta la dosis terapéutica inicial de 500 mg dos veces al día tras dos semanas de tratamiento. La dosis puede aumentarse en función de la respuesta clínica con 250 mg dos veces al día cada 2 semanas. La dosis máxima es de 1.500 mg dos veces al día.
Terapia concomitante en adultos (>18 años) y adolescentes (de 12 a 17 años) con un peso de 50 kg o superior
La dosis terapéutica inicial es de 500 mg dos veces al día. Esta dosis se puede instaurar desde el primer día de tratamiento. Dependiendo de la respuesta clínica y de la tolerabilidad, la dosis diaria se puede incrementar hasta 1.500 mg dos veces al día. La modificación de la dosis se puede realizar con aumentos o reducciones de 500 mg dos veces al día cada dos a cuatro semanas.
Poblaciones especiales
Pacientes de edad avanzada (65 años y mayores)
Se recomienda ajustar la dosis en los pacientes de edad avanzada con función renal comprometida (ver “insuficiencia renal”).
Insuficiencia renal
La dosis diaria se debe individualizar de acuerdo con la función renal.
Para pacientes adultos, referirse a la siguiente tabla y ajustar la dosis según se indica. Para utilizar esta tabla de dosificación se necesita una estimación del aclaramiento de creatinina (CLcr), en ml/min, del paciente. El CLcr, en ml/min, se puede estimar a partir de la determinación de la creatinina sérica (mg/dl) para adultos y adolescentes que pesen 50 kg o más utilizando la fórmula siguiente:
[140-edad(años)] x peso (kg)
CLcr (ml/min) =............................................(x 0,85 para mujeres)
72 x creatinina sérica (mg/dl)
Entonces se ajusta el CLcr para el área de la superficie corporal (ASC) como sigue:
2
CLcr (ml/min/1,73 m )
CLcr (ml/min)
--------------------------- x 1,73
2
ASC del sujeto (m )
Tabla 1: Ajuste de la dosificación en pacientes adultos y adolescentes con un peso superior a 50 kg con insuficiencia renal
|
Grupo |
Aclaramiento de creatinina (ml/min/1,73 m2) |
Dosis y frecuencia |
|
Normal |
> 80 |
500 a 1.500 mg dos veces al día |
|
Leve |
50-79 |
500 a 1.000 mg dos veces al día |
|
Moderada |
30-49 |
250 a 750 mg dos veces al día |
|
Grave |
< 30 |
250 a 500 mg dos veces al día |
|
Pacientes con enfermedad renal terminal bajo diálisis (1) |
- |
500 a 1.000 mg una vez al día (2) |
(1) Se recomienda una dosis de carga de 750 mg en el primer día de tratamiento con levetiracetam.
(2) Después de la diálisis se recomienda una dosis suplementaria de 250 a 500 mg.
En niños con insuficiencia renal, la dosis de levetiracetam debe ser ajustada en base a la función renal, puesto que el aclaramiento de levetiracetam está relacionado con la función renal. Esta recomendación se basa en un estudio en pacientes adultos con insuficiencia renal.
2
El CLcr en ml/min/1,73 m se puede estimar a partir de la determinación de la creatinina sérica (mg/dl) para adolescentes jóvenes, niños y lactantes utilizando la siguiente fórmula (fórmula Schwartz):
Altura (cm) x ks
2
CLcr (ml/min/1,73 m ) =---------------------------
Creatinina sérica (mg/dl)
ks= 0,45 en recién nacidos a término hasta 1 año de edad; ks= 0,55 en niños menores de 13 años y en adolescentes femeninas; ks= 0,7 en adolescentes varones
Tabla 2: Ajuste de la dosificación en lactantes, niños y adolescentes con un peso inferior a 50 kg con insuficiencia renal
|
Grupo |
Aclaramiento de creatinia(ml/min /1.73m2) |
Dosis y frecuencia (1) | |
|
Lactantes de 1 a menos de 6 meses de edad |
Lactantes de 6 a 23 meses de edad, niños y adolescentes que pesen menos de 50 kg | ||
|
Normal |
> 80 |
7 a 21 mg/Kg (0,07 a 0,21 ml/kg) dos veces al día |
10 a 30 mg/kg (0,10 a 0,30 ml/kg) dos veces al día |
|
Leve |
50-79 |
7 a 14 mg/kg (0,07 a 0,14 ml/kg) dos veces al día |
10 a 20 mg/kg (0,10 a 0,20 ml/kg) dos veces al día |
|
Moderada |
30-49 |
3,5 a 10,5 mg/kg ( 0,035 a 0,105 ml/kg) dos veces al día |
5 a 15 mg/kg (0,05 a 0,15 ml/kg) dos veces al día |
|
Grave |
< 30 |
3,5 a 7 mg/kg (0,035 a 0,07 ml/kg) dos veces al día |
5 a 10 mg/kg (0,05 a 0,10 ml/kg) dos veces al día |
|
Pacientes con enfermedad renal terminal bajo diálisis |
7 a 14 mg/kg (0,07 a 0,14 ml/kg) una vez al día (2) (4) |
10 a 20 mg/kg ( 0,10 a 0,20 ml/kg) una vez al día (3) (5) | |
(1) Levetiracetam solución oral se debe utilizar para administrar dosis por debajo de 250mg.
(2) Se recomienda una dosis de carga de 10,5 mg/kg (0,105 ml/kg) en el primer día de tratamiento con levetiracetam.
(3) Se recomienda una dosis de carga de 15 mg/kg (0,15 ml/kg) en el primer día de tratamiento con levetiracetam
(4) Después de la diálisis se recomienda una dosis suplementaria de 3,5 a 7 mg/kg (0,035 a 0,07 ml/kg).
(5) Después de la diálisis se recomienda una dosis suplementaria de 5 a 10 mg/kg (0,05 a 0,10 ml/kg).
Insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve a moderada. En pacientes con insuficiencia hepática grave, el aclaramiento de creatinina puede subestimar el
grado de insuficiencia renal. Por lo tanto, se recomienda una reducción del 50 % de la dosis de
2
mantenimiento diario cuando el aclaramiento de creatinina es < 60 ml/min/1,73 m .
Población pediátrica
El médico debe prescribir la forma farmacéutica, presentación y concentración más apropiada de acuerdo con el peso y la dosis.
La formulación en granulado recubierto no está adaptada para su administración en lactantes y niños menores de 6 años. Levetiracetam solución oral es la formulación más adecuada para su administración en esta población. Además, las concentraciones de granulados recubiertos en sobres no son apropiadas para el tratamiento inicial en niños que pesen menos de 25 kg o para la administración de dosis por debajo de 250 mg. En estos casos se debe utilizar Levetiracetam solución oral.
Monoterapia
No se ha establecido la seguridad y eficacia de levetiracetam como monoterapia en niños y adolescentes menores de 16 años.
No hay datos disponibles.
Terapia concomitante en lactantes de 6 a 23 meses, niños( de 2 a 11 años) y adolescentes (de 12 a 17 años) con un peso inferior a 50 kg
Levetiracetam solución oral es la formulación más adecuada para su administración en lactantes y niños menores de 6 años.
La dosis terapéutica inicial es de 10 mg/kg dos veces al día. En función de la respuesta clínica y de la tolerabilidad, se puede aumentar la dosis hasta los 30 mg/kg dos veces al día. Los cambios de dosis no deben exceder de aumentos o reducciones de 10 mg/kg dos veces al día cada dos semanas. Se debe utilizar la dosis menor eficaz. La dosis en niños con un peso de 50 kg o superior es la misma que en adultos.
Tabla 3: Dosis recomendada para lactantes desde 6 meses de edad, niños y adolescentes
|
Peso |
Dosis inicial: 10 mg/kg dos veces al día |
Dosis máxima: 30 mg/kg dos veces al día |
|
6 kg (1) |
60 mg (0,6 ml) dos veces al día |
180 mg (1,8 ml) dos veces al día |
|
10 kg (1) |
100 mg (1 ml) dos veces al día |
300 mg (3 ml) dos veces al día |
|
15 kg (1) |
150 mg (1,5 ml) dos veces al día |
450 mg (4,5 ml) dos veces al día |
|
20 kg (1) |
200 mg (2 ml) dos veces al día |
600 mg (6 ml) dos veces al día |
|
25 kg |
250 mg dos veces al día |
750 mg dos veces al día |
|
A partir de 50 kg (2) |
500 mg dos veces al día |
1500 mg dos veces al día |
(1) Niños con un peso de 25 kg o inferior deben preferiblemnte iniciar el tratamiento con Levetiracetam solución oral
(2) La dosis en niños y adolescentes con un peso de 50 kg o superior es la misma que en adultos.
Terapia concomitante en lactantes desde 1 mes a menos de 6 meses de edad La solución oral es la formulación que debe usarse en lactantes.
Forma de administración:
Los gránulos recubiertos se administran por vía oral, tragados con una cantidad suficiente de líquido y pueden administrarse con o sin alimentos. La dosis diaria se divide en dosis iguales repartidas en dos tomas al día.
Los gránulos recubiertos pueden también suspenderse en al menos 10 ml de agua, agitando un mínimo de 2 minutos y ser administrados por alimentación a través de sonda, que debe aclararse dos veces con 10 ml de agua inmediatamente después de la administración. Si se utiliza este método de administración, la suspensión debe prepararse justo antes de su administración.
Cada sobre es para una sola dosis.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a otros derivados de la pirrolidona o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
Supresión del tratamiento
De acuerdo con la práctica clínica actual, si se ha de suprimir la medicación con Asnervon se recomienda retirarlo de forma gradual (p. ej., en adultos y adolescentes que pesen más de 50 kg: reducciones de 500 mg dos veces al día cada dos a cuatro semanas; en lactantes mayores de 6 meses, niños y adolescentes que pesen menos de 50 kg: la reducción de dosis no debe exceder de los 10 mg/kg dos veces al día, cada dos semanas; en lactantes (menores de 6 meses): las reducciones de dosis no deberían exceder de los 7 mg/kg dos veces al día cada dos semanas)
Insuficiencia renal
La administración de Asnervon a pacientes con insuficiencia renal puede requerir el ajuste de la dosis. En pacientes con insuficiencia hepática grave se recomienda valorar la función renal antes de la selección de la dosis (ver la sección 4.2).
Suicidio
Se han notificado casos de suicidio, intento de suicidio y pensamientos y comportamientos suicidas en pacientes tratados con fármacos antiepilépticos (incluyendo levetiracetam). Un metanálisis de ensayos controlados con placebo, aleatorizados, con medicamentos antiepilépticos ha mostrado un pequeño aumento del riesgo de pensamientos y comportamientos suicidas. Se desconoce el mecanismo de este riesgo.
Por tanto, los pacientes deben ser monitorizados para detectar signos de depresión y/o pensamientos y comportamientos suicidas y debe considerarse el tratamiento adecuado. Se debe aconsejar a los pacientes (y a sus cuidadores) que consulten con su médico si aparecen signos de depresión y/o pensamientos suicidas.
Población pediátrica
La formulación en granulado recubierto no está adaptada para su adminsitarción en lactantes y en niños menores de 6 años.
Los datos disponibles en niños no sugieren ningún efecto en el crecimiento ni en la pubertad.
No obstante, siguen sin conocerse los efectos a largo plazo sobre el aprendizaje, inteligencia, crecimiento, función endocrina, pubertad y fertilidad en niños.
La seguridad y eficacia de levetiracetam no han sido evaluadas en profundidad en lactantes con epilepsia menores de 1 año. Sólo 35 lactantes menores de 1 año con crisis de inicio parcial estuvieron expuestos en los ensayos clínicos, de los cuales sólo 13 eran < 6 meses.
4.5 Interacción con otros medicamentos y otras formas de interacción
Medicamentos antiepilépticos
Los datos de los estudios clínicos, realizados en adultos antes de la comercialización, indican que levetiracetam no influye en las concentraciones séricas de los medicamentos antiepilépticos conocidos (fenitoína, carbamazepina, ácido valproico, fenobarbital, lamotrigina, gabapentina y primidona) y que estos medicamentos antiepilépticos no influyen en la farmacocinética de levetiracetam.
Como en adultos, no hay una evidencia clara de interacciones farmacológicas clínicamente significativas en pacientes pediátricos que hayan tomado hasta 60 mg/kg/día de levetiracetam. Una evaluación retrospectiva de las interacciones farmacocinéticas en niños y adolescentes con epilepsia (de 4 a 17 años) confirmó que la terapia coadyuvante con levetiracetam administrado por vía oral, no tuvo influencia en las concentraciones séricas en estado de equilibrio de carbamazepina y valproato administrados concomitantemente. Sin embargo los datos sugieren un 20% de incremento del aclaramiento de levetiracetam en niños que toman medicamentos antiepilépticos que sean inductores enzimáticos. No es necesario ajuste de dosis.
Probenecid
Se ha comprobado que probenecid (500 mg cuatro veces al día), un agente bloqueante de la secreción tubular renal, inhibe el aclaramiento renal del metabolito primario pero no el de levetiracetam. De cualquier modo, los niveles de este metabolito se mantienen bajos. Es de esperar que otros fármacos que se excretan por secreción tubular activa puedan reducir también el aclaramiento renal del metabolito. No se ha estudiado el efecto del levetiracetam sobre el probenecid y no se conoce el efecto de levetiracetam sobre otros fármacos secretados activamente, p. ej. AINES, sulfonamidas y metotrexato.
Anticonceptivos orales y otras interacciones farmacocinéticas
Dosis diarias de 1.000 mg de levetiracetam no influenciaron la farmacocinética de los anticonceptivos orales (etinilestradiol y levonorgestrel); no se modificaron los parámetros endocrinos (hormona luteinizante y progesterona). Dosis diarias de 2.000 mg de levetiracetam no influenciaron la farmacocinética de digoxina y de warfarina; no se modificó el tiempo de protrombina. La coadministración con digoxina, anticonceptivos orales y warfarina no tuvo influencia sobre la farmacocinética del levetiracetam.
Antiácidos
No se dispone de datos sobre la influencia de los antiácidos sobre la absorción del levetiracetam. Alimentos y alcohol
El grado de absorción del levetiracetam no se alteró por los alimentos, aunque la velocidad de absorción se redujo ligeramente. No se dispone de datos sobre la interacción del levetiracetam con alcohol.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de levetiracetam en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos.
Asnervon no se recomienda durante el embarazo ni en mujeres en edad fértil que no utilicen métodos anticonceptivos efectivos, a menos que sea estrictamente necesario. Al igual que con otros medicamentos antiepilépticos, los cambios fisiológicos durante el embarazo pueden afectar a las concentraciones de levetiracetam. Se ha observado la disminución de las concentraciones plasmáticas de levetiracetam durante el embarazo. Esta disminución es más pronunciada durante el tercer trimestre (hasta el 60 % de la concentración inicial antes del embarazo). Debe asegurarse un control clínico adecuado de la mujer embarazada tratada con levetiracetam. La retirada de los tratamientos antiepilépticos puede dar lugar a una exacerbación de la enfermedad, que podría perjudicar a la madre y al feto.
Lactancia
Levetiracetam se excreta en la leche materna humana. Por ello, no se recomienda la lactancia natural. Sin embargo, si durante el periodo de lactancia es necesario el tratamiento con levetiracetam, debe considerarse la relación beneficio/riesgo del tratamiento teniéndose en cuenta la importancia de la lactancia natural.
Fertilidad
En los estudios en animales no se detectó impacto sobre la fertilidad (ver sección 5.3). No hay datos clínicos disponibles, se desconoce el posible riesgo en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Debido a las posibles diferencias de sensibilidad individual algunos pacientes pueden experimentar somnolencia u otros síntomas relacionados con el sistema nervioso central, especialmente al inicio del tratamiento o después de un incremento de la dosis. Por tanto, se recomienda precaución a los pacientes cuando realicen tareas que requieran habilidad específica, p. ej. conducir vehículos o utilizar maquinaria. Se aconseja a los pacientes no conducir o utilizar maquinaria hasta que se compruebe que su capacidad para realizar estas actividades no queda afectada.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil de acontecimientos adversos que se muestra más abajo se basa en el análisis del conjunto de los ensayos clínicos controlados con placebo en todas las indicaciones estudiadas, con un total de 3.416 pacientes tratados con levetiracetam. Estos datos se complementan con el uso de levetiracetam en los correspondientes ensayos de extensión abierta, así como con la experiencia post-comercialización. Las reacciones adversas notificadas más frecuentemente fueron nasofaringitis, somnolencia, cefalea, fatiga y mareo. El perfil de seguridad de levetiracetam es, en general, similar en todos los grupos de edad (adultos y pacientes pediátricos) y en todas las indicaciones aprobadas en epilepsia.
Lista tabulada de reacciones adversas
A continuación se incluye una tabla de las reacciones adversas observadas en los ensayos clínicos (en adultos, adolescentes, niños y lactantes > 1 mes) y en la experiencia postcomercialización de acuerdo al sistema de clasificación de órganos y por frecuencia. La frecuencia se define de la siguiente manera : muy frecuentes (>1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000).
|
Clasificación de órganos del sistema MedDRA |
Frecuencia | |||
|
Muy frecuente |
Frecuentes |
Poco frecuentes |
Raras | |
|
Infecciones e infestaciones |
Nasofaringitis |
Infección | ||
|
Trastornos de la Sanare y del sistema linfático |
Trombocitopenia, leucopenia(1) |
Pancitopenia(1,2), neutropenia(1) | ||
|
Trastornos del Metabolismo v de la nutrición |
Anorexia |
Pérdida de peso(1), aumento de peso |
Hiponatremia | |
|
Trastornos nsiauiátricos |
Depresión, hostilidad/agresividad, ansiedad(1), insomnio, nerviosismo/irritabilidad |
Intento de suicidio(1), ideación suicida(1), alteraciones psicóticas(1), comportamiento anormal(1), alucinaciones |
Suicidio completado1-1-1, trastornos de la personalidad, pensamiento | |
|
ÜT cólera(1), estado confusional(1), inestabilidad emocional/cambios de humor, agitación |
anormal | |||
|
Trastornos del sistema nervioso |
Somnolencia, cefalea |
Convulsión, trastorno del equilibrio, mareo, letargo, temblor |
Amnesia, deterioro de la memoria, coordinación anormal/ataxia, parestesia(1), alteración de la atención |
Coreoatetosis(1), discinesia(1), hipercinesia |
|
Trastornos oculares |
Diplopía, visión borrosa | |||
|
Trastornos del oído y del laberinto |
Vértigo | |||
|
Trastornos respiaratorios, Torácicos y mediastínicos |
Tos | |||
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea, dispepsia, vómitos, náuseas |
Pancreatitis-1- | ||
|
Trastornos hepatobiliares |
Pruebas anormales de la función hepática(1) |
Fallo hepático-1-, hepatitis-1- | ||
|
Trastornos de la piel y del tejido subcutáneo |
Rash |
Alopecia1-1-1, eczema, prurito |
Necrolisis epidérmica tóxica-1-, síndrome de Stevens-Johnson(1), eritema multiforme-1- | |
|
Trastornos musculoesquelético s y del tejido conjuntivo |
Debilidad muscular, mialgia | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia/fatiga | |||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Lesión |
(1) Reacciones adversas añadidas durante la experiencia post-comercialización.
(2) En alguno de los casos se identificó supresión de la médula ósea.
Descripción de algunas reacciones adversas seleccionadas
El riesgo de anorexia es mayor cuando topiramato se administra junto con levetiracetam. En varios casos de alopecia, se observó una recuperación al suspender el tratamiento con levetiracetam.
Población pediátrica
En pacientes de 1 mes a menos de 4 años de edad, un total de 190 pacientes han sido tratados con levetiracetam en los ensayos de extensión abierta y controlados con placebo. Sesenta (60) de estos pacientes fueron tratados con levetiracetam en los ensayos controlados con placebo. En pacientes de 4-16 años de edad, un total de 645 pacientes han sido tratados con levetiracetam en los ensayos controlados con placebo y de extensión abierta. 233 de estos pacientes fueron tratados con levetiracetam en los ensayos controlados con placebo. En ambos rangos de edad pediátricos, estos datos se complementan con la experiencia post-comercialización del uso de levetiracetam.
El perfil del uso de levetiracetam es, en general, similar en todos los grupos de edad y en todas las indicaciones aprobadas en epilepsia. Los resultados de seguridad en los ensayos clínicos controlados con placebo en pacientes pediátricos coincidieron con el perfil de seguridad de levetiracetam en adultos excepto por las reacciones adversas psiquiátricas y de comportamiento, las cuales fueron más frecuentes en niños que en adultos. En niños y adolescentes de 4 a 16 años de edad, vómitos (muy frecuente, 11,2%), agitación (frecuente, 3,4 %), cambios de humor (frecuente, 2,1%), inestabilidad emocional (frecuente, 1,7%), agresividad (frecuente, 8,2%), comportamiento anormal (frecuente, 5,6%) y letargo (frecuente, 3,9%) fueron notificados más frecuentemente que en otros rangos de edad o que en el perfil de seguridad global. En lactantes y niños de 1 mes a menos de 4 años de edad, irritabilidad (muy frecuente, 11,7%) y coordinación anormal (frecuente, 3,3%) fueron notificados más frecuentemente que en otros grupos de edad o que en el perfil de seguridad global.
Un estudio de seguridad pediátrica doble ciego controlado con placebo con diseño de no-inferioridad ha evaluado los efectos cognitivos y neuropsicológicos de levetiracetam en niños de 4 a 16 años de edad con crisis de inicio parcial. Se concluyó que levetiracetam no era diferente (no era inferior) a placebo con respecto al cambio en la puntuación de base en la escala “Leiter-R Attention and Memory, Memory Screen Composite” en la población por protocolo. Los resultados relacionados con la función emocional y el comportamiento, medidos de forma estandarizada y sistemática usando un instrumento validado (cuestionario CBCL de Achenbach), indicaron un empeoramiento del comportamiento agresivo en los pacientes tratados con levetiracetam. Sin embargo los sujetos que tomaron levetiracetam en el ensayo de seguimiento a largo plazo abierto no experimentaron un empeoramiento, en promedio, en su comportamiento y función emocional; en concreto, las medidas del comportamiento agresivo no empeoraron con respecto al inicio.
4.9 Sobredosis
Síntomas
Se ha observado somnolencia, agitación, agresión, nivel de consciencia disminuido, depresión respiratoria y coma con sobredosis de levetiracetam.
Tratamiento de la sobredosificación
En la sobredosis aguda puede vaciarse el contenido del estómago por lavado gástrico o por inducción de la emesis. No hay un antídoto específico para levetiracetam. El tratamiento de la sobredosificación será sintomático y puede incluir hemodiálisis. La eficacia de la eliminación por diálisis es del 60 % para el levetiracetam y del 74 % para el metabolito primario.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antiepilépticos, otros antiepilépticos, código ATC: N03AX14.
El principio activo, levetiracetam, es un derivado de la pirrolidona (S-enantiómero de a-etil-2-oxo-1pirrolidina acetamida), no relacionado químicamente con otros principios activos antiepilépticos existentes.
Mecanismo de acción
El mecanismo de acción de levetiracetam está todavía por dilucidar completamente, pero parece ser diferente de los mecanismos de acción de los antiepilépticos actuales. Los estudios in vivo e in vitro sugieren que levetiracetam no altera las características básicas de la célula y la neurotransmisión normal. Estudios in vitro muestran que levetiracetam afecta los niveles intraneuronales de Ca2+ mediante inhibición parcial de las corrientes de Ca2+ tipo N, y reduciendo la liberación de Ca2+ de la reserva intraneuronal. Además, invierte parcialmente la reducción de corrientes dependientes de GABA y glicina inducidas por zinc y B-carbolinas. Por otra parte, estudios in vitro muestran que levetiracetam se une a un punto específico en el tejido cerebral de roedor. Este punto de unión específico es la proteína 2A de las vesículas sinápticas, el cual parece estar involucrado en la fusión de vesículas y en la exocitosis de neurotransmisores. Levetiracetam y sus análogos han mostrado un orden de afinidad por la unión a la proteína 2A de las vesículas sinápticas que se correlaciona con la potencia de la protección contra los ataques epilépticos en el modelo audiogénico de epilepsia en ratón. Este hallazgo sugiere que la interacción entre levetiracetam y la proteína 2A de las vesículas sinápticas parece contribuir al mecanismo de acción del fármaco como antiepiléptico.
Efectos farmacodinámicos
Levetiracetam induce una protección de la crisis en un amplio rango de modelos animales de crisis generalizadas parciales y primarias sin tener efecto pro-convulsivo. El metabolito primario es inactivo. En el hombre, la actividad en ambas condiciones de epilepsia, parcial y generalizada (descarga epileptiforme/respuesta fotoparoxismal), ha confirmado el amplio espectro del perfil farmacológico de levetiracetam.
Eficacia y seguridad clínica
Terapia concomitante en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en adultos, adolescentes, niños y lactantes desde 1 mes de edad, con epilepsia.
En adultos, la eficacia de levetiracetam ha sido demostrada en 3 ensayos doble ciego, controlados con placebo a dosis de 1.000 mg, 2.000 mg ó 3.000 mg/día, administrados en dos dosis separadas, con una duración de tratamiento de hasta 18 semanas. En un análisis agrupado, el porcentaje de pacientes que alcanzó una reducción de al menos el 50 %, desde el inicio, en la frecuencia de crisis de inicio parcial por semana, a dosis estable (12/14 semanas), fue del 27,7 %, 31,6 % y 41,3 % para los pacientes en tratamiento con 1.000, 2.000 ó 3.000 mg de levetiracetam respectivamente y del 12,6 % para los pacientes tratados con placebo.
Población pediátrica
En pacientes pediátricos (de 4 a 16 años), la eficacia de levetiracetam se demostró en un ensayo doble-ciego, controlado con placebo, en el que se incluyeron 198 pacientes y con una duración
de tratamiento de 14 semanas. En este ensayo, los pacientes recibieron levetiracetam a una dosis fija de 60 mg/kg/día (administrada dos veces al día). El 44,6 % de los pacientes tratados con levetiracetam y el 19,6 % de los pacientes tratados con placebo tuvieron una reducción de al menos el 50 % desde el inicio, en la frecuencia de crisis de inicio parcial por semana. Con un tratamiento continuado a largo plazo, el 11,4 % de los pacientes estuvieron libres de crisis durante al menos 6 meses y el 7,2 % estuvieron libres de crisis durante al menos 1 año.
La eficacia de levetiracetam en pacientes pediátricos (de 1 mes a menos de 4 años de edad) se estableció en un ensayo doble ciego, controlado con placebo que incluyó 116 pacientes y tuvo una duración del tratamiento de 5 días. En este ensayo a los pacientes se les prescribieron dosis diarias de solución oral de 20 mg/kg, 25 mg/kg, 40 mg/kg ó 50 mg/kg según el programa de ajuste de dosis por edad. En este ensayo se utilizaron dosis de 20 mg/kg/día a 40 mg/kg/día para lactantes de 1 mes a menos de 6 meses de edad y dosis ajustadas de 25 mg/kg/día a 50 mg/kg/día para lactantes de 6 meses a niños menos de 4 años de edad. La dosis diaria total se administró en dos veces al día.
La medida principal de la efectividad fue la tasa de respondedores (porcentaje de pacientes con una reducción > 50 % en promedio de la frecuencia de las crisis de inicio parcial diarias desde el inicio) evaluada por medio de un lector central ciego utilizando un video electroencefalograma EEG durante 48 horas. El análisis de la eficacia consistió en 109 pacientes que tuvieron al menos 24 horas de video EEG tanto al inicio como en periodos de evaluación. El 43,6 % de los pacientes tratados con levetiracetam y el 19,6 % de los pacientes con placebo se consideraron como respondedores. Los resultados coincidieron a través de los grupos de edad. Con tratamiento continuado a largo plazo, el 8,6 % de los pacientes estuvieron libres de crisis durante al menos 6 meses y el 7,8 % estuvieron libres de crisis durante al menos 1 año.
Monoterapia en el tratamiento de las crisis de inicio parcial con o sin generalización secundaria en pacientes a partir de 16 años con epilepsia de nuevo diagnóstico.
La eficacia de levetiracetam en monoterapia se demostró en un ensayo doble-ciego, de grupos paralelos, de no inferioridad frente a carbamazepina de liberación controlada en 576 pacientes a partir de los 16 años con epilepsia de nuevo o reciente diagnóstico. Los pacientes tenían que presentar crisis parciales no provocadas o únicamente crisis tónico-clónicas generalizadas. Los pacientes fueron aleatorizados a carbamazepina de liberación controlada de 400 - 1.200 mg/día o a levetiracetam de 1.000 - 3.000 mg/día, y la duración del tratamiento fue de hasta 121 semanas en función de la respuesta.
El 73,0 % de los pacientes tratados con levetiracetam y el 72,8 % de los pacientes tratados con carbamazepina de liberación controlada alcanzaron un periodo de 6 meses libres de crisis; la diferencia absoluta ajustada entre los tratamientos fue de 0,2 % (95 % IC: -7,8 8,2). Más de la mitad de los pacientes permanecieron libres de crisis durante 12 meses (56,6 % y 58,5 % de los sujetos con levetiracetam y con carbamazepina de liberación controlada respectivamente).
En un estudio que refleja la práctica clínica, se pudo retirar la medicación antiepiléptica concomitante en un número limitado de pacientes que habían respondido a la terapia concomitante con levetiracetam (36 de 69 pacientes adultos).
Terapia concomitante en el tratamiento de las crisis mioclónicas en adultos y en adolescentes a partir de 12 años, con Epilepsia Mioclónica Juvenil.
La eficacia de levetiracetam se demostró en un ensayo doble-ciego, controlado con placebo de 16 semanas de duración, en pacientes a partir de los 12 años que sufrían epilepsia generalizada idiopática con crisis mioclónicas en diferentes síndromes. La mayoría de los pacientes presentaban epilepsia mioclónica juvenil.
En este estudio, la dosis de levetiracetam fue de 3.000 mg/día repartida en dos dosis. El 58,3 % de los pacientes tratados con levetiracetam y el 23,3 % de los pacientes tratados con placebo, tuvieron una reducción de al menos el 50 % de días con crisis mioclónicas por semana. Con un tratamiento continuado a largo plazo, el 28,6 % de los pacientes estuvieron libres de crisis mioclónicas durante al menos 6 meses y el 21,0 % estuvieron libres de crisis mioclónicas durante al menos 1 año.
Terapia concomitante en el tratamiento de las crisis tónico-clónicas generalizadas primarias en adultos y adolescentes a partir de 12 años, con Epilepsia Generalizada Idiopática.
La eficacia de levetiracetam se demostró en un ensayo doble-ciego de 24 semanas, controlado con placebo en el que se incluyeron adultos, adolescentes y un número limitado de niños con Epilepsia Generalizada Idiopática con crisis tónico-clónicas generalizadas primarias en diferentes síndromes (epilepsia mioclónica juvenil, ausencia juvenil, ausencia infantil o epilepsia con crisis de Gran Mal al despertar). En este estudio, la dosis de levetiracetam fue de 3.000 mg/día para adultos y adolescentes o de 60 mg/kg/día para niños, administrados en dos dosis separadas. El 72,2 % de los pacientes tratados con levetiracetam y el 45,2 % de los pacientes tratados con placebo tuvieron una reducción de al menos el 50 % en la frecuencia de crisis tónico-clónicas generalizas primarias por semana. Con un tratamiento continuado a largo plazo, el 47,4 % de los pacientes estuvieron libres de crisis tónico-clónicas durante a menos 6 meses y el 31,5 % estuvieron libres de crisis tónico-clónicas durante al menos 1 año.
5.2 Propiedades farmacocinéticas
Levetiracetam es un compuesto muy soluble y permeable. Levetiracetam se absorbe rápidamente después de su administración oral con una biodisponibilidad casi absoluta.
La farmacocinética y bioequivalencia de Asnervon 1000 mg granulado recubierto en sobre y Asnervon 1500 mg granulado recubierto en sobre se investigaron en dos estudios en voluntarios sanos. En un primer estudio, Asnervon 1000 mg granulado recubierto en sobre se comparó con comprimidos recubiertos de referencia con 1000 mg de levetiracetam. En un segundo estudio,
Asnervon 1500 mg granulado recubierto en sobre se comparó con dos comprimidos recubiertos de referencia con 750 mg de levetiracetam. Ambos estudios se llevaron a cabo en 16 voluntarios sanos (cada vez 8 mujeres y 8 hombres), según un ensayo cruzado y abierto controlado con asignación de secuencias aleatoria. Cada individuo fue estudiado dos veces con una periodo de descanso de al menos una semana. En base a la farmacocinética de levetiracetam en plasma después de la administración oral de Asnervon 1000 mg granulado recubierto en sobres y Asnervon 1500 mg granulado recubierto en sobres, se evidenció que Asnervon granulado recubierto en sobres era bioequivalente a los comprimidos recubiertos de referencia (Tabla 4).
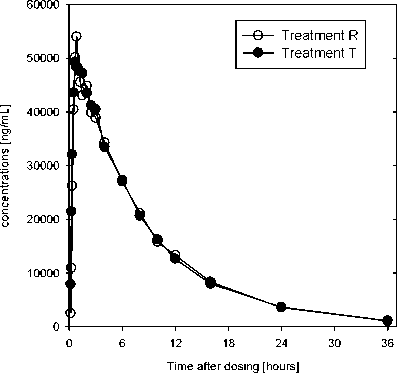
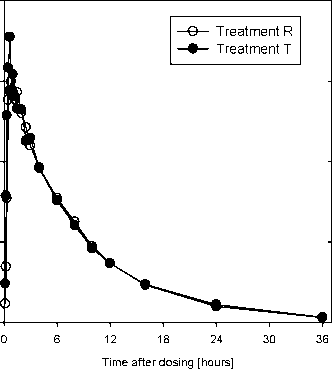
Las curvas de tiempo de las concentraciones plasmáticas fueron casi superponibles (Figura 1).
Asnervon 1000 mg granulado recubierto en sobres fue bioequivalente a los comprimidos recubiertos de referencia en cuanto a la exposición máxima (Cmax) y a la exposición total (AUC) de levetiracetam: para los intervalos de confianza del 90% los ratios entre el ensayo y la referencia fueron de 90 a 113% y de 97 a 106% respectivamente. Asnervon 1500 mg granulado recubierto en sobres fue bioequivalente a los comprimidos recubiertos de referencia en cuanto a la exposición máxima (Cmax) y a la exposición total (AUC) de levetiracetam: para los intervalos de confianza del 90% los ratios entre el ensayo y la referencia fueron de 89 a 103% y de 97 a 104% respectivamente. No hubo diferencias significativas en cuanto al tiempo en alcanzar la Cmax (tmax) y la vida mediad).
Tabla 4: Valores medios de la farmacocinética de Levetiracetam después de administraciones únicas por vía oral de 1000 mg y 1500 mg de Juste Levetiracetam granulado recubierto en sobres y los comprimidos recubiertos de referencia
|
Dosis únicas de Levetiracteam 1000 mg |
Dosis únicas de Levetiracteam 1500 mg | ||||
|
Asnervon granulado recubierto en sobre |
Comprimidos recubiertos de referencia |
Asnervon granulado recubierto en sobres |
Comprimidos recubiertos de referencia | ||
|
C max |
pg/mL |
42,0 |
41,7 |
64,6 |
67,3 |
|
tmax |
min |
35 |
40 |
35 |
35 |
|
AUC(0-tz) |
pg.h/mL |
264,7 |
262,2 |
450,6 |
448,4 |
|
AUC(0-<x>) |
pg.h/mL |
271,7 |
268,4 |
461,4 |
458,8 |
|
t/ |
h |
6,90 |
6,58 |
6,65 |
6,61 |
Leyenda: media geométrica Cmax, AUC(0-tz), y AUC(ü-ro), media aritmética de t1X y mediana de tmax para administración oral única de 1000 (primer estudio) y 1500 mg de Levetiracetam (segundo estudio) suministrados como Juste Levetiracetam granulado recubierto en sobres y los comprimidos recubiertos de referencia
Figura 1: Curvas de tiempo de las medias geométricas de concentraciones plasmáticas de Levetiracetam después de una administración oral única de 1000 mg y 1500 mg de Asnervon granulado recubierto en sobres y los comprimidos recubiertos de referencia
T ime course of the geometric mean concentrations T ime course of the geometric mean concentrations
30000
20000
10000
0
40000
Leyenda: curvas de tiempo de la media geométrica de las concentraciones plasmáticas de Levetiracetam después de una administración oral única de dosis de 1000 (primer estudio: cuadro izquierdo) y 1500 mg Levetiracetam (segundo estudio: cuadro derecho) suministrados como Asnervon granulado recubierto en sobres (•) y los comprimidos recubiertos de referencia (O).
El perfil farmacocinético es lineal y con poca variabilidad intra- e inter-individual. No hay modificación del aclaramiento después de la administración repetida. No hay evidencia de variabilidad relevante de género, raza o circadiana. El perfil farmacocinético en voluntarios sanos y en pacientes con epilepsia es comparable.
Debido a que su absorción es completa y lineal, se pueden predecir los niveles plasmáticos, expresados como mg/kg de peso corporal, tras la administración oral de levetiracetam. Por
,<Tfo.
ztSu
ÍTTI
consiguiente, no se necesita monitorizar los niveles plasmáticos de levetiracetam.
En adultos y niños se ha mostrado una correlación significativa entre las concentraciones en saliva y en plasma (tasa de concentraciones saliva/plasma desde 1 a 1,7 para la formulación oral en comprimidos y para la formulación en solución oral 4 horas después de la dosis).
Adultos y adolescentes
Absorción
Levetiracetam se absorbe rápidamente después de su administración oral. La biodisponibilidad absoluta por vía oral es cercana al 100%. El pico de nivel plasmático (Cmax) se alcanza a las
1,3 horas de su administración. Los niveles plasmáticos estables se obtienen a los dos días con la pauta de administración de dos veces al día. Los valores normales del pico plasmático (Cmax) después de una dosis simple de 1.000 mg y de una dosis repetida de 1.000 mg dos veces al día son del 31 y 43 pg/ml respectivamente. El grado de absorción es dosis-independiente y no está alterado por los alimentos.
Distribución
No se dispone de datos de distribución tisular en humanos.
Ni levetiracetam ni su metabolito primario se unen de forma significativa a las proteínas plasmáticas (< 10 %).
El volumen de distribución del levetiracetam es aproximadamente de 0,5 a 0,7 l/kg, valor cercano al volumen total de agua corporal.
Biotransformación
Levetiracetam no se metaboliza extensamente en humanos. La vía metabólica principal (24 % de la dosis) es la hidrólisis enzimática del grupo acetamida. La formación del metabolito primario, ucb L057, no está soportada por las isoformas del citocromo P450 hepático. La hidrólisis del grupo acetamida fue medible en un gran número de tejidos, incluyendo las células sanguíneas. El metabolito ucb L057 es farmacológicamente inactivo.
Se identificaron también dos metabolitos minoritarios. Uno estaba formado por la hidroxilación del anillo de la pirrolidona (1,6 % de la dosis) y el otro por la apertura del anillo de la pirrolidona (0,9 % de la dosis). Otros compuestos no identificados representaban solamente el 0,6 % de la dosis.
No se evidenció interconversión enantiomérica in vivo para levetiracetam o para su metabolito primario.
Los estudios in vitro han mostrado que levetiracetam y su metabolito principal no inhiben las isoformas principales del citocromo P450 hepático humano (CYP3A4, 2A6, 2C9, 2C19, 2D6,
2E1 y 1A2), la glucuronil transferasa (UGT1A1 y UGT1A6) y la actividad de la epóxido hidroxilasa. Además, levetiracetam no afecta la glucuronidación in vitro del ácido valproico.
En cultivos de hepatocitos humanos, levetiracetam tuvo poco o ningún efecto sobre el CYP1A2, SULT1E1 o UGT1A1. Levetiracetam provocó una leve inducción del CYP2B6 y del CYP3A4. Los datos de interacciones in vitro e in vivo con anticonceptivos orales, digoxina y warfarina indican que no se espera que exista una inducción enzimática significativa in vivo.
Por consiguiente, la interacción de levetiracetam con otras sustancias, o viceversa, es poco probable.
Eliminación
La vida media plasmática en adultos fue de 7± 1 horas y no varió con la dosis, con la vía de administración o con la administración repetida. El aclaramiento corporal total medio fue de 0,96 ml/min/kg.
La ruta mayoritaria de excreción fue por vía urinaria, alcanzando una media del 95 % de la dosis (aproximadamente un 93 % de la dosis se excretaba dentro de las primeras 48 horas). La excreción por vía fecal representaba solamente el 0,3 % de la dosis.
La excreción urinaria acumulada de levetiracetam y de su metabolito primario durante las primeras 48 horas alcanzó, respectivamente, el 66 % y el 24 % de la dosis. El aclaramiento renal de levetiracetam y de ucb L057 es de 0,6 y de 4,2 ml/min/kg respectivamente, lo que indica que levetiracetam se excreta por filtración glomerular con subsiguiente reabsorción tubular y que el metabolito primario se excreta también por secreción tubular activa en adición a la filtración glomerular. La eliminación de levetiracetam está correlacionada con el aclaramiento de creatinina.
Pacientes de edad avanzada
En la vejez, la vida media se incrementa alrededor de un 40 % (10 a 11 horas). Esto está relacionado con la disminución de la función renal en esta población (ver sección 4.2).
Insuficiencia renal
El aclaramiento corporal aparente está correlacionado con el aclaramiento de creatinina, tanto para levetiracetam como para su metabolito primario. Así, en pacientes con insuficiencia renal moderada o grave se recomienda ajustar la dosis diaria de mantenimiento de levetiracetam en base al aclaramiento de creatinina (ver sección 4.2).
En sujetos adultos con patología renal terminal anúrica la vida media fue aproximadamente de 25 y de 3,1 horas durante los períodos interdiálisis e intradiálisis respectivamente.
La fracción de levetiracetam eliminada durante una sesión de diálisis normal de 4 horas fue de un 51 %.
Insuficiencia hepática
En sujetos con insuficiencia hepática leve o moderada no hubo modificación relevante del aclaramiento de levetiracetam. En la mayoría de los sujetos con insuficiencia hepática grave el aclaramiento de levetiracetam se redujo en más del 50 % como consecuencia de la insuficiencia renal concomitante (ver sección 4.2).
Población pediátrica
Niños (de 4 a 12 años)
Después de la administración de una dosis oral única (20 mg/kg) a niños epilépticos (de 6 a 12 años), la vida media de levetiracetam fue de 6,0 horas. El aclaramiento corporal aparente ajustado al peso fue alrededor de un 30 % más alto que en los adultos epilépticos.
Tras la administración de dosis orales repetidas (de 20 a 60 mg/kg/día) a niños epilépticos (de 4 a 12 años), levetiracetam se absorbió rápidamente. El pico de concentración plasmática se observó entre 0,5 y 1,0 horas después de la administración. Se observaron incrementos lineales
,<Tfo.
ztSu
ÍTTI
y proporcionales a la dosis para los picos de concentraciones plasmáticas y el área bajo la curva.
La vida media de eliminación fue aproximadamente de 5 horas. El aclaramiento corporal aparente fue de 1,1 ml/min/kg.
Lactantes y niños (de 1 mes a 4 años)
Tras la administración de dosis únicas (20 mg/kg) de solución oral 100 mg/ml a niños epilépticos (de 1 mes a 4 años), levetiracetam fue rápidamente absorbido y los picos de concentraciones plasmáticas se observaron aproximadamente 1 hora tras la administración. Los resultados farmacocinéticos indicaron que la vida media era inferior (5,3 horas) que para adultos (7,2 horas) y el aclaramiento aparente era más rápido (1,5 ml/min/kg) que para adultos (0,96 ml/min/kg).
En el análisis farmacocinético poblacional realizado en pacientes desde 1 mes a 16 años de edad, el peso corporal estuvo significativamente relacionado con el aclaramiento aparente (aumento en el aclaramiento con aumento del peso corporal) y con el volumen de distribución aparente. La edad también tuvo influencia sobre ambos parámetros. Este efecto fue pronunciado para los lactantes más pequeños y decreció al ir aumentando la edad hasta hacerse insignificante alrededor de los 4 años de edad.
En ambos análisis farmacocinéticos poblacionales hubo alrededor de un 20 % de aumento en el aclaramiento aparente de levetiracetam cuando se administró conjuntamente con un medicamento antiepiléptico inductor-enzimático.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, genotoxicidad y potencial carcinogénico.
Los efectos adversos no observados en los estudios clínicos, pero vistos en la rata y en menor grado en el ratón a niveles de exposición similares a los niveles de exposición humanos y con posible repercusión en el uso clínico, fueron modificaciones hepáticas que indican una respuesta adaptativa con incremento de peso e hipertrofia centrolobular, infiltración de grasa e incremento de las enzimas hepáticas en plasma. No se observó ningún efecto adverso sobre el rendimiento reproductivo o la fertilidad en ratas macho o hembra a dosis de hasta 1.800 mg/kg/día (6 veces la dosis diaria máxima recomendada en humanos en base a los mg/m2 o a la exposición) en los padres y en la generación F1.
Se realizaron dos estudios de desarrollo embriofetal (EFD) en ratas a 400, 1200 y 3600 mg/kg/día. A 3600 mg/kg/día, sólo en uno de los dos estudios EFD hubo una ligera disminución en el peso fetal asociada con un aumento mínimo de variaciones en el esqueleto/anomalías menores. No hubo efecto sobre la embriomortalidad y no aumentó la incidencia de malformaciones. El NOAEL (nivel sin efecto adverso observable) fue 3600 mg/kg/día para ratas hembra preñadas (12 veces la dosis diaria máxima recomendada en humanos (MRHD) en base a los mg/m2) y 1200 mg/kg/día para los fetos.
Se realizaron cuatro estudios de desarrollo embriofetal en conejos cubriendo dosis de 200, 600,
800, 1200 y 1800 mg/kg/día. El nivel de dosis de 1800 mg/kg/día indujo una marcada toxicidad materna y un descenso del peso fetal asociado con un aumento en la incidencia de fetos con anomalias cardiovasculares/esqueléticas. El NOAEL fue <200 mg/kg/día para las madres y 200 mg/kg/día para los fetos (igual a la MRHD en base a los mg/m2).
Se realizó un estudio de desarrollo peri- y post-natal en ratas con dosis de levetiracetam de 70, 350 y 1800 mg/kg /día. El NOAEL fue > 1800 mg/kg/día para las hembras F0 y para la
,<Tfo.
ÍTTI
supervivencia, crecimiento y desarrollo de las crías F1 hasta el destete (6 veces la MRHD en base a los mg/m2).
Estudios en ratas y perros neonatos y jóvenes demostraron que no había efectos adversos en ninguno de los parámetros estándar de desarrollo o maduración a dosis hasta 1800 mg/kg/día (6-17 veces la MRHD en base a los mg/m2).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Povidona K30 Celulosa microcristalina Sílice coloidal anhidra Estearato de magnesio Alcohol polivinílico Dióxido de titanio (E 171)
Macrogol 3350 Talco
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Sobres de Papel/Alu/PE
Asnervon 250 mg granulado recubierto en sobre EFG Envases de 20, 30, 50, 60, 200 sobres Asnervon 500 mg granulado recubierto en sobre EFG Envases de 20, 30, 50, 60, 100, 200 sobres Asnervon 750 mg granulado recubierto en sobre EFG Envases de 20, 60, 200 sobres
Asnervon 1000 mg granulado recubierto en sobre EFG Envases de 20, 30, 50, 60, 100, 200 sobres
Puede que solamente estén comercializados algunos tamaños de envases
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7.
Ceninter, S.A.
Avda. de San Pablo 27 28823 Coslada (Madrid)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Septiembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
Diciembre 2013
19