Artiss Soluciones Para Adhesivo Tisular, Ultracongeladas
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
ARTISS Soluciones para adhesivo tisular Ultracongeladas
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Componente 1: Solución de proteína sellante
Fibrinógeno humano (como proteína coagulable) 91 mg1/ml
Aprotinina (sintética) 3000 UIC2/ml
Componente 2: Solución de trombina
Trombina humana 4 UI3/ml
Cloruro de calcio 40 mmol/ml
1 jeringa precargada de doble cámara que contiene <1 ml><2 ml><5 ml> de solución ultracongelada de
proteína sellante (con aprotinina) en una cámara y <1 ml><2 ml><5 ml> de solución ultracongelada de
trombina (con cloruro de calcio) en la otra cámara, que da lugar a <2 ml><4 ml><10 ml> de volumen total de producto listo para utilizarse.
|
Después de la mezcla |
1 ml |
2 ml |
4 ml |
10 ml |
|
Componente 1: Solución de proteína sellante Fibrinógeno humano |
45,5 mg |
91 mg |
182 mg |
455 mg |
|
(como proteína coagulable) Aprotinina (sintética) |
1.500 UIC |
3.000 UIC |
6.000 UIC |
15.000 UIC |
|
Componente 2: Solución de trombina Trombina humana |
2 UI |
4 UI |
8 UI |
20 UI |
|
Cloruro de calcio |
20 mmol |
40 mmol |
80 mmol |
200 mmol |
ARTISS contiene factor XIII humano copurificado con fibrinógeno humano en un rango de 0,6 - 5 UI/ml.
Para consultar la lista completa de excipientes ver sección 6.1.
1 Contenido en una concentración total de proteína de 96 - 125 mg/ml
2 1 UFE(Unidad de Farmacopea Europea) equivale a 1.800 UIC ( Unidades InactivadorCalidinogenasa)
3 La actividad de la trombina se calcula utilizando el Estándar Internacional actual de la OMS para la trombina.
3. FORMA FARMACÉUTICA
Soluciones para adhesivo tisular.
Ultracongeladas.
Soluciones incoloras o amarillo pálido y transparentes o ligeramente turbias. Componente 1, Solución de proteína sellante: pH 6,5 - 8,0 Componente 2, Solución de trombina: pH 6,0 - 8,0
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
ARTISS está indicado como sellante de tejidos para adherir/sellar tejido subcutáneo en cirugía plástica, reconstructiva o de quemados, como un sustituto o adyuvante de las suturas o de las grapas (ver 5.1). Además, ARTISS está indicado como complemento a la hemostasia en superficies de tejido subcutáneo.
4.2 Posología y forma de administración
ARTISS es solamente para uso hospitalario. El uso de ARTISS se limita a cirujanos experimentados que hayan sido debidamente formados acerca del uso de ARTISS.
4.2.1 Posología
Tanto la cantidad de ARTISS que se debe aplicar como la frecuencia de aplicación deben estar siempre orientadas a las necesidades clínicas subyacentes del paciente.
La dosis que se debe aplicar depende de algunas variables como el tipo de intervención quirúrgica, el tamaño del área y el método de aplicación y el número de aplicaciones, entre otras.
El médico debe individualizar la aplicación del producto. En ensayos clínicos, las dosis individuales han oscilado normalmente entre 0,2 y 12 ml. Puede que sea necesario suministrar volúmenes mayores en algunos procedimientos (p. ej., sellado de grandes superficies quemadas). Debe aplicarse una cantidad inicial de producto en la zona anatómica o la superficie destinada a ser tratada suficiente para cubrir completamente el área de aplicación deseada. Si es necesario, la aplicación puede repetirse en cualquiera de las áreas pequeñas que no han podido ser tratadas previamente. Sin embargo, se debe evitar volver a aplicar ARTISS en una zona previamente polimerizada con ARTISS ya que ARTISS no puede adherirse a una capa polimerizada.
Se recomienda que la aplicación inicial cubra toda el área de superficie a tratar.
Como guía para el sellado de superficies, 1 envase de ARTISS de 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) será suficiente, como mínimo, para un área de 10 cm2.
El injerto de piel se tiene que poner en el lecho de la herida inmediatamente después de la aplicación de ARTISS. El cirujano tiene hasta 60 segundos para manipular y posicionar el injerto antes de la polimerización. Después de que se haya posicionado el injerto o el colgajo, mantenerlo en la posición deseada mediante una compresión suave durante, al menos, 3 minutos para asegurar que ARTISS se fija adecuadamente y que el injerto o el colgajo se adhiere firmemente al tejido subyacente.
La cantidad necesaria de Artiss depende del tamaño de la superficie a cubrir. Las áreas aproximadas de superficie cubiertas por cada tamaño de envase de Artiss cuando se aplican mediante pulverización son las siguientes:
|
Área aproximada que requiere adherencia de tejido |
Tamaño de envase de Artiss requerido |
|
100 cm2 |
2ml |
|
200 cm2 |
4ml |
|
500 cm2 |
10ml |
Para evitar la excesiva formación de tejido de granulación y para asegurar la absorción gradual del adhesivo de fibrina solidificado, sólo debe aplicarse una capa fina de las soluciones de proteína sellante-trombina mezcladas.
En los ensayos clínicos ARTISS no ha sido administrado a mayores de 65 años.
Población pediátrica
Los datos disponibles actualmente se encuentran descritos en la sección 5.1 pero no se puede establecer una recomendación posológica.
4.2.2 Forma de administración
Para uso epilesional (tópico). No inyectar.
Sólo para uso subcutáneo. No se recomienda el uso de ARTISS en cirugía laparoscópica.
Para garantizar un uso seguro y óptimo de ARTISS se debe pulverizar utilizando un equipo regulador de presión que proporcione una presión máxima de hasta 2,0 bares (28,5 psi).
Antes de aplicar ARTISS es necesario secar la superficie de la herida utilizando para ello una técnica estándar (por ejemplo, aplicación intermitente de compresas, torundas, el uso de dispositivos de succión). No utilice ni aire ni gas presurizados para secar la zona.
ARTISS solo se debe pulverizar sobre zonas de aplicación que estén visibles.
ARTISS se debe reconstituir y administrar exactamente como se especifica en las instrucciones y sólo con los equipos recomendados para este producto (ver sección 6.6).
Para la aplicación por pulverización, ver secciones 4.4 y 6.6, que incluyen recomendaciones específicas relativas a la presión y a la distancia del tejido adecuadas para cada procedimiento quirúrgico y longitud de la punta aplicadora.
4.3 Contraindicaciones
ARTISS no está indicado para reemplazar a las suturas cutáneas realizadas para cerrar las heridas quirúrgicas.
El uso exclusivo de ARTISS no está indicado para el tratamiento de hemorragias arteriales o venosas masivas y rápidas.
ARTISS nunca debe aplicarseintravascularmente.
ARTISS está contraindicado en caso de hipersensibilidad a los principios activos o a cualquiera de los excipientes (ver también la sección 4.4. Advertencias especiales).
4.4 Advertencias y precauciones especiales de empleo
Solamente para uso epilesional. No aplicar intravascularmente. Pueden producirse complicaciones tromboembólicas perjudiciales para la vida si se aplica la preparación de forma intravascular. La inyección de ARTISS en tejidos blandos puede dañar los tejidos locales.
Se debe tener precaución al aplicar un adhesivo de fibrina utilizando aire o gas presurizado.
• Cualquier aplicación de aire o gas presurizado está asociada con un riesgo potencial de embolia gaseosa, rotura de tejido o atrapamiento de gas con compresión, que pueden poner en peligro la vidao resultar fatal.
• Aplicar ARTISS en capa fina. Un coágulo excesivamente grueso puede interferir negativamente en la eficacia del producto y en el proceso de cicatrización de la herida.
• Se han producido casos de embolia gaseosa (aire o gas) que pueden ser fatales o poner en peligro la vida asociados al uso de equipos pulverizadores que incorporan un regulador de presión para aplicar los adhesivos tisulares de fibrina. Estos casos parecen estar relacionados con el uso de equipos pulverizadores a presiones superiores a las recomendadas y/o a una distancia muy próxima a la superficie tisular. El riesgo parece ser mayor cuando los adhesivos tisulares de fibrina se pulverizan con aire, en comparación con CO2 y, por lo tanto, no se puede excluir con ARTISS cuando se pulveriza durante una intervención quirúrgica de una herida abierta.
• Al aplicar ARTISS con un equipo pulverizador, se debe asegurar de que la presión se encuentra en el intervalo de presión recomendado por el fabricante del equipo pulverizador (ver tabla en la sección 6.6 para conocer los valores de presión y distancia).
• La aplicación de ARTISS por pulverización sólo se debe realizar si es posible determinar con precisión que la distancia de pulverización es la recomendada por el fabricante. No pulverizar el producto a una distancia inferior a la recomendada.
• Siempre que se pulverice ARTISS, y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno y el nivel de CO2 al final de la espiración (ver también sección 4.2).
• No se debe utilizar ARTISS con el sistema EasySpray/Spray Set en espacios anatómicos confinados.
• Para la aplicación de ARTISS utilizar solo equipos con marcado CE.
ARTISS no está indicado para la hemostasia y el sellado en casos en los que sea necesaria una coagulación rápida del sellante. ARTISS no debe utilizarse específicamente en procedimientos cardiovasculares que requieran el sellado de anastomosis vasculares.
ARTISS no está indicado para su uso en neurocirugía ni como complemento de la sutura en anastomosis gastrointestinal o vascular ya que no se dispone de datos que apoyen estas indicaciones.
Antes de la administración de ARTISS se debe tener la precaución de proteger/cubrir suficientemente las partes del cuerpo exteriores al área de aplicación para prevenir cualquier adhesión de tejido de áreas no deseadas.
Las preparaciones que contienen oxicelulosa pueden reducir la eficacia de ARTISS y no deben ser utilizadas como materiales de soporte (ver sección 6.2).
Como con cualquier producto que contenga proteínas, se pueden producir reacciones de hipersensibilidad de tipo alérgico. Los signos de las reacciones de hipersensibilidad incluyen urticaria, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia. Si aparecen estos síntomas, debe interrumpirse inmediatamente la administración del producto.
ARTISS contiene aprotinina. Incluso si su aplicación es estrictamente local, existe un riesgo de reacción anafiláctica asociado a la presencia de aprotinina. El riesgo parece aumentar cuando ha habido
exposiciones anteriores, aunque éstas se hayan tolerado perfectamente. Por tanto, cualquier uso de aprotinina o de productos que contengan aprotinina debe incluirse en el historial de los pacientes.
Debido a que la aprotinina sintética es estructuralmente idéntica a la aprotinina bovina, el uso de ARTISS en pacientes con alergia a proteínas bovinas se debe evaluar cuidadosamente.
En caso de que se produzcan reacciones anafilácticas/anafilactoides o de hipersensibilidad graves, debe interrumpirse la administración. Si es posible, retirar cualquier cantidad del producto polimerizado y aplicado del sitio quirúrgico. En caso de una reacción anafiláctica se debe tener disponible para su uso inmediato un tratamiento médico adecuado. Las medidas de emergencia más avanzadas deben aplicarse. En caso de shock, se debe aplicar el tratamiento médico estándar para shock.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de sangre o plasma humanos se toman medidas estándar como la selección de donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar/inactivar virus. A pesar de ésto, cuando se administran medicamentos derivados de sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no puede excluirse totalmente. Esto también se refiere a virus y agentes infecciosos emergentes o de naturaleza desconocida.
Las medidas adoptadas se consideran eficaces para los virus envueltos como el virus de la inmunodeficiencia humana(VIH), virus de la hepatitis B(VHB), virus de la hepatitis C(VHC) y para los virus no envueltos de la hepatitis A(VHA).
Los procedimientos de inactivación/eliminación pueden tener un valor limitado para virus no envueltos tales como el parvovirus B19.La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para sujetos con immunodeficiencias o con una producción aumentada de hematíes (p. ej., con anemia hemolítica).
Se recomienda encarecidamente que cada vez que se administre ARTISS a un paciente, se deje constancia del nombre y el número de lote del producto, para poder mantener la trazabilidad entre el paciente y el lote del producto administrado.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción.
Como sucede con productos parecidos o soluciones de trombina, el producto se desnaturaliza si se expone a soluciones que contienen alcohol, yodo o metales pesados (p. ej., soluciones antisépticas). Esas sustancias deben eliminarse en la medida de lo posible antes de aplicar el producto.
Ver secciones 4.4 o 6.2 para las sustancias que pueden interferir con el funcionamiento del producto.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad de los adhesivos de fibrina/hemostáticos en mujeres embarazadas o en periodo de lactancia en ensayos clínicos controlados. No se han realizado ensayos en animales.
Por tanto, el producto no se debe administrar a mujeres embarazadas o en periodo de lactancia a no ser que sea estrictamente necesario.
Para información sobre infección por Parvovirus B19, ver sección 4.4.
Los efectos de ARTISS sobre la fertilidad no se han establecido.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
La inyección intravascular puede producir complicaciones tromboembólicas y coagulación intravascular diseminada (CID). También puede existir el riesgo de reacciones anafilácticas (ver 4.4).
En pacientes tratados con sellantes de fibrina/hemostáticos pueden aparecer casos raros de hipersensibilidad o reacciones alérgicas (que pueden incluir angioedema, ardor y picor en el punto de aplicación, bradicardia, broncoespasmo, escalofríos, disnea, sofocos, urticaria generalizada, dolor de cabeza, urticaria local, hipotensión, letargo, náuseas, prurito, inquietud, taquicardia, opresión en el pecho, hormigueo, vómitos, sibilancias).
En casos aislados, estas reacciones han progresado a anafilaxis grave. Estas reacciones pueden ocurrir especialmente si la preparación se aplica de forma repetida o si se administra a pacientes hipersensibles a la aprotinina (ver sección 4.4) o a cualquiera de los componentes del producto.
Incluso si se toleró bien un primer tratamiento con ARTISS, una administración subsiguiente de ARTISS o una administración sistémica de aprotinina puede dar lugar a reacciones anafilácticas graves.
Raramente pueden producirse anticuerpos frente a los componentes deadhesivos de fibrina.
Para información sobre seguridad de agentes transmisibles, ver sección 4.4.
Se han producido casos de embolia gaseosa (aire o gas) que pueden ser fatales o poner en peligro la vida, asociados al uso de equipos de aire a presión o gas a presión. Estos casos parecen estar relacionados con el uso inapropiado de equipos pulverizadores (p.ej. a presiones superiores a las recomendadas y a una distancia muy próxima a la superficie tisular).
Resumidas en la tabla a continuación, se describen las reacciones adversas notificadas durante los ensayos clínicos de Artiss y durante la experiencia postcomercialización con los adhesivos tisulares de fibrina de Baxter (señalados con una p en la tabla de reacciones adversas a continuación). Las frecuencias conocidas de estas reacciones adversas están basadas en un ensayo clínico controlado en 138 pacientes a los que se les fijaron los injertos de piel con ARTISS sobre la zona quemada libre de piel. Ninguno de los casos observados en el ensayo clínico fue clasificado como grave.
Las reacciones adversas y sus frecuencias se resumen a continuación:
Frecuentes (31/100 a <1/10)
Poco frecuentes (31/1.000 a <1/100)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Tabla 1 Reacciones adversas | ||
|
Clasificación de órganos del |
TérminoMedDRApre |
Frecuencia |
|
sistema (COS) |
ferido | |
|
Trastornos de la piel y del tejido subcutáneo |
Quistedérmico |
Pocofrecuentes |
|
Prurito |
Frecuentes | |
|
Lesiones traumáticas, |
Frecuentes | |
|
intoxicaciones y complicaciones de |
Fallo del injerto de | |
|
procedimientos terapéuticos |
piel | |
|
Trastornos vasculares |
Embolia gaseosa p debido al uso inapropiado de los |
No conocida |
equipos pulverizadores (ver sección 4.4)
pReacción adversa observada durante la experiencia postcomercialización.
Reaccionesde clase
Otras reacciones adversas asociadas con los medicamentos que contienen adhesivos de fibrina/hemostáticosincluyen: reacciones de hipersensibilidad incluyen irritación en el lugar de aplicación, dolor en el pecho, escalofríos, dolor de cabeza, letargo, inquietud y vómitos.
Otras reacciones de clase son: reacción anafiláctica, bradicardia, taquicardia, hipotensión, hematoma, disnea, náuseas, urticaria, enrojecimiento, alteración de la cicatrización, edema, pirexia y seroma.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRAM.es
4.9 Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hemostáticos locales, código ATC: B02BC; adhesivos tisulares, código ATC: V03A K.
ARTISS puede reemplazar a las suturas o a las grapas cuando se utiliza para la fijación de injertos de piel en áreas quemadas o heridas de algún otro modo. ARTISS se puede utilizar como un complemento de las suturas o grapas para adherir o sellar capas de piel en los casos en los que se espera que las suturas/grapas van a tener un resultado insatisfactorio con respecto a la aparición de hematoma o formación de un seroma postoperatorio.
El sistema de adhesión de la fibrina inicia la última fase de la coagulación sanguínea.
La conversión de fibrinógeno en fibrina se produce por la separación del fibrinógeno en monómeros de fibrina y fibrinopéptidos. Los monómeros de fibrina se agregan y forman un coágulo de fibrina. El factor XIIIa es activado desde el factor XIII por la trombina, a través de puentes cruzados de fibrina. Los iones de calcio son necesarios para la conversión del fibrinógeno y el entrecruzamiento de fibrina.
A la vez que avanza el proceso de curación de la herida, se experimenta un aumento de la actividad fibrinolítica inducida por la acción de la plasmina, y la fibrina empieza a descomponerse en sus productos de degradación. La degradación proteolítica de la fibrina se inhibe mediante antifibrinolíticos. La aprotinina se encuentra presente en ARTISS (presentación congelada) como antifibrinolítico para prevenir la degradación prematura del coágulo.
Para el estudio de su eficacia, se utilizaron estudios in vivo en modelos animales imitando al máximo la situación en pacientes. ARTISS (presentaciones congelada y liofilizada) demostró ser eficaz en sellados de injertos de piel autólogos de grosor dividido y en injertos en forma de red.
ARTISS (presentación congelada) se evaluó en la fijación de injertos de piel de grosor dividido en pacientes quemados en un ensayo clínico multicéntrico, controlado, aleatorizado y prospectivo. En cada uno de los 138 pacientes se identificaron dos zonas de prueba comparables. En una zona de prueba el injerto de piel se fijó con ARTISS y en la otra zona se fijó con grapas (control). ARTISS no fue inferior a las grapas con respecto al criterio principal de valoración de eficacia, la cicatrización completa de la herida
el día 28 se evaluó mediante un panel ciego evaluador a partir de las fotografías realizadas. Este criterio se alcanzó en 55/127 (43,3%) de los pacientes tratados con ARTISS (presentación congelada) y en 47/127 (37%) de los pacientes tratados con grapas.
Con respecto a los criterios secundarios de evaluación, ARTISS demostró una incidencia y un tamaño de hematoma/seroma significativamente menores en el día 1 (p < 0,0001 para incidencia y tamaño). La incidencia y la superficie del injerto en el día 5 y la cicatrización de la herida en el día 14 así como la cicatrización de la herida en el día 28, no fueron diferentes. ARTISS también fue superior a las grapas con respecto a la satisfacción del paciente (p < 0,0001) y los pacientes experimentaron significativamente menos ansiedad por el dolor con ARTISS que con las grapas (p < 0,0001). Además, ARTISS fue significativamente superior a las grapas en cuanto a la evaluación del investigador con respecto a la calidad de la adhesión del injerto, la preferencia del método de fijación y la satisfacción con la fijación de injertos, la calidad y la velocidad globales de la curación (p < 0,0001).
En este ensayo se evaluaron treinta y siete (37) pacientes pediátricos entre 1,1 a 18 años de edad.
De estos pacientes, dieciocho (18) tenían 6 años o menos.
En los ensayos clínicos se utilizó la misma posología en pacientes adultos y pediátricos.
5.2 Propiedades farmacocinéticas
ARTISS está indicado solamente para uso epilesional. La administración intravascular está contraindicada. Por tanto, no se han realizado estudios farmacocinéticosintravasculares con personas.
No se han realizado estudios farmacocinéticos en diferentes especies animales de laboratorio.
Los adhesivos/hemostáticos de fibrina se metabolizan de la misma forma que la fibrina endógena: por fibrinólisis y fagocitosis.
5.3 Datos preclínicos sobre seguridad
No hay datos preclínicos de seguridad disponibles para ARTISS (4 UI/ml de trombina). Los estudios de toxicidad se han realizado con otros adhesivos tisulares de fibrina que contienen 500 UI/ml de trombina, que son representativos para los productos que contienen 4 UI/ml de trombina. Los estudios de toxicidad a dosis única en ratas y conejos no indicaron toxicidad aguda del adhesivo de fibrina VH S/D (500 UI/ml). Además, se demostró que el adhesivo de fibrina VH S/D (500 UI/ml) fue bien tolerado en modelos de curación de heridas en ratas y conejos y en cultivos in vitro de fibroblastos humanos.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Componente 1: Solución de proteína sellante
Solución de albúmina humana
L-Histidina
Niacinamida
Polisorbato 80 (Tween 80)
Citrato de sodio dihidratado Agua para preparaciones inyectables
Componente 2: Solución de trombina
Solución de albúmina humana
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos. Las preparaciones que contienen oxicelulosa pueden reducir la eficacia de ARTISS y no deben ser utilizadas como materiales de soporte.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Conservar y transportar congelado (a £ -20°C).
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Las bolsas descongeladas a temperatura ambiente sin abrir pueden conservarse hasta 14 días a temperatura ambiente controlada (que no exceda los +25°C).
Una vez descongelado, no volver a congelar o refrigerar.
6.5 Naturaleza y contenido del envase
Solución de proteína sellante de 1 ml, 2 ml ó 5 ml y solución de trombina de 1 ml, 2 ml ó 5 ml en una jeringa (polipropileno) de doble cámara de un sólo uso con un tapón de rosca contenida en una bolsa y un equipo con dispositivos con un émbolo de jeringa doble, 2 boquillas de unión y 4 cánulas de aplicación.
Envase unitario (1 x 1 ml + 1 ml, 1 x 2 ml + 2 ml, 1 x 5 ml + 5 ml).
Tanto la solución de proteína sellante como la solución de trombina están contenidas en una jeringa de doble cámara de un sólo uso hecha de polipropileno.
Puede que solamente estén comercializados algunos tamaños de envases.
Pueden obtenerse otros accesorios de BAXTER para la aplicación del producto.
6.6 Precauciones especiales de eliminación y otras manipulaciones Generales
Para evitar la adhesión de ARTISS a guantes e instrumentos quirúrgicos, éstos deben humedecerse con suero salino antes de ponerlos en contacto.
Como guía para el sellado de superficies, 1 envase de ARTISS de 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) será suficiente, como mínimo, para un área de 10 cm2.
La dosis necesaria de ARTISS dependerá del tamaño de la superficie que se debe cubrir.
Manipulación y preparación
La bolsa interior y su contenido son estériles a menos que la integridad del envase exterior esté alterada.
Se recomienda descongelar y calentar los dos componentes utilizando un baño de agua estéril a una temperatura de 33-37°C. El baño de agua no debe exceder los 37°C. (Para controlar el rango de temperatura especificado, debe monitorizarse la temperatura del agua utilizando un termómetro y cambiar el agua cuando sea necesario. Si se utiliza el baño de agua estéril para la descongelación y calentamiento, la jeringa precargada de doble cámara debe retirarse de las bolsas de plástico-recubiertas de aluminio).
El tapón protector de la jeringa no debe retirarse hasta que la descongelación se haya completado y la boquilla de unión esté preparada para colocarse. No utilizar ARTISS a menos que la solución esté completamente descongelada y calentada (consistencia líquida).
Descongelar las jeringas precargadas utilizando una de las opciones siguientes:
1. Descongelación a temperatura ambiente (no debe superar los +25°C):
El producto se puede descongelar a temperatura ambiente. En la tabla 1 se proporcionan los tiempos mínimos para la descongelación a temperatura ambiente. El tiempo máximo que el producto puede mantenerse a temperatura ambiente es 14 días (en las bolsas de plásticorecubiertas de aluminio).
Cuando se descongela a temperatura ambiente, el producto debe calentarse adicionalmente a 33°C - 37°C en un incubador justo antes de su utilización. Los respectivos tiempos de calentamiento en incubador se proporcionan también en la Tabla 1.
Tabla 1: tiempos de descongelación a temperatura ambiente (= TA) seguidos de calentamiento adicional, previo a su utilización, en un incubador a 33°C hasta un máximo de 37°C
|
Tamaño del envase |
Tiempos de descongelación a temperatura ambiente (producto en bolsas de plástico- recubiertas de aluminio) |
Tiempos de calentamiento a 33-37°C en incubador después de descongelación a TA (producto en bolsas de plástico recubiertas de aluminio) | ||
|
2 ml |
60 minutos |
+ |
15 minutos | |
|
4 ml |
110 minutos |
+ |
25 minutos | |
|
10 ml |
160 minutos |
+ |
35 minutos | |
Una vez que ARTISS se haya calentado hasta 33 - 37°C, el producto se puede conservar hasta un máximo de 4 horas.
2. Descongelación rápida:
Tabla 2: tiempos de descongelación y calentamiento con un baño de agua estéril a 33°C hasta un máximo de 37°C
Sumergir el émbolo y la bolsa interior en el campo estéril, retirar la jeringa precargada de la bolsa interior y colocarla directamente en el baño de agua estéril. Asegurar que el contenido de la jeringa precargada queda totalmente sumergido en el agua.
|
Tamaño del envase |
Tiempos de descongelación y calentamiento |
|
(producto retirado de las bolsas de plástico recubiertas | |
|
de aluminio) |
|
2 ml |
5 minutos |
|
4 ml |
5 minutos |
|
10 ml |
12 minutos |
Una tercera alternativa es descongelar el producto en un baño de agua no estéril fuera del campo estéril. Mantener la jeringa precargada en ambas bolsas y colocarla en un baño de agua fuera del campo estéril durante un período de tiempo adecuado (ver Tabla 3). Asegurar que las bolsas quedan sumergidas a lo largo del proceso de descongelación. Sacarlas del baño de agua cuando se hayan descongelado, secar la bolsa exterior y sumergir la bolsa interior con la jeringa precargada y el émbolo en el campo estéril.
Tabla 3: tiempos de descongelación y calentamiento fuera del campo estéril con un baño de agua no estéril a 33°C hasta un máximo de 37°C
|
Tamaño del envase |
Tiempos de descongelación y calentamiento (producto en bolsas de plástico recubiertas de aluminio) |
|
2 ml |
30 minutos |
|
4 ml |
40 minutos |
|
10 ml |
80 minutos |
Alternativamente, los dos componentes adhesivos pueden descongelarse y calentarse en un incubador entre 33°C y 37°C. Los tiempos de descongelación y calentamiento en el incubador se indican a continuación en la Tabla 4. Los tiempos se refieren al producto en las bolsas de plástico- recubiertas de aluminio.
Tabla 4: tiempos de descongelación y calentamiento en incubador a 33°C hasta un máximo de 37°C
|
Tamaño del envase |
Tiempos de descongelación y calentamiento en Incubadora (producto en bolsas de plástico recubiertas de aluminio) |
|
2 ml |
40 minutos |
|
4 ml |
85 minutos |
|
10 ml |
105 minutos |
Nota: No descongelar el producto sosteniéndolo con las manos.
No introducir en el microondas.
Una vez descongelado, no volver a congelar o refrigerar.
Después de la descongelación rápida (por ejemplo, descongelación a 33 - 37°C) ARTISS puede conservarse a 33 - 37aC durante un máximo de 4 horas.
Los dos componentes deben calentarse a 33-37°C inmediatamente antes de su utilización para facilitar una mezcla óptima de las dos soluciones. (Sin embargo, no deben excederse los 37°C).
Las soluciones de proteína sellante y de trombina deben ser transparentes o ligeramente opalescentes. No utilizar soluciones que estén turbias o tengan depósitos. El producto descongelado debe inspeccionarse visualmente antes de su administración para descartar la presencia de partículas y decoloración o para cualquier variación de su apariencia física. Desechar la solución en caso de observar cualquiera de las condiciones mencionadas anteriormente.
La solución de proteína sellante descongelada debe ser un líquido ligeramente viscoso. Si la solución tiene la consistencia de un gel solidificado, se debe asumir que se ha desnaturalizado (por ejemplo, debido a la interrupción de la cadena de conservación en frío o por exceso de calor durante el calentamiento). En este caso ARTISS no debe utilizarse.
Las bolsas cerradas, descongeladas a temperatura ambiente, pueden conservarse hasta 14 días a temperatura ambiente controlada (que no exceda los +25°C). ARTISS debe eliminarse si no se utiliza dentro de los 14 días después de la descongelación.
El tapón protector de la jeringa no debe retirarse hasta que la descongelación se haya completado y la boquilla de unión esté preparada para colocarse. No utilizar ARTISS hasta que se haya descongelado y calentado totalmente (consistencia líquida).
Para más instrucciones de preparación consultar a la enfermera o médico responsable. ADMINISTRACIÓN
Para su aplicación, la jeringa de doble cámara con las soluciones de Proteína sellante y de Trombina tiene que conectarse a una boquilla de unión y a una aguja de aplicación incluidas en el equipo de dispositivos que se suministra. El émbolo común de la jeringa de doble cámara garantiza la aplicación de volúmenes iguales mediante una boquilla de unión antes de su mezclado en la cánula de aplicación y su salida.
Instrucciones de funcionamiento
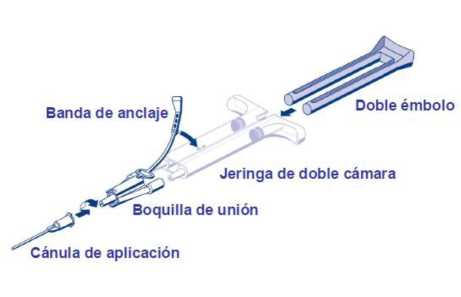
o Conectar las boquillas de la jeringa de doble cámara a la boquilla de unión asegurándose que ambas están firmemente fijadas. Asegurar la boquilla de unión fijando las bandas a la jeringa de doble cámara. Si la banda de anclaje retrocede, utilizar la boquilla de unión que sobra. Si no hay ninguna disponible, todavía es posible su utilización asegurándose que la conexión está ajustada para prevenir cualquier riesgo de fugas.
o Ajustar una cánula de aplicación a la boquilla de unión.
o No expulsar el aire que quede dentro de la boquilla de unión o de la cánula de aplicación hasta que inicie la aplicación ya que la abertura de la cánula puede obstruirse.
o Inmediatamente antes de la aplicación expulsar y desechar las primeras gotas de la cánula de aplicación para asegurar la mezcla adecuada del producto.
o Aplicar la mezcla de solución de proteína sellante-solución de trombina sobre la superficie o superficies de las partes a sellar.
Si la aplicación de los componentes del adhesivo de fibrina se interrumpe, pueden aparecer coágulos en la cánula. Sustituir inmediatamente la cánula de aplicación por una nuevaantes de volver a iniciar el sellado. Si la abertura de la boquilla de unión se obstruye, utilizar la boquilla de unión adicional proporcionada en el envase.
BAXTER también proporciona otros accesorios para realizar la aplicación que son especialmente adecuados para, p. ej., cirugía mínimamente invasiva, aplicación en áreas grandes o de difícil
acceso. Cuando se utilizan estos dispositivos de aplicación, deben seguirse estrictamente las Instrucciones de Uso de los dispositivos.
Aplicación por pulverización
Al aplicar ARTISS con un equipo pulverizador, se debe asegurar de que la presión y la distancia al tejido se encuentran dentro de los intervalos recomendados por el fabricante, según se indica a continuación:
|
Presión, distancia y equipos recomendados para la aplicación por pulverización t |
le ARTISS | ||||
|
Equipo pulverizador que se debe utlizar |
Puntas aplicadoras que se debe utilizar |
Regulador de presión que se debe utilizar |
Distancia del tejido de destino recomendada |
Presión de pulverización recomendada | |
|
Cirugía abierta de tejido subcutáneo |
Equipo pulverizador Tisseel/Artiss |
n.a. |
EasySpray |
10-15 cm |
1,5-2,0 bares (21,5-28,5 psi) |
|
Equipo pulverizador Tisseel/Artiss, envase de 10 |
n.a. |
EasySpray | |||
Siempre que se pulverice ARTISS, y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno y el nivel de CO2 al final de la espiración (ver secciones 4.2 y 4.4).
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BAXTER, S.L.
Pouet de Camilo, 2
46394 Ribarroja del Turia (Valencia)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
70914
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Mayo 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio 2015
13 de 13