Agua Para Preparaciones Inyectables Meinsol, Disolvente Para Uso Parenteral
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Agua para preparaciones inyectables.........1 g por 1 ml.
pH entre 4,5 y 7,0.
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Disolvente para uso parenteral.
Líquido transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
El agua para preparaciones inyectables estéril está indicada como vehículo para la dilución y reconstitución de medicamentos por vía parenteral.
4.2 Posología y forma de administración
1111
Posología
La dosis de las preparaciones reconstituidas estará marcada por la naturaleza de la sustancia que se añada. El rango de administración dependerá del régimen posológico del medicamento prescrito.
Siguiendo la mezcla apropiada de las sustancias prescritas que se añaden, la dosis normalmente depende de la edad, el peso y las condiciones clínicas del paciente así como de las determinaciones analíticas.
Forma de administración
La solución es para disolución y administración de sustancias terapéuticas. Las normas de uso relacionadas con la adición de medicamentos vendrán dadas por los volúmenes adecuados, así como por la vía de administración.
4.3 Contraindicaciones
No inyectar Agua para preparaciones inyectables Meinsol sola.
Se deben tener en cuenta las contraindicaciones relacionas con los medicamentos que se añaden.
4.4 Advertencias y precauciones especiales de empleo
El agua para preparaciones inyectables es hipotónica y no debe administrarse sola.
No usar para preparaciones inyectables intravenosas a no ser que se ajuste con un soluto adecuado para acercarse a la isotonicidad.
Cuando el agua para preparaciones inyectables se use como diluyente de soluciones hipertónicas, deberá diluirse de forma adecuada para acercar la solución a la isotonicidad. Como consecuencia de la perfusión de grandes volúmenes de soluciones hipotónicas que usan agua estéril para inyección, puede aparecer hemólisis.
Se debe monitorizar regularmente el balance iónico cuando se administran grandes volúmenes.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han descrito, sin embargo, se deben tener en cuenta las posibles interacciones entre los diferentes medicamentos que se disuelvan.
4.6 Fertilidad, embarazo y lactancia
Lo riesgos durante el uso en el embarazo y lactancia vienen determinados por la naturaleza del medicamento que se añada.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
La administración intravenosa de Agua para preparaciones inyectables Meinsol puede provocar hemólisis si se administra sola.
La naturaleza del medicamento añadido determinará la probabilidad de cualquier otro efecto adverso.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, http:Ywww.notificaram.es.
4.9 Sobredosis
Se puede dar hemólisis tras la perfusión de grandes volúmenes de soluciones hipotónicas que usan agua para preparaciones inyectables estéril como diluyente.
Los signos y síntomas de la sobredosis podrán también estar relacionados con la naturaleza del medicamento que se añada. En caso de sobredosis accidental, se debe interrumpir el tratamiento y se debe observar el paciente para signos y síntomas apropiados relacionados con el medicamento a administrar.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes solventes y diluyentes, incluyendo Soluciones para irrigación. Código ATC: V07AB.
Como Agua para preparaciones inyectables Meinsol es un vehículo para la administración de medicamentos añadidos, la farmacodinámica dependerá de la naturaleza del medicamento añadido.
5.2 Propiedades farmacocinéticas
Como Agua para preparaciones inyectables Meinsol es un vehículo para la administración de medicamentos añadidos, la farmacocinética dependerá de la naturaleza del medicamento añadido.
5.3 Datos preclínicos sobre seguridad
Como Agua para preparaciones inyectables Meinsol es un vehículo para la administración de medicamentos añadidos, los datos preclínicos de seguridad de las soluciones en uso dependerán de la naturaleza del medicamento añadido
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes No contiene.
6.2 Incompatibilidades
Los aditivos pueden ser incompatibles. Los aditivos para los cuales se conozca su incompatibilidad no se deben usar. Antes de añadir medicamentos comprobar:
- que son solubles y estables en agua al pH del Agua para preparaciones inyectables Meinsol.
- que son compatibles entre ellos
En ausencia de estudios de compatibilidad, este producto no se debe mezclar con otros medicamentos.
6.3 Periodo de validez
Ampollas de 5 ml, 10 ml y 20 ml: 2 años.
Caducidad tras la primera apertura: uso inmediato.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación. Conservar la ampolla en el embalaje exterior.
6.5 Naturaleza y contenido del envase
Ampollas de polietileno de baja densidad.
Estuche con 20 ampollas de 5 ml (Envase Clínico)
Estuche con 50 ampollas de 5 ml (Envase Clínico)
Estuche con 20 ampollas de 10 ml (Envase Clínico)
Estuche con 50 ampollas de 10 ml (Envase Clínico)
Estuche con 20 ampollas de 20 ml (Envase Clínico)
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Desechar tras un solo uso.
Desechar la porción no utilizada.
Usar solamente si la solución es transparente, sin partículas visibles y si el envase está intacto.
Es obligatorio realizar la mezcla de cualquier aditivo de forma aséptica cuidadosa y meticulosa.
Se debe llevar la perfusión a isotonicidad antes de la administración parenteral.
Las soluciones que contienen aditivos se deben usar inmediatamente tras su preparación, a menos que la preparación haya tenido lugar bajo condiciones asépticas controladas y validadas.
Para abrir:
Para separar una ampolla del resto, gire una ampolla sobre sí misma en contra del resto de las ampollas de la tira sin tocar la cabeza y cuello de las ampollas (1).Agitar la ampolla con un único movimiento tal como se muestra en el dibujo para eliminar el líquido que pueda estar en el tapón (2). Para abrir la ampolla, girar el cuerpo y la cabeza de la ampolla en sentidos opuestos hasta que se rompa por el cuello (3). Conectar la jeringa Luer o Luer-lock tal como se muestra en el dibujo (4).
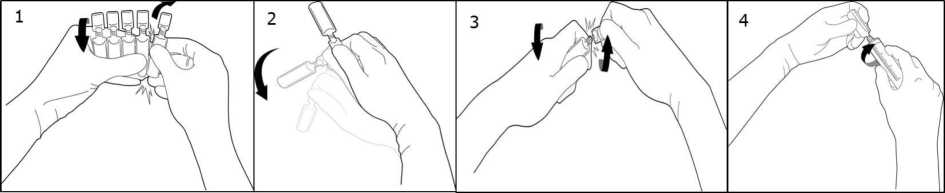
Por lo que no se necesita aguja para extraer la solución. Extraer el líquido.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Fresenius Kabi España S.A.U.
C/ Marina 16-18 08005 Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
58.935
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
31 de julio de 1990
10. FECHA DE LA REVISIÓN DEL TEXTO
-15 de Enero de 2015
5 de 5