Actiq 1200 Microgramos, Comprimidos Para Chupar Con Aplicador Bucal Integrado
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Actiq 200 microgramos comprimido para chupar con aplicador bucal integrado.
Actiq 400 microgramos comprimido para chupar con aplicador bucal integrado.
Actiq 600 microgramos comprimido para chupar con aplicador bucal integrado.
Actiq 800 microgramos comprimido para chupar con aplicador bucal integrado.
Actiq 1200 microgramos comprimido para chupar con aplicador bucal integrado.
Actiq 1600 microgramos comprimido para chupar con aplicador bucal integrado.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido contiene 200 microgramos, 400 microgramos, 600 microgramos, 800 microgramos, 1200 microgramos, 1600 microgramos de fentanilo (como citrato).
Excipiente(s) con efecto conocido:
Cada comprimido para chupar también contiene dextratos (equivalente a aproximadamente 2 gramos de glucosa), sacarosa (aproximadamente 30 mg de azúcar glaseado) y propilenglicol (parte de la aroma artificial de baya y de la tinta de impresión) como excipientes.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido para chupar con aplicador bucal integrado.
Actiq está formulado como una matriz farmacéutica de polvo comprimido de color blanco a blanquecino, unido con una goma comestible a un aplicador de plástico radiopaco resistente a la rotura, en el que figura la concentración de dosificación.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Actiq está indicado para el tratamiento de dolor irruptivo en pacientes que ya reciben tratamiento de mantenimiento con opiáceos para dolor crónico en cáncer. El dolor irruptivo es una exacerbación transitoria de dolor que se produce sobre una base de dolor persistente controlado por otros medios.
Los pacientes que reciben tratamiento de mantenimiento con opioides son los que toman como mínimo 60 mg de morfina oral diarios, 25 microgramos de fentanilo transdérmico cada hora, 30 mg de oxicodona diarios, 8 mg de hidromorfona oral diarios o una dosis equianalgésica de otro opioide durante una semana o más.
4.2 Posología y forma de administración
Posología
Con el fin de minimizar los riesgos de reacciones adversas relacionadas con los opiáceos y para establecer una dosis “satisfactoria”, es indispensable que los profesionales sanitarios lleven un control riguroso de los pacientes durante el proceso de titulación o ajuste de la dosis.
Actiq no es intercambiable, mcg a mcg, con otros productos de fentanilo de acción corta indicados para el tratamiento del dolor irruptivo oncológico, puesto que los perfiles farmacocinéticos y/o las pautas de dosificación de estos productos son considerablemente diferentes. Se debe advertir al paciente que no debe utilizar más de un producto de fentanilo de acción corta al mismo tiempo, para el tratamiento del dolor irruptivo oncológico y que debe desechar cualquier producto de fentanilo prescrito para el dolor irruptivo
oncológico (DIO) cuando cambie a Actiq. Con objeto de prevenir confusiones y posibles sobredosis, el paciente debe disponer en cada momento del mínimo número de concentraciones de Actiq.
Las unidades de Actiq no usadas que el paciente ya no necesite deben desecharse adecuadamente. Debe recordarse a los pacientes la necesidad de mantener Actiq en un lugar fuera del alcance y de la vista de los niños.
Adultos
Titulación o Ajuste de la dosis y terapia de mantenimiento
Actiq debe ajustarse de forma individual hasta obtener una dosis “eficaz” que proporcione la analgesia adecuada y que minimice las reacciones adversas. En los ensayos clínicos, la dosis satisfactoria de Actiq para el dolor irruptivo no se predijo a partir de la dosis diaria de mantenimiento de opiáceos.
a) Titulación o Ajuste de la dosis
Antes de proceder a la titulación de la dosis del paciente con Actiq, se presupone que el dolor persistente subyacente está controlado con el uso de terapia con opiáceos y que, en general, el paciente no padece más de 4 episodios de dolor irruptivo al día.
La dosis inicial de Actiq debe ser de 200 microgramos, con aumento de la dosis según sea necesario dentro del rango de concentraciones de dosificación disponibles (200, 400, 600, 800, 1200 y 1600 microgramos). Debe llevarse un control riguroso del paciente hasta que se llegue a una dosis que ofrezca la analgesia adecuada con unas reacciones adversas aceptables utilizando una sola unidad de dosis por episodio de dolor irruptivo. Así se define la dosis eficaz.
Durante la titulación de la dosis, si no se obtiene una analgesia adecuada dentro de 30 minutos desde el comienzo de la primera unidad (es decir en los 15 minutos siguientes después del consumo completo de una sola unidad de Actiq), el paciente podrá consumir una segunda unidad de Actiq de la misma concentración. No deben utilizarse más de dos unidades de Actiq para tratar un solo episodio de dolor. Con la dosis de 1600 microgramos, solo es probable que se necesite una segunda dosis en una minoría de pacientes.
Si para tratar episodios consecutivos de dolor irruptivo se precisa más de una unidad de dosificación por episodio, se debe considerar el aumento de la dosis hasta la siguiente concentración disponible
Proceso de titulación o ajuste de dosis de Actiq
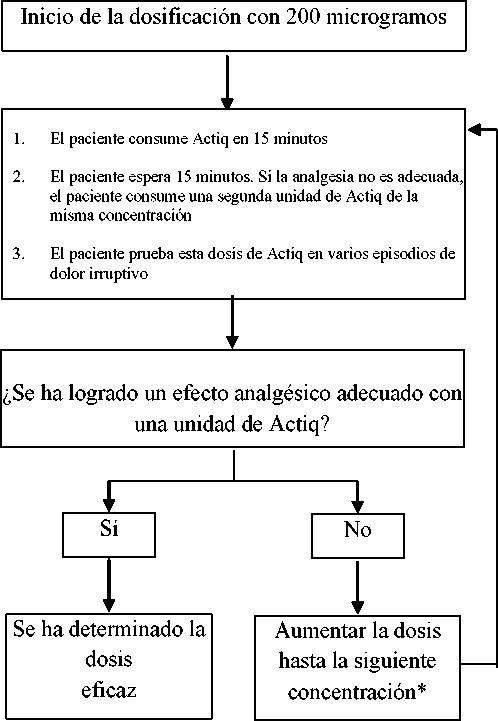
*Las concentraciones de dosis disponibles son: 200, 400, 600, 800, 1200 y 1600 microgramos b) Mantenimiento
Una vez determinada la dosis eficaz (es decir, aquella que, en términos medios, permita tratar con eficacia un episodio con una sola unidad), debe mantenerse dicha dosis y limitar el consumo a un máximo de cuatro unidades de Actiq al día.
El profesional sanitario deberá llevar un control del paciente para garantizar que no se exceda el consumo máximo de cuatro unidades de Actiq al día.
Reajuste de la dosis
La dosis de mantenimiento de Actiq debe aumentarse cuando un episodio no se trata de forma eficaz con una sola unidad, durante varios episodios consecutivos de DI. Para el reajuste de la dosis se aplican los mismos principios descritos para ajuste de la dosis (ver más arriba).
Si se manifiestan más de cuatro episodios de dolor irruptivo al día se debe volver a calcular la dosis del opiáceo de acción prolongada utilizado para el dolor persistente. Si se aumenta la dosis del opiáceo de acción prolongada, puede que sea preciso revisar la dosis de Actiq para tratar el dolor irruptivo.
Cualquier reajuste de dosis de cualquier analgésico debe ser supervisado obligatoriamente por un profesional sanitario.
Suspensión del tratamiento
El tratamiento con Actiq se debe interrumpir inmediatamente si el paciente ya no presenta episodios de dolor irruptivo. El tratamiento del dolor de base persistente se debe mantener tal como estaba prescrito. Si es necesario interrumpir la totalidad del tratamiento con opioides, el médico debe realizar un estrecho seguimiento del paciente con el fin de controlar el riesgo de efectos abruptos de abstinencia
Uso en ancianos
Se ha constatado que los pacientes ancianos son más sensibles a los efectos del fentanilo administrado por vía intravenosa. Por lo tanto, la titulación de la dosis debe abordarse con especial precaución. En el anciano, la eliminación de fentanilo es más lenta y la vida media de eliminación terminal es mayor, lo cual puede producir una acumulación del principio activo y un mayor riesgo de efectos indeseables.
No se han llevado a cabo ensayos clínicos formales con Actiq en ancianos. No obstante, se ha observado en los ensayos clínicos que los pacientes mayores de 65 años necesitan dosis más bajas de Actiq para lograr un alivio eficaz del dolor irruptivo.
Uso en pacientes con insuficiencia hepática o renal
Debe tenerse especial cuidado durante el proceso de titulación en pacientes con disfunción renal o hepática (ver sección 4.4).
Población _ pediátrica
Adolescentes de edad igual o superior a 16 años:
Deben seguir la pauta posológica para adultos
Niños de edad comprendida entre 2 y 16 años:
No se ha establecido la seguridad y eficacia en niños de 2 a 16 años. La experiencia de ensayos clínicos sobre el uso de Actiq en pacientes pediátricos que están siendo tratados con terapia opioide de mantenimiento es limitada (ver secciones 5.1 y 5.2).Por consiguiente no se recomienda su uso en esta población de pacientes.
Forma de administración
Actiq está destinado para la administración bucal y, por tanto, debe colocarse en la boca contra la mejilla y desplazarse por la boca con la ayuda del aplicador, de modo que se aumente al máximo la zona mucosa expuesta al producto. La unidad de Actiq debe chuparse, no masticarse, ya que la absorción del fentanilo por la mucosa oral es rápida en comparación con la absorción sistémica por vía gastrointestinal. En pacientes con sequedad de boca, se puede utilizar agua para humedecer la mucosa oral.
La unidad de Actiq debe consumirse en el transcurso de 15 minutos. Si se manifiestan signos de efectos opiáceos excesivos antes de consumir totalmente la unidad de Actiq, ésta debe retirarse inmediatamente y debe plantearse la reducción de las dosificaciones posteriores.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes que no estén en tratamiento de mantenimiento con opioides, por el mayor riesgo de depresión respiratoria.
Tratamiento del dolor agudo distinto al dolor irruptivo.
Empleo simultáneo de inhibidores de monoamina-oxidasa (IMAO), o en las 2 semanas posteriores a la finalización del empleo de los IMAO.
Depresión respiratoria grave o enfermedad pulmonar obstructiva grave.
4.4 Advertencias y precauciones especiales de empleo
Debe advertirse a los pacientes y a sus cuidadores que Actiq contiene un principio activo en cantidades que pueden causar la muerte a un niño. Se han notificado muertes en niños que ingirieron Actiq accidentalmente. Debe indicarse a los pacientes y a sus cuidadores que mantengan todas las unidades fuera del alcance y de la vista de los niños y que desechen adecuadamente las unidades abiertas o no abiertas. Se deberá efectuar una valoración de cada paciente ambulatorio con respecto a las posibles exposiciones accidentales de niños.
No debe administrarse el producto a pacientes que no estén en tratamiento de mantenimiento con opioides por el mayor riesgo de depresión respiratoria y muerte. Es importante que el tratamiento de mantenimiento con opioides utilizado para tratar el dolor persistente del paciente haya sido estabilizado antes de iniciar la terapia de Actiq y que el paciente prosiga el tratamiento de mantenimiento con opioides mientras esté tomando Actiq.
Al igual que con todos los opioides, con fentanilo se puede desarrollar tolerancia o dependencia física y/o psicológica. Sin embargo, raramente se produce adicción iatrogénica por el uso terapéutico de opiáceos. El riesgo se considera reducido en pacientes oncológicos con dolor irruptivo pero puede ser más elevado en aquellos pacientes con historial de drogadicción y alcoholismo. Todos los pacientes en tratamiento con opioides requieren de un cuidadoso seguimiento para detectar signos de abuso y adicción.
Como con todos los opiáceos, hay riesgo de depresión respiratoria clínicamente significativa asociada al uso de Actiq.
Debe prestarse especial atención durante el ajuste de la dosis de Actiq en pacientes con enfermedad pulmonar obstructiva crónica no severa u otros trastornos médicos que les predispongan a una depresión respiratoria, ya que incluso las dosis normalmente terapéuticas de Actiq pueden reducir el impulso respiratorio hasta provocar insuficiencia respiratoria.
Actiq debe administrarse sólo con precaución extrema en pacientes que puedan ser especialmente sensibles a los efectos neurológicos de la retención de CO2, como aquellos con un aumento constatado de la presión intracraneal o con alteración del estado de conciencia. Los opiáceos pueden enmascarar la evolución clínica de un paciente con lesiones en la cabeza y sólo deben utilizarse si están clínicamente justificados.
El fentanilo puede provocar bradicardia. El fentanilo debe utilizarse con precaución en pacientes con bradiarritmias previas o ya existentes.
Además, Actiq debe administrarse con precaución a pacientes con insuficiencia hepática o renal. No se ha valorado la influencia de la lesión hepática o renal sobre la farmacocinética del medicamento, sin embargo, cuando se administra por vía intravenosa se ha comprobado que el aclaramiento del fentanilo está alterado en las enfermedades hepática y renal debido a la alteración del aclaramiento metabólico y de las proteínas plasmáticas. Después de la administración de Actiq, la función hepática y renal alteradas pueden ambas incrementar la biodisponibilidad del fentanilo ingerido y disminuir su aclaramiento sistémico, lo cual podría conducir a un aumento y prolongación de los efectos opiáceos. Así pues, debe prestarse especial cuidado durante el proceso de titulación de dosis en pacientes con enfermedad hepática o renal moderada o grave.
Se deberían tomar precauciones especiales en pacientes con hipovolemia e hipotensión.
Se debería advertir a los pacientes diabéticos que el medicamento contiene dextratos (los dextratos están compuestos de un 93% de monohidrato de glucosa y un 7% de maltodextrina. El contenido de glucosa total por unidad de dosis es aproximadamente 1,89 gramos por dosis).
Los pacientes con problemas hereditarios de intolerancia a la fructosa, malabsorción de glucosa-galactosa o insuficiencia de sacarasa-isomaltasa no deben tomar este medicamento.
Se recomienda una higiene bucal normal para reducir cualquier lesión potencial a los dientes. Debido a que Actiq contiene aproximadamente 2 gramos de azúcar, su consumo frecuente incrementa el riesgo de caries dental. La sequedad de boca asociada al uso de medicamentos opioides puede contribuir a ese riesgo.
Se recomienda precaución cuando Actiq se administre de forma concomitante con medicamentos que afecten a los sistemas de neurotransmisores serotoninérgicos.
El desarrollo de un síndrome serotoninérgico potencialmente mortal puede aparecer con el uso concomitante de medicamentos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), y con los medicamentos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamino oxidasa [IMAO]). Esto puede ocurrir con la dosis recomendada.
El síndrome serotoninérgico puede incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), anomalías neuromusculares (p. ej., hiperreflexia, descoordinación, rigidez) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea).
Si se sospecha de un síndrome serotoninérgico, debe suspenderse el tratamiento con Actiq.
Uso en deportistas
Este medicamento contiene fentanilo que puede producir un resultado positivo en las pruebas de control de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
El fentanilo se metaboliza por medio del isoenzima CYP3A4 en el hígado y mucosa intestinal. Los potentes inhibidores del CYP3A4 tales como los antibióticos macrólidos (por ejemplo, la eritomicrina), antifungicos azólicos (por ejemplo ketoconazol, itraconazol y fluconazol) y ciertos inhibidores de proteasa, (por ejemplo, ritonavir), pueden incrementar la biodisponibilidad del fentanilo ingerido y pueden también disminuir su aclaramiento sistémico, lo cual puede producir un aumento o prolongación de los efectos opiáceos. Se pueden observar efectos similares después de la ingestión simultánea de zumo de pomelo, cuya actividad inhibidora del CYP3A4 es conocida. Por eso se aconseja precaución si se administra el fentanilo concomitantemente con inhibidores del CYP3A4.
La coadministración con agentes que inducen la actividad 3A4 pueden reducir la eficacia de Actiq.
El uso concomitante de otros depresores del SNC, incluyendo otros opiáceos, sedantes o hipnóticos, anestésicos generales, fenotiazinas, tranquilizantes, relajantes músculo esqueléticos, antihistaminas sedantes y alcohol puede producir efectos depresivos aditivos.
No se recomienda el uso concomitante de agonistas/antagonistas opioides parciales (p.ej. buprenorfina, nalbufina, pentazocina) ya que poseen una elevada afinidad por los receptores opioides con una actividad intrínseca relativamente baja y en consecuencia antagonizan parcialmente el efecto analgésico del fentanilo, pudiendo inducir síntomas de abstinencia en pacientes dependientes de opioides.
La administración concomitante de fentanilo con un fármaco serotoninérgico, como un inhibidor selectivo de la recaptación de serotonina (ISRS), un inhibidor de la recaptación de serotonina y noradrenalina (IRSN) o un inhibidor de la monoamino oxidasa (IMAO), puede aumentar el riesgo del síndrome serotoninérgico, un trastorno potencialmente mortal.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos suficientes sobre el empleo del fentanilo en mujeres embarazadas. Los estudios en animales han demostrado toxicidad en la reproducción (ver sección 5.3). Los analgésicos opiáceos pueden causar depresión respiratoria neonatal. Con un empleo prolongado durante el embarazo existe riesgo de que se produzcan síntomas de abstinencia neonatales. El Actiq no debería usarse durante el embarazo a menos que sea absolutamente necesario.
Se aconseja que no se administre fentanilo durante el parto ya que el fentanilo pasa por la placenta y puede causar depresión respiratoria en el feto. El índice de transferencia de la placenta es 0,44 (relación fetal-maternal: 1,00:2,27).
Lactancica
El fentanilo se excreta a través de la leche materna y puede causar sedación y depresión respiratoria en el lactante. El fentanilo no debe usarse durante la lactancia, no pudiendo reiniciarse la lactancia hasta transcurridos como mínimo 5 días de la última administración de fentanilo.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No obstante, los analgésicos opiáceos pueden perjudicar la capacidad mental y/o física necesaria para la realización de tareas potencialmente peligrosas (p. ej. conducir un coche o utilizar maquinaria). Debe advertirse a los pacientes que no conduzcan ni utilicen maquinaria si sienten somnolencia, mareos, visión borrosa o diplopia mientras toman Actiq.
4.8 Reacciones adversas
Con Actiq deben esperarse las reacciones adversas típicas de los opiáceos. A menudo, éstas cesan o disminuyen en intensidad con el uso continuado de este producto, o con el ajuste del paciente a la dosis más adecuada. No obstante, las reacciones adversas más graves son: depresión respiratoria (que potencialmente conduce a apnea o parada respiratoria), depresión circulatoria, hipotensión y colapso, por este motivo todos los pacientes deben ser estrechamente monitorizados.
Se han notificado, en el uso post-comercialización, reacciones en el lugar de administración, incluyendo sangrado, irritación, dolor y úlceras de las encías.
Debido a que los ensayos clínicos con Actiq han sido diseñados para valorar la seguridad y eficacia en el tratamiento del dolor irruptivo, todos los pacientes tomaban también opiáceos concomitantes, tales como morfina de liberación prolongada o fentanilo transdérmico, para su dolor persistente. De esta manera no es posible distinguir con seguridad los efectos del Actiq solo.
Se han notificado las siguientes reacciones adversas con Actiq y/u otros compuestos que contienen fentanilo provenientes de ensayos clínicos y de la experiencia postcomercialización. Las reacciones adversas se enumeran a continuación según el término preferente de MedDRA por el sistema de clasificación de órganos-sistema y frecuencia (frecuencias se definen como: muy frecuentes >1/10, frecuentes >1/100 a <1/10, poco frecuentes > 1/1.000 a < 1/100, frecuencia no conocida (no puede estimarse a partir de los datos disponibles):
|
Muy frecuentes |
F recuentes |
Poco frecuentes |
Frecuencia no conocida | |
|
Trastornos del sistema inmunitario |
reacción anafiláctica, edema en la lengua, edema en los labios | |||
|
Trastornos del metabolismo y de la nutrición |
anorexia | |||
|
Trastornos psiquiátricos |
confusión, ansiedad, alucinaciones, depresión, labilidad emocional |
sueños anormales, despersonalización, pensamientos anormales, euforia |
insomnio | |
|
Trastornos del sistema nervioso |
somnolenci a, mareo, dolor de cabeza |
pérdida de conciencia, convulsión, vértigo, mioclonus, sedación, parestesia (incluyendo hiperestesia/pareste sia perioral), trastornos de la marcha/incoordina ción, alteración del gusto |
coma, dificultad para hablar | |
|
Trastornos oculares |
Alteraciones de la visión (visión borrosa, diplopía) | |||
|
Trastornos vasculares |
vasodilatación |
enrojecimiento, sofocos | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
disnea |
edema faríngeo, depresión respiratoria | ||
|
Trastornos gastrointestinales |
náuseas, vómitos, estreñimien to, dolor abdominal |
sequedad de boca, dispepsia, estomatitis, afecciones de la lengua (por ejemplo sensación de ardor, úlceras), flatulencia, distensión abdominal |
íleo, úlceras bucales, caries dental, sangrado gingival |
pérdida de piezas dentales, recesión gingival, gingivitis, diarrea |
|
Trastornos de la piel y tejidos subcutáneos |
prurito, sudoración, erupción |
urticaria |
|
Muy frecuentes |
F recuentes |
Poco frecuentes |
Frecuencia no conocida | |
|
Trastornos renales y urinarios |
retención urinaria | |||
|
Trastornos generales y alteraciones en el lugar de la administración |
astenia |
reacciones en el lugar de la aplicación, como sangrado, irritación, dolor y úlceras en las encías, malestar |
fatiga, edema periférico, pirexia, síndrome de abstinencia* | |
|
Exploraciones complementarias |
pérdida de peso | |||
|
Lesiones traumáticas, intoxicaciones y complicaciones |
Lesiones accidentales (por ejemplo caídas) |
*Se han observado síntomas de abstinencia de opioides tales como náuseas, vómitos, diarea, ansiedad, escalofríos, temblor y sudoración con el fentanilo vía bucal
Notificación de Sospechas de Reacciones Adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
Los síntomas de sobredosis con fentanilo son de naturaleza similar a los de fentanilo intravenoso y a los de otros opiáceos, y son una prolongación de sus acciones farmacológicas, siendo los efectos significativos más graves alteración del estado mental, pérdida de conciencia, coma, paro cardiorespiratorio, depresión respiratoria, dificultad respiratoria y fallo respiratorio con resultado de muerte.
El tratamiento inmediato en caso de sobredosis de opiáceos consiste en retirar la unidad de Actiq con ayuda del aplicador si el paciente todavía la tiene en la boca, asegurando la abertura de la vía respiratoria; estimulación física y verbal del paciente; valoración del grado de conciencia, estado ventilatorio y circulatorio; y ventilación asistida (soporte ventilatorio) si es necesario.
Para el tratamiento de una sobredosificación (ingestión accidental) en una persona que nunca haya tomado opiáceos anteriormente, se debe colocar una vía intravenosa y utilizarse naloxona u otros antagonistas opiáceos según esté clínicamente indicado. La depresión respiratoria debida a la sobredosis puede durar más que los efectos de la acción del antagonista opiáceo (p. ej. la semivida de la naloxona varía de 30 a 81 minutos) por lo que puede ser necesaria la administración repetida. Consulte el Resumen de las características del producto del antagonista opiáceo concreto para la información sobre dicho uso.
Para el tratamiento de una sobredosis en pacientes mantenidos con opiáceos, debe colocarse una vía intravenosa. El uso moderado de naloxona u otro antagonista opiáceo puede estar justificado en algunos casos, pero está asociado al riesgo de precipitar la aparición de un síndrome de abstinencia agudo.
Si bien no se ha observado rigidez muscular que interfiera con la respiración después del uso de Actiq, puede manifestarse con fentanilo y otros opiáceos. Si así fuera, debe tratarse con respiración asistida, con un antagonista opiáceo y, como último recurso, con un agente bloqueante neuromuscular.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: analgésicos opiáceos, derivados de fenilpiperidona, código ATC: N02A B03.
El fentanilo, agonista puro opiáceo, actúa principalmente a través de la interacción con los receptores mu-opiáceos situados en el cerebro, la médula espinal y la musculatura lisa. El lugar principal de acción terapéutica es el sistema nervioso central (SNC). El efecto farmacológico clínicamente más útil que produce la interacción del fentanilo con los receptores mu-opiáceos es la analgesia. Los efectos analgésicos del fentanilo están relacionados con el nivel de sustancia activa en sangre, teniendo en cuenta el retraso de entrada y salida del SNC (un proceso con una semivida de 3-5 minutos). En las personas que nunca han recibido opiáceos anteriormente, la analgesia se produce con niveles en sangre de 1 a 2 ng/ml, mientras que niveles de 10-20 ng/ml en sangre provocarían anestesia quirúrgica y depresión respiratoria profunda.
En pacientes con dolor canceroso crónico que reciben dosis estables de opiáceos a intervalos regulares para controlar el dolor persistente, Actiq produjo un alivio significativamente mayor del dolor irruptivo, en comparación con el placebo a los 15, 30, 45 y 60 minutos después de la administración.
Otras acciones secundarias son aumento del tono y una disminución de las contracciones de la musculatura lisa gastrointestinal, lo que provoca la prolongación del tiempo de tránsito gastrointestinal y puede ser el responsable del efecto de estreñimiento de los opiáceos.
Aunque los opiáceos generalmente aumentan el tono de la musculatura lisa del tracto urinario, el efecto global suele variar, y en algunos casos produce urgencia urinaria y dificultad para orinar en otros.
Todos los agonistas del receptor mu-opiáceo, incluido el fentanilo, producen depresión respiratoria dependiente de la dosis. El riesgo de depresión respiratoria es menor en pacientes con dolor y pacientes que reciben terapia crónica con opiáceos, los cuales desarrollan tolerancia a la depresión respiratoria y a otros efectos opiáceos. En los sujetos sin tolerancia, se observan los efectos máximos típicos de tipo respiratorio a los 15-30 minutos después de la administración de Actiq, y pueden persistir durante varias horas.
Como efecto farmacológico secundario adicional se incluye miosis.
Población pediátrica
La experiencia sobre el uso de Actiq en pacientes pediátricos, de edad inferior a 16 años es limitada. En un estudio clínico, 15 pacientes pediátricos (de un total de 38), de edades que oscilaban entre 5 y 15 años, que ya recibían tratamiento de mantenimiento con opioides y padecían dolor irruptivo fueron tratados con Actiq. El estudio fue demasiado reducido para permitir conclusiones sobre la seguridad y la eficacia en este colectivo de pacientes
5.2 Propiedades farmacocinéticas
Introducción general
El fentanilo es altamente lipofílico y puede ser absorbido muy rápidamente a través de la mucosa bucal y más lentamente por la vía gastrointestinal convencional. Está sujeto a un metabolismo hepático e intestinal de primer paso y sus metabolitos no contribuyen a los efectos terapéuticos del fentanilo.
Absorción
La farmacocinética de absorción de fentanilo del Actiq comprende una combinación de una rápida absorción bucal y una más lenta absorción gastrointestinal del fentanilo tragado. Aproximadamente un 25%
de la dosis total de Actiq se absorbe rápidamente por la mucosa bucal. El 75% restante de la dosis se traga y se absorbe lentamente por el tracto gastrointestinal. Alrededor de 1/3 de dicha cantidad (25% de la dosis total) se escapa de la eliminación hepática e intestinal de primer paso y pasa a quedar disponible sistémicamente. La biodisponibilidad absoluta es de un 50% comparado con el fentanilo intravenoso, dividida por partes iguales entre la absorción bucal rápida y la absorción gastrointestinal más lenta. La Cmax oscila de 0,39 a 2,51 ng/ml después de la toma de Actiq (200 microgramos a 1600 microgramos). La Tmax es alrededor de 20 a 40 minutos después de la toma de una unidad de Actiq (fluctuación 20 - 480 minutos).
Distribución
Los datos en animales muestran que el fentanilo se distribuye rápidamente en el cerebro, corazón, pulmones, riñones y bazo con una posterior redistribución más lenta en los músculos y tejido adiposo. La unión a proteínas en plasma del fentanilo es del 80-85%. La principal proteína de unión es la alfa-1-acido-glucoproteína, si bien tanto la albúmina como las lipoproteínas contribuyen en cierta medida. La fracción libre de fentanilo aumenta con la acidosis. El volumen medio de distribución en estado estable (Vee) es de 4 l/kg.
Biotransformación
El fentanilo se metaboliza en el hígado y en la mucosa intestinal como norfentanilo por medio de la isoforma del CYP3A4. El norfentanilo no es activo farmacológicamente en los estudios en animales. Más del 90% de la dosis administrada de fentanilo se elimina por biotransformación en metabolitos inactivos N-desalquilados e hidroxilados.
Eliminación
Menos del 7% de la dosis se excreta inalterada en la orina, y solamente un 1% se excreta inalterada en las heces. Los metabolitos se excretan principalmente en la orina, mientras que la excreción fecal es menos importante. El aclaramiento en plasma total del fentanilo es 0,5 l/hr/kg (fluctuación 0,3-0,7 l/hr/kg). La vida media de eliminación terminal después de la administración de Actiq es de unas 7 horas.
Linealidad/no linealidad
Se ha demostrado la proporcionalidad de la dosis a través del rango disponible de concentraciones (200 a 1600 microgramos) de Actiq.
Población pediátrica
En un estudio clínico, 15 pacientes pediátricos, de edades que oscilaban entre 5 y 15 años, que ya recibían tratamiento de mantenimiento con opioides y padecían dolor irruptivo fueron tratados con Actiq a dosis comprendidas entre 200 mcg y 600 mcg. Los valores del área bajo la curva basados en las concentraciones observadas, fueron dos veces más elevados en los niños de menor edad que en los adolescentes (5,25 frente a 2,65 ng.hr/ml, respectivamente) y cuatro veces más elevados en comparación con los adultos (5,25 frente a 1,20 ng.hr/ml). Sobre la base ajustada según peso, los valores de aclaramiento y volumen de distribución fueron similares en este intervalo de edad.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y carcinogenicidad.
Los estudios de toxicidad del desarrollo embrionario y fetal llevados a cabo en ratas y conejos no evidenciaron malformaciones ni alteraciones del desarrollo inducidas por el fármaco, administrado durante el período de la organogénesis.
En un estudio de fertilidad y desarrollo embrionario temprano, en ratas, se observó un efecto asociado a los machos a altas dosis (300 mcg/kg/día s.c.) y es consistente con los efectos sedantes del fentanilo en estudios animales.
En estudios sobre el desarrollo pre y postnatal en ratas, la tasa de supervivencia de la progenie se redujo significativamente a dosis que causaban toxicidad materna severa. Los hallazgos adicionales en las crías de la generación F1, tras dosis maternales tóxicas, fueron retraso del desarrollo físico, de las funciones
sensoriales, reflejos y comportamiento. Dichos efectos pueden ser indirectos debidos a una alteración de los cuidados maternos y/o disminución de la frecuencia de la lactancia o bien un efecto directo del fentanilo sobre las crías.
Los estudios de carcinogenicidad (bioensayo dérmico alternativo de 26 semanas en ratones transgénicos Tg.AC; estudio de carcinogenicidad subcutánea de 2 años en ratas) con fentanilo no pusieron de manifiesto ningún hallazgo indicativo de potencial oncogénico. La evaluación de los cortes laminares de cerebro del estudio de carcinogenicidad en ratas mostró lesiones cerebrales en los animales tratados con dosis altas de citrato de fentanilo. Se desconoce la relevancia de estos hallazgos para los seres humanos.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Comprimido para chupar:
Dextratos hidratados (conteniendo glucosa)
Acido cítrico anhidro Fosfato disódico anhidro
Aroma artificial de baya (maltodextrina, propilenglicol, aromas artificiales y trietilcitrato) Estearato de magnesio
Goma comestible utilizada para unir el comprimido al aplicador:
Almidón comestible a base de maíz modificado (E 1450)
Azúcar glaseado (sacarosa y almidón de maíz)
Agua purificada
Tinta de impresión:
Agua desionizada
Goma laca blanca desencerada
Propilenglicol
Colorante azul sintético coal tar (E133)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar por debajo de 30°C.
6.5 Naturaleza y contenido del envase
Cada unidad de dosificación de Actiq está contenida en un envoltorio de tipo blister termosellado que consta de una tapa laminada con papel/lámina metálica y un blister termoformado de PVC/Aclar, suministrado en cajas de 3, 6, 15 ó 30 unidades individuales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
¡m
Los comprimidos con sustancia activa residual no deben ser descartados o extraviados.
La eliminación del medicamento utilizado o no utilizado pero que ya no se necesita y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva Pharma B.V.
Swensweg 5, 2031 GA Haarlem Holanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
64.056
|
64 |
057 |
|
64 |
058 |
|
64 |
059 |
|
64 |
060 |
|
64 |
061 |
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 12 Julio 2001 Fecha de la última renovación: 08 Octubre 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
06/2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http: //www.aemps.gob.es/
13 de 13