Zutectra 500 Ui Solucion Inyectable En Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Zutectra 500 UI solución inyectable en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada de 1 ml contiene 500 UI de inmunoglobulina humana contra la hepatitis B.
Proteína humana 150 mg/ml, de la cual por lo menos el 96% es IgG, con un contenido de 500 UI/ml de anticuerpos para el antígeno de superficie del virus de la hepatitis B (HB).
Distribución de subclases de IgG:
|
IgG1: |
59 % |
|
IgG2: |
35 % |
|
IgG3: |
3 % |
|
IgG4: |
3 % |
IgA: contenido máximo, 6.000 microgramos/ml.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
La solución es transparente y de color amarillo pálido o marrón claro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Prevención de la reinfección por el virus de la hepatitis B (VHB) en pacientes adultos negativos para el HbsAg y el ADN del VHB al menos una semana después del trasplante de hígado por insuficiencia hepática inducida por la hepatitis B. Se debe confirmar ADN del VHB negativo al menos en los tres meses previos al THO. Los pacientes deben ser negativos para el HbsAg antes del comienzo del tratamiento.
Si procede, se deberá tener en cuenta el uso concomitante de agentes virostáticos adecuados como patrón para la profilaxis de la reinfección por la hepatitis B.
4.2 Posología y forma de administración
Posología
En los adultos negativos para el ADN del VHB, al menos una semana después del trasplante de hígado, inyecciones subcutáneas de Zutectra semanales o quincenales según las concentraciones mínimas séricas de anti-HB.
Antes del inicio del tratamiento subcutáneo con Zutectra, se debe estabilizarla concentración sérica adecuada de anti-HB con una inmunoglobulina contra la hepatitis B intravenosa hasta una concentración de 300 a 500 UI/l o superior, a fin de garantizar una cobertura adecuada de anti-HB durante la transición desde la posología intravenosa a la subcutánea. Se debe mantener una concentración de anticuerpos > 100 UI/l en los pacientes negativos para el HBsAg y el ADN del VHB.
La dosis se puede determinar individualmente y adaptar a inyecciones subcutáneas de 500 UI a
1.000 UI (en casos excepcionales hasta 1.500 UI) cada semana o quincenalmente según las concentraciones séricas de anti-HB y bajo el criterio del médico responsable. Se debe mantener una concentración de anticuerpos > 100 Ul/l
Se deberá vigilar con regularidad la concentración sérica de anticuerpos anti-HB de los pacientes. La concentración sérica de anticuerpos anti-HB se debe determinar como mínimo cada 2-4 semanas y, según el criterio del médico responsable del tratamiento, al menos cada medio año.
Población pediátrica
La inmunoglobulina contra la hepatitis B no tiene indicaciones adecuadas para su uso en los niños menores de 18 años.
Forma de administración
Solo por vía subcutánea.
Precauciones que se deben tomar antes de manipular o administrar el medicamento La inyección del medicamento por el paciente o por la persona a cargo de su cuidado en un tratamiento domiciliario requiere una formación impartida por un médico con experiencia en la asistencia de pacientes para el tratamiento domiciliario. Se dará instrucciones al paciente o a la persona a cargo de su cuidado acerca de las técnicas de inyección, el mantenimiento de un diario del tratamiento y las medidas que se deben adoptar en caso de acontecimientos adversos graves. Se requiere un periodo de vigilancia suficiente, con una concentración mínima en el suero estable de anti-HB con un valor > 100 Ul/l, así como una pauta de dosificación fija: es necesario cumplir de forma minuciosa con el cronograma de seguimiento de la concentración de anticuerpos anti-HB se debe seguir de forma minuciosa (ver más arriba). Además, el paciente o la persona a cargo de su cuidado deben seguir la técnica de inyección, así como la pauta de administración del fármaco, a fin de garantizar una concentración mínima de anti-HB en el suero con un valor > 100 Ul/l, después de periodos extendidos entre los controles de la concentración.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1 o a las inmunoglobulinas humanas.
Zutectra no debe administrarse por vía intravascular.
4.4 Advertencias y precauciones especiales de empleo
Asegúrese de que Zutectra no se administre en un vaso sanguíneo, por el riesgo de choque.
Si el receptor es portador de HBsAg, no se obtiene ningún beneficio al administrar este medicamento. No existen datos acerca de la eficacia en la profilaxis después de la exposición.
Hipersensibilidad
Las reacciones de hipersensibilidad verdaderas son raras.
Zutectra contiene una pequeña cantidad de IgA. Las personas con una deficiencia de IgA pueden presentar anticuerpos de tipo IgA y pueden tener reacciones anafilácticas después de la administración de componentes hemáticos que contienen IgA. Por lo tanto, el médico debe sopesar la ventaja del tratamiento con Zutectra frente al posible riesgo de reacciones de hipersensibilidad.
En raros casos, la inmunoglobulina contra la hepatitis B humana puede inducir una disminución de la tensión arterial con reacción anafiláctica, incluso en pacientes que han tolerado un tratamiento anterior con inmunoglobulina humana.
Las posibles complicaciones se pueden evitar muchas veces asegurándose que los pacientes:
- no sean sensibles a la inmunoglobulina humana normal, mediante la inyección inicial lenta del medicamento.
- sean vigilados atentamente ante la aparición de cualquier síntoma durante la inyección. En particular, se debe vigilar a los pacientes durante la primera inyección y durante la primera hora después de la primera inyección, cuando no hayan recibido nunca tratamiento con inmunoglobulina humana normal, cuando se les haya cambiado el tratamiento desde otro medicamento alternativo, o cuando haya transcurrido un periodo prolongado desde la inyección anterior, a fin de detectar posibles signos adversos. A los demás pacientes se les debe observar durante al menos 20 minutos después de la administración.
Si hay sospecha de reacciones de tipo alérgico o anafiláctico, es imprescindible interrumpir inmediatamente la inyección. En caso de choque, se deberá administrar el tratamiento médico habitual para el choque.
Interferencia con los análisis serológicos
Después de la inyección de inmunoglobulina, el aumento pasajero de los diversos anticuerpos transferidos pasivamente a la sangre del paciente puede dar lugar a un resultado falso positivo en los análisis serológicos.
La transmisión pasiva de anticuerpos contra antígenos eritrocitarios, p. ej., A, B, D, puede interferir con algunos análisis serológicos de anticuerpos eritrocitarios, por ejemplo, la prueba de antiglobulina directa (DAT, prueba directa de Coombs).
Agentes transmisibles
Entre las medidas habituales para evitar infecciones resultantes de la utilización de medicamentos preparados a partir de sangre o plasma humanos se cuentan la selección de los donantes, la selección de donaciones individuales y mezclas de plasma para marcadores específicos de infección y la inclusión de etapas de fabricación eficaces para la desactivación o eliminación del virus. A pesar de esto, no se puede excluir totalmente la posibilidad de transmisión de agentes infecciosos al administrar medicamentos preparados a partir de sangre o plasma humanos. Esto también es válido para virus desconocidos o emergentes, y otros patógenos.
Las medidas tomadas se consideran eficaces para los virus con envoltura, tales como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), y para el virus de la hepatitis A, sin envoltura. Las medidas adoptadas pueden tener un valor limitado frente a los virus sin envoltura, como el parvovirus B19.
Existe una experiencia clínica tranquilizadora respecto a la ausencia de transmisión de la hepatitis A o del parvovirus B19 con las inmunoglobulinas, y también se supone que el contenido de anticuerpos contribuye de manera importante a la seguridad vírica.
Se recomienda encarecidamente que cada vez que se administre Zutectra a un paciente, se tome nota del nombre del paciente y del número del lote del medicamento, con el fin de mantener un vínculo entre el paciente y el lote del medicamento. Esta recomendación también debe aplicarse para el registro en el diario del tratamiento durante la autoadministración del medicamento en un tratamiento domiciliario.
4.5 Interacción con otros medicamentos y otras formas de interacción
Vacunas de virus atenuados vivos
La administración de inmunoglobulina puede interferir en la aparición de una respuesta inmunitaria a las vacunas de virus atenuados vivos, tales como la antirrubéola, antiparotiditis, antisarampionosa y antivaricela, durante un periodo de tres meses. Después de la administración de este medicamento, debe transcurrir un intervalo de por lo menos tres meses antes de una vacunación con vacunas de virus atenuados vivos.
La inmunoglobulina contra la hepatitis B humana se debe administrar tres o cuatro semanas después de la vacunación con dicha vacuna atenuada viva; en caso de que la administración de inmunoglobulina contra la hepatitis B humana sea imprescindible en un plazo de tres a cuatro semanas después de la vacunación, se deberá realizar una revacunación tres meses después de la administración de inmunoglobulina contra la hepatitis B humana.
4.6 Fertilidad, embarazo y lactancia
Embarazo
La seguridad de este medicamento para su uso en el embarazo humano no se ha establecido en ensayos clínicos controlados; por lo tanto, sólo debe administrarse con precaución a las mujeres embarazadas. La experiencia clínica con inmunoglobulinas sugiere que no deben esperarse efectos perjudiciales en el transcurso del embarazo, o sobre el feto y el neonato.
Lactancia
La seguridad de este medicamento durante la lactancia no se ha establecido en ensayos clínicos controlados; por lo tanto, sólo debe administrarse con precaución a mujeres lactantes.
Fertilidad
No se han realizado estudios relativos a la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de la inmunoglobulina contra la hepatitis B sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La mayoría de las reacciones adversas al fármaco fueron de naturaleza leve o moderada. En casos aislados, las inmunoglobulinas humanas normales pueden ocasionar un shock anafiláctico.
Tabla de reacciones adversas
Se han notificado las siguientes reacciones adversas basadas en 4.810 aplicaciones subcutáneas de Zutectra durante cuatro ensayos clínicos completos y en 1.006 aplicaciones en un estudio de seguridad post-comercialización (PASS, por sus siglas en inglés) no intervencionista.
Las reacciones adversas al fármaco comunicadas en cuatro ensayos se resumen y clasifican de acuerdo con la clasificación por órganos y sistemas y frecuencias de MedDRA, a continuación. Se ha evaluado la frecuencia por inyección usando los siguientes criterios: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Los efectos se agruparon por clases de órganos y sistemas, bajo los encabezados médicos pertinentes.
|
sistemas de MedDRA | ||
|
Infecciones e infestaciones |
Nasofaringitis |
Raras* |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Raras* |
|
Trastornos del sistema nervioso |
Cefalea |
Poco frecuentes |
|
Trastornos cardiacos |
Palpitaciones, molestias cardiacas |
Raras* |
|
Trastornos vasculares |
Hipertensión |
Raras* |
|
Trastornos respiratorios, torácicos y mediastínicos |
Dolor orofaríngeo |
Raras* |
|
Trastornos gastrointestinales |
Dolor abdominal superior |
Poco frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, exantema |
Raras* |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Espamos musculares |
Raras* |
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de la inyección |
Frecuentes |
|
Fatiga, cansancio |
Raras* | |
|
* informes de casos únicos | ||
Descripción de reacciones adversas seleccionadas
Las reacciones en el lugar de la inyección incluyen efectos como dolor, urticaria en la zona de inyección, hematoma y eritema.
Reacciones adversas observadas con otros preparados de inmunoglobulinas humanas
Con inmunoglobulinas normales pueden producirse a veces reacciones adversas como escalofríos, cefalea, fiebre, vómito, reacciones alérgicas, náuseas, artralgia, disminución de la tensión arterial y dolor lumbar moderado.
Raramente, las inmunoglobulinas normales humanas pueden producir una disminución súbita de la tensión arterial y, en casos aislados, choque anafiláctico, incluso cuando el paciente no ha mostrado ninguna hipersensibilidad ante una administración anterior.
Reacción local en el lugar de la inyección
Hinchazón, dolor, enrojecimiento, induración, calor local, picor, magulladuras y erupción.
Para la seguridad con respecto a los agentes transmisibles, ver sección 4.4.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se desconocen las consecuencias de una sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: sueros inmunitarios e inmunoglobulinas, inmunoglobulinas específicas, código ATC: J06BB04
La inmunoglobulina contra la hepatitis B consta principalmente de inmunoglobulina G (IgG) con un contenido específicamente elevado de anticuerpos frente al antígeno de superficie del virus de la hepatitis B (HBs).
Eficacia clínica y seguridad
En el ensayo clínico abierto, prospectivo, con un solo grupo se incluyó a 23 receptores de trasplante de hígado que habían estado recibiendo profilaxis con inmunoglobulina contra la hepatitis B por vía intravenosa y después se cambió su tratamiento a Zutectra por vía subcutánea. La dosis subcutánea semanal fue de 500 UI para los pacientes con un peso corporal < 75 kg (se permitió un aumento de la dosis hasta 1000 UI, en caso de que fuera necesario, desde el punto de vista médico, mantener una concentración de seguridad de > 100 UI) y 1000 UI para los pacientes con un peso corporal > 75 kg. Dos pacientes recibieron una dosis más alta, y otros dos, una dosis más baja que la recomendada por la pauta posológica basada en el peso. Se mantuvieron concentraciones mínimas séricas de anti-HB de 100 UI/l y más (criterio principal de valoración de la eficacia) para todos los pacientes durante el período de ensayo de 18 a 24 semanas. El margen de seguridad de100 UI/l es el nivel de prevención eficaz aceptado generalmente frente a la reinfección por el VHB en los pacientes con transplante de hígado con riesgo. Ningún paciente sufrió una reinfección por el VHB. La autoadministración fue posible en la mayoría de los pacientes.
La concentración media en el suero de anti-HBs antes del cambio era de 393 ± 139 UI/ml. Todos los pacientes recibieron medicamento antivírico.
Utilizando el método Clopper Pearson, el índice de fracaso después de 18 semanas fue del 0% en los pacientes del grupo con intención de tratar (I.C. 95%: [0, 14,8%]). Se halló también un índice de fracaso del 0% en la fase de ampliación facultativa (semana 24) (I.C. 95%: [0; 20,6%])
Los objetivos del ensayo clínico prospectivo, abierto y de un solo grupo fueron la investigación de la factibilidad de la autoadministración en el domicilio (incuido el cumplimiento del paciente), la eficacia y la seguridad de la administración por vía subcutánea de Zutectra en una población estable de pacientes durante el tratamiento a largo plazo para la profilaxis contra la reinfección de un trasplante de hígado en 66 pacientes. Todos los pacientes incluidos en este estudio tuvieron que pasar por un periodo de entrenamiento de, al menos, 29 días y la autoadministración pudo comenzar, como mínimo, el día 36. Con excepción de 6 pacientes que se retiraron antes del día 36, todos los pacientes completaron la administración hospitalaria y la autoadministración en el domicilio. Ningún paciente interrumpió prematuramente el ensayo debido a la incapacidad para cumplir con la autoadministración en el domicilio. Durante una fase de tratamiento de 48 semanas, se determinaron las concentraciones séricas constantes de anticuerpos HBs > 100 UI/l en todos los pacientes y en todas las evaluaciones, encontrándose valores medios de 312,0 ± 103,5 UI/l al final del periodo de tratamiento. En total, 53 de 66 pacientes (80,3%) utilizaron medicaciones antivirales y 13 pacientes recibieron monoterapia con Zutectra durante este estudio. No se notificó reinfección de hepatitis B y ningún paciente fue positivo para el antígeno de superficie de la hepatitis B (HBsAg) durante el periodo de tratamiento de 48 semanas. No se notificaron reacciones adversas graves relacionadas con la medicación del estudio. No se observaron casos de muertes durante el estudio.
El objetivo del ensayo clínico prospectivo, abierto y de un solo grupo fue la investigación de la eficacia y la seguridad de Zutectra para la prevención de la reinfección con el virus de la hepatitis B (VHB) > una semana después del trasplante ortotópico de hígado en pacientes negativos para el HbsAg y el ADN del VHB. En el momento del trasplante, 21 pacientes (42,9%) dieron positivo en las pruebas del VHD, excluyéndose de la participación en el estudio a los pacientes con un resultado positivo en las pruebas del VIH y del VHC. A 49 pacientes se les administraron inyecciones subcutáneas de Zutectra de 500 UI (1 ml) o de 1.000 UI (2 ml) (adaptación de la dosis en casos excepcionales hasta 1.500 UI) cada semana o quincenalmente según las concentraciones mínimas sérica de anti-HB. Durante el periodo de seis meses del estudio no se produjo ningún fracaso terapéutico. En todos los pacientes se midió una concentración sérica de anti-HB por encima de la concentración mínima de seguridad de >100 UI/l en todos los puntos temporales, con independencia de la forma de administración (por el investigador, por la persona a cargo del cuidado del paciente o por el paciente mismo), de la pauta posológica (500 UI, 1000 UI, 1500 UI) y de los intervalos del tratamiento. No se observaron signos clínicos de reinfección por el VHB, y ningún paciente dio positivo en la prueba del HBsAg ni en la del ADN del VHB durante el estudio, lo que confirma que la administración subcutánea de Zutectra como parte del tratamiento combinado con la terapia virostática del VHB 8 - 18 días después del trasplante ortotópico de hígado proporciona una protección eficaz contra la reinfección por el VHB. Se notificó una reacción adversa no grave relacionada con Zutectra (hematoma en el lugar de la inyección). No se observaron casos de muerte durante el estudio.
En el estudio de seguridad post-comercialización (PASS 978) no intervencionista se reclutaron 61 pacientes adultos a los > 6 meses después de un trasplante de hígado para evaluar la insuficiencia hepática inducida por la hepatitis B. El objetivo era evaluar el nivel de cumplimiento de los pacientes que utilizaron Zutectra por vía subcutánea como autotratamiento domiciliario para prevenir la reinfección de la hepatitis B. Los pacientes fueron tratados con Zutectra de acuerdo con la información y la posología indicadas en el RCP. Se pudo demostrar el cumplimiento de acuerdo con los niveles séricos de anti-HBs en 57 (de 61) pacientes (93%), sin valores inferiores a 100 UI/l y con un nivel sérico medio de anti-HBs de 254,3 UI/l en la última visita. En total, 42 de 61 pacientes (68,9%) utilizaron la medicación antiviral y 19 pacientes recibieron la monoterapia con Zutectra durante este estudio. No se produjo ningún fracaso del tratamiento definido como positivo para el ADN del VHB y las determinaciones de HBsAg se encontraron durante todo el periodo de observación. No se observó reinfección. No se notificaron reacciones adversas graves. No se observaron casos de muerte durante el estudio.
5.2 Propiedades farmacocinéticas
Distribución
Zutectra se absorbe lentamente en la circulación del receptor y alcanza un máximo después de un periodo de dos a siete días.
Biotransformación
La IgG y los complejos de IgG se descomponen en el sistema reticuloendotelial.
Eliminación
Zutectra tiene una semivida de unas tres a cuatro semanas. Esta semivida puede variar de un paciente a otro.
5.3 Datos preclínicos sobre seguridad
Las inmunoglobulinas son constituyentes normales del organismo humano; por lo tanto, la prueba de toxicidad en especies heterólogas no es pertinente.
En un ensayo de tolerancia local en conejos, no hubo indicios de irritación atribuible a Zutectra.
No se ha llevado a cabo ningún otro ensayo no clínico.
6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Glicina
Agua para inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
No se pueden añadir otras preparaciones a la solución de Zutectra, puesto que cualquier cambio en la concentración de electrolitos o del pH puede dar como resultado la precipitación o desnaturalización de las proteínas.
6.3 Periodo de validez
2 años.
La solución debe administrarse inmediatamente después de abrir la jeringa.
6.4 Precauciones especiales de conservación
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Conservar el envase en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Un ml de solución en una jeringa precargada (vidrio de tipo I) con un tapón (de bromobutilo) y una cápsula de cierre de la punta (caucho de bromobutilo).
Envase con cinco jeringas en un envase blíster.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Este medicamento debe estar a temperatura ambiente (aprox. 23° a 27°C) antes de su empleo.
La solución puede variar desde incolora a amarillo pálido, hasta marrón claro.
Las soluciones que estén turbias o tengan depósitos no deben utilizarse.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Biotest Pharma GmbH Landsteinerstrasse 5 D-63303 Dreieich Alemania
Tel.: + 49 6103 801-0
Fax: + 49 6103 801-150 / + 49 6103 801-727
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/600/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN 30/11/2009 / 16/09/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Biotest AG Landsteinerstr. 5 D-63303 Dreieich Alemania
Nombre y dirección del fabricante responsable de la liberación de los lotes
Biotest Pharma GmbH Landsteinerstrasse 5 D-63303 Dreieich Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
• Liberación oficial de lotes
De conformidad con el Artículo 114 de la Directiva 2001/83/CE modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Zutectra 500 UI solución inyectable en jeringa precargada Inmunoglobulina humana contra hepatitis B
2. PRINCIPIO(S) ACTIVO(S)
1 ml contiene:
Proteína humana 150 mg, de la cual por lo menos el 96 % es IgG, con un contenido de 500 UI de anticuerpos para el antígeno de superficie del virus de la hepatitis B (HB).
Distribución de subclases de IgG:
59 % de IgG1, 35 % de IgG2, 3 % de IgG3, 3 % de IgG4 IgA: contenido < 6.000 microgramos/ml
3. LISTA DE EXCIPIENTES
Excipientes: glicina, agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 5 jeringas precargadas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Únicamente para inyección por vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
La solución debe administrarse inmediatamente después de abrir la jeringa.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar.
Conservar el envase en el embalaje exterior para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Biotest Pharma GmbH Landsteinerstr. 5 D-63303 Dreieich Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/600/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Zutectra 500 UI
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLISTER
1. NOMBRE DEL MEDICAMENTO
Zutectra 500 UI inyectable Inmunoglobulina humana contra la hepatitis B Vía subcutánea
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Biotest Pharma GmbH
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
JERINGA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Zutectra 500 UI inyectable Inmunoglobulina humana contra la hepatitis B Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
500 UI
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Zutectra 500 UI solución inyectable en jeringa precargada
Inmunoglobulina humana contra la hepatitis B
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Zutectra y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Zutectra
3. Cómo usar Zutectra
4. Posibles efectos adversos
5. Conservación de Zutectra
6. Contenido del envase e información adicional
7. Cómo inyectarse Zutectra por sí mismo o por la persona a cargo de su cuidado
1. Qué es Zutectra y para qué se utiliza Qué es Zutectra
Zutectra contiene anticuerpos contra al virus de la hepatitis B, que son las sustancias defensivas del propio organismo para protegerle de la hepatitis B. La hepatitis B es una inflamación del hígado producida por el virus de hepatitis B.
Para qué se utiliza Zutectra
Zutectra se utiliza para prevenir la reinfección de la hepatitis B en los adultos a los que se ha realizado un trasplante de hígado hace por lo menos 1 semana, porque han sufrido una insuficiencia hepática producida por la hepatitis B.
2. Qué necesita saber antes de empezar a usar Zutectra No use Zutectra
- si es alérgico a la inmunoglobulina humana o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Una reacción alérgica puede consistir en un jadeo súbito, dificultad para respirar, pulso acelerado, hinchazón de los párpados, la cara, los labios, la garganta o la lengua, erupción cutánea o picor.
Zutectra es únicamente para inyección subcutánea (debajo de la piel). La inyección en una vena o en un vaso sanguíneo puede producir un choque alérgico.
Advertencias y precauciones
Informe a su médico o profesional del sector sanitario antes del tratamiento
- Si le han informado de que posee anticuerpos contra las inmunoglobulinas de tipo IgA en la sangre. Esto es muy infrecuente y puede producir reacciones alérgicas.
Puede que sea alérgico a las inmunoglobulinas (anticuerpos) sin saberlo, incluso si ha tolerado tratamientos anteriores con inmunoglobulinas humanas. Especialmente si no tiene suficientes inmunoglobulinas de tipo IgA en la sangre. Pueden producirse reacciones alérgicas, como una disminución súbita de la tensión arterial o un choque.
Se le observará atentamente durante la primera inyección con Zutectra y poco tiempo después,
para asegurarse de que usted no sufre una reacción. Si presenta una reacción alérgica a Zutectra, la inyección se interrumpirá inmediatamente. Informe a su médico o profesional sanitario inmediatamente si advierte alguna reacción durante la inyección con Zutectra.
Si resulta ser positivo para el antígeno HBs, no recibirá Zutectra, puesto que no existe ninguna ventaja en que se le administre este medicamento. Su médico podrá explicarle esto.
Por su propia seguridad, se vigilarán regularmente sus concentraciones de anticuerpos.
Posible interferencia con los análisis de sangre
Zutectra podría afectar a los resultados de determinados análisis de sangre (pruebas serológicas). Informe a su médico acerca de su tratamiento con Zutectra antes de cualquier análisis de sangre.
Información sobre el material de partida de Zutectra y la posibilidad de transmisión de agentes infecciosos:
El material de partida o con lo que se fabrica Zutectra es plasma sanguíneo humano (ésta es la parte líquida de la sangre).
Cuando se fabrican medicamentos a partir de sangre o plasma humanos, se ponen en práctica ciertas medidas para evitar la transmisión de infecciones a los pacientes. Entre otras:
- Una selección cuidadosa de donantes de sangre y de plasma para garantizar que se excluya a quienes presenten riesgo de portar infecciones.
- El análisis de cada donación y las mezclas de plasma, en busca de signos de virus o infecciones. Los fabricantes de estos medicamentos incluyen también etapas en el procesado de la sangre o del plasma que pueden desactivar o eliminar los virus. A pesar de estas medidas, no se puede excluir totalmente la posibilidad de transmisión de una infección cuando se administran medicamentos preparados a partir de sangre o plasma humanos. Esto también es válido para cualquier virus desconocido o de aparición reciente, u otros tipos de infecciones.
Las medidas tomadas se consideran eficaces para los virus con envoltura, tales como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, y para el virus sin envoltura de la hepatitis A. Las medidas adoptadas pueden ser de valor limitado frente a los virus sin envoltura, como el virus parvovirus B19 (agente causal del eritema infeccioso).
Las inmunoglobulinas como Zutectra no han sido relacionadas con las infecciones por hepatitis A o por el parvovirus B19 posiblemente porque los anticuerpos contra estas infecciones, que el producto contiene, ofrecen protección.
Se recomienda encarecidamente que, cada vez que se utilice Zutectra (tanto en el hospital como en un tratamiento en el domicilio), se tome nota del nombre del paciente y del número del lote del medicamento, con el fin de mantener un registro de los lotes utilizados.
Uso de Zutectra con otros medicamentos
Informe a su médico o profesional del sector sanitario si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Vacunaciones
Zutectra puede reducir la eficacia de algunas vacunas (sarampión, rubéola, paperas, varicela) durante un periodo de hasta 3 meses.
Puede que tenga que esperar por lo menos 3 meses después de la última inyección de Zutectra antes de que pueda recibir vacunas con microorganismos vivos atenuados.
Informe a su médico acerca de su tratamiento con Zutectra antes de cualquier vacunación.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o profesional sanitario antes de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de Zutectra sobre su capacidad para conducir o utilizar máquinas es nula o insignificante.
3. Cómo usar Zutectra
Zutectra está destinado a inyección subcutánea (debajo de la piel). El contenido de una jeringa está destinado únicamente a un solo uso. No inyectar en un vaso sanguíneo.
En la mayoría de los casos, su médico o enfermera le administrará la inyección. Sin embargo, si sus concentraciones de anticuerpos son suficientes y tiene una pauta de dosis fija, usted o la persona a cargo de su cuidado pueden recibir instrucciones para aplicarse la inyección en el domicilio (ver a continuación).
Para llevar un registro de sus inyecciones de Zutectra se recomienda encarecidamente usar el diario del tratamiento. Su médico le explicará cómo usarlo.
La dosis se puede determinar individualmente y adaptar de 500 UI hasta 1.000 UI (en casos excepcionales hasta 1.500 UI) semanales o quincenales. La dosis dependerá de su estado. Su médico comprobará regularmente su estado de salud y le informará sobre la cantidad y la frecuencia con la que debe utilizar Zutectra.
Inyección por sí mismo o por la persona a cargo de su cuidado
Puede inyectarse Zutectra a sí mismo sin ayuda de su médico, si ha recibido instrucciones para hacer esto. Si se está administrando Zutectra por sí mismo, lea detenidamente las instrucciones en la sección “Cómo inyectarse Zutectra por sí mismo o por la persona a cargo de su cuidado”.
Se debe dejar que Zutectra adquiera la temperatura ambiente (aproximadamente entre 23°C y 27°C) antes de su uso.
Si usa más Zutectra del que debe
Se desconocen las consecuencias de una sobredosis. Sin embargo, si ha utilizado una dosis mayor de Zutectra que lo que le recetaron, contacte inmediatamente con su médico, profesional del sector sanitario o farmacéutico para que le aconseje.
Si olvidó usar Zutectra
No se administre una dosis doble para compensar las inyecciones olvidadas. Hable con su médico acerca de cómo administrarse las dosis. Su médico le informará sobre la cantidad y la frecuencia con la que debe usar Zutectra.
Asegúrese de que utiliza Zutectra como se le ha recetado y como le indicó su médico, a fin de evitar el riesgo de una reinfección por hepatitis B.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
La mayoría de los efectos adversos observados con Zutectra fueron de tipo leve a moderado. En casos muy raros, las inmunoglobulinas humanas normales pueden provocar una reacción alérgica grave.
Si advierte cualquiera de los efectos siguientes, interrumpa la inyección e informe a su médico inmediatamente:
- erupción cutánea,
- picor,
- silbido al respirar,
- dificultad para respirar,
- hinchazón de los párpados, la cara, los labios, la garganta o la lengua,
- tensión arterial baja, pulso acelerado
Puede tratarse de una reacción alérgica o de una reacción alérgica grave (choque anafiláctico).
En caso de producirse algún acontecimiento adverso después de la inyección, hable con su médico inmediatamente.
Se han comunicado los siguientes efectos adversos con Zutectra:
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Reacciones en el lugar de la inyección: dolor, urticaria en la zona de la inyección, hematoma (una acumulación de sangre en el tejido debajo de la piel), enrojecimiento de la piel
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Cefalea (dolor de cabeza)
- dolor abdominal superior (desde el pecho hasta el ombligo)
Además se han comunicado las siguientes reacciones una sola vez:
- cansancio (fatiga)
- tensión arterial alta (hipertensión)
- inflamación de la nariz y la garganta (nasofaringitis)
- espasmo muscular
- reacciones alérgicas (hipersensibilidad)
- anomalías en el ritmo cardiaco (palpitaciones), molestias cardiacas
- prurito, erupción
- dolor en la boca y la garganta
Con otras preparaciones de inmunoglobulina humana se han comunicado los siguientes síntomas adicionales:
- escalofríos
- cefalea
- mareo
- fiebre
- vómito
- reacciones alérgicas leves
- náuseas (necesidad urgente de vomitar)
- dolor articular
- baja tensión arterial
- dolor moderado de espalda baja (zona lumbar)
Pueden producirse las siguientes reacciones locales en el lugar de la inyección: hinchazón, dolor, enrojecimiento, endurecimiento de la piel, calor local, picor, magulladuras y erupción.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, profesional del sector sanitario o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Zutectra
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el embalaje exterior y en la etiqueta de la jeringa después de CAD. La fecha de caducidad es el último día del mes que se indica.
- Conservar y transportar refrigerado (entre 2°C y 8°C).
- No congelar.
- Conservar el envase en el embalaje exterior para protegerlo de la luz.
- La solución se debe administrar inmediatamente después de abrir la jeringa.
- No utilice Zutectra si advierte que la solución está turbia o tiene partículas.
- La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. Una vez que haya completado la inyección, deseche rápidamente todas las agujas, jeringas y recipientes de vidrio vacíos, en un recipiente destinado a objetos punzantes que se le ha suministrado.
6. Contenido del envase e información adicional Composición de Zutectra
- El principio activo es inmunoglobulina contra la hepatitis B humana 500 UI/ml.
- Zutectra contiene 150 mg/ml de proteína plasmática humana, de los cuales por lo menos el 96% es inmunoglobulina G (IgG). El contenido máximo de inmunoglobulina A (IgA) es
6.000 microgramos/ml.
- Los demás componentes son glicina y agua para inyectables.
Aspecto del producto y contenido del envase
Zutectra se presenta en forma de solución inyectable suministrada en jeringas precargadas (500 UI/ml; envase con cinco unidades en un blíster). El color de la solución puede variar desde incolora hasta amarillo pálido o marrón claro.
Una jeringa precargada de 1 ml de Zutectra contiene 500 UI. Zutectra se suministra en un tamaño de envase que contiene 5 jeringas precargadas, cada una de ellas en un envase de tipo blíster.
Titular de la autorización de comercialización y responsable de la fabricación
Biotest Pharma GmbH
Landsteinerstrasse 5 D-63303 Dreieich Alemania
Tel.: + 49 6103 801-0
Fax: + 49 6103 801-150 y -727
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Infarama bvba Costermansstede 1 B-1850 Grimbergen Tél/Tel: + 32 22709522 |
Lietuva Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0 |
|
Etarapun AHTHCEH Epara Ceangnc Etarapna OOfl Ya. „CBeTH HBaH PnacKH” 33-35 Co^na 1606 Tea.: + 359 2 953 1224 |
Luxembourg/Luxemburg Biotest AG Landsteinerstr. 5 D-63303 Dreieich Tél/Tel: + 49 6103 801-0 |
|
Ceská republika Reg-Pharm spol.s.r.o. Fialková 45 CZ-10600 Praha 10 Tel: + 420 2 7265 4004 |
Magyarország Biotest Hungaria Kft. Torbágy u. 15/A H-2045 Tórókbálint Tel.: + 36 23 511 311 |
|
Danmark Unimedic Pharma AB Box 6216 SE-102 34 Stockholm Tlf:+ 46 10 130 99 80 |
Malta Rodel Ltd 55, Ravina Triq ir-Russett MT-Kappara SGN 4432 Tel: + 356 27 386221 |
|
Deutschland Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0 |
Nederland Infarama bvba Costermansstede 1 B-1850 Grimbergen Tel: + 32 22709522 |
|
Eesti Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0 |
Norge Unimedic Pharma AB Box 6216 SE-102 34 Stockholm Tlf:+ 46 10 130 99 80 |
|
EXXáda Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tqk: + 49 6103 801-0 |
Osterreich Biotest Austria GmbH Einsiedlergasse 58 A-1050 Wien Tel: + 43 1 545 15 61-0 |
|
España Biotest Medical, S.L.U. C/ Frederic Mompou, 5 - 6° 3a A ES-08960 Sant Just Desvern Barcelona Tel: +34 935 952 661 |
Polska Nobipharm Sp. Z.o.o. ul Rydygiera 8 PL-01-793 Warszawa Tel.: + 48 22 8322638 |
|
France Biotest AG |
Portugal SPCare Especialidades Farmacéuticas, Lda |
|
Landsteinerstrasse 5 D-63303 Dreieich Tél: 00800 98832872 |
Rua Luciano Cordeiro, n° 123, 1° dto. PT-1050 139 Lisboa Tel: + 351 21 193 14 20 |
|
Hrvatska Medical Intertrade d.o.o. Dr. Franje Tudjmana 3 HR-10431 Sveta Nedelja Tel: + 385 1 333 6036 |
Romania Besmax Pharmaceutical Distribution S.R.L. 61A Drumul Plaiul Sarului Street, Room 5 013982 Bucharest, District 1 - RO Tel: + 40 743 207 205 |
|
Ireland Aquilant Pharmaceuticals United Drug House, Magna Drive, Magna Business Park, Citywest Road IRL-Dublin 24 Tel: + 353 1 404 8344 |
Slovenija Lab Consulting d.o.o. Ljubljanska cesta 13 B 1236 Trzin Tel: + 386 1 830 80 50 |
|
Ísland Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Sími: + 49 6103 801-0 |
Slovenská republika Reg-Pharm spol.s.r.o. Fialková 45 CZ-10600 Praha 10 Tel: + 420 2 7265 4004 |
|
Italia Biotest Italia S.r.l. Via Leonardo da Vinci 43 I-20090 Trezzano sul Naviglio Tel: + 39 02 4844 2951 |
Suomi/Finland Unimedic Pharma AB Box 6216 SE-102 34 Stockholm Puh/Tel: + 46 10 130 99 80 |
|
Kórcpog AKHI nANAriQTOY & YIOI ATA r. KPANIAIQTH T. 0. 22578 1522 AEYKQIIA K Y n P O I TpL + 357 22 611 038 |
Sverige Unimedic Pharma AB Box 6216 SE-102 34 Stockholm Tel: + 46 10 130 99 80 |
|
Latvija Biotest AG Landsteinerstrasse 5 D-63303 Dreieich Tel: + 49 6103 801-0 |
United Kingdom Biotest (UK) Ltd. First Floor, Park Point, 17 High Street, Longbridge Birmingham B31 2UQ -UK Tel: + 44 121 733 3393 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
7. Cómo inyectarse Zutectra por sí mismo o por la persona a cargo de su cuidado
Estas instrucciones están destinadas a explicar cómo inyectar Zutectra. Lea las instrucciones detenidamente y sígalas paso a paso. El médico o su asistente le enseñarán el proceso de administración.
No intente inyectar Zutectra hasta que esté seguro de que comprende cómo preparar la solución inyectable y administrar la inyección.
Información general:
- Mantenga las jeringas y la unidad para la eliminación de la jeringa lejos del alcance de los niños; guarde bajo llave las reservas si es posible.
- Intente ponerse la inyección a la misma hora del día. Esto hace que sea más fácil de recordar.
- Compruebe siempre dos veces la dosis.
- La solución debe estar a temperatura ambiente antes de su uso.
- Abra cada jeringa únicamente cuando esté preparado para una inyección. Debe administrar la inyección inmediatamente después de la apertura de la jeringa.
- El color de la solución puede variar desde incolora hasta amarillo pálido o hasta marrón claro.
No utilice soluciones que estén turbias o tengan partículas.
- Este medicamento no debe mezclarse con otros medicamentos.
Antes de la inyección:
1. Lávese las manos. Es importante tener las manos y los elementos que utilice tan limpios como sea posible.
2. Disponga a su alcance todo lo que necesite antes de empezar. Busque un sitio limpio donde pueda extender todos los objetos que va utilizar:
- dos gasas con alcohol,
- una jeringa de Zutectra,
- una aguja apropiada para la inyección subcutánea.
Advierta que el envase no contiene las gasas con alcohol ni las agujas y que debe aportarlas usted mismo.
3. Antes de preparar la inyección, decida dónde se va a inyectar. Debe inyectarse Zutectra en la capa grasa situada entre la piel y el músculo (alrededor de 8 a 12 mm debajo de piel). Los mejores lugares para las inyecciones son las partes del cuerpo en que la piel es flácida y suave, por ejemplo, en el abdomen, los brazos, los muslos o las nalgas, y lejos de las articulaciones, los nervios o los huesos.
Importante: No elija ninguna zona donde pueda sentir masas, bultos, nódulos firmes, dolor o en una zona que esté decolorada, hundida, cicatrizada, o donde la piel se haya rasgado. Informe al médico o al profesional sanitario acerca de éstos o de cualquier otro problema inusual que pueda hallar. Se debe cambiar el lugar de la inyección en cada aplicación. Si algunas zonas son demasiado difíciles de alcanzar para usted, puede que necesite que otra persona lo ayude con estas inyecciones.
4. Prepare la jeringa de Zutectra:
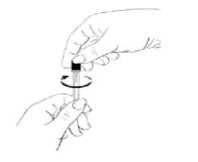
- Extraiga la jeringa del envase.
- Examine detenidamente la solución. Debe ser transparente y no contener partículas. Si la solución está decolorada, turbia o contiene partículas, deséchela y vuelva a comenzar con una jeringa nueva.
- Retire la cápsula de cierre de protección de la
Saque la aguja de su envase estéril y acople la aguja a la jeringa.
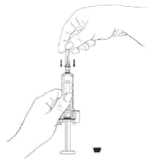
5. Expulse cualquier burbuja de aire que pueda haber en la jeringa.
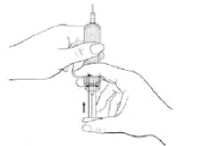
Sostenga la jeringa con la aguja apuntando hacia arriba, y golpee suavemente con los dedos la jeringa hasta que el aire haya llegado a la punta. Oprima el émbolo con cuidado hasta que las burbujas de aire hayan desaparecido.
Inyección
1. Elija el lugar en el que va a aplicar la inyección y anótelo en el diario.
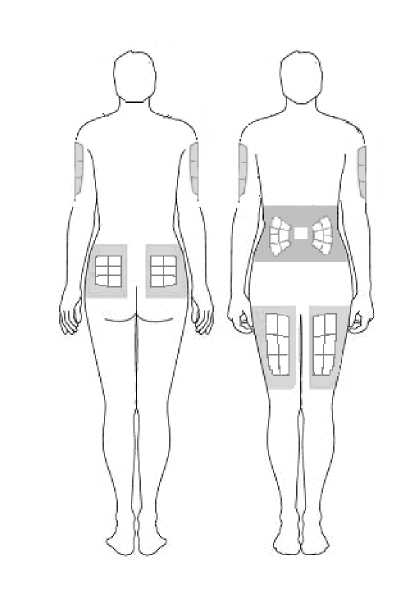
Abdomen (estómago): No utilice la zona que está a menos de 2,5 cm del ombligo. Evite utilizar la zona de la línea de la cintura, porque la fricción puede irritar el sitio de inyección. Evite las cicatrices quirúrgicas. Éste es probablemente el sitio más sencillo para inyectar si lo está haciendo por sí mismo.
Muslos: Utilice las zonas medias y exteriores, donde pueda pellizcar el tejido. Es probable que tenga más tejido graso cuanto más cerca esté de la cadera y cuanto más lejos esté de la rodilla.
Brazos: Se debe utilizar el dorso del brazo. Es difícil pellizcar el tejido e inyectar Zutectra por sí mismo utilizando este sitio. Si elige inyectarse por sí mismo en el brazo, intente pellizcar el tejido colocando el brazo sobre el respaldo de la silla o apóyelo contra una pared. Es mucho más sencillo para otra persona utilizar esta zona si usted necesita ayuda.
Nalgas: Utilice cualquier zona en la que pueda pellizcar el tejido. Es más difícil administrarse usted mismo una inyección aquí. Intente situarse frente a un espejo para localizar la zona, o puede pedir a la persona a cargo de su cuidado que le administre la inyección.
Es importante cambiar (rotar) los sitios de la inyección. Esto ayudará a que la piel permanezca flexible y ayudará a absorber el medicamento por igual. La rotación de los sitios quiere decir que se comienza en un sitio y se utilizan todos los demás sitios antes de regresar al primer sitio que usó.
Entonces se comienza de nuevo la rotación. Puede ser útil llevar un registro de dónde se aplicó la última inyección para evitar problemas.
En las siguientes imágenes se muestra un ejemplo de la administración en los muslos:
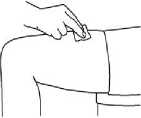
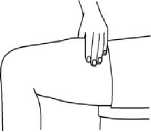
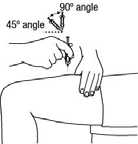
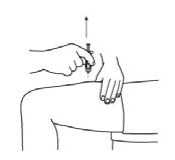
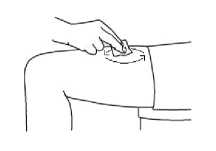
2. Limpie la zona con una gasa con alcohol. Deje secar al aire la piel.
3. Pellizque con suavidad la piel alrededor del lugar de inyección desinfectado (para levantarla un poco) y clave la aguja en la piel con un movimiento rápido y seguro, con un ángulo de 45 a 90°. Inyecte debajo de piel, como el médico o la enfermera le han mostrado.
4. Inyecte el líquido oprimiendo el émbolo con suavidad. Concédase suficiente tiempo para inyectar toda la solución hasta vaciar la jeringa.
5. A continuación, retire inmediatamente la aguja y suelte la piel que ha pellizcado.
6. Limpie el lugar de la inyección mediante un movimiento circular con la gasa con alcohol.
Eliminación de todos los objetos utilizados
Una vez que se haya puesto la inyección, deseche, sin demora, todas las agujas y recipientes de vidrio vacíos en un recipiente destinado a objetos punzantes.
30