Zomacton 10 Mg/ Ml Polvo Y Disolvente Para Solucion Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Zomacton 10 mg/ml, polvo y disolvente para solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Somatropina*...........................................10 mg
(10 mg/ ml tras la reconstitución del vial)
* Producida por tecnología ADN recombinante de células de Escherichia coli Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
Zomacton es un polvo blanco a blanquecino liofilizado. El disolvente en jeringa es transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Zomacton está indicado para:
debido a una secreción de Turner confirmado a
- el tratamiento a largo plazo en niños que tienen problemas de crecimiento insuficiente de hormona de crecimiento
- el tratamiento a largo plazo del retraso del crecimiento asociado al Síndrome través de un análisis cromosómico.
4.2 Posología y forma de administración
El tratamiento con Zomacton únicamente debe ser utilizado bajo la supervisión de un médico especialista, con experiencia en el diagnóstico de pacientes con deficiencia de hormona de crecimiento.
La dosis de administración de Zomacton debe individualizarse para cada paciente.
La duración del tratamiento, generalmente un periodo de varios años, dependerá del beneficio terapéutico máximo alcanzado.
La administración subcutánea de hormonas de crecimiento puede causar la pérdida o el aumento de tejido adiposo en el lugar de la inyección. Por lo tanto se deben alternar los sitios de inyección.
DEFICIENCIA EN HORMONA DE CRECIMIENTO
Se recomienda generalmente una dosis de 0,17 - 0,23 mg/kg de peso corporal (correspondiente a 4,9 mg/m2 -6,9 mg/m2 de área de superficie corporal) por semana dividido en 6 - 7 inyecciones subcutáneas (correspondiente a una inyección diaria de 0,02- 0,03 mg/kg de peso corporal ó 0,7 - 1,0 mg/m2 de área de superficie corporal). No debe excederse la dosis semanal total de 0,27 mg/kg ó 8 mg/m2 de área de superficie corporal (correspondiente a inyecciones diarias de hasta aproximadamente 0,04 mg/kg).
SÍNDROME DE TURNER
Se recomienda generalmente una dosis de 0,33 mg/kg de peso corporal (aproximadamente 9,86 mg/m2/área de superficie corporal) por semana dividido en 6-7 inyecciones subcutáneas (correspondiente a una inyección diaria de 0,05 mg/kg de peso corporal ó a 1,40-1,63 mg/m2 /área de superficie corporal).
Para Instrucciones de preparación, ver sección 6.6
Administración
La dosis requerida de Zomacton 10 mg/ml se administra con un dispositivo sin aguja ZomaJet Vision X o con una jeringa.
Las instrucciones específicas para el uso del dispositivo ZomaJet Vision X se dan junto con el folleto proporcionado con el dispositivo.
4.3 Contraindicaciones
Hipersensibilidad a somatropina o a algunos de los excipientes enumerados en la sección 6.1.
La somatropina no debe utilizarse cuando hay evidencia de tumor maligno activo. Los tumores intracraneales deben permanecer inactivos y la terapia antitumoral debe haberse completado antes de iniciar tratamiento con hormona de crecimiento. Se deberá suspender el tratamiento en caso de evidencia de crecimiento tumoral.
La somatropina no debe utilizarse para promover el crecimiento en niños con epífisis cerradas.
Los pacientes que sufren un estado crítico agudo derivado de complicaciones después de una cirugía a corazón abierto, cirugía abdominal, politraumatismos por accidente, fallo respiratorio agudo u otras condiciones similares no deberán ser tratados con somatropina.
En niños con enfermedad crónica renal deberá retirarse el tratamiento con somatropina tras el transplante renal.
4.4 Advertencias y precauciones especiales de empleo
No se debe exceder la dosis diaria máxima recomendada (ver sección 4.2).
Se han observado casos muy raros de miositis que pueden ser debidos a la presencia de metacresol como excipiente. En caso de mialgia o dolor desproporcionado en el lugar de inyección, debe considerarse miositis y, si se confirma, se deberá usar una presentación de Zomacton sin metacresol.
Pacientes con el Síndrome Prader-Willi
Zomacton no está indicado para el tratamiento a largo plazo de pacientes pediátricos que poseen baja estatura debido a la confirmación genética del Síndrome Prader-Willi, a menos que también dispongan de un diagnóstico de deficiencia de hormona de crecimiento. Se han reportado casos de apnea de sueño y muerte repentina tras iniciar la terapia con hormona de crecimiento en pacientes pediátricos con Síndrome Prader-Willi que tenían uno o más de los siguientes factores de riesgo: obesidad severa, historial de obstrucción de las vías respiratorias superiores o apnea de sueño o infección respiratoria no identificada.
Hipertensión intra-craneal
Se han reportado casos raros de hipertensión intra-craneal benigna. En caso de cefalea intensa o repetida, problemas visuales, náuseas y/o vómito, se recomienda realizar examen de fondo de ojo, para descartar edema de papila. Si se confirmara el edema de papila deberá considerarse el diagnóstico de hipertensión intracraneal benigna y, si procede, suspender el tratamiento con hormona de crecimiento (ver también sección 4.8). Actualmente, no hay evidencia suficiente para orientar en la toma de decisiones clínicas en pacientes con hipertensión intracraneal resuelta. Si se reinicia el tratamiento con hormona de crecimiento es necesario monitorizar con cuidado los síntomas de hipertensión intracraneal.
Leucemia
Se han comunicado casos de leucemia en un pequeño número de pacientes con deficiencia de hormona de crecimiento tratados con somatropina, así como en pacientes que no estaban recibiendo tratamiento. Sin embargo, no hay evidencia de que la incidencia de leucemia esté aumentada en pacientes sin factores de riesgo tratados con hormona de crecimiento.
Desarrollo de anticuerpos
Como con todos los productos que contienen somatropina, un porcentaje pequeño de pacientes pueden desarrollar anticuerpos a la somatropina. La capacidad de unión de estos anticuerpos es baja y no hay ningún efecto en el crecimiento. Se debe realizar un análisis de los anticuerpos a la somatropina en cualquier paciente que no responda a la terapia.
Hipotiroidismo
La hormona de crecimiento incrementa la conversión extratiroidea de T4 a T3 y puede, por tanto, desenmascarar un hipotiroidismo incipiente. Por tanto, se debe realizar una monitorización de la función tiroidea en todos los pacientes. En los pacientes con hipopituitarismo se debe monitorizar estrechamente la terapia sustitutiva estándar cuando se administra un tratamiento con somatropina.
Pacientes con diabetes mellitus
Debido a que la somatropina puede reducir la sensibilidad a la insulina, se debe monitorizar a los pacientes para detectar una intolerancia a la glucosa. En los pacientes con diabetes mellitus, podría requerirse un ajuste de la dosis de insulina tras el inicio del tratamiento con productos que contienen somatropina. Los pacientes con diabetes o intolerancia a la glucosa deben estar monitorizados estrechamente durante la terapia con somatropina. Zomacton debe ser utilizado con precaución en pacientes con antecedentes familiares de enfermedad.
Pacientes con lesiones intracraneales
Los pacientes con deficiencia de hormona de crecimiento secundaria a una lesión intracraneal, deben ser examinados con frecuencia para conocer la progresión ó recurrencia de la enfermedad subyacente. En niños que han sobrevivido al cáncer, se ha notificado un aumento del riesgo de una segunda neoplasia en pacientes tratados con somatropina tras su primera neoplasia. Los tumores intracraneales, en particular meningiomas, fueron los más frecuentes de estas neoplasias secundarias en pacientes tratados con radiación en la cabeza en su primera neoplasia.
Escoliosis
El tratamiento debe ser interrumpido cuando existe progresión ó recurrencia de la lesión.
En pacientes con enfermedades malignas previas se debe prestar especial atención a los signos y síntomas que indiquen una recaída.
Durante un rápido crecimiento puede tener lugar escoliosis en cualquier niño. Durante el tratamiento con somatropina se deberán monitorizar los signos de escoliosis.
Pacientes con alteraciones endocrinas
En los pacientes con alteraciones endocrinas puede desarrollarse con mayor frecuencia desplazamiento epifisario de la cabeza del fémur. En caso de que el paciente en tratamiento con Zomacton empezara a desarrollar una cojera o dolor en rodilla o cadera, este acontecimiento deberá evaluarse por su médico.
Se debe advertir a los pacientes que este medicamento contiene somatropina, que puede producir un resultado positivo en las pruebas de control del dopaje.
Pacientes que sufren complicaciones derivadas de una cirugía
Los efectos del tratamiento con la hormona de crecimiento en la recuperación, se han estudiado en dos ensayos controlados con placebo en 522 pacientes adultos gravemente enfermos que sufrían complicaciones derivadas de una cirugía cardiaca, cirugía abdominal, politraumatismo o fallo respiratorio agudo.
La mortalidad fue mayor (42% vs 19%) entre los pacientes tratados con hormona de crecimiento (dosis 5,3 a 8 mg/día) en comparación con aquellos tratados con placebo. Basándonos en esta información, este tipo de pacientes no deberían ser tratados con hormona de crecimiento. Debido a que no hay información disponible sobre la seguridad de la terapia sustitutiva con hormona de crecimiento en pacientes gravemente enfermos, los beneficios sobre la continuación del tratamiento en esta situación, deben sopesarse frente a los riesgos potenciales.
Se ha estudiado la experiencia de tolerabilidad local a la administración de Zomacton 10 mg/ml con el dispositivo sin aguja ZomaJet Vision X antes de la autorización de comercialización en un estudio de 12 semanas incluyendo solo niños caucasianos.
Aunque raro, la pancreatitis deberá considerarse en niños tratados con somatropina, especialmente en aquellos que desarrollen dolor abdominal.
4.5 Interacción con otros medicamentos y otras formas de interacción
El tratamiento concomitante con glucocorticoides inhibe la acción promotora del crecimiento de los productos que contienen somatropina. Los pacientes con deficiencia de ACTH deben recibir de forma ajustada su terapia sustitutiva con glucocorticoides para evitar cualquier efecto inhibidor sobre la hormona de crecimiento.
Altas dosis de andrógenos, estrógenos o esteroides anabolizantes pueden acelerar la maduración ósea y por lo tanto podrían reducir el aumento de talla final.
Debido a que somatropina puede provocar una resistencia a la insulina, debe ajustarse la dosis de insulina en pacientes diabéticos que reciban simultáneamente Zomacton.
Los datos de un estudio de interacción realizado en adultos con deficiencia de hormona de crecimiento sugieren que la administración de somatropina podría incrementar el aclaramiento de compuestos que se metabolizan a través de los isoenzimas del citocromo P450. El aclaramiento de compuestos metabolizados por el citocromo P450 3A4 (p.ej. Esteroides sexuales, corticoesteroides, anticonvulsivantes y ciclosporinas)
puede estar especialmente aumentado, lo que conlleva a bajos niveles plasmáticos de estos compuestos. La significación clínica se desconoce.
4.6 Fertilidad, embarazo y lactancia
No hay datos clínicos disponibles de la exposición de Zomacton en mujeres embarazadas.
No hay datos en animales del uso de Zomacton durante el embarazo (ver sección 5.3 Datos preclínicos sobre seguridad)
Por lo tanto, no se recomienda utilizar Zomacton durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
No se han realizado estudios clínicos con productos que contienen somatropina en mujeres en periodo de lactancia. Se desconoce si la somatropina se excreta en la leche materna. Por lo tanto se debe tener precaución cuando se administren productos que contiene somatropina a mujeres lactantes.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Los productos que contienen somatropina no tienen influencia sobre la capacidad de conducir ni utilizar máquinas.
4.8 Reacciones adversas
La administración subcutánea de hormona de crecimiento puede provocar una pérdida o ganancia de tejido adiposo al igual que hemorragia y hematoma puntual en el lugar de inyección.
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100, <1/10) |
Poco Frecuentes (>1/1.000, <1/100) |
Raro (>1/10.000, <1/1.000) |
Muy raros (<1/10.000) | |
|
plasias benignas, gnas y no cificadas |
Neoplasia maligna, neoplasia |
(niños) leucemia | |||
|
tomos de la re y del sistema tico |
Anemia | ||||
|
tornos del sistema mológico |
Formación de anticuerpos | ||||
|
tornos endocrinos |
Hipotiroidismo | ||||
|
tornos del ibolismo y de la ción |
(adultos) Hiperglucemia moderada |
(niños) Tolerancia de la glucosa modificada |
Hipoglucemia, Hiperfosfatemia |
Diabetes mellitus tipo II | |
|
tornos uiátricos |
Trastornos de personalidad | ||||
|
tornos del sistema ioso |
(adultos) Dolor de cabeza (niños) parestesia |
Dolor de cabeza, hipertonía, (adulto) insomnio |
Somnolencia, nistagmo |
Neuropatía, hipertensión intracraneal, (niños) insomnio, (niños) parestesia | |
|
tornos oculares |
Edema de papila, diplopía | ||||
|
tornos del oído y aberinto |
Vértigo | ||||
|
tornos cardiacos |
Taquicardia, (adulto) hipertensión |
(niños) Hipertensión | |||
|
tornos rointestinales |
Vómitos, dolor abdominal, flatulencia, nausea |
Diarrea | |||
|
tornos de la piel y ejido subcutáneo |
Lipodistrofia, atrofia de la piel, dermatitis exfoliativa, urticaria, hirsutismo, hipertrofia de la piel | ||||
|
tornos culoesqueléticos, ejido conjuntivo |
(adultos) Artralgia, (adultos) mialgia |
(niños) Artralgia, (niños) mialgia, (adultos) rigidez en las extremidades |
Atrofia muscular, dolor óseo, síndrome del túnel carpiano, (niños) rigidez en las extremidades | ||
|
stornos renales y arios |
Incontinencia urinaria, hematuria, poliuria, frecuencia miccional/polaquiuria, anomalías urinarias | ||||
|
stornos del aparato oductor y de la a |
Secreción genital, (adultos) ginecomastia |
(niños) ginecoma |
|
stornos generales y raciones en el r de íinistración |
(adultos) Edema, (adultos) edema periférico |
(niños) Edema, (niños) edema periférico, reacciones en el lugar de inyección, astenia |
Debilidad, atrofia en el lugar de inyección, hemorragia en el lugar de inyección, protuberancia en el lugar de inyección, hipertrofia | ||
|
foraciones íplementarias |
Pruebas de la función renal anormales |
Se ha reportado pancreatitis post-comercialización durante el tratamiento con GH (frecuencia desconocida)
Anticuerpos anti-somatropina: la proteína somatropina puede dar lugar a la formación de anticuerpos. Dependiendo del producto en cuestión, se han identificado estos anticuerpos en un porcentaje definido de la población tratada. Su capacidad de unión y sus valores son generalmente bajos, con ninguna consecuencia clínica. Sin embargo, se debe realizar análisis de detección de estos anticuerpos en caso de ausencia de respuesta al tratamiento con somatropina.
Leucemia: se han reportado casos (muy raros) de leucemia en niños con deficiencia de hormona de crecimiento, alguno de ellos tratados con somatropina e incluidos en los registros de seguimiento postcomercialización. Sin embargo, no existe una evidencia de un mayor riesgo de leucemia sin factores de predisposición.
Se han reportado, en niños tratados con hormona de crecimiento, desplazamiento epifisario de la cabeza del fémur y enfermedad de Legg-Calvé-Perthes. El desplazamiento epifisario de la cabeza del fémur ocurre mas frecuentemente en casos de alteraciones endocrinas y la enfermedad de Legg-Calvé-Perthes es mas frecuente en caso de talla baja. Pero se desconoce si estas dos patologías son más frecuentes o no durante el tratamiento con somatropina. Una molestia, un dolor en la cadera y/o en la rodilla debe evocar su diagnóstico.
Otras reacciones adversas se pueden considerar como efecto de clase, como la hiperglucemia debido a la disminución en la sensibilidad a la insulina, el descenso del nivel de tiroxina libre y el posible desarrollo de una hipertensión intracraneal benigna.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
No debe excederse la dosis recomendada de Zomacton.
Aunque no existe información sobre sobredosis con Zomacton, una sobredosis aguda puede producir inicialmente hipoglucemia y posteriormente hiperglucemia.
Se desconocen los efectos que podría producir un uso repetido de Zomacton durante largos períodos de tiempo a dosis que superen las recomendadas. Sin embargo, es posible que este uso repetido pueda dar lugar a signos y síntomas semejantes a los producidos por un exceso de hormona de crecimiento tales como acromegalia.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Somatropina y agonistas de la somatropina Código ATC: H01 AC 01
Propiedades farmacodinámicas
(pit -hGH) en la secuencia de Se espera que Zomacton tenga
Idénticas a las de la hormona de crecimiento humana derivada de la hipófisis aminoácidos, longitud de la cadena (191 aminoácidos) y perfil farmacocinético. los mismos efectos farmacológicos que la hormona endógena.
Sistema óseo:
La hormona de crecimiento produce generalmente un crecimiento proporcional del sistema óseo en humanos. Se ha demostrado que se produce un crecimiento lineal en niños con deficiencia confirmada de pit-hGH después de una administración exógena de Zomacton. Se produce un aumento considerable en estatura después de la administración de Zomacton procedente de la acción ejercida sobre las placas epifisarias de los huesos largos. En los niños que no poseen cantidades adecuadas de pit-hGH, Zomacton provoca una proporción de crecimiento mayor y un aumento de las concentraciones de IGF-1 (Factor de Crecimiento Insulínico Tipo 1) similares a las observadas después de un tratamiento con pit-hGH. También se observa un aumento en la concentración media de fosfatasa alcalina sérica.
Otros órganos y tejidos:
Como respuesta a la hormona de crecimiento también se produce un aumento en el tamaño de otros tejidos, proporcional al aumento total en el peso corporal. Los cambios incluyen: aumento en el crecimiento del tejido conectivo, piel y apéndices; aumento del músculo esquelético con aumento en el número y tamaño de células; crecimiento del timo; aumento del hígado con aumento de la proliferación celular; y un ligero aumento de las gónadas, suprarrenales y tiroides.
No se ha comunicado la existencia de crecimiento desproporcionado de la piel y huesos planos ni tampoco maduración sexual acelerada asociada al tratamiento con hormona de crecimiento.
Proteínas, carbohidratos y metabolismo lipídico:
La hormona de crecimiento retiene el nitrógeno y aumenta el transporte de aminoácidos dentro del tejido. Ambos procesos aceleran la síntesis protéica. La utilización de carbohidratos y lipogénesis se ven disminuidos por la hormona de crecimiento. La hormona de crecimiento actúa como agente diabetógeno cuando se utiliza a grandes dosis o en ausencia de insulina. produciendo los mismos efectos que los observados en período de ayuno (es decir. intolerancia a carbohidratos. inhibición de la lipogénesis. movilización de las grasas y cetosis).
Metabolismo mineral:
Tras el tratamiento con hormona de crecimiento se mantienen los niveles de sodio. potasio y fósforo. El aumento de pérdida de calcio producido por el riñón es compensado por el aumento de la absorción en el intestino. No se produce una alteración significativa en las concentraciones de calcio sérico en pacientes tratados con Zomacton o con pit-hGH. Se ha observado que se produce un aumento en las concentraciones séricas de fosfatos inorgánicos después del tratamiento con Zomacton así como con pit-hGH. La acumulación de estos minerales es señal de un aumento de la demanda durante la síntesis de los tejidos.
5.2 Propiedades farmacocinéticas
Veinticuatro (24) voluntarios sanos recibieron 1.67 mg de somatropina por inyección subcutánea convencional o mediante dispositivo sin aguja ZomaJet Vision. Se observaron picos plasmáticos de aproximadamente 20 ng /ml entre 3.5 a 4 horas tras la administración del medicamento.
Se observó una vida media terminal de 2.6 horas cuando se administró el compuesto con el dispositivo sin aguja ZomaJet Vision debido probablemente a un proceso restrictivo del índice de absorción.
Los datos de otros productos que contienen somatropina sugieren que la biodisponibilidad de somatropina administrada subcutáneamente es aproximadamente el 80 % en adultos sanos y que tanto el hígado como el riñón han demostrado ser órganos importantes para la producción de proteínas encargadas del catabolismo y eliminación del compuesto.
5.3 Datos preclínicos sobre seguridad
Los datos no clínicos no revelan ningún riesgo especial para humanos basados en los estudios convencionales de toxicidad y genotoxicidad a dosis repetida.
La somatropina producida por ingeniería genética es idéntica a la hormona de crecimiento humana endógena de la hipófisis. Tiene las mismas propiedades biológicas y se administra normalmente en dosis fisiológicas. Por lo tanto. los estudios sobre la farmacología de seguridad. la toxicidad en reproducción y carcinogenicidad no se han realizado ya que no se esperan tales efectos.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
POLVO
Manitol
Fosfato disódico dodecahidratado Dihidrógenofosfato sódico dihidratado
DISOLVENTE
Metacresol
Agua para inyección
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Tras su reconstitución, la solución puede almacenarse durante un máximo de 28 días en nevera, entre 2° C - 8° C.
Tras su reconstitución, conservar los viales en posición vertical.
6.4 Precauciones especiales de conservación
Conservar en nevera (2 °C - 8°C); mantener en su envase original para protegerlo de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Zomacton se suministra en varias presentaciones sujetas a autorización nacional:
a) Sets para la utilización con inyecciones con agujas:
Polvo: Vial (vidrio de Tipo I) con un tapón (goma, polímero de halo-butilo) en combinación con un sellado de aluminio y con una tapa tipo “flip-off” (plástico).
Disolvente: Jeringa (vidrio de tipo I) con tapa con punta (goma, polímero de halo-butilo), émbolo con tapón (goma, polímero halo-butilo) y un conector de transferencia del disolvente (policarbonato).
Envases de: 1, 3 y 5.
b) Sets para la utilización con el dispositivo sin aguja de ZomaJet Vision X:
Polvo: Vial (vidrio de Tipo I) con un tapón (goma, polímero de halo-butilo) en combinación con un sellado de aluminio y con una tapa tipo “flip-off” (plástico).
Disolvente: Jeringa (vidrio de tipo I) con tapa con punta (goma, polímero de halo-butilo), émbolo con tapón (goma, polímero halo-butilo) y un adaptador para el vial (resina de policarbonato y silicona);
Envases de: 1, 3 y 5.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones Reconstitución
Se debe reconstituir el polvo solo introduciendo el disolvente proporcionado contenido en la jeringa en el vial. Ver el prospecto para las instrucciones de reconstitución detalladas.
A continuación se muestra una descripción general del proceso de reconstitución y administración. La reconstitución debe realizarse de acuerdo con las reglas de buenas prácticas, principalmente en relación con la asepsia.
1. Deberá lavarse las manos.
i**4
'ni®:
2. Retire la capucha protectora amarilla de plástico del vial.
3. La parte superior del vial deberá limpiarse con una solución antiséptica para prevenir la contaminación de su contenido.
4. Coloque el adaptador del vial ó el conector de transferencia del vial sobre el centro del vial, con la punta dirigida hacia abajo, después presione firmemente hasta que suene click. Retire la tapa del adaptador.
5. Coja la jeringa. Retire el capuchón gris. Coloque la jeringa en el adaptador/ conector del vial e inyecte el disolvente lentamente en el vial dirigiendo el líquido contra la pared de cristal para evitar la formación de espuma.
6. Vuelva a colocar la capucha del adaptador/ conector en el adaptador/conector.
7. Gire suavemente el vial unas cuantas veces hasta que el contenido se haya disuelto completamente. No agitar; ya que puede causar la desnaturalización del principio activo.
8. Si la solución está turbia o contiene partículas, no deberá usarse. En caso de turbidez después de su refrigeración, deberá esperar a que el producto alcance la temperatura ambiente. Si persiste la turbidez, descartar el vial y su contenido
El contenido debe ser claro e incoloro después de la reconstitución.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
RECONSTITUCIÓN CON ADAPTADOR DEL VIAL PARA USO CON DISPOSITIVO
ZOMAJET VISION X
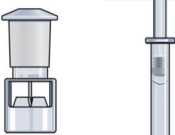

Paso 1
Retire la capucha amarilla del vial de Zomacton.
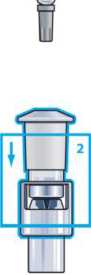

Paso 2
Coloque el adaptador del vial sobre el centro del vial, con la punta dirigida hacia abajo. Presione firmemente hasta que suene click.
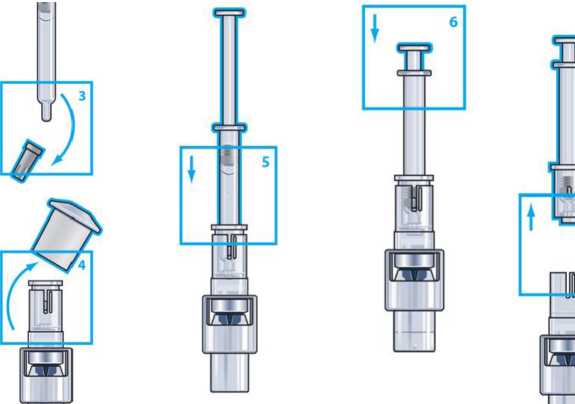
Paso 3 y 4
Retire el capuchón gris de la jeringa y también la capucha blanca del adaptador.
Paso 5
Coloque el vial en una superficie lisa y sostenga el adaptador del vial. Coloque la jeringa en el adaptador del vial y presione firmemente hacia abajo.
Paso 6
Presione el émbolo de la jeringa lentamente. Asegúrese que toda la solución pasa al vial.
Paso 7
Sosteng; tire firm la jering conecto] transfere jeringa permane sitio.
PASO 9
EL VIAL DEBE ENTONCES GIRARSE SUAVEMENTE HASTA QUE EL POLVO SE HAYA DISUELTO COMPLETAMENTE FORMANDO UNA SOLUCIÓN CLARA E INCOLORA.
COLOQUE EL VIAL RECONSTITUIDO DE ZOMACTON EN POSICIÓN VERTICAL EN LA NEVERA DE 2°C A 8°C.
EVITAR AGITARLO O MEZCLARLO VIGOROSAMENTE. SI LA SOLUCIÓN CONTINÚA TURBIA O CONTIENE PARTÍCULAS, EL VIAL Y SU CONTENIDO DEBERÁ DESCARTARSE. EN CASO DE TURBIDEZ DESPUÉS DE SU REFRIGERACIÓN, DEBERÁ ESPERAR A QUE LA SOLUCIÓN ALCANCE LA TEMPERATURA AMBIENTE. SI PERSISTE LA TURBIDEZ, DESCARTAR EL VIAL Y SU CONTENIDO.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
FERRING S.A.U.
C/ Orense 4 - 7° derecha 28020 MADRID-España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
70.642
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Noviembre 2009 Renovación de la autorización: Junio 2012.
10. FECHA DE LA REVISIÓN DEL TEXTO
Junio 2012
13 de 13