Zoladex Trimestral 10,8 Mg Implante En Jeringa Precargada
1
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Zoladex Trimestral 10,8 mg implante en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada implante en jeringa precargada contiene 10,8 mg de goserelina (como acetato). Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Implante en jeringa precargada.
Implante estéril, color crema, de aproximadamente 17 mm de longitud y 1,5 mm de diámetro, en una jeringa precargada, lista para administrar.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Zoladex Trimestral 10,8 mg está indicado en el tratamiento del cáncer de próstata, cuando la terapia hormonal está indicada.
4.2 Posología y forma de administración
Posología
Adultos varones incluyendo ancianos
Un implante de Zoladex Trimestral 10,8 mg inyectado por vía subcutánea en la pared anterior del abdomen, cada 3 meses.
Adultos con insuficiencia renal No es necesario ajustar la dosis.
Adultos con insuficiencia hepática No es necesario ajustar la dosis.
Población pediátrica
Zoladex Trimestral 10,8 mg no está indicado para uso en niños.
Forma de administración
Para una administración correcta seguir las instrucciones incluidas en la etiqueta del envase, que corresponden a las detalladas al final de esta Ficha Técnica.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Ver “Fertilidad, embarazo y lactancia”, en la sección 4.6.
4.4 Advertencias y precauciones especiales de empleo
Esta concentración de Zoladex Trimestral 10,8 mg no está indicada para uso en mujeres. Para pacientes femeninas que requieran tratamiento con goserelina, consultar Ficha Técnica de Zoladex 3,6 mg.
Zoladex Trimestral 10,8 mg no está indicado en el tratamiento de niños, ya que no se han establecido la seguridad y eficacia en este grupo de pacientes.
No se dispone de datos sobre la retirada o disolución del implante.
Debe ser considerada cuidadosamente la administración de Zoladex Trimestral 10,8 mg en pacientes con riesgo de desarrollar obstrucción ureteral o compresión medular; estos pacientes serán debidamente observados durante el primer mes de tratamiento. Se debe considerar el uso inicial de un anti-andrógeno (por ejemplo, 300 mg diarios de acetato de ciproterona durante tres días antes y tres semanas después de comenzar el tratamiento con Zoladex Trimestral 10,8 mg) al inicio de la terapia con el análogo de la LHRH, ya que se ha notificado que esto previene la posible secuela del aumento inicial de testosterona plasmática. Si se presenta o desarrolla compresión medular o insuficiencia renal, debido a obstrucción ureteral, se debe establecer el tratamiento específicamente estandarizado para estas alteraciones.
La utilización de agonistas de la LHRH puede causar reducción en la densidad mineral ósea. Datos preliminares sugieren que el empleo de un bisfosfonato en combinación con un agonista de la LHRH puede reducir la pérdida mineral ósea.
Se requiere precaución especial en pacientes con factores de riesgo adicionales para la osteoporosis (por ejemplo abuso crónico de alcohol, ser fumador, tratamiento a largo plazo con anticonvulsivos o corticoides, historial familiar de osteoporosis).
Los pacientes con depresión conocida y los pacientes con hipertensión deben ser monitorizados adecuadamente.
Existe un mayor riesgo de depresión (que puede ser grave) en pacientes sometidos a tratamiento con agonistas de la hormona liberadora de gonadotropinas (GnRH), como goserelina. Los pacientes deben ser informados y recibir tratamiento si se presentan síntomas de depresión.
En pacientes tratados con agonistas de la LHRH se ha observado una disminución de la tolerancia a la glucosa, lo que puede manifestarse como diabetes o como pérdida del control glucémico en pacientes con diabetes mellitus preexistente, por lo que deberá considerarse monitorizar la glucosa en sangre.
En un estudio farmacoepidemiológico de agonistas de la LHRH empleados en el tratamiento de cáncer de próstata se ha observado infarto de miocardio e insuficiencia cardíaca. Parece que el riesgo aumenta cuando se emplea en combinación con anti-andrógenos.
El tratamiento de deprivación androgénica puede prolongar el intervalo QT.
En pacientes con antecedentes o con factores de riesgo de prolongación del intervalo QT y en pacientes que reciben medicamentos concomitantes que podrían prolongar el intervalo QT (ver sección 4.5), los profesionales sanitarios deben evaluar el balance beneficio/riesgo incluyendo el riesgo potencial de Torsade des Pointes antes de iniciar el tratamiento con Zoladex Trimestral 10,8 mg.
El tratamiento con Zoladex Trimestral 10,8 mg puede llevar a reacciones positivas en las pruebas de antidopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se debe valorar cuidadosamente el uso concomitante de Zoladex Trimestral 10,8 mg con medicamentos que prolongan el intervalo QT o medicamentos capaces de inducir Torsade des Pointes, tales como antiarrítmicos clase IA (por ejemplo: quinidina, disopiramida) o clase III (por ejemplo: amiodarona, sotalol, dofetilida, ibutilida), metadona, moxifloxacino, antipsicóticos, etc (ver sección 4.4) ya que el tratamiento de deprivación androgénica también puede prolongar el intervalo QT.
4.6 Fertilidad, embarazo y lactancia
Zoladex Trimestral 10,8 mg no está indicado para uso en mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No existe evidencia de que Zoladex Trimestral 10,8 mg altere la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Las siguientes categorías de frecuencia para reacciones adversas al medicamento (RAMs) se calcularon en base a los informes de los ensayos clínicos y fuentes post-comercialización de Zoladex Trimestral 10,8 mg.
Para la clasificación de la frecuencia se ha utilizado el siguiente criterio: Muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (> 1/1.000 a <1/100); raras (> 1/10.000 a <1/1.000); muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1 Reacciones adversas a Zoladex Trimestral 10,8 mg por frecuencia y Clasificación por Órganos y Sistemas (COS)
|
Frecuencia |
COS |
Reacción Adversa |
|
Muy frecuentes (> 1/10) |
Trastornos psiquiátricos |
Disminución de la libido3 |
|
Trastornos vasculares |
Sofoco3 | |
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosisa | |
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil | |
|
Trastornos generales y alteraciones en el lugar de administración |
(ver frecuentes) | |
|
Frecuentes (> 1/100 a <1/10) |
Trastornos del metabolismo y de la nutrición |
Alteración de la tolerancia a la glucosab |
|
Trastornos del sistema nervioso |
Parestesia, compresión medular | |
|
Trastornos cardíacos |
Insuficiencia cardíaca3, infarto de miocardio3 | |
|
Trastornos vasculares |
Presión arterial anormald | |
|
Trastornos de la piel y del tejido subcutáneo |
Rashe | |
|
Trastornos musculoesquéticos, del tejido conjuntivo y de los huesos |
Dolor óseof | |
|
Trastornos del aparato reproductor y de la mama |
Ginecomastia |
|
Frecuencia |
COS |
Reacción Adversa |
|
Trastornos generales y alteraciones en el lugar de administración |
Reacción en el lugar de la inyección | |
|
Trastornos psiquiátricos |
Cambios de humor, depresión (Tratamiento prolongado) | |
|
Exploraciones complementarias |
Disminución de densidad mineral ósea, aumento de peso | |
|
Poco frecuentes (> 1/1.000 a <1/100) |
Trastornos del sistema inmunológico |
Hipersensibilidad al medicamento |
|
Trastornos musculoesquéticos, del tejido conjuntivo y de los huesos |
Artralgia | |
|
Trastornos renales y urinarios |
Obstrucción ureteral | |
|
Trastornos del aparato reproductor y de la mama |
Sensibilidad mamaria | |
|
Trastornos psiquiátricos |
Cambios de humor, depresión (Tratamiento corto) | |
|
Raras (> 1/10.000 a <1/1.000) |
Trastornos del sistema inmunológico |
Reacción anafiláctica |
|
Muy raras (< 1/10.000) |
Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos) |
Tumor hipofisario |
|
Trastornos endocrinos |
Hemorragia hipofisaria | |
|
Trastornos psiquiátricos |
Trastorno psicótico | |
|
No conocida |
Trastornos de la piel y del tejido subcutáneo |
Alopeciag |
|
Trastornos cardíacos |
Prolongación del intervalo QT (ver secciones 4.4 y 4.5) |
a Estos son efectos farmacológicos que rara vez requieren la interrupción del tratamiento. Hiperhidrosis y sofocos pueden continuar después de suspender el tratamiento.
b En pacientes varones en tratamiento con agonistas de la LHRH se ha observado una disminución de la tolerancia a la glucosa. Esto puede manifestarse como diabetes o como pérdida del control glucémico en aquellos con diabetes mellitus preexistente.
c Observados en un estudio farmacoepidemiológico de agonistas de la LHRH empleados en el tratamiento de cáncer de próstata. Parece que el riesgo aumenta cuando se emplea en combinación con anti-andrógenos.
d Se puede manifestar como hipotensión o hipertensión, y se ha observado ocasionalmente en pacientes en tratamiento con Zoladex Trimestral 10,8 mg. Estos cambios son generalmente transitorios y desaparecen bien durante el tratamiento continuado o tras la interrupción del mismo. Dichos cambios, raramente han sido suficientes como para requerir intervención médica, incluyendo la retirada del tratamiento con Zoladex Trimestral 10,8 mg.
e Es generalmente leve, y a menudo remite sin interrumpir el tratamiento.
f Inicialmente los pacientes con cáncer de próstata pueden experimentar un aumento temporal del dolor óseo, que puede ser tratado sintomáticamente.
g Especialmente pérdida de vello corporal, un efecto esperado por la disminución de los niveles de andrógenos.
Experiencia post-comercialización
Se ha comunicado un pequeño número de casos de cambios en el recuento sanguíneo, disfunción hepática, embolismo pulmonar y neumonía intersticial, relacionados con Zoladex Trimestral 10,8 mg.
4.9
Sobredosis
La experiencia acerca de la sobredosis en humanos es limitada. No se han observado reacciones adversas clínicamente significativas en los casos en los que Zoladex Trimestral 10,8 mg se ha administrado antes de lo planeado o a dosis mayores de lo establecido inicialmente. La experimentación animal sugiere que no se evidenciarán otros efectos que los efectos terapéuticos sobre las concentraciones de hormonas sexuales y tracto reproductivo con dosis superiores de Zoladex Trimestral 10,8 mg. Si se produjese sobredosificación, ésta deberá ser tratada sintomáticamente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: análogos hormona liberadora de gonadotropinas, código ATC: L02AE03
Zoladex Trimestral 10,8 mg (D-Ser (But)6 Azgli10 LHRH) es un análogo sintético de la hormona liberadora de hormona luteinizante de origen natural (LHRH). Durante la administración crónica de Zoladex Trimestral 10,8 mg se produce una inhibición de la secreción de la hormona luteinizante hipofisaria originando una reducción de las concentraciones de testosterona sérica en varones. Inicialmente, al igual que otros agonistas de la LHRH, Zoladex Trimestral 10,8 mg puede aumentar transitoriamente dichas concentraciones.
En varones, aproximadamente a los 21 días después de la inyección del primer implante, las concentraciones de testosterona disminuyen hasta el rango de castración y permanecen suprimidas con el tratamiento cada 3 meses.
En estadios avanzados de carcinoma de próstata, el tratamiento más habitual en pacientes sintomáticos es la manipulación hormonal, pudiendo realizarse por orquidectomía (método clásico) o por la utilización de análogos de la LHRH, consiguiéndose con ambos tratamientos niveles hormonales similares. No se ha demostrado que el tratamiento con análogos de la LHRH, así como la orquidectomía, produzcan una prolongación de la supervivencia, aunque sí está demostrado que mejoran la calidad de vida del paciente.
En cuanto a la supresión de testosterona, la administración de un único implante de Zoladex Trimestral
10,8 mg es similar a la administración secuencial de 3 dosis de Zoladex 3,6 mg.
5.2 Propiedades farmacocinéticas
La administración de Zoladex Trimestral 10,8 mg de acuerdo con las recomendaciones posológicas garantiza que la exposición a Zoladex Trimestral 10,8 mg se mantiene sin una acumulación clínicamente significativa. Zoladex Trimestral 10,8 mg presenta una escasa unión a proteínas y una vida media de eliminación sérica de 2 a 4 horas en sujetos con función renal normal, incrementándose dicha vida media en pacientes con insuficiencia renal. Para el compuesto administrado, como se recomienda, en una formulación implante de 10,8 mg este cambio no causará ninguna acumulación; por consiguiente, no se necesita ajustar la dosis en estos pacientes.
No existe cambio significativo en la farmacocinética de pacientes con insuficiencia hepática.
5.3 Datos preclínicos sobre seguridad
Con la administración crónica de Zoladex Trimestral 10,8 mg se ha observado un aumento en la incidencia de tumores hipofisarios benignos en ratas macho. Aunque este hallazgo es similar al previamente detectado en esta especie, tras la castración quirúrgica, no se ha establecido su relevancia en humanos.
En ratones, la administración repetida a largo plazo con múltiplos de la dosis administrada en humanos originó cambios histológicos en algunas zonas del sistema digestivo, puestos de manifiesto por hiperplasia de las células de los islotes pancreáticos y una proliferación benigna en la región pilórica del estómago, también comunicados como una lesión espontánea en esta especie. Se desconoce la relevancia clínica de estos hallazgos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Una mezcla de copolímeros láctido/glicólido de alto y bajo peso molecular.
6.2 Incompatibilidades
No procede.
6.3 Período de validez
Tres años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C.
6.5 Naturaleza y contenido del envase
Envase conteniendo en un sobre sellado el implante (10,8 mg de principio activo) en una jeringa precargada de dosis única con un sistema de protección de la aguja.
El sobre contiene en su interior, además, un desecante.
La jeringa precargada dispone de un dispositivo de seguridad (clip-azul).
6.6 Precauciones especiales de eliminación y otras manipulaciones
Utilizar sólo si el sobre no presenta alteración. Usar inmediatamente después de abrir dicho sobre.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca Farmacéutica Spain, S.A.
C/ Serrano Galvache, 56 Edificio Roble 28033 Madrid
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.367
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10 Mayo 1990 / Mayo 2008
10.
FECHA DE LA REVISIÓN DEL TEXTO
7
INSTRUCCIONES PARA UNA CORRECTA ADMINISTRACIÓN
NUEVO SISTEMA DE SEGURIDAD. Lea atentamente las instrucciones.
1. Tumbar al paciente con la parte superior del cuerpo ligeramente elevada.
Limpiar la zona abdominal de la inyección con un algodón impregnado en un agente desinfectante (alcohol, etc...).
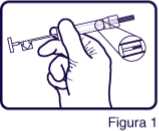
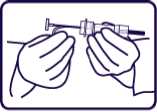
Figura 2
2. Manteniendo la jeringa inclinada hacia la luz, comprobar que se observa al menos parte del implante de Zoladex Trimestral 10,8 mg (Figura 1).
3. Retirar suavemente la pestaña de seguridad de color azul de la jeringa y desecharla (Figura 2). Retirar el capuchón que protege la aguja.
Al no ser un inyectable líquido, NO SE DEBE PURGAR.
4. Sujetar la jeringa alrededor del sistema de protección y situar el orificio/bisel de la aguja hacia arriba.
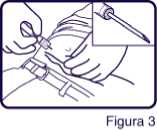
Coger un pliegue de la piel del paciente en el tejido subcutáneo de la pared abdominal anterior, e introducir la aguja con un ángulo de inclinación poco pronunciado (30 a 45 grados), HASTA QUE EL SISTEMA DE PROTECCION TOQUE LA PIEL DEL PACIENTE (Figura 3).
5. RETIRAR LOS DEDOS DEL SISTEMA DE PROTECCION HASTA SUJETAR LA JERINGA POR LA PARTE POSTERIOR. Presionar el émbolo COMPLETAMENTE y a fondo hasta oír un "CLICK", con el fin de depositar el implante de Zoladex Trimestral 10,8 mg. Notará cómo se activa el sistema de protección, deslizándose automáticamente para recubrir la aguja.
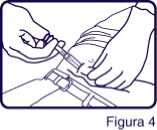
6. Continuar sujetando la jeringa como se muestra en la Figura 4, retirar la aguja permitiendo que el sistema de protección continúe deslizándose y cubriendo la aguja.
Desechar la jeringa y cubrir el lugar de la inyección con un apósito estéril.
11.Nov.2014 (PRAC)/(Oct.14)